Sincronización del estro en ovejas de pelo mediante
protocolo basado en prostaglandinas + GnRH
Estrous synchronization in
hair sheep using a protocol based on prostaglandin + GnRH
Blas Rogelio Ávila-Castillo1, Enrique
Octavio García-Flores2, Pedro Molina-Mendoza3, J. Jesús
German Peralta-Ortiz1, María Teresa Sánchez-Torres-Esqueda4*
*Correspondencia: teresa@colpos.mx/Fecha de
recepción: 1 de noviembre de 2017/Fecha de aceptación: 13 de septiembre de
2018/Fecha de publicación: 31 de enero de 2019 1
Universidad
Autónoma del Estado de Hidalgo, Instituto de Ciencias Agropecuarias, Medicina
Veterinaria y Zootecnia. Rancho Universitario, Av. Universidad, km 1,
Ex Hacienda de Aquetzalpa, Tulancingo, Hidalgo, México, C. P. 43600. 2
Universidad de Guadalajara, Ingeniería en Recursos Naturales y Agropecuarios. 3
Universidad Intercultural del Estado de Puebla, División de Ciencias
Naturales, Ingeniería Forestal Comunitaria. 4 Colegio de
Postgraduados, Recursos Genéticos y Productividad Ganadería, Campus Montecillo.
RESUMEN
El uso de progestágenos puede contaminar el
medio ambiente y el tejido animal, por lo que el uso de prostaglandinas F2α
(PGF2α) y hormona liberadora de gonadotropinas (GnRH) pueden
representar una alternativa viable. El objetivo del presente trabajo fue
evaluar el efecto de aplicar una dosis de GnRH en el intervalo de aplicación de
dos dosis de PGF2α, y comparar- lo con protocolos basados en
progestágenos y PGF2α, comúnmente utilizados en la sincroni- zación
de estros, con respecto al pico pre-ovulatorio de la hormona luteinizante (LH),
concentraciones de progesterona post-estro, tasa de preñez, pariciones y
prolificidad. Después de una pre-sincronización con doble aplicación de PGF2α,
30 ovejas adultas multíparas (peso vi- vo = 45 ± 3.1 kg, condición corporal=
3.2 ± 0.5 unidades y tiempo post-parto = 60 d a 90 d) fueron asignadas
aleatoriamente a uno de tres tratamientos (n = 10). Grupo 1: P (Testigo), re-
cibieron dosis única de 125 μg de cloprostenol por vía IM (intramuscular);
Grupo 2: FP, reci- bieron esponjas intravaginales que contenían 20 mg de
acetato de fluorgestona por 5 d, y al retiro de la esponja fueron inyectadas
con 125 μg de cloprostenol vía IM; Grupo 3: GP, recibieron 50 μg de GnRH IM, y
7 d después fueron inyectadas con 125 μg de cloprostenol. El inicio del estro
fue más rápido (P ≤ 0.05) en el grupo P comparado con el grupo FP. El grupo GP
(P ≤ 0.05) tuvo mayores concentra- ciones de progesterona después de 5 d
postestro, comparado con los grupos P y FP. La tasa de preñez no fue diferente
(P > 0.05) en- tre grupos. Los protocolos de sincronización evaluados fueron
semejantes en su efectividad para mejorar el comportamiento reproductivo en
ovejas de pelo. Se recomienda usar protocolos basados en su aplicación de PGF2α,
debido a su facilidad de aplicación.
PALABRAS CLAVE: cuerpo lúteo, progesterona,
hormona luteinizante, estro, gestación.
ABSTRACT
The use of progestogens can contaminate the environment and animal
tissue. Therefore, the use of prostaglandins F2α (PGF2α) and gonado- tropin-releasing hormone (GnRH)
may represent a viable alternative. The aim of the present work was to evaluate
the effect of applying a dose of GnRH within the
range of application of two doses of PGF2α, and compare it with protocols based on progestogens and PGF2α, commonly used in the synchronization of
estrus, with respect to the pre-ovulatory peak of luteinizing hormone (LH), post-estrus progesterone concentrations, pregnancy
rate, calving and prolificacy. After a pre-synchronization with a double application
of PGF2α, 30 multiparous
adult ewes (live weight = 45 ± 3.1 kg, body condition = 3.2 ± 0.5 units and
postpartum time = 60 d to 90 d, were randomly assigned to one of three
treatments (n = 10). The ewes in Group 1: P (Control) received a single dose of
125 μg of cloprostenol
via IM (intramuscular); the ewes in Group 2: FP received intravaginal
sponges containing 20 mg of fluorogestone acetate for 5 d; and upon removal of the sponge, they were injected
with 125 μg of cloprostenol
via IM; the ewes in Group 3: GP received 50 μg of GnRH IM, and 7 d later they were injected
with 125 μg of cloprostenol.
The onset of estrus was detected faster (P ≤ 0.05) in P and GP groups than in
the FP group. The GP group (P ≤ 0.05) had higher concentrations of progesterone
after 5 d post-estrus, compared to the P and FP groups. The pregnancy rate was
not different (P > 0.05) between groups. All the synchronization protocols
evaluated were similar in the effectiveness to improve the reproductive behavior
in hair sheep. Therefore, the use of protocols based on the application of PGF2α is recommended, due to their
its ease of application.
KEYWORDS: corpus luteum, progesterone, luteini-
zing hormone, estrus, gestation.
INTRODUCCIÓN
Los protocolos de sincronización del estro, en
la oveja, se han basado principalmente en imitar la fase lútea del ciclo
estral, a través de dispositivos o esponjas impregnadas con progestágenos,
tales como acetato de medroxiprogesterona (MAP, por sus siglas en inglés: Medroxiprogesterone
acetate), acetato de melengestrol (MGA, por sus siglas en inglés: Melengestrol
acetate) y acetato de fluorogestona (FGA, por sus siglas en inglés:
fluorogestone acetate) (Abecia y col., 2012); no obstante, existe una tendencia
a reducir el empleo de progestágenos, debido a los riesgos de contaminar el
medio ambiente y los tejidos que se encuentran en contacto con residuos propios
de los progestágenos utilizados, además de antibióticos usados para evitar
vaginitis en la oveja (Manes y col., 2016), implicando un cambio en el método
tradicional del control de la reproducción en los pequeños rumiantes
(Delgadillo y Martin, 2015). En respuesta a lo anterior, algunos investigadores
han disminuido el tiempo de exposición de los progestágenos, obteniendo
protocolos de sincronización de corta duración, con resultados aceptables en la
inducción y la sincronización de estros en ovejas durante las temporada
reproductiva y no reproductiva (Fleisch y col., 2012; Martinez y col., 2015).
Sin embargo, existe la tendencia de usar solamente prostaglandinas F2α
(PGF2α), porque son rápidamente metabolizadas en pulmón y, por lo
tanto, no se acumulan en los tejidos (Abecia y col., 2012), además de tener
ventajas prácticas, como fácil aplicación, costo reducido y menor
contaminación, comparada con dispositivos intravaginales impregnados con
progestágenos (Fierro y col., 2013). Cabe mencionar que las PGF2α,
al ser utilizadas de manera individual, en una sola dosis, no proveen una
sincronía aceptable de estro en las ovejas (Fierro y col., 2017), por lo que
una alternativa para mejorar el nivel de sincronía de estro y fertilidad,
provista por PGF2α es, asociarla al uso de la hormona liberadora de
gonadotropina (GnRH, por sus siglas en inglés: Gonadotropin-releasing hormone),
aplicándola al inicio del tratamiento para eliminar folículos grandes por
ovulación o atresia, e induciendo la emergencia de una nueva onda folicular en
los siguientes 3 d o 4 d después de su administración. Se ha documentado que
GnRH puede ser empleada para controlar la función folicular y lútea, así como incrementar
la precisión del estro y sincronización de la ovulación en ovejas durante la
época reproductiva (Hashem y col., 2015). La asociación de GnRH y PGF2α
se ha evaluado como alternativa a tratamientos basados con progestágenos,
obteniéndose resultados prometedores de fertilidad en la época reproductiva
(Rekik y col., 2016), pero no en la época no reproductiva (Almadaly y col.,
2016), observándose para este último, que el protocolo de sincronización con
dos aplicaciones de PGF2α, a intervalo de 9 días, y la
administración de gonadotropina coriónica equina en la segunda aplicación de
PGF2α, logró mejorar la tasa de preñez (100 %) pero la respuesta a
estro fue baja (30 %).
La GnRH es utilizada para inducir la ovulación
o bien la luteinización de un folículo (Rekik y col., 2016), sin embargo, si se
aplica en un programa de sincronización antes de la inserción de progestágenos,
puede influir en el reclutamiento de folículos, iniciando una nueva oleada
folicular e indirectamente influir en la función del cuerpo lúteo (Karaca y
col., 2009), lo cual podría a su vez contribuir en la fertilidad.
Investigaciones recientes en ovejas (Bartlewski y col., 2017) y vacas Bos indicus (Simões y col., 2018),
registraron que la aplicación exógena de progesterona durante la fase lútea del
ciclo estral, incrementó la tasa de crecimiento de los folículos antrales
grandes, y redujo el número y porcentaje de folículos ovulatorios emergentes en
la penúltima oleada del ciclo estral estudiado, aunque también disminuyó la
tasa de ovulación. Resulta interesante que incrementara la tasa de crecimiento
de algunos folículos, lo cual, puede contribuir a que al momento de la
ovulación se tenga un folículo lo suficientemente grande para generar un
subsecuente cuerpo lúteo, que pueda producir concentraciones altas de
progesterona, lo que puede ser benéfico para mejorar la fertilidad en ovejas.
El
objetivo del presente trabajo fue evaluar, durante la época reproductiva, el
efecto de administrar una dosis de GnRH a la mitad del intervalo de aplicación
de dos dosis de PGF2α sobre el pico pre-ovulatorio de hormona
luteinizante (LH), las concentraciones progesterona post-estro, la tasa de
preñez, la fertilidad y la prolificidad en ovejas de pelo, además de comparar
la eficiencia reproductiva de ovejas sincronizadas con PGF2α + GnRH
versus progestágeno + PGF2α.
MATERIALES Y MÉTODOS
Localización
del área de estudio El experimento se realizó en una granja de ovinos ubicada
en el municipio de Autlán de Navarro, Jalisco, México (19º48’ N, 104º24’ W y 1 013
msnm), donde el clima es templado seco, con lluvias en verano (García, 2004).
El estudio se llevó a cabo durante la época reproductiva (septiembre a
octubre). Todos los animales fueron manejados con base en los lineamientos
indicados en las siguientes Normas Oficiales Mexicanas: NOM-062-ZOO-1999
(especificaciones técnicas para la producción, cuidado y uso de los animales de
laboratorio) y NOM-051-ZOO-1995 (especificaciones del trato humanitario en la
movilización de animales).
Animales
experimentales y tratamientos Se utilizaron 30 ovejas hembras adultas
multíparas (cruzas de las razas Katahdin y Pelibuey), con un peso promedio de
45 ± 3.1 kg, una condición corporal de 3.2 ± 0.5 unidades (escala 1 a 5)
(Russel y col., 1969) y 60 d a 90 d postparto, considerándose aptas para los
protocolos de sincronización (Ungerfeld y SanchezDavila, 2012). Las ovejas se
encontraban separadas de los machos, sin embargo, se realizó la confirmación de
que estuvieran en una condición fisiológica de “no gestantes”, a través de
ultrasonografía de tiempo real, usando un equipo de ultrasonido (Medison®,
modelo Sonovet 2000, Seúl, Korea) equipado con el transductor lineal rectal de
7.5 MHz (Medison®, modelo Sonovet 2000, Seúl, Korea). Las ovejas fueron
asignadas al azar a uno de tres tratamientos (n = 10), después de haber sido
presincronizadas con PGF2α (cloprostenol sódico, Celosil®, MSD,
salud animal, New Jersey, USA) (Figura 1).
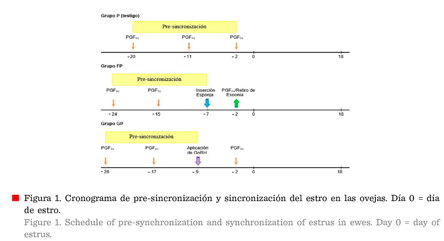
Grupo
P (Testigo): Las ovejas de este grupo recibieron la primera dosis de 125 μg de
cloprostenol sódico en el día - 20, (día 0, presentación del estro), la segunda
dosis se aplicó el día -11, correspondiendo estas dos aplicaciones al periodo
de pre-sincronización, la última aplicación de cloplostenol sódico se realizó
en el día - 2.
Grupo
FP: Las ovejas de este grupo recibieron la primera dosis de 125 μg de
cloplostenol en el día - 24, y la segunda el día - 15, correspondiente al
periodo de pre-sincronización, en el día - 7, cada oveja fue tratada con una
esponja intravaginal impregnada de 20 mg de acetato de fluorgestona (FGA;
Chronogest® CR; MSD Salud Animal, New Jersey, Estados Unidos) por un periodo de
5 d (- 7 d al - 2 d), y al término, se aplicó una dosis de 125 μg de
cloprostenol sódico por vía IM.
Grupo GP: La ovejas de este grupo recibieron la
primera dosis de 125 μg cloprostenol sódico el día - 26, y una segunda
aplicación el día - 17, comprendiendo estas dos aplicaciones el periodo de
pre-sincronización, en el día - 9 las ovejas fueron inyectadas, vía IM, con 50
μg de gonadorelina, un análogo sintético de GnRH (Fertagyl®; MSD salud animal,
New Jersey, Estados Unidos); y en el día - 2 se administraron 125 μg de
cloprostenol sódico por vía IM.
Alojamiento y alimentación
Las ovejas estuvieron en condiciones de
estabulación con un espacio de 1.0 m2 por animal, techo de lámina de 10 m x 8 m
y un espacio abierto de 10 m x 20 m con paredes de malla, alimentadas con 1.0
kg/d de alimento comercial por oveja, conteniendo 90 % de materia seca (DM, por
sus siglas en inglés: dry matter), 2.40 Mcal/kg de energía metabolizable y 16 %
de proteína cruda, más rastrojo de maíz ad
libitum; el alimento se ofreció en dos comederos de metal de 80 cm de ancho
y 4 m de largo, con acceso libre al agua en bebedero de cemento de 60 cm de
ancho, 2 m de largo y 40 cm de hondo.
Observación de la presentación y duración del
estro
El
comportamiento del estro de las ovejas fue monitoreado a partir de las 24 h
después de la aplicación de la última dosis de PGF2α,
correspondiente al programa de sincronización del estro. Las observaciones
fueron realizadas por 30 min, a intervalos de 4 h durante 4 d. Se utilizó un
macho con mandil (para evitar la preñez) para detectar las ovejas en estro. Las
ovejas detectadas en estro fueron servidas por el semental, repitiéndose la
monta 12 h después (Molina-Mendoza y col., 2005). Se trabajó con 6 machos
adultos de una edad de 4 ± 0.2 años, de la raza pelibuey, a los cuales, se les
realizaron pruebas para determinar su viabilidad espermática. Los resultados
fueron: volumen 1.0 ± 0.2 mL, motilidad 85.0 ± 5.0 %, concentración espermática
1.7 ± 0.1x 109 /mL y espermatozoides vivos 60.0 ± 4.0 %. Se asignaron dos
sementales, de forma aleatoria, por grupo de oveja, para realizar un sistema de
monta controlada, la cual consistió en que cada semental montara dos veces a
cada oveja. Las ovejas servidas fueron llevadas a otro corral.
Diagnóstico de gestación
El diagnóstico de gestación se realizó 45 d
después del servicio, utilizando un equipo de ultrasonido (Sonovet, 2000).
Toma de muestras sanguíneas
Se colectaron muestras sanguíneas mediante
venopunción de la vena yugular, obteniéndose 5.0 mL de sangre para determinar
concentraciones de progesterona (P4) y LH. Para determinar las
concentraciones de P4, se colectaron muestras sanguíneas cada 3 d, a
partir del día 1 al día 18 del ciclo estral. Para las concentraciones de LH se
colectaron muestras cada 4 h, desde las 24 h hasta las 96 h, después de
terminados los tratamientos. Posteriormente, las muestras sanguíneas fueron
centrifugadas a 1 500 xg durante 15
min, el suero fue separado por decantación para ser congelado y almacenado a –
20 °C hasta su análisis.
Al
finalizar este periodo de muestreo, todas las ovejas fueron suplementadas
durante 15 d con minerales Superbayphos® Bayer (10 mg por oveja) y además, se
aplicó vitamina K, dosis única de 1.5 mg/kg de peso vivo.
Análisis hormonales
La concentración de P4 se determinó
por el método inmunoenzimático, con un kit comercial (Inmunometrics UK Ltd. 280
Munster Roard, London SW6 6BQ). La sensibilidad del análisis fue de 0.12 ng/mL,
con coeficientes de variación intra e inter ensayo de 8.3 % y 10.7 %,
respectivamente. Las concentraciones de LH fueron determinadas por radioinmuno
análisis (Niswender y col., 1969). La sensibilidad de la prueba fue de 0.7
ng/mL y el coeficiente de variación intra ensayo fue de 7.0 % e inter ensayo de
13.3 %.
Variables de respuesta
-Porcentaje de presentación de estro: se
determinó como el resultado de dividir el número de hembras que presentaron
estro entre ovejas que recibieron tratamiento, multiplicadas entre 100.
-Inicio
del estro: se estableció como la resultante de las horas transcurridas desde el
momento de la última aplicación de croplostenol, hasta el momento que la oveja
manifiesta estro.
-Duración
del estro: se determinó como el resultado de la diferencia entre el inicio y
fin del estro.
-Inicio
y duración del pulso pre-ovulatorio de LH: el inicio de la elevación de LH se
definió como el tiempo en el cual, las concentraciones de LH fueron mayores a 2
desviaciones estándar con respecto a la secreción promedio basal, y
permanecieron así, mínimo 4 h. El fin de la elevación fue definida como el
tiempo en el cual las concentraciones de LH regresaron a su concentración basal
(Van-Cleeff y col., 1998).
-Amplitud
del pulso pre-ovulatorio de LH: fue establecido como el punto más alto del
pico, menos la concentración nadir precedente del Pico (Mattioli y col., 1986).
-Porcentaje
de preñez: se determinó como resultado de dividir el número de ovejas que
quedaron preñadas entre el número de ovejas que presentaron estro,
multiplicando el cociente por 100.
-Porcentaje
de pariciones: se definió como resultado de dividir el número de ovejas que
parieron entre el número de ovejas que estaban preñadas, multiplicando el
cociente por 100.
-Prolificidad:
se determinó como resultado de dividir el número de corderos vivos entre el
número de ovejas que parieron.
Análisis estadístico
Se utilizó un diseño completamente al azar,
donde la unidad experimental fue cada oveja. Los resultados de presentación del
estro, gestación y parto fueron analizados mediante la prueba exacta de Fisher,
a través del sistema de análisis estadístico (SAS) con el PROC FREQ (SAS,
2008). Mediante el análisis de varianza de los datos de inicio, duración del
estro e inicio, amplitud y duración de LH y prolificidad, se obtuvieron valores
promedio ± error estándar de la media (EEM), con el programa SAS, usando el PROC
GLM (SAS, 2008). Para determinar las diferencias entre las medias de los
tratamientos (P ≤ 0.05) se realizó la prueba de comparación de medias de Tukey.
Para las concentraciones de P4, se elaboró un análisis de mediciones
repetidas en el tiempo, con el software SAS, empleando el PROC MIXED para un
diseño completamente al azar (Littell y col., 1998), teniendo como factor fijo
al tratamiento, y factor aleatorio a la oveja y al tiempo. La estructura de
covarianza fue obtenida de acuerdo a la metodología establecida por Wang y
Goonewardene (2004), utilizando una arreglo de covarianza auto regresiva de
primer orden AR (1).
RESULTADOS
Porcentaje de presentación, inicio y duración
del estro El 100 % de las ovejas del grupo FP presentaron estro, pero los grupos
P y GP, presentaron una diferencia de 20 % y 10 %, respectivamente con respecto
al grupo FP (Tabla 1). El aplicar los diferentes programas de sincronización de
estros a mitad de la fase lútea no registró diferencia (P > 0.05) para la
variable duración del estro, donde la duración para los tres grupos estuvo en
el rango de 31.55 h a 36.50 h.
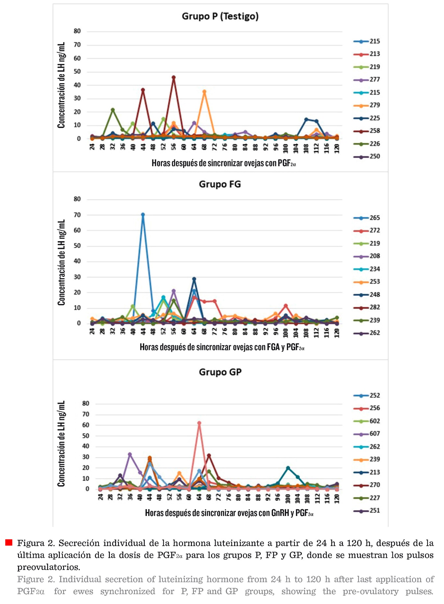
Descripción del pulso pre-ovulatorio en
las variables de inicio, amplitud y duración del pico
Las
ovejas de los tres grupos presentaron al menos un pulso pre-ovulatorio durante
un periodo de 120 h, después de la última aplicación de PGF2α
(Figura 2), registrando los valores individuales más altos en un rango de 48
ng/mL a 70 ng/mL, en los diferentes grupos. No se observó efecto alguno (P >
0.05) entre los grupos de tratamiento sobre el inicio, amplitud y duración del
pulso pre-ovulatorio, donde los promedios para amplitud y duración fueron muy
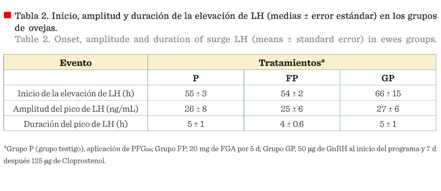
cercanos entre los diferentes grupos (Tabla 2).
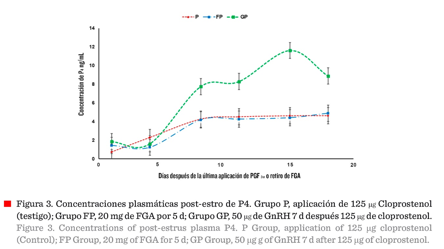
Concentración de progesterona
posterior
al estro Las concentraciones de P4 no variaron (P > 0.05) entre
tratamientos durante los primeros 5 d de post-finalizados los protocolos
(Figura 3); no obstante, después de 8 d de finalizados los tratamientos, se
detectó una diferencia significativa (P ≤ 0.05) en las concentraciones séricas
promedio de P4 entre tratamientos, siendo esta más alta para el
grupo GP en relación a los grupos P y FP. Se mantuvo dicha diferencia entre
grupos al día 18 de finalizados los tratamientos, observándose esta diferencia
en un rango de 4 ng/mL a 8 ng/mL, para este periodo.
Gestación, parto y prolificidad
El porcentaje de gestación
fue muy parecido entre los diferentes protocolos de sincronización de estro. En
tanto que, el porcentaje de partos varió del 71 % al 100 % (Tabla 1). Las
ovejas del grupo GP lograron mantener la gestación hasta el momento del parto.
La prolificidad no fue afectada (P > 0.05) por los tratamientos.
DISCUSIÓN
Los
resultados de presentación del estro se esperaban, ya que esta variable se
encuentra relacionada con la concentración de P4 al momento de la
elevación de estradiol, GnRH y gonadotropinas, pero no con la concentración
sérica de P4 durante la fase lútea (Swelum y col., 2018). La
duración del estro se ha reportado que se encuentra influida por el tiempo que
dure los niveles altos de estradiol, y los niveles de estradiol registrados
durante el estro dependen de la cantidad y el tamaño de los folículos
dominantes (Martinez-Ros y col., 2018). También la cantidad de P4
durante la fase lútea, previa al estro, juega un rol importante en los niveles de
estradiol que puedan presentarse en el estro subsecuente (Skinner y col.,
2000). Sin embargo, en el presente estudio no se encontraron efectos de los
tratamientos sobre la duración del estro (Tabla 1), lo cual sugiere que las
variaciones en las concentraciones de P4, en el ciclo previo, y la
actividad folicular fueron similares entre tratamientos.
Si
bien, la duración del estro no fue afectada por los tratamientos, el inicio de
estro fue más rápido en el grupo P (testigo), que solo utilizó PGF2α,
comparado con el grupo FP, donde se usó FGA+ PGF2α (Tabla 1). Esta
diferencia puede ser explicada por el lento metabolismo de los progestágenos,
en comparación a la progesterona natural (Swelum y col., 2015), y la efectiva
acción de la PGF2α sobre un cuerpo lúteo maduro, con una gran
cantidad de receptores (Fierro y col., 2017). Por su parte, la aplicación de
GnRH días antes de administrar PGF2α, no mostró ninguna alteración
en el tiempo de aparición del estro. Esto puede ser debido a que el GnRH se
aplicó a la mitad de la fase lútea, que es cuando el cuerpo lúteo alcanza
concentraciones altas de progesterona, evitando con ello que la GnRH tenga
efecto completo sobre la secreción de gonadotropinas, sin alcanzar a luteinizar
u ovular un folículo dominante (Titi y col., 2010).
El
pulso pre-ovulatorio de LH, en sus variables de inicio, amplitud y duración, no
se afectó por comenzar los diferentes tratamientos a mitad de la fase lútea
(Tabla 2). Skinner y col. (2000) observaron que una mayor concentración y
duración de P4, durante la fase lútea, retrasa el inicio del pulso
pre-ovulatorio de LH, durante un periodo de muestreo de 40 h, después de
retiradas las esponjas, siendo este efecto dependiente de la dosis. Para el
presente experimento, el inicio de la elevación del pulso pre-ovulatorio de LH
no fue diferente entre tratamientos (Tabla 2), por lo que es posible que la
concentración de P4, durante la fase lútea, no difiriera lo
suficiente para causar un efecto en esta variable, lo que explicaría la
ausencia de diferencias entre ellos. En relación con la amplitud y duración,
los resultados de este trabajo coinciden con los de Skinner y col. (2000),
quienes demostraron que diferentes concentraciones de P4, en la fase
lútea anterior al estro, no afecta la amplitud y duración del pulso
pre-ovulatorio de LH.
La
diferencia de concentraciones de progesterona posteriores al estro, siendo
mayores para el grupo GP, en comparación a los grupos P y FP (Figura 3), podría
deberse al grado de madurez del folículo pre-ovulatorio, al momento de la
aplicación de PGF2α, y con ello un mayor grado de hipertrofia o
luteinización en las células de la granulosa que rodean al antrum folicular
después de la ovulación (Sangha y col., 2002). En este sentido, la aplicación
de GnRH a la mitad de la fase lútea, puede provocar un aumento en el
crecimiento y desarrollo de las células foliculares, propiciando que en la
subsecuente ovulación y formación del nuevo cuerpo lúteo haya un aumento en la
concentración de P4, después del estro sincronizado, como consecuencia
de un mayor número y desarrollo de células luteales.
Es
reconocido el papel que tiene la LH, en la luteinización de las células de la
granulosa y vascularidad sanguínea, transporte de oxígeno, nutrientes y
hormonas, así como varios factores (Sangha y col., 2002), lo que podría influir
en su posterior producción de P4. Sin embargo, en este experimento
no existieron diferencias en la amplitud o duración del pulso preovulatorio,
que pueda sostener esta idea (Tabla 2).
Se
podría esperar que las altas concentraciones de P4, después del
estro, como las observadas para el grupo GP, influyeran en una mayor tasa de
gestación en comparación a los grupos P y FP, pero en este trabajo no existió
diferencia entre tratamientos para dicha variable, resultado similar a lo
reportado por Miranda y col. (2018). Al parecer, en el presente estudio, los
diferentes protocolos de sincronización de estros fueron capaces de generar
cuerpos lúteos con la suficiente producción de P4, para permitir la
implantación y desarrollo embrionario, lo que puede atribuirse al momento en el
que se iniciaron los protocolos de sincronización de estro que, en este caso,
fue a mitad de la fase lútea, cuando las concentraciones de P4 son
altas, lo que permite el desarrollo de un folículo adecuado para su ovulación y
subsecuente formación del cuerpo lúteo (Johnson y col., 1996).
En
lo que respecta al parto, no existió diferencia entre grupos (Tabla 2), sin
embargo, en el grupo GP ninguna oveja perdió su gestación, lo cual podría estar
influenciado por las altas concentraciones de P4 registradas para
este grupo, coincidiendo con lo reportado por deBrun y col. (2016), quienes
observaron que, las ovejas que tuvieron más altas concentraciones de P4 mantuvieron
su gestación hasta el parto, sugiriendo que el medio endocrino entre los d 7 a
18, condiciona el desarrollo del producto, guiando a la pérdida de la preñez
después del d 18.
En
este estudio, la variable de prolificidad no fue afectada, lo cual es un
resultado esperado, debido a que no se utilizó algún fármaco que estimulara el
crecimiento de varios folículos, tales como gonadotropina coriónica equina u
hormona folículo estimulante de origen porcino (Hasani y col., 2018; Kraisoon y
col., 2018)
CONCLUSIONES
Los protocolos de P, FP y GP, iniciados
durante la mitad de la fase lútea, fueron efectivos en sincronizar el estro en
ovejas de pelo durante la época reproductiva, así como en una fertilidad
aceptable con monta natural, considerando que, bajo las condiciones del
presente estudio, los protocolos P y GP pueden ser una alternativa al uso de
progestágenos. Por lo tanto, se recomienda usar protocolos basados en la
aplicación de PGF2α, debido a su facilidad de aplicación y aceptable
fertilidad.
AGRADECIMIENTOS
Agradecemos
el apoyo al MVZ. Ramón Andrade Mancilla, por darnos las facilidades para
trabajar con sus animales, para la realización del presente experimento.
También agradecemos al laboratorio de reproducción del Instituto de Ciencias
Agropecuarias de la Universidad Autónoma del Estado de Hidalgo y al Instituto
Nacional de Ciencias Médicas y Nutrición Salvador Zubirán, departamento de
Biología de la Reproducción, por el apoyo en el proceso, manejo y determinación
de hormonas proteínicas y esteroidales.
REFERENCIAS
Abecia, J. A. A., Forcada, F., and
González-Bulnes, A. (2012). Hormonal control of
reproduction in small ruminants. Animal Reproduction Science. 130(3-4):
173-179.
Almadaly, E., Ashour, M., El-Kon,
I., Heleil, B., andFattouh,
E. S. (2016). Efficacy of various synchronization protocols on the
estrus behavior, lambing rate and prolificacy in rahmani
egyptian ewes during the
non-breeding season. Asian
Journal of Animal and Veterinary Advances.
11(1): 34-43.
Bartlewski, P. M., Sohal, J., Paravinja, V., Baby,
T., Oliveira, M. E. F., Murawski, M., …, and Keisler, D. H. (2017). Is
progesterone the key regulatory factor behind ovulation rate in sheep? Domestic Animal Endocrinology.
58: 30-38.
de-Brun, V., Meikle, A., Fernández-Foren, A., Forcada, F.,
Palacín, I., Menchaca, A.,
…, and Abecia, J. A. (2016). Failure to establish and
maintain a pregnancy in undernourished recipient ewes is associated with a poor
endocrine milieu in the early luteal phase. Animal Reproduction Science. 173: 80-86.
Delgadillo, J. A. and
Martin, G. B. (2015). Alternative methods for control of reproduction in small
ruminants: A focus on the needs of grazing industries. Animal
Frontiers. 5(1): 57-65.
Fierro,
S., Gil, J., Viñoles, C., and Olivera-Muzante, J. (2013). The use of
prostaglandins in controlling estrous cycle of the ewe: A review. Theriogenology. 79(3): 399-408.
Fierro, S., Viñoles, C., and Olivera-Muzante, J. (2017). Long
term prostaglandin based-protocols improve the reproductive performance
after timed artificial insemination in sheep. Theriogenology. 90: 109-113.
Fleisch, A., Werne, S., Heckendorn, F., Hartnack, S., Piechotta, M., Bollwein, H., …, and Janett, F. (2012). Comparison of 6-day progestagen
treatment with Chronogest® CR and Eazi-breedTM
CIDR® G intravaginal
inserts for estrus synchronization in cyclic ewes. Small Ruminant Research. 107(2): 141-146.
García,
E. (2004). Modificaciones al sistema de
clasificación climatológica de Köppen. Instituto de Geografía. México:
Instituto de Geografía, Universidad Nacional Autónoma de México. 68 Pp.
Hasani,
N., Ebrahimi, M., Ghasemi-Panahi,
B., and HosseinKhani, A. (2018). Evaluating
reproductive performance of three estrus synchronization protocols in Ghezel ewes. Theriogenology. 122: 9-13.
Hashem, N. M., El-Azrak, K. M., Nour-El-Din, A. N.
M., Taha, T. A., and Salem, M. H. (2015). Effect of GnRH treatment on ovarian
activity and reproductive performance of low-prolific Rahmani
ewes. Theriogenology. 83(2):192-198.
Johnson, S. K., Dailey, R.
A., Inskeep, E. K., and Lewis, P. E. (1996). Effect of peripheral concentrations of progesterone on follicular
growth and fertility in ewes. Domestic Animal Endocrinology. 13(1): 69-79.
Karaca,
F., Ataman, M. B., and Çoyan, K. (2009). Synchronization of estrus with short- and long-term progestagen treatments and the use of GnRH
prior to short-term progestagen treatment in ewes.
Small Ruminant
Research. 81(2-3): 185-188.
Kraisoon, A., Redmer, D. A., Bass, C. S., Navanukraw,
C., Dorsam, S. T., Valkov,
V., …, and Grazul-Bilska, A.
T. (2018). Corpora lutea in superovulated
ewes fed different planes of nutrition. Domestic Animal Endocrinology. 62: 16-23.
Littell,
R. C., Henry, P. R., and Ammerman, C. B. (1998). Statistical analysis of repeated measures data using SAS
procedures. Journal
of Animal Science. 76(4): 1216-1231.
Manes, J., Ríos, G., Fiorentino, M. A., and Ungerfeld,
R. (2016). Vaginal mucus from ewes treated with progestogen
sponges affects quality of ram spermatozoa. Theriogenology. 85(5): 856-861.
Martinez-Ros,
P., Astiz, S., Garcia-Rosello, E., Rios-Abellan, A., and Gonzalez-Bulnes, A.
(2018). Effects of shortterm intravaginal progestagens on the
onset and features of estrus, preovulatory LH surge and ovulation in sheep. Animal Reproduction Science. 197: 317-323.
Martinez, M. F., McLeod, B., Tattersfield, G., Smaill, B.,
Quirke, L. D., and Juengel, J. L. (2015). Successful
induction of oestrus, ovulation and pregnancy in
adult ewes and ewe lambs out of the breeding season using a GnRH+
progesterone oestrus synchronisation
protocol. Animal
Reproduction Science. 155: 28-35.
Mattioli,
M., Conte, F., Galeati, G., and Seren,
E. (1986). Effect of naloxone on plasma concentrations of prolactin and LH in lactating sows. Journal of Reproduction and Fertility.
76(1): 167-73.
Miranda, V. O., Oliveira, F.
C., Dias, J. H., Vargas-Júnior, S. F., Goularte, K. L., Sá Filho, M. F., …, and Gasperin, B. G. (2018). Estrus
resynchronization in ewes with unknown pregnancy status. Theriogenology. 106: 103-107.
Molina-Mendoza, P., Sánchez-Torres-Esqueda, T., García-Flores, E.
O., Martínez-García, A., Cárdenas-León, M.,
Peralta-Ortiz, J., …, and Ortega-Cerrilla,
M. E. (2005). Manipulation of corpus luteum
presence at estrus synchronization in Dorset ewes. Agrociencia. 39(1): 11-18.
Niswender, G. D.,
Reichert, L. E., Midgley, A. R., and Nalbandov, A. V. (1969). Radioimmunoassay
for bovine and ovine luteinizing hormone. Endocrinology. 84(5): 1166-1173.
NOM-051-ZOO-1995
(1995). Trato humanitario en la movilización de animales. Secretaría de
Agricultura, Ganadería y Desarrollo Rural, en Diario Oficial de la Federación.
[En línea]. Disponible en: http://www.omecega.org.mx
/uploads/1/6/5/2/16526694/nom-051-zoo-1995_trato_humanitario_en_la_movilizacio%CC%81n_animal.pdf.
Fecha de consulta: 12 de noviembre de 2017.
NOM-062-ZOO-1999
(1999). Especificaciones técnicas para la producción, cuidado y uso de los
animales de laboratorio, en Diario
Oficial de la Federación. [En línea]. Disponible en:
http://www.dof.gob.mx/nota_detalle.php?codigo= 762506&fecha=22/08/2001.
Fecha de consulta: 5 de noviembre de 2017.
Rekik,
M., Haile, A., Abebe, A., Muluneh, D., Goshme, S., Ben-Salem, I., …, and
Rischkowsky, B. (2016). GnRH and
prostaglandin-based synchronization protocols as alternatives to progestogen-based treatments in sheep. Reproduction in Domestic Animals.
51(6): 924-929.
Russel, A. J. F., Doney, J. M., and Gunn, R. G. (1969). Subjective
assessment of body fat in live sheep. The Journal of Agricultural Science.
72(03): 451-454.
Sangha, G. K.,
Sharma, R. K., and Guraya, S. S. (2002). Biology of corpus luteum in small
ruminants. Small
Ruminant Research. 43(1): 53-64.
SAS, Statistical
Modeling Software (2008). User´s
Guide: Statistics. USA: Cary, NC, USA Inst. Inc. [En línea]. Disponible en: https://support.sas.com/documentation/cdl/en/statugstatmodel/61751/PDF/default/statugstatmodel.pdf.
Fecha de consulta: 13 de noviembre de 2017.
Simões, L. M. S., Orlandi, R. E., Massoneto, J. P.
M., Scandiuzzi, L. A., Freitas,
B. G., Bastos, M. R., …, and
Sales, J. N. S. (2018). Exposure to progesterone previous to the protocol of
ovulation synchronization increases the follicular diameter and the fertility
of suckled Bos indicus cows.
Theriogenology.
116: 28-33.
Skinner, D. C.,
Harris, T. G., and Evans, N. P. (2000). Duration and amplitude of
the luteal phase progesterone increment times the estradiol-induced luteinizing
hormone surge in ewes. Biology
of Reproduction. 63(4): 1135-1142.
Swelum, A. A. A., Alowaimer, A. N., and Abouheif,
M. A. (2015). Use of fluorogestone acetate sponges or
controlled internal drug release for estrus synchronization in ewes: Effects of
hormonal profiles and reproductive performance. Theriogenology. 84(4): 498-503.
Swelum, A. A. A., Saadeldin, I. M., Moumen, A. F.,
Ali, M. A., and Alowaimer, A. N. (2018). Efficacy of controlled internal drug release (CIDR)
treatment durations on the reproductive performance, hormone profiles, and
economic profit of Awassi ewes. Small Ruminant Research.
166: 47-52.
Titi,
H. H., Kridli, R. T., and Alnimer,
M. A. (2010). Estrus synchronization in sheep and
goats using combinations of GnRH, Progestagen
and prostaglandin F2α. Reproduction
in Domestic Animals. 45(4): 594-599.
Ungerfeld, R. and
Sanchez-Davila, F. (2012). Oestrus synchronization in
postpartum autumn-lambing ewes : effect of postpartum
time, parity , and early weaning. Spanish Journal of Agricultural Research. 10(1): 62-68.
Van-Cleeff, J., Karsch, F., and Padmanabhan, V. (1998). Characterization of
endocrine events during the periestrous period in
sheep after estrous synchronization with controlled internal drug release (CIDR) Device. Domestic Animal Endocrinology. 15(1): 23-34.
Wang, L. A. and Goonewardene,
Z. (2004). The use of MIXED models in the analysis of animal experiments with
repeated measures data. Canadian Journal of Animal Science. 84(1): 1-11.