Películas
comestibles a base de almidón nanoestructurado como material de barrera a la
humedad
Edible films based on nanostructured starch as barrier
material moisture
Alma
Vázquez-Luna1, Maricela Santiago1, Eduardo
Rivadeneyra-Domínguez2, Rafael Díaz-Sobac1*
*Correspondencia:
radiaz@uv.mx/Fecha de recepción: 7 de marzo de 2018/Fecha de aceptación: 22 de
noviembre de 2018/Fecha de publicación: 31 de enero de 20191
Universidad Veracruzana, Instituto de Ciencias Básicas, Av. Dr. Rafael Sánchez
Altamirano S/N, Carretera Xalapa-Las Trancas Km. 3.5, col. Industrial Ánimas,
Xalapa, Veracruz, México, C. P. 91192.2 Facultad de Química
Farmacéutica Biológica. Universidad Veracruzana
RESUMEN
Los materiales de empaque proporcionan
protección física y crean las condiciones fisicoquímicas apropiadas para
proporcionar una vida útil adecuada. Recientemente, la industria alimentaria ha
propuesto incorporar nanocompuestos a películas comestibles que se degraden en
un periodo corto, sin causar problemas medioambientales. El objetivo de esta
investigación fue desarrollar una película comestible resistente a la humedad,
utilizando almidón nanoestructurado, que pueda servir de empaque para aumentar
la vida útil de los alimentos, sin afectar el medio ambiente. Los efectos del
almidón nanoestructurado sobre las propiedades físicas y estructurales de una
película comestible fueron estudiados en términos de espesor, solubilidad en
agua, difusión, permeabilidad al vapor de agua (PVA), velocidad de transmisión
de vapor de agua (VTVA) y comparados a las películas de almidón nativo. Los
resultados mostraron que las películas comestibles formuladas con almidón
nanoestructurado presentaron menor espesor, comparadas con las elaboradas con
almidón nativo, además, los valores de la solubilidad en agua, el coeficiente
de difusión, PVA y VTVA fueron menores para las películas nanoestructuradas,
con respecto a las de almidón nativo. La nanoestructuración del almidón de maíz
permitió obtener películas comestibles con excelentes propiedades de barrera a
la humedad, sin modificar las propiedades estructurales de la matriz del
polímero, lo que podría constituir una alternativa para el empaque de
alimentos.
PALABRAS CLAVE: propiedades de
películas comestibles, nanoestructruación, almidón de maíz.
ABSTRACT
The packaging materials provide physical protection
and create the appropriate physicochemical conditions to give an adequate shelf
life. Recently, the food industry has proposed to incorporate nanocomposites into edible films that degrade in a short
period of time without causing environmental problems. The objective of this
research was to develop an edible film using nanostructured starch, which can
serve as a packaging, resistant to moisture, stable that can extend the shelf
life of food and additionally environmental benefits. The effects of
nanostructured starch on the physical and structural properties of an edible
film were studied in terms of thickness, water solubility, diffusion, water
vapor permeability (WVP) and water vapor transmission
rate (WVTR). The results showed that the edible films
formulated with nanostructured starch had the lowest thickness. Furthermore,
the solubility in water, the diffusion coefficient, WVP and WVTR were lower for these
films. The nanostructuring of corn
starch made it possible to obtain edible films with excellent water
barrier properties without modifying the structural properties of the polymer
matrix, which could constitute an alternative for food packaging.
KEYWORDS: edible films properties, nanostructuring,
cornstarch.
INTRODUCCIÓN
Los biopolímeros más comúnmente
utilizados, en la preparación de películas y recubrimientos comestibles, son
polisacáridos (almidón, pectina, celulosa, alginato y carragenano), proteínas
(gelatina, caseína, gluten de trigo y zeína) y lípidos (ácido esteárico, ceras
y grasas, ésteres de ácidos grasos), los cuales, pueden emplearse
individualmente o en combinación (Bravin y col., 2004; Chiumarelli y Hubinger,
2014; Oleyaei y col., 2016), o incluso con diferentes aditivos plastificantes,
como el glicerol o el sorbitol, que dan la flexibilidad adecuada a la película,
disminuyendo su fragilidad y mejorando las propiedades mecánicas de los
hidrocoloides, debido a su naturaleza hidrofílica (Chiralt y col., 2016). Las
películas y los recubrimientos comestibles, basados en polisacáridos, son
actualmente una alternativa para el empacado de alimentos, por su
biodegradabilidad y bajo costo de producción, sin embargo, su naturaleza
higroscópica y su inestabilidad física son limitantes importantes (Sorrentino y
col., 2007; Rafieian y col., 2014).
Las principales propiedades
funcionales de los materiales hidrofílicos dependen de su contenido de agua
(Slavutsky y Bertuchi, 2012; 2015). El estudio de las propiedades de barrera al
vapor de agua genera información sobre la interacción entre las películas
comestibles y la humedad durante el procesamiento y el almacenamiento (Bertuzzi
y col., 2007; Chinma y col., 2015). Para mejorar las propiedades de los
bioplásticos, incluida la permeabilidad al vapor de agua y las propiedades
mecánicas, se han desarrollado diversos métodos para reforzar los biopolímeros,
mediante la incorporación de nanopartículas o la fabricación de materiales
nanoestructurados, derivados de estos biopolímeros, sin interferir con la
biodegradabilidad y biocompatibilidad de dichos compuestos (Avella y col.,
2005). Por lo tanto, la aplicación de la nanotecnología en la industria
alimentaria, específicamente en el envasado de productos alimenticios, es un
área prometedora de innovación y desarrollo de nuevos productos (Silvestre y
col., 2011; Oleyaei y col., 2016). Los nanomateriales tienen superficies de
contacto más grandes, lo que favorece las interacciones con la matriz del
polímero (Bradley y col., 2011). El comportamiento del agua en espacios a
nanoescala difiere del agua a nivel macroscópico (Pascual y col., 2014;
Youssef, 2016).
El objetivo del presente trabajo
fue desarrollar una película comestible, utilizando almidón nanoestructurado,
que pueda ser utilizado como empaque resistente a la humedad y que extienda la
vida útil de los alimentos, con los beneficios ambientales adicionales.
MATERIALES
Y MÉTODOS
Materiales
Se compraron 10 kg de maíz
blanco (Zea mays L.) en el mercado local de la ciudad de Xalapa,
Veracruz, México. El nitrógeno líquido se obtuvo de GENEXA S.A. de C.V.
(Xalapa, Veracruz, México).
Métodos
Extracción y aislamiento de
almidón. Primero se lavó el maíz; después, se extrajo el almidón por molienda
húmeda (Ji y col., 2004). La suspensión blanca obtenida se dejó reposar en
refrigeración durante 12 h y se decantó para separar la fase sólida (almidón)
de la líquida. El almidón aislado se secó en una estufa (Novatech®,
Mod.EI35-AIA, Tlaquepaque, Jalisco, México) con recirculación de aire a una
temperatura de 45 °C durante 48 h. Posteriormente, se molió el almidón con un
mortero marca Isolab (Isolab Laborgerate GmbH, Wertheim, Alemania), y se tamizó
con malla 80 U.S. (0.177 mm) para lograr un tamaño de partícula uniforme,
similar a los almidones comerciales. Se separó parte del almidón obtenido y
para almacenarlo se envasó al vacío utilizando un sistema Food Viver Mod V2240
(Oster® Boca Raton, Florida, EU).
Nanoestructuración del almidón
El almidón aislado se modificó físicamente a escala nanométrica, para ello, se
empleó un proceso criogénico reportado previamente por Acosta y col. (2016). Se
congeló el almidón con nitrógeno líquido. Después, se utilizó un liofilizador
(Labconco®Mod FreeZone 2.5, Kansas City, MO, EU) a 0.1 mBar y - 50 ºC durante 2
d. El almidón de maíz nanoestructurado obtenido también fue envasado al vacío
hasta su uso.
Formulación
de las películas comestibles
Se elaboraron 9 formulaciones
diferentes con almidón nativo (películas sin nanoestructurar: PSN) y almidón
nanoestructurado (películas nanoestructuradas: PN) (Tabla 1), 3 %, 4 % y 5 % de
almidón se disolvieron en 75 mL de agua; se agitaron durante 10 min (25 ± 1 °C)
y posteriormente se calentaron a 85 °C durante 20 min mediante una parrilla de
calentamiento (Scientific Scorpion®, Mod. A50020, México DF, México). Después,
se añadieron 6 %, 10 % y 12 % de glicerol para cada porcentaje de almidón,
agitando las diferentes suspensiones durante 10 min y aforando a un volumen de
100 mL cada una. Finalmente, se tomaron 13 mL de cada suspensión y se vertieron
en placas de polietileno (8.1 cm φ), para su posterior secado a 45 °C en una estufa de temperatura
controlada (Novatech®, Mod.
EI35-AIA, Tlaquepaque, Jalisco, México).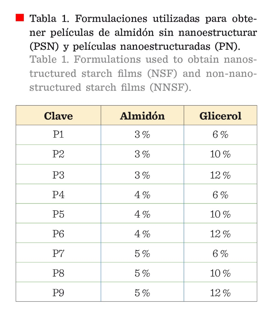
Humedad
de la película
El método utilizado para determinar la
cantidad de agua presente en las películas se basó en gravimetría indirecta por
desecación. El peso seco inicial se obtuvo después de colocar, al vacío,
muestras de película, en desecadores con pentóxido de fósforo, durante 3
semanas, hasta obtener peso constante (Bertuzzi y col., 2007). La humedad fue
calculada por diferencia de pesos.
Espesor
de la película
El espesor fue medido con un micrómetro
digital (Mitutoyo®, Mod. 293-721, Wilmington, NC, USA). El espesor de cada
película en µm, fue
calculado como el promedio de 10 mediciones tomadas en diferentes puntos de
estas.
Solubilidad
de la película en agua
Las películas se colocaron en 50 mL de agua
destilada y se mantuvieron bajo agitación constante durante 2 h a temperatura
ambiente (25 ± 1 °C) usando una parrilla (Scientific Scorpion®, Mod. A50020,
México D.F., México). Los restos no solubilizados se separaron mediante una
centrífuga (Hettich®, Mod. Mikro 220R, Tuttlingen Freiburg, Alemania) a 3 000
rpm durante 10 min, y se secaron. El peso seco final se calculó por diferencia,
con respecto al peso seco inicial, determinados por gravimetría, a peso constante,
en desecadores con pentóxido de fósforo.
Cinética
de adsorción de vapor de agua
La cinética de adsorción de vapor de agua se
realizó a 25 °C para PN y PSN, con 3 % de almidón, a los diferentes porcentajes
de glicerol 6 %, 10 % y 12 %. Las muestras de cada película se almacenaron en
desecador con pentóxido de fósforo (P2 O5 ) por una
semana. Posteriormente, las muestras secas de las diferentes películas se
colocaron a 100 % de humedad relativa (HR) dentro de celdas de vidrio selladas,
y los cambios de peso se determinaron cada 10 min en una balanza analítica
(ADAM®, Mod. PW124, MK Buckinghamshire, England) hasta que no se observaron
cambios, en tres medidas consecutivas (Acosta y col., 2016).
Análisis de los mecanismos de transferencia de
vapor de agua
La ecuación 1 se empleó para analizar los
mecanismos de transferencia de vapor de agua:
![]()
Donde: Mt es humedad
al tiempo t.
M∞ es la
humedad en el equilibrio, k es una constante que incorpora las
características del sistema de red macromolecular y la penetración.
t es
tiempo, n es un exponente difusional (Peppas y Sinclair, 1983;
Brannon-Peppas y Peppas, 1989).
Cálculo de coeficientes de
difusión Las curvas de adsorción de vapor de agua se ajustaron, según la
ecuación 2 de difusión de Fick (Crank, 1975) y se calcularon los coeficientes
de vapor de agua en la película:
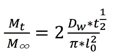
Donde: Mt es la
humedad al tiempo t.
M∞ es la humedad en el
equilibrio.
t es el tiempo, l0 es el espesor
promedio de la película.
Dw es el coeficiente
de difusión
Determinación
de la permeabilidad al vapor de agua
Se colocaron muestras circulares
de películas durante 7 d en recipientes con 53.6 %, 76.5 % y 84.6 % HR a 25 ºC.
Los cambios en las celdas de permeación fueron registrados diariamente por
diferencia de peso, mediante una balanza analítica (ADAM®, Mod. PW124, MK
Buckinghamshire, Inglaterra). La velocidad en la transmisión del vapor de agua
(VTVA) fue calculada usando la pendiente de la regresión lineal de pérdida de
peso contra el tiempo (ASTM, E96, 2000). La permeabilidad al vapor de agua
(PVAm) fue calculada de acuerdo con la ecuación 3:
![]()
Donde:
VTVA es la
velocidad de transmisión del vapor de agua en la película.
L es el
espesor de la película.
pw1 es la presión parcial de vapor
de agua dentro del recipiente.
pw2 es la presión
parcial de la solución saturada de sal dentro de la celda de permeación.
Los valores ajustados de la
permeabilidad al vapor de agua (PVAc) (Gennadios y col., 1994) fueron obtenidos
de acuerdo con la siguiente ecuación:
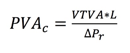
Donde:
VTVA es la
velocidad de transmisión del vapor de agua en la película.
L es el espesor de la película.
ΔPr es la diferencia de la presión parcial real del vapor de agua
en ambos lados de la película. El
porcentaje de error fue calculado por diferencia con PVAc.
Microscopia
electrónica de barrido (MEB)
La microestructura, morfología
superficial, distribución del plastificante y el grosor de la película fueron
analizados con un microscopio electrónico de barrido de emisión de campo de
alto vacío (JEOL JSM-7600F, Massachusetts, USA). Las muestras fueron cortadas
en cuadrados de 0.5 cm x 0.5 cm, y colocadas por separado en portamuestras, de
manera horizontal y vertical, para su observación morfológica a diversas
amplificaciones, considerando 1.5 kV, WD = 8.4 mm y barra = 100 µ.
Espectroscopia
óptica
Se utilizó la espectroscopia
infrarroja por transformada de Fourier (FTIR, por sus siglas en inglés: Fourier
Transform Infrared) para obtener los espectros de las películas nativas y
nanoestructuradas, en el intervalo espectral de 400 cm a 4 000 cm.
Diseño experimental
Para establecer la mejor formulación, tanto en el
tratamiento control (PSN) y el tratamiento nanoestructurado (PN), se utilizó un
diseño factorial 32, teniendo dos factores: concentración de almidón
y concentración de glicerol; ambos con tres niveles cada uno, 3 %, 4 % y 5 %; y
6 %, 10 % y 12 %, respectivamente. Los experimentos fueron llevados a cabo por
triplicado, para un total de 54 muestras.
Análisis
estadístico
El efecto de la concentración
del almidón y del plastificante en la matriz estructural de las PN y PSN fue
determinado mediante análisis de varianza factorial (ANOVA) (P ≤ 0.05)
para las variables de respuesta espesor y solubilidad. La comparación de medias se llevó a cabo mediante la prueba de
Tukey. Se utilizó el
paquete estadístico
Minitab 16 para realizar el análisis de los datos.
RESULTADOS
Y DISCUSIÓN
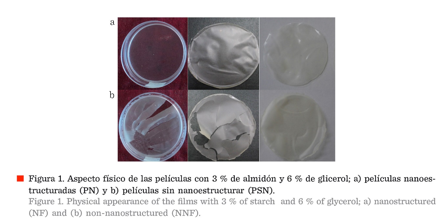
Fragilidad y flexibilidad de la película Las
películas con 3 % de almidón nanoestructurado (PN) (Figura 1a) fueron más
translúcidas, con mejor flexibilidad y menos frágiles, que las películas con 3
% de almidón sin nanoestructurar (PSN) (Figura 1b), ambas contenían 6 % de
glicerol, además de que las PN se desprendieron fácilmente de las placas donde
se formaron. Películas formuladas por Chiumrelli y col. (2010), utilizando
almidón de yuca como material base, también fueron translúcidas, así como las
elaboradas con nanocristales de almidón de maíz y proteína de amaranto por
Condés y col. (2015). Aún cuando no se realizaron fuerzas de tensión, mediante
equipos especiales, Chiumarelli y Hubinger (2012) determinaron que el uso de
glicerol mejora la flexibilidad de las películas, a diferencia de otros
plastificantes, como la cera de carnauba y el ácido esteárico, lo que evita a
su vez que las películas se vuelvan quebradizas.
Humedad
de la película
La humedad en base seca para PN
fue de 11.46 % y para PSN 21.8 %. Con estos resultados, y en términos de “agua
libre”, es decir, agua que se libera con facilidad por evaporación o secado;
PSN presenta un porcentaje mayor en comparación con PN. Ambas películas fueron
formuladas y obtenidas con las mismas condiciones, modificando únicamente el
tipo de almidón utilizado; por lo tanto, tendría que haber presentado el mismo
porcentaje de humedad. El uso del almidón nanoestructurado en las películas
podría inducir a una distribución más homogénea de las moléculas de agua, así
como de una menor movilidad de las mismas. Acosta y col. (2016), reportaron que
los materiales nanoestructurados incrementan la firmeza, la energía de
superficie y las fuerzas capilares de una matriz sólida.
Espesor
de la película
El espesor de las PN fue estadísticamente
diferente al de las PSN (P ≤ 0.05) (Figura 2), mientras las
PN tuvieron espesores entre 40 µm y 45 µm, todos los espesores de las PSN rebasaron las 50 µm. La
concentración de almidón, presente en las diferentes películas, también afectó
el espesor de las mismas (P ≤ 0.05), cuando la concentración del almidón aumentó, el espesor también. Estos resultados coinciden
con las características
de otros nanomateriales, los cuales forman superficies delgadas, como de papel
(Cao, 2004). La concentración del plastificante no afectó este parámetro (P
> 0.05). Gutiérrez y col. (2015) y Slavutsky y Bertuzzi (2014), formularon
películas con almidones modificados de yuca y cush-cush y nanocristales de
bagazo de caña; obtuvieron espesores mayores: 120 µm ± 20 µm

El espesor es una característica
muy importante de las películas, debido a que afecta las propiedades de
barrera, tales como la permeabilidad al vapor de agua (PVA), además de la
permeabilidad de otros gases.
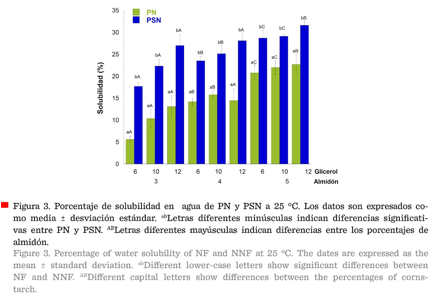
Solubilidad
en agua
El porcentaje de solubilidad de las películas
en agua (Figura 3) a 25 ºC, bajo condiciones dinámicas, fue estadísticamente
significativo (P ≤ 0.05). Las PSN presentaron porcentajes más altos de solubilidad que las
PN (P ≤ 0.05).
Al llevar a cabo el análisis de
medias, se determinó que las
películas nanoestructuradas con 3 %
de almidón, a los diferentes porcentajes
de glicerol, eran significativamente mejores que las demás, por lo que esto se tomó como referencia para llevar a
cabo las siguientes determinaciones. El almidón de PSN fue más fácil de
solubilizar que el de las PN; por lo que esta última película sería más
resistente a condiciones extremas de humedad. Es importante medir la
solubilidad en agua, ya que esto permite determinar la resistencia que tienen
las películas al estar expuestas a humedades altas (Bertuzzi y col., 2007).
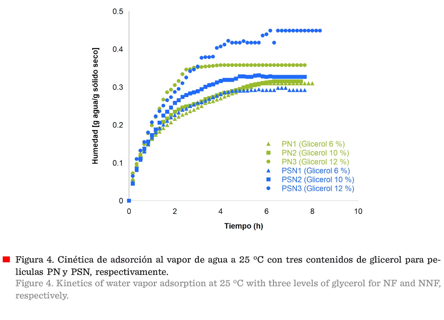
Cinética
de adsorción de vapor de agua
Para PN hubo tendencias prácticamente iguales
con los dos primeros porcentajes de glicerol, no así para la de 12 % (v/w)
(Figura 4), ya que hubo un incremento importante en la adsorción del vapor de
agua desde la primera hora. Por el contrario, en las PSN se observó un aumento
en la adsorción de agua, misma que conforme entra a la red estructural genera
un incremento en el movimiento de las cadenas del biopolímero, induciendo
cambios en el hinchamiento de la estructura, la formación de microcavidades y
la reorganización de la estructura, así como de los segmentos de la misma.
También se observó que, al aumentar la concentración de glicerol, se incrementó
la adsorción de la película, volviéndola más higroscópica; principalmente, por
la naturaleza del glicerol y la porosidad del almidón. Esta propiedad
condiciona el comportamiento de algunos materiales, facilitando principalmente
su disolución. Esto coincide con los resultados encontrados en la solubilidad
de las películas, ya que las PSN fueron más higroscópicas.
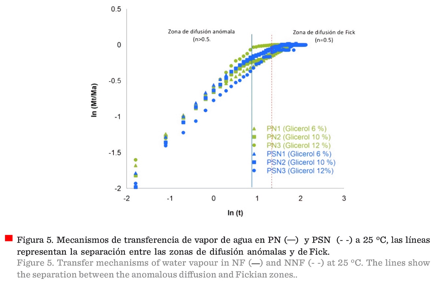
Análisis
de los mecanismos de la transferencia de vapor de agua
La difusión es un proceso de transporte de
masa, resultante de movimientos moleculares aleatorios. En polímeros amorfos,
se considera un parámetro importante, porque pequeñas moléculas, como el agua,
pueden penetrar la matriz estructural del material polimérico, y en
consecuencia, introducir cambios o transiciones físicas en el material. En
polímeros gomosos, la difusión del penetrante es generalmente Fickiana, y en
polímeros vítreos, la difusión de la molécula penetrante es mucho más compleja
(Piringer y Baner, 2008). En este trabajo, como se puede observar (Figura 5),
se presenta la relación con ln (Mt/M∞) contra
ln (t) de acuerdo a una ecuación
semiempírica (Brannon-Peppas y Peppas,
1989), donde hubo un área de
difusión anómala, determinada para grados de
hidratación inferiores a 0.216 g de agua/g en seco para PN, con valores entre
0.5 y 1.0, posteriormente, la hidratación aumentó hacia un mecanismo de difusión
Fickiano, con un valor de n = 0.5, causando una transición en el material,
volviéndolo suave y plástico. Las PSN tuvieron un área más amplia de difusión
anómala, a estados bajo hidratación de 0.286 g de agua/g en base seca. Por
arriba de este estado de hidratación, se observó un mecanismo de difusión
Fickiano (n = 0.5). Las desviaciones del comportamiento de Fick se atribuyen a
la velocidad a la que la estructura del biopolímero se reorganizó, debido a la
entrada de moléculas de agua. En el caso de esta investigación, los principales
reordenamientos estructurales se observaron a humedades bajas, cuando las
moléculas de vapor de agua comenzaron a penetrar en la matriz estructural de
las películas.
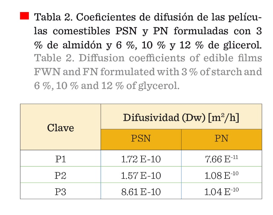
Cálculos
de los coeficientes de difusión
En PN, los valores calculados para los
coeficientes de difusión fueron significativamente diferentes a los obtenidos
para PSN (P ≤ 0.05) (Tabla 2), estas probablemente presentaron
zonas de difusión con
difusividad menor, pero cuando la concentración del glicerol
aumentó (6 %, 10 % y 12 %), el coeficiente también aumentó (P ≤ 0.05).
Las zonas de difusión
Fickianas para las PN fueron más
estrechas (Figura 5), en cambio los coeficientes de difusión fueron más altos, con respecto a las PSN,
debido a su afinidad por el agua y a la adsorción “desordenada” de las PSN. El
comportamiento observado en estas películas fue el esperado, debido a las
propiedades hidrofílicas (Figura 4), donde la PSN 3 (con almidón nativo) tuvo
una mayor adsorción de agua, aún cuando la formulación tenía el contenido de
glicerol más alto; respecto a las PN, la adsorción fue muy parecida para PN1 y
PN2, a pesar de la concentración de glicerol aumentó del 6 % al 10 %. Con base
en los resultados anteriores, se eligió la primer formulación de las PN como la
mejor, ya que tuvo el menor espesor y porcentaje de solubilidad en agua, así
como un coeficiente de difusión bajo, estos dos últimos parámetros son las
propiedades más críticas de un material de embalaje.
Permeabilidad
al vapor de agua (PVA)
Los polisacáridos y proteínas son conocidos
por su capacidad de formación de películas y pueden actuar como transportadores
efectivos de gases (O2 y CO2) o barreras, exhibiendo alta
PVA (Bertuzzi y col., 2007). Este es el caso de polisacáridos como el almidón,
que debido a su naturaleza hidrofílica, cuando interactúa con el agua, sus
propiedades mecánicas y de barrera se ven afectadas. Las interacciones generalmente
tienen un efecto plastificante, que causa un aumento en la permeabilidad. Los
valores de PVA y VTVA de las películas PN y PSN (Tabla 3), se utilizaron para
obtener la permeabilidad al vapor de agua medida y corregida (PVAm y PVAc), ya
que algunos autores han considerado el efecto que tiene la resistencia del aire
en la difusión del vapor de agua, a través de películas o revestimientos con
matrices hidrofílicas, especialmente cuando se usan sistemas estáticos
(Gennadios y col., 1994). Los resultados obtenidos mostraron diferentes valores
de PVAm para ambas películas, estos cambios presentados en la permeabilidad se
debieron a la adsorción y desorción de las películas generadas por el gradiente
de presión en la celda de permeación y la aw a la cual fue equilibrada la
película. En cuanto a PVAc no se observó una tendencia, este comportamiento se
presentó probablemente por diferencias en el espesor de las películas,
relacionado con la adsorción del agua. La PVA es una combinación de solubilidad
en agua en la película y la difusividad de las moléculas de agua en la matriz
de almidón, ambos coeficientes fenomenológicos dependen de la concentración de
humedad en la matriz del polímero. En el presente trabajo, la matriz de almidón
fue plastificada cada vez más por las moléculas de agua adsorbidas, lo que
resultó en una PVA mayor (Cheviron y col., 2015).
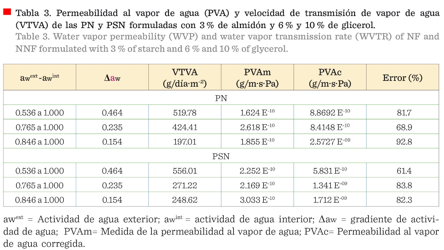
Microscopia
electrónica de barrido
Se observaron superficies
homogéneas en los cortes horizontales de las micrografías de las PN con 3 % de
almidón y 6 % de glicerol (Figura 6a), no así en las de PSN, con 3 % de almidón
y 6 % de glicerol, las cuales, presentaron micropartículas de material
plastificante, mediante los cortes verticales (Figura 6b); se determinó el
espesor de las películas observando que los promedios fueron 39.7 ± 0.7 µm y 51.4
± 2.1 µm,
respectivamente, los cuales coincidieron con los presentados en la Figura 2.
También se puede observar en esta figura, que el espesor en las PSN no fue
homogéneo.
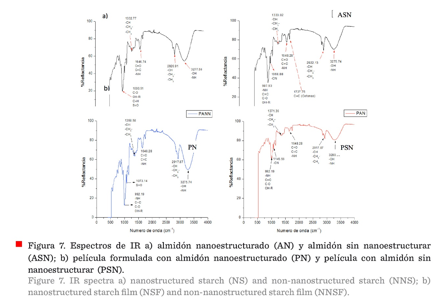
Espectroscopia
óptica
Al realizar la nanoestructuración, no se
afectó la composición química del almidón por el proceso criogénico, ambos
almidones presentaron los mismos grupos funcionales (Figura 7a). En cuanto a
las películas (Figura 7b), se observaron cambios en la intensidad de las
bandas; por ejemplo, el punto 3 275 cm, característico de los grupos hidroxilos
(OH-), se puede ver que el valor de reflactancia fue mayor para la PSN que para
PN, por lo que se podría relacionar una mayor presencia de agua en la PSN, para
una misma unidad de volumen en la PN, toda vez que, las bandas vibracionales
cambian dependiendo de la concentración. Este supuesto se basa en las
características de nanoestructuras y nanomateriales, ya que poseen una gran
fracción de átomos de superficie por unidad de volumen (Cao, 2004).
CONCLUSIONES
El tipo de almidón fue el factor con mayor
influencia significativa, para el espesor y solubilidad en agua. Las películas
formuladas con nanoestructurado presentaron menor grosor y menor solubilidad.
La concentración de glicerol afectó la velocidad de difusión del vapor de agua
en las películas, sin embargo, tal afectación fue más visible en las películas
de almidón sin nanoestructurar, que en las nanoestructuradas. La permeabilidad
al vapor de agua dependió de la humedad relativa del medio, así como de las
características de la película, esta variable aumentó a medida que aumentó la
humedad relativa del ambiente. La menor permeabilidad de las PN y PSN se obtuvo
bajo condiciones de prueba de humedades relativas de 76.5 % a 100 % y 53.6 % a
100 %, respectivamente. El proceso criogénico de nanoestructuración para la
matriz de la película utilizado en este estudio, posiblemente creó
nanocavidades con mayor contenido de humedad; lo cual pudo ser evidenciado al
presentar una mayor absorción del espectro infrarrojo.
AGRADECIMIENTOS
Maricela Santiago agradece el apoyo a Conacyt
(No. 290842) por sus estudios realizados durante la Maestría.
REFERENCIAS
Acosta, D. L., Hernández, S. H.,
Gutiérrez, L. G. F., Alamilla, B. L., and Azuara, E. (2016). Modification of the soy
protein isolate surface
at nanometric scale and its effect on physicochemical
properties. Journal of
Food Engineering. 168: 105-112.
ASTM, E96,
American Society for Testing and Materials (2000). Standard test methods for water vapour
transmission of materials. Philadelphia: Standards American Society for
Testing and Materials. 739 Pp.
Avella, M., De-Vlieger, J.
J., Errico, M. E., Fischer, S., Vacca,
P., and Grazia, V. M. (2005). Biodegradable starch/clay
nanocomposite films for food packaging applications. Food Chemistry. 93:
467-474.
Bertuzzi, M. A., Armada, M., and Gottifredi, J. C. (2007). Physicochemical characterization of
starchbased films. Journal of Food Engineering.
82(1): 17-25.
Bradley, L. E., Castle, L., and Chaudhry,
Q. (2011). Application of nanomaterials
in food packaging with a consideration of opportunities for developing
countries. Trends
in Food Science and Technology. 22(11): 604-610.
Brannon-Peppas, L. and Peppas, N. A. (1989). Solute and penetrant diffusion in swellable polymers. IX. The mechanisms of drug
release from pH-sensitive swelling-controlled systems. Journal of Control Release. 8(3):
267-274.
Bravin, B., Peressini,
D., and Sensidoni, A. (2004). Influence of emulsifier type and
content on functional properties of polysaccharide lipid-based edible films.
Journal of Agricultural
and Food Chemistry. 52(21): 6448-6455.
Cao, G. (2004). Nanostructures
and nanomaterials: synthesis, properties and
applications. Ed. Imperial College Press, UK. 433 Pp.
Cheviron, P., Gouanvé,
F., and Espuche, E. (2015). Effect of silver nanoparticles generation routes on
the morphology, oxygen, and water transport properties of starch nanocomposite films. Journal of Nanoparticules Research.
17(9): 1-16.
Chinma,
C. E., Ariahu, C. C., and Alakali,
J. S. (2015). Effect of temperature and relative humidity on the water vapour permeability and mechanical properties of cassava
starch and soy protein concentrate based edible films. Journal of Food Science and Technology. 52(4): 2380-2386.
Chiralt, A., Talens, P., Monedero, F. M., and Fabra, M. J.
(2016). Effect of different components of
edible/biodegradable composite films on water relationships in the polymer
matrix. In water, stress in biological, chemical, pharmaceutical and
food systems. In G. F. Gutiérrez-Lópéz, B. L. Alamilla, M. P. Buera, C. J. Welti, A. E. Parada, and G. V.
Barbosa-Cánovas (Ed.), Food Engineering Series (pp. 101-113). New York, NY: Springer
Science.
Chiumarelli, M. and Hubinger M. D.
(2012). Stability, solubility, mechanical and barrier
properties of cassava starch–Carnauba wax edible coatings to preserve fresh-cut
apples. Food Hydrocolloids. 28(1):
59-67.
Chiumarelli, M. and Hubinger, M. D.
(2014). Evaluation of edible films and coating formulated with cassava starch,
glycerol, carnauba wax and stearic acid. Food
Hydrocolloids. 28: 20-27.
Chiumarelli, M., Pereira, L. M. R.,
Ferrari, C. C., Sarantópoulos, C. I. G. L., and Hubinger.
M. D. (2010). Cassava starch coating and citric acid to
preserve quality parameters of fresh-cut “Tommy Atkins” mango. Journal of Food Science.
75: 297-304.
Condés, M. C., Añón, M. C., Mauri, A. N., and Dufresne, A. (2015). Amaranth protein films reinforced with maize starch nanocrystals. Food
Hydrocolloids. 47: 146-157.
Crank, J. (1975). The
mathematics of diffusion. (Second edition).
England, Oxford: University Press. 414 Pp.
Gennadios, A., Weller, C. L., and Gooding, C. H. (1994). Measurement errors in water vapor permeability of highly permeable,
hydrophilic edible films. Journal of Food Engineering. 21(4): 395-409.
Gutiérrez, J. T., Tapia, M. S., Pérez, E., and Famá, L. (2015). Structural and mechanical properties of
edible films made from native and modified cush-cush
yam and cassava starch. Food
Hydrocolloids. 45: 211-217.
Ji,
Y., Seetharaman, K., and White, P. J. (2004).
Optimizing a small-scale cornstarch extraction method for use in the
laboratory. Cereal Chemistry. 81(1):
55-58.
Oleyaei, S. A., Zahedi, Y., Ghanbarzadeh, B., and Moayedi, A.
A. (2016). Modification of physicochemical and thermal properties of starch
films by incorporation of TiO2 nanoparticles. International Journal of Biological
Macromolecules. 89: 256-264.
Pascual, P. L. A., Flores, A. E., Alamilla,
B. L., Chanona, P. J. J., Beristain,
C. I., Gutiérrez, L. G. F., and Azuara, E. (2014). Micropores and their relationship with carotenoids stability:
A new tool to study preservation of solid foods. Food and Bioprocess Technology.
7(4): 1160-1170.
Peppas,
N. A. and Sinclair, J. L. (1983). Anomalous transport of
penetrants in glassy polymers. Colloidal Polymer Sciences. 261(5): 404-408.
Piringer, O. G. and Baner, A. L. (2008). Plastic
packaging materials for food: barrier function, mass transport, quality
assurance, and legislation. Nueva York: Wiley-VCH
Germany. 576 Pp.
Rafieian, F., Shahedi,
M., Keramat, J., and J. Simonsen,
J. (2014). Thermomechanical and morphological
properties of nanocomposite films from wheat gluten
matrix and cellulose nanofibrils. Journal of Food Science 79(1):
N100-N107.
Romero, C. A., Zamudio, P.
B., and Bello, L. A. (2011). Antimicrobials in oxidized banana starch films:
effect on antibacterial activity, microstructure, mechanicals and barrier
properties. Revista
Mexicana de Ingeniería Química. 10(3): 445-453.
Silvestre, C., Duraccio, D., and
Cimmino, S. (2011). Food
packaging based on polymer nanomaterials. Progress
in Polymer Science. 36(12): 1766-1782.
Slavutsky, M. A. and Bertuzzi A. M.
(2012). A phenomenological and thermodynamic study of the
water permeation process in corn starch/MMT films.
Carbohydrates Polymers. 90(1):
551-557.
Slavutsky, M. A. and Bertuzzi, A. M.
(2014). Water barrier properties of starch films reinforced with cellulose nanocrystals obtained from sugarcane bagasse. Carbohydrates Polymers. 110: 53-61.
Slavutsky, M. A. and Bertuzzi A. M.
(2015). Formulation and characterization of nanolaminated starch-based film. LWT-Food Science and Technology. 61(2): 407-413.
Sorrentino, A., Gorrasi,
G., and Vittoria, V. (2007). Potential perspectives of bio-nanocomposites for food packaging applications. Trends in Food Science &
Technology. 18(2): 84-95.
Youssef, A. M. (2016). Polymer Nanocomposites as a New Trend for Packaging Applications.
Polymer Plastics Technology
Engineering. 52(7): 635-660.