Cinética de la adsorción de fluoruro y
arsénico usando nano-fibras de alúmina
Kinetics of the fluoride and arsenic
adsorption using alumina nanofibers
Adrián Zamorategui-Molina1*,
Norma Leticia Gutiérrez-Ortega1, Julio Del Ángel-Soto2
*Correspondencia:
zamorategui@ugto.mx/Fecha de
recepción: 5 de abril de 2018/Fecha de aceptación: 22 de febrero de
2019/Fecha de
publicación: 29 de julio de 2019
1Universidad
de Guanajuato, División de Ingenierías, av. Juárez 77, Centro, Guanajuato,
Guanajuato, México, C. P. 36000. 2Universidad de Guanajuato,
División de Ciencias Naturales y Exactas.
Resumen
En
muchos países del mundo, incluido México, la presencia de elementos tóxicos,
como el arsénico y flúor por encima de los niveles máximos permitidos en el agua potable (0.01 mg/L y 1.5 mg/L),
respectivamente está generando problemas a la salud, como el cáncer y la fluorosis esquelética, respectivamente. El objetivo de
este trabajo fue determinar la cinética del proceso de adsorción del fluoruro y arsénico en soluciones
sintéticas, utilizando gamma alúmina (γ-Al2O3)
para establecer si el proceso se desarrolla
espontáneamente. Se sintetizó γ-Al2O3 nano-fibrilar, con alta área superficial (352 m2/g),
por precipitación homogénea, y se secó
por espray. El nanomaterial adsorbente obtenido se usó para eliminar el fluoruro y el arsénico total de soluciones sintéticas. La morfología
de la nano-fibra de γ-Al2O3 mesoporosa se analizó
usando microscopía electrónica de transmisión y de barrido. El área superficial
se determinó por adsorción-desorción a pH 7
de nitrógeno. Las isotermas de adsorción del proceso de remoción
coincidieron con el modelo de Langmuir para ambos elementos. La γ-Al2O3
eliminó hasta 96 % de iones flúor y 92 % de
arsénico total a pH 5, mientras que a
pH 7 se alcanzó una remoción del 90 %
y 94.2 % de fluoruro y arsénico, respectivamente. La cinética de
remoción siguió el modelo de seudo-segundo orden, y el parámetro de equilibrio adimensional y la energía libre estándar de
Gibbs confirmaron que el proceso se desarrolló espontáneamente. La gamma
alúmina nano-fibrilar permitió la remoción natural y espontánea de arsénico y fluoruro presente en las soluciones utilizadas
en este estudio.
Palabras clave: nano-fibras, Langmuir, cinética, energía libre.
Abstract
In
many countries of the world including Mexico, the presence of toxic elements
such as arsenic and fluoride on the maximum levels permitted in drinking water
(0.01 mg/L and 1.5 mg/L) is causing health problems such as cancer and skeletal
fluorosis, respectively. For this reason, the objective of this work was to
determine the kinetics of adsorption process of the fluoride and arsenic in
synthetic water using gamma alumina (γ-Al2O3)
and to determine whether the process develops spontaneously. Nanofiber γ-Al2O3
with high surface area was synthesized by homogeneous
precipitation and spray dry method. This
adsorbent nanomaterial was used to remove fluoride and total arsenic
from synthetic water. Nanofiber morphology of the mesoporous γ-Al2O3
was analyzed by transmission and scanning electron microscopy. The high surface area (352 m2/g)
was determined by nitrogen adsorption-desorption. The adsorption
isotherms of the removal process concur by the Langmuir model for both toxic
elements. γ-Al2O3 removes
up to 96 % of fluoride ions and 92 % of total arsenic at pH5, while a removal
of 90 % and 94.2 % at pH7 of fluoride and arsenic, respectively, is achieved. The removal kinetics follows the pseudo-second
order model, and the dimensionless equilibrium parameter and Gibbs standard
free energy confirm that the process is performed spontaneously. The gamma
nano-fibrillar alumina is a good material for the natural and spontaneous
removal of arsenic and fluoride present in synthetic water used in this study.
Keywords:
nanofibers, Langmuir, kinetics, free energy.
Introducción
En
varios países se ha informado sobre la presencia de altas concentraciones de
arsénico (As) y flúor (F) en el agua potable
extraída de fuentes subterráneas, y se sabe que pueden ser peligrosos para
la salud humana. Entre los países se
encuentran: Canadá, EE. UU., México, Chile, Argentina, Japón, China,
India, Bangladesh, Taiwán, Polonia y Nueva Zelanda (Jadhav y col., 2015). Los problemas de Asinorgánico están relacionados con su movilización bajo condiciones
naturales. Algunas actividades, como
la minería, la quema de combustibles fósiles y productos agroquímicos, como los
herbicidas o aditivos a base de As producen una alta contaminación de
las aguas superficiales y subterráneas (Singh y col., 2015; Varga y col.,
2017). En el agua subterránea, la concentración de F varía con el tipo de roca
por la que fluye. Este mineral se encuentra en el agua de mar, ríos y
manantiales, en ciertos tallos de hierbas y en huesos y dientes de animales (Kanduti y col., 2016, Alconada-Magliano y col., 2017). Las aguas superficiales tienden
a contener concentraciones más bajas de As
en comparación con el agua subterránea, porque esta última está en contacto con
depósitos de este y otros elementos tóxicos (Smedley y
col., 2002).
La
calidad del agua superficial o subterránea que se utiliza con fines domésticos,
industriales o agrícolas, está en función de las influencias humanas y la
composición química del suelo y el subsuelo.
De acuerdo con las directrices de la Organización Mundial de la Salud
(WHO, por sus siglas en inglés: World Health Organization)
(WHO, 2011) la concentración de F en
el agua potable no debe exceder 1.5 mg/L y para la concentración de As, se ha adoptado el valor límite de
10 ppb (0.01 mg/L). Hoy en día, es
necesario prestar mayor atención a los posibles daños futuros a la salud humana
y al impacto ambiental causado por el
F y el As presente en el agua usada para consumo humano (Jiang y col., 2013; Chhatwani y col., 2016).
Entre las técnicas utilizadas para la eliminación de As y F del
agua potable extraída de pozos, se encuentran el tratamiento biológico, la
nano-filtración, coagulación, técnica de adsorción,
proceso de membrana, técnicas de oxidación y desalinización como ósmosis
inversa, electrodiálisis, intercambio iónico y precipitación química. También
se han usado algunos compuestos de hierro y minerales naturales (caolinita,
hematita y feldespato) para la adsorción de As y F. Así mismo, se ha investigado
la adsorción de elementos tóxicos del agua de
pozo utilizando adsorbentes de bajo costo, como alúmina activada, carbón
activado, quitosano, óxidos metálicos y otros adsorbentes (Saha y Sarkar, 2012; Rajasulochana y col., 2016;
Singh y col., 2016).
La
adsorción de iones de F y As es un proceso
que se lleva a cabo en la superficie activa del material adsorbente,
como los óxidos metálicos, entre los cuales,
han adquirido importancia la alúmina activada y el óxido/hidróxido
férrico. Sus superficies poseen grupos hidroxilo que están sujetos a reacción
de protonación en contacto con el agua, y el grado de protonación o
desprotonación depende de las propiedades de la superficie, como el potencial zeta (pZ) y su punto isoeléctrico (PIE), donde
la carga neta es igual, debido al fenómeno de protonación o desprotonación.
Para valores de pH por debajo del PIE, la superficie está predominantemente
protonada y posee una carga neta positiva.
En contraste, para un pH más alto que el pH del PIE, la superficie está predominantemente desprotonada
y posee una carga negativa (Franks y Ganz, 2017).
Los
aspectos cinéticos y termodinámicos del proceso de adsorción implican conocer
su funcionamiento y mecanismos para su
implementación. La cinética de adsorción permite determinar la capacidad
de eliminación del lecho fijo del adsorbente
en un sistema de flujo continuo, semicontinuo o discontinuo (Batch).Además, en base al análisis cinético del adsorbente,
puede establecerse la velocidad de eliminación del soluto, que está relacionado
con el tiempo de residencia
requerido para completar el proceso de adsorción. Por lo tanto, esto
permite escalar un equipo de adsorción para algunas aplicaciones. La adsorción
de iones de elementos tóxicos se ha estudiado en términos de la isoterma de adsorción de Langmuir, Freundlich y
Temkin, permitiendo la evaluación de la capacidad efectiva del adsorbente.
La velocidad de adsorción inicial y la constante de velocidad del proceso de adsorción
se pueden evaluar utilizando modelos cinéticos. En función de la capacidad del
adsorbente, estos modelos cinéticos consideran las ecuaciones de seudo primer
orden de Lagergren y seudo segundo orden, que
concuerdan con la fisisorción y la quimisorción, respectivamente, y la ecuación de Elovich (Ho, 2006; Qiu
y col., 2009).
El
objetivo de este trabajo fue estimar la cinética del proceso de adsorción de
ion fluoruro (F-) y arsénico (As), presente en el agua potable, utilizando
gamma alúmina con morfología de nano-fibra,
para evaluar si el proceso se desarrolla espontáneamente, en base a
los valores de
la energía libre
de Gibbs.
MATERIALES Y MÉTODOS
La
γ-Al2O3, con morfología nano-fibrilar y de alta
área superficial, se sintetizó por precipitación homogénea, usando el método de
secado por espray, como se describe a continuación. Se precipitó sulfato básico
de aluminio (SBA) utilizando una mezcla de una
solución de sulfato de aluminio 0.311 molar y una solución de bisulfito amónico
con una densidad de 1.3 g/mL. La mezcla se calentó hasta alcanzar la
temperatura de 90 °C, que se mantuvo durante
30 min con agitación constante a 350 rpm. El SBA se secó durante 10 h a
110 °C en horno (Torrero, HSM-101,
Aguascalientes, México), obteniendo un polvo blanco muy fino. Para
producir pseudoboehmita (PB), el SBA se neutralizó en solución de amoniaco a 70 ºC con agitación constante de 350 rpm por 30 min. La PB AlO(OH)
se filtró y se lavó con suficiente agua destilada, y después de eso, se secó
por espray a 170 °C (Mini Spray Dry
Yamato, ADL31-A, Tokio, Japón). Finalmente, la PB se trató térmicamente a 450
ºC para obtener el polvo de gamma alúmina (Zamorategui y col., 2012;
Baneshi y col.,
2014).
La identificación de fase y la cristalinidad del SBA, PB y γ-Al2O3
se analizaron por difracción de rayos X (XRD, por sus siglas en inglés: X-ray diffraction),
usando el difractómetro Siemens (DRX, D500, Karlsruhe, Alemania) en el rango de 5° a 80°, con radiación
de cobre monocromática CuKα. La caracterización de la textura se realizó
aplicando la técnica de adsorción/desorción de gas nitrógeno a la temperatura del nitrógeno líquido (77.4 K), utilizando el equipo ASAP 2010
(Micromeritics Instrument Corp., USA). El área de superficie específica y la
distribución del tamaño de poro se determinaron mediante los métodos Brunauer-Emmett-Teller (BET) y Barret-Joyner-Hallenda
(BJH), respectivamente. La Microscopía
Electrónica de Transmisión (TEM)
(Philips Tecnai F-20, Oregón, USA) se usó para establecer el tamaño y la morfología de las nano-fibras, y se
utilizó la Microscopía Electrónica de Barrido
con Emisión de Campo (FE-SEM) (JEOL
JSM 7600F, Tokio, Japón) acoplada a un detector (QUANTAXEDS, Bruker,
Berlín, Alemania) microanálisis de rayos X,
para determinar la morfología y composición química de las nano-fibras aglomeradas. El tamaño de partícula
y la magnitud de la repulsión/atracción electrostática, entre partículas (pZ),
se analizaron en suspensiones acuosas al 5
%, en volumen del sólido, en solución de KCl 10 mM, utilizando la técnica
electroacústica, usando el Acousto Sizer II (ESA, Colloidal Dynamics, USA).
Se usó una solución patrón de F (1 000 mg/L) para preparar las
diluciones con agua desionizada a concentraciones conocidas, y el F-remanente en el agua tratada
final se midió con un electrodo selectivo de
este ion (Orion, modelo SA 720, Thermo Scientific
Orion, Beverly, USA). La solución estándar de As utilizada se obtuvo comercialmente (H₃AsO4 en HNO₃ 0.5 mol/L 1 000 mg/L As Certipur®). Para determinar la
concentración de As remanente en el agua tratada se empleó la espectrometría de emisión óptica por plasma acoplado
inductivamente (ICP-OES, por sus siglas en inglés: Inductively coupled
plasma optical emission
spectrometry).
El
proceso de adsorción por lotes se realizó utilizando una relación de adsorbente
solución, de 10 g/L, es decir, 0.5 g de material adsorbente en 50 mL de las
diluciones preparadas (soluciones sintéticas),
con concentraciones iniciales por encima de los límites máximos establecidos
por la OMS, desde 5 mg/L, hasta concentraciones de 200 mg/L de F- y
As en agua desionizada. La cantidad de adsorbente seleccionada se utilizó con
el objetivo de manejar las mismas unidades de concentración de los dos contaminantes
y con base en la capacidad de remoción reportada por algunos autores, expresada
en mg/g de adsorbente (Mohan y Pittman, 2007; Zaspalis y col., 2007; Chakraborty
y col., 2010; Nicomel y col., 2015). El experimento se llevó a cabo a pH 5 y 7,
ajustado con ácido clorhídrico (0.1 M). Además, la temperatura (28 ºC) del sistema se controló con un calentador 9106A11B.
(Illinois, USA) manteniéndose con agitación magnética constante a 300
rpm. Con base en pruebas preliminares de la capacidad de remoción del adsorbente
en estudio, para alcanzar el equilibrio, las soluciones se mantuvieron a pH y temperatura constante por un periodo de 24 h
durante el proceso de adsorción. Por último, las soluciones tratadas se
filtraron para determinar las concentraciones
finales de los iones
fluoruro y arsénico.
Para
determinar el pH óptimo del proceso de remoción máxima del fluoruro y arsénico
en solución, la adsorción de iones en equilibrio se llevó a cabo con diferentes
valores de pH (de 4 a 12), usando concentraciones iniciales de F- y As de 10 mg/L, en medio acuoso. Lo anterior debido a que, en
medios muy ácidos, a pH por debajo de 4 y medios muy básicos a pH superior a 12, el material adsorbente se
ve afectado estructuralmente y se disuelve (Franks y col.,
2007).
RESULTADOS Y DISCUSIÓN
Análisis XRD y de
Espectroscopía por Energía Dispersiva de Rayos X (XEDS, por sus siglas en
inglés: Energy-dispersive X-ray spectroscopy)
La
Figura 1 muestra el difractógrama de rayos X
del SBA obtenido por precipitación homogénea, en él no se observan picos
de XRD considerables, lo que indica que esto
corresponde a un material amorfo con
nula cristalinidad, concordando con la estructura amorfa reportada en
otros estudios (Jiménez-Becerril y col., 2011).
La precipitación homogénea garantiza la síntesis de precursores amorfos,
como el SBA y la PB, para obtener gamma alúmina, con un área superficial
específica alta y baja cristalinidad (Satoshi
y col., 2001).
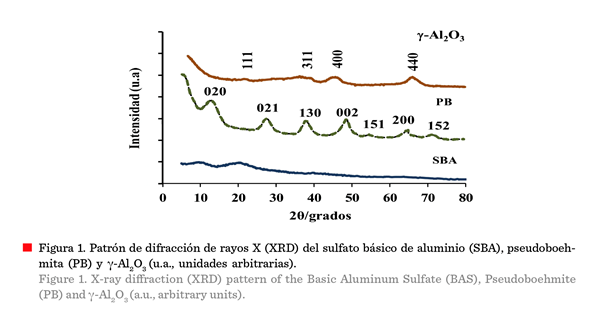
Con respecto a la PB, los ángulos de difracción (2θ), correspondientes
a los planos cristalinos
de la PB (020, 021, 130, 002, 151, 200 y 152), concuerdan muy bien con los
reportados en el JCPDS No. 21-1307. Los picos de difracción anchos y con poca altura indican que el material tiene baja cristalinidad, con
posibilidades de generar una gran área superficial. Además, los ángulos de
difracción (2θ) de la γ-Al2O3
correspondientes a los planos 311, 400 y 440 son consistentes con
aquellos reportados en el JCPDS No. 10-0425 para la γ-Al2O3,
y el patrón de difracción de rayos X del SBA presenta un bajo grado de
cristalización, debido a los picos anchos y
de baja intensidad (Jokanović y col., 2009; Hu y col., 2015; Shokati-Poursani y
col., 2015).
La cristalización de un material aumenta la agregación de partículas, y esto origina una proporcionalidad
inversa entre el área superficial y la cristalinidad del material, en consecuencia, hay una disminución del área específica de
la superficie. Es muy importante controlar la morfología y evitar el
desarrollo de estructuras cristalinas durante el proceso de síntesis de
materiales, para obtener una gran área de superficie en los adsorbentes, ya que
esta propiedad está relacionada con sus propiedades fisicoquímicas o energía superficial,
que induce una mayor capacidad de adsorción
(Coria, 2011).
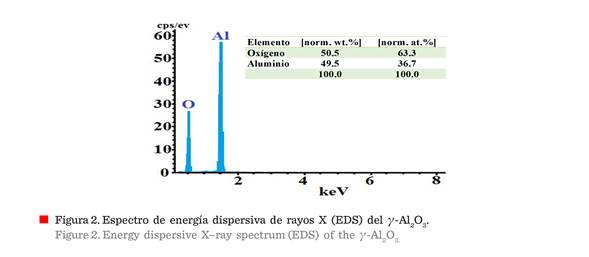
La
Figura 2 muestra el espectro XEDS correspondiente a la composición química
elemental de la γ-Al2O3.
En el FE-SEM, se utilizó un detector de EDS para separar los rayos X característicos de diferentes elementos en un espectro
de energía, y el software del sistema EDS se utilizó para
analizar el espectro de energía, con el fin de determinar la abundancia de elementos
específicos. El detector EDS contiene un cristal que absorbe la energía de los
rayos X entrantes por ionización. La absorción
de rayos X convirtió la energía de los rayos X individuales en voltajes eléctricos de tamaño proporcionales, y así, los impulsos
eléctricos corresponden a los rayos X
característicos del elemento. Los resultados
emitidos por el software revelaron que el 50.5 % en peso, o 63.3
% atómico, corresponde a oxígeno y el 49.5 % en peso (36.7 % atómico) es de
aluminio. Este resultado se debe al hecho de
que la γ-Al2O3 es una de las fases de transición más termodinámicamente
estables del corindón (α-Al2O3)
teniendo 52.93 % en peso de aluminio y 47.07 en peso de oxígeno. Como se sabe,
la ruta de transformación del oxi-hidróxido de aluminio bohemitico bohemita y
la secuencia de formación de las fases de
transición se pueden representar de la
siguiente manera (Lamouri y col.,
2016).
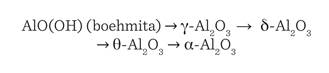
Tamaño de partícula y
morfología analizada mediante microscopía electrónica
La Figura 3a, tomada por FE-SEM muestra aglomerados porosos,
con un tamaño de 0.4 micrómetros,
aproximadamente, y presentan estructuras
muy amorfas, conformadas por nano-fibras, que ocasionan grandes huecos o porosidades por su acomodo de forma irregular.
Esta porosidad genera alta área superficial en la alúmina, favoreciendo sus
propiedades como material adsorbente. Esta observación concuerda muy bien con
los picos bajos y amplios, observados en los
resultados de XRD, lo que indica una estructura con poca cristalina y con
posibilidades de generar alta área superficial. La Figura 3b, tomada por TEM,
muestra a las nano-fibras con una longitud de 100 nm y 4 nm de diámetro aproximadamente (Kabir y col., 2007). La morfología
nano-fibrilar favorece la formación de mesoporos,
por la dificultad de acomodarse simétricamente en los aglomerados,
formando además porosidades irregulares que permiten una buena adsorción superficial y complican el proceso de
desorción.

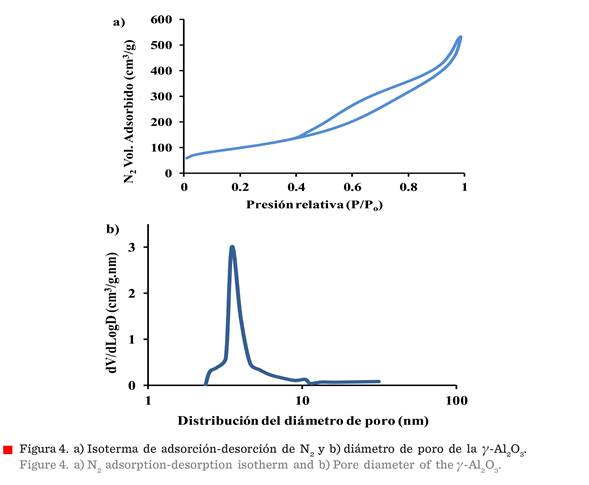
Isoterma
de adsorción/desorción de N2 y distribución del
diámetro de poro
La
isoterma de adsorción-desorción de N2, a 77 K, en la γ-Al2O3
nano-fibrilar, se muestra en la Figura 4a. La γ-Al2O3 presenta una isoterma tipo IV,
según la definición IUPAC, que es
característica de un material mesoporoso (Kim y col., 2007), lo cual coincide
con las imágenes obtenidas por FE-SEM (Figura 3a), donde se observan mesoporos generados por las nano-fibras y distribuidos irregularmente
en los aglomerados. La isoterma de forma
irregular con el ciclo de histéresis tipo E confirma que los poros en el aglomerado tienen una forma irregular, conocidos como tipo
tintero. La nano-fibra sintetizada por
precipitación homogénea y técnica de secado por espray presentó 352 m2/g de superficie
específica, calculada por el método BET; y la distribución promedio del
diámetro de poro (7.8 nm) (Figura 4b), el
volumen de poro de (0.749 8 cm3/g) y diámetro máximo de poro
(4.14 mm) se determinaron usando el método de
BJH (Siahpoosh y col.,
2016).
Potencial zeta
y tamaño de
aglomerado
La
Figura 5 muestra el perfil del pZ típico de la γ-Al2O3
y la variación del tamaño del aglomerado de las nano-fibras, de acuerdo con el cambio de pH. Los cambios en la carga superficial
de la partícula reflejan el PIE, donde las
cargas positiva y negativa son iguales, y las nano-fibras se aglomeran drásticamente.
Se encontró que el PIE tenía un pH de 8.7, y esto es consistente con otros datos reportados (Parida y
col., 2009; Anielak y Grzegorczuk-Nowacka, 2011; Avci y col., 2016). El conocimiento del comportamiento de las
nano-fibras de γ-Al2O3,
en medio acuoso, es muy importante para
definir el pH óptimo en el proceso de
adsorción y evitar la liberación de algunas
especies de aluminio en el agua, por su grado de solubilidad. Como se ha
informado, la γ-Al2O3
tiene una solubilidad determinada en agua y esto depende del pH de la solución,
la temperatura y otras especies iónicas. La solubilidad aumenta significativamente a medida que el pH disminuye por
debajo de pH 4 o cuando el pH aumenta por arriba de pH 10. La γ-Al2O3 es más estable en el rango
de pH 5 y 9.5, aproximadamente, y el proceso
de adsorción puede conducir a mejores resultados en este intervalo de
pH, con menos especies de aluminio en la
solución (Franks y col.,
2007).
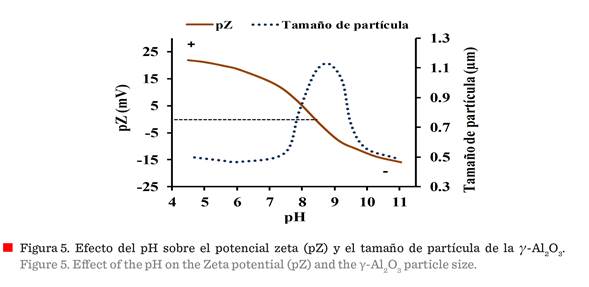
El
pZ en la dispersión de γ-Al2O3
es moderadamente alto, ya sea por debajo o por arriba del PIE, es decir, para
partículas con carga positiva y negativa, respectivamente. Estos cambios en la
zona de mayor potencial pueden mejorar el
proceso de adsorción. Además, por debajo de pH 7, la suspensión tiene un
tamaño de aglomerado pequeño, lo que concuerda
con los valores máximos del pZ obtenidos a estos valores de pH. El
tamaño del aglomerado aumenta drásticamente desde
pH 7.5, alcanzando su valor máximo en el PIE, que denota una alta floculación, porque las fuerzas de
repulsión electrostáticas disminuyen a medida que se vuelven comparables o
iguales a las fuerzas de atracción de Van der Waals entre partículas y se
neutralizan. Finalmente, el tamaño del aglomerado
disminuye a un pH aproximado de 10,
ya que las partículas adquieren mayor carga
negativa, generando defloculación por arriba
del PIE, produciendo una dispersión estable. Por lo antes mencionado, la
variación del pZ, debido a la carga superficial generada sobre la partícula a diferentes
valores de pH, es particularmente importante en el proceso de adsorción, ya que
cada material adsorbente tiene un PIE característico que define el rango de pH
donde tiene mayor capacidad de adsorción. De esta manera, la superficie activa
de γ-Al2O3, que está compuesta de átomos que tienen enlaces vacíos o vacantes, puede
reaccionar con algunos iones positivos o negativos en medios acuosos ácidos o básicos. La γ-Al2O3
es un material sólido, anfótero, que puede
reaccionar tanto como un ácido o como una base, debido al tipo de coordinación del catión de aluminio con el grupo
hidroxilo de la superficie (Carre y
col., 2008).
Efecto del pH sobre el
proceso de adsorción
La
Figura 6 muestra el comportamiento de la adsorción y el perfil de pZ con
respecto a la variación del pH. Como se mencionó, las cargas superficiales del
adsorbente son afectadas con la variación del pH, y con ello el proceso de
adsorción se ve afectado. La máxima capacidad
de remoción del F y el As total se observan a bajo pH (pH 5), muy lejos del PIE (pH
8.7), y la capacidad mínima se observa a
pH alto (pH 10). Este comportamiento de la
eliminación puede atribuirse al hecho de que,
a un pH bajo, el adsorbente tiene una carga superficial positiva, que
promueve mayores atracciones electrostáticas con la carga negativa del F- y las especies de As. Por el contrario, a pH alto, después del PIE, el
cambio de carga superficial (positivo a negativo), en el adsorbente, disminuye
la atracción electrostática.
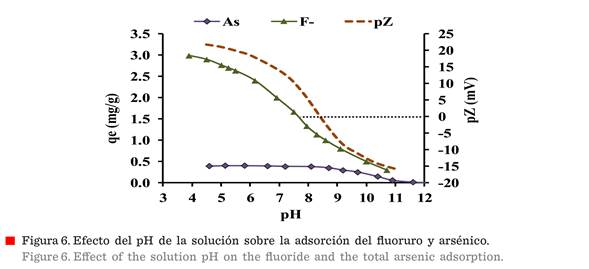
El
proceso de adsorción continúa ligeramente después del PIE, debido a los sitios
ácidos remanentes (cargas positivas internas) en la estructura de la alúmina,
sin embargo, se observa que la capacidad de
adsorción se reduce drásticamente. Con respecto a la adsorción de As, esta permanece casi constante para un pH inferior a 8, y luego disminuye significativamente para condiciones de pH mayores.
Para pH inferior a 8, la carga superficial de
γ-Al2O3 es positiva, y las especies de As predominantes poseen carga negativa: H2AsO4-y
HAsO4-2, que son atraídas por la carga superficial positiva del adsorbente (Nordstroma
y col., 2017). Finalmente, como se ha publicado (Rathore y Mondal, 2017) el
proceso de adsorción depende del pH, y la adsorción máxima se obtiene en la
zona con pZ alto, alrededor de pH 5.
Por lo tanto, el mejor valor de pH para la
adsorción concuerda con las condiciones estables de pH para γ-Al2O3
nano-fibrilar, como se muestra en las Figuras
5 y 6.
Isoterma de
adsorción de Langmuir
Es muy importante seleccionar el material adsorbente
adecuado y conocer su máxima capacidad de adsorción, así como su comportamiento
fisicoquímico. La adsorción puede ser un fenómeno fisicoquímico (reversible o irreversible) con base en la naturaleza de
las fuerzas y enlaces entre la superficie
adsorbente y las moléculas que se adsorben. Se atribuye principalmente a
la interacción de los grupos hidroxilo de la
superficie de la alúmina con los iones, átomos o moléculas, a través de
diversos mecanismos, tales como reacciones donador-receptor de electrones y/o formación
de complejos metálicos en la superficie del óxido (Kundu y col., 2007 y Yang y
col., 2017).
Se han estudiado algunos modelos de isotermas
(Langmuir, Freundlich, Temkin y Dubinin-Radushkevich)
para comprender cómo interactúa
el adsorbato con el adsorbente, y establecer la correlación más adecuada para
las condiciones de equilibrio en el proceso de adsorción (Habuda-Stanić, 2014).
Las isotermas de adsorción del F y el
As sobre la alúmina nano-fibrilar se muestran en la Figura 7a, concordando
en ambos casos con la ecuación de Langmuir,
y con los resultados reportados por otros investigadores (Mohan y Pittman,
2007; Jain y Agarwal; 2017) que se representa como:
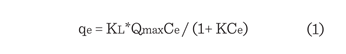
Dónde:
qe
es la cantidad de F o As adsorbido por
gramo de adsorbente, KL es la constante de Langmuir (L/mg), Qmax es la cantidad
máxima de F o As por unidad de peso del
adsorbente para formar una monocapa completa en la superficie (mg/g) y Ce es la concentración
de F o As que queda en solución. Se observa que la tendencia de la
isoterma de F es más pronunciada que la
observada para el As, y con un cambio más pronunciado en la forma de la
isoterma. Esto es indicativo de que ambos procesos de adsorción son diferentes,
como se observó en los resultados obtenidos en el efecto del pH sobre el
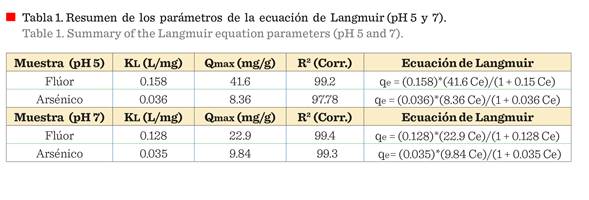
proceso de adsorción. La Tabla 1 resume
los parámetros de la ecuación de Langmuir a pH 5 y pH
7.
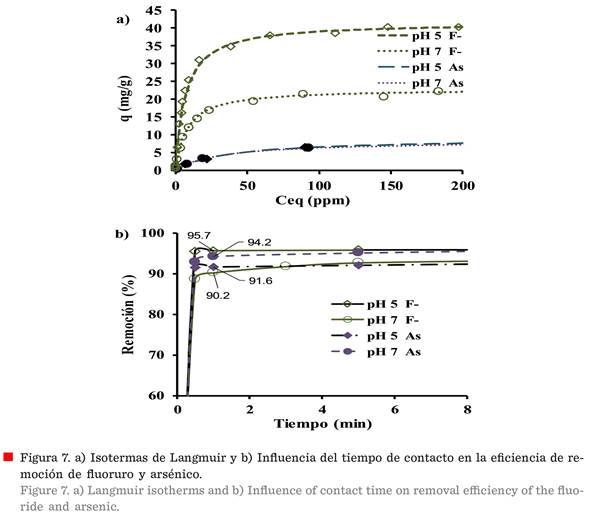
Como
ya se mencionó, la adsorción del F-,
usando γ-Al2O3 mesoporosa, depende del pH inicial
de la solución, y esto se puede ver en la
Figura 7a, donde la capacidad de adsorción máxima de 41.6 mg/g se
obtiene a pH 5, en comparación con 22.9 mg/g obtenido a pH 7. Por otro lado,
como se discutió anteriormente, la adsorción
de As total permanece casi constante a pH por debajo de 8 (Figura 6).
Además, estos resultados concuerdan con la máxima capacidad de remoción de fluoruro a pH
5 y de arsénico a pH 7 (Tabla 1; Figura 7b), encontrándose que la γ-Al2O3 nano-fibrilar
presenta mayor capacidad (41.6 mg/g),
comparada con lo reportado de 1.566
mg/g a pH 5 para el fluoruro, y mayor capacidad (9.84 mg/g) de remoción
de As, comparada con lo reportado de 0.090 9 mg/g (Das y col., 2013; Habuda-Stanić
y col., 2014; Jadhav y col., 2015). Chinnakoti hace una evaluación comparativa de
la capacidad de adsorción de fluoruro con alúmina con tamaño de nanopartícula y
otras reportadas, indicando que la alúmina con tamaño de nanopartícula tenía
mayor capacidad de adsorción de 32 mg/g, comparada con las reportadas, sin embargo, menor que la obtenida en este estudio de
41.6 mg/g. Esta capacidad de remoción indica que la cantidad de F
removido depende de la cantidad de adsorbente
utilizado en el proceso de adsorción. En este caso de estudio, un gramo
de γ-Al2O3 nano-fibrilar,
por litro de solución, permite tratar
el agua con concentración máxima de 22.9 mg/L de F para reducir su contenido por debajo del límite máximo permisible recomendado por la OMS (1.5 mg/L) a
pH 7. En el caso del As, para reducir su concentración
por debajo del límite máximo permisible
por la OMS (0.01 mg/L), se requiere que el agua a tratar tenga concentraciones de hasta 10 mg/L, con base en la
capacidad máxima de adsorción
de la γ-Al2O3 (9.84 mg/g)
a pH 7.
La influencia del tiempo de contacto en la eficiencia de eliminación
de F- y As con γ-Al2O3, a pH 5 y 7, se muestra en la Figura 7b. Se usaron
soluciones de 50 mg/L de fluoruro y 10 mg/L de soluciones de As sobre la base del
límite máximo establecido en la OMS. Como se puede ver, la tasa máxima de
eliminación del contaminante se logró
durante el primer minuto, y la eliminación máxima se observó para el F- en ese momento (95.7 %) a pH
5, en comparación con lo que se observa para el As (91.6 %) a pH 5, y el
porcentaje de eliminación a pH 7 fue 90.2 % para F y 94.2 % para As. Este
tiempo de un minuto para la remoción del 94.2 % de As a pH7, es mucho menor
comparado con los 60 min reportados para la remoción del 97 % de As al mismo
pH (Jain y
Agarwal, 2017).
Los
resultados indican que la adsorción de F-
y As, presentes en las soluciones usadas en
este estudio, pueden eliminarse fácilmente, utilizando nano-fibras de
alúmina activada (γ-Al2O3). De hecho, como
se puede ver en la Figura 7a, la capacidad máxima para el As total es menor que la obtenida para el fluoruro, debido
a que, durante el proceso de adsorción, la
concentración de As presente en la solución satura más rápido la carga
superficial del material adsorbente. Pero
sobre la base del límite máximo
establecido en la OMS, este resultado se encuentra dentro del límite
para el As (0.01 mg/L). Sin embargo, la isoterma de Langmuir no predice el
mecanismo de adsorción de F- y As, siendo necesario
analizar el modelo cinético del
proceso de adsorción.
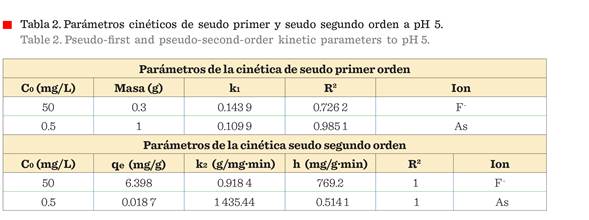
Cinética de
adsorción
Se
examinó el mecanismo que controla el proceso de adsorción, usando los modelos
cinéticos de seudo primero y seudo segundo orden en su forma linealizada. Las
concentraciones iniciales de F y As utilizadas para el estudio de la cinética
de adsorción fueron 50 mg/L y 0.5
mg/L, respectivamente. Se analizaron las concentraciones finales o remanentes
durante el proceso de adsorción de los contaminantes. Como se ha reportado, la
ecuación simple de velocidad de adsorción, de seudo primer orden de Lagergren,
se representa como (Das y col., 2013; Zhang
y col., 2014):
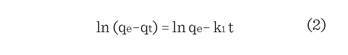
Dónde:
qe y qt (ambos en mg/g) son la
cantidad de F- y de As
adsorbidos por unidad de masa de alúmina en equilibrio y tiempo t (min), respectivamente,
y k1 es la constante de velocidad
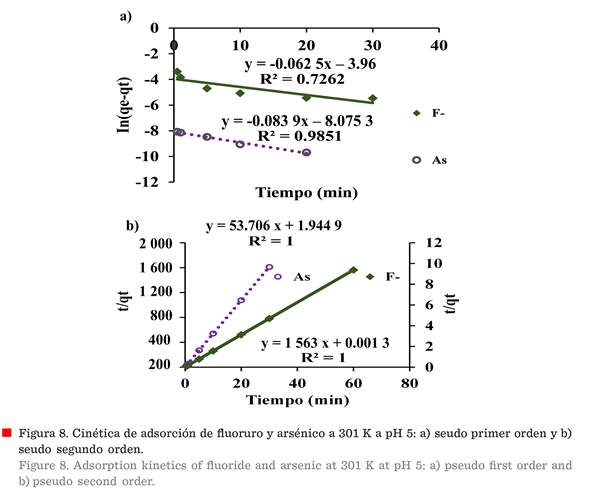
(min). El gráfico lineal de ln (qe - qt), frente al tiempo, se muestra en la
Figura 8a, y los parámetros
se resumen en
la Tabla 2.
El
modelo cinético lineal de seudo segundo orden
tiene la ecuación:
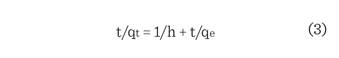
Dónde:
qt =
qe2 ∙ k2∙t/(1 + qe∙k2∙t) es la cantidad de adsorbato sobre la
superficie del adsorbente en cualquier momento (mg/g), k2 es la constante de velocidad de seudo segundo orden (mg/g·min),
qe es la cantidad de contaminante adsorbido en equilibrio (mg/g) y la tasa de
adsorción inicial, h = k2 ∙ qe2 (mg/g·min). El valor de qe (1/pendiente), k2
(pendiente2/intersección) y
h (1/intersección), de la ecuación de seudo segundo orden, se obtuvo
experimentalmente, trazando t/qt contra t para la adsorción de F- y As a 301 K. Los parámetros
obtenidos para el modelo cinético de seudo segundo orden
se resumen en
la Tabla 2.
La
gráfica de t vs. t/qt de la ecuación (3) genera
una línea recta con un coeficiente de correlación (R2) de 1, que es
el valor de correlación máximo alcanzable, lo que establece la aplicabilidad del modelo de seudo segundo orden,
en ambos casos de adsorción de F-
y As (Figura 8b), indicando un predominio del proceso de quimisorción (Ho,
2006). Este resultado concuerda con lo reportado por otros autores para la
cinética de seudo segundo orden (Kamble y
col., 2010; Jain y Agarwal,
2017).
Parámetro de
equilibrio adimensional (RL)
Para predecir la eficiencia del proceso de adsorción, el parámetro
de equilibrio adimensional se determinó
mediante la siguiente ecuación (Samarghandi y col., 2009; Kumar y Tamilarasan, 2017):
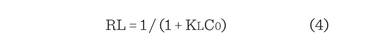
Dónde:
RL es
un factor de
separación adimensional
C0 es
la concentración inicial
(mg/L)
KL es
la constante de
Langmuir (L/mg)
Para
los valores 0 < RL < 1, la isoterma de Langmuir es favorable, y si el
valor de RL es > 1 la isoterma es desfavorable, como consecuencia, la adsorción
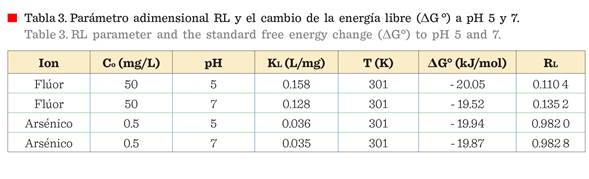
es desfavorable. Los valores obtenidos de RL se resumen en la Tabla 3. Este valor
< 1, concuerda con los resultados reportados por otros autores (Chinnakoti y
col., 2017; Jain y Agarwal, 2017). En ambos casos, los valores de RL son <
1, indicando una adsorción favorable a pH 5 y pH 7 para el F y el As total. Sin
embargo, la adsorción del F-
es más favorable, porque los valores de RL son más pequeños que los valores
obtenidos para la adsorción de As total.
El cambio
de energía libre
estándar (ΔG°)
La energía libre estándar de Gibbs es un parámetro termodinámico
que permite estimar la viabilidad del proceso
de adsorción. Permite discernir si un proceso es espontáneo o no. Los valores negativos de ΔG° implican un
proceso espontáneo, mientras que los valores positivos significan que es
necesario aportar energía al sistema,
ya que el sistema no puede evolucionar por sí mismo. La energía libre de Gibbs puede calcularse usando la siguiente ecuación:
![]()
Dónde:
R es la constante universal de los gases (8.314 J/mol∙K),
T es la
temperatura en Kelvin
KL es la constante de la isoterma de Langmuir
(L/mol) (Kamble y col., 2010; Das y col., 2013).
Utilizando el peso molar de cada contaminante, la constante de Langmuir
se usó en las unidades correspondietes (L/mol) para evaluar la energía libre. Los valores calculados de
ΔGº se resumen en la Tabla 3. El
valor negativo de - 19.52 kJ/mol, calculado de la ΔGº a pH 7 y 28 ºC, para la
adsorción del F-, es mayor negativamente
que - 2.52 kJ/mol, reportado por Kamble y col. (2010) a pH 7 y 30 ºC, indicando que el proceso es más favorable usando
alúmina nano-fibrilar en las mismas condiciones de pH 7 en un proceso de
adsorción por lotes y una
temperatura de 30 ºC. En contraste, los valores de la adsorción de F
son ligeramente más negativos que los
obtenidos para la adsorción de As a pH 5. Estos
resultados son consistentes con la isoterma de Langmuir, el valor del parámetro RL y el efecto del pH de la
solución sobre la adsorción de F y As total, lo que indica que, en ambos casos, el proceso de adsorción es de naturaleza espontánea, pero la adsorción de F es
más favorable. Esto significa que la γ-Al2O3
nano-fibrilar tiene mayor capacidad para eliminar el F- a pH 5 y 7 que la obtenida para
la remoción del
As total.
CONCLUSIONES
La
γ-Al2O3 nano-fibrilar, con alta área superficial
como adsorbente (352 m2/g), es un buen candidato para aplicarse en
el proceso de remoción de F-
y As, por su capacidad de adsorción a pH entre 5 y 7, y por desarrollarse de
forma natural el proceso de adsorción. Este nanomaterial puede eliminar hasta
96 % de F- en agua potable
a pH 5, y 90 % a pH 7, y remueve 92 % y 94.2 % del As total a pH 5 y 7, respectivamente. La correlación de los
datos de equilibrio se ajustó a la isoterma
de adsorción de Langmuir y el proceso de adsorción siguió un modelo
cinético de seudo segundo orden, que se relaciona con la adsorción química en la monocapa. Además, el
valor de RL mostró un proceso de adsorción favorable. En ambos casos, el
proceso de adsorción se lleva a cabo de forma espontánea, pero fue más eficiente para la eliminación del F-, como lo indican los valores
ligeramente más negativos obtenidos para la energía libre
de Gibbs.
AGRADECIMIENTOS
Los autores agradecen al Laboratorio de Investigación y
Caracterización de Minerales y Materiales (LICAMM), del departamento de Minas, por su
apoyo en la caracterización de las nano-fibras
de γ-Al2O3.
ReferencIAs
Alconada-Magliano, M. M.,
Damiano, F., Carrillo-Rivera, J. J., and Fagundo-Castillo J. R. (2017). Arsenic
and fluoride in water in northwestern Buenos Aires: their association with
natural landscape elements. Journal of Geography and
Regional Planning. 10(2):
8-27.
Anielak, A. M. and Grzegorczuk-Nowacka,
M. (2011). Significance of Zeta Potential in the Adsorption of Fulvic Acid on
Aluminum Oxide and Activated Carbon. Polish Journal of
Environmental Studies. 20(6):
1381-1386.
Avci, G., Akhlaghi, O.,
Ustbas, B., Ozbay, C., Menceloglu, Y. Z., and Akbulut, O. (2016). A PCE-based
rheology modifier allows machining of solid cast green bodies of alumina. Ceramics
International. 42(3): 3757-3761.
Baneshi, J., Haghighi,
M., Jodeiri, N., Abdollahifar, M., and Ajamein, H. (2014). Homogeneous precipitation
synt-hesis of CuO–ZrO2–CeO2–Al2O3 na-nocatalyst
used in hydrogen production via methanol steam reforming for fuel cell
applications. Energy Conversion and
Management. 87: 928-937.
Carre, S., Gnep, N. S.,
Revel, R., and Magnoux, P. (2008). Characterization of the acid–base properties
of transition aluminas by model reaction. Applied Catalysis A: General.
348(1): 71-78.
Chakraborty, D.,
Rahman, M. T., Das, B., Murrill, M., Dey, S., Mukherjee, S., and Quamruzzaman,
Q. (2010). Status of groundwater arsenic contamination in Bangladesh: A 14-year study report. Water Research. 44(19):
5789-5802.
Chhatwani, R., Acharya,
A., and Alim, I. (2016). Isotherm studies of equilibrium sorption of fluoride
onto calcium alginate beads. Asian Journal of Agriculture & Life
Sciences. 1(2): 9-14.
Chinnakoti, P.,
Chunduri, A. L. A., Vankayala, R. K., Patnaik, S., and Kamisetti V. (2017).
Enhanced fluoride adsorption by nano crystalline
c-alumina: adsorption kinetics, isotherm modeling and thermodynamic studies. Applied Water Science. 7(5): 2413-2423.
Coria, I. D. (2011). Variación
de las propiedades superficiales a altas temperaturas en óxidos de metales de transición
soportados en alúmina, para su utilización en reacciones catalíticas que
involucren adsorción de gases. Invenio.
14(26): 141-154.
Das, B., Devi, R. R.,
Umlong, I. M., Borah, K., Banerjee, S., and Talukdar, A. Kr. (2013). Arsenic
(III) adsorption on iron acetate coated activated alumina: thermodynamic,
kinetics and equilibrium approach. Journal of En-vironmental Health
Sciences & Engineering. 11(1): 42.
Franks, G. V. and Ganz,
Y. (2007). Charging behavior at the alumina–water interface and
implications for ceramic processing. Journal of the
American Ceramic Society. 90(11): 3373-3388.
Habuda-Stanić, M.,
Ergović, M. R., and Flanagan, A. (2014). A review on adsorption
of fluoride from aqueous solution. Materials.
7(9): 6317-6366.
Ho, Y. S. (2006). Review of second-order
models for adsorption systems. Journal of
Hazardous Materials. 136(3):681-689.
Hu, F., Wu, X., Wang,
Y., and Lai, X. (2015). Ultrathin γ-Al2O3 nanofibers with
large specific surface area and their enhanced thermal stability by Si-doping. RSC
Advances. 5(67): 54053-54058.
Jadhav, S. V., Bringas,
E., Yadav, G. D., Rathod, V. K., Ortiz, I., and Marathe, K. V. (2015). Arsenic
and fluoride contaminated groundwaters: A review of current technologies for
contaminants removal. Journal of Environ-mental Management. 162: 306-325.
Jain, A. and Agarwal,
M. (2017). Kinetic equilibrium and thermodynamic study of arsenic removal from
water using alumina supported iron nano particles. Journal of Water
Process Engineering. 19:
51-59.
Jiang, J. Q., Ashekuzzaman,
S. M., Jiang A., Sharifuzzaman, S. M., and Chowdhury, S. R. (2013). Arsenic contaminated
groundwater and its treatment options in Bangladesh. International Journal of Environmental Research and Public
Health. 10(1): 18-46.
Jiménez-Becerril, J.,
Sosa, I. G., and Rivero, I. A. (2011). Synthesis of basic aluminum sulfate
assisted by microwave heating. Ceramics
International. 37(8): 3627-3630.
Jokanović, V.,
Jokanović, B., Marković-Todorović, B., and Marković, Z. (2009). Synthesis and characterization of
hydrothermallyobtained colloidal pseudoboehmite/boehmite. Journal of Optoelectronics
and Advanced Materials. 11(2): 164-168.
Kabir, Md. E., Saha, M.
C., and Jeelani, S. (2007). Effect of ultrasound sonication in carbon nanofibers/polyurethane
foam composite. Materials Science and Enginee-
ring A. 459(1-2): 111-116.
Kamble, S. P.,
Deshpande, G., Barve, P. P., Rayalu, S., Labhsetwar, N. K., Malyshew, A., and
Kulkarni, B. D. (2010). Adsorption of fluoride from aqueous solution by alumina
of alkoxide nature: Batch and continuous operation. Desalination. 264(1-2): 15-23.
Kanduti, D., Sterbenk,
P., and Artnik, B. (2016). Fluoride: A review of use and effects on health. Materia
socio-medica. 28(2): 133-137.
Kim, S. M., Lee, Y. J.,
Jun, K. W., Park, J. Y., and Potdar, H. S. (2007). Synthesis of thermo-stable
high surface area alumina powder from sol–gel derived boehmite. Materials
Chemistry and Physics. 104(1): 56-61.
Kumar, M. and
Tamilarasan, R. (2017). Kinetics, equilibrium data and modeling studies for the
sorption of chromium by Prosopis juliflora bark carbon. Arabian Journal
of Chemistry. 10(2): S1567-S1577.
Kundu, S., Chowdhury,
I. H., Sinha, P. K., and Naskar, M. K. (2017). Effect of organic acid-modified
mesoporous alumina toward fluoride ions removal from water. Journal of Chemical & Engineering Data. 62(7): 2067-2074.
Lamouri, S., Hamidouche,
M., Bouaouadja, N., Belhouchet, H., Garnier, V., Fantozzi, G., and Trelkat, J.
F. (2016).
Control of the γ-alumina to α-alumina phase transformation
for an optimized alumina densification. Boletín de la Sociedad Española de
cerámica y vidrio. 56(2): 47-54.
Mohan, D. and Pittman,
C. U. Jr. (2007). Arsenic removal from water/wastewater using adsorbents - A
cri-tical review. Journal of Hazardous Materials. 142(1-2): 1-53.
Nicomel, N. R., Leus,
K., Folens, K., Van-Der-Voort, P., and Laing, G. D. (2015). Technologies for
arsenic removal from water: current status and future perspectives. International
Journal of Environmental Research and Public
Health. 13(1): 62.
Nordstroma, D. K., Zhub,
X., McCleskeya, R. B., Königsbergerc, L. C., and Königsbergerc, E. (2017). Thermodynamic
properties of aqueous arsenic species and scorodite solubility. Procedia Earth and Planetary Science. 17: 594-597.
Parida, K. M., Pradhan,
A. C., Das, J., and Sahu, N. (2009). Synthesis and characterization
of nano-sized porous gamma-alumina by control
precipitation method. Materials Chemistry
and Physics. 113(1): 244-248.
Qiu, H., Lv, L., Pan,
B. C., Zhang, Q. J., Zhang, W. M., and Zhang, Q. X. (2009). Critical review in
adsorption kinetic models. Journal of Zhejiang University-Science A.10(5): 716-724.
Rajasulochana, P. and Preethy,
V. (2016). Comparison on efficiency of various techniques in treatment of waste
and sewage water – a comprehensive review. Resource Efficient Technologies.
2(4): 175-184.
Rathore, V. K. and
Mondal, P. (2017). Competitive adsorption of arsenic
and fluoride onto economically prepared
aluminum oxide/hydroxide nanoparticles: Multicomponent isotherms and spent adsorbent management.
Industrial & Engineering Chemistry Research. 56(28): 8081-8094.
Saha, S. and Sarkar, P.
(2012). Arsenic remediation from drinking water by synthesized nano-alumina dispersed
in chitosan-grafted
polyacrylamide. Journal of Hazardous
Materials. 227-228: 68-78.
Samarghandi, M. R.,
Hadi, M., Moayedi, S., and Askari, F. B. (2009). Two-parameter isotherms of
methyl orange sorption by pinecone derived activated carbon. Iranian J
Environ Health Sci Eng. 6(4): 285-294.
Shokati-Poursani, A.,
Nilchi, A., Hassani A. H., Shariat, M., and Nouri, J. (2015). A novel method for
synthesis of nano-c-Al2O3: study of adsorption behavior of chromium, nickel,
cadmium and lead ions. International Journal of Environmental Science and
Technology. 12(6): 2003-2014.
Siahpoosh, S. M., Salahi,
E., Hessari, F. A., and Mobasherpour, I. (2016). Synthesis of γ-alumina with
highsurface-area via sol-gel method and their performance for the removal of
nickel from aqueous solution. Bulletin de la Société Royale des Sciences de
Liège. 85: 912-934.
Singh, R., Singh, S.,
Parihar, P., Singh, V. P., and Prasad, S. M. (2015). Arsenic contamination,
consequences and remediation techniques: A review. Ecotoxicology and
Environmental Safety. 112: 247-270.
Singh, J., Singh, P.,
and Singh, A. (2016). Fluoride ions vs removal technologies: A study. Arabian
Journal of Chemistry. 9(6): 815-824.
Satoshi, S. Contreras,
C. Juarez, H. Aguilera, A., and Serrato, J. (2001). Homogeneous precipitation
and phase transformation of mullite ceramic precursor. International Journal
of Inorganic Materials. 3(7): 625-632.
Smedley, P. L. and
Kinniburgh, D. G. (2002). A review of the source, behaviour and distribution of
arsenic in natural waters. Applied
geochemistry. 17(5): 517-568.
Varga, A., Raucsik, B.,
and Szakmány, G. (2017). Origin of natural arsenic and antimony contents in the
permian to lower tria-ssic siliciclastic rocks
of the western mecsek mountains, sw hungary. Carpathian
Journal of Earth and Environmental
Sciences. 12(1):5-12.
WHO, World Health Organization (2011).
Guidelines for drinking water quality.
Fourth edition, WHO Press, Geneva. [En línea]. Disponible en:
http://whqlibdoc.who.int/publications/2011/9789241548151_eng.pdf. Fecha de
consulta: 15 de mayo de
2017.
Yang, L., Yang, M., Xu,
P., Zhao, X., Bai, H., and Li, H. (2017). Characteristics of nitrate removal
from aqueous, solution by modified
steel slag. Water. 9(10):
757.
Zamorategui, A., Soto,
J. A., and Sugita, S. (2012). The effect of drying methods on the textural
properties of the pseudoboehmite synthesized by homogeneous precipitation. Advances
and Applications in Mechanical Engineering
and Technology. 4(4): 1-17.
Zaspalis, V., Pagana,
A., and Sklari, S. (2007). Arsenic removal from contaminated water by iron
oxide sorbents and porous ceramic membranes. Desalination. 217(1-3):
167-180.
Zhang, N., Yang, X.,
Yu, X., Jia, Y., Wang, J., Kong, L., ..., and Liu, J.
(2014). Al-1,3,5-benzenetricarboxylic metal–organic
frameworks: A promising adsorbent for defluoridation of water with pH
insensitivity and low aluminum residual. Chemical Engineering Journal.
252: 220-229.