Riqueza, composición y
abundancia de especies en una comunidad vegetal ribereña en el río Santa
Catarina, Monterrey, Nuevo León
Richness,
composition and abundance of species in a riparian plant community in the Santa
Catarina river, Monterrey, Nuevo León
José Manuel Mata-Balderas1,2, Silvino Eduardo
Hernández-Cárdenas1,
Eduardo Alanís-Rodríguez2*, Arturo Mora-Olivo3
*Correspondencia:
eduardo.alanisrd@uanl.edu.mx/Fecha de recepción: 7 de agosto de 2018/Fecha de aceptación: 6 de septiembre de 2019 Fecha de publicación: 31 de enero de 2020.
1Gestión
Estratégica y Manejo Ambiental S. C., carretera San Miguel-Huinalá núm. 935,
segundo piso, local 31, plaza comercial Acanto, Apodaca, Nuevo León, México, C.
P. 66647. 2Universidad Autónoma de Nuevo León, Facultad de Ciencias
Forestales, Linares, Nuevo León, México. 3Universidad Autónoma de
Tamaulipas, Instituto de Ecología Aplicada, Ciudad Victoria, Tamaulipas,
México.
Resumen
La
vegetación ribereña constituye un elemento clave para el mantenimiento de los ecosistemas
fluviales, en especial, en aquellos que se
encuentran circundados por zonas urbanas. El objetivo del presente
trabajo fue evaluar la variación espacial de
la riqueza, la composición y la estructura de la vegetación ribereña en
un tramo del río Santa Catarina sobre dos municipios de la Zona Metropolitana
de Monterrey. Para el análisis de la vegetación, se establecieron transectos de muestreo, en un tramo de 15.65 km. El estrato alto (plantas arbustivas y arbóreas),
se analizó mediante un modelo de ordenación Bray-Curtis y una gráfica de dominancia-diversidad.
Para el estrato bajo (plantas herbáceas), se utilizó el coeficiente de
similitud de Jaccard. En el estrato alto, se registraron
16 familias pertenecientes a 25 géneros y 28 especies. Las especies con mayor
número de individuos fueron Salix nigra, Leucaena leucocephala, Ricinus communis y Parkinsonia aculeata. La composición de la vegetación tiene
una similitud de intermedia a alta, ya que los grupos variaron con valores de
60 % a 71.53 %. En el estrato bajo, se registraron
25 familias, 53 géneros y 60 especies, con una similitud de baja a
intermedia, debido a que los primeros tres grupos variaron entre 23 % a 47 %.
Las especies que se reportaron con mayor distribución en el estrato bajo,
fueron Cyperus involucratus y Phragmites australis en 7 sitios cada una, Eragrostis mexicana,
Heliantus annuus, Melinis repens, Polygonum pensylvanicum y Typha domingensis, en 6 sitios cada una. La composición de la vegetación se encuentra en un
estado sucesional secundario, debido a que las
especies con mayor presencia son
introducidas, como Leucaena leucocephala y Ricinus communis para el estrato alto, y Cypereus involucratus y Melinis repens, para el estrato bajo.
Palabras clave:
ecosistemas fluviales, especies invasoras, estratos vegetales.
Abstract
Riparian vegetation constitutes a key element for the maintenance of fluvial ecosystems, especially for those that are
surrounded by urban zones. The aim of this study was to evaluate the
composition and variation of riparian vegetation in a stretch of the Santa
Catarina river, over two cities of the Monterrey
Metropolitan Area. For the analysis of the vegetation, sampling
transects were established in a section of
15.65 km. The high stratum (shrub and tree plants) was analyzed using a
Bray-Curtis ordering model and a dominance-diversity plot. The Jaccard
similarity coefficient was used for the low stratum (herbaceous plants). In the
high stratum, 16 families belonging to 25 genera and 28 species were recorded.
The species with the highest number of individuals were Salix nigra, Leucaena leucocephala, Ricinus communis and Parkinsonia aculeata. The composition of the
vegetation has a similarity level of intermediate to high, because the groups
vary between 60 % to 71.53 %. In thelow stratum, 25
families, 53 genera and 60 species were recorded with a similarity level of low
to intermediate, because the groups vary between 23 to 47 %. The species that
were mostly registered in the low stratum were Cyperus involucratus in 7 sites, and Eragrostis mexicana, Heliantus annuus, Melinis repens, Polygonum
pensylvanicum
and Typha domingensis in six sites each one. The
composition of the vegetation is in a secondary successional state,
because the species with greater presence are
exotic or invasive, such as Leucaena leucocephala and Ricinus communis for the high stratum and Cyperus involucratus, Typha domingensis and Melinis repens for
the low stratum.
Keywords: river ecosystems, invasive
species, plant strata.
Introducción
La
vegetación ribereña se desarrolla a lo largo de cursos de agua naturales, y
constituye un elemento clave para el mantenimiento de los ecosistemas fluviales
(Rzedowski, 2006). Estas comunidades vegetales
representan un hábitat natural, y a su vez, corredores biológicos para la fauna
silvestre que se desarrolla en ellas (Paolino
y col., 2018). Así mismo, cumplen con una función de protección de
grandes avenidas fluviales, evitando con ello el desbordamiento de ríos e
inundaciones (Croke y col., 2017).
Estas comunidades vegetales tienen una estructura y composición
florística muy rica, como
resultado de una serie de sucesiones a lo
largo del tiempo, que han propiciado un balance de especies que dominan
2 o más estratos; sin embargo, este equilibrio puede cambiar drásticamente para
los que se encuentran dentro o cercanos a las áreas urbanas (Bozóki y col., 2018; Dahmer y
col., 2018). Usualmente, las actividades
antropogénicas, como la canalización,
obras hidráulicas, desazolve, entre otros, contribuyen a que estas
zonas riparias sean invadidas por especies introducidas y ruderales, potencialmente invasoras (Aronson
y col., 2017; Grella y col., 2018), lo cual modifica
la composición y variación de la
vegetación nativa.
Lamentablemente,
la modificación de los cursos de agua en zonas urbanas, es un fenómeno muy
común en la actualidad (Aronson y col., 2017). Quizá
las zonas rurales no presenten problemas tan drásticos en este
sentido,
pero en ciudades con altas densidades demográficas es evidente que existen graves complicaciones ecológicas y sociales
(Guida-Johnson y col., 2017). Un ejemplo de lo anterior es la Zona Metropolitana de Monterrey (ZMM), en el estado de Nuevo León, México,
la cual es atravesada por el río Santa Catarina
de poniente a oriente.
El río Santa Catarina nace en el cañón La Purísima de la sierra de San
José (límites con Coahuila)
y atraviesa parte de los municipios de Santiago, Santa Catarina, San Pedro, Monterrey,
Guadalupe, Juárez y Cadereyta, con una
cuenca aproximada de 1 200 km2,
y una longitud de 160 km, hasta su confluencia con el río San Juan, uno de los más importantes de la región noreste del país (Periódico
Oficial del Gobierno Constitucional del
Estado Libre y Soberano de Nuevo
León, 2008).
En el año 2008, un trayecto del cauce del río Santa Catarina en la ZMM
fue decretado como Área
Natural Protegida Estatal, en categoría de
Parque Urbano, bajo la denominación de “Parque Lineal”. Esta categoría
obedece al
hecho de que es un reducto de vegetación riparia, que
ofrece múltiples servicios ambientales (Periódico Oficial del Gobierno Constitucional
del Estado Libre y Soberano de Nuevo
León, 2008).
A pesar de que
el río normalmente lleva un gasto de poca consideración y sin turbulencia, con lluvias importantes en verano, se suele
convertir en un temible torrente, no solamente por la cantidad de agua recibida
del cañón La Purísima, sino también de los flujos torrenciales de la ZMM, cuya
red fluvial se ve sobrepasada por las fuertes lluvias, como ha sucedido en años
pasados, con los huracanes Gilberto, Emiliy y Alex (en los años 1988, 2005 y 2010,
respectivamente), de acuerdo al Plan de desarrollo Urbano del Municipio de
Monterrey (PDUMM, 2012).
Los
estudios florístico-ecológicos de los ríos generan conocimiento para la
determinación de estrategias adecuadas para el manejo eficiente de estos ecosistemas. Actualmente,
los antecedentes sobre estos temas, en la región, son el de Villarreal y col.
(2006), quienes estudiaron la flora riparia de los
ríos Sabinas y San Rodrigo en Coahuila; los de Treviño y col. (2001) y Canizales y col.
(2010), que trabajaron con comunidades
vegetales ribereñas de los ríos Ramos y Cabezones en Nuevo León. Sin
embargo, ninguno de estos cuatro ríos fueron
estudiados en una zona urbana afectada por el
cambio de uso de suelo.
El objetivo
del presente trabajo fue evaluar la variación
espacial de la riqueza, la composición y la estructura (únicamente en el
estrato alto), de especies de la vegetación ribereña del río Santa Catarina, en
una porción con alta
densidad urbana.
MATERIALES Y MÉTODOS
Área de estudio
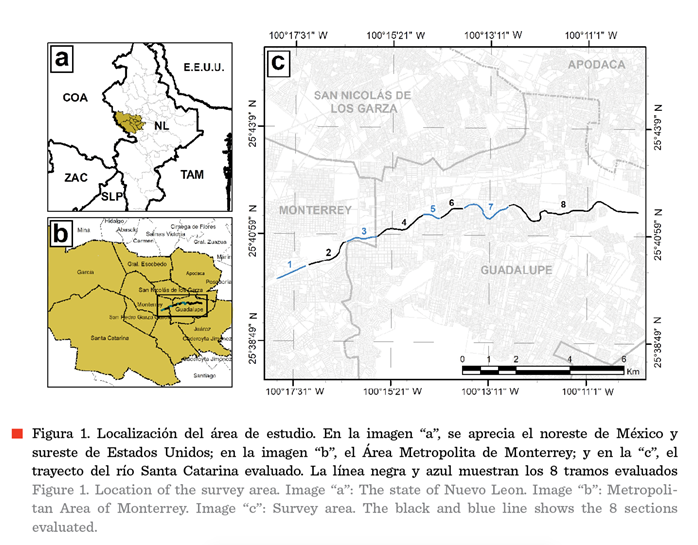
El estudio
se desarrolló en una comunidad vegetal ribereña en el río Santa Catarina, en el
noreste de México, específicamente en los municipios de Monterrey y Guadalupe,
Nuevo León (Figura 1). Las coordenadas de ubicación del sitio de inicio, al
oeste son 25º40’04” N y 100º17’50” W, y las del sitio donde concluye el
análisis, ubicado más al este, son 25º41’25”
N y 100º09’53” W, con una altitud que varía de 428 msnm a 517 msnm.
De acuerdo a la clasificación de Köeppen, modificada por García (1964), para la
república mexicana, el clima es estepario, semicálido,
subhúmedo ((A)Cx’), con lluvias de verano. El
porcentaje de precipitación invernal es entre 5 % y 10.2 % anual, con una temperatura
media anual de 18 °C a 22 °C. El suelo del área donde se realizó el estudio está
constituído por feozem, un
tipo caracterizado por su humedad, color oscuro, producto de la alta cantidad
de materia orgánica y por su saturación de bases, de acuerdo a la Organización
de las Naciones Unidas para la Alimentación y la Agricultura (FAO, por sus
siglas en inglés: Food and Agriculture Organization) (FAO,
2015).
Análisis de la
vegetación
El análisis
de la comunidad vegetal se realizó en septiembre y octubre (meses de mayor
precipitación) mediante un inventario de la cubierta
vegetal en un tramo de 15.65 km lineales
y un ancho aproximado de 80 m (40 m en ambas riberas del río), sobre ambos
lados del cauce del río Santa Catarina, conformando un área de estudio de
125.20 ha de superficie. La evaluación se realizó en 8 secciones (identificadas en forma numerada en la Figura 1) que variaron de 1.20 km hasta 3 km, a lo
largo de la zona de estudio. El total del
área muestreada fue de 9.6 ha de superficie, lo que representa el 7.66 %
del área total. La longitud de cada una de las secciones obedeció a la
accesibilidad del sitio y la abundancia de vegetación. En estas secciones se
contabilizó el número total de individuos de estrato alto y la presencia de
especies del estrato bajo. La clasificación de la cubierta vegetal se dividió
en 2 clases y/o grupos. En el estrato alto, se consideró la vegetación de porte
arbustivo y arbóreo que presentaron alturas que van de los 2 m hasta los 8 m de
altura; y el estrato bajo, como las especies del grupo de las herbáceas, con alturas estimadas
que van de los 0.30 m
hasta los 1.99 m de altura. Las especies se
identificaron utilizando claves taxonómicas de Correll
y Johnston (1970) y el libro de Molina-Guerra y col. (2019). Para definir las
especies introducidas se siguió principalmente a Villaseñor y Espinosa-García
(2004).
Análisis de
la información
Para
evaluar la diversidad beta, que es el grado
de reemplazamiento de especies o cambio biótico, a través de condiciones ambientales (Whittaker,
1972), en el estrato alto, se utilizó un
algoritmo que analiza la similitud de
las muestras mediante el cálculo del
porcentaje de similitud (0 % a 100 %) entre cada una de ellas y que es
representada en una gráfica de similitud de Bray-Curtis
(Brower y col.,
1998). Valores cercanos a 0 indican que existe una escasa similitud
florística, valores cercanos al 50 % indican intermedia, y cercanos al 100
alta. El análisis se desarrolló mediante el programa BioDiversity
Pro 2.0 (McAleece y col., 1997).
Para el
estrato bajo, únicamente se registró la presencia de las especies en los sitios
de muestreo, por lo tanto, se utilizó el
coeficiente de similitud de Jaccard para determinar
el grado de semejanza entre los sitios (Magurran,
1988), mediante la siguiente ecuación:
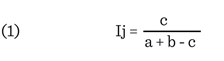
Donde:
Ij es el coeficiente de similitud
de Jaccard, a es el número de especies presentes en
el sitio A, b número de especies presentes en el sitio B, y c son las especies
presentes en ambos sitios A y B. El análisis se realizó en
el programa PAST 3.20 (Hammer
y col., 2001).
Para describir la estructura de la comunidad, se
generó una gráfica de dominanciadiversidad (Brower y col.,
1998), la cual, describe la relación del número de individuos de las especies en función de un arreglo secuencial
de especies, y esta se presenta del mayor al menor valor (Martella
y col., 2012). De igual manera, los valores cercanos a 0 de este índice, indican que existe una escasa similitud
florística, valores cercanos al 50 % indican intermedia, y cercanos al 100
alta.
RESULTADOS
Variación de
la riqueza
En general, se registraron 87 especies, 77 géneros y 37 familias de plantas, incluyendo a una alga
macroscópica. De estas, 18 especies son introducidas y el resto nativas. Algunos
autores ya han reportado la presencia de especies introducidas en comunidades
vegetales ribereñas e indican que existe una relación positiva entre el nivel
de urbanización y el porcentaje de especies introducidas (Burton y col., 2005; Pennington y col., 2010).
Estrato alto
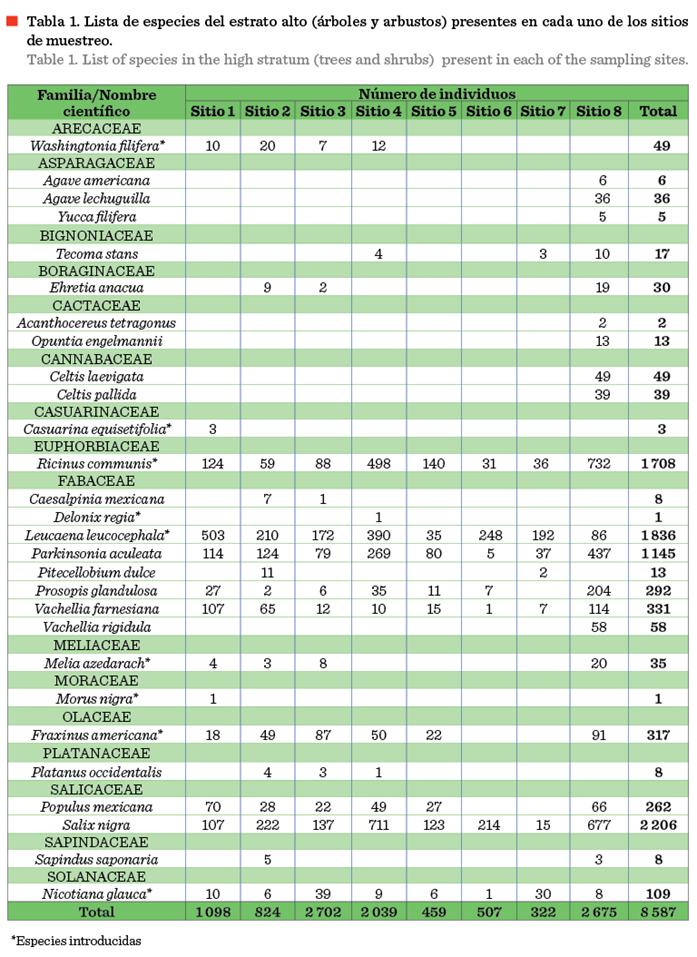
Derivado del muestreo, en el estrato alto se registraron 16 familias
pertenecientes a 25 géneros
y 28 especies, incluyendo 9 especies
introducidas (Tabla 1). Las especies con mayor número de individuos
fueron Salix nigra Marshall
1785, Leucaena leucocephala (Lam.) de
Wit 1961, Ricinus communis L. 1753
y
Parkinsonia aculeata L. 1753. Dichas especies,
además de Vachellia farnesiana (L.) Wight & Arn. 1834 y Nicotiana glauca Graham 1828, tuvieron presencia
en todos los sitios de muestreo. Las
especies Vachellia rigidula (Benth.)
Seigler & Ebinger 2005,
Acanthocereus tetragonus (L.) Hummelinck
1938, Agave americana L. 1753, Agave lechuguilla Torr. 1859, Casuarina equisetifolia L. 1759, Celtis laevigata Willd. 1814, Celtis pallida Torr. 1859, Delonix regia, Morus nigra L. 1753, Opuntia engelmanni Salm-Dyck
1849 y Yucca filifera
Chabaud 1876, sólo se presentaron en un sitio de
muestreo.
Estrato bajo
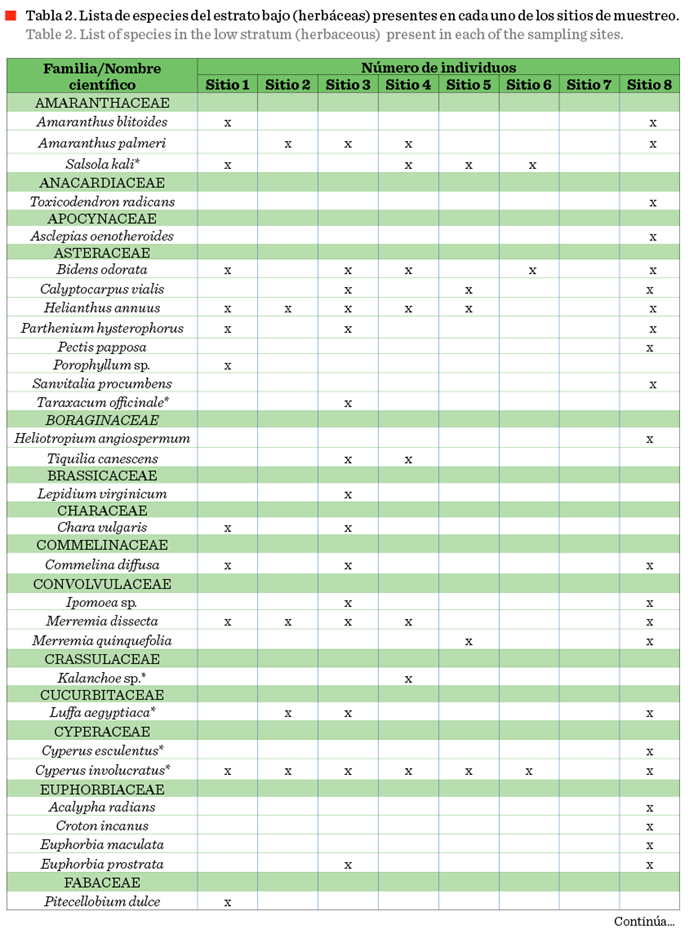
Se registraron 25 familias pertenecientes a 53 géneros y 60 especies (Tabla 2). Las especies que
se reportaron con mayor distribución, fueron Cyperus involucratus Rottb. 1806 y Phragmites australis Cav.
(Trin.) ex
Steud 1840 en 7 sitios cada una, Eragrostis mexicana (Hornem.) Link 1827, Helianthus annuus L. 1753, Melinis repens (Willd.)
Zizka 1988, Polygonum pensylvanicum
L.
1753 y Typha domingensis Pers. 1807 en 6 sitios cada
una. Mientras
que 26 de las especies registradas solo se presentaron en un sitio. Del total
de las especies reportadas 10 son introducidas, entre las cuales, Cyperus involucratus y Melinis repens cuentan con presencia en la mayoría de los
sitios de muestreo.
Variación de
la composición
Estrato alto
El dendrograma de similitud Bray-Curtis
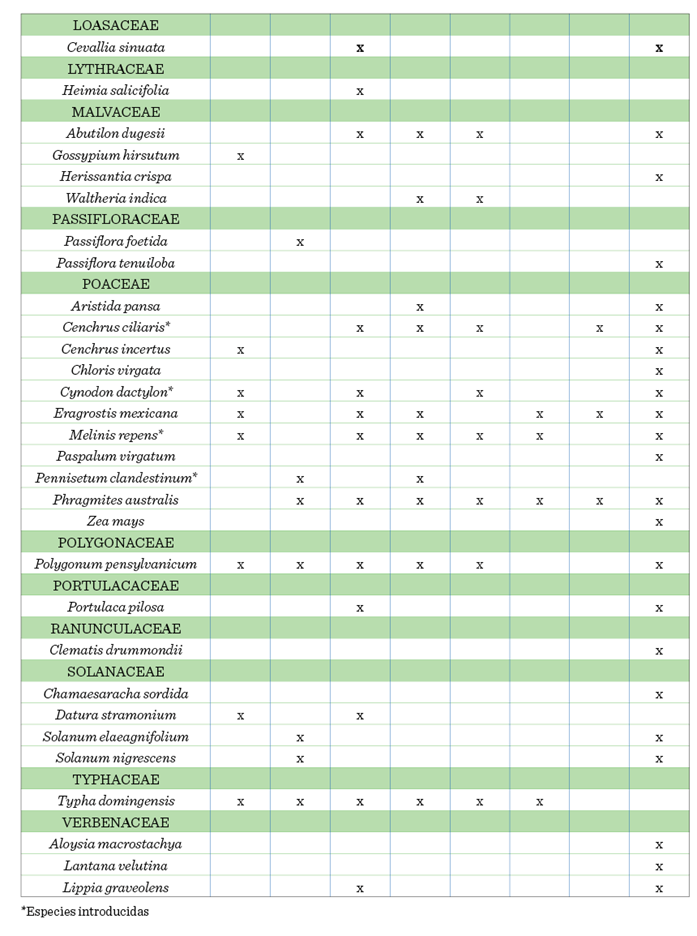
(Figura 2) muestra que el primer grupo que se forma es el que diferencia a los
sitios 4 y 8 del resto de la comunidad, esto debido al gran número de
individuos de las especies Salix nigra con 711 N/ha y 677 N/ha, Ricinus communis con 498 N/ha y 732 N/ha y Parkisonia aculeata con 269 N/ha y 437 N/ha, respectivamente, así como de otras
cantidades similares, pero con menor abundancia. El segundo grupo está
conformado únicamente por el sitio 7, debido a la baja presencia de Salix nigra (15 N/ha). El tercer grupo (conformado
por los sitios 1, 2, 3, 5 y 6) presenta
intermedia presencia de Salix nigra (≥
107 N/ha y ≤ 214
N/ha). Es importante mencionar que los 3 grupos presentan una similitud de
intermedia a alta, debido a que la similitud
entre el grupo 2 y 3 es del 60 % y del
1con el resto es de 71.53 %.
Estrato bajo
Con base en
el dendrograma de similitud de Jaccard
(Figura 3), el sitio 7 se separa en cuanto a similitud de los demás, debido a
que fue el sitio que menor número de especies presentó. El siguiente grupo está
conformado por 4 sitios (2, 4, 5 y 6), los cuales comparten 3 especies en común
(Cyperus involucratus y Typha domingensis), siendo una de estas introducida (Cyperus involucratus). Los sitios 1, 3 y 8 conforman otro
grupo, en el cual destacan 9 especies compartidas (Bidens odorata Cav. 1791, Helianthus annuus, Commelina
diffusa Burm. 1768, Merremia dissecta (Jacq.) Hallier f. 1893, Cyperus involucratus, Cynodon
dactylon (L.) Pers. 1805, Eragrostis mexicana, Melinis repens y Polygonum pensylvanicum) siendo 3 introducidas (Cyperus involucratus, Cynodon
dactylon y Melinis repens). En general, la composición de la vegetación presenta una similitud de
baja a intermedia, debido a que en los sitios del grupo 3, es de un 23 % a 40
%, y en los sitios de los grupos 1 y 2, es de 18 % a 47 %.

Variación de la
abundancia
Estrato alto
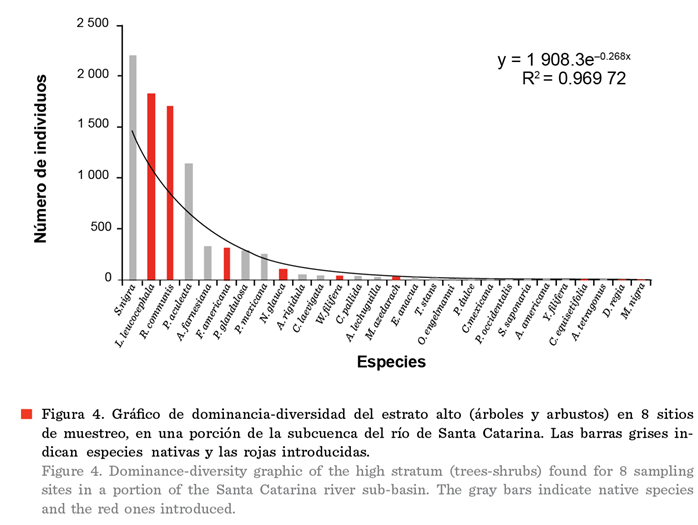
El gráfico de dominancia-diversidad (Figura 4), muestra una distribución
de modelo geométrico de tipo
discreta, en donde la comunidad vegetal ribereña
está conformada por escasas especies muy abundantes, y el resto de las especies
son prácticamente raras.
DISCUSIÓN
Variación de la riqueza
Estrato alto
La riqueza
florística presente en el área de estudio del río Santa Catarina (15 km lineales) se considera media, a pesar de la influencia antropogénica, ya que se registró la presencia de 28 especies en total, en diferentes estadios sucesionales.
En el estrato alto, se encontraron tanto especies nativas (19) (por
mencionar algunas, Celtis laevigata, Celtis
pallida, Populus mexicana Wesm.
ex DC. 1868) como
introducidas (9) (por citar algunas, Washingtonia filifera (Linden ex André) H. Wendl.
1879, Leucaena leucocephala, Morus nigra
y Fraxinus americana
L. 1753). En otras comunidades vegetales ribereñas mejor conservadas, como
Sabinas y San Rodrigo, en Coahuila, el estrato arbóreo tuvo una diversidad
similar (17 especies), aunque la mayoría de esas especies fueron nativas (Villarreal
y col., 2006). Sin embargo, en ríos también afectados por cambios de uso de suelo,
como el Ramos y Cabezones, en Nuevo León, la riqueza de árboles fue variable,
con 7 y 19 especies, respectivamente (Treviño y col., 2001). Una posible
explicación del por qué se registró un mayor número de especies en el presente
estudio en comparación a otros desarrollados en el noreste de México, es debido
a que en esta investigación se evaluó una comunidad vegetal en proceso de
regeneración natural, y al haber mayor espacio disponible después del disturbio
(Huracán Alex), existe la posibilidad de que se establezca un mayor número de especies (Alanís y col., 2011;
Graciano-Ávila y col., 2018).
La alta
presencia de individuos de Salix nigra, en el estrato
alto, para la comunidad vegetal ribereña del río Santa Catarina coincide con lo registrado por Treviño y col.
(2001), quienes la registraron como una de las más conspicuas en un estudio
realizado en el río Cabezones, Nuevo León, México. Por su parte, Íñiguez-Ayón y
col. (2015), reportaron esta especie en una evaluación del río Tamazula, en la
ciudad de Culiacán, Sinaloa, México. Dicha especie ha sido ampliamente evaluada,
se asocia a vegetación de galería, se reproduce
sexual y asexualmente, y se establece preferentemente en elevaciones
intermedia y altas al cause del agua, donde los eventos
de inundación son menos frecuentes (Stover y col. 2018), como en el caso de esta investigación.
La segunda
especie con mayor abundancia fue la introducida e invasora Leucaena leucocephala, la cual, se encuentra
en la lista de las 100
especies exóticas invasoras más dañinas del mundo (Lowe
y col. 2004). Si
bien,
México es considerado el centro de máxima diversidad del género Leucaena (Zárate, 1994), la especie L. leucocephala se distribuye de manera natural en el sur de
México (Peralta- Juárez y col., 2017), pero debido a su uso en actividades
pecuarias (Ledesma, 2002), se ha distribuido en todo el mundo, incluyendo el
noreste de México. Esta especie no ha sido documentada en comunidades ribereñas del noreste de México (Treviño
y col., 2001 y Canizalez y col., 2010), pero sí se tiene
registro de su uso en plantaciones experimentales (Jurado y col., 1998) y áreas
urbanas (Leal y col., 2018b). Es importante mencionar que la especie ha sido
reportada en ecosistemas ribereños por algunos autores, como Moreno-Jiménez y
col. (2017), que la registraron en un
afluente del río Tacotalpa, en Tabasco, México; y Peguero (2010) ha
reportado su presencia en vegetación riparia de la República Dominicana.
Otra
especie de interés en este estudio, por su abundancia, fue Ricinus communis, una especie introducida que,
comúnmente, se presenta en zonas ribereñas y
que muestra adaptación en canales permanentes de riego (Reveles y col., 2010).
Lo registrado en esta investigación coincide con Cornejo-Denman
y col. (2018), quienes reportaron a Parkinsonia aculeata como una de las
especies dominantes en un estudio de la vegetación riparia
presente en la sección baja del río Bravo, entre México y Estados Unidos. De
hecho, en otros países, como Australia, Parkinsonia aculeata forma poblaciones tan densas a lo largo de ríos, que
causa serios problemas para el uso
del agua (Cochard y Jacques, 2005).
De las cuatro especies con mayor presencia en el estrato alto, Garcillán y Rebman (2016), registraron a Ricinus communis como una especie exótica de origen
africano que se ha adaptado a las condiciones de los ecosistemas de México, y
mencionaron que esta especie suele estar presente en zonas con disturbio
antrópico o natural, como bordes de caminos, asentamientos humanos y zonas riparias. Muller (1947) y Rzedowski, y Calderón-de-Rzedowski
(1997), reportaron a Parkinsonia aculeata como una especie que se distribuye de
forma nativa en el matorral espinoso tamaulipeco.
Treviño y
col. (2001); Canizales y col. (2010), realizaron
estudios de diversidad y estructura de comunidades ribereñas maduras en el
noreste de México, donde registraron a Taxodium mucronatum Ten. 1853 como una de las especies mayormente
presentes, con altos valores de abundancia y dominancia, lo cual difiere con lo
reportado en la presente investigación, ya que en el área de estudio no fue
observada esta especie. Otra especie que presenta altos valores de abundancia
(470 N/ha) en comunidades maduras es Platanus occidentalis L. 1753 (Canizales
y col., 2010), mientras en este estudio, fue escasamente registrada, con 8
N/ha. Las especies antes mencionadas son esciófilas, ya que necesitan
condiciones de sombra para germinar y desarrollarse en las primeras
faces, y después de cierto tiempo, necesitan mayor intensidad de luz
(Enríquez-Peña y col., 2004), por lo tanto, podrían considerarse indicadoras de
que la comunidad vegetal observada no presenta un grado de madurez avanzado y se
encuentra en las primeras fases de estado sucesional.
Estrato bajo
La presente
investigación, a diferencia de Treviño y col. (2001); Rzedowski
(2006), de Canizales y col. (2010) y de
Santiago-Pérez y col. (2014), incluyó
el estrato bajo, el cual está conformado por 60 especies. Se consideró importante
evaluar este estrato, debido a que se ha reportado que presenta alta riqueza de
especies comparado con la comunidad arbórea y arbustiva (Pérez-Calix, 1996; Villarreal y col., 2006). Como se mencionó en
la metodología, la vegetación del estrato bajo consistió en evaluar las
herbáceas que van de los 0.30 m hasta los 1.99 m de altura, las cuales no han
sido consideradas en los estudios desarrollados en
México.
Rzedowski
(2006) mencionó en su clasificación de la vegetación acuática y subacuática,
que existen comunidades de tular y carrizal, las
cuales presentan una distribución cosmopolita,
y cuyas asociaciones principales están
dominadas por Typha spp.
y Cyperus spp. En el área de estudio se registraron en
la mayoría de los sitios de muestreo Cyperus involucratus y Typha domingensis.
Las especies Cyperus involucratus y Melinis repens se encuentran
reportadas como especies introducidas en México (Mora-Olivo y Villaseñor, 2007;
SAGARPA, 2016). En diversos estudios, como los de McCoy-Sulentic
y col. (2017) y Wassens y col. (2017), se ha demostrado los efectos que las
especies introducidas provocan al ambiente en el que se desarrollan, uno de los
principales, es que son responsables de gran número de extinciones. March-Mifsut y Martínez (2007), registraron en su estudio
que M.
repens es una especie que desplaza a la vegetación
nativa y promueve regímenes anómalos de fuego, por lo que es importante
realizar más estudios en el noreste de México para
conocer la situación de estas especies en el área, y tomar las medidas que sean pertinentes para
el control de las mismas.
Variación de la
composición
Estrato alto
La
diversidad beta presente en el estrato alto es de intermedia a alta, lo cual
coincide con los resultados presentados por Canizales y col. (2010), quienes registraron una diversidad
media alta en las áreas estudiadas en una comunidad ribereña en el noreste de
México. La alta abundancia de las especies Salix nigra y Leucaena leucocephala es el factor
principal de la agrupación de los sitios. La especie Salix nigra ha sido registrada
con alta presencia en vegetación ribereña del noreste de México (Treviño y col., 2001),
caso contario a la introducida e invasora Leucaena leucocephala, que no ha sido reportada
en el noreste de México, pero sí con escasa abundancia en vegetación
ribereña del sureste de México (Moreno-Jiménez
y col., 2017).
Estrato
bajo
La
diversidad beta es de baja a intermedia. Gärtner y col. (2015), registraron valores similares en su estudio de patrones
compositivos para herbáceas. Del total de las especies reportadas, 10 son
introducidas, entre las cuales, Cyperus involucratus y Melinis repens cuentan con presencia en la mayoría de los sitios
de muestreo. Espinosa-García y col.
(2004), mencionaron que existe una relación
positiva entre el tamaño de la población o el disturbio causado por la
actividad humana con el número de especies exóticas presentes. Dado que el río
Santa Catarina se encuentra inmerso en la mancha urbana, se esperaría que se presenten especies introducidas,
como ya ha sido documentado en otras áreas
urbanas (Aronson y col., 2017; Grella y col., 2018). El porcentaje
de especies exóticas o introducida fue de 16.66 %, valor menor a lo reportado por Aronson y col. (2017), quienes registraron 55 % y 41
% en 2 ríos urbanos de Nueva Jersey, Estados
Unidos.
Variación
de la estructura
Estrato
alto
Los
resultados mostraron una distribución de modelo geométrico de tipo discreta, en
donde la comunidad vegetal ribereña está conformada por escasas especies muy
abundantes, el resto de las especies son prácticamente raras. El modelo supone
que las especies difieren marcadamente en su dominancia competitiva, de manera
que las especies más abundantes ocupan una fracción grande del nicho y las
demás especies se distribuyen en los espacios restantes. Este patrón suele
observarse en estadios tempranos de una sucesión o en ambientes desfavorables (Martella y col., 2012). Dicho patrón ha sido documentado en
comunidades vegetales regeneradas después de actividades pecuarias (Leal y
col., 2018a) y mineras (Marroquín-Castillo
y col., 2016). En el caso de esta investigación, la comunidad vegetal
ribereña se encuentra en una fase de regeneración natural, donde no se han
realizado prácticas de restauración ecológica y aún no llega a ser una comunidad vegetal madura.
CONCLUSIONES
Se concluye
que la variación de la vegetación del estrato alto, presenta similitud de
intermedia a alta, debido a la alta abundancia de individuos de las especies Salix nigra y Leucaena
leucocephala. La vegetación del estrato bajo, presenta una
similitud de baja a intermedia, toda vez que existen escasas especies en común
en el trayecto evaluado. La composición de la vegetación se encuentra en un
estado sucesional secundario, debido a que algunas de
las especies con mayor presencia son introducidas, como Leucaena leucocephala y Ricinus communis para el estrato alto, y Cyperus involuratus y Melinis repens
para el estrato bajo.
ReferencIAs
Alanís,
E., Jiménez, J., Valdecantos, A., Pando, M., Aguirre,
O. y Treviño, E. J. (2011). Caracterización de regeneración leñosa
post-incendio de un ecosistema templado del Parque Ecológico Chipinque, México. Chapingo serie
Ciencias Forestales y del Ambiente. 17(1):
31-39.
Aronson, M. F., Patel,
M. V., O’Neill, K. M., and Ehrenfeld, J. G. (2017). Urban riparian systems function as corridors for both
native and invasive plant species. Biological Invasions.
19(12): 3645-3657.
Burton, M. L., Samuelson, L. J., and Pan, S. (2005).
Riparian woody plant diversity and forest structure along an urban-rural
gradient. Urban Ecosystems. 8(1): 93-106.
Brower, J. E., Zar, J. H.,
and Von-Ende, C. N. (1998). General Ecology.
Boston, MA. Estados Unidos: McGraw-Hill. 273 Pp.
Bozóki, T., Krasznai-Kun, E. A., Csercsa, A.,
Várbíró, G., and Boda, P. (2018). Temporal
and spatial dynamics in aquatic macroinvertebrate communities along a small urban
stream. Environmental Earth Sciences. 77(559): 1-10.
Canizales, P. A., Alanís, G. J., Lara, S.,
Torres, M., Alanís, E., Jiménez, J. y Padilla, H. (2010). Efecto de la
actividad turística en la diversidad y estructura del bosque de
galería en el noreste de México. Ciencia UANL. 13(1): 55-63.
Cochard, R. and Jackes, B. R.
(2005). Seed ecology of the invasive tropical tree Parkinsonia aculeata. Plant Ecology. 180(1): 13-31.
Correll, D. S. and M. C. Johnston. (1970). Manual of the Vascular Plants of Texas. College Station, TX. Estados Unidos: Texas Research Foundation. 1881 Pp.
Croke, J., Thompson, C., and Fryirs,
K. (2017). Prioritising the placement of riparian
vegetation to reduce flood risk and end-of-catchment sediment yields: Important
considerations in hydrologically-variable
regions. Journal of Environmental Management. 190: 9-19.
Dahmer, S. C., Matos, L., and Morley, A. (2018).
Preface—Restoring Toronto’s waters: Progress toward delisting the Toronto and
Region Area of Concern. Aquatic Ecosystem Health & Management. 21(3): 223-229.
Enríquez-Peña, E. G., Suzán-Azpiri,
H. y Malda-Barrera, G. (2004). Viabilidad
y germinación de semillas de Taxodium
mucronatum (Ten.) en el estado
de Querétaro, México. Agrociencia.
38(3): 375-381.
Espinosa-García,
F. J., Villaseñor, J. L., and Vibrans, H. (2004). The rich generally get richer, but there are
exceptions: Correlations between species richness of native plant species and
alien weeds in Mexico. Diversity and Distributions. 10(5-6): 399-407.
FAO, Food and Agriculture Organization of the United
Nations (2015). Base referencial mundial del recurso suelo 2014,
Actualización 2015. Sistema internacional de clasificación de suelos para la
nomenclatura de suelos y la creación de leyendas de mapas de suelos. Informes
sobre recursos mundiales de suelos 106. Roma: IUSS Working
Group WRB. 205 Pp.
García,
E. (1964). Clasificación Climática Köppen,
Modificada por Enriqueta García. México: Universidad Nacional Autónoma
de México. 90 Pp.
Garcillán, P. P. y Rebman,
J. P. (2016). Nota sobre los primeros registros históricos de dos plantas invasoras
en la península de Baja California: crónica del misionero jesuita Miguel del
Barco. Acta
Botánica Mexicana. (115): 43-49.
Gärtner, E., Rojas, G., and Castro, S.
(2015). Compositional patterns of ruderal
herbs in Santiago, Chile. Gayana Botanica.
72(2): 192-202.
Graciano-Ávila,
G., Alanís-Rodríguez, E., Aguirre-Calderón, Ó. A.,
Rubio-Camacho, E. A. y González-Tagle, M. A. (2018). Estructura y diversidad postincendio en un área del matorral espinoso tamaulipeco. Polibotánica. 45: 89-100.
Grella, C., Renshaw, A., and Wright,
I. A. (2018). Invasive weeds in urban riparian zones: the influence of catchment
imperviousness and soil chemistry across an urbanization gradient. Urban Ecosystems.
21(3): 505-517.
Guida-Johnson, B., Faggi, A. M.,
and Zuleta, G. A. (2017). Effects of Urban Sprawl on Riparian Vegetation: Is Compact or
Dispersed Urbanization Better -for Biodiversity?
River Research and Applications. 33(6): 959-969.
Hammer,
Ø., Harper, D. A. T., and Ryan, P. D. (2001). PAST: Paleontological Statistics Software Package for
Education and Data Analysis. Palaeontologia
Electronica. 4(1): 9.
Íñiguez-Ayón,
Y. P., Peña-Salmón, C. Á. y Sicairos-Avitia, S. E. (2015). Ecosistema fluvial
urbano: evaluación ecológica y visual del río Tamazula en la ciudad de
Culiacán, Sinaloa. Quivera.
17(1):75-97.
Jurado,
E., Flores, J., Navar, J., and Jiménez, J. (1998). Seedling establishment under native tamaulipan thornscrub and Leucaena leucocephala plantation. Forest Ecology and Management. 105(1-3): 151-157.
Leal, N. A, Alanís, E., Mata, J. M., Treviño,
E. J. y Yerena, J. I. (2018a). Composición
y diversidad del matorral espinoso tamaulipeco regenerado post-ganadería en el noreste
de México. Polibotánica. 45:
75-88.
Leal, C. E., Leal, N.,
Alanís, E., Pequeño, M. A., Mora-Olivo, A. y Buendía, E. (2018b). Estructura,
composición y diversidad del arbolado urbano de Linares, Nuevo León. Revista Mexicana de
Ciencias Forestales. 9(48): 252-270.
Ledesma,
L. M. (2002). El silvopastoreo: una alternativa de
producción que disminuye el impacto ambiental de la ganadería bovina. Revista
Colombiana de Ciencias Pecuarias. 15(2): 226-231.
Lonard, R. I. and Judd,
F. W. (2002). Riparian vegetation of the lower
Rio Grande. The Southwestern Naturalist. 47(3):
420-432.
Lowe, S., Browne M., Boudjelas
S. y De-Poorter M. (2004). 100 de las Especies Exóticas Invasoras más
dañinas del mundo. Una selección del Global Invasive Species Database. Publicado por el Grupo Especialista de Especies
Invasoras (GEEI), un grupo especialista de la Comisión de Supervivencia de
Especies (CSE) de la Unión Mundial para la Naturaleza (UICN) Nueva Zelanda, 12
Pp.
Magurran, A. (1988). Ecological
diversity and its measurement. New Jersey: Princeton
University Press. 179
Pp.
March-Mifsut, I. J. and
Martínez, J. R. (2007). Especies invasoras de alto impacto a la
biodiversidad, prioridades en México. México: IMTA, Conabio,
GECI, AridAmérica. The Nature Conservancy. 72
Pp.
Marroquín-Castillo,
J. J., Alanís-Rodríguez, E., Jiménez-Pérez, J., Aguirre-Calderón, O. A.,
Mata-Balderas, J. M. y Chávez-Costa, A. C. (2016). Composición florística y
diversidad de un área restaurada post-minería en el matorral espinoso
tamaulipeco. Polibotánica. 42:
1-17.
Martella, M., Trumper,
E., Bellis, L., Renison,
D., Giordano, P., Bazzano, G. y Gleiser,
R. (2012). Manual de Ecología: Evaluación de la biodiversidad. Reduca (Biología). Serie Ecología. 5(1): 71-115.
McAleece, N., Lambshead, P. J. D., Paterson, G. L. J., and
Gage, J. D. (1997). Natural History Museum and Scottish Association for Marine
Science, in Biodiversity Professional (V.2.0). [En línea]. Disponible en: http://biodiversity-pro.software.informer.com. Fecha de consulta: 25 de mayo de 2018.
McCoy-Sulentic, M. E., Kolb,
T. E., Merritt, D. M., Palmquist, E., and Ralston, B. E. (2017). Changes in
Community-Level Riparian Plant Traits over Inundation Gradients, Colorado
River, Grand Canyon. Wetlands. 37(4): 635-646.
McLeod, K. W. and McPherson, J. K. (1973). Factors
limiting the distribution of Salix nigra. Bulletin
of the Torrey Botanical Club.
102-110.
Molina-Guerra,
V. M., Mora-Olivo, A., Alanís-Rodríguez, E., Soto-Mata, B., Patiño-Flores, A.
M. 2019. Plantas características del matorral espinoso tamaulipeco en México.
Editorial Universitaria de la Universidad Autónoma de Nuevo León. Monterrey,
México. 114 Pp.
Mora-Olivo,
A. and Villaseñor, J. L. (2007). Diversidad y distribución de la flora vascular
acuática de Tamaulipas, México. Journal
of the Botanical Research Institute of Texas. 1(1): 511-527.
Moreno-Jiménez,
V., Castillo-Acosta, O., Gama-Campillo, L., Zavala-Cruz, J. y Ortiz-Pérez, M.
A. (2017). Relación de vegetación ribereña y propiedades del suelo
en un afluente del río Tacotalpa, Tabasco, México. Madera y Bosques. 23(1): 91-109.
Muller, C. (1947). Vegetation and climate in Coahuila,
México. Madroño. 9: 33-57.
Paolino, R. M., Royle, J. A., Versiani, N. F.,
Rodrigues T. F., Pasqualotto, N., Krepschi,
V. G., and Chiarello, A. G. (2018) Importance of
riparian forest corridors for the ocelot in agricultural landscapes. Journal of Mammalogy. 99(4): 874-884.
Pedroche,
S. Z. (1994). Revisión del género Leucaena
en México (parte C). Anales del Instituto
de Biología. Serie Botánica.
65(2): 83-162.
Peguero,
B. (2010). Composición y Estructura de la Vegetación en la Franja de
la Línea de Transmisión Sub-estación Pizarrete Los
Montones. Santo Domingo, D.
N., República Dominicana. [En línea]. Disponible en: https://www.eib.org/attachments/pipeline/20070230_eia8_es.pdf.
Fecha de consulta: 24 de junio de 2018.
Pennington, D. N., Hansel, J. R., and Gorchov, D. L. (2010). Urbanization and riparian forest woody communities: diversity, composition, and structure
within a metropolitan landscape. Biological
Conservation. 143(1): 182-194.
Peralta-Juárez,
I., Gómez-Campos, A., Romero-Castillo, P. A., and Reyes-Dorantes, A. (2017).
Uso antropocéntrico del guaje Leucaena
esculenta (Moc. & Sessé ex. Dc.) Benth, en dos comunidades de
la mixteca baja oaxaqueña, México. Polibotánica.
(43): 349-364.
Pérez–Calix, E. (1996). Flora y vegetación
de la cuenca del lago de Zirahuén,
Michoacán, México. Flora del Bajío
y de Regiones Adyacentes. Fascículo complementario XIII.
Pátzcuaro, Michoacán: Instituto de Ecología. 73 Pp.
Periódico
Oficial del Gobierno Constitucional del Estado Libre y Soberano de Nuevo León
(2008). Decreto por el cual se declara como “Área Natural Protegida Estatal, en
categoría de “Parque Urbano”, bajo la denominación de “Parque Lineal” el cauce
del río Santa Catarina, localizado en los municipios de Monterrey, San Pedro
Garza García, Guadalupe, Juárez y Santa Catarina, Nuevo León, supeditada la
vigencia a los términos de su Artículo Cuarto, y 2 Anexos (primera
publicación). [En línea]. Disponible en: http://www.nl.gob.mx/sites/default/files/d_plineal.pdf. Fecha
de consulta: 13 de abril de 2018.
PDUMM,
Plan de Desarrollo Urbano del Municipio de Monterrey 2013-2025 (2012). Plan de
Desarrollo Urbano del Municipio de Monterrey. [En línea]. Disponible en:
http://portal.monterrey.gob.mx/pdf/2013_2025.pdf.
Fecha de
consulta: 22 de febrero
de 2018.
Reveles,
F. O., Rosales, R., Nava, C. A., Delgado, E., Cuéllar, E. I., Carrete, F. Ó. y Ríos, J. C. (2010). Identificación de especies vegetales
con potencial para la producción de biocombustibles líquidos en Durango,
México. Revista
Mexicana de Ciencias Agrícolas.
1(1): 45-54.
Rzedowski, J. (2006). Vegetación de México.
Primera edición digital. [En línea]. Disponible en:
https://www.biodiversidad.gob.mx/publicaciones/librosDig/pdf/VegetacionMx_Cont.pdf. Fecha
de consulta: 13 de abril de 2018.
Rzedowski, J. y Calderón-de-Rzedowski, G. (1997). Flora del Bajío y
zonas adyacentes. Fascículo 51. Familia Leguminosae.
Sub-familia Caesalpinioideae. Pátzcuaro,
Michoacán. México: Instituto de Ecología, A. C. Centro Regional
del Bajío. 57 Pp.
SAGARPA,
Secretaría de Medio Ambiente y Recursos Naturales (2016). Acuerdo
por el que se determina la Lista de las
Especies Exóticas Invasoras para México. Diario Oficial.
Tercera Sección. México, D.F. [En línea]. Disponible en:
http://www.dof.gob.mx/nota_detalle.php?codigo=5464456&fecha=07/12/2016.
Fecha de consulta: 6 de junio de 2018.
Santiago-Pérez,
A. L., Ayón, A., Rosas, V. C., Rodríguez, F. A. y Toledo, S. L. (2014).
Estructura del bosque templado de galería en la Sierra de Quila, Jalisco. Revista Mexicana de
Ciencias Forestales. 5(24): 144-159.
Stover, J., Keller,
E., Dudley, T., and Langendoen,
E. (2018). Fluvial geomorphology, root
distribution, and tensile strength of the invasive giant reed, Arundo donax and its role on stream bank stability in the Santa Clara
River, Southern California. Geosciences. 8(8): 304.
Treviño,
E. J., Cavazos, C. y Aguirre, O. A. (2001). Distribución y estructura de los
bosques de galería en dos ríos del centro sur de Nuevo León. Madera
y Bosques. 7(1): 13-25.
Villarreal, J. A., Carranza,
M. A., Estrada, E. y Rodríguez, A. (2006). Flora riparia
de los Ríos Sabinas y San Rodrigo, Coahuila, México. Acta Botanica Mexicana. 75: 1-20.
Villaseñor,
J. L. and Espinosa-García, F. J. (2004). The alien flowering plants of Mexico. Diversity and Distributions. 10(2): 113-123.
Wassens, S., Ning, N., Hardwick, L., Bino,
G., and Maguire, J. (2017). Long-term changes in freshwater aquatic plant
communities following extreme drought. Hydrobiologia. 779(1): 233-247.
Whittaker, R. H. (1972). Evolution and measurement of species diversity. Taxon.
21(2-3): 213-251.
Zárate,
S. (1994). Revisión del género Leucaena en
México. Anales
del Instituto de Biología. Serie Botánica. 65(2): 83-162.