¿Los
protocolos experimentales son un símil real de la diabetes humana?
Are
experimental protocols an authentic simile of human
diabetes?
María Luisa Moreno-Cortés1,
Ana G. Gutiérrez-García2*, Carlos M. Contreras2,3
*Correspondencia: angutierrez@uv.mx/Fecha
de recepción: 3 de mayo de
2019/Fecha de aceptación: 6 de septiembre de
2019/Fecha de
publicación: -
1Universidad Veracruzana, Instituto de Investigaciones Biológicas, Área
de Biomedicina, Xalapa, Veracruz, México. 2Universidad Veracruzana,
Instituto de Neuroetología, Laboratorio de Neurofarmacología, av. Dr. Luis Castelazo
s/n, col. Industrial Las ánimas, Xalapa, Veracruz, México, C. P. 91190. 3Universidad
Nacional Autónoma de México, Instituto
de Investigaciones Biomédicas, Unidad Periférica-Xalapa, Ciudad de México,
México.
Resumen
Para el
estudio de la diabetes se dispone de diversas estrategias metodológicas en modelos animales,
tales como, técnicas quirúrgicas, modificaciones
dietéticas, incluso manipulación genética y la administración de fármacos
específicos, por su toxicidad. En animales,
la diabetes experimental se logra con el uso de fármacos, como la aloxana o la estreptozotocina,
los cuales producen daño irreversible en las células![]() -pancreáticas, aunque causan una alta mortalidad, debido a la
cetosis asociada al daño agudo de estas
células pancreáticas. El objetivo de
este trabajo fue analizar los protocolos farmacológicos y otras
estrategias disponibles, para determinar si la diabetes experimental realmente
emula la diabetes humana. La diabetes es un proceso progresivo y crónico, en el
que la mayor parte de las alteraciones
clínicas son consecuencia, en el largo plazo, de alteraciones micro y macrovasculares. Por ello, es conveniente diferenciar entre
los efectos de una hiperglucemia aguda, con aquellos que se observan cuando la
hiperglucemia se prolonga a lo largo del tiempo, a fin de establecer analogías, entre el modelo experimental animal, con
el síndrome diabético humano, mediante datos
de laboratorio y de tipo clínico, de uso habitual en el diagnóstico
y manejo
de la diabetes
humana.
-pancreáticas, aunque causan una alta mortalidad, debido a la
cetosis asociada al daño agudo de estas
células pancreáticas. El objetivo de
este trabajo fue analizar los protocolos farmacológicos y otras
estrategias disponibles, para determinar si la diabetes experimental realmente
emula la diabetes humana. La diabetes es un proceso progresivo y crónico, en el
que la mayor parte de las alteraciones
clínicas son consecuencia, en el largo plazo, de alteraciones micro y macrovasculares. Por ello, es conveniente diferenciar entre
los efectos de una hiperglucemia aguda, con aquellos que se observan cuando la
hiperglucemia se prolonga a lo largo del tiempo, a fin de establecer analogías, entre el modelo experimental animal, con
el síndrome diabético humano, mediante datos
de laboratorio y de tipo clínico, de uso habitual en el diagnóstico
y manejo
de la diabetes
humana.
Palabras clave: modelos experimentales, diabetes, aloxana, estreptozotocina, hiperglucemia.
Abstract
For the study of
diabetes, several methodological strategies use animal models.
Such methodologies involve surgical techniques, diet modifications, some genetic manipulations and
specific toxic drugs. The experimental production of diabetes in animal models
use the administration of alloxan or streptozotocin
and these drugs produce irreversible damage
to pancreatic ![]() -cells.
However, its use is associated to a ketosis high mortality
rate due to the acute damage
of pancreatic cells. The aim of this review consisted in the analysis of the pharmacological diabetes production
protocols as well as other available strategies, in order to elucidate which is potentially the ideal protocol that emulates
human diabetes. Diabetes is a progressive
and chronic process, in which most of the clinical alterations
are a long-term consequence
of micro and macrovascular alterations. Therefore,
it is convenient
to establish a difference between the effects of acute hyperglycemia, with those effects
observable when hyperglycemia is present
over the long-term in order to reach enough analogies between the animal experimental model with the
human diabetes syndrome, through
the use of laboratory and clinical indicators commonly employed for the diagnoses and management
of human diabetes.
-cells.
However, its use is associated to a ketosis high mortality
rate due to the acute damage
of pancreatic cells. The aim of this review consisted in the analysis of the pharmacological diabetes production
protocols as well as other available strategies, in order to elucidate which is potentially the ideal protocol that emulates
human diabetes. Diabetes is a progressive
and chronic process, in which most of the clinical alterations
are a long-term consequence
of micro and macrovascular alterations. Therefore,
it is convenient
to establish a difference between the effects of acute hyperglycemia, with those effects
observable when hyperglycemia is present
over the long-term in order to reach enough analogies between the animal experimental model with the
human diabetes syndrome, through
the use of laboratory and clinical indicators commonly employed for the diagnoses and management
of human diabetes.
Keywords: experimental models, diabetes, allo-xan, streptozotocin, hyperglycemia.
Introducción
La diabetes es un grave problema de salud en el mundo, por su elevada morbilidad y mortalidad (Tancredi y col., 2015; Rawshani y col., 2018). Existen aún grandes incógnitas sobre los procesos fisiopatológicos involucrados en su desarrollo y sus consecuencias en el organismo, por lo que es necesario profundizar en su conocimiento, con la finalidad de lograr mejores estrategias para la prevención, la detección temprana y el tratamiento adecuado. El desarrollo de las alteraciones relacionadas con la diabetes tiene un curso temporal bien identificado. La Figura 1A representa la cronología de la diabetes en humanos.
Independientemente del tipo de diabetes que ocurra, en la etapa del desarrollo de la enfermedad (fase aguda) y en el largo plazo (fase crónica) los signos y síntomas son los mismos. En cambio, independientemente de los modelos experimentales que se empleen para producir diabetes, en modelos de animales de laboratorio (Figura 1B), la mayor parte de los estudios realizados, a la fecha, se concentran en la detección de los signos y síntomas de la fase aguda de la enfermedad. Son notablemente escasos los estudios sobre la fase crónica de la hiperglucemia, lo cual ilustra que la mayor parte del conocimiento experimental que se tiene sobre la diabetes, es claramente parcial.

En la actualidad se dispone de modelos experimentales (Harwood y col., 2012; Brito-Casillas y col., 2016), que asemejan algunas de las anormalidades metabólicas propias de la diabetes. Tales modelos incluyen algunas estrategias quirúrgicas actualizadas (Yu y col., 2015; Shivaswamy y col., 2016), dietas especiales (Castell-Auví y col., 2012; Lewis y col., 2019), productos naturales hipoglucemiantes (Necyk y col., 2017), modificaciones genéticas (Drel y col., 2006) y fármacos con toxicidad específica sobre el páncreas (Szkudelski, 2001). Uno de ellos, es la estreptozotocina. Su uso para producir diabetes experimental se inició a finales de la década de 1960 (Rerup, 1970). Otro es la aloxana que se descubrió a principios del siglo XIX, y se comenzó a emplear como modelo experimental de diabetes hacia 1940 (Dunn y col., 1943). Un hecho interesante es que, la estreptozotocina se emplea exitosamente en el manejo del cáncer de páncreas (Prakash y col., 2017; Karatas y col., 2018), y aún continúa el debate acerca de una comorbilidad de diabetes y cáncer, así como la posible potencia carcinogénica de ciertos medicamentos antidiabéticos (Wojciechowska y col., 2016).
La diabetes debe considerarse como un síndrome que afecta diversas y amplias regiones del organismo, tanto a nivel macro como microscópico que, como se ha demostrado recientemente, incluye al tejido neural, además de los bien conocidos efectos en otros órganos. Por ejemplo, el hipotálamo es una estructura cerebral que participa en el balance energético (Burbridge y col., 2016); y actualmente, se comienzan a identificar las rutas metabólicas afectadas por la presencia de obesidad y resistencia a la insulina, que producen inflamación hipotalámica (Benomar y Taouis, 2019), lo que puede ocasionar, por otras vías metabólicas, resistencia hipotalámica a la insulina (Ono, 2019). El proceso de resistencia a la insulina abarca otras áreas del cerebro, como el hipocampo, lo que podría explicar algunas alteraciones cognitivas en la diabetes (Grillo y col., 2015; Grillo y col., 2019; Soto y col., 2019), aunado al hecho de que, la deficiencia de glucosa, en el medio neuronal intracelular, es un factor relevante para producir daño neuronal en la diabetes (Contreras y Gutiérrez-García, 2017).
A pesar de que existen modelos experimentales de diabetes, se tienen dudas de si efectivamente se trata de símiles de la enfermedad en el humano.
El objetivo de este trabajo fue revisar los protocolos de diabetes experimental, para establecer si se dispone de un protocolo ideal que emule la diabetes humana.
Técnicas quirúrgicas
La
primera aproximación para producir diabetes experimental fue la quirúrgica, la
cual, consistía en la ligadura de los ductos pancreáticos
o la remoción parcial o total del páncreas. Esta técnica fue empleada desde 1880, cuando el páncreas fue extraído a un perro,
mismo que desarrolló poliuria y polidipsia, dos de los síntomas patognomónicos
de la diabetes (Minkowski y Bretzel,
2002). Este procedimiento fue empleado por más de un siglo, aunque poco a poco
se ha ido sustituyendo por el uso de fármacos con toxicidad selectiva por las
células pancreáticas y usando roedores, lo que permite el uso racional y ético
de modelos animales (Radenković y col., 2016) para el
estudio experimental de la
diabetes.
Modelos dietéticos
Existe consenso en la idea de que el desarrollo del síndrome metabólico (que incluye a la diabetes) está asociado, ampliamente, a malos hábitos de vida (Park y col., 2003). En efecto, hacia fines del siglo pasado, se demostró que, los niveles altos de grasas y azúcares en la dieta pueden contribuir al desarrollo, tanto de resistencia a la insulina, como de obesidad en la rata; muy pronto se encontraron semejanzas con la llamada dieta de cafetería (Buyukdere y col., 2019; Lewis y col., 2019), la cual consta de comida paladeable, como papas fritas, chocolates, galletas, mantequilla de maní y muchos otros alimentos con contenido calórico alto (Chen y col., 2014). La dieta de cafetería pareciera ser una estrategia adecuada para estudiar el desarrollo de obesidad y alguna relación con la diabetes. Efectivamente, los roedores normalmente prefieren dietas de tipo cafetería (Gómez-Smith y col., 2016) en lugar de la comida estándar. Esta dieta suele producir hiperfagia espontánea en los roedores, los cuales llegan a aumentar su ingesta hasta en un 80 % (Heyne y col., 2009).
Los
animales obesos suelen ser empleados para simular la compleja patogénesis de la
diabetes (Daryabor y col., 2019). No obstante, queda la
duda si en el corto plazo, la obesidad,
aunada a la resistencia a la insulina, realmente representa una
aproximación a la diabetes clínica, o bien, si simplemente es una característica
más de la obesidad (Saltiel y Olefsky,
2017). Es cierto que la obesidad se considera como factor de riesgo para el
desarrollo de diabetes (Wells, 2019). Sin embargo, puede suponerse que, al menos
en algunos casos, esa propensión a la obesidad, más que un factor de riesgo, es
un síntoma temprano de la enfermedad (Boles y col., 2017; Saltiel
y Olefsky, 2017); en efecto, la secuencia de
desnutrición, en etapas tempranas de la vida, seguida de obesidad, se asocia a
un mayor riesgo de desarrollo de diabetes más adelante (Stein
y col., 2019).
En la diabetes, la obesidad es uno de los datos prodrómicos, mientras que ante la expresión de la enfermedad, el dato típico es la baja de peso, como consecuencia de una desviación del uso metabólico hacia los lípidos, ante la carencia de glucosa intracelular como fuente primaria del aporte calórico (Kahn y col., 2006), lo que conlleva el riesgo de la cetoacidosis. La obesidad por sí misma es causa de diversas alteraciones (Flores y col., 2019), que ameritan ser estudiadas, tomando en cuenta que, un modelo de obesidad se asemeja más al periodo previo a la expresión de la diabetes (Barbour, 2019; Spurr y col., 2019; Waernbaum y col., 2019) que a la diabetes en sí.
De cualquier manera, estos modelos basados en obesidad adquieren relevancia si se consultan datos estadísticos acerca de la misma. En la ciudad de México, la obesidad adulta aumentó del 16 % de la población, en el año 2000, al 26 % en 2012. Ese mismo año, el 35 % de los niños de la ciudad, de 5 a 11 años, eran obesos o con sobrepeso. De hecho, 7 de cada 10 mexicanos están en sobrepeso, y un tercio de ellos ya caen en la categoría de obesidad (Chan, 2017). Pero aún es difícil hacer alguna predicción acerca del futuro del grupo que presenta obesidad, ya que hacen falta estudios de tipo longitudinal sobre estas poblaciones. Aunque la obesidad, junto con la inactividad, siguen siendo consideradas como factores de riesgo para el desarrollo de diabetes (Geiss y col., 2017), al parecer no todo obeso será diabético en un futuro (Tamas y col., 2018; Mtintsilana y col., 2019; Okamura y col., 2019), lo cual da algunas limitaciones al modelo de obesidad. En todo caso, estos modelos pueden ser útiles para estudiar el periodo prodrómico del síndrome diabético, lo cual es interesante, ya que podría ayudar a encontrar alternativas de diagnóstico temprano y de manejo terapéutico oportuno, antes del desarrollo pleno de la sintomatología diabética y, desde luego, sus complicaciones.
Manipulación genética
En la actualidad, con el avance en el conocimiento de las bases moleculares de las enfermedades, se dispone de organismos genéticamente modificados, generalmente roedores (Brito-Casillas y col., 2016) predispuestos a desarrollar la enfermedad de manera relativamente controlada. Se cuenta ya con modelos genéticos de resistencia a la insulina (Sah y col., 2016). En el caso de la diabetes, se lograron mutaciones de un solo gen, que dan lugar a cepas con predisposición genética a desarrollar resistencia a la insulina y/o sensibilidad a la misma. Entre los modelos manipulados genéticamente de diabetes tipo 1 o tipo 2, se encuentra el ratón hipoinsulinémico diabético no obeso (NOD, por sus siglas en inglés: Non-Obese Diabetic Mouse), el ratón KKAy, el ratón obeso Nueva Zelanda y el ratón mutante homocigoto ob/ob y db/db (Staats, 1975; Al-Awar y col., 2016), por mencionar algunos.
Entre los modelos genéticos, el ratón NOD, es reconocido por desarrollar diabetes tipo 1 de entre el 83 % y 90 % de los machos y hembras, respectivamente (Hugés-Hernandorena y col., 2002), a escasas 3 semanas de nacidos (Carrero y col., 2017). Es de notar que en primer lugar no todos estos roedores desarrollan diabetes, y que existe dimorfismo sexual. Este modelo tiene un marcado fondo poligénico, y en su genoma existen más de 17 locus, sobre al menos 5 cromosomas diferentes, lo que constituye el mayor factor genético de diabetes tipo 1 ubicado en el cromosoma 17.18 humano (Hugés-Hernandorena y col., 2002). De manera semejante, la rata BB desarrolla diabetes tipo 1 y cetoacidosis entre los 50 d y 90 d de edad, en proporción semejante entre hembras y machos, mediado por alteraciones del complejo mayor de histocompatibilidad y linfopenia T (Acharjee y col., 2013). Es de destacar que estos son eventos reconocidos como críticos en el riesgo autoinmune en el humano, de particular interés en la diabetes tipo 1. Conviene reflexionar en que los aspectos epigenéticos quedan lejos de ser tomados en cuenta en estos modelos.
Dentro de
los modelos de diabetes tipo 2, se encuentran los ratones db/db, caracterizados
por resistencia a la leptina,
hiperinsulinemia y resistencia a la insulina,
evidentes a escasos 10 d a 12 d de edad. En ellos, existe una mutación
autosómica recesiva, que altera las células ![]() -pancreáticas.
Esta cepa desarrolla, a la larga, hiperglucemia, cambios de su peso corporal y
depleción de los niveles de insulina de manera gradual, tal como ocurre en el
síndrome diabético humano (Fu y col., 2013; Liljedahl
y col., 2017). Este modelo de ratón diabético db/db, posee una mutación en el receptor de leptina, que da lugar a hiperfagia,
obesidad, hiperleptinemia, hiperinsulinemia e infertilidad (Sharma
y col., 2003). El gen db/db
y otros, son autosómicos recesivos, en consecuencia, sólo una parte de los
ratones con esta característica va a desarrollar el símil completo de la
diabetes. Además, entre ellos hay una alta mortalidad debida a la cetosis, y
requieren ser protegidos con la administración de insulina, para lograr una supervivencia
acorde al protocolo del estudio (Srinivasan y Ramarao, 2007). Es de notar, además, un aspecto relevante,
que consiste en que la diabetes tipo 1 se caracteriza por una baja
disponibilidad de insulina. Entonces, este modelo es lo opuesto a la diabetes
clínica, además de que otros síntomas y signos presentes, carecen de conexión alguna con la enfermedad, sugiriendo que
la mutación de un solo gen produce una multitud de
alteraciones.
-pancreáticas.
Esta cepa desarrolla, a la larga, hiperglucemia, cambios de su peso corporal y
depleción de los niveles de insulina de manera gradual, tal como ocurre en el
síndrome diabético humano (Fu y col., 2013; Liljedahl
y col., 2017). Este modelo de ratón diabético db/db, posee una mutación en el receptor de leptina, que da lugar a hiperfagia,
obesidad, hiperleptinemia, hiperinsulinemia e infertilidad (Sharma
y col., 2003). El gen db/db
y otros, son autosómicos recesivos, en consecuencia, sólo una parte de los
ratones con esta característica va a desarrollar el símil completo de la
diabetes. Además, entre ellos hay una alta mortalidad debida a la cetosis, y
requieren ser protegidos con la administración de insulina, para lograr una supervivencia
acorde al protocolo del estudio (Srinivasan y Ramarao, 2007). Es de notar, además, un aspecto relevante,
que consiste en que la diabetes tipo 1 se caracteriza por una baja
disponibilidad de insulina. Entonces, este modelo es lo opuesto a la diabetes
clínica, además de que otros síntomas y signos presentes, carecen de conexión alguna con la enfermedad, sugiriendo que
la mutación de un solo gen produce una multitud de
alteraciones.
El gen denominado ob, en condiciones normales, codifica para la síntesis de leptina, la cual es secretada por los adipocitos, que son los responsables de almacenar los triglicéridos. Debido a una mutación genética, los adipocitos de un ratón ob no producen leptina, por lo cual, estos roedores experimentan efectos significativos, tanto sobre su metabolismo, como sobre su consumo de alimentos y desarrollan obesidad, aunque notablemente, la incidencia de diabetes es baja entre ellos (Arias-Díaz y Balibrea, 2007). Es de resaltar que los ratones homocigotos, con deficiencia de leptina ob/ob, desarrollan una diabetes tipo 2, que lleva a las características clínicas y especialmente histológicas, que definen la lesión renal diabética del humano. Por tanto, el estudio de los ratones ob/ob puede ayudar a identificar nuevos factores clave en la patogénesis molecular de la nefropatía diabética (Chittka y col., 2018).
Otro modelo basado en manipulación genética es el ratón obeso Nueva Zelanda (Igel y col., 1997), el cual tiene alteraciones en el transporte de leptina. Es un modelo que exhibe hiperfagia, hiperinsulinemia, alteraciones de la tolerancia a la glucosa y resistencia a la insulina. La característica típica del modelo Nueva Zelanda es la obesidad. Es considerado un caso de mutación espontánea, aunque el receptor de leptina polimórfico parece desempeñar solo un papel menor, si es que tiene alguno, en la obesidad y la hiperleptinemia de este modelo. Se trata de una alteración de un gen, lo que genera obesidad masiva, que no necesariamente remeda la diabetes tipo 2 del humano. Puede ser útil para estudiar un factor de riesgo o quizá un signo prodrómico, pero nada más.
Los
modelos genéticos, previamente citados, figuran como
estrategias efectivas para el desarrollo de la diabetes tipo 1 o 2; no obstante, hay que tener en cuenta que cualquier
mutación genética produce múltiples alteraciones. Por ejemplo, algunos de estos
modelos también son empleados para explorar alteraciones
de memoria (Winocur y col., 2005) y trastornos alimenticios, como la anorexia (Gutiérrez
y col., 2002; Churruca y col., 2008), en cuyo caso es
difícil establecer el objetivo del estudio, ya que bien pudiera ser el
desarrollo de diabetes y algunas de sus consecuencias metabólicas, pero al
mismo tiempo, la obesidad por sí misma. Además, es de destacar el elevado costo que conlleva el manejo y
mantenimiento de estos modelos (Al-Awar y col., 2016) y otros inconvenientes, comunes
a diversos modelos experimentales de diabetes (Srinivasan
y Ramarao,
2007).
Métodos
farmacológicos
La producción de diabetes
experimental en la rata, usando fármacos que destruyen selectivamente las
células β-pancreáticas, resulta relativamente conveniente y fácil de usar.
Tales fármacos, con toxicidad selectiva, son la aloxana
y la estreptozotocina (Szkudelski,
2001; Kaur y col.,
2014). La aloxana (2, 4, 5,
6-tetra-oxipirimidina; 5, 6-dioxiuracilo), suele administrarse por vía
intravenosa, intraperitoneal o subcutánea. Se absorbe rápidamente y ejerce efecto citotóxico en las células ![]() -pancreáticas, donde aumenta la concentración de calcio citosólico, y de
momento, se produce una súbita liberación de insulina y de especies reactivas a
oxígeno. Estos cambios lesionan la célula
pancreática y, en consecuencia, ocurre
supresión de la respuesta a la elevación plasmática de glucosa, incluso
en condiciones de hiperglucemia (Szkudelski, 2001; Kaur y col., 2014;
Zhou y col., 2017). La estreptozotocina
(2-deoxi-2-(3-(methil-3-nitrosoureido)-D-glucopiranosa),
se administra por vía parenteral y ocasiona efectos semejantes a los de la aloxana (Radenković y col.,
2016). Los protocolos actuales contienen múltiples variantes, generalmente, debido a la condición fisiológica que
desee implementarse, ya que, dependiendo del protocolo, puede resultar un
modelo experimental de lo que se conoce clínicamente como
diabetes tipo 1
o tipo 2.
-pancreáticas, donde aumenta la concentración de calcio citosólico, y de
momento, se produce una súbita liberación de insulina y de especies reactivas a
oxígeno. Estos cambios lesionan la célula
pancreática y, en consecuencia, ocurre
supresión de la respuesta a la elevación plasmática de glucosa, incluso
en condiciones de hiperglucemia (Szkudelski, 2001; Kaur y col., 2014;
Zhou y col., 2017). La estreptozotocina
(2-deoxi-2-(3-(methil-3-nitrosoureido)-D-glucopiranosa),
se administra por vía parenteral y ocasiona efectos semejantes a los de la aloxana (Radenković y col.,
2016). Los protocolos actuales contienen múltiples variantes, generalmente, debido a la condición fisiológica que
desee implementarse, ya que, dependiendo del protocolo, puede resultar un
modelo experimental de lo que se conoce clínicamente como
diabetes tipo 1
o tipo 2.
El modelo farmacológico del tipo de diabetes, depende tanto de la dosis del fármaco empleado, como de la vía de administración. La dosis de aloxana más frecuentemente empleada por vía intravenosa en ratas va de 45 mg/kg a 65 mg/kg de peso corporal. Si el fármaco es administrado vía subcutánea, se emplea el triple de la dosis intravenosa, en tanto que, por vía intraperitoneal suele administrarse una dosis máxima de 200 mg/kg de peso corporal (Lenzen, 2008).
En el caso de la estreptozotocina, el rango de
dosis más empleado va de 40 mg/kg a 60 mg/kg (Guex y col., 2019; Sharma y col., 2019), con grandes variaciones dependientes
de la vía de administración. La dosis única de
estreptozotocina (por ejemplo, 90 mg/kg, por vía
intravenosa), administrada en ratas de 2 d de edad, produce después de 6 o 15 semanas algunos síntomas de diabetes tipo 2; aunque, con modificaciones al protocolo, puede
dar lugar a un modelo de diabetes tipo
1 (Radenković y
col., 2016).
Tanto la aloxana como la estreptozotocina, aun en dosis única, producen un alto índice de mortalidad (Radenković y col., 2016). Las ratas tratadas con estos fármacos desarrollan en lapso de horas, hiperglucemia y suelen fallecer por cetoacidosis entre 6 d y 9 d después de la administración; notablemente, la mortalidad va del 55 % al 80 % (Federiuk y col., 2004).
Existen
variantes metodológicas para reducir la pérdida de
sujetos asociada al fármaco citotóxico pancreático. Estas estrategias incluyen
administrar fructosa (10 % a 40 %), antes
y después de una dosis baja del tóxico
(Wilson e Islam, 2012). La protección con fructosa, previa al
citotóxico, seguida de la administración
diaria de insulina, permite alcanzar más del
80 % de supervivencia. Las ratas despliegan
altas glucemias plasmáticas, cetonuria,
glucosuria, además de polifagia,
polidipsia y baja de peso. Con este manejo, una hiperglucemia prolongada, se
asocia con una disminución generalizada de un marcador de la actividad neuronal, la proteína
Fos, en estructuras cerebrales relacionadas con el
procesamiento emocional (Moreno-Cortés y col., 2016) y con alteraciones de la responsividad entre circuitos neurobiológicos mediadores de
estrategias adaptativas (Contreras y col., 2019). Es importante resaltar que,
la dosis protectora de insulina empleada en
estos dos trabajos previamente citados,
se calcula para: i) lograr concentraciones plasmáticas de glucosa bien planeadas; ii)
evitar llegar al coma diabético; y, iii) sostener una hiperglucemia lo
suficientemente alta, como para previsiblemente producir el daño tisular
característico del síndrome.
En su mayoría, los reportes que proponen algún supuesto tratamiento, se basan en modelos en los que apenas se desarrolló hiperglucemia durante unas cuantas semanas (Radenković y col., 2016). Un periodo demasiado corto para el desarrollo de las alteraciones micro y macrovasculares, que son posiblemente la base fundamental de las alteraciones que ocurren a largo plazo en el curso de la diabetes (Contreras y Gutiérrez-García, 2017; Sankrityayan y col., 2019). Desde luego que algunos estudios han dado seguimiento por lapsos de semanas a meses en animales que fueron inyectados con estreptozotocina (Wilson e Islam, 2012; Barriere y col., 2018) o aloxana (Lucchesi y col., 2013; Lucchesi y col., 2015), y cuidadosamente se vigilaron signos, síntomas y datos de laboratorio que verificaron el desarrollo de diabetes experimental.
La Figura 2, sintetiza las observaciones que llevan a proponer el rediseño de los modelos experimentales de diabetes. Los procedimientos quirúrgicos prácticamente han sido abandonados, especialmente con base en lo traumático del procedimiento. Como ya se mencionó, el estudio de factores dietéticos lleva a identificar riesgos e impactos de la obesidad; en este punto, conviene destacar el aspecto de los llamados factores de riesgo. Varios de estos factores, por ejemplo, la obesidad y la acantosis, ocurren en muchas personas que no necesariamente van a ser diabéticas en el corto o largo plazo (Ozlu y col., 2018; Lascar y col., 2019). La mayor parte de los modelos apoyados en la genética, hasta ahora, emplean modelos poligénicos. Es de desearse que, en el futuro, se disponga de modelos monogénicos, con sintomatología más pura. No es de sorprender que, el uso de estos modelos poligénicos ha llevado a la elaboración del concepto de alguna relación entre la diabetes y la enfermedad de Alzheimer (Hascup y col., 2019; Kim y col., 2019; Norwitz y col., 2019). En cuanto a los dos modelos farmacológicos disponibles, conviene destacar la elevada mortalidad de los sujetos experimentales, lo cual está relacionado con
el repentino daño masivo a las células pancreáticas. Aunque los signos y síntomas de la diabetes requieren del daño funcional de las células β-pancreáticas (Gerber y Rutter, 2017), más que de la masa de las mismas. De hecho, ya se han realizado intentos con éxitos relativos al administrar aloxana y estreptozotocina de manera gradual (Radenković y col., 2016). Los resultados son desalentadores, lo cual lleva a la necesidad de encontrar o tal vez diseñar fármacos con toxicidad selectiva sobre las células β-pancreáticas del islote de Langerhans, con una acción lenta y gradual.
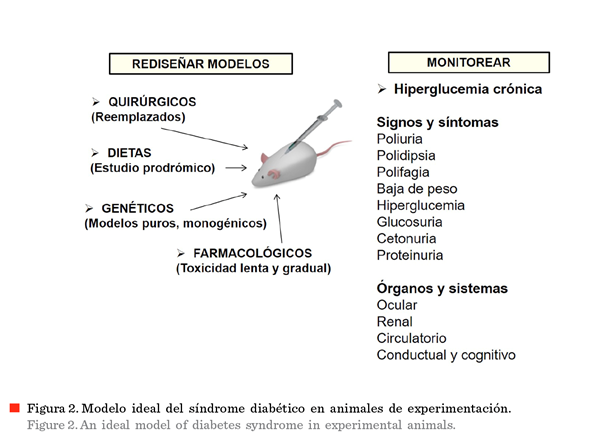
Lo ideal será hallar algunos de estos modelos y monitorear los signos y síntomas típicos de la diabetes, apoyados en el estudio de órganos y sistemas que son afectados por la hiperglucemia crónica, por ejemplo, examen ocular (búsqueda de cataratas) y estudio de fondo de ojo (para la detección de la retinopatía diabética); evaluación de la función renal (determinación de nivel de creatinina); daño circulatorio; y desde luego, enriquecer los datos que ya existen sobre las alteraciones conductuales y cognitivas asociadas a la diabetes.
CONCLUSIONES
No parece que se disponga aún de un modelo experimental que emule en su totalidad el síndrome diabético. Es necesario estructurar diseños experimentales que consideren la supervivencia de los animales experimentales por meses, a fin de establecer analogías con la cronología de la enfermedad en el humano. La meta es lograr diversos signos y síntomas, semejantes a los que ocurren en el enfermo diabético en su etapa crónica.
ReferencIAs
Acharjee, S., Ghosh, B., Al-Dhubiab, B. E., and Nair, A. B. (2013). Understanding type 1 diabetes: etiology
and models. Canadian Journal of Diabetes. 37(4): 269-276.
Al-Awar,
A., Kupai, K., Veszelka,
M., Szűcs, G., Attieh, Z., Murlasits, Z., …, and Varga, C. (2016). Experimental diabetes mellitus in
different animal models. Journal of Diabetes Research. 2016: 9051426.
Arias-Díaz,
J. and Balibrea, J. (2007). Modelos
animales de intolerancia a
la glucosa y diabetes tipo
2. Nutrición Hospitalaria.
22(2): 160-168.
Barbour, L. A. (2019). Metabolic
culprits in obese pregnancies and gestational diabetes mellitus: big babies, big twists, big
picture: The 2018 Norbert Freinkel Award Lecture. Diabetes Care. 42(5): 718-726.
Barriere, D. A., Noll, C., Roussy, G., Lizotte, F., Kessai, A., Kirby, K., ..., and Sarret,
P. (2018). Combination of high-fat/high-fructose diet and low-dose streptozotocin to model longterm type-2 diabetes complications. Scientific Reports.
8(1): 424.
Benomar, Y. and Taouis,
M. (2019). Molecular mechanisms underlying obesity-induced hypothalamic
inflammation and insulin resistance: pivotal role of resistin/TLR4
pathways. Frontiers in Endocrinology. 10: 140.
Boles, A., Kandimalla,
R., and Reddy, P. H. (2017). Dynamics of diabetes and obesity: Epidemiological
perspective. Biochimical et
Biophysica Acta Molecular
Basis Disease. 1863(5): 1026-1036.
Brito-Casillas, Y., Melián, C., and Wägner, A. M.
(2016). Study of the pathogenesis and treatment of diabetes mellitus through
animal models. Endocrinololgía y Nutrición. 63(7): 345-353.
Burbridge, S., Stewart, I., and Placzek, M. (2016). Development of the neuroendocrine
hypothalamus. Comprehensive Physiology. 6(2): 623-643.
Buyukdere, Y., Gulec,
A., and Akyol, A. (2019). Cafeteria diet increased
adiposity in comparison
to high fat diet in young male rats. PeerJ. 7:
e6656.
Carrero, J. A., McCarthy, D. P., Ferris,
S. T., Wan, X., Hu, H., Zinselmeyer, B. H., …, and Unanue, E. R. (2017). Resident macrophages of pancreatic
islets have a seminal role in the initiation of autoimmune diabetes of NOD
mice. Proceedings of the National Academy of Sciences of the United
States of America. 114(48):
E10418-E10427.
Castell-Auví,
A., Cedó, L., Pallarès, V.,
Blay, M., Ardévol, A., and Pinent, M. (2012). The effects of a cafeteria diet on
insulin production and clearance in rats. The British Journal of Nutrition. 108(7):
1155-1162.
Chan, M. (2017). Obesity and
Diabetes: The Slow-Motion Disaster. Milbank Q. 95(1): 11-14.
Chen, Y. W., Fiscella,
K. A., Bacharach, S. Z., and Calu, D. J. (2014).
Effect of cafeteria diet history on cue-, pellet-priming-, and stress-induced
reinstatement of food seeking infemale rats. PloS One.
9(7): e102213.
Chittka, D., Banas,
B., Lennartz, L., Putz, F.
J., Eidenschink, K., Beck, S., …,
and Banas, M.
C. (2018). Long-term expression of glomerular genes in diabetic nephropathy. Nephrology, Dialysis, Transplantation. 33(9): 1533-1544.
Churruca, I., Portillo, M. P., Casis, L., Gutierrez, A., Macarulla,
M. T., and Echevarria, E. (2008). Effects of
fluoxetine administration on
hypothalamic melanocortin system in obese Zucker
rats. Neuropeptides. 42(3):
293-299.
Contreras, C. M. and Gutiérrez-García, A. G. (2017). Cognitive impairment in diabetes and
poor glucose utilization in the intracellular neural milieu. Med Hypotheses.
104: 160-165.
Contreras, C. M., Gutiérrez-García, A. G., and Moreno-Cortés, M. L. (2019).
Responsivity of lateral septum-mPFC connections in alloxan-induced
hyperglycemia. Behavioural Brain Research. 368: 111919.
Daryabor, G., Kabelitz,
D., and Kalantar, K. (2019). An update on immune dysregulation in
obesity-related insulin resistance.
Scandinavian Journal of Immunology. 89(4): e12747.
Drel, V. R., Mashtalir, N., Ilnytska, O., Shin, J., Li, F., Lyzogubov,
V. V., and Obrosova, I. G. (2006). The leptindeficient
(ob/ob) mouse: a new animal
model of peripheral neuropathy of type 2 diabetes and obesity. Diabetes.
55(12): 3335-3343.
Dunn, J. S., Sheehan, H. L., and McLetchie, N. G. B. (1943). Necrosis of islets of
Langerhans produced experimentally. Lancet.
241 (6242): 484-487.
Federiuk, I. F., Casey, H. M., Quinn, M.
J., Wood, M. D., and Ward, W. K. (2004). Induction of type-1 diabetes mellitus
in laboratory rats by use of alloxan: route of
administration, pitfalls, and insulin treatment. Comparative Medicine. 54(3):
252-257.
Flores, Y. N., Contreras, Z. A.,
Ramirez-Palacios, P., Morales, L. S., Edwards, T. C., Gallegos-Carrillo, K., …,
and Patrick, D. L. (2019). Increased prevalence of psychosocial, behavioral,
and socio-environmental risk factors among over-weight and obese youths in
Mexico and the United States. International Journal of Environmental
Research and Public Health. 16(9): E1534.
Fu, Z., Gilbert, E. R., and Liu,
D. (2013). Regulation of insulin synthesis and secretion and pancreatic Beta-cell dysfunction in diabetes. Current
Diabetes Reviews. 9(1): 25-53.
Geiss, L. S., Kirtland, K., Lin, J.,
Shrestha, S., Thompson, T., Albright, A., and Gregg, E. W. (2017). Changes in
diagnosed diabetes, obesity, and physical inactivity prevalence in US counties,
2004-2012. PLoS One. 12(3): e0173428.
Gerber, P. A. and Rutter, G. A.
(2017). The role of oxidative stress and hypoxia in pancreatic beta-cell
dysfunction in diabetes mellitus. Antioxidants & Redox Signaling. 26(10):
501-518.
Gómez-Smith, M., Karthikeyan, S., Jeffers, M. S., Janik,
R., Thomason, L. A., Stefanovic, B., and Corbett, D.
(2016). A physiological characterization of the Cafeteria diet model of
metabolic syndrome in the rat. Physiology and Behavior. 167: 382-391.
Grillo, C. A., Piroli,
G. G., Lawrence, R. C., Wrighten, S. A., Green, A.
J., Wilson, S. P., ..., and Reagan, L. P. (2015). Hippocampal insulin resistance
impairs spatial learning and synaptic plasticity. Diabetes.
64(11): 3927-3936.
Grillo, C. A., Woodruff, J., Macht, V. A., and Reagan, L. P. (2019). Insulin resistance and
hippocampal dysfunction: Disentangling peripheral and brain causes from
consequences. Experimental Neurology. 318: 71-77.
Guex, C. G., Reginato,
F. Z., de-Jesus, P. R., Brondani, J. C., Lopes, G. H.
H., and Bauermann, L. F. (2019). Antidiabetic effects
of Olea europaea L. leaves in diabetic rats induced
by high-fat diet and low-dose streptozotocin. Journal
of Ethnopharmacology. 235: 1-7.
Gutiérrez, A., Saracibar,
G., Casis, L., Echevarria,
E., Rodriguez, V. M., Macarulla, M. T., ..., and Portillo, M. P. (2002). Effects of fluoxetine
administration on neuropeptide y and orexins in obese zucker
rat hypothalamus. Obesity Research. 10(6): 532-540.
Harwood, H. J., Listrani,
P., and Wagner, J. D. (2012). Nonhuman primates and other animal models in
diabetes research. Journal of Diabetes Science and Technology. 6(3):
503-514.
Hascup, E. R.,
Broderick, S. O., Russell, M. K., Fang, Y., Bartke,
A., Boger, H. A., and Hascup,
K. N. (2019). Dietinduced insulin resistance elevates
hippocampal glutamate as well
as VGLUT1 and GFAP expression in AbetaPP/PS1 mice. Journal of Neurochemistry. 148(2): 219-237.
Heyne, A., Kiesselbach,
C., Sahún, I., McDonald, J., Gaiffi,
M., Dierssen, M., and Wolffgramm,
J. (2009). An animal model of compulsive food-taking behaviour. Addiction
Biology. 14(4): 373-383.
Hugés-Hernandorena, B., Rodríguez-García,
J. C., Rodríguez-González, J. C., and Marrero-Rodríguez, M. T. (2002). Animales de experimentación como modelos
de diabetes mellitus tipo 2. Revista
Cubana de Endocrinología. 13(2):
160-168.
Igel, M., Becker, W., Herberg, L., and Joost, H. G.
(1997). Hyperleptinemia, leptin resistance, and
polymorphic leptin receptor
in the New Zealand obese mouse. Endocrinology. 138(10): 4234-4239.
Kahn, S. E., Hull, R. L., and Utzschneider, K. M. (2006). Mechanisms linking obesity to
insulin resistance and type 2 diabetes. Nature.
444(7121): 840-846.
Karatas, F., Sahin,
S., Aytekin, A., Hacioglu,
M. B., Imamoglu, G. I., and Altinbas,
M. (2018). Durable complete response with a short course of streptozotocin
plus doxorubicin combination in malignant metastatic insulinoma.
Journal of Cancer
Research and Therapeutics. 14(5): 1149-1151.
Kaur, M., Bedi,
O., Sachdeva, S., Reddy, B. V. K. K., and Kumar, P.
(2014). Rodent animal models: from mild to advanced stages of diabetic
nephropathy. Inflammopharmacology. 22(5):
279-293.
Kim, B., Elzinga,
S. E., Henn, R. E., McGinley, L. M., and Feldman, E. L. (2019). The effects of
insulin and insulin-like growth factor I on amyloid precursor protein phosphorylation
in in vitro and in vivo models of Alzheimer’s disease.
Neurobiology of Disease.
132: 104541.
Lascar, N., Altaf,
Q. A., Raymond, N. T., Broen, J., Pattison, H.,
Barnett, A., ..., and Bellary, S. (2019). Phenotypic
characteristics and risk factors in a multi-ethnic cohort of young adults with
type 2 diabetes. Current Medical Research and Opinion. 1-8.
Lenzen, S. (2008). The mechanisms of alloxan- and streptozotocin-induced
diabetes. Diabetologia.
51(2): 216-226.
Lewis, A. R., Singh, S., and Youssef,
F. F. (2019). Cafeteria-diet induced obesity results in impaired cognitive
functioning in a rodent model. Heliyon.
5(3): e01412.
Liljedahl, L., Norlin,
J., McGuire, J. N., and James, P. (2017). Effects of insulin and the
glucagon-like peptide 1 receptor agonist liraglutide
on the kidney proteome in db/db
mice. Physiology Reproduction. 5(6): e13187.
Lucchesi, A. N., Cassettari,
L. L., and Spadella, C. T. (2015). Alloxan-induced diabetes causes morphological and ultrastructural
changes in rat liver that resemble the natural history of chronic fatty liver
disease in humans. Journal of Diabetes Research. 2015: 494578.
Lucchesi, A. N., Freitas, N. T., Cassettari, L. L., Marques, S. F., and Spadella,
C. T. (2013). Diabetes mellitus triggers oxidative stress in the liver of alloxan-treated rats: a mechanism for diabetic chronic
liver disease. Acta Cirurgica
Brasileira. 28(7): 502-508.
Minkowski, O. and Bretzel,
R. G. (2002). Further reports on diabetes mellitus after the extirpation of the
pancreas. Journal of Molecular
Medicine (Berlin, Germany). 80(1): 3-4.
Moreno-Cortés, M. L., Gutiérrez-García, A. G., Guillén-Ruiz, G., Romo-González, T., and Contreras, C. M. (2016). Widespread
blunting of hypothalamic and amygdala-septal activity and behavior in rats with
long-term hyperglycemia. Behavioural Brain Research.
310: 59-67.
Mtintsilana, A., Micklesfield,
L. K., Chorell, E., Olsson, T., and Goedecke, J. H. (2019). Fat redistribution and accumulation
of visceral adipose tissue predicts type 2 diabetes risk in middle-aged black
South African women: a 13-year longitudinal study. Nutrition and Diabetes.
9(1): 12.
Necyk, C. and Zubach-Cassano,
L. (2017). Natural health products and diabetes: a practical review.
Canadian Journal of Diabetes. 41(6): 642-647.
Norwitz, N. G., Mota,
A. S., Norwitz, S. G., and Clarke, K. (2019).
Multi-Loop model of Alzheimer disease: an integrated perspective on the Wnt/GSK3beta, alpha-synuclein,
and type 3 diabetes bypotheses. Frontiers in Aging
Neuroscience. 11: 184.
Okamura, T., Hashimoto, Y., Hamaguchi, M., Obora, A., Kojima,
T., and Fukui, M. (2019). Ectopic fat obesity presents the greatest risk for
incident type 2 diabetes: apopulationbased
longitudinal study. International Journal of Obesity. 43(1): 139-148.
Ono, H. (2019). Molecular
mechanisms of hypothalamic insulin resistance. International Journal of
Molecular Sciences. 20(6): E1317.
Ozlu, E., Uzuncakmak,
T. K., Takir, M., Akdeniz,
N., and Karadag, A. S. (2018). Comparison of
cutaneous manifestations in diabetic and nondiabetic obese patients: A prospective,
controlled study. Northern Clinics of Istanbul. 5(2): 114-119.
Park, Y. W., Zhu, S., Palaniappan, L., Heshka, S., Carnethon, M. R., and Heymsfield,
S. B. (2003). The metabolic syndrome: prevalence and associated risk factor
findings in the US population from the Third National Health and Nutrition
Examination Survey, 1988–1994. Archives International of Medicine.
163(2003): 427-436.
Prakash, L., Bhosale,
P., Cloyd, J., Kim, M., Parker, N., Yao, J., ..., and Katz, M. H. (2017). Role of fluorouracil,
doxorubicin, and streptozocin therapy in the
preoperative treatment of localized pancreatic neuroendocrine tumors. Journal
of Gastrointestinal Surgery. 21(1): 155-163.
Radenković, M., Stojanović,
M., and Prostran, M. (2016). Experimental diabetes
induced by alloxan and streptozotocin:
The current state of the art. Journal and Pharmacological and Toxicological Methods.
78: 13-31.
Rawshani, A., Sattar,
N., Franzén, S., Rawshani,
A., Hattersley, A. T., Svensson, A. M., ..., and Gudbjörnsdottir, S. (2018). Excess mortality and
cardiovascular disease in Young adults with type 1 diabetes in relation to age
at onset: a nationwide, register-based cohort study. Lancet. 392(10146):
477-486.
Rerup, C. C (1970). Drugs producing
diabetes through damage of the insulin secreting cells. Pharmacology Review.
22(4): 485-518.
Sah, S. P., Singh, B., Choudhary, S., and Kumar, A. (2016). Animal models of
insulin resistance: A review. Pharmacological Reports: PR. 68(6):
1165-1177.
Saltiel, A. R. and Olefsky,
J. M. (2017). Inflammatory mechanisms linking obesity and metabolic disease. Journal
Clinical Investigation. 127(1): 1-4.
Sankrityayan, H., Oza,
M. J., Kulkarni, Y. A., Mulay, S. R., and Gaikwad, A.
B. (2019). ER stress response mediates diabetic microvascular complications. Drug
Discovery Today. 1359-6446(19): 30314-30319.
Sharma, G., Ashhar,
M. U., Aeri, V., and Katare,
D. P. (2019). Development and characterization of late-stage diabetes mellitus and associated
vascular complications. Life Sciences.
216: 295-304.
Sharma, K., McCue, P., and Dunn, S.
R. (2003). Diabetic kidney disease in the db/db mouse. American Journal of Physiology. Renal
Physiology. 284(6): F1138-F1144.
Shivaswamy, V., Boerner,
B., and Larsen, J. (2016). Post-Transplant diabetes mellitus: causes, treatment,
and impact on outcomes. Endocrinology Review. 37(1): 37-61.
Soto, M., Cai, W., Konishi, M., and
Kahn, C. R. (2019). Insulin signaling in the hippocampus and amygdala regulates
metabolism and neurobehavior. Proceeding of the National Academy of Sciences of
the United States America. 116(13): 6379-6384.
Spurr, S., Bally, J., Allan, D., Bullin,
C., and McNair, E. (2019). Prediabetes: An emerging public health concern in adolescents. Endocrinology,
Diabetes and Metabolism. 2(2): e00060.
Srinivasan, K. and Ramarao,
P. (2007). Animal models in type 2 diabetes research: an overview. The
Indian of Journal of Medical Research. 125(3): 451-472.
Staats, J. (1975). Diabetes in the mouse
due to two mutan genes - a bibliography. Diabetologia.
11(4): 325-327.
Stein, A. D., Obrutu,
O. E., Behere, R. V., and Yajnik,
C. S. (2019). Developmental undernutrition, offspring obesity and type 2
diabetes. Diabetologia. 62(10): 1773-1778.
Szkudelski, T. (2001). The mechanism of alloxan and streptozotocin action in B cells of the rat
pancreas. Physiological Research. 50(6): 537-546.
Tamas, M. J., Khakharia,
A., Rothenberg, R. B., and Phillips, L. S. (2018). Weight trends in veterans
with and without diabetes, 2000 to 2014. Obesity. 26(12): 1949-1957.
Tancredi, M., Rosengren,
A., Svensson, A. M., Kosiborod,
M., Pivodic, A., Gudbjörnsdottir,
S., …, and Lind, M. (2015).
Excess mortality
among persons with Type 2 diabetes. The New England Journal of Medical.
373(18): 1720-1732.
Waernbaum, I., Dahlquist,
G., and Lind, T. (2019). Perinatal risk factors for type 1 diabetes revisited:
a populationbased register study. Diabetologia.
1-12.
Wells, J. C. K. (2019). The diabesity epidemic in the light of evolution: insights from
the capacity-load model. Diabetologia.
62(10): 1740-1750.
Wilson, R. D. and Islam, M. S.
(2012). Fructose-fed streptozotocin-injected rat: an
alternative model for type 2 diabetes. Pharmacological Reports: PR. 64(1): 129-139.
Winocur, G., Greenwood, C. E., Piroli, G. G., Grillo, C. A., Reznikov, L. R., Reagan, L. P., and McEwen, B. S. (2005).
Memory impairment in obese Zucker rats: an
investigation of cognitive function in an animal model of insulin resistance
and obesity. Behavioral Neuroscience. 119(5): 1389-1395.
Wojciechowska, J., Krajewski,
W., Bolanowski, M., Kręcicki,
T., and Zatoński, T. (2016). Diabetes and Cancer: a
review of current knowledge. Experimental Clinical Endocrinology Diabetes.
124(5): 263-275.
Yu, Y. B., Bian,
J. M., and Gu, D. H. (2015).
Transplantation of insulin-producing cells to treat diabetic rats after 90 %
pancreatectomy. World Journal of Gastroenterology. 21(21): 6582-6590.
Zhou, W., Wei, L., Xiao, T., Lai,
C., Peng, M., Xu, L., …, and Zhang, F. (2017). Diabetogenic agent alloxan is a
proteasome inhibitor. Biochemical and Biophysical Research Communications.
488(2): 400-406.