Evaluación de los
métodos utilizados para el diagnóstico de vaginosis bacteriana en el Hospital Regional ISSSTE
Puebla
Evaluation of methods
used for the diagnosis of bacterial vaginosis in the Hospital Regional ISSSTE Puebla
Guadalupe Jiménez-Flores1,
Jesús Flores-Tlalpa1,
Alejandro César Ruiz-Tagle2, Claudy Lorena
Villagrán-Padilla2*
*Correspondencia: claudy.villagran@correo.buap.mx/Fecha de recepción: 13 de mayo de 2019/Fecha de aceptación: 26 de septiembre de 2019/ Fecha de publicación: 31 de enero de 2020
1Instituto de Seguridad y Servicios Sociales de los Trabajadores del Estado (ISSSTE)
Puebla, Puebla, México. 2Benemérita Universidad Autónoma
de Puebla, Facultad de Ciencias
Químicas, Ciudad Universitaria,
edificio FCQ9, 14 sur y avenida
San Claudio s/n, Puebla, Puebla, México, C. P. 72000.
Resumen
La vaginosis bacteriana (VB) es una alteración frecuente de la
microbiota vaginal en mujeres en edad reproductiva.
El diagnóstico puede ser efectuado aplicando criterios clínicos o por la evaluación
de los morfotipos bacterianos presentes en la tinción
de Gram realizada a la secreción vaginal o mediante procedimientos microbiológicos,
los cuales se desarrollaron como una alternativa al diagnóstico clínico,
reemplazándolo paulatinamente. El objetivo del presente trabajo fue determinar
la efectividad de los métodos de Amsel e Ison-Hay, para el diagnóstico de vaginosis
bacteriana, empleando el método de Nugent como estándar. En este estudio se analizaron 305
muestras de secreción vaginal de pacientes del Hospital Regional ISSSTE Puebla.
Las muestras se procesaron y analizaron para el diagnóstico de VB, siguiendo
las recomendaciones de los métodos de Amsel, Nugent e Ison-Hay. El análisis de los resultados indicó un 12.8 %
por Nugent, 31.1 % de VB por el método de Amsel y 36.7 %
por Ison-Hay; sugiriendo que ambas técnicas
muestran una alta tasa de falsos positivos. La sensibilidad para el método de Amsel e Ison-Hay fue de 97.44 %,
la especificidad fue de 78.57 % y 72.18 % para Amsel
e Ison-Hay, respectivamente. En conclusión, dado a
los resultados obtenidos y a las mínimas diferencias entre los métodos
analizados, se recomienda realizar los criterios de Amsel,
seguidos de la observación de la tinción de Gram del flujo vaginal para la
valoración de la microbiota por el método de Ison-Hay, para tener un mejor diagnóstico de VB, cuando no
se emplea el método de Nugent.
Palabras clave: vaginosis bacteriana, especificidad, sensibilidad.
Abstract
Bacterial
vaginosis (BV) is a frequent alteration of the vaginal microbiota in women of reproductive age. The diagnosis can be made by applying clinical
criteria or by the eva-luation
of bacterial morphotypes present in Gram stain performed to vaginal secretion or by microbiological
procedures, which were developed as an alternative to clinical diagnosis, gradually
replacing it. The objective of this work
was to determine the effectiveness of the Amsel and Ison-Hay methods, used for
the diagnosis of bacterial vaginosis using the Nugent method
as a standard. In this study,
305 samples of
vaginal discharge from patients of the ISSSTE Puebla Regional Hospital were
analyzed. The samples were processed
and analyzed for the diagnosis of BV following the recommendations of the Amsel, Nugent
and Ison-Hay methods. The analysis of the results indicated
12.8 % by Nugent, 31.1 % of
BV by the Amsel method and 36.7 % by Ison-Hay; suggesting
that both techniques show a high rate of false positives. The sensitivity for the Amsel and Ison-Hay
method was 97.44 %, the specificity was 78.57 % and 72.18 % for Amsel and Ison-Hay, respectively. In conclusion, given the results
obtained and the minimal differences between the analyzed
methods, it is recommended to perform the Amsel
criteria, followed by the observation
of Gram staining of the
vaginal flow for the assessment of the microbiota by the Ison-Hay
method, to have a better diagnosis of BV, when the Nugent
method is not used.
Keywords: bacterial vaginosis,
sensitivity, specificity.
Introducción
La vaginosis bacteriana (VB) se define como una alteración de
la microbiota vaginal, en la cual hay disminución de
los lactobacilos, aumento de las bacterias anaerobias obligadas, y presencia de
microorganismos como Gardnerella vaginalis, Mobiluncus sp o Mycoplasma. Esta infección se caracteriza por la
ausencia de síntomas inflamatorios y por un aumento en la secreción vaginal,
generalmente de color blanco grisáceo y mal olor (Mejía-Pérez y col., 2015).
Además de la microbiota común, los métodos de
biología molecular han permitido identificar microbiota
específica, como los géneros Alloscardovia, Bifidobacterium, o Dialister (van-Den-Munckhof y col.,
2019). Es la causa más común de problemas vaginales, constituyendo un tercio de
las infecciones vulvovaginales (López y col., 2016),
y se presenta con mayor frecuencia en mujeres entre 15 a 44 años (Morales,
2015). La infección asintomática es la forma más común, en la literatura mundial se reporta con una frecuencia
entre 11 % y 48 % (Cardona-Arias y col., 2015). En los Estados Unidos de América
(E.U.A.), un estudio con 21 millones de pacientes
con infección vaginal registró un 29.2 % de prevalencia de VB
asintomática, y solamente el 15.7 % presentó sintomatología (García, 2007). La
prevalencia de VB es mayor en países subdesarrollados, y es frecuente en estudios
con sexoservidoras y en clínicas de
infecciones de transmisión sexual (ITS) (Martínez, 2013). A pesar de que se considera una
infección de tipo universal, su prevalencia en E.U.A. en mujeres afroamericanas es mayor (De-la-Calle y De-la-Calle,
2009). Los factores de riesgo relacionados con la VB son polémicos e incluyen
un nivel socioeconómico y/o de instrucción bajo, aumento en la frecuencia de coitos, múltiples parejas sexuales e
infecciones vaginales previas (García, 2007; López y col., 2016). Por
otro lado, algunos factores que reducen el riesgo de padecer VB son el uso del
preservativo, la ingesta de calcio y vitamina A y la anticoncepción hormonal
(García, 2007). Además, se considera que la prevalencia de VB es alta, en parte debido a la falta de sintomatología y a la baja especificidad de los
métodos de diagnóstico (Cancelo y col., 2012).
El
diagnóstico de VB es un tema muy discutido.
La principal razón es la existencia de diferentes metodologías
diagnósticas. Algunas consideran exclusivamente el examen clínico, y dado el
elevado porcentaje de pacientes asintomáticas se genera cierta inexactitud. La prevalencia
de VB puede variar según la técnica diagnóstica empleada (Arnold
y col., 2014).
Históricamente,
Amsel fue el primero en proponer un método diagnóstico
para la VB, el cual, considera la observación de parámetros clínicos, y requiere la demostración de tres de los cuatro criterios: 1. Flujo blanco-grisáceo,
homogéneo, delgado y pegado a las paredes vaginales, 2. Presencia de
células clave, 3. pH mayor a 4 y 4.5. Liberación de aminas volátiles (olor “a
pescado”), producido al mezclar la secreción vaginal con hidróxido de potasio
al 10 % (Adu-Sarkodie e Ison,
2014). Los criterios de Amsel son más subjetivos que
la información aportada por la tinción de Gram, e infecciones como la tricomoniasis pueden compartir algunas de esas
características (Romero y Andreu, 2016). El método de Nugent
consiste en la evaluación de los morfotipos
bacterianos presentes en la secreción vaginal después de una tinción de Gram.
Durante la VB se puede observar una
disminución de bacilos rectos Gram positivos compatibles con Lactobacillus, aumento de cocos y
bacilos Gram variables,
compatibles con Gardnerella, y de bacilos Gram
negativos curvados (Mobiluncus),
así como también células clave (células del epitelio vaginal con cocobacilos
adheridos) y ausencia de leucocitos (Romero y Andreu, 2016).
La metodología desarrollada por Nugent y col. (1991), consiste en asignar un puntaje
que va del 0 al 10 en la escala de evaluación de la microbiota
vaginal; esta escala cuantifica los siguientes morfotipos
bacterianos: bacilos rectos Gram positivos (Lactobacillus sp),
bacilos pequeños Gram negativos (Gardnerella vaginalis) y bacilos Gram
negativos curvos (Mobiluncus sp). En la técnica de Nugent se realiza un extendido del exudado vaginal teñido
por el método de Gram y se observa al microscopio (100 X), y con base en el
número de elementos de cada morfotipo por campose asigna un valor de 0 a 4. El detalle de la
interpretación se muestra en la Tabla 1 (Adu-Sarkodie
e Ison, 2014). Para la interpretación, se considera
la puntuación total asignada, y si el valor es de 7 a 10 puntos se interpreta
como sugestivo de VB, de 4 a 6 puntos se considera microbiota
intermedia y de 0 a 3 se considera normal
(Morales, 2015). En muchos
países, es el método más aceptado para el diagnóstico de VB. Se le considera la prueba de oro, y en diversos estudios
realizados se observa que presenta mayor sensibilidad y especificidad que los
criterios de Amsel
(Arnold y col., 2014). Entre sus ventajas, se
encuentra que, al agregar la categoría de microbiota
intermedia pierde la dicotomía frente al método de Amsel,
y que toma en cuenta la microbiota vaginal y no las características clínicas de la paciente (Martínez,
2013). Tiene como desventajas no considerar
otras especies bacterianas que pueden ser causantes de VB y que no
pueden ser discriminadas por la tinción de
Gram, además de que aún no se establece cuál es la importancia de las
puntuaciones intermedias (Romero y Andreu, 2016), y con frecuencia se argumenta
que el cálculo de la puntuación es un poco complejo (García, 2007). La aplicación
de los criterios de Nugent en el diagnóstico de VB es efectiva en mujeres en
edad fértil, en el periodo entre la menarquia y
la menopausia. En la mujer prepuberal o menopáusica, es normal la disminución de lactobacilos, y en
particular, para la mujer menopáusica no hay aumento de la microbiota anaeróbica
(Martín y col.,
2008).

Otro método
cualitativo para el diagnóstico de VB es el desarrollado por Ison y Hay en 2002. Al igual que el método de Nugent, utiliza la observación microscópica de la tinción
de Gram, sin embargo, no realiza un conteo exacto de los morfotipos,
sino la proporción relativa de los diferentes morfotipos
compatibles con lactobacilos y los compatibles con VB. Ison-Hay
los clasifica en 5 grados: 0 grados: ausencia
de bacterias y presencia de células epiteliales; grado I (microbiota normal): solo morfotipos
de lactobacilos; grado II (Microbiota intermedia):
mezcla de morfotipos bacterianos y disminución de lactobacilos; grado III (VB): ausencia o escaso
número de lactobacilos, con microbiota bacteriana mixta;
y grado IV: presencia de células epiteliales
recubiertas solamente con cocos Gram positivos (Adu-Sarkodie
e Ison, 2014). El grado 0 se observa en aquellas mujeres
que han tenido un tratamiento antibiótico intravaginal
y el IV se encuentra en mujeres que están colonizadas por cocos Gram positivos como estreptococos y lactobacilos en
número reducido (Adu-Sarkodie e Ison,
2014). Tiene entre sus ventajas analizar la proporción de las especies
bacterianas, tanto de los lactobacilos como de las especies implicadas en la
VB, es menos complicado, y realiza una clasificación precisa de la microbiota, que permite la exclusión de aquellas pacientes
que no están cursando con VB (Martínez, 2013). En la actualidad se dispone de
pruebas moleculares para el diagnóstico de VB. Aunque su costo es relativamente
elevado, resultan rápidas, reproducibles y con una alta especificidad para
identificar bacterias como Gardnerella (García-Agudo y col., 2013; Romero-Morelos y col.,
2019). Sin embargo, el diagnóstico microbiológico, basado en el examen
microscópico de la secreción vaginal, ha demostrado ser un método confiable,
rápido y con una buena reproducibilidad y con
una mejor relación costo-beneficio
(Santos y col., 2017).
El objetivo
del presente trabajo fue evaluar la capacidad de los métodos de Amsel e Ison-Hay para el
diagnóstico de vaginosis bacteriana, empleando como
método de referencia el sistema de Nugent.
MATERIALES Y MÉTODOS
Selección de la
población
Se trabajó
con 1 500 mujeres que acudieron a consulta ginecológica al Hospital Regional
del Instituto de Seguridad y Servicios Sociales de los Trabajadores del Estado
(ISSSTE) Puebla, de México, durante los meses de enero a diciembre 2017. Se
tenía una prevalencia esperada de 25 % de VB,
por lo que se requirió de un tamaño de muestra n = 300. Se tomaron 305 muestras
de pacientes aleatorias, que cumplían con los requisitos previos al estudio,
como consentimiento informado, orden médica con diagnóstico presuntivo de vaginosis, y quienes al agendar su cita, fueron instruidas
para presentarse a la toma de muestra sin realizarse duchas vaginales, espumas
o tratamientos vaginales, abstinencia sexual de 48 h, no estar en
periodo de menstruación, y sin tratamiento con antibióticos 72
h antes del
estudio.
El
protocolo de investigación fue revisado y autorizado por los Comités de
Investigación y Ética en Investigación del Hospital Regional ISSSTE Puebla (número de registro 094. 2019).
Instrucciones
Antes de la
toma de muestra, se les realizó una encuesta a las 305 mujeres, la cual fue
diseñada y aprobada para este proyecto, con el
propósito de reunir información sobre la sintomatología que presentaba
la paciente, así como estado civil, inicio de la actividad sexual, uso de
preservativo, uso de duchas vaginales, embarazos y nivel académico. Se les indicó
en qué consistía la toma de muestra vaginal, y se siguió con el protocolo
correspondiente a dicha toma. Para obtener
la muestra del exudado vaginal, se introdujo el espejo vaginal, se
deslizaron 3 hisopos sobre las secreciones en el fondo posterior de la vagina, y se observó el aspecto y color de la secreción
vaginal. Durante el periodo enero a diciembre
de 2017, se analizaron las 305 muestras
de secreción vaginal.
Determinación de pH
La
determinación del pH se realizó inoculando una tira de papel pH con la
secreción vaginal por medio de un hisopo. Para la prueba de aminas se hizo un
extendido en una laminilla con el hisopo en solución salina isotónica (SSI) y
se mezcló con unas gotas de hidróxido de potasio (KOH) al 10 %, después, se verificó la producción del olor característico reconocible
por los analistas.
Células clave
Para la
búsqueda de células clave de acuerdo con los criterios de Amsel,
se mezcló una gota de secreción vaginal y SSI en un portaobjetos, y se examinó
“en fresco” al microscopio (Carl Zeiss®, Pri-mo Star, Gottingen,
Alemania) con el
objetivo de 40X.
Tinción
Para el
examen microscópico, se hizo un extendido en portaobjetos con el hisopo, se
secó al aire y se fijó con calor emitido por mechero. Posteriormente, se tiñó
siguiendo la técnica de tinción de Gram, y se observó al microscopio con el objetivo de inmersión (100X). Por
último, se cuantificó cada morfotipo bacteriano de
acuerdo con los criterios de Nugent e Ison-Hay.
Análisis de
las pruebas diagnósticas
Para la
determinación de los parámetros que describen una prueba diagnóstica: sensibilidad, especificidad y valores predictivos, se construyeron
tablas de contingencia, considerando el resultado del diagnóstico (positivo o
negativo de los métodos de Amsel e Ison-Hay) y las pruebas diagnósticas, precisando como
estándar de oro la prueba de Nugent. Se calcularon
con base en las fórmulas (Bravo-Grau y Cruz, 2015), y de acuerdo con el tamaño
de la muestra. Se consideró un intervalo de confianza de
95 % y
un error de
5 %. Los estudios clínicos se
realizaron en el laboratorio; la obtención de la muestra de exudado vaginal, y
su análisis, se llevó a cabo por el personal químico del laboratorio de microbiología.
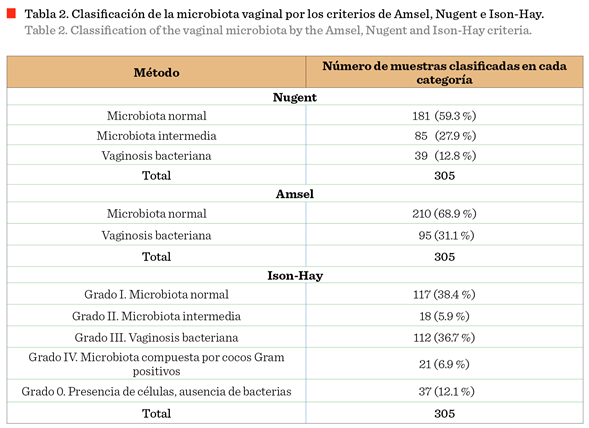
RESULTADOS
El análisis
clínico y microscópico de las muestras de secreción vaginal mostró la diversa microbiota vaginal, y con base en los diferentes criterios
se identificaron como microbiota normal 210 muestras
(68.9 %) según el método de Amsel, 181 (59.3
%) por Nugent, y 117 (38.4 %) por Ison-Hay
(Tabla 2). El número de muestras determinadas como VB por Amsel,
fue de 95 (31.1 %), por Nugent de 39 (12.8
%) e Ison-Hay de 112 (36.7 %) (Tablas 3a y 3b). La microbiota intermedia,
considerada por Nugent e Ison-Hay
fue 85 (27.9 %) y 18 (5.95 %) (Tabla 2), respectivamente. Con base en los
criterios de Ison-Hay, la microbiota
se asignó a 2º más, grado IV (microbiota compuesta por cocos Gram positivos) con 21
muestras (6.9 %) y en grado 0 (presencia de células, ausencia de bacterias)
37 (12.1 %).


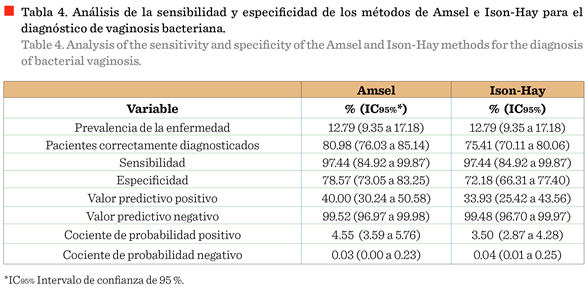
El cálculo
de la sensibilidad, especificidad, y parámetros tales como el número de pacientes
correctamente diagnosticados, valor predictivo positivo y negativo, se muestran
en Tabla 4. La comparación de los diferentes
parámetros entre los métodos de Amsel e Ison-Hay, tomando en cuenta al método de Nugent como el estándar de oro, muestra que la prevalencia
de la infección fue del 12.79 %. La
sensibilidad para Amsel e Ison-Hay
fue de 97.44 %, la especificidad fue de 78.57 % para Amsel
y de 72.18 % para Ison-Hay. La exactitud del método (Bravo-Grau y Cruz, 2015)
para detectar pacientes con VB fue de 80.98 % y 75.41 % para Amsel e Ison-Hay, respectivamente.
El valor predictivo positivo para Amsel fue de 40 % y
para Ison-Hay de 33.93 %, mientras que el valor
predictivo negativo fue de 99.52 % para Amsel y de 99.48 % para
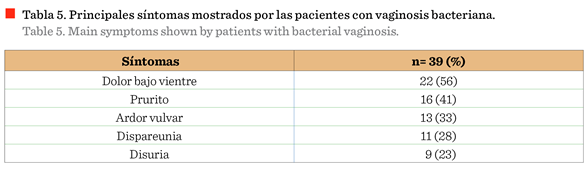
Ison-Hay. A partir de la información proporcionada
por las pacientes, se observó que los síntomas mostrados con mayor frecuencia
en las pacientes diagnosticadas con VB fueron
dolor en el bajo vientre (56 %), prurito (41 %), y ardor vulvar (33 %) (Tabla
5).
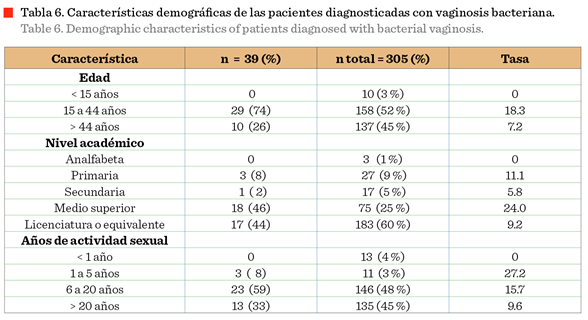
La VB fue
diagnosticada principalmente en pacientes de 15 a 44 años (74 %). No fue observada
en pacientes menores de 15 años (Tabla 6). En cuanto al nivel de estudios, las
encuestadas con VB contaban con estudios de nivel medio superior (46 %) y de
licenciatura (44 %). En cuanto a la actividad sexual, una gran parte (59 %) de las 39 pacientes, manifestó una actividad
sexual de 6 a 20 años, y otra parte indicó tenerla de más de 20 años (33 %) (Tabla
6).
DISCUSIÓN
Desde las
primeras descripciones de la VB, el
diagnóstico de esta enfermedad ha sido controvertido, Amsel
propone un método diagnóstico basado en criterios clínicos. Este método
ha sido muy utilizado debido a su fácil realización, sin embargo, algunos de
sus criterios como el flujo vaginal abundante
puede ser causado por Candida spp y la prueba de aminas positiva por
microorganismos como Trichomonas vaginalis, ambos causantes de vaginitis (Arnold y col., 2014). Por su parte, Nugent
propone un método en el que se cuantifican los morfotipos
bacterianos involucrados en la infección; la puntuación obtenida lo asigna a
una categoría que establece si la microbiota presente
es normal, intermedia o característica de una VB. Aunque este método desde su
validación se ha colocado como el estándar de oro para el diagnóstico de VB
(Santos y col., 2017), requiere del recuento de diferentes tipos de bacterias,
lo que lo hace más lento para un laboratorio clínico, y requiere de personal
mejor calificado para su implementación (Keane y col., 2005). En la actualidad, el método de Ison-Hay es de los más utilizados, dada a su sencillez y
menor tiempo de realización. Este método
incluye 2 grados más que el de Nugent, grado
IV, que es un microbiota compuesta por cocos Gram positivos,
y 0 grados, en el que hay presencia de
células epiteliales y ausencia de bacterias. Los grados añadidos
permiten una mejor discriminación de
la microbiota vaginal (Martínez y col., 2011).
A partir de
los resultados, se observa que el método de Ison-Hay diagnosticó a un mayor número de pacientes con VB
(112), que el método de Amsel (95) y Nugent (39), sin embargo, este método podría estar sobrevalorando
el número de pacientes que realmente poseen este padecimiento, lo que se corrobora con un mayor número de
diagnósticos falsos positivos (74),
mientras que por Amsel se observaron 57, por lo que
en este método se reportó un mayor porcentaje
de exactitud del diagnóstico, un 5.57
% más que el de Ison-Hay;
así como una especificidad de 6.39 %, sobre el método de Ison-Hay. En cuanto al valor predictivo negativo, se observaron
valores muy altos para ambos méto-
dos, 99.52 % para Amsel
y 99.48 % para Ison-Hay. El porcentaje de pacientes
que efectivamente no presentaron VB se incluyeron entre todos los que dieron un
resultado negativo, lo que puede deberse a la baja prevalencia de la enfermedad
(12.79 %), en contraste, el valor predictivo positivo fue mucho mayor, 40 %
para Amsel y 33.93
% por
Ison-Hay.
La
capacidad del sistema de puntuación de Nugent para el
diagnóstico de la VB ha sido evaluada por diferentes autores (Rodríguez y col.,
2014; Santos y col., 2017). Tafner y col. (2015)
detectaron una prevalencia del 43 % en un grupo de adolescentes embarazadas, y
López y col. (2016) determinaron en un estudio realizado con 6 322 mujeres en
20 ciudades del Perú una prevalencia del 23.7 %, ambas mayores que los
resultados de este trabajo.
En un estudio de Rodríguez y col. (2014), consideraron el método de Nugent como la prueba
de oro para el diagnóstico de la VB, ya
que supera en sensibilidad y especificidad a la metodología basada en los
criterios clínicos de Amsel. Sin embargo, aún no se
adopta de manera universal en todos los laboratorios diagnósticos.
En una investigación
sobre los métodos empleados para el diagnóstico de VB, por Keane
y col. (2005), en clínicas de medicina genitourinaria del Reino Unido,
reportaron que de 99 clínicas, 24 usaron el método de Nugent,
8 el de Spiegel, 33 el procedimiento de Ison-Hay y 34 un procedimiento diferente (Martínez y col., 2011). Los autores recomiendan
al método de Ison-Hay con la finalidad de adoptar un
método universal, pero sin avalar de forma científica la superioridad de alguno de los procedimientos (Keane
y col., 2005; Martínez y col., 2011).
Por último, Martínez y col. (2011), realizaron una comparación de los
criterios de Nugent y Spiegel
pa-ra el diagnóstico de VB, y aplicaron el método de Ison-Hay para los resultados discordantes, y concluyeron
que los sistemas propuestos por Spiegel, Nugent e Ison-Hay son comparables
para realizar un diagnóstico de
VB.
En este
trabajo, se confirmó que la infección se
manifiesta frecuentemente de manera asintomática, el 31 % de la población
diagnosticada con VB no refirió ninguna sintomatología. Por su parte, la literatura mundial reporta el 48 % de
infecciones asintomáticas (Cardona-Arias y col, 2015). Las pacientes que presentaron sintomatología describieron
principalmente dolor en el
bajo vientre (56 %)
y prurito (41 %).
Del
análisis demográfico, se observó que el grupo etario donde la infección fue más
frecuente es en el rango de edad que corresponde
a la etapa fértil de la mujer (74 %), un porcentaje mayor al determinado para
el total de 305 pacientes analizadas para este grupo (52 %). García (2007)
reportaron un resultado semejante, sin embargo, la prevalencia de VB en mujeres en edad reproductiva varía dependiendo
de las características demográficas y culturales del país (García, 2007). Por
otro lado, la tasa de mujeres con VB en la etapa fértil fue de 18.3 %, más alta
que la de mujeres > 44 años (7.2 %), lo que podría deberse a una mayor
actividad sexual, ya que dentro de este grupo hay mujeres más jóvenes, que
inician su vida
sexual.
Dentro de
los factores que predisponen a la población a
presentar VB, se mencionan el tener un estado socioeconómico o de
instrucción bajo (García, 2007), múltiples
parejas sexuales, así como el inicio temprano de la vida sexual (López y
col., 2016). En el presente estudio, las mujeres diagnosticadas con VB
declararon cursar estudios de educación media superior (46 %) y licenciatura o
equivalente (44 %), mientras que en la población total estudiada, se registró
un porcentaje menor en nivel medio superior (25 %), y mayor en nivel
licenciatura (60 %).
No se observó
una relación entre la prevalencia de VB y un nivel instruccional bajo. Sin
embargo, la tasa de mujeres con VB con nivel medio superior (24 %), fue mayor
que la tasa de mujeres con nivel de licenciatura (9.2 %), lo que podría deberse
a que las primeras tienen menos experiencia en el cuidado de su salud, ya que
en esta etapa escolar, se supone que la mayoría de ellas debieran ser más
jóvenes que las mujeres de licenciatura. Cabe mencionar que el lugar en donde
se realizó este estudio atiende a derechohabientes trabajadoras del estado mexicano,
por lo que estas poseen mayoritariamente estudios de licenciatura o
equivalente. En cuanto a la actividad sexual, los resultados de este trabajo
coinciden con la información que señala la literatura, al considerar como un
factor predisponente la frecuencia de actividad sexual, y el número de parejas sexuales
(López y col., 2016), el cual no fue considerado en este trabajo. En cuanto a
la actividad sexual de las mujeres, la tasa de 1 a 5 años (27.2 %) fue mucho
mayor a la tasa de 6 a 20 años (15.7 %) y > de 20 años (9.6 %), lo que podría asociarse a que las mujeres
que tienen menos años de actividad sexual, son mujeres mayores de 15 años, en etapa
de preparatoria, que inician su vida sexual, por lo que, como ya se mencionó
tienen menos experiencia en el cuidado de su salud y posiblemente tengan una
mayor actividad sexual, que las mujeres de más edad. Dado a los resultados
obtenidos y a las mínimas diferencias entre los métodos comparados, para
obtener un mejor diagnóstico de VB, se recomienda realizar los criterios
clínicos de Amsel, seguidos de la observación microcópica de la tinción de Gram del flujo vaginal para la
valoración de la microbiota por el método de Ison-Hay. No se descarta la creación
de un nuevo método que combine los puntos más importantes de cada método para
el diagnóstico de VB.
CONCLUSIONES
De los 3
métodos evaluados en este estudio, Ison-Hay es el que
clasifica un mayor número de muestras en el grado III, positivo para vaginosis bacteriana (VB), y dada su sensibilidad, posee
una capacidad para detectar enfermos, similar
al método de Amsel, sin embargo, la especificidad del método de Ison-Hay es menor que la del método de Amsel,
por lo que tiene menor capacidad de discriminar a pacientes sin la enfermedad
de VB. El método de Amsel posee un porcentaje mayor de pacientes correctamente diagnosticados, sin
embargo, el método de Ison-Hay a través de sus
5 grados proporciona una valoración más amplia de la microbiota
vaginal y no se limita al
diagnóstico de vaginosis.
ReferencIAs
Adu-Sarkodie, Y. e Ison, C. (2014). Vaginosis
bacteriana. En M. Unemo (Ed.), Diagnóstico
de laboratorio de las infecciones de transmisión sexual, incluida la infección
por el virus de la inmunodeficiencia
humana (pp. 89-93). Ginebra, Suiza:
Publicaciones de la OMS.
Arnold, M., González, A. y Carbonell, T.
(2014). Diagnóstico de vaginosis bacteriana. Aspectos
clínicos y estudios microbiológicos. Revista Médica Electrónica. 36(3):
325-338.
Bravo-Grau,
S. y Cruz, Q. J. (2015). Estudios de exactitud diagnóstica: Herramientas para
su Interpretación. Revista Chilena de Radiología. 21(4): 158-164.
Cancelo,
M., Beltrán, D., Calaf, J., Campillo, F., Cano, A., Guerra,
J. y Neyro, J. (2012). Protocolo Sociedad Española de
Ginecología y Obstetricia de diagnóstico
y tratamiento de las infecciones vulvovaginales. Progresos
de Obstetricia y Ginecología. 56(5): 278-284.
Cardona-Arias,
J., Valecia-Arredondo, M., Suárez-Henao, J. y
Herrera-Posada, D. (2015). Prevalencia de vaginosis
bacteriana en usuarios de una institución prestadora de servicios de salud de
Medellín Colombia. Investigaciones Andina.
17(30): 1151-1165.
De-la-Calle,
I. y De-la-Calle, M. (2009). Vaginosis bacteriana. Medicina
clínica. 133(20): 789-797.
García-Agudo,
L., De-la-Calle, I. J., Román, E. M., Aznar, M. P. y Rodríguez, I. M. (2013)
Diagnóstico de vaginitis-vaginosis mediante
hibridación con sondas de ADN. Ginecologia
y Obstetricia de México. 81(4):195-200.
García,
P. (2007). Vaginosis bacteriana. Revista
Peruana de Ginecología y
Obstetricia. 53(3): 167-171.
Keane, F., Maw,
R., Pritchard, C., and Ison,
C. A. (2005). Methods employed
by genitourinary medicine clinics in the United Kingdom
to diagnose bacterial vaginosis. Sexually transmitted
infections. 81(2): 155-157.
López,
T., Chiappe, M. y Cárcamo, C. (2016). Prevalencia de vaginosis bacteriana y factores asociados en 20 ciudades del
Perú. Revista
Peruana de Medicina Experimental y Salud
Pública. 33(3): 1-7.
Martín,
R., Soberón, N., Vázquez, F. y Suárez, J. E. (2008).
La microbiota vaginal: composición, papel protector,
patología asociada y perspectivas terapéuticas. Enfermedades
Infecciosas y Microbiología
Clínica. 26(3):160-167.
Martínez,
M., Ovalle, A., Gaete, A., Lillo, E., De-La-Fuente, F., Araneda, F., …. y Salinas, H. (2011). Comparación de los criterios de Nugent y Spiegel para el
diagnóstico de vaginosis bacteriana y análisis de los
resultados discordantes por el método de Ison y Hay. Revista
Médica de Chile.
139(1): 66-71.
Martínez,
W. (2013). Actualización sobre vaginosis bacteriana. Revista
Cubana de Obstetricia y Ginecología. 39(4): 427-441.
Mejía-Pérez,
D., Ángel-Müller, E., Rodríguez-Hernández, A., Ruiz-Parra, A., Tolosa-Ardila,
J. y Gaitán-Duarte, H. (2015). Características operativas del diagnóstico
clínico con y sin pruebas de consultorio (pH y prueba de aminas) para el
diagnóstico de vaginosis bacteriana, en pacientes
sintomáticas en Bogotá, Colombia. Revista Colombiana de
Obstetricia y Ginecología. 66(4): 253-262.
Morales,
P. G. (2015). Aspectos clínicos y diagnóstico de laboratorio de la vaginosis bacteriana. Revista Habanera de
Ciencias Médicas. 14(5): 611-623.
Nugent, R., Krohn,
M., and Hillier, S. (1991). Reliability
of Diagnosing Bacterial Vaginosis is Improved
by a Standardized Method of Gram Stain Interpretation. Journal
of Clinical Microbiology. 29(2): 297-301.
Rodríguez,
M., González, A. y Carbonell, T. (2014). Diagnóstico de vaginosis
bacteriana. Aspectos clínicos y estudios microbiológicos. Revista Médica
Electrónica. 36(3): 325-338.
Romero,
D. y Andreu, A. (2016). Vaginosis bacteriana. Enfermedades infecciosas
y microbiología clínica. 34(3):14-18.
Romero-Morelos, P., Bandala, C., Jiménez-Tenorio, J., Valdespino-Zavala, M.,
Rodríguez-Esquivel, M., Gama-Ríos, R. A., ..., and López-Romero, R. (2019). Bacterias
relacionadas con vaginosis bacteriana y su asociación
a la infección por virus del
papiloma humano. Medicina
Clínica. 152(1): 1-5.
Santos,
F. R., Casado, M. P. y Méndez, J. O., Martínez, M. V., Jiménez, A. D y Cordoví, A. L. (2017). Efectividad del sistema de
puntuación de Nugent en el diagnóstico de vaginosis bacteriana.
Archivo Médico
de Camagüey. 21(6):729-739.
Tafner, C., Marconi, C., Garcia, C., Cassamassimo, M.,
Oliveira, A., Cunha, M., and Guimarães-da-Silva, M.
(2015). Bacterial vaginosis
in pregnant adolescents: proinflammatory cytokine and bacterial sialidase profile. Cross-sectional study. São Paulo Medical Journal.
133(6): 465-470.
van-Den-Munckhof, E.
H., van-Sitter, R. L., Boers, K. E., Lamont, R. F., te-Witt, R., le-Cessie,
S., ..., and Leverstein-van-Hall, M. A. (2019). Comparison of Amsel criteria, Nugent score, culture
and two CE-IVD marked quantitative real-time PCRs with microbiota analysis for the
diagnosis of bacterial vaginosis.
European
Journal of Clinical Microbiology & Infectious Diseases. 38(5): 959-966.