Caracterización de bacterias ácido lácticas con actividad antimicrobiana aisladas del queso crema de Chiapas, México
Characterization
of lactic acid bacteria with antimicrobial activity isolated from cream cheese
from Chiapas, Mexico
Bacterias lácticas con
actividad antimicrobiana
Arnoldo Wong-Villarreal1*, Hipólito Corzo-González1, Emanuel Hernández-Núñez2, Avel
González-Sánchez3,
Germán Giacomán-Vallejos3
*Correspondencia: wova79@hotmail.com/Fecha de recepción: 18 de septiembre de 2019/Fecha de aceptación: 24 de agosto de 2020/Fecha de publicación:
1Universidad Tecnológica de la Selva, División
Agroalimentaria, carretera Ocosingo-Altamirano km 0.5, Ocosingo, Chiapas,
México, C. P. 29950. 2Centro de Investigaciones y de Estudios
Avanzados del Instituto Politécnico Nacional, Departamento de Recursos del Mar,
Unidad Mérida,
Mérida, Yucatán, México. 3Universidad
Autónoma de Yucatán,
Facultad de Ingeniería,
Laboratorio de Ingeniería
Ambiental, Mérida, Yucatán,
México.
Resumen
El queso crema de Chiapas es un producto artesanal
fabricado en diferentes regiones de México. La capacidad de las bacterias
lácticas, de producir grandes cantidades de ácido láctico y acético, tiene como
efecto la disminución del pH, considerado uno de los factores primarios en la
inhibición de microorganismos indeseables, como patógenos y bacterias
coliformes, en alimentos lácteos. El objetivo de este trabajo fue aislar
bacterias ácido lácticas y evaluar su efecto antagónico contra bacterias
patógenas in vitro y contra patógenos presentes en la leche cuando se
adicionan durante la elaboración del queso crema. Se aislaron cepas de
bacterias lácticas del queso crema de Chiapas, México. Los aislados fueron
identificados mediante pruebas bioquímicas API 50CH y secuencias del gen
ribosomal 16S. Las bacterias de interés se usaron en pruebas de inhibición del
crecimiento con cepas patógenas. Se cuantificó la producción de ácido acético y láctico por cromatografía de gases
acoplado a masas en los quesos, al inicio y a los 10 d posteriores a su elaboración.
Se aislaron 203 cepas bacterianas, de las
cuales 82 tuvieron la capacidad de inhibir el crecimiento de 7 cepas bacterianas patógenas. Las cepas
fueron identificadas por la secuencia parcial del gen ribosomal 16S como
pertenecientes al género Lactobacillus; la adición de estas cepas en la elaboración
del queso crema redujo o eliminó coliformes,
Staphylococcus aureus, mohos y levaduras, mientras que en el queso elaborado con leche pasteurizada se detectaron
290 UFC/mL de mohos y levaduras. Estos
resultados sugieren que las cepas de Lactobacillus aisladas del
queso crema artesanal de Chiapas tienen potencial para su uso como cultivo
iniciador con actividad de bioconservación en este y productos similares.
Palabras clave: queso artesanal, ácido láctico, ácido acético, Listeria
monocytogenes, bioconservador.
Abstract
Chiapas cream cheese is an artisanal product
manufactured in different regions of Mexico. The ability of lactic bacteria to
produce large amounts of lactic and acetic acid has the effect
of decreasing the pH, considered one of the primary
factors in the inhibition of undesirable microorganisms such as pathogens and
coliform bacteria, in dairy foods. The objective of this work was to isolate
lactic acid bacteria and evaluate their
antagonistic effect against pathogenic
bacteria in vitro, as well as their effect against pathogens that are present in milk when they are added in the preparation of cream cheese. Strains of lactic bacteria were isolated from cream cheese from Chiapas, Mexico. Isolates were
identified by API 50CH biochemical tests and 16S ribosomal gene sequences. The bacteria under study were used in pathogen growth
inhibition tests. The production of acetic and lactic acid was quantified by gas chromatography coupled to masses in the
cheeses at the beginning and 10 d after its elaboration. 203 bacterial strains were isolated, 82 of which had the ability to inhibit the growth of 7 pathogenic
bacterial strains. The strains were identified by the partial
sequence of the 16S ribosomal gene as belonging to the genus Lactobacillus;
The addition of these strains in the
elaboration of cream cheese reduces or eliminates coliforms, Staphylococcus
aureus, molds and yeasts, while in the cheese made with pasteurized milk
290 CFU/mL of molds and yeasts were
detected. These results suggest that Lactobacillus
strains isolated from Chiapas artisanal cream
cheese has the potential to be used as a starter culture with
bioconservation activity in
this and similar
products.
Keywords: artisan cheese, lactic acid, acetic
acid, Listeria monocytogenes, bioconservative.
Introducción
El queso crema de Chiapas
es un producto artesanal fabricado en las regiones norte, Frailesca y costa del estado. Forma parte de la
dieta básica y constituye una actividad económica
para muchas familias chiapanecas. Su sabor, textura y calidad han
logrado que sea reconocido como un signo
distintivo de la gastronomía chiapaneca y de la identidad cultural de sus habitantes (Culebro y col., 2014).
También es uno de los quesos
artesanales de México que tiene marca
colectiva y potencial para obtener
una denominación de origen protegida
(González y col., 2016). Las características
físicas, químicas y microbiológicas del queso varían dependiendo de la región donde se produce (González y
col., 2016). Se obtiene a través de la coagulación ácido-enzimática prolongada de la leche cruda de vaca y
tiene características sensoriales únicas, debido a las bacterias ácido lácticas
(BAL) endógenas de la leche de cada región
(Villegas-de-Gante y Cervantes-Escoto,
2011; González y col., 2016). Se ha
reportado la identificación por
electroforesis en gel desnaturalizante en gradiente (DGGE, por sus siglas en inglés: Denaturing Gradient Gel Electrophoresis) y secuencia
del gen ribosomal 16S de los géneros Lactobacillus, Streptococcus y Lactococcus
en este tipo de queso (González y col., 2016).
La capacidad de producir
ácidos orgánicos por la fermentación de los carbohidratos presentes y la consecuente disminución del pH son
los factores primarios en los que basan su actividad
antimicrobiana las bacterias lácticas (Heredia
y col., 2017). Sin embargo, su complejo
sistema antagonista no se limita a la producción de ácidos, sino que también participan activamente otros
metabolitos inhibitorios que, a pesar de ser sintetizados en menor cantidad,
contribuyen significativamente a los fenómenos de antibiosis. Entre ellos cabe destacar
la producción de peróxido de hidrógeno (H2O2) y otros
derivados del metabolismo del oxígeno (O2), dióxido de carbono (CO2),
compuestos aromáticos (diacetilo, acetaldehído),
derivados deshidratados del glicerol (reuterina),
benzoato, enzimas bacteriolíticas, bacteriocinas
y antibióticos, que tienen potencial
considerable para la bioconservación en la industria
alimentaria y para terapia humana como posibles complementos o
sustitutos de los antibióticos utilizados en la actualidad (Heredia y col., 2017; Radaic y col., 2020). Las BAL
son microorganismos empleados como cultivos iniciadores,
debido al papel que desempeñan en la producción de ácido láctico y la
inhibición del desarrollo de patógenos (Cobo y col., 2019).
El objetivo del presente
trabajo fue aislar bacterias ácido lácticas y evaluar su efecto antagónico
contra bacterias patógenas in vitro, así como cuando son adicionadas en
la elaboración del queso crema.
MATERIALES
Y MÉTODOS
Muestreo y aislamiento de BAL de queso en la región de Chiapas,
México
Se
colectaron 9 muestras en cada uno de los 8 municipios incluidos en el estudio, considerando 3 quesos de 3 diferentes productores, para
un total de 72 muestras. Los municipios donde se obtuvieron fueron
Ocosingo (16°54´17´ N; 92°05´40´´ W), Palenque (17°30´36´´ N; 91°58´53´ W),
Cintalapa (16°41´52´´ N; 93°43´13´´ W), Villaflores (16°14´00´´ N;
93°16´09´´ W), Villa Corzo (16°11´00´´ N;
93°16´00´´ W), Rayón (17°12´03´´ N; 93°00´42´´ W), Solosuchiapa (17°25´41´´ N;
93°01´55´´ W) y Pijijiapan (15°41´7´´ N; 93°12´44´´ W), de Chiapas, México. Las muestras se transportaron
al laboratorio en hielera y se almacenaron a
4 ºC en un refrigerador (Torrey, R36L,
Nuevo León, México). Después se homogenizaron usando el equipo Stomacher
a 230 rpm y 30 °C (Lab Blender, England);
10 g de queso se diluyeron en
90 mL de solución salina de buffer de
fosfatos. Posteriormente, 1 mL de la solución
obtenida fue inoculada en cajas Petri que contenían medio de cultivo
agar Man, Rogosa, Sharpe (MRS, Difco,
Madrid, España); cada muestra se
inoculó por triplicado y fueron
incubadas a 30 °C por 48 h en anareobiosis.
Del crecimiento microbiano obtenido se seleccionaron 3 colonias por cada
muestra, con base en su morfología circular
e irregular, bordes ondulados y lisos, superficies convexas, de
colores opacos, blancos, cremosos, tinción Grampositiva y su reacción negativa
a la prueba de catalasa y peroxidasa; estas son características morfológicas y bioquímicas de las BAL (Vázquez y col., 2018). En total se obtuvieron 216
colonias correspondientes a 3 colonias de las
9 muestras para cada uno de los 8 municipios.
Actividad
bactericida de las
cepas
La actividad bactericida
se determinó conforme al método de botón, reportado por Lewus y col. (1991). Primero se obtuvieron cultivos
puros de cada cepa candidata a BAL en medio
líquido MRS, incubados a 30 °C durante 18 h.
Se adicionaron 10 mL del medio MRS (Difco, Madrid,
España) (0.8 % de agar) en cada caja Petri, se dejaron gelificar y se
colocaron 2 mL
del cultivo puro de cada BAL. Las cajas Petri se incubaron a 30 °C durante 18
h. Posteriormente se utilizaron 8 mL del medio MRS, adicionando 20 mL de las cepas
patógenas Listeria monocytogenes (ATCC 19115), Salmonella enterica var.
Typhimurium (ATCC 14028), Escherichia coli O157:H7, Staphylococcus
epidermidis (ATCC 12228), Pseudomonas aeruginosa (ATCC 27853), Shigella
flexnerii (ATCC 12022) y Staphylococcus aureus (ATCC 25923) en una concentración de
108 UFC/mL. Cada cepa patógena fue inoculada y analizada de manera
independiente de las otras. Las cepas patógenas fueron provistas por del Dr.
Javier Castro Rosas, de la Universidad Autónoma de Hidalgo. Las cajas fueron
incubadas a 30 °C por 18 h. El efecto antibacteriano se detectó por la
presencia de halos de inhibición alrededor de las cepas ácido lácticas. Se
seleccionaron las cepas que presentaron efecto inhibitorio contra las 7 cepas
patógenas, descartando las que inhibieron solo a algunas de ellas.
Agrupación
genética BOX-PCR
Las
cepas seleccionadas con actividad antagonista contra las 7 cepas
bacterianas patógenas fueron
agrupadas mediante perfiles genéticos generados por BOX-PCR, el cual fue amplificado usando el oligonucleótido BOXA1R
(CTACGGCAAGGCGACGCTGACG). Las condiciones
de amplificación fueron las siguientes:
95 °C por 5 min y luego 35 ciclos de 95 °C por 1 min, 63 °C durante 1
min y 72 °C durante 3 min y un ciclo de
elongación final durante 10 min a 72 °C (Versalovic y col., 1991). Se
construyó una matriz binaria con los perfiles genéticos obtenidos por BOX-PCR
de las cepas según el método UPGMA, utilizando el coeficiente de Jaccard con corte al 70 %.
Secuenciación del gen ribosomal 16S rARN
Para la identificación de
las cepas se realizó la extracción del ADN genómico de los aislados seleccionados con base en los perfiles
genéticos por BOX-PCR, empleando el kit ZR Fugal/Bacterial
DNA Miniprep™. Posteriormente se amplificó por PCR el gen ribosomal 16S utilizando
los oligonucleótidos rBAL y fBAL (Ramos y col., 2009). Los productos de amplificación obtenidos de ~ 658 nucleótidos fueron purificados con el kit GeneJET (Thermo Scientific)
y enviados para secuenciación a la unidad de secuenciación del Instituto de
Biotecnología de la Universidad Nacional Autónoma
de México. Las secuencias del gen ribosomal 16S fueron alineadas con el
programa CLUSTALW (Thompson y col., 1994).
Para detectar la similitud con especies del género Lactobacillus
se usó el algoritmo de herramienta básica de
búsqueda de alineación local (BLAST, por sus siglas en inglés: Basic
Local Alignment Search Tool) en la base de
datos de nucleótidos del Gen bank.
Caracterización
bioquímica de las
BAL
Una cepa de cada perfil
genético obtenido por BOX-PCR fue cultivada en el medio MRS, para la
caracterización bioquímica con API 50CH (bioMerieux).
Árbol filogenético
Para la construcción del
árbol filogenético se usó un fragmento de las secuencias del gen 16S ribosomal a fin de confirmar la identidad
de los aislamientos al nivel de género
mencionado. El árbol filogenético fue construido con el método
neirghbor-joining (Saitou y Nei, 1987), empleando ~ 658 nucleótidos de acuerdo a la matriz de distancia de Jukes y Cantor (1969), utilizando el programa MEGA versión 7 (Tamura
y col., 2016).
Elaboración de queso crema en condiciones controladas de
laboratorio
La
elaboración del queso crema fue de manera artesanal y este proceso se realizó
dos veces. Los tratamientos fueron los siguientes: leche pasteurizada (63 °C por 30 min),
leche cruda de vaca y leche
cruda de vaca acidificada con las cepas de Lactobacillus
(CO42) y la mezcla de Lactobacillus (P47, VF17) en una concentración de 108 UFC/mL. Las cepas utilizadas
(como cultivos iniciadores) para la elaboración del queso crema fueron seleccionadas con base en la compatibilidad entre cepas lácticas, que consiste en realizar
pruebas de antagonismo. Por cada 10 L de leche se adicionó 1 mL de cuajo (1:10 000 v/v) y se dejó reposar 18 h (pH 4.9 a 5.3). La
cuajada fue cortada y se dejó escurrir 12
h a 4 ºC; se le agregó sal de mesa en una proporción del 4 % p/v; se prensó durante 4 h, se
empaquetó en papel de polietileno y se
almacenó a 4 ºC durante 10 d, para
sus análisis posterior.
Análisis
microbiológico del queso
crema
Las
muestras del queso crema fueron analizadas por triplicado para la determinación
microbiológica de rutina:
mohos y levaduras mediante la Norma Oficial Mexicana (NOM-111-SSA1-1994), bacterias coliformes por el método
del número más probable (NMP) mediante la NOM-112-SSA1-1994, coliformes totales en placas de acuerdo a la NOM-113-SSA1-1994, Salmonella mediante la NOM-114-SSA1-1994 y Staphylococcus aureus
con el método marcado por la NOM-115-SSA1-1994.
Extracción de ácido láctico y acético
del queso crema
Se
tomaron muestras de los quesos elaborados con leche pasteurizada, leche no
pasteurizada y leche adicionada con las bacterias ácido lácticas para la
cuantificación de ácido láctico y ácido acético. Las muestras fueron colectadas
en dos etapas: la primera el día 0, correspondiente al día de la elaboración del
queso, y la segunda 10 d después de su elaboración. La extracción se realizó
conforme a lo reportado por Ramírez
y col. (2009), donde 5 g de queso
fueron colectados de cada tratamiento y colocados en 10 mL de agua ultrapura estéril y homogenizados; posteriormente,
centrifugados 40 min a 6 000 xg.
Preparación de las muestras y condiciones cromatográficas
Las muestras se filtraron
con filtros de celulosa regenerada hyper-clean® (0.45 mm) y después
se diluyeron en acetona grado HPLC (1:4). La cuantificación del ácido láctico y acético se realizó en un cromatógrafo de gases (Thermo scientific,
Trace GC Ultra, Massachusetts, USA) acoplado al espectrómetro de masas (Thermo scientific, ITQ 900,
Massachusetts, USA). Los compuestos se separaron usando una columna capilar (TR-5MS 30 m x 0.25 mm ID x 0.25 mm, Thermo
Scientific). Las condiciones cromatográficas fueron las siguientes: el gas portador fue helio, con un flujo de 1.1 mL/min;
puerto de inyección a 200 °C en modo sin división. El programa de temperatura
del horno se mantuvo a 50 °C durante 2 min, luego se elevó a 10 °C/min a 290 °C y se mantuvo durante 1 min.
La temperatura de la línea de transferencia CG-MS
fue de 270 °C. El espectrómetro MS
(Thermo scientific, Trace GC Ultra,
Massachusetts, USA) funcionaba en modo de exploración completa (3 exploraciones/s) en un rango de m/z
35 a 200. La ionización se realizó mediante energía de impacto de electrones a
70 eV y la temperatura de la fuente de iones
se mantuvo a 200 °C. Los compuestos se
identificaron con base en la comparación de espectros de masas, con los contenidos en la biblioteca NIST 2.0, y en comparación con los tiempos de retención
de los estándares de alta pureza.
Análisis estadístico
Se realizó un análisis de
varianza de los datos, complementada con un análisis por comparaciones
múltiples de Tukey, a una significancia de P
≤ 0.05, para determinar las diferencias entre las muestras de estudio. Se
utilizó el paquete estadístico Sistema de Análisis Estadístico (SAS, por sus
siglas en inglés: Statistical Analysis
System) (SAS, 2016)
versión 9.4.
RESULTADOS
Aislamiento de bacterias
ácido lácticas
A
partir de las 72 muestras del queso crema colectadas en los diferentes municipios del estado
de Chiapas, México, se aislaron un total de 203 colonias candidatas a BAL en el
medio de cultivo MRS.
Evaluación
bactericida de cepas
De las 203 cepas seleccionadas como
candidatas de BAL, se detectó que 82 tienen la capacidad de inhibir el
crecimiento de las 7 cepas patógenas: Listeria monocytogenes (ATCC 19115), Salmonella enterica var. Typhimurium
(ATCC 14028), Escherichia coli
O157: H7, Staphylococcus
epidermidis (ATCC 12228), Pseudomonas
aeruginosa (ATCC 27853), Shigella
flexnerii (ATCC 12022) y Staphylococcus aureus (ATCC
25923) (Tabla 1). Se obtuvieron 121 cepas que inhibieron al menos un patógeno
(datos no mostrados).
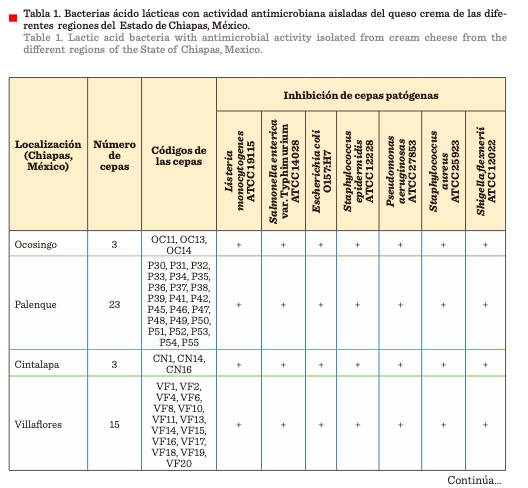
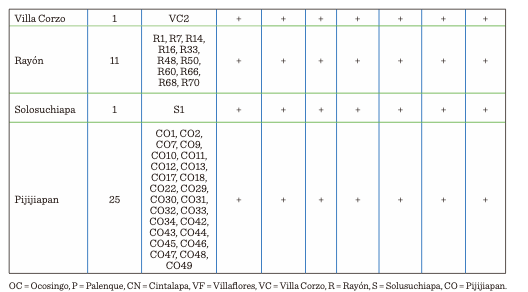
BOX–PCR
Los productos de
amplificación de las 82 cepas aisladas,
analizadas mediante BOX-PCR, generaron huellas genómicas compuestas por fragmentos que varían en tamaño de 100 a 900
pares de bases. Se encontraron 10 cepas que
presentaron perfiles idénticos a otras (VF4, R1, R70, S1, CO44, CO45,
CO46, CO47, CO48, CO49), por lo que no fueron consideradas en el dendograma que
se muestra en la Figura 1, estructurado con
72 cepas, las cuales puede observarse que formaron 10 grandes grupos.
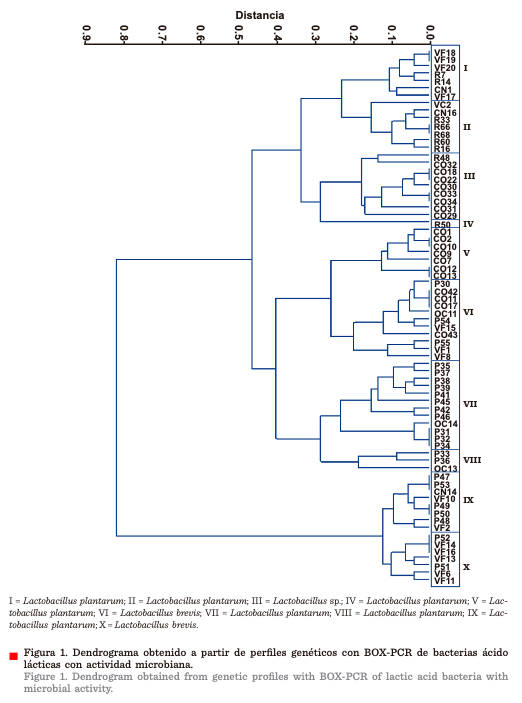
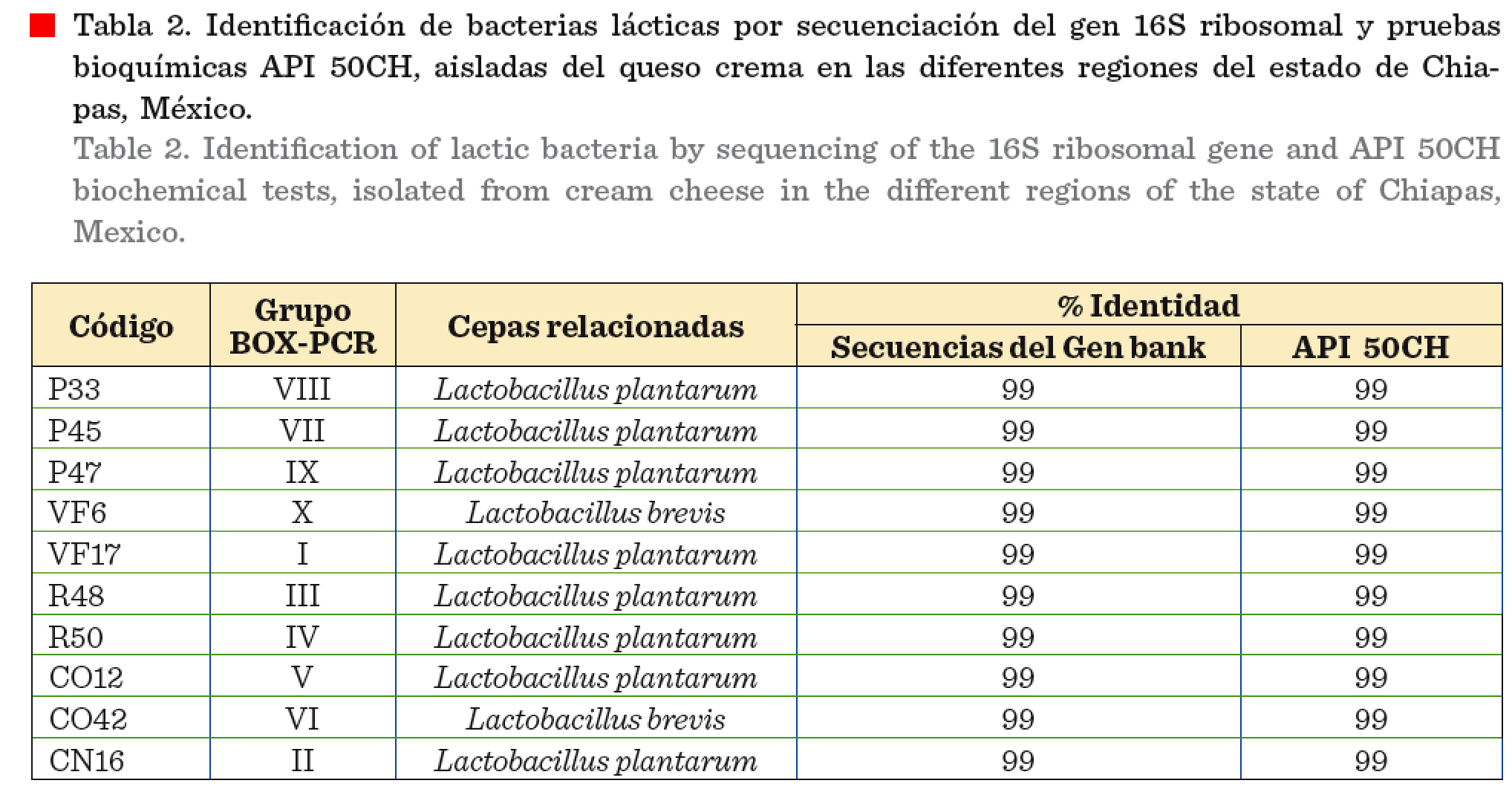
Secuenciación del gen 16S de las cepas BAL
En cada uno de los 10
grupos del dendograma se seleccionó una cepa representativa, a la que se le
realizó el análisis de las secuencias del gen 16S ribosomal. Estas cepas
mostraron una similitud del 99 % con especies
del género Lactobacillus (Tabla 2).
Caracterización bioquímica de las cepas de BAL
Los
microensayos API 50CH de las cepas BAL seleccionadas de
los 10 grupos obtenidos por perfiles genéticos y secuenciadas (Figura 1)
mostraron el perfil metabólico de
carbohidratos que corresponde al
género Lactobacillus (Tabla 1), en concordancia con los
resultados de las secuencias del gen 16S ribosomal.
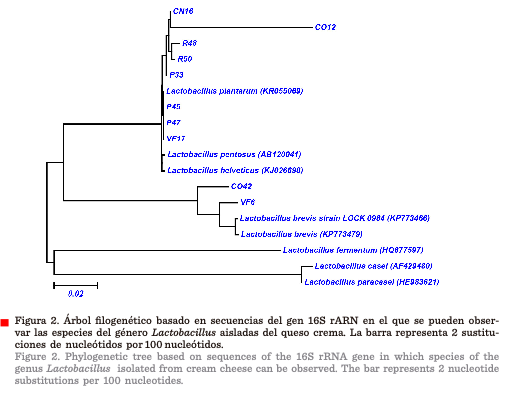
Árbol filogenético
El análisis del árbol
filogenético confirmó que las cepas CO42 y VF6 están genéticamente relacionadas con Lactobacillus brevis,
mientras que las cepas P33, P45, P47, VF17, R48, R50, CO12 y CN16 se
encuentran relacionadas con Lactobacillus
plantarum (Figura 2
y Tabla 2).
Análisis
microbiológico del queso
crema
En los
análisis microbiológicos realizados a los tratamientos del queso crema
elaborado con leche pasteurizada, leche no pasteurizada, leche inoculada con las cepas de Lactobacillus
(CO42) y mezcla de Lactobacillus (P47, VF17) no se detectó la presencia
de coliformes totales, Staphylococcus aureus, mohos o levaduras. Sin embargo, en los quesos elaborados con leche no pasteurizada y pasteurizada se
encontraron, respectivamente, 1 200 UFC/mL y 290 UFC/mL de levaduras y
mohos.
Cuantificación
del ácido láctico
No se
observó diferencia significativa (P ≤ 0.05) en el contenido de ácido láctico el
día 0 en los tratamientos del queso crema elaborado con leche no pasteurizada e
inoculado con las cepas de Lactobacillus
(CO42) y la mezcla de Lactobacillus (P47, VF17) (Tabla 3), mientras que en el
queso elaborado con leche pasteurizada se encontró
menor contenido de ácido láctico inicial (P ≤ 0.05) (Tabla 3). Con
respecto al contenido de ácido láctico en las
muestras de 10 d de almacenamiento
posteriores a su elaboración, se encontró
diferencia significativa (P ≤ 0.05) en el contenido de ácido láctico en
el queso crema donde se inocularon las cepas
de Lactobacillus en relación con los tratamientos del queso crema elaborado con leche pasteurizada y no pasteurizada (Tabla 3). El contenido de ácido láctico después de 10 d fue mayor en los tratamientos de los quesos donde se inocularon las cepas de Lactobacillus que en los
de quesos elaborados con leche
pasteurizada y no pasteurizada (Tabla 3).
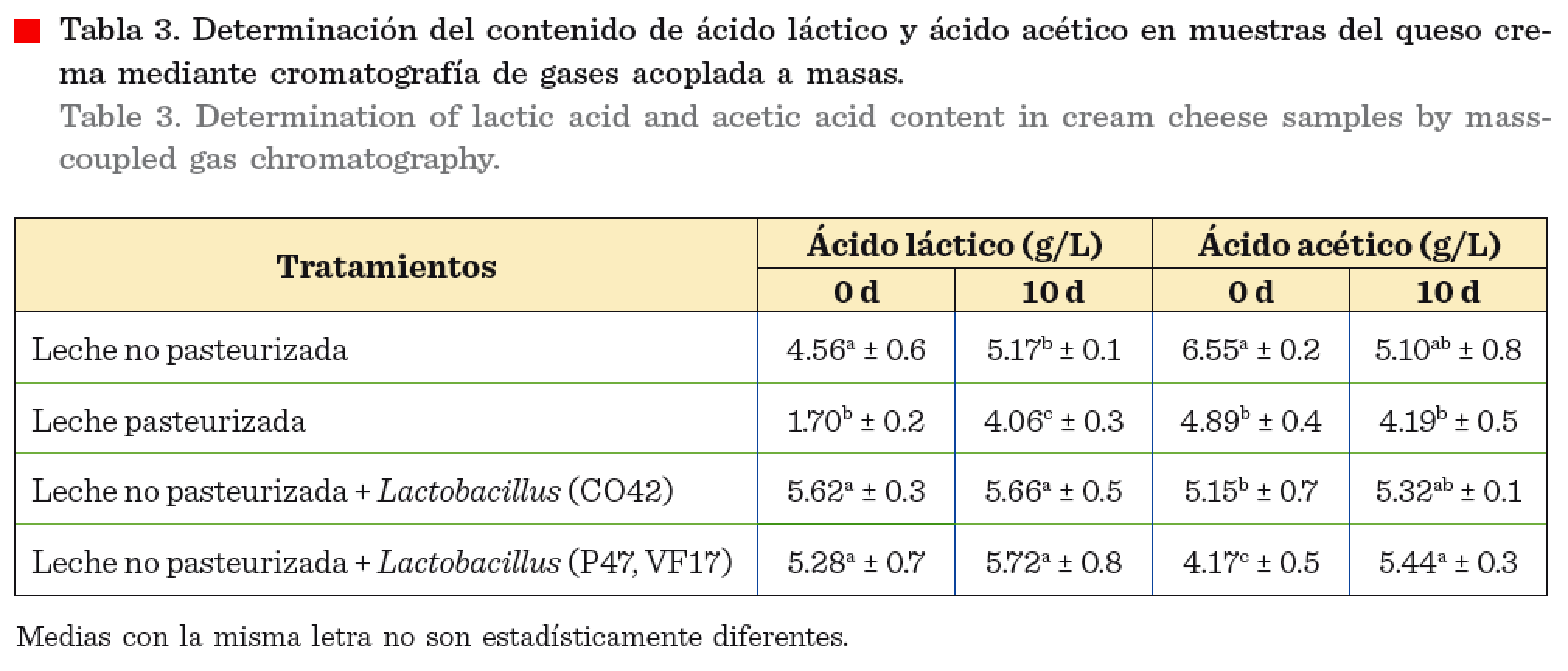
Cuantificación
del ácido acético
Se
observaron diferencias significativas (P ≤ 0.05) en el contenido de ácido acético de los quesos. En el
día 0 el queso elaborado con leche no pasteurizada presentó mayor contenido de
ácido acético que el queso obtenido con leche no pasteurizada con la adición de
la mezcla de Lactobacillus (P47, VF17), que presentó el menor valor. A
los 10 d, este último queso fue el que presentó mayor contenido de ácido
acético, superior al obtenido con leche pasteurizada (P ≤
0.05).
DISCUSIÓN
Un
total de 82 cepas puras, seleccionadas de las 203 cepas candidatas a BAL, presentaron
efecto de inhibición del crecimiento de 7 cepas bacterianas patógenas (Tabla 1). Este efecto antagónico contra microorganismos patógenos también fue reportado por Zapata y col. (2009) en Lactobacillus
plantarum, que inhibió el
cre-cimiento de Salmonella tiphy (ATCC 6539), Escherichia coli, Listeria monocytogenes y Staphylococcus
aureus. Dicha
actividad microbiana también ha sido registrada por Rivera y col. (2017), donde cepas
de Leuconostoc spp y Lactococcus lactis, aisladas de queso artesanal, inhibieron el crecimiento de Salmonella enterica
var. Typhimurium. Los 10 perfiles agrupados de huellas genómicas por
BOX-PCR obtenidos de las 82 cepas con
actividad antimicrobiana muestran
diversidad de las BAL en el queso crema producido en las diferentes
regiones del estado de Chiapas (Figura 1).
Las pruebas bioquímicas
API 50CH y las secuencias del gen 16S
ribosomal de las 10 cepas que representan a los grupos obtenidos por BOX–PCR
mostraron similitud del 99 % con especies de Lactobacillus
plantarum y brevis (Tabla 2). Sin embargo, es necesario utilizar
otro marcador molecular, el gen rpoB, para confirmar a nivel de especie. En el árbol filogenético se puede observar
que las cepas CN16, CO12, R48, R50,
P33, P45, P47 y VF17 están relacionadas con Lactobacillus plantarum,
mientras que las cepas CO42 y VF6
tienen relación con Lactobacillus brevis (Figura 2). Este género bacteriano también ha sido aislado de los
quesos bola, cotija y doble crema, elaborados
en las diferentes regiones de México, donde ha sido reportado que restaura las
características sensoriales del queso cuando es elaborado con leche
pasteurizada, así como también está involucrado
en el proceso de maduración (Vázquez y col., 2018; Cobo y col., 2019).
El efecto de la inhibición
del crecimiento de las cepas patógenas por Lactobacillus
puede estar relacionado con la producción de los ácidos orgánicos, como lo
documentó Gao y col. (2019), donde el bajo contenido de ácido láctico afecta la
inhibición de patógenos. Este efecto también se reporta en Lactobacillus
brevis P68 y PS1, las cuales, en pH ácido originado por la producción de ácidos orgánicos, inhibieron el crecimiento de especies del género Fusarium
(Mauch y col., 2010; Valan y col., 2015).
El efecto de la inhibición
del crecimiento microbiano en los quesos elaborados con las cepas de Lactobacillus,
evaluado 10 d después de su elaboración,
puede estar relacionado con el mayor
contenido de ácido láctico y acético que se detectó, ya que la producción
de estos ácidos orgánicos es un
mecanismo de las BAL para la
inhibición de otros microorganismos. Esta característica metabólica ha sido
utilizada como un método biotecnológico de conservación de algunos alimentos,
para incrementar su vida útil (Gao y col., 2019). Por lo contrario, el contenido de ácido láctico fue considerablemente
menor en el queso elaborado con leche pasteurizada (Tabla 3); esta disminución puede estar relacionada con la pérdida de
microorganismos durante el proceso de pasteurización (Alegría y col.,
2016), debido a que este proceso no solo elimina microorganismos patógenos, sino que también reduce significativamente
la microbiota nativa de la leche, lo
que puede afectar la producción de ácidos
orgánicos, así como otras sustancias con actividad antimicrobiana, como
enzimas bacteriolíticas, bacteriocinas, compuestos aromáticos y antibióticos.
Por otro lado, un aumento en este metabolito puede modificar la población de BAL y otros microorganismos (Martínez
y col., 2016). También se puede esperar que cuando se eliminan cepas autóctonas de la
leche por el proceso de pasteurización, pueden afectarse las
características organolépticas del queso, ya que las bacterias ácido lácticas son responsables de producir metabolitos que
definen estas características en los quesos artesanales, como lo han reportado
Alegría y col. (2016) y Sacristán y col. (2016). Debido a estas
características, las cepas de Lactobacillus
evaluadas podrían ser utilizadas como cultivos iniciadores en la elaboración del queso crema, las cuales serían adicionadas posteriormente al proceso de pasteurización, contribuyendo así a que los quesos elaborados mediante este procedimiento
puedan mantener sus características
organolépticas (las cuales no fueron
evaluadas en este estudio), que es lo que aprecian los consumidores de los quesos artesanales;
y, al mismo tiempo, que contribuya a cumplir
con la NOM-121-SSA1-1994, que
establece que, para la fabricación de queso, la leche debe pasteurizarse (Vázquez y col., 2018). Otra aplicación
que podrían tener estas cepas es la biopreservación de alimentos, con el
objetivo de garantizar la inocuidad
microbiológica, como lo reportan
Di-Gioia y col. (2016), quienes evaluaron
la capacidad de las BAL de eliminar Clostridium en carne
fermentada. Por lo tanto, las 3 cepas bacterianas ácido lácticas que tuvieron
la capacidad de eliminar a los microorganismos patógenos del queso crema
podrían ser utilizadas en el proceso de
biopreservación de alimentos (Di-Gioia y col., 2016; Da-Costa y col.,
2019).
CONCLUSIONES
Se aislaron 203 cepas del
queso crema de las regiones productoras del
estado de Chiapas, de las cuales, 82 tuvieron un efecto antimicrobiano contra 7 cepas bacterianas patógenas, así
también, mostraron esta actividad cuando fueron
adicionados en la elaboración del queso crema, eliminando Staphylococcus
aureus, mohos y levaduras, mientras que en el queso elaborado con leche pasteurizada se detectaron 290 UFC/mL de mohos y levaduras. Estas cepas están
relacionadas genéticamente con Lactobacillus plantarum y Lactobacillus
brevis. El contenido de ácido láctico y acético fue mayor en los
quesos a los que se adicionaron las cepas de Lactobacillus
CO42 y Lactobacillus P47 y VF17. Los resultados sugieren que estas últimas cepas de Lactobacillus aisladas del
queso crema artesanal de Chiapas
tienen potencial para su uso como cultivo iniciador con actividad de bioconservación en este y productos similares,
lo que permitiría estandarizar la calidad del
queso comercial que se produce en la región.
AGRADECIMIENTOS
Los autores agradecen el
apoyo del Programa para el Desarrollo
Profesional Docente (PRODEP) y a la Secretaría de Educación Pública (SEP) de
México por el financiamiento para el desarrollo del proyecto de
investigación “Potencial Biotecnológico de
la Microflora Asociada al Queso Crema
de las Diferentes Regiones del Estado de Chiapas”.
Referencias
Alegría,
A., González, P., Delgado, S., Flórez, A. B., Hernández, B. A., Rodríguez, A.,
and Mayo, B. (2016). Characterization
of the technological behavior of mixtures of mesophilic lactic acid bacteria
isolated from traditional cheeses made of raw milk without added starters. International Journal
of Dairy Technology. 69(4): 507-519.
Cobo, R., Rosas, R., Gálvez, D., Adriano, L. y
Vázquez, A. (2019). Bacterias ácido lácticas nativas como
cultivo iniciador para la elaboración de queso crema mexicano. Agronomía Mesoamericana. 30(3): 855-870.
Culebro,
M., Jiménez, A., Ortiz, M. y León, H. (2014). El queso crema Chiapas. Una
historia que nos identifica. México: Universidad Autónoma de Chiapas,
Unidad de Divulgación Científica. 35-41
Pp.
Da-Costa,
J. R., Voloski, S. L., Mondadori, G. R., Duval, H. E., and
Fiorentini, M. A. (2019). Preservation of meat
products with bacteriocins produced by lactic
acid bacteria isolated from meat. Journal of Food Quality. 1-12.
Di-Gioia, D., Mazzola, G., Nikodinoska, I., Aloisio,
I., Langerholc, T., Rossi, M., and Rovira, J. (2016). Lactic acid bacteria as protective cultures in fermented
pork meat to prevent Clostridium spp. Growth. International Journal
of Food Microbiology. 235: 53-59.
Gao, Z, Daliri, E. B., Wang, J., Liu, D., Chen, S.,
Ye, X., and Ding, T. (2019). Inhibitory effect of lactic acid bacteria on
foodborne pathogens: A Review. Journal of Food Protection. 82(3):
441-453.
González, A. F., Yescas, C., Ortiz, E. A., De-la-Rosa,
A. M., Mendoza, H. A., and Vallejo, C. B. (2016). Invited
review: Artisanal Mexican cheeses. Journal
of Dairy Science. 99(5): 3250-3262.
Heredia, P., Hérnández, A., González, A. y Vallejo, B.
(2017). Bacteriocinas de bacterias ácido lácticas: mecanismos de acción y actividad antimicrobiana contra
patógenos en quesos.
Interciencia. 42(6): 340-346.
Jukes, T. H. and Cantor, C. R. (1969). Evolution of protein
molecules. In H. N. Munro (Ed.), Mammalian protein metabolism (pp 21-23). New York: Academic Press. Inc.
Lewus, C. B., Kaiser A., and Montville, T. J. (1991). Inhibition
of food-borne bacterial pathogens by bacteriocins
from lactic acid bacteria isolated from meat. Applied Environmental. Microbiology. 57(6): 1683-1688.
Martínez,
V., Moral-Ventura, S. T. D., Sachman, B., Ramírez, L. y García, M.
(2016). Dinámica poblacional y aislamiento
de bacterias ácido lácticas en lactosuero fermentado. Nova Scientia. 8(17): 326-339.
Mauch, A., Dal-Bello, F., Coffey, A., and Arendt, E.
K. (2010). The use of Lactobacillus brevis PS1 to in vitro
inhibit the outgrowth of Fusarium culmorum and
other common Fusarium species found
on barley. International Journal of
Food Microbiology. 141(1-2): 116-121.
NOM-111-SSA1-1994 (1994). Bienes y servicios. Método
para la cuenta de mohos y levaduras en alimentos.
[En línea]. Disponible en:
http://www.salud.gob.mx/unidades/cdi/nom/111ssa14.html. Fecha de consulta: 14
de marzo de 2019.
NOM-112-SSA1-1994
(1994). Bienes y servicios. Determinación de bacterias coliformes. Técnica
del número más probable. [En línea]. Disponible en: http://www.salud.gob.mx/unidades/cdi/nom/112ssa14.html.
Fecha de consulta: 14 de
marzo de 2019.
NOM-113-SSA1-1994
(1994). Bienes y servicios. Método para la cuenta de mohos y levaduras en
alimentos. [En línea]. Disponible en: http://www.salud.gob.mx/unidades/cdi/nom/113ssa14.html. Fecha de consulta: 14 de
marzo de 2019.
NOM-114-SSA1-1994
(1994). Bienes y servicios. Determinación de Salmonella en alimentos.
[En línea]. Disponible en:
http://www.salud.gob.mx/unidades/cdi/nom/114ssa14.html. Fecha
de consulta: 14
de marzo de
2019.
NOM-115-SSA1-1994
(1994). Bienes y servicios. Método
para la determinación de Staphylococcus aureus en alimentos.
[En línea]. Disponible en: http://www.salud.gob.mx/unidades/cdi/nom/115ssa14.html.
Fecha de consulta: 14 de
marzo de 2019.
NOM-121-SSA1-1994
(1994). Bienes y servicios. Quesos: Frescos, Madurados y Procesados.
Especificaciones Sanitarias. [En línea]. Disponible en: www.salud.gob.mx/unidades/cdi/nom/121ssa14. Fecha de consulta: 14 de marzo de 2019.
Radaic,
A., de-Jesus, M. B., and Kapila, Y. L. (2020). Bacterial antimicrobial peptides and nano-sized drug
delivery systems: The state of the art toward improved bacteriocins. Journal of Controlled
Release. (321): 100-118.
Ramírez, N. L., Wacher, R. M. y Pérez C. M. (2009). Producción de metabolitos
y pruebas de actividad antagónica de bacterias lácticas termotolerantes
aisladas de productos cárnicos. Nacameh. 3(1): 33-47.
Ramos,
B., Bucio, A., Bautista, C., Aranda, E. y Izquierdo, F. (2009).
Aislamiento, identificación y caracterización de bacterias ácido lácticas para
la elaboración de queso crema tropical. Universidad
Ciencia Trópico Húmedo.
25(2): 159-171.
Rivera,
J. F., Villegas, A., Miranda, L. y García, J. (2017). Identificación de
bacterias acidolácticas antagónicas de Salmonella enterica var. Typhimurium
aisladas de queso artesanal. Revista
Mexicana de Ciencias Agrícolas.
8(4): 785-797.
Sacristán,
N., Fernández, D., Castro, J. M., Tornadijo, M. E., and Fresno,
J. M. (2016). Effect of an autochthonous
starter culture, including lactococci and Geotrichum candidum strains,
on the ripening of a semi-hard goats milk cheese.
African Journal of Microbiology Research. 10(9): 301-311.
Saitou,
N. and Nei, M. (1987). The Neiighbor-joining method:
a new method for reconstructiong phylogenetic tres. Molecular
Biology and Evolution.
4(4): 406-425.
SAS, Statital Analysis System (2016). SAS ® version
9.4 Macro Language: Reference. Cary, NC: SAS Institute Inc.
Tamura, K., Stecher, G., Peterson, D., Filipski, A.,
and Kumar,
S. (2016). MEGA7: molecular evolutionary genetics
analysis version 7.0. Molecular Biology and Evolution. 30(12): 2725-2729.
Thompson, J. D., Higgins, D. G., and Gibson, T. J.
(1994). CLUSTAL W: improving the
sensitivity of progressive multiple
sequence alignment through sequence weighting,
position-specific gap penalties and weight matrix choice. Nucleico
Acids Research. 22(22):
4673-4680.
Valan,
M., Al-Dhabi, N. A., Rejiniemon, T. S., Lee, K. D., Huxley, V. A. J., Kim, D.
H., ..., and Choi, K. C. (2015). Identification and characterization of Lactobacillus
brevis P68 with antifungal, antioxidant and probiotic functional properties. Indian Journal of
Microbiology. 55(1): 19-28.
Vázquez,
R., Salvador, M., Adriano, M. L., DeGyves, G., and Vázquez, A. (2018). Use of
starter culture of native lactic acid bacteria for producing an artisanal
Mexican cheese safe and sensory aceptable. CyTA-Journal of Food. 16(1):
460-468.
Versalovic,
J., Koeuth, T., and Lupski, J. (1991). Distribution of repetitive DNA sequences
in eubacteria and application to fingerprinting of bacterial genome. Nucleic Acids Research. 19(24): 6823-31.
Villegas-de-Gante, A. y
Cervantes-Escoto, F. (2011). La genuinidad y tipicidad en la revalorización de
los quesos artesanales mexicanos. Estudios Sociales. 19(38): 146-164.
Zapata,
S., Muñoz, J., Ruíz, O., Montoya, O. y Gutiérrez, P. (2009). Aislamiento de Lactobacillus
plantarum LPBM10 y caracterización parcial de su bacteriocina. Vitae, Revista
de la Facultad
de Química Farmacéutica. 16(1):
75-82.