Efecto
antioxidante de la miel de abeja sobre la carne de conejo
almacenada en refrigeración
Antioxidant effect of bee honey on rabbit meat stored
under
refrigeration
Efecto
antioxidante de la miel de abeja sobre la carne de conejo
Daniel Salvador López-Velasco1,
Eliseo Sosa-Montes1*, Arturo Pro-Martínez2, Fernando
González-Cerón1,
Artemio Jovanny
Vargas-Galicia2
*Correspondencia: eliseososa@yahoo.com.mx/Fecha de recepción: 13 de noviembre de 2019/Fecha de aceptación: 27 de agosto de 2020/
Fecha de publicación: 29 de enero
de 2021
1Universidad Autónoma Chapingo, Departamento de
Zootecnia, km 38.5,
carretera México-Texcoco, Texcoco, Estado de México, México, C. P. 56230. 2Colegio
de Postgraduados, Recursos Genéticos y Productividad-Ganadería, Campus
Montecillo, Texcoco, Estado de México, México.
Resumen
La oxidación de lípidos
deteriora los alimentos, por lo que se usan antioxidantes sintéticos para disminuirla, sin embargo, estos compuestos
en exceso poseen efectos carcinogénicos. Algunas
plantas como el orégano, así como la miel de abeja, contienen
antioxidantes naturales que no dañan la salud. Hasta el momento no se han
encontrado registros del uso de la miel de abeja para disminuir la oxidación
lipídica en carne de conejos. El objetivo de este estudio fue evaluar el efecto de la miel de abeja como antioxidante
en la carne cruda de lomo de conejo almacenada en refrigeración a 4 °C. Se
evaluó la actividad antioxidante (AA) de
tres tipos de miel: oscura, ámbar y clara, para mezclarla con la carne de conejo. Se seleccionó la miel oscura por su
mayor efecto antioxidante. Se prepararon 64 muestras de 100 g de carne cruda,
32 se mezclaron con 2 g de miel oscura y las otras 32 se dejaron sin miel
(control). Las muestras se almacenaron a 4°C
y se evaluó la AA y la concentración
de malondialdehído (MDA) a los 0 d, 3 d,
6 d y 9 d de almacenamiento. La AA disminuyó y la concentración de MDA aumentó (P
< 0.05) con el tiempo de refrigeración (cambios que indican deterioro de la
carne). A los 3 d y 6 d, las muestras de carne cruda con miel exhibieron mayor AA (P < 0.05), y a los 6 d,
menores valores de MDA (P < 0.05)
comparadas con las muestras control
(indicando que no hubo deterioro de la carne). La miel oscura de abeja contiene altas concentraciones de antioxidantes naturales que protegen a la carne cruda
molida de lomo de conejo contra el daño oxidativo
que puede presentarse durante la refrigeración, por lo que se recomienda su uso
para este fin.
Palabras clave: oxidación
de lípidos, refrigeración, lomo de conejo.
Abstract
Lipid oxidation deteriorates foods; therefore, synthetic
antioxidants are used to decrease it. However,
excess synthetic antioxidants have carcinogenic
effects. Some plants such as oregano, as
well as bee honey, contain natural antioxidants which are not harmful
to health. No reports were found on the
use of bee honey to decrease lipid
oxidation in rabbit meat. The objective
of this study was to assess the effect of bee honey as antioxidant on raw
rabbit loin, refrigerated at 4 °C.
The antioxidant activity (AA)of three types of honey was evaluated: dark,
amber
and clear, to be mixed with rabbit meat. Dark honey was selected for its higher antioxidant effect. 64 samples of 100 g of raw meat were
prepared, 32 samples were mixed with 2 g
dark honey and the other 32 were left without honey (control). The samples were stored at 4 °C and AA as well as
malondialdehyde (MDA) concentrations were evaluated at 0 d, 3 d, 6 d and 9 d of storage. The AA decreased, and the MDA concentration
increased (P < 0.05) with refrigeration
time (changes that indicate meat spoilage). After 3 d and 6 d, the raw
meat samples with honey showed higher
AA (P < 0.05) and after 6 d, they showed lower MDA values (P < 0.05)
compared to the control samples (these changes
indicate no spoilage of meat). Dark
bee honey contains high concentrations of natural
antioxidants that protect ground raw rabbit loin against oxidative damage that can occur during refrigeration, therefore, its use is recommended for this purpose.
Keywords: lipid oxidation, refrigeration, rabbit loin.
Introducción
La oxidación de lípidos
deteriora los alimentos cárnicos, cuyo color y olor se alteran cuando se almacenan, causando una disminución en
la preferencia del consumidor (Alasnier y col., 2000; Carvalho y col., 2017).
Además, el proceso oxidativo produce
radicales libres a partir de ácidos
grasos poliinsaturados y finalmente malondialdehído (MDA), una molécula
que puede causar problemas de salud en humanos (Tao, 2015). En una revisión
hecha por Kumar y col. (2015) se muestra que para disminuir la oxidación de las
grasas sobre la carne, en estudios experimentales se usan antioxidantes
sintéticos como butilhidroxianisol (BHA) y butilhdroxitolueno (BHT), sustancias
que retardan o previenen la oxidación, la formación de radicales libres y el
MDA (Galano, 2015). Sin embargo, el uso de
antioxidantes sintéticos está
restringido debido a su efecto carcinogénico (Nobuyuki y Masao, 1989;
Shasha y col., 2014; Xiang y col., 2019). Por
esta razón, muchos consumidores evitan
productos alimenticios que contengan antioxidantes sintéticos (Soltani y
col., 2016; Carvalho y col., 2017). Los
antioxidantes naturales como tocoferoles, ácido ascórbico, ácidos fenólicos y
flavonoides de algunas plantas como orégano, romero y salvia (Velasco y
Williams, 2011; Ghorbani y Esmaeilizadeh, 2017; Gutiérrez-Grijalva y col.,
2018; Nieto y col., 2018) disminuyen la oxidación de la carne (Sampaio y col.,
2012) y no dañan la salud.
Se ha reportado que los
antioxidantes naturales reducen la
concentración de MDA en la carne de pollo (Sampaio y col., 2012) y en el
plasma humano (Nagyova y col., 2004). La miel de abeja tiene abundantes
flavonoides y ácidos fenólicos (Pichichero y
col., 2009; Cianciosi y col., 2018) y se ha usado como un antioxidante
natural para disminuir la oxidación de la carne de pavos, pollos y bovinos
(Antony y col., 2006; Avila-Ramos y col., 2013; Rabaa y col., 2013). Sin
embargo, la miel de abeja no se ha usado
como antioxidante en carne de conejo.
El
objetivo de este estudio fue evaluar el efecto de la miel de abeja como
antioxidante en carne cruda de
lomo de conejo almacenada en refrigeración.
MATERIALES
Y MÉTODOS
Localización del estudio y origen geográfico de las mieles
Este estudio se realizó en la estación
experimental del Colegio de Postgraduados, campus Montecillo, estado de México,
localizada a 19°29’ N, 98°53’ W y 2 250 msnm. La miel provino de Ecatzingo y
Amecameca, estado de México (mieles oscura y clara, respectivamente), y de
Jiutepec, estado de Morelos (miel ámbar).
Estas poblaciones se conocen por su alta
calidad y gran diversidad de mieles de abeja en la región central de México.
Actividad antioxidante de las mieles
La actividad antioxidante (AA) se evaluó por medio de
la capacidad captadora de radicales del DPPH (2,2-difenil-1-picrilhidrazil), de
acuerdo con el método de Brand-Williams y col.
(1995). Para ello, se mezclaron 2 g de miel con 10 cm3 de
metanol (Sigma Aldrich) y se dejó reposar en baño de agua a 30 °C durante 30 min
(Baño con agitación, Thermo Fisher
Scientific, modelo 2870, Walthman, MA, USA). La mezcla se agitó usando
un equipo vortex (Genie 2, Scientific Industries, modelo G560, NY, USA) y se filtró a través de papel filtro Whatman
No. 4. Posteriormente, a 1 cm3 del filtrado
y a 1 cm3 de agua destilada se les agregaron por separado 3 cm3 de solución de DPPH (0.042 g de DPPH, Sigma Aldrich, más 100
cm3 de metanol), y cada solución se agitó durante 10 s. Estas dos soluciones se denominan DPPH con
filtrado y DPPH con agua, respectivamente.
Las soluciones se dejaron en la oscuridad a temperatura ambiente por 20
min y se centrifugaron a 2 000 rpm durante 10
min (Centrífuga Clínica serie 428-7181 Damon/IEC, Needham, MA, USA). Finalmente, se midió la absorbancia a 515 nm contra un blanco de metanol (Espectrofotómetro Thermo Fisher Scientific, Modelo
Genesis 10S VIS, Madison WI, USA). Todos los reactivos
usados fueron grado
analítico o grado HPLC (por sus siglas en inglés: High Pressure Liquid Chromatographic).
La actividad antioxidante (AA) se calculó
como porcentaje de inhibición de la absorbancia del DPPH usando la
siguiente ecuación:
AA = (absorbancia del DPPH con
agua ‑ absorbancia del DPPH con
filtrado) × 100/(absorbancia
del DPPH con agua)
La miel de abeja con la mayor
actividad antioxidante se empleó para adicionarla a las muestras de carne cruda
molida de conejo.
Procesamiento de la carne
Para obtener la carne de conejo, a fin de elaborar las muestras se obtuvieron aleatoriamente
8 conejos de un lote de 80 (un conejo por jaula de 30 cm de ancho × 60 cm de largo
× 40 cm de alto), los que se engordaron con
una dieta comercial de 30 d a 69 d de edad. Consumieron alimento y agua ad
libitum en comederos de tolva y en
bebederos automáticos. Al final del
periodo de engorda, los 8 conejos se
sacrificaron de acuerdo a la Norma
Oficial Mexicana (NOM-033-SAG/ZOO-2014) e inmediatamente las canales se
identificaron y almacenaron a 4 °C durante 24 h. Posteriormente, el músculo longissimus
dorsi (lomo) se removió de cada canal, se empacó al vacío, y por razones de
mercado, se almacenó a - 20 °C. Después de 10 meses de almacenamiento, la carne
se descongeló a temperatura ambiente y se molió usando malla de 3.18 mm (Torrey M-12-FS,
Monterrey, México). Posteriormente,
se prepararon las muestras de carne de conejo adicionando y homogenizando 0 g
de miel/100 g de carne molida (control) o 2
g de miel/100 g de carne molida; para cada tratamiento se obtuvieron 32
réplicas (32 muestras de carne con miel y 32 sin miel provenientes de 8 canales
diferentes). Finalmente, las muestras se envasaron en bolsas negras de polietileno dentro de un
contenedor de polipropileno y se almacenaron a 4 °C durante 0 d, 3 d, 6 d y 9 d. Toda manipulación se realizó con la
limpieza y desinfección apropiadas. Las temperaturas de - 20 °C para 10 meses y de 4 °C para 0 d a 9 d de
almacenamiento concuerdan con lo recomendado por Agustini y col. (2001) y James
y James (2014).
Actividad antioxidante y concentración de malondialdehído
de la carne
La AA se midió, como en el caso de las mieles, de
acuerdo con el método de Brand-Williams y col. (1995). Se usaron 5 g de muestra
de carne cruda provenientes de cada una de las muestras de carne molida para el
día correspondiente de almacenamiento, mezclando y homogenizando con 5 cm3
de metanol.
El MDA se midió por duplicado de acuerdo a la técnica
de sustancias reactivas al ácido tiobarbitúrico
(TBARS, por sus siglas en inglés: thiobarbituric
acid reactive substances), con algunas modificaciones (Shin y col., 2011). Se agregaron 50 cm3
de agua grado HPLC y 0.2 cm3 de solución con 7.2 g/100 cm3
de butilhidroxitolueno (BHT) (0.72 g BHT + 10 cm3
de metanol) a 10 g de muestras de carne cruda. La mezcla se homogenizó usando
una licuadora convencional (Sunbeam-Oster, modelo 465-42, 0462-13, Fort
Lauderdale, FL) y se dejó reposar en la
oscuridad a temperatura ambiente por 15 min. Después, 1 cm3
de esta mezcla se dejó reaccionar con 2 cm3 de una solución 2 M de
TBA/TCA o ácido tiobarbitúrico/ácido tricloroacético (0.1154 g de TBA + 40 cm3
de una solución con 15 g de TCA/100 cm3 = 15 cm3 de
TCA aforados a 100 cm3 con agua grado HPLC). Los tubos de ensayo se
mezclaron con vortex (GENIE2, Scientific Industries, modelo G560, NY, USA) y se
incubaron en baño de agua a 50 °C durante 10
min. Inmediatamente después, los tubos se enfriaron y se centrifugaron a 2 000
rpm durante 10 min (Centrífuga Clínica serie
428-7181 Damon/IEC, Needham, MA, USA) y finalmente, la absorbancia del sobrenadante se midió a 530 nm
(Espectrofotómetro Thermo Fisher Scientific, Modelo Genesis 10S VIS,
Madison WI, USA). Con base en una curva estándar de metoxipropano, el cual se
convierte a malondialdehído cuando reacciona con la solución de TBA/TCA, los
datos se expresaron como mg de MDA por kg de carne fresca.
Debido a que la formación de MDA
es directamente
proporcional a la oxidación de lípidos (Velasco y Williams, 2011; El-Gogary y col., 2018), una menor concentración de
MDA indica una mayor estabilidad oxidativa.
Análisis estadístico
Los datos de actividad antioxidante de los tipos de
miel fueron analizados usando un diseño
completamente al azar, con tres tratamientos: miel oscura, ámbar y
clara, y una muestra de miel se consideró la unidad experimental que se corrió
con 8 repeticiones. Se usó el Paquete estadístico para ciencias sociales (SPSS,
por sus siglas en inglés: Statistical Package for the Social Sciences) (SPSS, 2011)
versión 8.0, bajo el procedimiento del modelo general lineal.
Los datos de las muestras de
carne se analizaron bajo un
diseño completamente al azar de 8 tratamientos: 0 g de miel/100 g de carne a 0
d, 3 d, 6 d y 9 d y 2 g de miel/100 g de carne a 0 d, 3 d, 6 d y 9 d de
almacenamiento a 4 °C. Una muestra de carne
fue la unidad experimental (32
unidades experimentales con 2 g de miel y 32 con 0 g de miel). En cada
muestra de carne se evaluaron AA y MDA por duplicado en el laboratorio, cuyo
promedio se asignó a cada unidad experimental.
Todas las comparaciones de medias se realizaron
empleando la prueba de Tukey (P < 0.05).
RESULTADOS
Actividad antioxidante en mieles
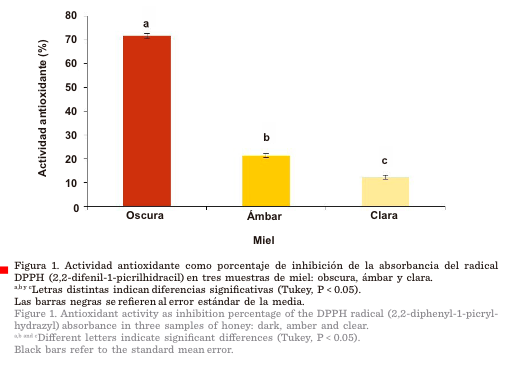
La miel oscura mostró la
más alta AA, como porcentaje de inhibición de la absorbancia del DPPH, en
comparación con las mieles clara y ámbar (Figura 1).
Actividad
antioxidante de la carne
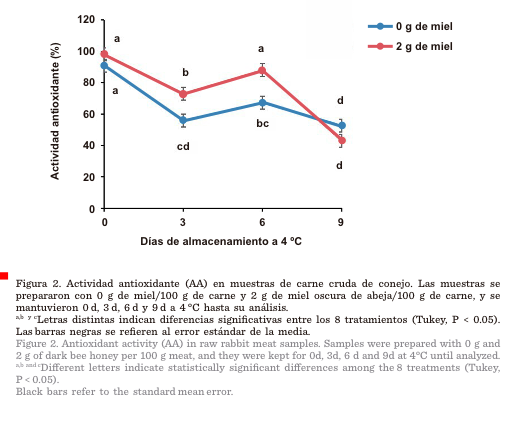
Tanto en la carne control
como en aquella con 2 g de miel (Figura 2), al avanzar los días de
almacenamiento refrigerado disminuyó la AA. En
la carne con 2 g de miel, que contenía más antioxidantes, la disminución de AA
fue menor (P < 0.05) que en la carne control los días 3 y 6. Sin embargo, en el día 9 de almacenamiento, la capacidad antioxidante de la miel disminuyó y las muestras con 2 g de miel mostraron
valores similares de AA a las muestras control (Figura 2).
Concentración de malondialdehído de la
carne
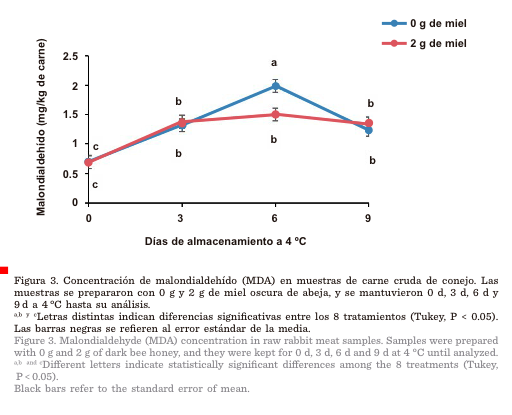
La
carne control y las muestras con 2 g de miel presentaron
un incremento en la concentración de MDA al avanzar los días de almacenamiento (Figura 3). No obstante, el día 6
se observó una menor concentración de MDA (P
< 0.05), estimada en un 25 % menos en la carne con 2 g de miel al compararla con la carne control.
Finalmente, la concentración de MDA de la carne control disminuyó
significativamente el día 9 de almacenamiento y presentó un valor similar al de
la carne con 2 g de miel.
DISCUSIÓN
Actividad antioxidante en mieles
La
miel contiene compuestos como a-tocoferol, ácido
ascórbico, flavonoides y enzimas como catalasa y peroxidasa, que actúan como antioxidantes naturales y son más abundantes en la
miel oscura (Alvarez-Suarez y col., 2014). Su contenido y naturaleza dependen
de su origen floral (Alvarez-Suarez y col.,
2014; Škrovánková y col., 2019). Por ello, las mieles oscuras tienen
mayor AA que las claras (Johnston y col.,
2005; Can y col., 2015; Srećković y col., 2019). En este estudio la miel oscura produjo 71.75 % de AA (Figura 1),
mientras que Dżugan y col. (2018) reportaron
51.39 % a 85.29 % en miel oscura, valores
de AA superiores a los de las mieles claras.
Actividad antioxidante de la carne
En ambos tratamientos (2 g
de miel y 0 g de miel), la mayor AA en carne se presentó el día 0 (> 90 %),
mientras que la menor (< 55 %) se observó en el día 9 de almacenamiento a 4
°C (Figura 2). Esto se debe a un aumento de radicales libres por oxidación
lipídica, que, a su vez, consumen los antioxidantes naturales de la carne
(Shahidi y Udaya, 2007; Kumar y col., 2015). Se ha reportado que mientras mayor
es el tiempo de refrigeración, menor es la AA de la carne cruda de lomo de
conejo. Según Velázquez y col. (2014), del día 0 al 6 de refrigeración la AA de carne de conejo disminuyó de
70 % a 50 % aproximadamente. En este estudio, la AA en el mismo tipo de carne
con 0 g de miel, del día 0 al día 6 de refrigeración a 4 °C disminuyó de >
90 % a < 70 %.
La
carne con 2 g de miel presentó valores más altos de AA (73.15 % y 88.17 %) que la carne control
(56.16 % y 67.58 %) los días 3 y 6 de
refrigeración (Figura 2). Esto se atribuye a la alta cantidad de antioxidantes que la carne adquiere de la miel (Nagai y
col., 2006). Los resultados concuerdan
con lo reportado por Antony y col.
(2006), quienes encontraron que la adición
de miel a la carne de pechuga de pavos inhibió
la formación de compuestos oxidantes. Los valores de AA los días 3 y 6
de almacenamiento indican que las muestras de carne con 2 g de miel estuvieron
mejor protegidas contra la oxidación que las
del grupo control. Sin embargo, la capacidad antioxidante de la miel
disminuyó para el día 9 de refrigeración.
Concentración de
malondialdehído de la carne
La concentración
de MDA aumentó con el tiempo de refrigeración (Figura 3), debido a
que los antioxidantes presentes en la carne pierden su capacidad antioxidante
y, en consecuencia, se produce MDA (Shahidi y Udaya, 2007). Cuando se inicia la
refrigeración a 4 °C los antioxidantes retardan la oxidación, posteriormente se
consumen y se produce la oxidación de lípidos (Possamai y col., 2018) y la
formación de MDA. Bobko y col. (2019) reportaron en pavos 0.63 mg/kg a 4.7
mg/kg de MDA para 0 d y 14 d de almacenamiento, respectivamente, valores
similares a los del presente estudio.
En la
carne control la concentración de MDA aumentó del día 3 al día 6 de
almacenamiento. En el día 9,
disminuyó la concentración de MDA,
probablemente debido a la producción de aminoácidos por hidrólisis de
las proteínas, los cuales capturan al MDA,
formando bases de Schiff (Wazir y col., 2019).
En el
caso de la carne con 2 g de miel, este antioxidante natural mantuvo
constante la concentración
de MDA desde el día 3 al día 9 de almacenamiento en
refrigeración a 4 °C. El día 6 de almacenamiento la miel oscura
produjo menor concentración de MDA en la carne que en la muestra control
(Figura 3). Esto se debe a que el alto contenido de compuestos con actividad antioxidante de la miel (Galano, 2015)
ayuda a prevenir la oxidación de ácidos
grasos poliinsaturados y la formación
de MDA en la carne (Alasnier y col., 2000;Tao, 2015). Por tanto, con
base en los valores de MDA el día 6 de
almacenamiento, las muestras de carne con 2 g de miel estuvieron mejor
protegidas contra la oxidación que las del grupo control.
En
lomo de conejo California × Nueva Zelanda se han reportado valores de MDA de
1.6 mg/kg (Velázquez y col., 2014), similares a los del tratamiento con 2 g de
miel del presente estudio (Figura 3).
CONCLUSIONES
La
miel oscura mostró una alta actividad antioxidante, que se mantuvo durante el almacenamiento
en refrigeración de la carne molida de
conejo que la contenía, y permitió protegerla contra la oxidación, disminuyendo
el contenido de malondialdehído. La
adición de 2 % de miel oscura
(peso/peso) en carne de conejo molida permite retrasar su oxidación y prolongar
su vida de almacenamiento. Se requieren estudios adicionales para analizar el
efecto sobre la estabilidad microbiológica y la aceptación organoléptica.
Referencias
Agustini,
T. W., Suzuki, T., Hagiwara, T., Ishizaki, S., Tanaka, M., and Takai, R.
(2001). Change of K value and water state of yellowfin
tuna Thunnus albacares meat stored in a wide temperature range (20°C to
- 84°C). Fisheries Science. 67(2): 306-313.
Alasnier,
C., David-Briand, E., and Gandemer, G. (2000).
Lipolysis in muscles during refrigerated storage as related to the
metabolic type of the fibres in the rabbit. Meat Science. 54(2):
127-134.
Alvarez-Suarez, J. M., Gasparrini, M., Forbes-Hernández,
T. Y., Mazzoni, L., and Giampieri, F. (2014).
The composition and biological
activity of honey: a focus on Manuka honey. Foods. 3(3):
420-432.
Antony, S., Rieck, J. R., Acton, J. C., Han, I. Y.,
Halpin, E. L., and Dawson, P. L. (2006). Effect of dry
honey on the shelf life of packaged turkey slices. Poultry Science. 85(10): 1811-1820.
Avila-Ramos, F.,
Pro-Martínez, A., Sosa-Montes, E., Cuca-García,
J. M., Becerril-Pérez, C., Figueroa-Velasco, J. L., …, and
Narciso-Gaytán, C. (2013). Dietary
supplemented and meat-added antioxidants effect
on the lipid oxidative stability of refrigerated
and frozen cooked chicken meat. Poultry Science. 92(1):
243-249.
Bobko,
M., Kročko, M., Haščík, P., Tkáčová, J., Bučko, O., Bobková, A., …, and
Pavelkova, A. (2019). Parameters of quality raw cooked meat product. Journal of Microbiology, Biotechnology and Food
Sciences. 9: 366-369.
Brand-Williams,
W., Cuvelier, M. E., and Berset, C. (1995). Use of a free radical method to
evaluate antioxidant activity. Lebensmittel-Wissenschaft and Technologie.
28(1): 25-30.
Can, Z., Yildiz, O., Sahin, H., Akyuz, T. E., Silici,
S., and Kolayli, S. (2015). An investigation of Turkish honeys: Their physico-chemical properties, antioxidant capacities and phenolic profiles.
Food Chemistry. 180: 133-141.
Carvalho,
R., Shimokomaki, M., and Estévez M. (2017).
Poultry meat color and oxidation. In M. Petraci and C. Berri (Eds.), Poultry
Quality Evaluation (pp. 133-157). Oxford: Elsevier, UK.
Cianciosi,
D., Forbes-Hernández, T. Y., Afrin, S., Gasparrini, M., Reboredo-Rodríguez, P.,
Manna, P. P., …, and Battino, M. (2018). Phenolic compounds in honey and their
associated health benefits: A review. Molecules. 23(9): 2322.
Dżugan,
M., Tomczyk, M., Sowa, P., and Grabek-Lejko, D. (2018). Antioxidant activity as
biomarker of honey variety. Molecules. 23(8): 2069.
El-Gogary,
M. R., El-Said, E. A., and Mansour, A. M. (2018). Physiological and
immunological effects of rosemary essential oil in growing rabbit diets. Journal of Agricultural Science. 10(7): 485-491.
Galano,
A. (2015). Free radicals induced oxidative stress at a molecular level: The current
status, challenges and perspectives of computational chemistry based protocols.
Journal of the Mexican Chemical Society. 59(4): 231-262.
Ghorbani,
A. and Esmaeilizadeh, M. (2017). Pharmacological properties of Salvia
officinalis and its components. Journal
of Traditional and Complementary Medicine. 7(4): 433-440.
Gutiérrez-Grijalva,
E. P., Picos-Salas, M. A., Leyva-López, N., Criollo-Mendoza, M. S., Vazquez-Olivo, G., and Basilio-Heredia, J. (2018). Flavonoids and
phenolic acids from oregano: Occurrence, biological activity and health benefits.
Plants. 7(1): 2.
James,
S. J. and James, C. (2014). Chilling and Freezing
of Foods. In S. Clark, S. Jung, and B. Lamsal (Eds), Food Processing: Principles and Applications
(pp. 79-105). Oxford: John Wiley & Sons, UK.
Johnston, J. E., Sepe, H. A., Miano, C. L., Brannan,
R. G., and Alderton, A. L. (2005). Honey
inhibits lipid oxidation in ready-to-eat ground beef patties. Meat Science.
70(4): 627-631.
Kumar,
Y., Narayan, Y. D., Ahmad, T., and Narsaiah, K. (2015). Recent trends in the
use of natural antioxidants for meat and meat
products. Comprehensive
Reviews in Food Science and Food Safety. 14(6): 796-812.
Nagai, T., Inoue, R., Kanamori, N., Suzuki, N., and
Nagashima, T. (2006). Characterization of honey
from different floral sources. Its functional properties and effects of
honey species on storage of meat. Food Chemistry. 97(2): 256-262.
Nagyova, A., Krajcovicova, K. M., Horska, A., Smolkova, B., Blazicek, P., Raslova, K., …, and Dusinska,
M. (2004). Lipid peroxidation in men after dietary supplementation with a
mixture of antioxidant nutrients. Bratislavské
Lekárske Listy – Bratislava Medical
Journal. 105(7/8): 277-280.
Nieto, G., Ros, G., and Castillo, J. (2018).
Antioxidant and antimicrobial properties of rosemary (Rosmarinus officinalis,
L.): A review. Medicines. 5(3): 98.
Nobuyuki,
I. and Masao, H. (1989). Antioxidantscarcinogenic and chemopreventive
properties. Advances in Cancer Research.
53:
247-302.
NOM-033-SAG/ZOO-2014
(2014). Métodos para dar muerte a los animales domésticos y silvestres. Secretaría de Agricultura y Recursos
Hidráulicos, en Norma Oficial Mexicana. [En línea]. Disponible
en:
http://www.dof.gob.mx/nota_detalle.php?codigo=5405210&fecha=26/08/2015&print=true. Fecha de consulta: 25 de noviembre de 2019.
Pichichero,
E., Canuti, L., and Canini, A. (2009). Characterization
of the phenolic and flavonoid fractions and antioxidant power of Italian honeys
of different botanical origin. Journal of
the Science of Food and Agriculture. 89(4): 609-616.
Possamai,
A. P. S., Alcalde, C. R., Feihrmann, A. C., Possamai, A. C. S. Rossi, R. M.,
Lala, B., …, and Macedo F. A. (2018). Shelf life of meat from Boer-Saanen
goatsfed diets supplemented with vitamin E. Meat Science. 139: 107-112.
Rabaa,
A. M., Mashair, A. S., and Elgasim, A. E.(2013).
Effect of bee honey in safety and storability of beef sausage. Pakistan
Journal of Nutrition. 12(6): 560-566.
Sampaio, G. R., Saldanha, T., Soares, R. A. M., and
Torres, E. A. F. S. (2012). Effect of natural antioxidant combinations on lipid
oxidation in cooked chicken meat during refrigerated storage. Food Chemistry.
135(3): 1383-1390.
Shahidi, F. and Udaya, N. W. (2007). Methods for
measuring oxidative rancidity in fats and oils. In C. C. Akoh and D. B. Min
(Eds.), Food lipids: Chemistry, Nutrition and Biotechnology (pp.
387-403). London: Taylor and Francis Group, UK.
Shasha,
D., Magogo, C., and Dzomba, P. (2014). Reversed
phase HPLC-UV quantitation of BHA, BHT
and TBHQ in food items sold in Bindura supermarkets, Zimbabwe. International
Research Journal of Pure and Applied
Chemistry. 4: 578-584.
Shin,
D., Yang, H. S., Min, B. R., Gaytán, C. N., Sánchez, P. M. X., and Ruiz, F. C.
(2011). Evaluation of antioxidant effects of vitamins C and E alone and in
combination with sorghum bran in a cooked and stored chicken sausage. Korean
Journal of Food Science. Animal Resources. 31(5): 693-700.
Škrovánková,
S., Snopek, L., Mlček, J., and Volaříková, E.
(2019). Bioactive compounds evaluation in different types of Czech and
Slovak honeys. Potravinarstvo Slovak Journal of Food Sciences. 13(1):
94-99.
Soltani, M., Tabeidian, S. A., Ghalamkari, G.,
Adeljoo, A. H., Mohammadrezaei, M., and Fosoul, S. S. A. S.
(2016). Effect of dietary extract and dried areal parts of Rosmarinus officinalis on performance, immune responses
and total serum antioxidant activity in broiler chicks. Asian Pacific
Journal of Tropical Disease. 6(3): 218-222.
SPSS,
Statistical Package for the Social Sciences
(2011). Institute. SPSS-X. User’s Guide. Version 8, Chicago IL. USA.
Srećković,
N. Z., Mihailović, V. B., and Katanić-Stanković,
J. S. (2019). Physico-chemical, antioxidant and antimicrobial properties
of three different types of honey from
central Serbia. Kragujevac Journal of Science. (41):
53-68.
Tao,
L. (2015). Oxidation of polyunsaturated fatty acids and its impact on food
quality and human health. Advances in Food Technology and Nutritional Sciences.
1(6): 135-142.
Velasco, V. and Williams, P. (2011). Improving meat
quality through natural antioxidants. Chilean Journal of Animal Research.
71(2): 313-322.
Velázquez,
R. S. R., Sosa, M. E., Ramírez, G. M. E., Pro, M. A., Suarez, L. R., Avila, R.
F., …, and Rodríguez, C. J. C. (2014). Genotype,
feed type and refrigeration time on the antioxidant and oxidative stability of
rabbit loin meat. Archivos de Zootecnia. 63(243): 531-542.
Wazir, H., Chay, S. Y., Zarei, M., Hussin, F. S.,
Mustapha, N. A., Ibadullah, W. Z. W., and Saari, N. (2019). Effects
of storage time and temperature on lipid oxidation and protein cooxidation of
low-moisture shredded meat products. Antioxidants.
8(10): 486.
Xiang,
L., Si, Ch., Jing-En, L., Ning, W., Xin, L., Qi, A., ..., and Wen-Jun, W. (2019).
Chemical composition and antioxidant activities of polysaccharides from Yingshan Cloud Mist Tea. Oxidative
Medicine and Cellular Longevity. 1-11.