La
cabra: selección y hábitos de consumo de plantas
nativas en agostadero
árido
The goat: selection and intake habits of native plants
in arid range
Selección y hábitos de consumo de la cabra
Cecilia Carmela Zapata-Campos1*,
Miguel Ángel Mellado-Bosque2
*Correspondencia: cezapata@uat.edu.mx/Fecha
de recepción: 3 de diciembre de 2019/Fecha
de aceptación: 16 de septiembre de 2020/Fecha
de publicación: 29 de enero de 2021
1Universidad Autónoma de Tamaulipas, Facultad de
Medicina Veterinaria y Zootecnia, carretera Victoria-Mante km 5 s/n, Ciudad
Victoria, Tamaulipas, México, C. P.
87274. 2Universidad Autónoma
Agraria Antonio Narro, Departamento
de Nutrición Animal,
Saltillo, Coahuila, México.
Resumen
Las
cabras habitan regiones áridas como resultado de su adaptación a condiciones
extremas. La selección de la dieta es una de las estrategias conductuales que
les han permitido evitar deficiencias nutricionales o intoxicaciones aun en condiciones de baja disponibilidad de alimento.
Así mismo, el ramoneo, como conducta
ingestiva de la especie, les permite seleccionar y obtener plantas con adecuados valores de proteína cruda que
favorezcan su desarrollo y supervivencia.
También, las cabras se adaptan a las características químicas de las plantas, las cuales desarrollan compuestos bioactivos para evitar ser
consumidas. Estos metabolitos secundarios
pueden tener efectos
antinutricionales y tóxicos así como medicinales o curativos,
dependiendo del consumo que tenga el animal. El objetivo de este trabajo fue revisar
la selección y hábitos de las cabras en el
consumo de plantas nativas, para determinar cómo favorecen la
supervivencia y productividad de la especie, bajo las condiciones de adversidad
ambiental que caracterizan a las regiones
áridas. Dicho conocimiento permitirá establecer estrategias para el
manejo adecuado del agostadero y conocer el
efecto que los compuestos del metabolismo secundario de las plantas
puedan tener en los procesos reproductivos,
nutricionales, sanitarios, así como en los productos derivados de la leche o carne de estos animales.
Palabras clave: conducta alimenticia, dieta,
componentes nutricionales, consumo, metabolitos
secundarios.
Abstract
Goats dwell arid regions as a
result of their adaptation to extreme conditions. Diet selection is one of the behavioral strategies that has allowed
them to avoid nutritional deficiencies or
poisonings, even under conditions of
low food availability. Likewise, browsing as
an ingestive behavior of the species allows them to select and obtain plants with adequate
crude protein values, which favor their development and survival. Also, goats adapt to the chemical
characteristics of plants, which develop bioactive
compounds to avoid being consumed. These secondary metabolites can have
antinutritional and toxic effects, as well as medicinal or curative effects, depending on the consumption that the animal
has. The objective of this work was to
review the selection and habits of goats
in the consumption of native plants, to determine how they favor the survival and productivity of the species
under the conditions of environmental adversity that characterize arid
regions. This knowledge will allow to establish strategies for the proper management of the rangeland and to know
the effect that the compounds of the
secondary metabolism of the plants may have on the reproductive,
nutritional, and health processes, as well
as on the products derived from the
milk or meat of these animals.
Keywords: nutritional
behavior, diet, nutritional components, intake, secondary metabolites.
Introducción
La cabra fue uno de los primeros animales
en ser domesticados, comenzando este proceso
con el bezoar (Capra aegagrus). Existe evidencia de su presencia en Ganj Darech (Irán) desde el año 10 000
a. C. (Zeder y Hesse, 2000; Rosa-García y
col., 2012). La carne y leche producidas por esta especie han sido
aprovechadas por el hombre del Medio Oriente al menos desde el año 2 500 a. C., habiéndose encontrado pruebas de su domesticación en el Valle
Indo, en China, y probablemente en Mesoamérica (Boyazoglu y col., 2005). De la
población caprina existente en el mundo, el
88 % se encuentra localizada en
zonas de Asia y África, de acuerdo con la
Organización de las Naciones Unidas
para la Alimentación y la Agricultura
(FAO, por sus siglas en inglés: Food and Agriculture Organization) (FAO,
2020). En las zonas áridas las cabras son la
especie animal más abundante (Devendra, 2010). El 47 % de la superficie de la
tierra corresponde a zonas áridas,
donde habitan 2 000 millones de personas,
la mayoría en condiciones de pobreza (FAO, 2007). En estos ambientes los
sitios de toma de agua son escasos y distantes entre ellos, y la disponibilidad
de alimento es escasa y de baja calidad
nutricional, por lo que la cabra tiene
que desplazarse largas distancias
para satisfacer sus necesidades de alimento (Zobel y col., 2019).
Los
caprinos, al ser una de las especies mejor adaptadas a la desertificación de
las regiones áridas, son una de las
principales fuentes de proteína para
el hombre que habita en esos climas. En estas regiones los recursos
vegetales son heterogéneos y restringidos en calidad y cantidad (Silanikove,
2000a). Por ello, la cabra ha desarrollado diversos mecanismos adaptativos,
tales como capacidad de caminar distancias largas, requerimientos metabólicos
bajos y reducida masa corporal. A nivel nutricional presentan adaptaciones, como la capacidad de seleccionar las plantas
más nutritivas entre las diversas opciones disponibles, maximizando la ingesta
de nutrientes y minimizando la ingesta de
metabolitos secundarios, mediante el
rechazo de plantas menos nutritivas. De esta manera disminuyen el riesgo de intoxicación, y en algunos casos
obtienen beneficios nutricionales y/o medicinales,
con las plantas que seleccionan para su
consumo (Egea y col., 2016). El conocimiento de estas adaptaciones nutricionales y de comportamiento, así
como las características de las diferentes plantas elegidas en función de la
condición climática o del estado fisiológico del animal permitirá desarrollar
futuras investigaciones para el manejo sostenible de las zonas de pastoreo. Así
también, conocer los efectos del tipo y la cantidad de material vegetal consumido, en la producción, bienestar
y estado de salud de las cabras.
El
objetivo de este trabajo fue revisar los hábitos de selección y consumo de
plantas nativas por parte de las cabras, con la finalidad de ofrecer una visión
actual de cómo estas adaptaciones favorecen la supervivencia y productividad de
la especie bajo las condiciones de adversidad ambiental, característica de los
territorios áridos.
Adaptación y conducta alimenticia en caprinos
Se ha demostrado, en distintos ambientes y países, que
las cabras criollas tienen un mejor rendimiento que otros rumiantes, debido a
su capacidad de termorregulación y adaptación al consumo de plantas ricas en lignina, así como el
hecho de que pueden limitarse en el consumo
de agua y alimento (Silanikove, 2000b; Koluman-Darcan y Silanikove,
2018). La abundancia de cabras en las
regiones áridas es resultado de una adecuada
adaptación a estas condiciones
extremas (Silanikove, 2000a). Particularmente,
en la cabra, el proceso de adaptación
está catalogado en seis aspectos: anatómico, morfológico, fisiológico, conducta
alimenticia, metabolismo y rendimiento (Silanikove y Koluman-Darcan, 2015).
En el
aspecto de adaptación anatómica, Silanikove (2000b) mencionó que la disminución
del tamaño corporal en los animales se debe a
tres condiciones: la selección natural, la se-lección social y la
endogamia. En este caso, la selección natural
es el factor individual más importante, ya que en condiciones de aridez
los individuos de talla pequeña son los mejor adaptados, en comparación con
tallas mayores del rebaño. La presión de
selección, relacionada con tasas de
supervivencia y reproducción ligeramente mayores en animales de talla pequeña, ha promovido una modificación
gradual en cuanto a la talla de la población,
favoreciendo a los individuos pequeños (Silanikove y Koluman-Darcan, 2015). Otros autores
argumentaron que la reducción en la dimensión
corporal puede relacionarse con el tipo de alimento y la productividad
de las plantas primarias (Calder, 1984;
Hetem y col., 2011).
Con
respecto a la adaptación anatomo-fisiológica,
la cabra presenta glándulas salivales más grandes, mayor área de superficie de la mucosa absorbente y capacidad para aumentar sustancialmente el
volumen del intestino delgado cuando se nutre
con alimentos con alto contenido de fibra (Silanikove, 2000b). Al reducir su metabolismo y rendimiento, como medida
adaptativa, la cabra minimiza sus requerimientos nutricionales y sus
necesidades de agua en las zonas áridas. La
capacidad de reducir el metabolismo le permite sobrevivir incluso después de periodos prolongados de disponibilidad limitada de alimentos (Goetsch,
2019).
En cuanto a la conducta alimenticia, esta actividad
comienza antes del consumo de alimento
y se caracteriza por presentar dos fases:
inicial y apetitiva. La fase inicial es cuando los animales deciden buscar comida, lo cual podría ser por un deseo general para
adquirir energía o un deseo específico por una comida en particular.
Esta fase incluye un cambio en la conducta, pasando de una actitud de reposo, al acto de abastecerse obteniendo alimento,
decisión basada en la recompensa esperada por alimentarse (Ginane y col.,
2015). La segunda fase es la apetitiva, en donde el animal recibe información de uno o varios alimentos, y con base en su percepción sensorial (visión, olfato y gusto) tiene la
oportunidad de elegir (Ginane y col., 2011). Así, tanto el estímulo
preingestivo como el grado de gusto refuerzan su motivación por el consumo de
cada alimento o, por el contrario, reducen la probabilidad de consumirlo
(Provenza, 1995).
Cuando
el animal está motivado para comer asume que la comida está disponible, por lo
que comienza un estímulo de preingestión, lo que refuerza su deseo de comer,
iniciando entonces los procesos de ingestión, masticación, deglución,
digestión y absorción (Ginane y col., 2015).
En función de la digestibilidad de los
alimentos las cabras son capaces de discriminar
entre ellos, cambiando su consumo y favoreciendo la especie o parte de la
planta que sea más nutritiva, en un momento dado
(Ackermans y col., 2019). Esta habilidad puede deberse a diversos mecanismos
anatómicos y fisiológicos, tales como la capacidad de pararse en dos patas (para ramonear), hipsodoncia para
detectar abrasividad (anatomía bucal),
presencia de proteínas salivares unidas a taninos (proteínas ricas en prolina),
flora del tracto digestivo adaptada a
plantas taniniferas y capacidad de reciclar urea en el rumen
(Torres-Fajardo y col., 2019). Además, poseen una
glándula parótida larga que produce suficiente saliva para ayudar como buffer a
la rápida digestión de la dieta y así facilitar el pasaje del alimento al rumen
(Robbins y col., 1995).
El amplio volumen ruminal de las cabras (9 L a 18 L)
es una adaptación importante al servir como una gran cámara de fermentación y
depósito de agua. El agua almacenada en el rumen se utiliza durante la
deshidratación, y el rumen sirve como un
recipiente que acomoda el agua ingerida después de la rehidratación.
Esta situación es provocada por recorrer
grandes distancias para pastorear o
ramonear en los ambientes con disponibilidad limitada de alimento o agua (Silanikove y Koluman-Darcan, 2015).
Todas estas cualidades permiten a la cabra
digerir de manera efectiva los
alimentos (Silanikove, 2000a; Alonso-Díaz y col., 2012; Mellado, 2016;
Ventura-Cordero y col., 2017; Schmitt y
col., 2020).
Por
otra parte, la selección de la dieta es una adaptación
conductual que puede modificarse por periodos cortos o largos. Dicha
modificación puede verse influenciada por
aspectos como la experiencia previa en
el consumo de algún material específico, y a su vez, está relacionada
con cambios neurales o fisiológicos a nivel
celular, los cuales se denominan en conjunto “conducta adaptativa” (Ginane y col., 2015). Particularmente, la conducta adaptativa alimenticia se observa cuando el animal
intenta cumplir con sus requerimientos metabólicos y mantener la homeostasis
(Berridge, 1996). La conducta alimenticia es un importante aspecto de la
producción animal y constituye el vínculo entre la comida y el consumo. Esta conducta alimenticia considera
diferentes aspectos, incluyendo el encontrar y escoger la comida, el ganar y
mantener el acceso a la misma, así como la cantidad de ingesta en cualquier
momento y la rapidez de la digestión (Nielsen y col., 2016).
De
acuerdo con Silanikove (2000a), la cabra se encuentra clasificada como
consumidor intermedio; sin embargo, de acuerdo a la disponibilidad y tipo de
alimento en el agostadero, las cabras se
pueden ubicar tanto en el grupo de
consumidores de concentrados (si en el agostadero hay alta disponibilidad de arbustivas)
como en el de consumidores de forrajes (si la disponibilidad de pastos es alta)
(Osoro y col., 2013). Con las modificaciones
en la disponibilidad de materiales se modifica el tipo de
microorganismos ruminales, así como la conformación de las papilas de este
órgano. Dicha característica también les permiten consumir rebrotes y pastos a
la vez. Su ritmo de alimentación es
intermedio en los dos grupos mencionados anteriormente (van-Soest, 1994;
Bojkovski y col., 2014). Esta capacidad
faculta a la cabra a soportar mayor cantidad de leguminosas en su dieta,
comparada con los ovinos y bovinos, ya que no tiene una tasa de fermentación
tan elevada (Silanikove, 2000a).
Características
del agostadero y su influencia en el consumo y selección de plantas en las cabras
El 25
% de la superficie de tierra en el mundo es utilizada para la producción
ganadera en extensivo, de la cual una cuarta parte está principalmente poblada
por arbustos (Estell y col., 2010). Los
agostaderos son territorios donde predomina la vegetación autóctona de
la zona agroecológica específica; parte de dicha vegetación posee potencial
para su utilización en la alimentación animal, además de ser consumida por especies silvestres (Reid y
col., 2014). Otra característica importante
delos agostaderos es que la vegetación es muy heterogénea, con una distribución multiestratificada, y se encuentra
sujeta a variaciones de calidad (proteína cruda, energía, fibra) y cantidad de forraje (disponibilidad), dependientes
de la época del año y del uso de los recursos (Torres-Acosta y col., 2008).
La principal estrategia alimenticia utilizada por
las cabras en las regiones áridas y semiáridas es el ramoneo de plantas y arbustos, principalmente relacionada con la obtención de proteína (Gutteridge y Shelton,
1994; Mkhize y col., 2014). Por lo tanto, la conducta de consumo y selección de forraje está influenciada por la
cantidad, calidad, accesibilidad, dispersión de los recursos alimenticios y por las características individuales del
animal (edad, sexo, estatus reproductivo y condición corporal) (Heuermann y col.,
2011).
El contenido de PC (proteína cruda), humedad y extracto
libre de nitrógeno de árboles y arbustos varía de acuerdo con la época del año
en las zonas áridas y semiáridas, lo cual está asociado principalmente con la
distribución de la precipitación pluvial (Chimphango y col., 2020; Mclntosh
y col., 2019). Así, en la región semiárida del noreste de México, los frutos y
hojas de las familias Mimosaceae, Ebanaceae,
Olaceae, Borraginaceae, Rutaceae y Caelsaepinaceae presentan
mayor porcentaje de preferencia de las cabras
(78 %) y mayor contenido de celulosa (12
% a 22 %) y PC (18 % a 24 %) en verano y otoño. En el verano, las herbáceas
tienen la segunda importancia en la selección (12 % a 18 % de preferencia), de
estas, las que más consumen las
cabras son Clematis drummondii, Malva parviflora y Euphorbia
maculate. En tercer lugar de preferencia (6 % a 10 %) se encuentran las
gramíneas establecidas, como Panicum hallii, Setaria macrostachya,
Cenchrus ciliaris, las cuales son más consumidas en primavera y
otoño (Foroughbakhch y
col., 2013).
Foroughbakhch y col. (2013),
encontraron que las plantas con mayor
contenido de PC durante todo el año fueron Acacia berlandieri (21.9 %),
Celtis pallida (20.6 %), Prosopis laevigata (20.0 %) y Acacia
wrightii (20.2 %). En tanto que Bernardia myricaefolia,
Lantana macropoda y Mimosa
biuncifera tuvieron menor
contenido de PC de 11.6 %, 13.9 % y 14.3 %, respectivamente.
En la
región árida del norte de México, Mellado y col. (2008) encontraron que la planta
nativa Sphaeralcea angustifolia es un forraje palatable y nutritivo, con
una composición química semejante a la alfalfa (Medicago sativa); es decir, contiene 170 g de PC por kilogramo
y 8.2 MJ/kg de energía metabolizable (EM). Por
su parte, Olivares-Pérez y col. (2013) evaluaron
tres especies de arbustos forrajeros (Phitecellobium dulce, Gliricidia sepium y Haematoxylum brasiletto)
consumidas por las cabras, y reportaron que las dos primeras tienen niveles de
PC de 149.6 g/kg y 103.9 g/kg, respectivamente, valores suficientes para
promover una microflora ruminal óptima en cabras. Algunos árboles del género Prosopis
spp, Acacia spp y Leucaena spp, también han sido considerados
fuentes alternativas de alimento para cabras, ya que sus hojas y frutos presentan niveles de PC considerables (10 % a 33 %) (Sawal
y col., 2004; Ayala-Burgos y col., 2006; Quiroz-Cardoso
y col., 2015; Habib y col., 2016; Carvalho y col., 2017; Santos y col., 2017).
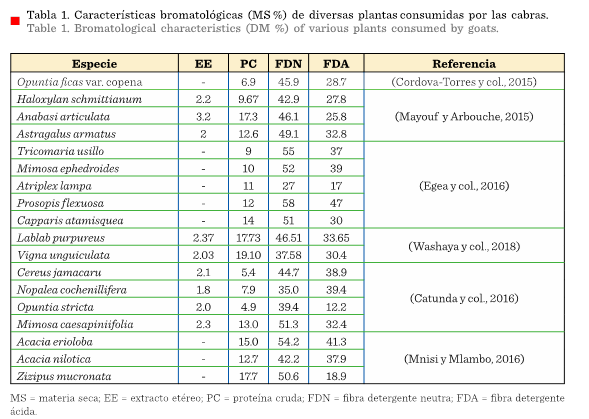
En la Tabla 1 se presenta información nutricional de otras plantas localizadas en el agostadero pastoreado por
caprinos.
Selectividad
de plantas según sexo y estado fisiológico
de las cabras
En
cuanto a la relación entre conducta selectiva y el sexo del animal, se ha
reportado que las hembras son más selectivas y usan más su tiempo en el forrajeo, lo cual se debe a que su eficiencia en la
digestión de los alimentos es menor que la de los machos (Manousidis y col., 2016). En el caso de los machos,
presentan una conducta de mayor masticación que la hembra en todo el año, lo
que facilita la extracción de nutrientes del
alimento por maceración; sin embargo, esta se reduce en la época de apareamiento, mientras que las hembras
solo la aumentan en la etapa fisiológica de
lactancia (Ferretti y col., 2014), para lograr una utilización más
eficiente de los alimentos, por parte de los
microorganismos rumi-nales y obtener la mayor cantidad de energía posible de la dieta (Church y col., 2002), ya que
tienen mayores requerimientos energéticos
para la producción de leche (Moquin y col., 2010).
En las
cabras lactantes se ha observado que su dieta está compuesta por niveles altos de hierbas y bajas cantidades de arbustos (Cardozo-Herrán y col., 2019). Los pastos son
poco consumidos por ellas,
probablemente porque tienen una pared
celular más gruesa y fibrosa, lo cual podría causar un mayor gasto energético
para el desdoblamiento y digestión, que las hojas frágiles del ramoneo y
las hierbas (Hunt y col., 2008). Cabe mencionar que la conducta alimenticia
puede ser transmitida de madre a cría en las etapas pre y postnatal (Smotherman y Robinson, 1987). El
feto puede experimentar sabores en el útero
(Mennella y col., 1995) que son
transmitidos por la sangre de la madre al líquido amniótico (Hai y col., 2014).
Se ha observado que el feto ingiere
cantidades significativas de líquido amniótico durante las últimas
etapas de la gestación, y el tener las vías aéreas abiertas provoca que se
impregnen en el líquido amniótico. Los receptores olfativos fetales pueden ser
estimulados por los olores difundidos desde los capilares sanguíneos, después
de cruzar la barrera placentaria (Nolte y col., 1992; Mennella y col., 1995). Es así que, la madre transmite la experiencia de la selección
de plantas nutritivas y no tóxicas (Hai y col., 2014), y esta enseñanza no se
le da a la cría a través de la lactancia, como sucede en otras especies (Nolte y col., 1992). Este mecanismo evita que la cría presente neofobia, que
es
la resistencia a comer y/o probar nuevos alimentos (Pliner y Hobden, 1992), principal factor que afecta el
consumo de plantas en herbívoros sin experiencia (Provenza, 1995).
Por
otro lado, Mellado y col. (2011) encontraron
que las cabras gestantes seleccionaron plantas con alto contenido de PC,
en comparación con cabras no gestantes. Otro estudio también reportó que
durante la época de sequía, las cabras gestantes seleccionan forrajes con altos niveles de calcio (Ca) y son más selectivas
de plantas con mayor valor nutricional, para lograr satisfacer sus
requerimientos (Villalba y col., 2002).
De acuerdo a los estudios reportados, el estado
reproductivo de las cabras no solo afecta la tasa de masticación de las mismas,
para aprovechar mejor los alimentos y obtener mayor energía, sino también la
selectividad en el consumo de plantas o arbustos.
Modificaciones adaptativas de las cabras para
el consumo de metabolitos presentes en las arbustivas nativas
Las
plantas utilizan estrategias para evitar su consumo
por parte de los herbívoros; entre estos mecanismos se encuentran, endurecimiento de la pared exterior, presencia de es-pinas y síntesis
de sustancias químicas (Alonso-Díaz y col.,
2012; Sebata y Ndlovu, 2012; Cuchillo y col., 2013; Hernández-Orduño y
col., 2015; Pech-Cervantes y col.,
2016). En las plantas existe un
metabolismo primario, esencial para el
crecimiento y desarrollo, asociado a un metabolismo secundario, formado
por un conjunto de vías metabólicas que
generan compuestos químicos que son diversos, entre y dentro de las
poblaciones vegetales. Estos compuestos químicos o metabolitos secundarios tienen en las plantas funciones tan diversas,
como la atracción de polinizadores y dispersores
de semillas, protección de la radiación
ultravioleta, defensa contra del estrés oxidativo, enfermedades,
patógenos y depredadores herbívoros (Speed y col., 2015; Isah, 2019). Las
cabras pueden verse afectadas por estos metabolitos, al igual que otros
herbívoros (Villalba y col., 2016), sin embargo, se han adaptado total o
parcialmente a su efecto antinutricional y tóxico, para poder aprovechar los nutrientes de las plantas (Mkhize y col., 2014).
Los compuestos químicos surgidos de este metabolismo secundario, mayormente
estudiados son terpenoides, alcaloides y
compuestos fenólicos (Makkar, 2006;
Cuchillo y col., 2013; Vadlamani
y col., 2016).
Los terpenoides son derivados de repetidas fusiones de la
cadena de carbono 5 de isopentano (Croteau y
col., 2000); ejemplo de terpenos son los
esteroides, carotenoides y ácido giberélico (Wink, 2015). Por su parte, los
alcaloides son biosintetizados a partir de aminoácidos como la
tirosina, y se caracterizan por una amplia diversidad estructural; no existe una clasificación uniforme de ellos, habiéndose clasificado recientemente con base en su esqueleto de carbono
(Wink, 2015). Los fenoles pertenecen a un grupo más amplio de metabolitos secundarios.
Un grupo importante de fenoles son los
polifenoles, los cuales se clasifican en diferentes grupos en función al número
de anillos de fenol y la unión de estos con
otros anillos. Como ejemplo de compuestos fenólicos se puede mencionar a los flavonoides (Škerget
y col., 2005), los cuales a su vez se
subdividen en flavonol, flavonas,
isoflavonas, flavononas, antocianinas,
antocianidinas y flavonoles (catequina y proantocianidinas) (Manach y
col., 2004). Otro grupo importante de
compuestos fenólicos son los taninos,
específicamente los taninos condensados (TC) e hidrolizados (TH). Los primeros
son referidos como proantocianidinas (Min y col., 2015), mientras que los TH
contienen esteres de ácido gálico o ácido elágico (Olivas-Aguirre y col., 2015).
La
ingesta de metabolitos secundarios puede generar beneficios. Dentro del grupo
de fenoles, los TC son eficaces para el
control de los parásitos en el abomaso e intestino delgado en ovinos y
caprinos, así como para estimular la inmunidad
innata, lo cual se debe a su capacidad
de unirse a proteínas (Hoste y col., 2015; Worku y col., 2016).
Adicionalmente, los taninos en caprinos han mostrado incrementar hasta un 43 %
la producción de leche, así como mejorar su ganancia diaria de peso mediante el
consumo de plantas (Lotus cornicu-latus) con TC a libre acceso (Waghorn,
2008). Con relación al aspecto sanitario, los rumiantes, incluidas las cabras,
que consumen leguminosas (Lotus
corniculatus, Hedysarum coronarium, Lotus
pedunculatus) con TC reducen su producción de gas
ruminal mediante la precipitación de la espuma de las proteínas de las plantas;
de esta manera previenen la aparición de timpanismo (Ramírez-Restrepo y Barry,
2005). Los TC precipitan las proteínas de la ingesta, con lo cual incrementan su
paso por el intestino delgado para ser absorbidos,
protegen la fracción 1 de la proteína, aumentan la absorción de los
aminoácidos esenciales y disminuyen la de los no esenciales (Durmic y Blache,
2012; Mueller-Harvey y col., 2019). Estos
efectos benéficos de los TC se presentan cuando la dieta contiene entre 2 % y 4
% de la materia seca (MS); arriba de
este porcentaje se manifiesta su efecto antinutricional (Durmic y
Blache, 2012; van-Cleef y Dubeux, 2020). La
unión a proteínas cuando hay un efecto
antinutricional, principalmente se lleva a cabo en el rumen, con pH
entre 5.5 a 7.2, haciendo indigestibles las proteínas para la microflora
ruminal. Lasproteínas por lo general son solubles en el abomaso e
intestino delgado con pH de < 3.5 y > 8, respectivamente (Hervás y col.,
2003; Andrabi y col., 2005; Min y col.,
2015). Así también, se unen a enzimas como celulasa, ureasa,
alfa-amilasa, proteasa y beta-glucosilasa, lo que les permite disminuir la
actividad celulolítica, con lo que reducen la digestibilidad de la materia
orgánica. De igual manera, se ligan a membranas y a la pared celular de hongos
y bacterias, aminorando así la fermentación ruminal (Márquez-Lara
y Suárez-Londoño, 2008).
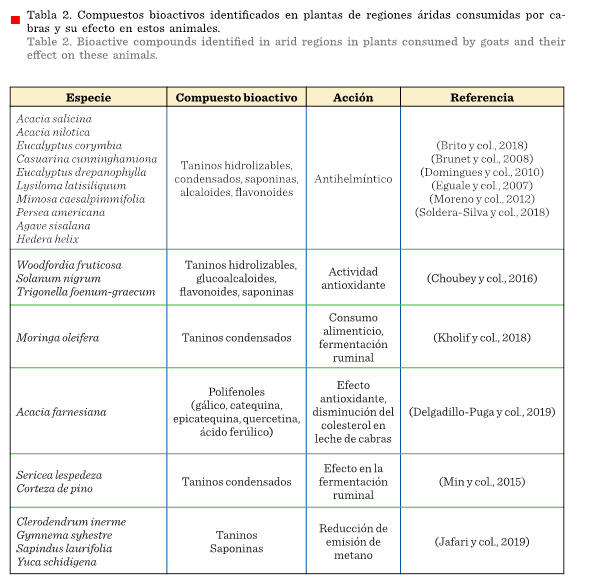
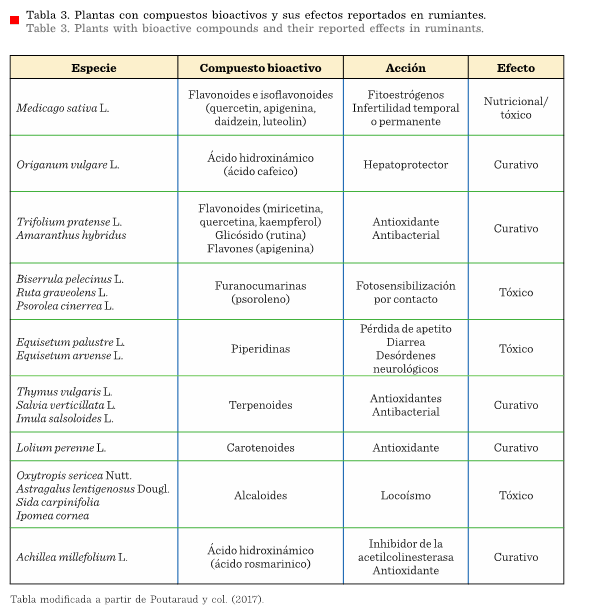
En la
Tabla 2 se muestran diversas plantas que consumen
las cabras, su contenido en compuestos bioactivos y su efecto en estos
animales. En la Tabla 3, se muestran plantas con compuestos bioactivos y su
efecto biológico en general para rumiantes.
El
consumo de estos metabolitos tiene entonces dos objetivos: por un lado, un
efecto an-tinutricional y tóxico, por el
otro, un efecto medicinal o curativo (Villalba y col., 2016). Así que, cuando la intensidad de los efectos
medicinales de los componentes secundarios de las plantas es más fuerte, que la
de los efectos negativos en el estado de salud/productividad, la auto selección del herbívoro al metabolito es esperada. Esta auto selección deberá, en primera
instancia devolver la salud a los animales enfermos (Estell y col.,
2010).
La
cabra ha desarrollado mecanismos conductuales y fisiológicos que le permiten
consumir del agostadero arbustos (generalmente leguminosas) ricos en compuestos
del metabolismo secundario. Schmitt y col. (2020) sugieren que en animales
ramoneadores, como la cabra, la presencia de proteínas ligadas a taninos hace
posible el consumo de plantas taniniferas, estas proteínas inactivan dichos
compuestos. Las proteínas salivales vinculantes de taninos (PSVT) se consideran el
primer mecanismo que puede inactivar los metabolitos secundarios
(taninos) (McArthur y col., 1991; Silanikove
y col., 1996). Ntuthuko y col. (2018) comprobaron que el comportamiento
de búsqueda de alimento de las cabras en libertad les permite regular las tasas
de ingesta de TC en la sabana africana; observaron que las cabras prefieren
pastar más que ramonear, como mecanismo de control de consumo de TC. Distel y
Provenza (1991) encontraron que la
experiencia temprana en el consumo de compuestos secundarios ayuda
posteriormente a definir la preferencia de
plantas que los contengan sobre plantas libres de estos, incrementando
el consumo de TC y taninos totales.
Torres-Fajardo y col. (2019) analizaron
el papel de la infección con nemátodos gastrointestinales y la neutralización de TC, como dos factores que
influyen en la conducta alimenticia en cabras criollas de hábitats de
vegetación heterogénea, y concluyeron que estos dos factores no afectan la ingesta o selección de alimento. Al
contrario, la selección y consumo de plantas nativas taniniferas actúan como
mecanismo de afrontamiento, desarrollado por las cabras para contrarrestar los
efectos negativos de parásitos como de
metabolitos secundarios (Tablas 2 y 3).
Las
características de afrontamiento que ha desarrollado la cabra, la convierten en
modelo para el estudio de efectos tóxicos de
distintas plantas. Welch y col.
(2020) indicaron que cuando los
animales son envenenados con toxinas vegetales extremadamente potentes, como
la cicuta de agua (Cicuta douglasii), a menudo se encuentran muertos con pistas mínimas de la causa de su
fallecimiento. Por ello, se han realizado investigaciones para ayudar en el
diagnóstico de animales envenenados, mediante el análisis químico del contenido del rumen, además de otras muestras biológicas,
como suero, saliva, cerumen, pelo y mucosidad nasal
(Davis y col., 2014, Stonecipher y col., 2019, Lee y col., 2020). Las cabras pueden ser un buen modelo para otras
especies de ganado rumiante, ya que se ha demostrado que los caprinos
son más resistentes a algunas plantas
venenosas (Welch y col., 2016). Por lo tanto, una dosis tóxica letal de
cicuta de agua puede ser menor en especies como el bovino en comparación con lo
que se informa para el caso de las cabras.
Producto de estas adaptaciones, es que las cabras
pueden aprovechar el efecto nutricional de plantas, que para otros rumiantes
pudieran ser tóxicas, como Medicago sativa,
Leucaena leucocephala y Prosopis glandulosa
(Washburn y col., 2002; Gorniak y col., 2008;
Poutaraud y col., 2017).
Efectos
del consumo de arbustivas nativas en el aspecto nutricional, reproductivo y
sanitario en las cabras
Los
compuestos bioactivos presentes en las plantas heterogéneas del agostadero se
pue-den transmitir a través de su consumo, por lo que permiten a la cabra, como resultado de su adaptación anatómica y fisiológica, obtener beneficios
nutricionales, que, a su vez, se pueden transmitir a los productos finales,
como carne, leche y sus derivados. Al respecto, Giorgio y col. (2019)
estudiaron la composición química nutricional de quesos elaborados con leche de cabras (Red Syrian) alimentadas con
las leguminosas Festuca arundinacea, Pisum
sativum, Trifolium alexandrinum, Vicia
sativa y Vicia faba minor, y las gramíneas Hordeum
vulgare y Triticosecale. Las cabras que consumieron Festuca arundicacea tuvieron la más
alta producción láctea con 1 061.5 g/d, así como el mayor porcentaje de grasa
(55 % en base seca). Los quesos elaborados con leche de cabras, que consumieron Trifolium alexandrinum, Triticosecale
y Hordeum vulgare, presentaron un mejor perfil de ácidos grasos.
Con respecto al indicador capacidad total antioxidante en el forraje (TAC-F),
la leche proveniente del consumo de Vicia faba minor y Vicia sativa
mostró valores altos, con 288.4 % y 218 %
TAC-F, respectivamente. En esta investigación se determinó cuales quesos presentaban
características más altas del índice general
de salud de quesos (GHIC Index, por sus siglas en inglés: General Health Index
of Cheese), que es un indicador de la presencia de componentes en el
queso que promueve la salud pública. Los quesos con esta característica
provenían de leche de cabras que consumieron Trifolium
alexandrinum yTriticosecale.
Leparmarai y col. (2019) evaluaron el efecto
de la suplementación alimenticia con extractos de semilla de uva a cabras
Saanen. Se les proporcionaron 7.4 g/100 g MS del extracto conteniendo 3.5 g de fenoles/100 g MS. Las cabras que
consumieron este extracto presentaron mayor porcentaje de composición láctea,
con respecto a grasa, proteína y lactosa. Se observó un aumento en el indicador
de actividad antioxidante en plasma sanguíneo en la semana 11 del consumo del
concentrado de fenoles (211 mmol Fe2+/L),
a diferencia del grupo experimental con 198 mmol
Fe 2+/L.
Di-Trana y col. (2015) estudiaron el efecto nutricional y
antioxidante de Sulla coronarium L, y reportaron que, a comparación de los animales que
consumieron heno de cebada, los que consumieron hojas verdes de Sulla coronarium L,
tuvieron mayor ingesta de MS (1.65 g/d vs. 1.82 g/d, respectivamente), probablemente
por su alto contenido de PC y bajo de fibra detergente neutra (FDN) de las
hojas verdes. En la leche de las cabras, bajo este experimento, se detectó que aquellas que consumieron Sulla coronarium L, el contenido de polifenoles
total en la leche (MTP, por sus siglas en inglés: Milk Total Phenolic) fue mayor, en comparación con las
cabras que consumieron heno de cebada (0.96
g/equivalentes de ácido gálico [EAG]/d y 0.82 g/EAG/d, respectivamente), reportando similar comportamiento para los polifenoles libres en la leche, proporcionando
esta planta un valor adicional en términos de estatus oxidativo, debido a la
presencia de polifenoles, por lo que mejora la calidad láctea.
También los compuestos bioactivos de las plantas
heterogéneas tienen efectos en el aspecto reproductivo y/o sanitario. En el
primero, se ha registrado que la ingestión de arbustos impacta las características seminales en los sementales caprinos. Vera-Avila y col. (1997)
analizaron el efecto del consumo de Acacia berlandieri y Acacia
rigidula en machos Angora activos sexualmente, y encontraron que
aquellos que consumieron estas plantas
tuvieron niveles bajos de testosterona (0.70 ± 0.07 ng/mL), en comparación con
el grupo control, alimentado con heno de alfalfa (1.52 ± ng/mL) (P < 0.001).
Además observaron una reducción en la circunferencia escrotal de 3.0 cm en el día 52 del tratamiento, en
comparación con 0.6 cm en el grupo testigo. La concentración espermática no se
afectó, pero si hubo un efecto según los días de tratamiento. El grupo que consumió Acacias
presentó un valor de 1 211 mill/cel/mL al día 10, aumentando a 2 044
mill/cel/mL para el día 52, mientras que el grupo control solo alcanzó valores
adecuados los días 24 y 38, con 1 575 mill/cel/mL y 1 830 mill/cel/mL, respectivamente.
Asimismo, Mellado (2016) señaló que la calidad del semen y perfiles metabólicos de machos caprinos en
pastoreo eran sensibles a la ingestión de
algunos forrajes del desierto chihuahuense en México.
Okukpe
y col. (2014) estudiaron el efecto del extracto de Mucuna pruriens, planta que contiene L-3, 4-dihydroxyphenyl alanina
(L-Dopa), precursor de la dopamina, y registraron que a dosis de 0.2 mL/kg de peso vivo (PV) obtuvieron valores de 2.30 x
109/mL de conteo espermático, viabilidad del 83.5 % y niveles de testosterona en suero de 2.5 g/dL, a comparación
del grupo testigo (0.1 mL/kg PV, citrato de sildenafil), donde se obtuvieron
los valores de 1.65 x 109/mL,
75.3 %
y 1.40 g/dl.
En el aspecto sanitario, Worku y col. (2016) analizaron
el efecto del consumo de Sericea lespedeza en la inmunidad innata en
animales infectados con parásitos, y encontraron que la concentración de citoquinas proinflamatorias en suero
(TNF-a, IFN-r, G-CSF, GM-CSF, IL-1a, IP-10) fue mayor en los animales
que consumieron esta planta, a comparación
del grupo testigo, que se alimentó con pellets de alfalfa. Así
también, el consumo estimuló la expresión de ciertos genes relacionados con la
inmunidad innata, como los genes TLR4, TLR2,
IFN- g y CD-14, entre otros. Los autores concluyeron
que, consumiendo esta planta, el animal es resiliente a la infección parasitaria, por el efecto
de la presencia de TC y la estimulación de la inmunidad innata.
Las cabras tienen una conducta alimenticia
adaptativa que les permite consumir las plantas
heterogéneas que se encuentran en el agostadero. Sin embargo, es
necesario seguir realizando investigaciones, sobre cómo esta conducta
adaptativa puede tener una influencia en el uso potencial del agostadero y su
repercusión en la producción caprina,
y como esta conducta es modificada
por la presencia de compuestos pertenecientes al metabolismo secundario de las plantas. Por lo tanto,
es necesario elaborar investigaciones sobre el uso adecuado, planeado y
estratégico de los recursos forrajeros de las zonas áridas. Para ello, es
preciso realizar la identificación (taxonómica), distribución y disponibilidad
de las distintas plantas consumidas por las cabras en zonas áridas. Analizar el
perfil de compuestos bioactivos (metabolitos secundarios), con
respecto a identificación de moléculas y actividad antioxidante, así como de
los elementos nutricionales (PC, ácidos
grasos, fracción fibrosa). Investigar los efectos en la salud (control
de parasitosis, control de infecciones bacterianas) y la productividad
(ganancia de peso, conversión alimenticia)
de las cabras al incluirlos en la
dieta. También, es importante conocer el efecto de la inclusión en la
calidad de los productos obtenidos de las
cabras (carne, leche y queso),
particularmente sobre el contenido de ácidos grasos y antioxidantes. Se
deben realizar diseños experimentales que logren
explicar los modos de acción (absorción, distribución,
dinámica y cinética) de polifenoles, terpenos y alcaloides. Sobre todo, que los
resultados de estos hallazgos puedan ser
extrapolados a cualquier
agroecosistema.
CONCLUSIONES
Las
cabras se han adaptado a zonas agroecológicas áridas, mediante mecanismos
conductuales y fisiológicos, que les permiten seleccionar, consumir alimento y
producir en condiciones limitantes para otras
especies animales. Las adaptaciones desarrolladas por las cabras, de
acuerdo con las variaciones en disponibilidad y calidad del agostadero árido,
deben ser aprovechadas, con la finalidad de establecer estrategias de manejo,
para favorecer su producción. Se requiere más
investigación acerca de la respuesta adaptativa de las cabras al consumo
de metabolitos secundarios y sus efectos
sobre procesos reproductivos, nutricionales, estado sanitario y en los
productos derivados de la leche o
carne de esta especie.
Referencias
Ackermans, L. N., Martín, F. L., Hummel, J.,
Muller, D. W. H., Clauss, M., and Hatt,
J. M. (2019). Feeding selectivity for diet abrasiveness in shep
and goats. Small Ruminant Research. 175: 160-164.
Alonso-Díaz, M. A., Torres-Acosta, J. F. J.,
Sandoval-Castro, C. A., and Capetillo-Leal, C. M.
(2012). Amino acid profile of the protein from whole saliva of goats and sheep
and its interaction with tannic acid and tannins extracted from the fodder of
tropical plants. Small Ruminant Research. 103(1): 69-74.
Andrabi, S. M., Ritchie, M. M., Stimson, C., Horadagoda,
A., Hyde, M., and McNeill, D. M. (2005). In vivo assessment of the
ability of condensed tannins to interfere with the digestibility of plant
protein in sheep. Animal Feed Science and Technology. 122(1-2): 13-27.
Ayala-Burgos, A., Cetina-Gongora, R.,
Zapata-Campos, C. C., Capetillo-Leal, C. y
Sandoval-Castro, C. A. (2006). Composición
Química - Nutricional de Árboles Forrajeros. Merida, Yucatán: Universidad Autónoma de Yucatán.
54 Pp.
Berridge, K. C. (1996). Food reward – brain
structures of wanting and liking. Neuroscience and Biobehavioral Reviews.
20(1): 1-25.
Bojkovski, D., Štuhec,
I., Kompan, D., and Zupan, M. (2014). The behavior of
sheep and goats cograzing on pasture with different
types of vegetation in the Karst region. Journal of Animal Science. 92(6):
2752-2758.
Boyazoglu, J., Hatziminaoglou,
I., and Morand-Fehr, P. (2005). The role of the goat
in society: Past, present and perspectives
for the future. Small Ruminant Research. 60(1-2): 13-23.
Brito, D. R. B., Costa-Júnior, L. M., Garcia, J. L., Torres-Acosta, J.
F. J., Louvandini, H., Cutrim-Júnior,
J. A. A., ..., and Soares, E. D. S. (2018). Suplementation
with dry Mimosa caesalpiniifolia leaves can
reduce the Haemonchus contortus
worm burden of goats. Veterinary Parasitology. 252: 47-51.
Brunet, S., De-Montellano, C. M. O., Torres-Acosta, J. F. J.,
Sandoval-Castro, C. A., Aguilar-Caballero, A. J., Capetillo-Leal, C., and Hoste, H.
(2018). Effect
of the consumption of Lysiloma
latisiliquum on the larval establishment
of gastrointestinal nematodes in goats. Veterinary Parasitology. 157(1-2):
81-88.
Calder, W. A. (1984). Size, Function and Life history. Mineola,
New York: Harvard University Press, Cambridge. 423 Pp.
Cardozo-Herrán,
M., Ayala-Burgos, A., Aguilar-Perez, C., Ramírez-Avilés, L., Ku-Vera,
J., and Solorio-Sánchez,
F. J. (2019). Productivity of lactanting goats under three
grazing systems in the tropics of México. Agroforest System.
1-9.
Carvalho, W. F. D., Oliveira, M. E. D., Alves, A. A., Moura, R. L. D.,
and Moura, R. M. D. A. D. S. (2017). Energy supplementation in goats under a silvopastoral system of tropical grasses and leucaena. Revista
Ciencia Agronomica. 48(1): 199-207.
Catunda, K.
L. M., de-Aguiar, E. M., de-Góes-Neto, P. E.,
da-Silva, J. G. M., Moreira, J. A., do-Nascimento-Rangel, A. H., and de-Lima-Júnior, D.
M. (2016). Grosscomposition, fatty acid profile and sensory characteristics of Saanen goat milk fed
with Cacti varieties. Tropical Animal Health and Production. 48(6):
1253-1259.
Chimphango, B. M. S., Gallant, H. L., Poulsen,
C. Z., Poulsen, C. Z., Samuels, M. I., Hattas, D., …,
and Howieson, J. (2020). Native legume species as
potential fodder crops in the mediterranean renosterveld shrubland, South Africa. Journal of Arid Enviroments.
173: 104015.
Choubey, M., Pattanaik, A. K., Baliyan, S., Dutta, N., Jadhav, S. E., and Sharma, K.
(2016). Dietary suplementation of a novel phytogenic
feed adictive: effects on nutrient metabolism, antioxidant,
status and immune response of goats. Animal
Production Science. 56(10): 1612-1621.
Church, D. C., Pond, W. G., and Pond, K. R. (2002). Nutrición y alimentación de los animales. (Second edition). Madrid,
España: Limusa Wiley.
438 Pp.
Cordova-Torres,
A. V., Mendoza-Mendoza, J. C., Bernal-Santos, G., García-Gasca, T., Kawas, J. R., Costa, R. G., …, and Andrade-Montemayor, H. M. (2015). Nutritional composition, in vitro
degradability and gas production of Opuntia ficus indica and four other
wild cacti species. Life Science Journal. 12(2).
Croteau, R., Kutchan, T. M., and Lewis, N. G.
(2000). Natural products (secondary metabolites). Biochemistry and Molecular
Biology of Plants. 24:
1250-1319.
Cuchillo,
H., Puga, D., Wrage-Mönning, N., Espinosa, M.,
Montaño, B., Navarro-Ocaña, A., …, and Pérez-Gil, R. (2013). Chemical composition, antioxidant
activity and bioactive compounds of vegetation species ingested by goats on
semiarid rangelands. Journal of Animal and Feed Sciences. 22(2):
106-115.
Davis, T. Z., Stegelmeier, B. L., and Hall, J.
O. (2014). Analysis in horse hair as a means of evaluating selenium toxicoses
and long-term exposures. Journal of Agricultural and Food Chemistry.
62(30): 7393-7397.
Delgadillo-Puga, C., Cuchillo-Hilario,
M., León-Ortiz, L., Ramírez-Rodríguez, A., Cabiddu,
A., Navarro- Ocaña, A., ...,
and Pedraza-Chaverri, J. (2019). Goats’ feeding
supplementation with Acacia farnesiana pods and their
relationship with milk composition: Fatty
acids, polyphenols, and antioxidant activity. Animals. 9(8): 515.
Devendra, C. (2010). Concluding synthesis and the future for sustainable
goat production. Small Ruminant Research. 89(2-3): 125-130.
Distel, R. A. and Provenza
F. D. (1991). Experience early in life affects voluntary intake of blackbrush
by goats. Journal of Chemical Ecology.
17(2): 431-450.
Di-Trana, A., Bonanno,
A., Cecchini, S., Giorgio, D., Di-Grigoli,
A., and Claps, S. (2015). Effects of Sulla forage (Sulla coronarium
L.) on the oxidative status and milk polyphenol content in goats. Journal of
Dairy Science. 98(1): 37-46.
Domingues, L. F., Botura,
M. B., Cruz, A. C. F. G. D., Yuki, C. C., Silva, G. D. D., Costa, M. S., ...,
and Branco, A. (2010). Evaluation of anthelmintic
activity of liquid waste of Agave sisalana (sisal) in goats. Revista Brasileira de Parasitologia Veterinária. 19(4):
270-272.
Durmic, Z. and Blache, D. (2012). Bioactive plants and plant products :
Effects on animal function, health and welfare. Animal Feed Science and
Technology. 176: 150-162.
Egea, A. V., Allegretti,
L. I., Paez-Lama, S. A., Grilli,
D., Fucili, M., Guevara, J. C., and Villalba, J. J. (2016). Diet mixing and condensed tannins
help explain foraging preferences by Creole
goats facing the physical and chemical diversity of native woody plants in the
central Monte desert (Argentina). Animal
Feed Science and Technology.
215: 47-57.
Eguale, T., Tilahun,
G., Debella, A., Feleke,
A., and Makonnen, E. (2007). Haemonchus contortus: in vitro and in vivo anthelmintic
activity of aqueous and hydro-alcoholic extracts of Hedera helix. Experimental
Parasitology. 116(4): 340–345.
Estell, R. E., Utsumi, S. A., and Cibils, A. F. (2010). Measurement
of monoterpenes and sesquiterpenes in serum, plasma, and rumen fluid
from sheep. Animal Feed Science and Technology. 158(1-2): 104-109.
FAO, Food and Agriculture Organization of the United Nations (2007). Zonas áridas del mundo. [En línea]. Disponible en: http://fao.org/3/y5738s02.pdf.
Fecha de consulta: 8 de
diciembre de 2019.
FAO, Food and Agriculture Organization of the United Nations (2020). FAOSTAT. [En línea]. Disponible en: http://faostat.fao.org/site/409/default.aspx.
Fecha de consulta: 5 de enero
de 2020.
Ferretti, F., Costa, A., Corazza, M., Pietrocini, V., Cesaretti, G.,
and Lovari, S. (2014). Males are faster foragers than females: Intersexual zdifferences of foraging behaviour
in the Apennine chamois. Behavioral Ecology and Sociobiology. 68(8):
1335-1344.
Foroughbakhch, R., Hernández-Piñero,
J. L., Carrillo-Parra, A., and Rocha-Estrada, A. (2013). Composition and animal
preference for plants used for goat feeding in semiarid Northeastern Mexico. Journal
of Animal and Plant Sciences. 23(4): 1034-1040.
Ginane, C., Baumont,
R., and Favreau-Peigné, A. (2011). Perception and
hedonic value of basic tastes in domestic ruminants. Physiology & Behavior.
104(5): 666-674.
Ginane, C., Bonnet, M., Baumont,
R., and Revell, D. K. (2015). Feeding behaviour in
ruminants: A consequence of interactions
between a reward system and the regulation of metabolic homeostasis. Animal
Production Science. 55(3):
247-260.
Giorgio, D., Di-Trana, Di-Napoli, A. M., Sepe,
L., Cechinni, S., Rossi, R., and Claps, S. (2019).
Comparison of cheeses from goats fed 7 forages based on a new health index. Journal of Dairy Science. 102:
6790-6801.
Goetsch, A. L. (2019). Recent research of
feeding practices and the nutrition of lactantig dairy goats. Journal Applied
Animal Research. 47(1): 103-114.
Gorniak, S. L., Pfister, J. A., Lanzonia, E. C., and Raspantini,
E. R. (2008). A note on averting goats to a
toxic but palatable plant, Leucaena leucocephala. Applied
Animal Behaviour Science. 111(3-4): 396-401.
Gutteridge, R. C. and Shelton, H. M. (1994).
Animal Production Potential of Agroforestry Systems. In M. Copland, J. W. Djajanegra,
and A. Sabrani (Eds.), Agroforestry
and animal production for human welfare (pp. 7-17). Canberra: Association
Agroforestry Animal Production.
Habib, G., Khan, N. A., Sultan, A., and Ali, M. (2016). Nutritive value
of common tree leaves for livestock in the semi-arid and arid rangelands of
Northern Pakistan. Livestock Science.184: 64-70.
Hai, P. V., Schonewille, J. T., Dam-Van, T.,
Everts, H., and Hendriks, W. H. (2014). Exposure to a novel feedstuff by goat
dams during pregnancy and lactation versus pregnancy alone does not further
improve post-weaning a cceptance of this feedstuff by
their kids. Journal of the Science of Food and Agriculture. 96(6):
2215-2219.
Hernández-Orduño, G., Torres-Acosta, J. F. J.,
Sandoval-Castro, C. A., Capetillo-Leal, C. M., Aguilar-Caballero, A. J., and
Alonso-Díaz, M. A. (2015). A tannin-blocking agent does not modify the preference of sheep towards
tannin-containing plants. Physiology & Behavior. 145: 106-111.
Hervás, G., Frutos, P., Giráldez, F. J.,
Mantecón, Á. R., and Del-Pino, M. C. Á. (2003). Effect of different doses of
quebracho tannins extract on rumen fermentation in ewes. Animal Feed Science and Technology. 109(1-4): 65-78.
Hetem, R. S., de-Witt, B. A., Fick, L. G.,
Fuller, A., Maloney, S. K., Meyer, L. C. R., …, and Kerley, G. I. H. (2011).
Effects of desertification on the body temperature, activity and water turnover
of Angora goats. Journal of Arid Environments. 75(1): 20-28.
Heuermann, N., van-Langevelde,
F., van-Wieren, S. E., and Prins, H. H. T. (2011).
Increased searching and handling effort in tall swards lead to a Type IV
functional response in small grazing herbivores. Oecologia. 166(3): 659-669.
Hoste, H., Torres-Acosta, J. F. J.,
Sandoval-Castro, C. A., Mueller-Harvey, I., Sotiraki, S., Louvandini, H., …, and Terrill, T. H. (2015). Tannin containing legumes as a model
for nutraceuticals a) gainst digestive parasites in
livestock. Veterinary Parasitology. 212(1-2): 5-17.
Hunt, J. W., Dean, A. P., Webster, R. E., Johnson, G. N., and Ennos, A. R. (2008). A Novel Mechanism by which Silica
Defends Grasses Against Herbivory. Annals of Botany. 102(4): 653-656.
Isah, T. (2019). Stress and defense
responses in plant secondary metabolites
production. Biology Research. 52(39): 2-25.
Jafari. S., Ebrahimi, M., Goh, Y. M, Rajion,
M. A., Jahromi M. F., and Al-Jumaili,
W. S. (2019). Manipulation of rumen fermentation and methane gas production by
plant secondary metabolites (saponin, tannin and essential oil): a review of
ten-year studies. Annual Animal Science.
19: 3-29.
Kholif, A. E., Gouda, G. A., Anele, U.Y.,
and Galyean, M. L. (2018). Extract of Moringa
oleifera leaf improves feed utilization of lactating Nubian goats. Small
Ruminant Research. 158: 69-75.
Koluman-Darcan, N. and Silanikove,
N. (2018). The advantages of goats for future adaptation to Climate Change: A
conceptual overview. Small Ruminant Research. 163: 34-38.
Lee, S. T., Welch, K. D., Stonecipher, C. A.,
Cook, D., Gardner, D. R., and Pfister, J. A. (2020). Analysis of rumen contents
and ocular fluid for toxic alkaloids from goats and cows dosed larkspur
(Delphinium barbeyi), lupine (Lupinus
leucophyllus), and death camas (Zigadenus paniculatus).
Toxicon. 176: 21-29.
Leparmarai, P. T., Sinz,
S., Kunz, C., Liesegang, A., Ortmann,
S., Kreuzer, M., and Marquardt, S. (2019). Transfer of total phenols from a grapeseed-supplemented diet to dairy
sheep and goat milk, and effects on performance
and milk quality. Journal of Animal Science. 97(4): 1840-1851.
Makkar, H. P. S.
(2006). Chemical and biological assays for quantification of major plant secondary metabolites. BSAP Occasional Publication. 34:
235-249.
Manach, C., Scalbert,
A., Morand, C., and Rémésy,
C. (2004). Polyphenols: food sources and
bioavailability. The American
Journal of Clinical Nutrition.
79(5): 727-747.
Manousidis, T., Kyriazopoulos,
A. P., Parissi, Z. M., Abraham, E. M., Korakis, G., and Abas, Z. (2016). Corrigendum to Grazing behaviour, forage selection and diet composition of goats in a Mediterranean woody rangeland. Small Ruminant Research. 145:
142-153.
Márquez-Lara,
D. y Suárez-Londoño, Á. (2008). El uso de taninos condensados como alternativa
nutricional y sanitaria en rumiantes. Revista de Medicina
Veterinaria.
1(16): 87-109.
Mayouf, R. and Arbouche,
F. (2015). Seasonal variations in the chemical composition and nutritional
characteristics of three pastoral species from Algerian arid rangelands. Livestock
Research of Rural Development. 27: 3.
McArthur, C., Hagerman, A. E., and Robbins, C. T. (1991). Physiological
strategies of mammalian herbivores against plant defenses. In R. Thomas and C.
T. Robbins (Eds.), Plant defenses against mamalian
herbivory (pp.103-114). Boca Ratón, Florida: CRC
Press, Inc.
Mclntosh, M., M., Holechek,
J. L., Spiegal, S. A., Cibils,
A. F., and Estell, R. E. (2019). Long-term declining trends in Chihuahuan desert forage production in relation to
precipitation and ambient temperature. Rangeland Ecology & Management.
72(6): 976-987.
Mellado, M. (2016). Dietary selection by
goats and the implications for range management in the Chihuahuan
Desert: A review. Rangeland Journal.
38(4): 331-341.
Mellado, M., Aguilar, C. N., Arévalo, J. R., Rodríguez, A., García, J. E., and Mellado, J. (2011). Selection fornutrients by pregnant goats on a microphyll desert scrub. Animal. 5(6): 972-979.
Mellado, M., Salas, G., and Pittroff, W. (2008). Sphaeralcea angustifolia as a substitute for alfalfa for growing goats. Rangeland Ecology & Management.
61(4): 405-411.
Mennella, J. A., Johnson, A., and Beauchamp, G. K. (1995). Garlic
ingestion by pregnant women alters the odor of amniotic fluid. Chemical
Senses. 20(2): 207-209.
Min, B. R., Perkins, D., Wright, C., Dawod,
A., Min, B. J., Terrill, T. H., ..., and Gurung, N. (2015). Effects of feeding
two different tannin-containing diets on ruminal
fermentation profiles and microbial community changes in meat goats. Agriculture,
Food and Analytical Bacteriology. 5: 153-165.
Mkhize, N. R., Scogings, P. F., Nsahlai, I. V., and Dziba, L. E.
(2014). Diet selection of goats depends on season: roles of plant physical and
chemical traits. African Journal of Range and Forage Science. 31(3):
209-214.
Mnisi, C. M. and Mlambo, V. (2016).
Influence of harvesting site on chemical composition and potential
protein value of Acacia erioloba, A. nilotica and Ziziphus mucronata leaves for ruminants. Journal of Ani-mal
Physiology and Animal Nutrition. 101(5): 994-1003.
Moquin, P., Curry, B.,
Pelletier, F., and Ruckstuhl, K. E. (2010).
Plasticity in the rumination behaviour of bighorn sheep: contrasting strategies
between the sexes? Animal Behaviour.
79(5): 1047-1053.
Moreno, F. C., Gordon, I. J., Knox, M. R., Summer,
P. M., Skerrat, L. F., Benvenutti,
M. A., and Saumell, C. A. (2012). Anthelmintic
efficacy of five tropical native Australian plants against Haemonchus
contortus and Trichostrongylus
colubriformis in experimentally infected goats (Capra hircus).
Veterinary Parasitology. 187: 237-243.
Mueller-Harvey, I., Bee, G., Dohme-Meier, F., Hoste,
H., Karonen, M., Kölliker, R. …, and Waghorn, G. C. (2019). Benefits
of condensed tannins in forage legumes fed to ruminants: importance of
structure, concentration, and diet composition. Crop Science. 59(3):
861-885.
Nielsen, B. L., De-Jong, I. C., and Devries, T. J. (2016). Nutrition and the Welfare of farm animals. In J.
C. P. Clive (Ed.), Nutrition and
the welfare of farm animals (pp.
59-84). Switzerland: Springer International Publishing.
Nolte, D. L., Provenza, F. D., Callan, R.,
and Panter, K. E. (1992). Garlic in the ovine fetal enviroment. Physiology & Behavior. 52:
1091-1093.
Ntuthuko, R., Ignas, M. A., Heitkönig, P. F., Scogings., Hattas, D., Luthando,
E., …, and Prins-Willem, F. (2018). Seasonal
regulation of condensed tannin consumption by free-ranging goats in a semi-arid
savanna. Plos One. 13: 1-17.
Okukpe, K. M., Adeloye,
A. A., and Soladoye, A. O. (2014). Effects of varying
levels of mucuna pruriens
extract on reproductive performance of west african dwarf bucks.
Centrepoint Journal. 20(2):
95-102.
Olivares-Pérez,
J., Avilés-Nova, F., Albarrán-Portillo, B., Castelán-Ortega, O., and
Rojas-Hernández, S. (2013). Use of three fodder trees in the feeding of goats in the subhumid
tropics in Mexico. Tropical
Animal Health Production. 45(3): 821-828.
Olivas-Aguirre, F. J., Wall-Medrano, A., González-Aguilar, G. A., López-Díaz, J. A., Álvarez-Parrilla, E.,
de-la-Rosa, L. A. y Ramos-Jiménez, A. (2015). Taninos hidrolizables,
bioquímica, aspectos nutricionales y analíticos
y efectos en la salud. Nutrición Hospitalaria. 31(1):
55-66.
Osoro,
K., Ferreira, L. M. M., García, U., Jáuregui, B.
M., Martínez, A., Rosa-García, R., and Celaya, R. (2013). Diet selection
and performance of sheep and goats grazing on different heathland vegetation
types. Small Ruminant Research. 109(2-3): 119-127.
Pech-Cervantes, A. A., Ventura-Cordero, J., Capetillo-Leal, C. M.,
Torres-Acosta, J. F. J., and Sandoval-Castro, C. A. (2016). Relationship between intake of
tannin-containing tropical tree forage, PEG supplementation, and salivary haze development in hair sheep and
goats. Biochemical Systematics and Ecology. 68: 101-108.
Pliner, P. and Hobden,
K. (1992). Development of a scale to measure the trait of food neophobia in
humans. Appetite. 19(2): 105-120.
Poutaraud, A., Michelot-Antalik,
A., and Plantureux, S. (2017). Grasslands: a source
of secondary metabolites for livestock health. Journal of Agricultural and
Food Chemistry. 65(31): 6535-6553.
Provenza, F. D. (1995). Postingestive
feedback as an elementary determinant of food preference and intake in
ruminants. Journal of Range Management. 48: 2-17.
Quiroz-Cardoso, F., Rojas-Hernández, S., Olivares-Pérez,
J., Hernández-Castro, E., Jiménez-Guillén, R., Córdova-Izquierdo, A., … y Abdel-Fattah, S. (2015). Composición nutricional, consumo e índices de palatabilidad
relativa de los frutos de tres acacias en la alimentación de ovejas y cabras. Archivos
de Medicina Veterinaria. 47(1):
33-38.
Ramírez-Restrepo, C. A. and Barry, T. N. (2005). Alternative temperate forages
containing secondary compounds for improving sustainable productivity in
grazing ruminants. Animal Feed Science and Technology. 120 (3-4):
179-201.
Reid, R. S., Fernández-Giménez, M. E., and
Galvin, K. A. (2014). Dynamics and resilience of rangelands and pastoral
peoples around the globe. Annual Review of Enviroment
and Resource. 39: 217-242.
Robbins, C. T., Spalinger, D. E., and
van-Hoven, W. (1995). Adaptation of ruminants to browse and grass diets: are
anatomical-based browser-grazer interpretations valid? Oecologia. 103(2): 208-213.
Rosa-García,
R., Celaya, R., García, U., and Osoro, K. (2012). Goat
grazing, its interactions with other herbivores and biodiversity conservation
issues. Small Ruminant Research. 107(2-3): 49-64.
Santos, K. C., Magalhães, A. L. R., Silva, D.
K. A., Araújo, G. G. L., Fagundes,
G. M., Ybarra, N. G., and Abdalla, A. L. (2017). Nutritional potential of forage species found in Brazilian Semiarid region. Livestock
Science. 195: 118-124.
Sawal, R. K., Ratan, R., and Yadav, S. B.
S. (2004). Mesquite (Prosopis juliflora)
pods as a feed resource for livestock - A review. Asian-Australasian Journal
of Animal Sciences. 17(5): 719-725.
Schmitt, H. M., Ward, D., and Shrader, M. A. (2020). Salivary tannin-binding
protein: A foranging Advantage for Goats. Livestock
Science. 234: 103974.
Sebata, A. and Ndlovu, L. R. (2012). Effect of shoot morphology on
browse selection by free ranging goats in a semi-arid savanna. Livestock
Science. 144(1-2): 96-102.
Silanikove, N. (2000a). Goat production under
harsh environmental conditions: The physiological basis and the challenge, in The
Opportunities and Challenges for Enhancing Goat Production in East
Africa. Langston University, Langston. [En línea]. Disponible en:
https://www.researchgate.net/publication/236162686_Goat_production_under_harsh_environmental_conditions_The_physiological_basis_and_the_challenge. Fecha de consulta: 7 de julio de 2019.
Silanikove, N. (2000b). The physiological basis
of adaptation in goats to harsh enviroments. Small
Ruminant Reseacrh. 35(3): 181-193.
Silanikove, N., Gilboa, N., Perevolotsky,
A., and Nitsan, Z. (1996). Goats fed
tannin-containing leaves do not exhibit toxic syndromes. Small Ruminant
Research. 21(3): 195-201.
Silanikove, N. and Koluman-Darcan,
N. (2015). Impact of climate change on the dairy industry in temperate zones:
Predications on the overall negative impact and on the positive role of dairy goats in adaptation to earth
warming. Small Ruminant Research. 123(1): 27-34.
Škerget, M., Kotnik, P., Hadolin, M., Hraš, A. R., Simonič, M., and Knez, Ž. (2005). Phenols, proanthocyanidins,
flavones and flavonols in some plant materials and
their antioxidant activities. Food Chemistry. 89(2): 191-198.
Smotherman, W. P. and Robinson, S. R. (1987).
Prenatal expression of species-typical
action patterns in the rat fetus
(Rattus norvegicus). Journal of Comparative Psychology. 101(2): 190-196.
Soldera-Silva, A., Seyfried,
M., Campestrini, L. H., Zawadzki-Baggio, S. F., Minho, A. P., Molento, M. B.,
and Maurer, J. B. B. (2018). Assessment of anthelmintic activity and
bio-guided chemical analysis of Persea americana seed extracts. Veterinary
Parasitology. 251: 34-43.
Speed, M. P., Fenton, A., Jones, M. G., Ruxton, G. D., and Brockhurst, M. A. (2015). Coevolution can explain defensive
secondary metabolite diversity in plants. New Phytologist. 208(4):
1251-1263.
Stonecipher, C. A., Lee, S. T., Green, B. T.,
Cook, D., Welch, K. D., Pfister, J. A., and Gardner, D. R. (2019). Evaluation
of noninvasive specimens to diagnose lives-tock exposure to toxic larkspur
(Delphinium spp.). Toxicon. 161: 33-39.
Torres-Acosta,
J. F. de J., Alonso-Díaz, M. Á., Hoste, H., Sandoval-Castro, C. A., and
Aguilar-Caballero, A. J. (2008). Efectos negativos y positivos del consumo de
forrajes ricos en taninos en la producción de caprinos. Tropical and Subtropical Agroecosystems. 9(1): 83-90.
Torres-Fajardo,
R. A., Navarro-Alberto, J. A., Ventura-Cordero, J., González-Pech, G.,
Sandoval-Castro, C. A., Chan-Pérez, J. I., and Torres-Acosta, J. F. J. (2019). Intake and selection of goats grazing
heterogeneous vegetation: effect of gastrointestinal nematodes and condensed tannins. Rangeland Ecology &
Management. 72(6): 946-953.
Vadlamani, P. S., Devi, B. D., Poosarala, A., and Bapatla, V. K.
(2016). Identification of plant sources from north Andhra Pradesh exhibiting immunomodulatory activity using Balb/c
models. International Journal of Pharma and Bio Sciences. 7(1): 295-300.
van-Cleef, F. and Dubeux, J.
(2020). Condensen tannins in forage legumes. EDIS. (1):
4-4.
van-Soest, P. J. (1994). Nutritional
Ecology of the Ruminant. Ithaca, USA: Comstock Publishing Associates. 463 Pp.
Ventura-Cordero,
J., Gozález-Pech, P. G., Sandoval-Castro, C. A.,
Torres-Acosta, J. F. J., and Tun-Garrido, J. (2017). Feed resource
selection by Criollo goats browsing a tropical deciduous forest. Animal Production
Science. 58: 2314-2320.
Vera-Avila, H. R., Forbes, T. D. A., Berardinelli, J. G., and Randel, R.
D. (1997). Effect of dietary phenolic amines on testicular function and
luteinizing hormone secretion in male angora goats. Journal of Animal
Science. 75(6): 1612-1620.
Villalba, J. J., Costes-Thiré,
M., and Ginane, C. (2016). Phytochemicals in animal health: Diet selection and trade-offs
between costs and benefits. Proceedings of the Nutrition Society. 76(2):
113-121.
Villalba, J. J., Provenza,
F. D., and Banner, R. E. (2002). Influence of macronutrients and activated
charcoal on intake of sagebrush by sheep and goats 1, 2. Journal of Animal Science.
80(8): 2099-2109.
Waghorn, G. (2008). Beneficial and detrimental
effects of
dietary condensed tannins for sustainable sheep and goat production – Progress
and challenges. Animal Feed Science and Technology. 147(1-3): 116-139.
Washburn, K. E., Breshears, M. A., Ritchey, J.
W., Morgan, S. E., and Streeter, R. N. (2002). Honey mesquite toxicosis in a goat. Journal of the American Veterinary Medical
Association. 220(12): 1837-1839.
Washaya, S., Mupangwa,
J., and Muchenje, V. (2018). Chemical composition of
Lablab purpureus and Vigna unguiculata and their subsequent effects on methane production in Xhosa lop-eared goats. South
African Journal of Animal Science. 48(3): 445-458.
Welch, K. D., Gardner, D. R., Green, B. T., Stonecipher,
C. A., Cook, D., and Pfister, J. A. (2016). Comparison of the serum toxicokinetics of larkspur toxins in cattle, sheep and goats.
Toxicon. 119: 270-273.
Welch, K. D., Stonecipher, C. A., Lee, S. T.,
and Cook, D. (2020). The acute toxicity of water hemlock (Cicuta
douglasii) in a goat model. Toxicon.
176: 55-58.
Wink, M. (2015). Modes of action of herbal medicines and plant secondary
metabolites. Medicines. 2(3): 251-286.
Worku, M., Abdalla, A., Adjei-Fremah, S., and Ismail, H. (2016). The impact of diet
on expression of genes involved in innate
immunity in goat blood. Journal of Agricultural Science.
8(3): 1.
Zeder, M. A. and Hesse, B. (2000). The
initial domestication of goats (Capra hircus) in the
Zagros mountains 10,000 years ago. Science. 287(5461):
2254-225.
Zobel, G., Neave, W. H., and Webster, J. (2019). Understanding natural
behavior to improve dairy goat (Capra hircus) manegement systems. Translational Animal Science.
3(1): 212-224.