Microcápsulas y microesferas: una visión
a la caracterización integral y aplicación para la liberación de medicamentos
biotecnológicos
Microcapsules and microspheres: A vision to integral
characterization and applications for biotechnological
drugs delivery
Microcápsulas para la liberación de biomedicamentos
Elvia
Zárate-Hernández, Rosa Alejandra Hernández-Esquivel, José Trinidad
Pérez-Urizar*
*Correspondencia: jpurizar@uasl.mx/Fecha
de recepción: 9 de octubre de 2020/Fecha
de aceptación: 12 de enero de
2021/Fecha de publicación: 30 de
enero de 2021.
Universidad Autónoma de San Luis Potosí, Facultad de Ciencias Químicas,
Laboratorio de Farmacología, Avenida Dr. Manuel Nava núm. 6, Zona
Universitaria, San Luis Potosí, San Luis Potosí, México,
C. P. 78210.
Resumen
Los
microacarreadores basados en microcápsulas y microesferas han sido ampliamente estudiados y ensayados para controlar la liberación de
medicamentos biotecnológicos (MB), disminuyendo la dosificación o
modificando la vía de administración. Los métodos para la obtención de
microacarreadores, son complejos y variados,
por lo que es necesario determinar los requisitos mínimos que debe
cumplir el sistema. El objetivo de este trabajo fue establecer las principales características que deben ser
evaluadas en los microacarreadores para garantizar
que la actividad biológica de los medicamentos biotecnológicos permanezca
intacta a través del proceso de microencapsulación y, por lo tanto, que la
seguridad del MB (desarrollo de
reacciones inmunes) se mantenga inalterada. Las características a evaluar de un
microacarreador deben describir las propiedades del
material, tamaño y forma del sistema, carga de la partícula, funcionalidad,
eficiencia de la microencapsulación y la
cinética de liberación. Mientras que
la integridad de los MB puede ser evaluada a partir de parámetros
críticos de calidad: estructura y función biológica del MB, pureza del producto, presencia de agregados de alto peso
molecular, estructura de orden superior y
ensayos de actividad biológica. La caracterización de los microacarreadores
debe enfocarse en la seguridad del biopolímero y proteínas ensayadas.
Palabras
clave: medicamento
biotecnológico, microesferas,
estabilidad proteica.
Abstract
Microcarriers based on microcapsules and microspheres
have been widely studied and tested to control the release of
biotechnological drugs (BD), diminishing the dosage or
modifying the route of administration. The methods for obtaining
microcarriers are complex and varied, so it is necessary to determine the
minimum characteristics with which the system must comply.
The aim of this work was to establish the main characteristics that should be
evaluated in the microcarriers in order to
guarantee that the biological activity of biotechnological
drugs remains intact through the
microencapsulation process, and therefore the safety of the BD (development
of immune reactions) remains unaltered. The characteristics of a
microcarrier to be evaluated must describe the properties of
the material, the size and shape of
the system, the particle load, functionalization, the microencapsulation
efficiency, and the kinetics of liberation. Whereas the integrity of BD can be evaluated by critical
quality parameter such as: structure and biological function of the BD, product purity, presence of high molecular weight aggregations, higher order structure and biological activity tests. The characterization of the microcarriers must focus on the safety of the bipolymer and proteins tested.
Keywords: biotechnology
drug, microspheres, protein stability.
Introducción
En los últimos 30 años se
han aprobado diversos medicamentos biotecnológicos (MB) para diferentes padecimientos, tales como diabetes,
artritis o cáncer, por mencionar algunos (Schellekens,
2009; Bhawani y col., 2018). Con más de 8 500 productos en desarrollo, esta industria
fue valuada en $ 174.7 billones de dólares
en 2019, y para 2020 se proyectaba un crecimiento
de $ 248.7 billones de dólares (Agyei
y col., 2017; Jiang y col., 2017; Informa, 2019).
En su
mayoría, los MB se caracterizan por baja biodisponibilidad oral (menor al 2 %), tiempo de vida media corto en fluidos biológicos (aproximadamente de 30 min) y una escasa absorción gastrointestinal. Estas características limitan
la vía de administración y la confinan a la
intravenosa, subcutánea e intramuscular (Bruno y col., 2013; Pawar y col., 2014; Pachioni-Vasconcelos
y col., 2016).
Para mantener las
concentraciones terapéuticas, los MB deben ser administrados varias veces al
día, esquema que compromete el éxito terapéutico a largo plazo (Pawar y col., 2014; Pachioni-Vasconcelos
y col., 2016). Para hacer frente a este
problema, el uso de microacarreadores ha favorecido los sistemas de administración de fármacos, células y proteínas,
disminuyendo los efectos colaterales asociados
a los tratamientos y garantizando el éxito farmacológico (Pawar
y col., 2014; Shah y Schwendeman,
2014). Los sistemas micrométricos están representados por polímeros, lípidos,
metales y materiales inorgánicos (Tabla 1),
los cuales pueden estar en el
rango micro y nanométrico (Bilati
y col., 2005; Bruno y col., 2013; Wang y col., 2013).
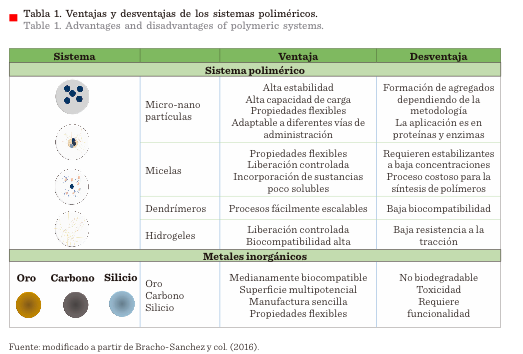
Cada sistema tiene
peculiaridades únicas, sin embargo, los
sistemas micrométricos ofrecen las siguientes ventajas: (i) protección al biofármaco de una rápida degradación y aclaramiento
después de su administración, así como de efectos ambientales de pH, luz,
temperatura y humedad; (ii) el efecto terapéutico pue-de prolongarse, a
diferencia de la forma tradicional de
administración y (iii) el perfil de liberación puede controlarse, dependiendo
del diseño de la microesfera
o microcápsula Figura 1 (Wang y col., 2013; Pachioni-Vasconcelos
y col., 2016; Hu y col., 2017).
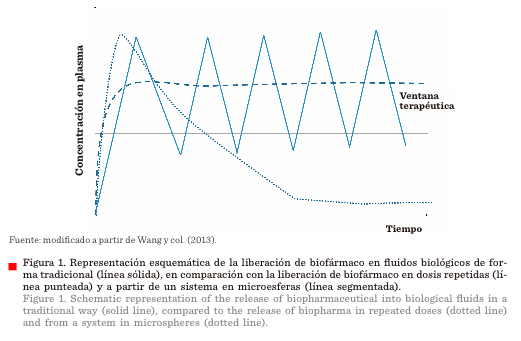
El
objetivo de este trabajo fue destacar las principales características que deben ser evaluadas en el
desarrollo de microacarreadores, enfatizando la seguridad de los medicamentos biotecnológicos,
tras el proceso de microencapsulación, para el desarrollo de nuevas formas de administración.
Métodos de preparación de microcápsulas
y microesferas a partir de biopolímeros
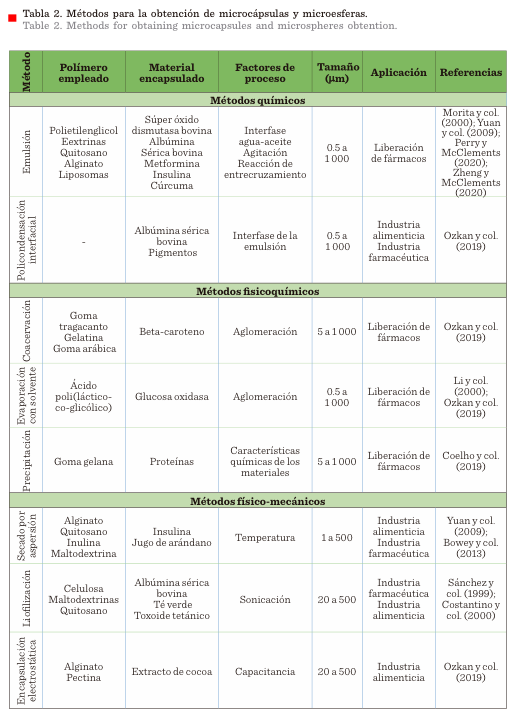
Las micropartículas tienen
un diámetro medio de 1 mm a 1 000 mm y pueden dividirse en microcápsulas o microesferas. El
término “microcápsula” hace referencia a un cuerpo
esférico que recubre al principio activo, mientras que el término “microesfera” se refiere a una matriz homogénea, donde la
sustancia activa está inmersa en el cuerpo de la esfera. Los métodos de
obtención de microesferas y microcápsulas
se categorizan en tres tipos (Tabla 2): métodos químicos, fisicoquímicos y
físico-mecánicos (Coelho y col., 2010; Jyothi y col., 2010; Singh y col., 2010; Wong y col., 2018).
El material empleado debe ser biocompatible, de baja
toxicidad y biodegradable en fluidos
biológicos (Bracho-Sanchez y col., 2016). En
este sentido, los polímeros hidrofílicos, como el alginato o quitosano, ofrecen una
ventaja determinante al ser inmunotolerables y solubles
en agua (McClements, 2018).
Caracterización integral de microcápsulas
y microesferas
La caracterización integral de microesferas
y micropartículas se resume en la Tabla 3 y está
basada en la determinación de lo siguiente: i) propiedades del material, ii)
tamaño de partícula, morfología, forma o
estructura del cristal, iii) propiedades de superficie, como carga, funcionalidad,
iv) eficiencia de la microencapsulación, v) cinética de liberación, vi)
estabilidad del MB (Gill y col., 2010).
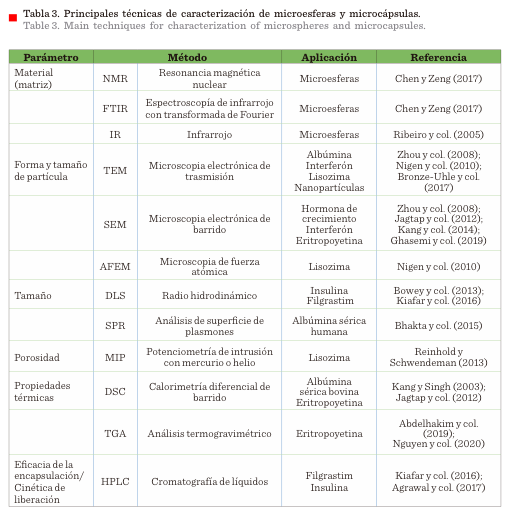
La forma de las partículas puede ser observada a
partir de diversas microscopias, cuyo alcance depende de las necesidades y
limitaciones propias de la metodología. Las
microscopias más empleadas son microscopia electrónica de barrido (SEM,
por sus siglas en inglés: Scanning Electron Microscopy), microscopia electrónica de transmisión
(TEM, por sus siglas en inglés: Transmission Electron Microscopy), microscopia
de fuerza atómica (AFEM, por sus siglas en inglés: Atomic
Force Electroluminescence Microscopy), entre otras (Rokstad
y col., 2014; Chogale y col., 2016). El radio hidrodinámico determina la vía por la cual podrá
ser administrada la formulación, por lo que la técnica de dispersión dinámica
de luz (DLS, por sus siglas en inglés: Dynamic Light Scattering) es comúnmente usada para este fin; la
principal desventaja de este método es la
interferencia que implican moléculas de grandes dimensiones, las cuales
pueden sedimentar o formar agregados,
comprometiendo la fiabilidad de los resultados (Andhariya
y Burgess, 2016).
Las propiedades físicas de las microcápsulas
y microesferas
dependen de las propiedades térmicas de una sustancia y se analizan por calorimetría
diferencial de barrido (DSC, por sus siglas en inglés: Differential
Scanning Calorimetry) o termogravimetría (TGA, por sus siglas en inglés: Thermogravimetric Analysis), lo
que permite determinar la temperatura y el flujo de calor asociado a las
transiciones térmicas, como la temperatura
de fusión o transición vítrea, así como pérdida de masa (Schick, 2009; Gill y col., 2010).
Las propiedades de superficie determinan el grado de biotolerabilidad de estas moléculas en el organismo receptor. Las metodologías empleadas
son la espectroscopia fotoelectrónica de rayos X (XPS, por sus siglas en inglés: X-Ray Photoelectron Spectrometry), espectrometría de masas de iones
secundarios de tiempo de vuelo (ToF-SIMS, por sus
siglas en inglés: Time-of-Flight Secondary Ion Mass Spectrometry) y espectroscopía de infrarrojo con
transformada de Fourier acoplado a reflectancia total
atenuada (ATR-FTIR, por sus siglas en inglés: Attenuated
Total Reflection-Fourier Transform Infra-Red
Spectroscopy).
La eficacia de atrapamiento puede evaluarse como i) la
capacidad de encapsulación (CE), expresada en la relación de principio activo entre
cantidad total de otros componentes de las micropartículas,
o ii) la eficiencia de encapsulación (EE), que se define en términos de porcentaje
o fracción del principio activo presente en el sistema y la cantidad del
principio activo inicial (Paul y col., 2012; Kim y col., 2014). La eficacia de
microencapsulación puede verse afectada por la concentración y peso molecular
del biopolímero, el método de preparación, la solubilidad del fármaco y del
polímero, las interacciones fármaco-polímero y la tasa de evaporación del solvente (Jyothi y col.,
2010; Bale y col., 2016).
Evaluar la cinética de liberación de los microacarreadores
determina la cantidad de medicamento disponible y el tiempo que tarda en hacerlo (Kim y col., 2014; Zhao
y col., 2016). Los modelos de
cinéticas se ajustan a: i) difusión, donde el mecanismo obedece a la velocidad
con la que el líquido traspasa la membrana de polímero y la velocidad con la
que el MB migra de la microesfera
(Singh y col., 2010); ii) disolución, que depende del grado de solubilidad
del polímero y del biofármaco en fluidos biológicos (Bittner y col., 1998; Singh y col., 2010), iii) erosión, proceso complejo que implica la
hinchazón, difusión y disolución del sistema (Mohammed y col., 2017).
La caracterización integral de estos sistemas permite
brindar seguridad y certeza a las formulaciones desarrolladas, al asegurar la biocompatibilidad con los tejidos. La biocompatibilidad es la habilidad que tiene el material de no inducir, directa o indirectamente, respuestas inflamatorias
(Rokstad y col., 2014). Diversos estudios relacionan
las propiedades fisicoquímicas, como peso del
polímero, tamaño, forma, carga del sistema y vías de degradación, con el
desarrollo de respuestas inmunes (Andorko y col.,
2017). Por ejemplo, el tamaño de partícula es capaz de influenciar la distribución biológica y limita la vía de administración.
Micropartículas diseñadas para liberación oral, con
un diámetro medio de 11 mm, pueden localizarse
en el intestino (placas de Peyer), mientras
que las micropartículas de 5 mm son trasladadas del intestino de rata
al bazo por el sistema linfático (Benne y col., 2016;
Savage y col., 2019; Alqahtani
y col., 2020). La forma de la partícula influye en esta internalización, ya que
el proceso depende de la interacción del sistema con células fagocíticas (células dendríticas); partículas esféricas
favorecen este proceso, mientras que formas
cilíndricas pueden decrecer la eficacia de la vía de transporte,
partículas con otras formas favorecen la presentación de antígenos (Savage y col., 2019). Durante el metabolismo, las
partículas son degradadas y esto favorece la
liberación del principio activo, sin embargo, los productos de degradación
pueden tener propiedades químicas diferentes al material inicial, por lo que
pueden interaccionar de manera distinta con células del sistema inmune y los
tejidos; estas interacciones no siempre son benéficas; los productos de degradación de materiales, como los poliésteres,
pueden ser empleados como adyuvantes en la fabricación de vacunas (Andorko y col.,
2017). El desarrollo de efectos no deseados se puede evaluar mediante ensayos
in vitro, que precisan la interacción entre
las micropartículas o nanopartículas
con diferentes sistemas celulares. Los ensayos in vitro detallan
posibles modificaciones en el crecimiento, reproducción y morfología celular (Li
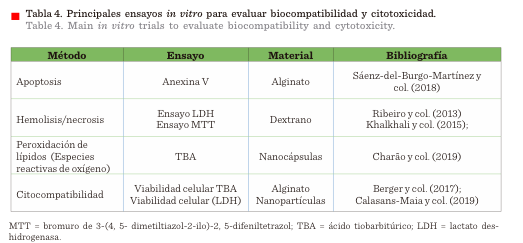
y col., 2015). En la Tabla 4 se exponen algunas de las principales pruebas in
vitro para evaluar la citotoxicidad o viabilidad celular por parte de los
materiales empleados para la fabricación de sistemas en escala nano o micrométrica.
Caracterización integral de estabilidad
de biofármacos como proteínas terapéuticas
Los medicamentos biotecnológicos
dependen de su estructura
para ejercer actividad biológica (eficacia), por lo que el sistema y método de
microencapsulación deben asegurar la integridad del MB (Paul y col., 2012). La
pérdida de esta estructura (calidad) podría
llevar a la formación de productos de degradación que potencialmente
minimizan el efecto terapéutico y modifican las propiedades farmacocinéticas y fármacodinámicas de los MB, lo que conllevaría la presencia de diferentes efectos adversos y
respuestas inmunes no deseadas (seguridad) (Butreddy y col., 2020; Schuster y col., 2020).
La integridad de una proteína
farmacéutica puede ser
estudiada en términos de estabilidad física y química. La degradación química incluye
procesos de desamidación, isomerización, hidrólisis y oxidación, mientras que la
degradación física es evidenciada por la formación
de agregados que llevará invariablemente a un decaimiento en la
actividad biológica (Kim y col., 2014).
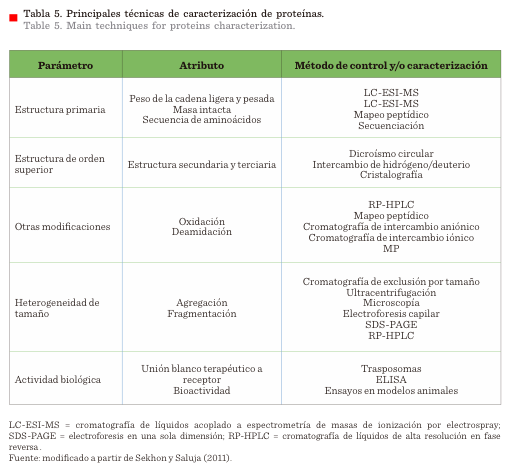
La estabilidad se determina en parámetros críticos de calidad (Tabla 5), los cuales dependen de
los atributos relacionados con la estructura y función biológica del MB.
Los principales parámetros son, i) pureza del
producto, ii) presencia de agregados de alto peso molecular, iii) la estructura
de orden superior; iv) análisis de isoformas,
v) ensayos de actividad biológica (Kim y col., 2014).
La determinación de agregados, partículas o fragmentos
es un atributo crítico de calidad, el cual se relaciona directamente con la
eficacia y seguridad de las proteínas terapéuticas (Wagh y col., 2018). La cromatografía de
exclusión por tamaño (SEC-HPLC, por sus siglas
en inglés: Size
Exclusion Chromatography) y
la electroforesis capilar (CE, por sus siglas en inglés: Capillary Electrophoresis) son las técnicas empleadas para analizar las variantes de peso (Kirchhoff y col., 2017; Wagh
y col., 2018). Las variantes de carga
pueden ser seguidas mediante
cromatografía aniónica (IEX, por sus siglas en
inglés: Ionic Exchange Chromatography)
o Electroforesis Capilar (EC); las diferencias en este parámetro afectan
directamente los perfiles farmacocinéticos y farmacodinámicos (Zhao y col., 2016;
Kirchhoff y col., 2017). La estructura de orden superior (secundaria y terciaria)
puede ser determinada por cristalografía,
dicroísmo circular (DC) o calorimetría diferencial de barrido (DCS).
Por otra parte, los modelos in vitro permiten describir
el comportamiento del biofármaco liberado, mientras
que los modelos in vivo detallan su biodisponibilidad en fluidos biológicos (Andhariya y Burgess, 2016), en tanto que los modelos animales deben asegurar: i) la evaluación a largo
plazo en las formulaciones y ii) la medición
de anticuerpos neutralizantes (Andhariya y Burgess, 2016).
La pérdida de estabilidad involucra respuestas celulares complejas, que dan como resultado
la formación de citocinas pro-inflamatorias,
reacciones de hipersensibilidad (reacciones alérgicas y anafilaxia) hasta la
formación de anticuerpos neutralizantes (anticuerpos que inhiben la actividad biológica deseada del MB), además
de la presencia de síntomas como dolor,
anemia y fiebre, que darán como resultado modificaciones en las propiedades
farmacocinéticas del MB (mayor aclaramiento
renal y menor eficacia terapéutica) (Schellekens,
2002; Laptoš y Omersel,
2018).
Aplicaciones
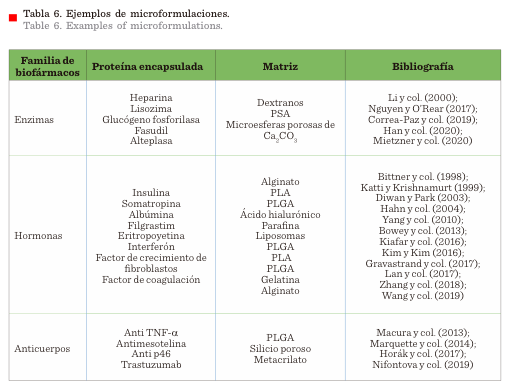
Algunos microacarreadores empleados para la liberación
de medicamentos biotecnológicos se resumen en la Tabla 6.
La insulina recombinante es el tratamiento de elección
para combatir la diabetes mellitus, padecimiento que afecta a más de 439
millones de adultos en el mundo. En el
trabajo publicado por Bowey y col. (2013) se
caracterizaron las micropartículas de alginato e insulina
obtenidas por la técnica de secado por aspersión. El resultado fueron micropartículas con un diámetro medio de 2.1 ± 0.3 mm, de forma esférica y una eficiencia de
carga del 38.2 ± 9.5 %. Se determinó por microscopia confocal
la presencia de una distribución matricial de insulina en las micropartículas. El bioensayo in vitro, para la
determinación de la potencia biológica, consistió en medir la fosforilación intracelular de la proteína quinasa B (PKB,
por su siglas en inglés: Protein Kinase
B) en la línea celular L6 de mioblasto (rata), donde la insulina liberada de las
partículas presentó un 88 ± 15 % de actividad, demostrando que el secado por
aspersión no impacta de forma significativa la estructura de la proteína.
Mientras que en el trabajo de
Zhang y col. (2018) se diseñaron microesferas de
finas capas de polivinil-sulfato y ácido poliláctico
cargadas con insulina. El tamaño de las microesferas
fue de 5.25 ± 0.15 mm, con una eficiencia de carga del 33.7 ± 0.19 % y una
liberación de 111.33 ± 1.15 mg/g de insulina. El ensayo de eficacia preclínica in
vivo consistió en probar el control glicémico de la formulación, en un
modelo animal de diabetes tipo II, mediante la inducción del estado hiperglicémico en ratas hembra Sprague
Dawley con la administración intraperitoneal de estreotozotocina (55 mg/kg). Se formaron seis grupos experimentales (n = 10) que
recibieron tratamiento como se describe a continuación: grupo control (solución
salina vía oral), grupo control negativo (200 U/kg insulina vía oral), grupo
control positivo (5 U/kg insulina subcutánea) y tres grupos experimentales (100 U/kg, 200 U/kg y 300 U/kg, todos vía
oral). Se logró demostrar que los tratamientos ejercieron un control glucémico
dependiente de la dosis, lo cual sugiere un método prometedor para la obtención
de microesferas cargadas con MB (Zhang y col., 2018).
Estos trabajos evidencian que la insulina presente en ambos sistemas se
encuentra activa, a pesar de haberse obtenido por metodologías diferentes.
La osteoclasis mandíbular, asociada a medicamentos como los bisfosfonatos, genera problemas en pacientes medicados que
requieren extracciones dentales, con la finalidad de disminuir los efectos colaterales de este tratamiento. Erten-Taysi y col. (2019) demostraron la exitosa
fabricación de microesferas de quitosano
cargadas con hormona paratiroidea humana por el método de gelación.
Las microesferas cargadas tienen un tamaño promedio de
0.61 mm,
con un valor de potencial z de (+) 18.5 mV. Se
compararon varias formulaciones, pero las partículas con la proporción 3:1 de quitosano y hormona evidenciaron la eficacia de
encapsulación más alta, con un 72.9 ± 4.84 % de hormona, porcentaje que
decreció dramáticamente al modificar la
relación. El estudio in vivo
consistió en la observación del proceso necrótico. Después de la
extracción de tres molares superiores en
ratas hembra Sprague-Dawley de 6 semanas, las cuales
fueron aleatorizadas en 4 grupos (n = 12), como se describe a
continuación: grupo control (la curación de los animales se permite sin la administración
de tratamientos), grupo control negativo (se colocan 30 mL de formulación con microcápsulas
vacías en la región subperiostal) y 2 grupos
experimentales. El grupo experimental 1 recibió hormona paratiroidea contenida en un hidrogel (0.05 mg/mL por 3 d),
mientras que el grupo experimental 2 fue tratado con una sola administración de
microesferas (0.233 mg/L de hidrogel). En los días 10 y 21 después de la extracción dental, 6
animales de cada grupo fueron sacrificados para el análisis histomorfométrico. En ambos casos se
observó un proceso necrótico, inferior en
aquellos animales que recibieron una sola dosis de microesferas,
a diferencia de aquellos que recibieron dosis repetidas de hormona paratiroidea
(Erten-Taysi y col., 2019).
La hormona de crecimiento
representa una alternativa de tratamiento para infantes con trastornos del crecimiento, falla renal o
síndrome de Turner. Los problemas asociadas a las limitaciones de la proteína
la confinan a la administración intramuscular (IM), dando como resultado
inflamación en el sitio de administración y
un pobre apego al tratamiento. En el trabajo presentado por Kang
y col. (2014) se desarrollaron microesferas de dextranos con PLGA
cargadas con hormona de crecimiento por el método de doble emulsion.
La caracterización de estas microesferas evidenció partículas con un diámetro
medio de 40 mm
a 100 mm. Mientras que la caracterización de la
integridad de la proteína se realizó mediante cromatografía de exclusión por
tamaño, para evaluar la presencia de
fragmentos, y microscopia de dicroísmo circular, para determinar la estructura de orden superior. La formulación
de dextrano con PLGA y somatropina
no desnaturalizó de forma significativa al MB, al no decaer la presencia del
monómero que conforma la proteína. La estructura de orden superior se determinó por comparación de la microscopia
DC de una solución de proteína fresca
y proteína contenida en el sistema de micropartículas. Los resultados no sugieren diferencia significativa en este parámetro, por
lo que se asume que la proteína tendrá efecto biológico.
El ensayo de liberación in vivo consistió en la
determinación de los niveles de hormona de crecimiento en plasma, en ratas
hembra Sprague Dawley que fueron
aleatorizadas en 3 grupos (n = 5) que se detallan a continuación: grupo
control (recibe hormona de crecimiento, 5 mg/kg vía
subcutánea), grupo experimental 1 (microesferas de dextrano con
PLGA, 5 mg/kg vía subcutánea) y grupo experimental 2 (microesferas sin la presencia de dextranos,
5 mg/kg vía subcutánea). Los días 1, 2, 3, 4, 5, 6, 7, 8, 10, 12, 15 y 28 se
tomó una muestra de sangre para la cuantificación de hormona de crecimiento,
mediante un kit de ELISA (por sus siglas en inglés: Enzyme-Linked
Immunosorbent Assay). Las
curvas de concentración de hormona de crecimiento sérica versus el
tiempo permitieron visualizar un aumento de concentración media después de la dosis.
Los resultados evidenciaron una mayor concentración
de hormona de crecimiento en suero y un perfil de liberación lento, hasta por
40 d en las microesferas
de dextrano con PLGA, en comparación con las microesferas sin la presencia de dextrano,
lo que sugiere un sistema altamente efectivo para la liberación controlada de hormona
de crecimiento.
El modelo in vivo de
eficacia consistió en evaluar
la ganancia de peso en ratas macho Sprague Dawley hipofisectomizados de 6
semanas y tratados con un agente inmunosupresor (tacrolimus
50 g vía sc). Los animales de estudio fueron
aleatorizados en 4 grupos (n = 5) para recibir tratamiento, de esta manera:
grupo control negativo (solución salina),
grupo control positivo (solución de hormona de crecimiento, 6 mg/kg por
30 d) y dos grupos experimentales: grupo
experimental 1 (6 mg/kg de microesferas sin dextranos vía
subcutánea) y grupo experimental 2 (6 mg/kg de microesferas
con dextranos vía subcutánea). La ganancia de peso se
determinó cada 24 h por 40 d. Los resultados obtenidos con el modelo de
eficacia abordado fueron consistentes con el modelo in vitro; el modelo in
vivo confirmó un aumento de peso, superior del día 6 hasta el día 40 en
aquellos animales tratados con microesferas de dextrano y PLGA, en comparación con el grupo control. Los
resultados demostraron el desarrollo de una formulación de liberación
controlada estable y con evidencia de actividad biológica (eficacia) de la hormona
de crecimiento.
La microencapsulación o formación de microesferas de proteínas farmacéuticas, empleando biopolímeros
para modificar la vía de administración, el régimen de dosificación o controlar
la liberación de medicamentos biotecnológicos, se han estudiado arduamente, con
la finalidad de caracterizar los procesos de fabricación
de manera integral para asegurar que los MB
no pierdan su estructura y por ende presenten menor actividad biológica
y mayor inmunogenicidad, por lo que este trabajo describe las principales técnicas de caracterización de
microesferas y proteínas farmacéuticas, para asegurar
la viabilidad de estos sistemas de encapsulación.
CONCLUSIONES
El éxito de los microacarreadores como sistemas de
liberación de medicamentos biotecnológicos está basado en la integridad de las proteínas
farmacéuticas, a través del proceso de microencapsulación. Las nuevas
estrategias para el desarrollo de
microacarreadores se sustentan en la exploración y explotación de
biopolímeros altamente biotolerables, de baja inmunogenicidad y fácil degradación en fluidos biológicos,
así como en la optimización de los parámetros en cada método, para obtener
sistemas con altos porcentajes de carga y de rendimiento, evitando la
desnaturalización de las proteínas farmacéuticas. Las vías de degradación de
biopolímeros y la falta de estabilidad de las proteínas podrían conducir al fracaso
terapéutico y al desarrollo de reacciones inmunes no deseadas, como procesos inflamatorios y la aparición de anticuerpos
neutralizantes. La caracterización integral
de los microacarreadores debe ser gradual y enfocada en la seguridad
tanto del biopolímero empleado como de las proteínas ensayadas.
Referencias
Abdelhakim, H. E., Coupe,
A., Tuleu, C., Edirisinghe,
M., and Craig, D. Q. M. (2019). Electrospinning optimization of eudragit E PO with and without chlorpheniramine maleate using a design of experiment approach. Molecular Pharmaceutics. 16(6): 2557-2568.
Agrawal, G. R., Wakte, P., and Shelke, S. (2017).
Formulation, physicochemical characterization and in vitro evaluation of
human insulin-loaded microspheres as potential oral carrier. Progress
in Biomaterials. 6(3): 125-136.
Agyei, D., Ahmed,
I., Akram, Z., Iqbal, H. M., and Danquah, M. K.
(2017). Protein and peptide biopharmaceuticals: An overview. Protein and
Peptide Lettters. 24(2): 94-101.
Alqahtani, M. S., Syed,
R., and Alshehri, M. (2020). Size-dependent
phagocytic uptake and immunogenicity of gliadin nanoparticles. Polymers.
12(11): 2576.
Andhariya, J. V. and
Burgess, D. J. (2016). Recent advances in testing of microsphere drug delivery
systems. Expert Opinion on Drug Delivery. 13(4): 593-608.
Andorko, J. I.,
Pineault, K. G., and Jewell, C. M. (2017). Impact of molecular weight on the
intrinsic immunogenic activity of poly (beta amino esters). Journal of
Biomedical Materials Research. Part A. 105(4): 1219-1229.
Bale, S., Khurana, A., Reddy, A. S., Singh,
M., and Godugu, C. (2016). Overview on therapeutic
applications of microparticulate drug delivery systems. Critical Reviews in
Therapeutic Drug Carrier Systems. 33(4): 309-361.
Benne, N., van-Duijn, J., Kuiper, J., Jiskoot,
W., and Slütter, B. (2016). Orchestrating immune responses:
How size, shape and rigidity affect the immunogenicity of particulate vaccines. Journal of Controlled Release. 234: 124-134.
Berger, E., Breznan, D., Stals, S., Jasinghe, V. J., Gonçalves, D., Girard, D., ..., and
Lavigne, C. (2017). Cytotoxicity assessment, inflammatory properties, and
cellular uptake of Neutraplex lipid-based
nanoparticles in THP-1 monocyte-derived macrophages. Nanobiomedicine.
4: 1-14.
Bhakta, S., Seraji, M. S., Suib, S. L., and Rusling, J. F. (2015). Antibody-like biorecognition sites
for proteins from surface imprinting on nanoparticles. ACS Applied Materials
& Interfaces. 7(51): 28197-28206.
Bhawani, S. A., Husaini, A., Ahmad, F. B., and Asaruddin,
M. R. (2018). Polymer based protein therapeutics. Current Protein and
Peptide Science. 19(10): 972-982.
Bilati, U., Allemann,
E., and Doelker, E. (2005). Strategic approaches for
overcoming peptide and protein instability within biodegradable nano-and microparticles.
European Journal of Pharmaceutics and Biopharmaceutics. 59(3):
375-388.
Bittner, B.,
Morlock, M., Koll, H., Winter, G., and Kissel, T. (1998). Recombinant human
erythropoietin (rhEPO) loaded poly (lactide-co-glycolide) microspheres: influence of the encapsulation
technique and polymer purity on microsphere characteristics. European
Journal of Pharmaceutics and Biopharmaceutics. 45(3): 295-305.
Bowey, K., Swift, B. E., Flynn, L. E.,
and Neufeld, R. J. (2013). Characterization of biologically active insulin-loaded
alginate microparticles prepared by spray drying. Drug
Development and Industrial Pharmacy. 39(3): 457-465.
Bracho-Sanchez, E., Xia, C. Q., Clare-Salzler, M. J., and Keselowsky,
B. G. (2016). Micro and nano material carriers for immunomodulation. American
Journal of Transplantation. 16(12): 3362-3370.
Bronze-Uhle, E. S., Costa, B. C., Ximenes, V. F., and Lisboa-Filho, P. N. (2017). Synthetic nanoparticles of
bovine serum albumin with entrapped salicylic acid. Nanotechnology Science
and Applications. 10: 11-21.
Bruno, B. J.,
Miller, G. D., and Lim, C. S. (2013). Basics and recent advances in peptide and
protein drug delivery. Therapeutic Delivery. 4(11):
1443-1467.
Butreddy, A., Janga, K. Y., Ajjarapu, S., Sarabu, S., and Dudhipala, N.
(2020). Instability of therapeutic proteins - An overview of stresses,
stabilization mechanisms and analytical techniques involved in lyophilized
proteins. International Journal of Biological Macromolecules. 167: 309-325.
Calasans-Maia, M. D.,
Barboza-Junior, C., Soriano-Souza, C. A., Alves, A., Uzeda,
M., Martinez-Zelaya, and Rossi, A. M. (2019). Microspheres of alginate
encapsulated minocycline-loaded nanocrystalline carbonated hydroxyapatite:
therapeutic potential and effects on bone regeneration. International
Journal of Nanomedicine. 14: 4559-4571.
Charão, M. F., Goethel,
G., Brucker, N., Paese, K., Eifler-Lima,
V. L., Pohlmann, A. R., and Garcia, S. C. (2019). Melatonin-loaded
lipid-core nanocapsules protect against lipid
peroxidation caused by paraquat through increased SOD expression in Caenorhabditis
elegans. BMC Pharmacology & Toxicology. 20(1): 1-7.
Chen, K. Y. and
Zeng, S. Y. (2017). Preparation and characterization of quaternized
chitosan coated alginate microspheres for blue dextran delivery. Polymers. 9(6):
210.
Chogale, M. M., Ghodake, V. N., and Patravale, V.
B. (2016). Performance parameters and characterizations of nanocrystals: A brief review. Pharmaceutics. 8(3).
Coelho, J.,
Eusebio, D., Gomes, D., Frias, F., Passarinha, L. A.,
and Sousa, A. (2019). Biosynthesis and isolation of gellan
polysaccharide to formulate microspheres for protein capture. Carbohydrate
Polymers. 220: 236-246.
Coelho, J. F., Ferreira, P. C., Alves,
P., Cordeiro, R., Fonseca, A. C., Gois,
J. R., and Gil, M. H. (2010). Drug delivery
systems: Advanced technologies potentially applicable in personalized
treatments. EPMA Journal. 1(1): 164-209.
Correa-Paz, C., Navarro-Poupard, M. F., Polo, E., Rodríguez-Pérez, M., Taboada, P.,
Iglesias-Rey, R., and Pelaz, B. (2019). In vivo
ultrasound-activated delivery of recombinant tissue plasminogen activator from
the cavity of sub-micrometric capsules. Journal of Controlled Release. 308:
162-171.
Costantino, H.
R., Firouzabadian, L., Hogeland,
K., Wu, C., Beganski,
C., Carrasquillo, K., and Tracy, M. A. (2000). Protein spray-freeze drying.
Effect of atomization conditions on particle size and stability. Pharmaceutical
Research. 17(11): 1374-1383.
Diwan, M. and
Park, T. G. (2003). Stabilization of recombinant interferon-alpha by pegylation for encapsulation in PLGA microspheres. International
Journal of Pharmaceutics. 252(1-2):
111-122.
Erten-Taysi, A., Cevher, E., Sessevmez, M., Olgac, V., Mert-Taysi, N., and Atalay, B. (2019). The efficacy of sustained-release
chitosan microspheres containing recombinant human parathyroid hormone on MRONJ. Brazilian Oral Research. 33:
e086.
Ghasemi, R., Abdollahi, M., Emamgholi-Zadeh, E.,
Khodabakhshi, K., Badeli,
A., Bagheri, H., and Hosseinkhani, S. (2019). mPEG-PLA and PLA-PEG-PLA nanoparticles as new carriers for delivery of recombinant human
Growth Hormone (rhGH). Scientific Reports.
8(1): 9854.
Gill, P.,
Moghadam, T. T., and Ranjbar, B. (2010). Differential
scanning calorimetry techniques: applications in biology and nanoscience. Journal
Biomolecular Techniques. 21(4): 167-193.
Gravastrand, C.,
Hamad, S., Fure, H., Steinkjer, B., Ryan, L.,
Oberholzer, J., and Rokstad, A. M. (2017). Alginate
microbeads are coagulation compatible, while alginate microcapsules activate
coagulation secondary to complement or directly through FXII. Acta Biomaterialia. 58: 158-167.
Hahn, S. K., Kim,
S. J., Kim, M. J., and Kim, D. H. (2004). Characterization and in vivo
study of sustained-release formulation of human growth hormone using sodium
hyaluronate. Pharmaceutical Research. 21(8): 1374-1381.
Han, P., Zhou,
X., and You, C. (2020). Efficient multi-enzymes immobilized on porous microspheres
for producing inositol from starch. Frontiers in Bioengineering and
Biotechnology. 8: 380.
Horák, D., Hlídková,
H., Kit, Y., Antonyuk, V., Myronovsky,
S., and Stoika, R. (2017). Magnetic poly
(2-hydroxyethyl methacrylate) microspheres for affinity purification of
monospecific anti-p46 kDa/Myo1C antibodies for early
diagnosis of multiple sclerosis patients. Bioscience Reports. 37(2).
Hu, M., Guo, J., Yu, Y., Cao, L., and
Xu, Y. (2017). Research advances of microencapsulation and its prospects in the
petroleum industry. Materials. 10(4): 369.
Informa (2019). Pharmaprojects Pharma R&D Annual Review 2019. [En
línea]. Disponible en: https://pharmaintelligence.informa.com/~/media/informa-shop-window/pharma/2019/files/whitepapers/pharma-rd-review-2019-whitepaper.pdf. Fecha de consulta: 14 de marzo de 2020.
Jagtap, Y. M.,
Bhujbal, R. K., Ranade, A. N., and Ranpise, N. S.
(2012). Effect of various polymers concentrations on physicochemical properties
of floating microspheres. Indian Journal Pharmaceutical Sciences. 74(6):
512-520.
Jiang, M.,
Severson, K. A., Love, J. C., Madden, H., Swann, P., Zang, L., and Braatz, R. D. (2017). Opportunities and challenges of
real-time release testing in biopharmaceutical manufacturing. Biotechnology
and Bioengineering. 114(11): 2445-2456.
Jyothi, N. V.,
Prasanna, P. M., Sakarkar, S. N., Prabha, K. S.,
Ramaiah, P. S., and Srawan, G. Y. (2010). Microencapsulation
techniques, factors influencing encapsulation efficiency. Journal of
Microencapsulation. 27(3): 187-197.
Kang, F. and
Singh, J. (2003). Conformational stability of a model protein (bovine serum
albumin) during primary emulsification process of PLGA microspheres synthesis. International
Journal of Pharmaceutics. 260(1): 149-156.
Kang, J., Wu, F.,
Cai, Y., Xu, M., He, M., and Yuan, W. (2014). Development of Recombinant Human Growth
Hormone (rhGH) sustained-release microspheres by a
low temperature aqueous phase/aqueous phase
emulsion method. European Journal of Pharmaceutical Sciences. 62:
141-147.
Katti, D. and Krishnamurti,
N. (1999). Preparation of albumin microspheres by an improved process. Journal
of Microencapsulation. 16(2): 231-242.
Khalkhali, M., Sadighian, S., Rostamizadeh, K., Khoeini, F., Naghibi, M., Bayat, N., …, and Hamidi, M. (2015). Synthesis and
characterization of dextran coated magnetite nanoparticles for diagnostics and therapy.
BioImpacts: BI. 5(3): 141-150.
Kiafar, F., Siahi-Shadbad,
M. R., and Valizadeh, H. (2016). Filgrastim (G-CSF)
loaded liposomes: mathematical modeling and optimization of encapsulation efficiency
and particle size. Bioimpacts. 6(4): 195-201.
Kim, N. A., Lim,
D. G., Lim, J. Y., Kim, K. H., and Jeong, S. H.
(2014). Comprehensive evaluation of etanercept stability in various
concentrations with biophysical assessment. International Journal of
Pharmaceutics. 460(1-2): 108-118.
Kim, S. J. and
Kim, C. W. (2016). Development and Characterization of Sodium
Hyaluronate Microparticle-Based Sustained Release
Formulation of Recombinant Human Growth Hormone Prepared by Spray-Drying. Journal
of Pharmaceutical Sciences. 105(2):613-622.
Kirchhoff, C. F.,
Wang, X. M., Conlon, H. D., Anderson, S., Ryan, A. M., and Bose, A. (2017).
Biosimilars: key regulatory considerations and similarity assessment tools. Biotechnology
and Bioengineering. 114(12): 2696-2705.
Lan, L., Tian, F.
R., ZhuGe, D. L., ZhuGe, Q.
C., Shen, B. X., Jin, B. H., ..., and Xu, H. L.
(2017). Implantable porous gelatin microspheres sustained release of bFGF and improved its neuroprotective effect on rats
after spinal cord
injury. Plos One.12(3):
e0173814.
Laptoš, T. and Omersel,
J. (2018). The importance of handling high-value biologicals: Physico-chemical instability and immunogenicity of monoclonal
antibodies. Experimental and Therapeutic Medicine.
15(4): 3161-3168.
Li, X., Zhang,
Y., Yan, R., Jia, W., Yuan, M., Deng, X., and Huang, Z. (2000). Influence of
process parameters on the protein stability encapsulated in poly-DL-lactidepoly (ethylene glycol) microspheres. Journal of
Controlled Release. 68(1): 41-52.
Li, W., Zhou, J.,
and Xu, Y. (2015). Study of the in vitro cytotoxicity testing of medical
devices. Biomedical Reports.
3(5): 617-620.
Macura, S. L., Steinbacher, J. L., MacPherson, M. B., Lathrop, M. J., Sayan, M., Hillegass, J. M., ...,
and Mossman, B. T. (2013). Microspheres targeted with a mesothelin antibody and
loaded with doxorubicin reduce tumor volume of human mesothe
liomas in xenografts. BMC Cancer. 13(1): 400.
Marquette, S., Peerboom, C., Yates, A., Denis, L., Langer, I., Amighi, K., and Goole, J. (2014).
Stability study of full-length antibody (anti-TNF alpha) loaded PLGA
microspheres. International Journal of Pharmaceutics. 470(1-2): 41-50.
McClements, D. J.
(2018). Encapsulation, protection, and delivery of bioactive proteins and peptides
using nanoparticle and microparticle systems: A review. Advances in Colloid
and Interface Science.253: 1-22.
Mietzner, R., Kade, C., Froemel, F., Pauly, D., Sta.mer,
W. D., Ohlmann, A., and Breunig,
M. (2020). Fasudil Loaded PLGA microspheres as
potential intravitreal depot formulation for glaucoma therapy. Pharmaceutics.
12(8): 706.
Mohammed, M. A., Syeda, J. T. M., Wasan, K. M., and
Wasan, E. K. (2017). An overview of chitosan nanoparticles
and its application in non-parenteral drug delivery. Pharmaceutics.
9(4).
Morita, T., Sakamura, Y., Horikiri, Y.,
Suzuki, T., and Yoshino, H. (2000). Protein encapsulation into biodegradable
microspheres by a novel S/O/W emulsion method using poly (ethylene glycol) as a
protein micronization adjuvant. Journal of
Controlled Release. 69(3): 435-444.
Nguyen, C. T.,
Kim, C. R., Le, T. H., Koo, K. I., and Hwang, C. H. (2020). Magnetically guided
targeted delivery of erythropoietin using
magnetic nanoparticles: Proof of concept. Medicine.
99(19): e19972.
Nguyen, H. X. and
O’Rear, E. A. (2017). Modified dextran, heparin-based
triggered release microspheres for cardiovascular delivery of therapeutic drugs
using protamine as a stimulus. Journal of Microencapsulation. 34(3):
299-307.
Nifontova, G., Ramos-Gomes,
F., Baryshnikova, M., Alves, F., Nabiev, I., and Sukhanova, A. (2019). Cancer cell targeting with
functionalized quantum dotencoded polyelectrolyte microcapsules. Frontiers in Chemistry. 7: 34.
Nigen, M., Gaillard, C., Croguennec, T., Madec, M. N., and
Bouhallab, S. (2010). Dynamic and supramolecular organisation of alpha-lactalbumin/lysozyme microspheres: A
microscopic study. Biophysical Chemistry. 146(1): 30-35.
Ozkan, G., Franco, P., De-Marco,
I., Xiao, J., and Capanoglu, E. (2019). A review of microencapsulation methods for food antioxidants:
Principles, advantages, drawbacks and applications. Food Chemistry. 272: 494-506.
Paul, M., Vieillard, V., Jaccoulet, E., and
Astier, A. (2012). Long-term stability of diluted
solutions of the monoclonal antibody rituximab. International Journal
of Pharmaceutics. 436(1-2): 282-290.
Pachioni-Vasconcelos, J., Lopes,
A. M., Apolinario, A. C., Valenzuela-Oses, J. K., Costa, J. S., Nascimento, L., …, and Rangel-Yagui,
C. de O. (2016). Nanostructures for
protein drug delivery. Biomaterials Science. 4(2): 205218.
Pawar, V. K., Meher,
J. G., Singh, Y., Chaurasia, M.,
Surendar-Reddy, B., and Chourasia, M. K. (2014). Targeting of gastrointestinal tract for amended delivery of
protein/peptide therapeutics: strategies and industrial perspectives.
Journal of Controlled Release. 196: 168-183.
Perry, S. L. and
McClements, D. J. (2020). Recent advances in encapsulation, protection, and
oral delivery of bioactive proteins and peptides using colloidal systems. Molecules
25(5): 1161.
Reinhold, S. E.
and Schwendeman, S. P. (2013). Effect of polymer
porosity on aqueous selfhealing encapsulation of
proteins in PLGA microspheres. Macromolecular Bioscience. 13(12): 1700-1710.
Ribeiro, A. J.,
Silva, C., Ferreira, D., and Veiga, F. (2005).
Chitosan-reinforced alginate microspheres obtained through the
emulsification/internal gelation technique. European Journal of Pharmaceutical Sciences. 25(1): 31-40.
Ribeiro, M. P., Morgado, P. I., Miguel, S. P., Coutinho, P., and Correia,
I. J. (2013). Dextran-based hydrogel
containing chitosan microparticles loaded with growth factors to be used in wound healing. Materials Science
and Engineering: C. 33(5): 2958-2966.
Rokstad, A. M., Lacik, I., de-Vos, P., and Strand, B. L. (2014). Advances
in biocompatibility and physicochemical characterization of microspheres for cell
encapsulation. Advanced Drug Delivery Reviews. 67:
111-130.
Sáenz-del-Burgo-Martínez, L., Ciriza-Astrain, J., Espona-Noguera,
A., Xavier, I., Cabruja-Casas, E., Orive-Arroyo, G., ..., and Alvarez, M. (2018). 3D Printed porous polyamide macrocapsule
combined with alginate microcapsules for safer cell-based therapies. Scientific
Reports. 8(1): 8512.
Sánchez, A., Villamayor, B., Guo, Y., McIver, J., and Alonso, M. J.
(1999). Formulation strategies for the stabilization of tetanus toxoid in poly
(lactideco-glycolide) microspheres. International
Journal of Pharmaceutics. 185(2): 255-266.
Savage, D. T.,
Hilt, J. Z., and Dziubla, T. D. (2019). In vitro methods
for assessing nanoparticle toxicity. Methods in Molecular Biology. 1894:
1-29.
Schellekens, H. (2002).
Bioequivalence and the immunogenicity of biopharmaceuticals. Nature Reviews
Drug Discovery. 1(6): 457-462.
Schellekens, H. (2009).
Biosimilar therapeutics-what do we need to consider? NDT Plus. 2(1):
i27-i36.
Schick, C.
(2009). Differential scanning calorimetry (DSC) of semicrystalline polymers. Analytical
and Bioanalytical Chemistry. 395(6): 1589-1611.
Schuster, J., Koulov, A., Mahler, H. C., Detampel,
P., Huwyler, J., Singh, S., and Mathaes,
R. (2020). In vivo stability of therapeutic proteins. Pharmaceutical
Research. 37(2): 23.
Sekhon, B. S. and Saluja,
V. (2011). Biosimilars: an overview. Biosimilars. 1: 1-11.
Shah, R. B. and Schwendeman, S. P. (2014). A biomimetic approach to active selfmicroencapsulation of proteins in PLGA. Journal of
Controlled Release. 196: 60-70.
Singh, M. N.,
Hemant, K. S., Ram, M., and Shivakumar, H. G. (2010).
Microencapsulation: A promising technique for controlled drug delivery. Research in Pharmaceutical Sciences. 5(2): 65-77.
Wagh, A., Song, H., Zeng, M., Tao, L.,
and Das, T. K. (2018). Challenges and new frontiers in analytical
characterization of antibody-drug conjugates. MAbs.
10(2): 222-243.
Wang, L., Liu,
Y., Zhang, W., Chen, X., Yang, T., and Ma, G. (2013). Microspheres and microcapsules
for protein delivery: strategies of drug activity retention. Current
Pharmaceutical Design. 19(35): 6340-6352.
Wang, X., Qi, F.,
Xing, H., Zhang, X., Lu, C., Zheng, J., and Ren, X. (2019). Uniform-sized
insulin-loaded PLGA microspheres for improved early-stage peri-implant bone regeneration. Drug Delivery.
26(1): 1178-1190.
Wong, C. Y.,
Al-Salami, H., and Dass, C. R. (2018). Microparticles,
microcapsules and microspheres: A review of recent
developments and prospects for oral delivery of insulin. International
Journal of Pharmaceutics. 537(1-2): 223-244.
Yang, F., Song,
F. L., Pan, Y. F., Wang, Z. Y., Yang, Y. Q., Zhao, Y. M., …, and Zhang, Y. M.
(2010). Preparation and characteristics of interferon-alpha poly(lactic-co-glycolic
acid) microspheres. Journal of Microencapsulation. 27(2):
133-141.
Yuan, W., Wu, F.,
Guo, M., and Jin, T. (2009). Development of protein
delivery microsphere system by a novel S/O/O/W multi-emulsion. European
Journal of Pharmaceutical Sciences.
36(2-3): 212-218.
Zhang, H., Wang,
W., Li, H., Peng, Y., and Zhang, Z. (2018). Microspheres for the oral delivery
of insulin: preparation, evaluation and hypoglycaemic
effect in streptozotocin-induced diabetic rats. Drug Development
and Industrial Pharmacy. 44(1): 109-115.
Zhao, Y. Y.,
Wang, N., Liu, W. H., Tao, W. J., Liu, L. L., and Shen, Z. D. (2016). Charge
variants of an avastin biosimilar isolation,
characterization, in vitro properties
and pharmacokinetics in rat. Plos One. 11(3): e0151874.
Zheng, B. and
McClements, D. J. (2020). Formulation of more efficacious curcumin delivery systems
using colloid science: enhanced solubility, stability, and bioavailability. Molecules.
25(12): 2791.
Zhou, S., Sun,
J., Sun, L., Dai, Y., Liu, L., Li, X., …, and Zhang, Z. (2008). Preparation and
characterization of interferon-loaded magnetic biodegradable microspheres. Journal
of Biomedical Materials Research. Part B. 87(1): 189-196.