Perfil de compuestos orgánicos volátiles
y ácidos grasos del aguacate (Persea americana) y sus
beneficios a la salud
Volatile organic compounds and fatty
acids profile of avocado (Persea americana) and its health benefits
COV, ácidos grasos y su contribución a la salud
Cynthia
Teresa Lara-García, Hugo Jiménez-Islas, Rita Miranda-López*
*Correspondencia: rita.miranda@itcelaya.edu.mx/ Fecha de
recepción: 18 de noviembre de 2020/Fecha de aceptación: 31 de marzo de
2021/Fecha de publicación: 27 de julio de 2021.
Tecnológico Nacional de México
Celaya, Departamento de Ingeniería Bioquímica, Antonio García Cubas Pte. núm.
600, esq. Avenida Tecnológico, col. Alfredo V. Bonfil, Celaya, Guanajuato,
México, C. P. 38010.
Resumen
La caracterización y evaluación de recursos fitogenéticos a partir de su contenido de ácidos grasos y compuestos
orgánicos volátiles (COV) permiten determinar su utilidad potencial. Se han
realizado pocos estudios recientes relacionados con los COV encontrados en el
aguacate, los cuales pueden variar
dependiendo del lugar de origen, genética y fenotipos. El objetivo del
presente trabajo fue presentar el estado del arte de la fitoquímica
del aguacate criollo comparado con variedades comerciales. Se encontró que los
COV le confieren un perfil de aroma que identifica a diversas variedades y que
los ácidos grasos son responsables de la síntesis
de algunos COV. En la hoja de aguacate criollo se identificaron 26 COV,
siendo 8 monoterpenoides, 7 sesquiterpenos,
6 fenilprondes, 1 acetato y 4 alcanos; estos COV no
se han encontrado en las variedades
comerciales. Por otro lado, la variedad Drymifolia
se caracteriza por su contenido fenólico,
diversos ácidos grasos y acetogeninas. Dichos
componentes químicos también se han asociado con diversos beneficios a la salud, como actividad anticancerígena
en colon, próstata y células K562, actividad antiinflamatoria
y antioxidante. Ello ha propiciado el interés de fomentar su uso como ingrdiente,
aditivo o fitofármaco en la industria alimentaria o biotecnológica.
Palabras clave: Persea
americana, compuestos volátiles, ácidos grasos, bioactividad.
Abstract
The characterization
and evaluation of phytogenetic resources, based on
their content of fatty acids and in volatile organic compounds (VOC) allow to determine their potential
usefulness. There
have been few recent studies related to
the VOC found in avocado, which can vary depending on the place of origin,
genetics and phenotypes. These compounds have been associated to health benefits
effects. The objective of the present work was to present the current
literature review of the phytochemistry of creole avocado compared to commercial
varieties. VOC were found to confer an aroma profile that identifies various
varieties, and that fatty acids are responsible for the synthesis of some VOC.
In the creole avocado leaf, 26 VOC were identified, being 8 monoterpenoids, 7 sesquiterpenes, 6
phenylpropanoids and 4 alkane; these VOC
have not been found in the commercial varieties. On the other hand, the Drymifolia variety is characterized by its phenolic
content, various fatty acids and acetogenins. These
chemical components have also been associated with various health benefits such
as anticancer activity in colon, prostate and K562 cells, anti-inflammatory and
antioxidant activity. This has led to the interest in promoting its use as an
ingredient, additive or phytopharmaceutical in the food or biotechnology
industry.
Keywords: Persea americana,
volatile compounds, fatty acids, bioactivity.
INTRODUCCIÓN
El aguacate es originario de las partes
altas de Guatemala y las zonas montañosas del centro y este de México.
Actualmente se diferencian las razas
guatemaltecas (Persea americana
var. Guatemalensis),
mexicana (P. americana var. Drymifolia) y
antillana (P. americana var. americana). La mayoría de las variedades en el
mercado son Bacon, Hass, Fuerte y Gwen,
siendo la Hass la de mayor comercialización
(Turner y Miksicek, 1984; Acosta y col., 2012; Melgar y
col., 2018).
México es el centro de origen y distribución del aguacate y
cuenta con gran variedad de “criollos”, los
cuales se han diversificado a través del tiempo. La caracterización y
evaluación de dichos recursos fitogenéticos
permiten establecer su utilidad potencial. Los aguacates de la variedad mexicana Drymifolia
son frutos con formas elipsoides, ovoides, piriformes, oblongos
o romboidales (Acosta y col., 2013). Estos aguacates nativos se cultivan naturalmente en jardines de traspatio y tierras agrícolas.
Se han realizado estudios donde se identifican
de manera morfológica, midiendo los diámetros ecuatorial y polar, tanto
de la fruta como de la semilla; además del peso de la fruta completa, semilla, pulpa y cáscara. Se han registrado genotipos de buena calidad, para preservarlos
y posteriormente usarlos como portainjerto, debido al
pericarpio delgado del aguacate criollo, que lo hace susceptible al daño
postcosecha (mecánico y fisiológico), lo que causa que solamente se consumen de manera
regional, a diferencia de la variedad ‘Hass’, que
posee una piel mediana gruesa, con textura rugosa (Figura 1), y que es
altamente demandada; un consumidor reconocido de esta variedad es Estados
Unidos, que la importa, principalmente de México, país del cual absorbe el 87 % de la producción (Salazar-García, 2016;
Damián-Nava y col., 2017; Espinosa-Alonso y col., 2017 ; Cho
y col., 2021).

Los compuestos orgánicos volátiles (COV)
son sustancias químicas producidas por las frutas y verduras que
contribuyen a su sabor y aroma. El tipo y concentración de COV dependen de la
especie y la variedad y cambian conforme la fase de maduración, el estado
fisiológico y el ritmo circadiano de las plantas, lo que vuelve muy complejo dilucidar su biosíntesis y
por lo tanto, el cómo dichos compuestos influyen en la decisión del consumo de
los frutos. Se han utilizado como biomarcadores para el diagnóstico y manejo de la calidad
postcosecha (Mahendran y
col., 2018; Campuzano-Granados y Cruz-López,
2021; Guo y col., 2020).
El aguacate es rico en compuestos bioactivos
que tienen diversos beneficios para la salud. Es
reconocido como una fuente particularmente rica de compuestos fitoquímicos lipofílicos como
ácidos grasos monoinsaturados, tocoferoles,
carotenos, esteroles y acetogeninas (Rodríguez-Sánchez y col., 2013). Su consumo se asocia
a una mejor calidad de dieta, ingesta de nutrientes
y menor riesgo de síndrome metabólico, destacando por su actividad
antimicrobiana, antioxidante y anticancerígena, entre otras (Araújo y col., 2018; Edwards y col.,
2020). También se ha reportado la presencia de ésteres, alcoholes, aldehídos, cetonas, monoterpenos
y sesquiterpenos (Poll y
col., 2006; Dávila-Aviña y col., 2011; Canto y col., 2013; Tiwari
y col., 2020).
El objetivo del presente trabajo fue presentar el estado del
arte actual de la fitoquímica del aguacate criollo
comparado con variedades comerciales.
Compuestos orgánicos volátiles
Los COV se asocian con el sabor característico de una amplia variedad de frutas. Su producción se deriva principalmente de ácidos
grasos modulada por etileno (García-Rojas y
col., 2016). En aguacate ‘Hass’ se ha
detectado la presencia de hexanal
y E-2 hexanal, asociados con el aroma herbal
del fruto y con una tendencia adisminuir su
concentración durante su maduración (García-Rojas y col., 2016).
Los aldehídos predominaron entre los COV
presentes en 14 genotipos de aguacate, debido probablemente a
que estos compuestos se generan a partir de
la degradación de los lípidos, los cuales abundan en dicha fruta. Entre
las características de estos compuestos
identificados destacan las siguientes: el acetaldehído es un aldehído de
cadena corta, muy volátil y se caracteriza
por un aroma a fruta fresca, el hexanal y E-2-hexenal presentan un aroma a hierba con
un umbral característico, el limoneno aporta
una nota aromática fresca cítrica, el -cubebeno
tiene aromas frutales parecido a los
cítricos, mientras que el -copaeno y el -cariofileno
poseen notas especiadas y amaderadas (Ali y col., 2020).
La concentración de COV responsables de
aroma y sabor dependió de la composición atmosférica usada durante el
almacenamiento controlado de la variedad Fuerte. Los compuestos identificados
fueron, alcoholes, aldehídos, ésteres e hidrocarburos. Los autores infieren que
el sabor del aguacate, que es generalmente descrito como fresco y herbáceo, se debe a la presencia de alcoholes
y aldehídos (Mahendran y col., 2018).
Los COV además de ser responsables del aroma y sabor, pueden
ayudar para la clasificación de diversas variedades de aguacate criollo. Debido
a que el taxón de estos productos es muy variable, resulta importante tipificar
a los árboles de aguacate como fuente de genes de resistencia contra plagas y enfermedades. También es una
herramienta útil para diferenciar los fenotipos
químicos prominentes en variedades comerciales. Los compuestos que imperaron en P. americana var.
Drymifolia fueron estragol y cariofileno (22 % a 72 % y de 9 % a 16 %, respectivamente) (Torres-Gurrola y col., 2009). Otra investigación de aguacates en Florida,
Estados Unidos. comparó 3 variedades con el perfil de
COV, los cuales diferían entre los
tres cultivares con varios compuestos detectados en un solo cultivar. El híbrido Simmonds difirió por el contenido de
3-metil-buten-1-ol, cis-3-hexen-1-ol, cis--ocimeno, hexilo butirato, -elemeno y transnerolidol.
El híbrido Booth 7 se caracterizó por su contenido de
2-metil-1-butanol, 2-metil-bu-tenal, crotonato de etilo, isovalerato de
etilo, tiglato
de etilo, cis--bisaboleno
y selineno; finalmente,
el híbrido Monroe se distinguió por
el contenido de butirato de metilo,
valenciano e ilángeno (Canto y col., 2013).
Campuzano-Granados y Cruz-López (2021)
identificaron y compararon los COV florales presentes en el aguacate ‘Hass’
y el de raza antillana. Se identificaron 35 compuestos volátiles, caracterizándose por poseer en su mayoría monoterpenos
y sesquiterpenos; el linalool
fue el compuesto más abundante en la
raza antillana, mientras que en Hass fue el (E)--ocimeno. Lo anterior
condujo a clasificar de manera taxonómica las razas de aguacate analizadas
gracias a las diferencias en el
perfil de COV florales. La Tabla 1 muestra
los COV que se han encontrado en diferentes
partes del aguacate (flor, mesocarpio y hoja), de plantas que provienen de
diversos lugares de origen y, por lo tanto, con distintas características cada una.
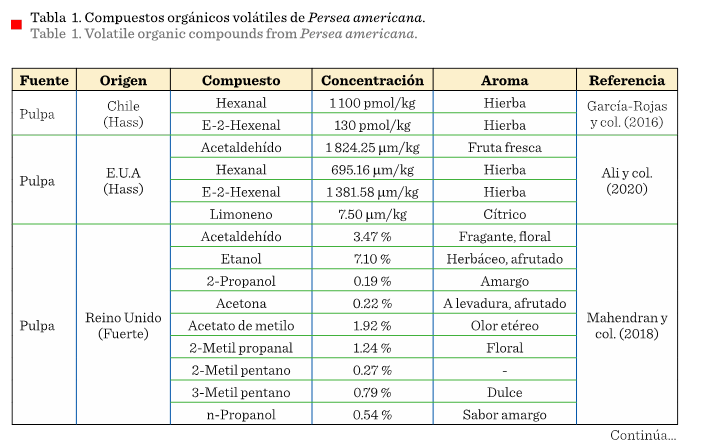
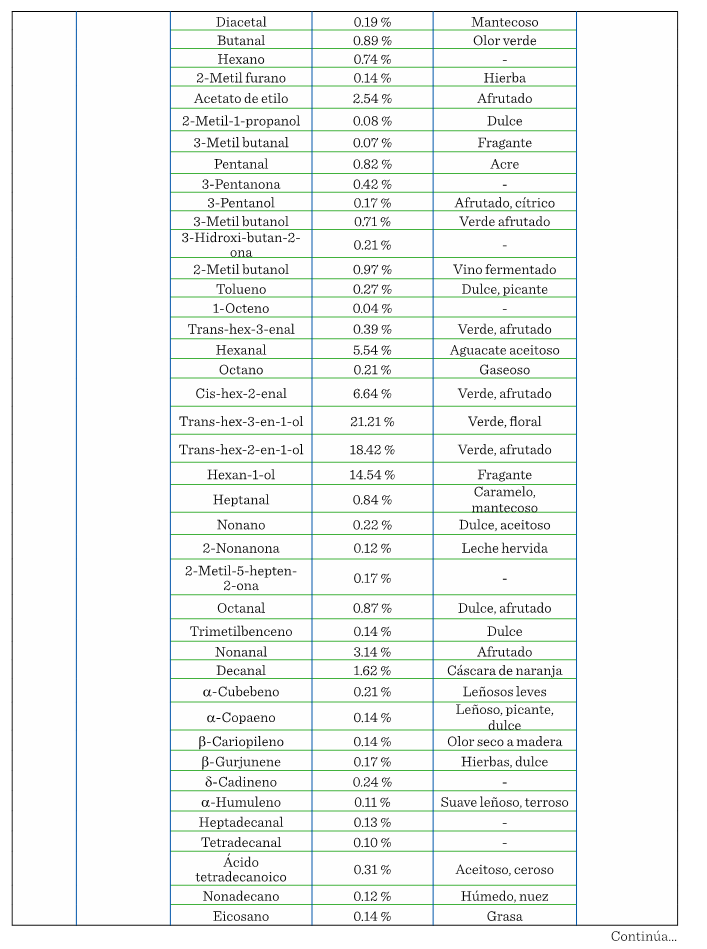
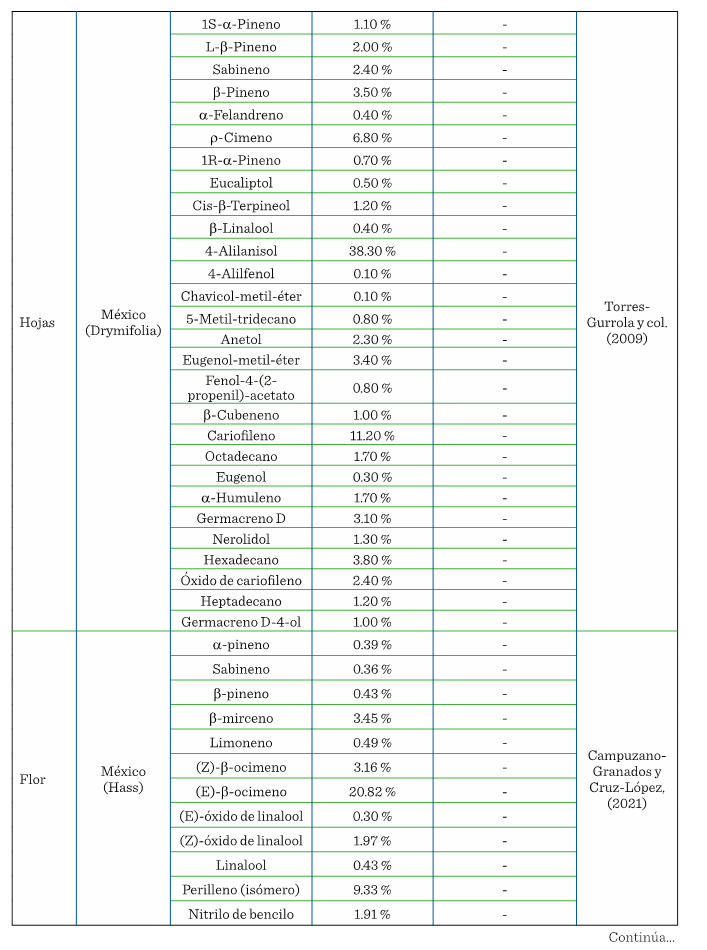
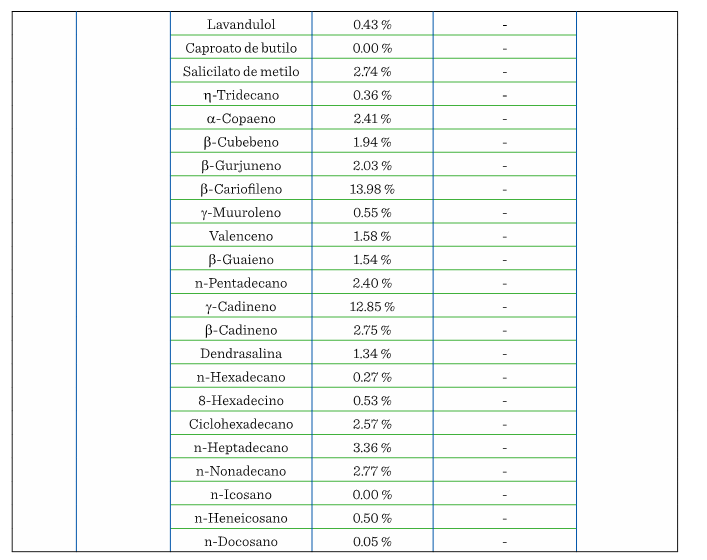
En 10 años se han realizado únicamente 5 estudios de COV
presentes en el aguacate, donde la pulpa, flor y hoja son los materiales analizados.
En pulpa existen 2 estudios de ‘Hass’ y 1 de Fuerte,
ninguno de ellos hecho en México. De los 2 estudios realizados en México, en 1
se analizó el perfil de COV en hojas para seleccionar árboles de P. americana var. Drymifolia, como fuente de genes de resistencia a plagas y enfermedades, ya que previamente
se había demostrado, en el caso de los pinos con
mayor concentración de -pineno, que son menos atacados que los que
tienen menor cantidad del compuesto. Por ello, se considera que el fenotípico
químico puede ayudar a determinar la susceptibilidad a plagas. Esto se observó
en el aguacate criollo-Trioza,
en el que, los árboles con más concentración
de estragol presentaron menos agallas
foliares. En otro ángulo, en la investigación de COV florales, realizada también entre las variedades ‘Hass’ y raza antillana, muestra el ejemplo analizado en el barrenador del hueso Conotrachelus perseae,
el cual ha sido reportado únicamente en el
cultivo de ‘Hass’ en la región de Comitán, Chiapas;
mientras que el barrenador del hueso Stenoma
catenifer se ha encontrado en cultivos de la raza
antillana en la región del Soconusco, Chiapas. Lo anterior se relaciona a los COV florales, ya que estos envían
a los insectos fitófagos y polinizadores señales químicas que les permiten localizar
fuentes de alimento, hábitats y sitios de oviposición;
estas señales varían dependiendo de la especie, variedad, estado fisiológico y el ritmo circadiano de las
plantas (Torres-Gurrola y col., 2009; García-Rojas y col., 2016; Flores-Álvarez y col., 2018; Ali y col.,
2020; Campuzano-Granados y Cruz-López, 2021).
El perfil de COV en la variedad Drymifolia mostró la presencia
de 28 compuestos que no se encuentran reportados en las variedades
extranjeras (Torres-Gurrola y col., 2009). En tanto que en el análisis
realizado en la flor de la variedad mexicana Hass y
la antillana se identificaron 2 de los 28 compuestos de la variedad Drymifolia: sabineno y -pineno (Campuzano-Granados
y Cruz-López, 2021), por lo que se puede inferir que el perfil de COV y la
ubicación geográfica podrían ser clave para una caracterización y clasificación
propia (García-Rojas y col., 2016; Flores-Álvarez y col., 2018; Ali y col.,
2020). Por lo tanto, en la hoja de aguacate criollo se identificaron 26 COV que
lo caracterizan, de los cuales 8 fueron monoterpenoides,
7 sesquiterpenos, 6 fenilpropanoides,
1 acetato y 4 alcanos.
Ácidos grasos
Los compuestos lipídicos son abundantes e importantes en la
composición de los aguacates. Se identifican 5 a 6 ácidos grasos en cantidades significativas, conteniendo ácidos grasos saturados, monoinsaturados
y polinsaturados (Alkhalaf y col., 2019). Por otro lado, se ha informado
que el ácido oléico reduce el colesterol total y la
lipoproteína de baja densidad (LDL, por sus siglas en inglés: low density lipoproteins)
sin reducir la lipoproteína de alta densidad (HDL, por sus siglas en inglés: high density lipoproteins)
ni inhiben la agregación plaquetaria o la acción trombótica
(Krumreich y col., 2018).
El estado de maduración del aguacate influye en el contenido
de ácidos grasos; al ir madurando, el contenido de ácidos grasos monoinsaturados y saturados aumenta, mientras que los polinsaturados disminuyen, debido a su degradación
(Villa-Rodríguez y col., 2011). También se ha observado que, el contenido de
ácidos grasos monoinsaturados
y polinsaturados está relacionado con
temperaturas de crecimiento más frías, como mecanismo para conferir más fluidez a las membranas celulares y, por
ende, brindarle cierta resistencia al frío (Pedreschi
y col., 2016).
Es importante considerar que, tanto la localización
geográfica del aguacate, como su relevante contribución a la salud están
relacionadas con su contenido de ácidos grasos, por lo que ambos parámetros se
han propuesto como variables a tomar en cuenta en futuros estudios de denominación
de origen (Carvalho y col., 2015). En este
sentido, Ali y col. (2020) clasificaron en 3 grupos los genotipos de aguacate, con base en el perfil de ácidos grasos y COV.
El primero estaba conformado por 11 genotipos
y se caracterizó por poseer mayor contenido de ácido oléico
y la menor cantidad de ácido palmítico; el segundo se limitó a un genotipo y se
distinguió por tener mayor concentración de (E)-2-hexanal, limoneno y ácido palmitoleico; el tercer grupo estuvo constituido por 2 subgrupos,
los cuales tenían la mayor cantidad de hexanal y
acetaldehído.
Se ha demostrado que los ácidos grasos tienen la capacidad de
actuar como antioxidantes en sistemas tisulares in vitro. Esta capacidad
dependió directamente del grado de insaturación, siendo
más eficientes los ácidos grasos omega 3 de cadena larga, en particular
el ácido eicosopentanoico. Su mecanismo de acción no ha sido precisado,
pero se ha sugerido que inhiben la
producción de radicales libres por la NAD(P)Hoxidasa y la posibilidad de secuestrar agentes oxidantes,
aunque esto último no se ha probado (Richard
y col., 2008). Asimismo, se les atribuye
a los ácidos grasos una asociación con los
compuestos orgánicos volátiles, en donde los ácidos linolénico
y linoleico están involucrados en la producción de
COV, debido a que existió una reducción significativa del ácido linolénico durante el proceso de maduración, la cual fue de
109 g/mL a 6 g/mL asociado
con el incremento de COV. Por su parte, en
una investigación realizada en manzanas, los ácidos linolénico
y linoleico, como ácidos grasos libres o liberados
por la actividad de la lipasa y luego metabolizadas por las enzimas-oxidasa y/o lipoxigenasa, son considerados los
principales precursores de ésteres volátiles,
alcoholes y aldehídos, producidos durante la maduración de la fruta
(García-Rojas y col., 2016). Un efecto similar fue documentado en aguacate Hass por Richard y col. (2008).
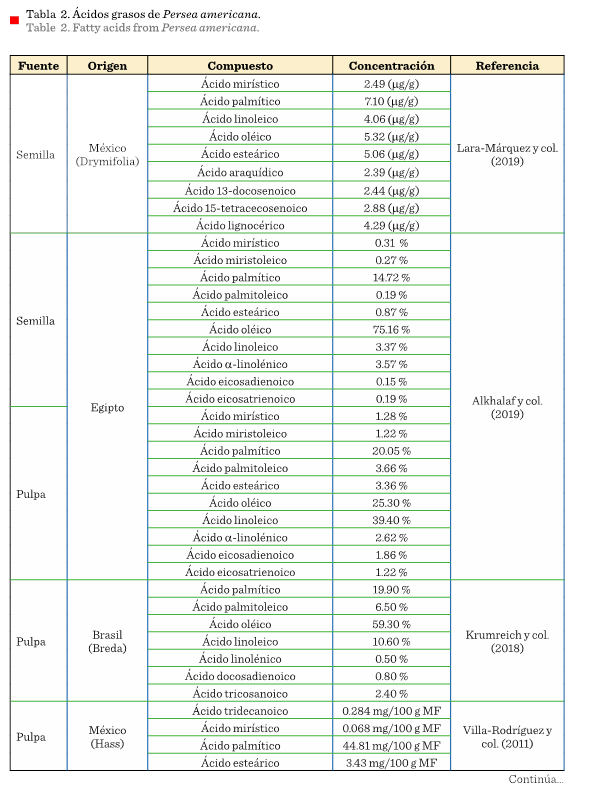
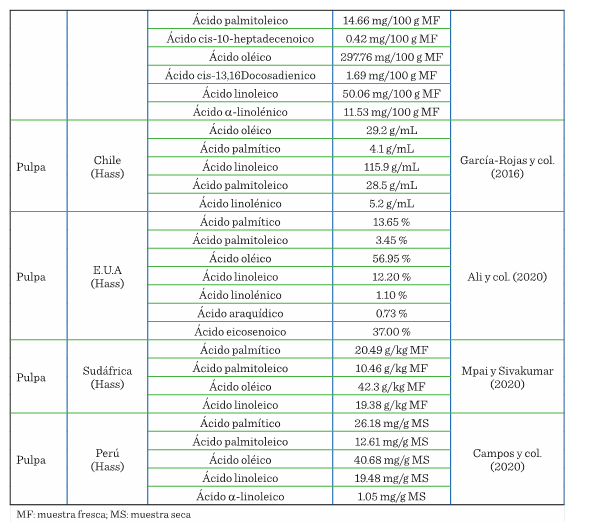
La Tabla 2 muestra los ácidos grasos reportados en las diversas partes del aguacate (pericarpio,
mesocarpio y semilla). En México, se analizó la semilla del aguacate var. Drymifolia, en la que se
identificaron 9 ácidos grasos, que se caracterizan por el contenido de ácido araquídico, 13-docosenoico, 15-tetracosenoico y lignocérico (Lara-Márquez y col., 2019). El contenido de ácidos grasos, característico de esta
variedad, depende de la variedad botánica, la temporada de cultivo,
ubicación geográfica, condiciones climáticas y la etapa de madurez, factores
que se toman en cuenta para considerar al aguacate como materia prima para la industria del aceite, farmacéutica o alguna otra
similar (Mpai y Sivakumar, 2020).
Beneficios a la salud
El aguacate destaca entre las frutas por tener cualidades
dietéticas y medicinales extraordinarias (Alkhalaf y
col., 2019). Su consumo proporciona niveles significativos de fibra dietética,
minerales (magnesio, potasio), vitaminas como
A, B-6, C, E, K, ácido fólico, ácido pantoténico, colina, niacina, riboflavina; además de
fitoesteroles, luteína, zeaxantina
y aceite rico en ácidos grasos insaturados, que solamente proporcionan 1.7
kcal/g. Esta densidad calórica se considera media-baja, porque un aguacate tiene aproximadamente un 80 % parte comestible,
de lo cual 72 % es peso de agua y 8 % fibra
dietética (Dreher y Davenport, 2013). Figueroa
y col. (2018) lo consideran un alimento funcional por la presencia de
compuestos bioactivos, tales como el hidroxibenzoico, los ácidos hidroxicinámicos,
flavonoles y procianidinas.
Existe un interés particular en los lípidos de la semilla de
aguacate y sus derivados, ya que poseen una importante actividad anticancerígena.
La variedad nativa mexicana muestra un mayor
contenido de aceite en la semilla (20 % a 30 %). Lara-Márquez y col.
(2019) documentaron que la citotoxicidad de moléculas lipídicas inhibe la oxidación
de ácidos grasos y aumenta la producción de especies reactivas de oxígeno, lo que
conduce a una pérdida de potencial mitocondrial en células Caco-2, células de
cáncer de colón, lo que explica el afecto anticancerígeno. Además, reportaron 4
compuestos exclusivamente en la semilla del aguacate var.
Drymifolia, los cuales caracterizan dicha variedad.
En general, a estos 4 compuestos se les denomina acetogeninas
(avocatinas, ácidos grasos polihidroxílicos,
persinas y pahuatinas),y se estima que son promotores de biopelículas bacterianas e inhibidores neurotóxicos.
Es importante mencionar que dichos
compuestos son derivados de ácidos grasos.
Los extractos lipídicos de la semilla y
el fruto de aguacate tienen una actividad inhibidora significativa de radicales
oxidantes ABTS y DPPH, lo que se asocia a su capacidad antioxidante. También se ha registrado una inhibición significativa
del carcinoma hepatocelular en células HepG2 y
HCT116 y el contenido de compuestos fitoquímicos
tiene un efecto de laberinto en la detención
del ciclo celular, deteniendo el crecimiento de algunas células cancerosas a
través de la estimulación de la apoptosis
(muerte auto-programada de la célula) (Alkhalaf
y col., 2019).
El extracto cetónico de aguacate contiene carotenoides y tocoferoles que frenan el crecimiento in
vitro de líneas celulares de
cáncer de próstata, tanto dependientes (LNCaP)
como independientes (PC-3) de
andrógenos (Lu y col., 2005). En tanto que los efectos de los múltiples compuestos bioactivos
que existen en el aguacate no pudieron
ser reproducidos utilizando únicamente luteína purificada, por lo que se
infiere que diversas sustancias bioactivas liposolubles pueden interactuar para producir
efectos benéficos a la salud. Es probable que estos carotenoides bioactivos se absorban en el torrente sanguíneo, donde, en sinergismo con otros compuestos fitoquímicos
comunes en una dieta de frutas y verduras, pueden contribuir a la reducción significativa
del riesgo de cáncer (Lu y col., 2005).
Rodríguez-Sánchez y col. (2013), determinaron que existe una relación
entre las acetogeninas presentes en el mesocarpio de la variedad ‘Hass’
y la actividad antioxidante del fruto. Estos
COV pueden intervenir como antioxidantes lipofílicos
en alimentos, al actuar como agentes estabilizantes de especies aniónicas
y como agentes donadores de
hidrógeno.
La hoja de aguacate representa también una fuente importante
de compuestos con alta actividad antioxidante, como son ácidos fenólicos (Hexaóxido de ácido dimetil elágico y ácido cafeico-hexosido),
flavonoides (Cinchonain, pelargonidin 3-O-glucósido, quercetina-3-glucósido, quercetina-O-desoxihesoxido y Kaempferol-O-pentosido) y otros (Perseitol),
que podrían ser utilizados como agentes bioactivos
para el tratamiento de varias enfermedades, y para el desarrollo de nuevos productos alimenticios (Castro-López y col., 2019).
El aceite de aguacate criollo mexicano
tiene mayor contenido fenólico que otros aceites comestibles y
exhibe también actividad antiinflamatoria (Espinosa-Alonso y col., 2017). PaDef, es un péptido proveniente del aguacate, que activa
la apoptosis en células de K652, por apoptosis extrínseca, lo que podría implicar la participación de TNF-. Dicha actividad
sugiere que esta defensina tendría la posibilidad de
ser una molécula potencial en el tratamiento de leucemia (Flores-Álvarez
y col., 2018).
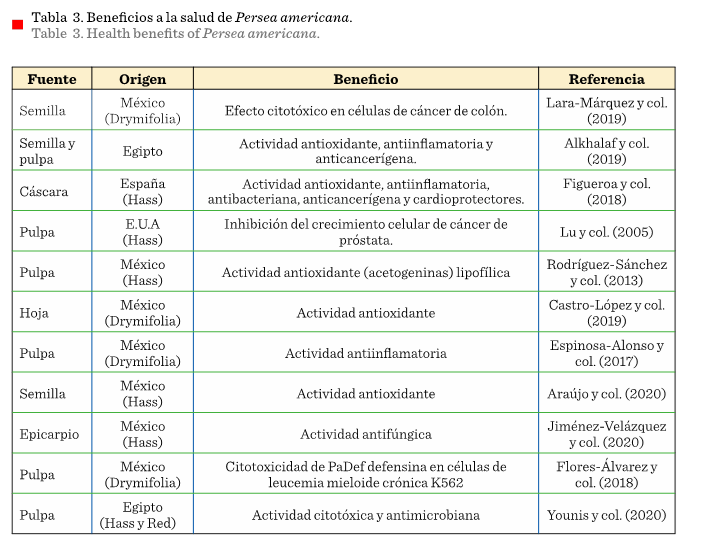
En la Tabla 3 aparecen 11 estudios, 7 de ellos en México, de los
cuales 4 fueron en la var. Drymifolia,
en hoja, pulpa y semilla mediante la extracción de diversos péptidos. Los resultados
indican que los extractos se relacionan con la muerte de células de cáncer de
próstata y células K562, actividad antioxidante y antiinflamatoria (Rodríguez-Sánchez y col., 2013; Espinosa-Alonso
y col., 2017; Flores-Álvarez y col., 2018; Castro-López y col., 2019;
Lara-Márquez y col., 2019).
Acerca de los posibles compuestos que inhiben las células de cáncer de próstata, uno de ellos es
la luteína, según el reporte de Lu y col. (2005), quienes observaron que
este compuesto detuvo el ciclo celular resultante de la regulación negativa de
proteína p27. En otras investigaciones, los compuestos
obtenidos del extracto de la pulpa de aguacate empleando acetona como
solvente, mostraron ser ricos en luteína, zeaxantina,-criptoxantina, -caroteno, -caro-teno,
-tocoferol y -tocoferol. Estos extractos demostraron capacidad para detener
las células de cáncer de próstata PC-3 en el
G2/M y aumentar la expresión de la proteína p27 (Melgar y
col., 2018).
En diversos estudios, la actividad anticancerígena la relacionan
con la presencia de glutatión, compuesto que destaca por estar presente en
mayor proporción que en otros frutos, siendo un potente antioxidante tripéptido que desempeña un papel importante en las vías de desintoxicación y la reducción del estrés oxidativo
(Dreher y Davenport, 2013). Es posible que tenga relación con el COV limoneno,ya que posee la capacidad de inhibir la formación de tumores estimulando la enzima glutatión
S-transferasa, siendo esta una enzima desintoxicante
que cataliza la reacción del glutatión con electrófilos peligrosos, para formar
compuestos menos tóxicos y más solubles en agua, que puedan ser excretados del
organismo fácilmente. En algunas pruebas
preliminares, pacientes con cáncer reciben limoneno oralmente para
probar su efectividad terapéutica (Craig,
1997). Las acetogeninas alifáticas (avocatinas, persinas y pahuatinas),
inhibieron la proliferación celular en células cancerosas orales humanas, mediante la contención de la vía EGFR/RAS/RAF/MEK/ERK1/2 al disminuir EGFR (Tyr1173), fosforilación
de c-RAF (Ser338) y ERK1/2
(Thr202/Tyr204) (Cascinu y col., 2002; Ding y col., 2009; D’Ambrosio y
col., 2011; Naveed y col., 2018).
Otros trabajos se enfocaron en la actividad antiinflamatoria
del aguacate. El estudio del extracto acuoso de sus hojas demostró un efecto
antiinflamatorio efectivo in vivo, inhibiendo el edema en la pata de
rata inducido por carragenina (Adeyemi
y col., 2002); la reducción de óxido nítrico sintasa
y ciclooxigenasa-2, en macrófagos murinos activados, se debe a la persenona A y B (Kim y col.,
2000). En cuanto a la actividad anti-oxidante, existen una gran diversidad de
compuestos que la favorecen, como es el caso del ácido gálico, vanílico y ferúlico, quercetina, catequina, epicatequina, ácido neoclorogénico,
procianidinas B1 y B2, vitamina E, to-coferol, ácido clorogénico (Lu
y col., 2005; Bhattacharyya y col., 2010;
Ortega-Arellano y col., 2019; Santana y col., 2019). Para la identificación y cuantificación de los compuestos anteriores en aguacate se han utilizado diversas técnicas,
entre ellas por ácido 2, 2’-azino-bis -3-etil-benzotiazolin-6-sulfónico (ABTS,
por sus siglas en inglés: 2,20-azino-bis
(3-ethylbenzothiazoli-ne-6-sulfonic acid diammonium salt)),
2, 2- Difenil-1-picrilhidrazilo (DPPH, por sus siglas en inglés: 2,2-diphenyl-1-picrylhydrazyl), capacidad de
absorción de radicales oxígeno (ORAC, por
sus siglas en inglés: oxygen radical absorbance capacity), capacidad
antioxidante reductora cúprica (CUPRAC, por sus siglas en inglés: cupri-creducing antioxidant capacity), poder antioxidante
reductor férrico (FRAP, por sus siglas
en inglés: ferric-reducing ability
of plasma), cromatografía líquida de
alta resolución (HPLC, por sus siglas
en inglés: high-performance liquid chromatography),
cromatografía líquida de alta resolución
espectrometría de masas (HPLC-MS, por
sus siglas en inglés: high performance liquid chromatographymass spectrometry)
cromatografía de gases acoplada a espectrometría de masas (GC-MS, por
sus siglas en inglés: gas chromatography-mass spectrometry) y
cromatografía de gases mediante detector de ionización de flama (GC-FID, por
sus siglas
en inglés: gas chromatography-flame ionization detector) (Bhuyan y
col., 2019). Por lo que de acuerdo
con el consenso de información que realizó Bhuyan
y col. (2019), en donde los compuestos fenólicos, carotenoides, tocoferoles y acetogeninas, antioxidantes significativos que se encuentran en el aguacate, se han relacionado
positivamente con los compuestos fenólicos con la capacidad antioxidante,
aumentando a la par, ya que los compuestos fenólicos reducen la oxidación, inflamación y agregación plaquetaria. Cabe resaltar que dicha actividad es mayor en hojas, cáscara y semilla, en
comparación con pulpa, así mismo, entre mayor
es la etapa de maduración, los compuestos fenólicos aumentan.
Aunque el aguacate ha sido reconocido por sus efectos
benéficos a la salud, se ha informado toxicidad aguda animal por el consumo de
la pulpa y hojas, reportándose que la hoja induce daño en el miocardio y en las
glándulas mamarias en animales (Jimenez y col.,
2020). En este sentido, en estudios
realizados con extracto metanólico de pulpa y
hoja de aguacate se descubrió que tienen
efectos genotóxicos sobre linfocitos periféricos humanos cultivados (Kulkarni y col., 2010). Sin embargo, en otro estudio,
el extracto acuoso de aguacate no presentó
toxicidad en ratas macho adultas (Ozolua y
col., 2009). Finalmente, se ha descubierto que el compuesto con mayor toxicidad
del aguacate es la persina,
la cual tiene efecto sobre la glándula lactante en dosis entre 60
mg/kg y 10 mg/kg (Oelrichs y col., 1995), por lo que hacen
falta estudios sobre el tipo de extracción que se podría utilizar y
la dosis correcta a administrar.
Los diversos estudios in vitro, in vivo y
preclínicos, han ayudado a formular la posible obtención de compuestos con
acción farmacológica o tratamientos de atención o prevención para diversas
enfermedades a partir de la planta de
aguacate, pero se necesita una mayor investigación al respecto.
Acorde con la información descrita en el presente trabajo, es
importante resaltar que, de las investigaciones realizadas en aguacate, sobresale en su mayoría las efectuadas en variedades
comerciales como la Hass. La información obtenida resultó ser limitada en P.
americana variedad Drymifolia sobre la caracterización
del perfil de compuestos orgánicos volátiles
y del perfil de ácidos grasos y la
relación con su ubicación geográfica
en México. Por lo tanto, para futuras investigaciones, se propone determinar tanto el perfil de ácidos grasos como el de compuestos orgánicos volátiles, para así resaltar los
compuestos que los tipifiquen y le confieran
la importancia que se desea dar a
conocer sobre P. americana
variedad Drymifolia.
CONCLUSIONES
Los
ácidos grasos están estrechamente relacionados
con la síntesis de algunos compuestos orgánicos volátiles (COV), estos
últimos le confieren diversas características
organolépticas al aguacate. Tanto la
localización geográfica del aguacate como su relevante contribución a la
salud están relacionadas con el contenido de ácidos grasos, los cuales,
permiten ser considerados como una importante variable para futuras clasificaciones,
aunado a ello, conociendo el perfil de COV complementaría dicha propuesta. Por otro lado, los compuestos fitoquímicos
presentes en aguacates nativos y en diversos híbridos se consideran compuestos bioactivos, a los que se les han atribuido diferentes
cualidades anticancerígenas, antiinflamatorias, antioxidantes y efecto cardioprotector, entre otras, lo que motiva a profundizar
en investigaciones futuras para darle la importancia a este tipo de sustancias.
Por lo que, el aguacate, además de consumirse en fresco, podría llevar a
establecer procesos de aprovechamiento integral
que permitan utilizar al fruto o a sus subproductos como fuente de
ingredientes de grado alimenticio o farmacéutico, entre otros. Sin embargo, los
estudios para establecer la ingesta segura y niveles de administración de los
extractos de aguacate han mostrado, en algunos casos, cierto grado de toxicidad. Se requieren más investigaciones
para evaluar el potencial terapéutico del
aguacate, así como para comprender la biodisponibilidad y la farmacocinética
de los fitoquímicos presentes.
AGRADECIMIENTOS
Autores agradecen la beca otorgada (1011431) por el Consejo
Nacional de Ciencia y Tecnología (CONACyT) para
realizar sus estudios de posgrado y al Tecnológico Nacional de México por el
fomento a la investigación.
Referencias
Acosta, E., Almeyda, I. H. y
Hernández, I. (2013). Evaluación de aguacates criollos en Nuevo León, México: región
norte. Revista Mexicana de Ciencias Agrícolas. 4(4): 531-542.
Acosta, E., Hernández, I. y Almeyda,
I. H. (2012). Evaluación de aguacates criollos en Nuevo León, México: región
sur. Revista Mexicana de Ciencias Agrícolas. 3(2): 245-257.
Adeyemi,
O., Pkpo, S., and Ogunti,
O. (2002). Analgesic and anti-inflammatory effects of Persea
americana
Mill (Lauraceae). Fisioterapia.
52: 2311-2323.
Ali, S., Plotto,
A., Scully, B. T., Wood, D., Stover, E., Owens, N., …, and Bai, J. (2020).
Fatty acid and volatile organic compound profiling of avocado germplasm grown
under East-Central Florida conditions. Scientia
Horticulturae. 261: 109080.
Alkhalaf, M. I., Alansari, W. S.,
Ahmed, E. A., and Elhalwagy, M. E. A. (2019). Anti-oxidant, antiinflammatory and anti-cancer activities of
avocado (Persea americana)
fruit and seed extract. Journal of King
Saud University – Science. 31(4): 1358-1362.
Araújo, R. G., Rodríguez-Jasso, R.
M., Ruiz, H. A., Govea-Salas, M., Pintado, M. E., and
Aguilar, C. N. (2020). Process optimization of microwave-assisted extraction of
bioactive molecules from avocado seeds. Industrial
Crops & Products. 154: 112623.
Araújo, R. G., Rodríguez-Jasso, R.
M., Ruiz, H. A., Pintado, M. M. E., and Aguilar, C. N. (2018). Avocado by-products: Nutritional and functional properties. Trends
in Food Science and Technology. 80: 51-60.
Bhattacharyya,
S. S., Paul, S., Dutta, S., Boujedaini, N., and Khuda-Bukhsh, A. R. (2010).
Anti-oncogenic potentials of a plant
coumarin (7-hydroxy-6-methoxy coumarin) against 7,12-dimethylbenz [a] anthracene-induced skin papilloma in mice:
The possible role of several key signal proteins. Chinese Journal
Integrative Medicine. 8(7): 645-654.
Bhuyan, D. J., Alsherbiny, M. A., Perera, S.,
Low, M., Basu, A., Devi, O. A., …, and Papoutsis, K. (2019). The Odyssey of Bioactive Compounds in Avocado (Persea americana)
and Their Health Benefits. Antioxidants.
8(10): 426.
Campos, D., Teran-Hilares,
F., Chirinos, R., Aguilar-Galvez,
A., García-Ríos, D., Pacheco-Avalos, A., and Padreschi, R. (2020). Bioactive compounds and antioxidant activity from harvest to edible ripeness of
avocado cv. Hass (Persea americana) throughout the harvest seasons. International
Journal of Food Science and Technology. 55(5): 2208-2218.
Campuzano-Granados, A. J. and Cruz-López, L. (2021).
Comparative analysis of floral volatiles between the ‘Hass’ variety and Antillean race avocado. Revista Chapingo Serie Horticultura.
27(1): 19-26.
Canto, E. M., Tieman,
D. M., Sargent, S. A., Klee, H. J., and Huber,
D. J. (2013). Volatile profiles of ripening West Indian
and Guatemalan-West Indian avocado cultivars as affected by aqueous 1-methylcyclopropene. Postharvest Biology
and Technology. 80: 37-46.
Carvalho, C. P., Bernal, J.,
Velázquez, M. A., and Cartagena J. R.
(2015). Fatty acid content of avocados (Persea
americana
Mill. cv. Hass) in relation to orchard altitude and fruit maturity stage. Agronomía Colombiana. 33(2):220-227.
Cascinu,
S., Catalano, V., Cordella,
L., Labianca, R., Giordani,
P., Baldelli, A. M., …, and Catalano,
G. (2002). Neuroprotective effect of reduced
glutathione on oxaliplatin-based
chemotherapy in advanced colorectal cancer: A randomized, double-blind, placebo-controlled trial. Journal Clinical Oncology. 20(16): 3478-3483.
Castro-López, C., Bautista-Hernández,
I., González-Hernández, M. D., Martínez-Ávila, G. C. G., Rojas, R., Gutiérrez-Díez,
A., …, and Aguirre-Arzola, V. E. (2019). Polyphenolic profile and antioxidant activity of leaf purified
hydroalcoholic extracts from seven Mexican Persea
americana cultivars. Molecules. 24(1):
173.
Cho, K., Goldstein, B., Gounaridis, D., and Newell, J. P. (2021). Where does your guacamole come from? Detecting deforestation
associated with the export of avocados from Mexico to the United States. Journal
of Environmental Management. 278: 111482.
Craig, W. J. (1997). Phytochemicals:
guardians of our health. Issues in Vegetarian Dietetics. 5(3): 1-8.
D’ Ambrosio, S. M., Han, C., Pan, L.,
Kinghom, A. D., and Ding, H., (2011). Aliphatic acetogenin constituents of avocado fruits inhibit human oral
cancer cell proliferation by targeting the EGFR/RAS/RAF/MEK/ERK1/2 pathway. Biochemical Biophysical Research Communications. 409(3): 465-469.
Damián-Nava, A., Palemón-Alberto,
F., Moreno-Juárez, J., Hernández-Castro, E., Damián-Díaz, P. E.,
Vargas-Álvarez, D., …, and Reyes-García, G. (2017). Characterization of creole avocado fruits harvested from both central
and northern regions of Guerrero, Mexico. International Journal of Advanced
Research in Biological Sciences. 4(10): 151-159.
Dávila-Aviña, J. E. J., González-Aguilar, G. A., Ayala-Zavala, J.
F., Sepúlveda, D. R. y Olivas, G. I. (2011). Compuestos
volátiles responsables del sabor del tomate. Revista Fitotecnia Mexicana.
34(2): 133-143.
Ding, H., Han, C., Guo, D., Chin, Y.
W., Ding, Y., Kinghorn, A. D., and D’ Ambrosio, S. M. (2009). Selective
induction of apoptosis of human oral cancer cell lines by avocado extracts via a ros-mediated
mechanism. Nutrition and Cancer. 61(3): 348-356.
Dreher, M. L. and Davenport, A. J.
(2013). Hass avocado composition and potential health effects. Critical
Reviews in Food Science and Nutrition. 53(7): 738-750.
Edwards, C. G., Walk, A. M.,
Thompson, S. V., Reeser, G. E., Burd, N. A., Holscher, H. D., and Khan, N. A. (2020). Effects of 12-week
avocado consumption on cognitive function among adults with overweight and
obesity. International Journal of Psychophysiology. 148: 13-24.
Espinosa-Alonso, L. G.,
Paredes-López, O., Valdez-Morales, M., and Oomah, B.
D. (2017). Avocado oil characteristics of Mexican creole genotypes. European
Journal of Lipid Science and Technology. 119(10): 1600406.
Figueroa, J. G., Borrás-Linares, I.,
Lozano-Sánchez, J., and Segura-Carretero A. (2018). Comprehensive identification of bioactive compounds of avocado peel by
liquid chromatography coupled to ultra-high-definition accurate-mass Q- TOF. Food Chemistry.
245: 707-716.
Flores-Álvarez, L. J., Guzmán-Rodríguez, J. J., López-Gómez,
R., Salgado-Garciglia, R., Ochoa-Zarzosa, A., and
López-Meza, J. E. (2018). PaDef defensin
from avocado (Persea americana
var. Drymifolia) is cytotoxic to K562 chronic myeloid leukemia cells through extrinsic
apoptosis. International Journal of Biochemistry and Cell Biology.
99: 10-18.
García-Rojas, M., Morgan, A., Gudenschwager, O., Zamudio, S., Campos-Vargas, R.,
González-Agüero, M., and Defilippi,
B. G. (2016). Biosynthesis of fatty acids-derived volatiles in Hass avocado is
modulated by ethylene and storage conditions during ripening. Scientia Horticulturae.
202: 91-98.
Guo, J., Yue, T., Yuan, Y., Sun, N.,
and Liu, P. (2020). Characterization of volatile and sensory profiles of apple
juices to trace fruit origins and investigation of the relationship between the
aroma properties and volatile constituents. LWT - Food Science and
Technology. 124: 109203.
Jimenez, P., Garcia, P., Quitral, V., Vasquez, K., Parra-Ruiz, C., Reyes-Farias, M.,
..., and Soto-Covasich, J. (2020). Pulp, Leaf, Peel
and Seed of Avocado Fruit: A review of bioactive compounds and healthy
benefits. Food Reviews International. 1-37.
Jiménez-Velázquez, P., Valle-Guadarrama, S., Alía-Tejacal, I., Salinas-Moreno, Y., García-Cruz, L.,
Pérez-López, A., and Guerra-Ramírez, D.
(2020). Separation of
bioactive compounds from epicarp of ‘Hass’
avocado fruit through aqueous two-phase systems. Food and Bioproducts
Processing. 123: 238-250.
Kim, O. K., Murakami, A., Nakamura,
Y., Takeda, N., Yoshizumi, H., and Ohigashi, H. (2000). Novel nitric oxide and superoxide generation inhibitors, persenone A and B, from avocado fruit. Journal of Agriculture and Food Chemical. 48:
1557-1653.
Krumreich, F. D., Borges, C. D., Mendonça,
C. R. B., Jansen-Alves, C., and Zambiazi, R. C.
(2018). Bioactive compounds and quality parameters of avocado oil obtained by
different processes. Food Chemistry. 257: 376-381.
Kulkarni, P., Paul, R., and Ganesh,
N. (2010). Evaluation of Genotoxicity of Avocado (Persea
Americana) Fruit and Leaf Extracts in Human Peripheral Lymphocytes. Journal
of Environmental Science and Health, Part C. 28(3): 172-187.
Lara-Márquez, M., Báez-Magaña,
M., Raymundo-Ramos, C., Spagnuolo, P. A., Macías-Rodríguez,
L., Salgado-Garciglia, R., …, and López-Meza, J. E.
(2019). Lipid-rich extract from Mexican avocado (Persea
americana var. Drymifolia)
induces apoptosis and modulates the inflammatory response in Caco-2 human colon
cancer cells. Journal of Functional Foods. 64: 103658.
Lu, Q. Y., Arteaga, J. R., Zhang, Q.,
Huerta, S., Go, V. L. W., and Heber, D. (2005). Inhibition of prostate cancer
cell growth by an avocado extract: role of lipid-soluble bioactive substances. Journal
of Nutritional Biochemistry. 16: 23-30.
Mahendran, T.,
Brennan, J. G., and Hariharan, G. (2018). Aroma volatiles components of ‘Fuerte’ Avocado
(Persea americana Mill.)
stored under different modified atmospheric conditions. Journal of Essential
Oil Research. 31(21): 1-9.
Melgar, B., Días, I. M., Ciric,
A., Sokovic, M., García-Castello, E. M.,
Rodríguez-López, A. D., …, and Ferreira, I. C. R. F. (2018). Bioactive
characterization of Persea americana Mill. by-products: A rich source of inherent
antioxidants. Industrial Crops & Products. 111: 212-218.
Mpai, S. and Sivakumar, D. (2020). Influence of growing
seasons on metabolic composition, and fruit quality of avocado cultivars at
‘ready-to-eat stage’. Scientia Horticulturae. 265: 109-159.
Naveed, M., Hejazi, V., Abbas, M.,
Kamboh, A. A., Khan, G. J., Shumzaid, M., …, XiaoHui, Z. (2018). Chlorogenic acid (CGA): A
pharmacological review and call for further research. Biomed Pharmacother. 97: 67-74.
Oelrichs, P. B., Ng, J. C., Seawright, A. A., Ward, A., Schäffeler, L., and MacLeod, J. K. (1995). Isolation and
identification of a compound from avocado (Persea
Americana) Leaves wich causes necrosis of the acinar
epithelium of the lactating mammary gland and myocardium. Natural
Toxins. 3(5): 344-349.
Ortega-Arellano, H. F., Jimenez-Del-Rio,
M., and Velez-Pardo, C. (2019). Neuroprotective effects of methanolic
extract of avocado Persea americana (var. Colinred)
peel on paraquat-induced locomotor impairment, lipid
peroxidation and shortage of life span in transgenic knockdown parkin
drosophila melanogaster. Neurochemical Research. 44(8): 1986-1998.
Ozolua, R. I., Anaka, O. N., Okpo, S. O., and Idogun, S.E. (2009). Acute and Sub-Acute toxicological
assessment of the aqueous seed extract of Persea
Americana Mill (Lauraceae) in
Rats. African Journal of Traditional, Complementary and
Alternative Medicines. 6(4): 573-578.
Pedreschi, R., Hollak, S., Harkema, H., Otma, E., Robledo,
P., Westra, E., …, and Defilippi,
B. G. (2016). Impact of postharvest ripening strategies on ‘Hass’ avocado fatty
acid profiles. South African Journal of Botany. 103: 32-35.
Poll, L., Nielsen, G. S., Varming, C., and Petersen, M. A. (2006). Aroma changes from
raw to processed products in fruits and vegetables. Developments in Food
Science. 43: 239-244.
Richard, D., Kefi,
K., Barbe, U., Bausero, P., and Visioli,
F. (2008). Polyunsaturated fatty acids as
antioxidants. Pharmacological Research. 57: 451-455.
Rodríguez-Sánchez, D., Silva-Platas, C., Rojo, R. P., García, N., Cisneros-Zevallos,
L., García-Rivas, G., and Hernández-Brenes, C.
(2013). Activity-guided identification of acetogenins
as novel lipophilic antioxidants present in avocado pulp (Persea
americana). Journal of Chromatography B. 942:
37-45.
Salazar-García, S., Medina-Carrillo, R.
E. y Álvarez-Bravo, A. (2016). Evaluación inicial de algunos aspectos de
calidad del fruto de aguacate ‘Hass’ producido en
tres regiones de México. Revista Mexicana de Ciencias Agrícolas. 7(2):
277-289.
Santana, I., Castelo-Branco, V. N., Guimarães, B. M.,
de-Oliveira-Silva, L., Peixoto, V. O. D. S., Cabral,
L. M. C., ..., and Torres, A. G. (2019). Hass avocado (Persea americana Mill.) oil enriched in phenolic compounds and
tocopherols by expeller-pressing the
unpeeled microwave dried fruit. Food Chemistry. 286: 354-361.
Tiwari, S., Kate, A., Mohapatra, D.,
Tripathi, M. K., Ray, H., Akuli, A., …, and Modhera, B. (2020). Biomarkers for quality management of
horticultural commodities during storage through e-sensing. Trends in Food
Science y Technology. 106: 417-433.
Torres-Gurrola,
G., Montes-Hernández, S., and Espinosa-García, F. J. (2009). Patterns of
variation and geographic distribution in foliar chemical phenotypes of Persea americana
var. Drymifolia. Revista Fitotecnia Mexicana.
32(1): 19-30.
Turner, B. L. and Miksicek,
C. H. (1984). Economic plant-species associated with prehistoric agriculture in the
Maya lowlands. Economic Botany. 38(2): 179-193.
Villa-Rodríguez, J. A., Molina-Corral, F. J., Ayala-Zavala,
J. F., Olivas, G. I., and González-Aguilar G. A. (2011). Effect of maturity stage on the content of fatty acids
and antioxidant activity of ‘Hass’ avocado. Food Research International.
44(5): 1231-1237.
Younis, I., Hifnawy, M. S., El-Hawary, S. S.,
El Bishbishy, M. H., and Elateek, S. Y. (2020). Bioactive
metabolites of hass and reed avocados targeting
methicillin-resistant Staphylococcus aureus enterotoxin like X via
molecular modeling and cytotoxicity assessments. Natural Product Research.
1-5.