Caracterización de
abonos orgánicos aplicados a cultivos florícolas en el sur del Estado de México
Characterization
of organic fertilizers applied to flower crops in the south of the State of
Mexico
Marithza Guadalupe Ramírez-Gerardo1*,
Sergio Vázquez-Villegas1, Gloria Isabel Méndez-Gómez1,
Jaime Mejía-Carranza2
*Correspondencia: maritthza@gmail.com/ Fecha de recepción: 4
de enero de 2021/Fecha de aceptación: 21 de abril de 2021/Fecha de publicación:
27 de julio de 2021.
1Tecnológico
Nacional de México, Tecnológico de Estudios Superiores de Villa Guerrero,
División de Ingeniería en Innovación Agrícola Sustentable, carretera federal Toluca-Ixtapan de la Sal km
64.5, La Finca, Villa Guerrero, Estado de México, México, C. P. 51767. 2Universidad
Autónoma del Estado de México, Centro Universitario Tenancingo, Tenancingo,
Estado de México, México.
Resumen
Las ventajas de
incorporar abonos orgánicos (AO) disminuyen cuando sus propiedades físicas,
químicas y microbiológicas no son las adecuadas. El objetivo de la presente investigación
fue caracterizar abonos orgánicos destinados
a suelos florícolas y analizar las repercusiones de su aplicación. Se
determinaron las propiedades de 10 AO: potencial de hidrógeno (pH),
conductividad eléctrica (CE), materia orgánica (MO), contenido de nitrógeno,
fósforo, potasio y nitratos. Se utilizó un diseño completo al azar y análisis
de varianza (P ≤ 0.05) para evaluar el índice germinativo (IG) en semillas de
rábano y maíz, con lixiviados de AO al 5 %, así como la actividad microbiana de tres AO incorporados al suelo en
incubaciones aerobias. El pH promedio fue de 8.2 ± 0.81, y el intervalo de la
CE en AO fue de 0.15 dS/m a 6.7 dS/m,
mientras que el de la MO fue de 28.8 % a 80
%. El IG fue diferente
estadísticamente (P < 0.05) en cada especie de semilla. Asimismo, la
incorporación de AO incrementó significativamente (P < 0.05) la actividad
microbiana del suelo. Se concluye que la heterogeneidad de la materia prima
genera una gran variabilidad en las características de los AO, sin embargo, en
todos los casos, su aplicación mejoró las propiedades de los suelos florícolas.
Palabras clave: composta, lombricomposta,
materia orgánica, relación carbono/nitrógeno (C/N).
Abstract
The advantages of incorporating organic fertilizers (OF) decrease when their physical, chemical and
microbiological properties are not adequate.
The objective of this research was to characterize organic fertilizers
intended for floricultural soils and analyze
the effects of their application. The properties of 10 OF were
determined: hydrogen potential (pH), electrical conductivity (EC), organic
matter (OM), content of nitrogen, phosphorus, potassium and nitrates. A completely randomized design and analysis
of variance (P ≤ 0.05) were used to evaluate, the germination index (GI) in radish and corn seeds, with leachates of
OF at 5 %, as well as the microbial activity of three
OF incorporated into the soil in aerobic incubations. The average pH was 8.2 ± 0.81,
and the interval of EC in OF ranged from 0.15 dS/m to
6.7 dS/m, whereas that of the OM was from 28 % to 80
%. The GI was statistically different (P < 0.05) in each seed species. Likewise, the incorporation of OF significantly increased (P < 0.05) the microbial activity
of the soil. It is concluded that the heterogeneity
of the raw material generates a great variability
in the characteristics of the OF; however, in all cases, its application
improved the properties of the floricultural soils.
Keywords: compost,
lombricompost, organic matter, carbon/nitrogen ratio
(C/N).
INTRODUCCIÓN
La agricultura convencional se caracteriza por el empleo de agroquímicos
como fertilizantes, plaguicidas y herbicidas de origen
sintético, que permiten alcanzar altos rendimientos,
sin embargo, esta forma de producción está vinculada al deterioro físico,
químico y biológico del suelo (Sakin y col., 2018).
El municipio de Villa Guerrero, en el Estado de México, México,
forma parte del corredor florícola más
importante del país, con una producción intensiva de flores de corte,
cuyos sistemas productivos se caracterizan por tener una alta demanda de
nutrientes, como nitrógeno (N), fósforo (P) y potasio (K) (Cabrera y col.,
2017) que los floricultores incorporan como fertilizantes sintéticos, acción que impacta de manera negativa a los suelos, ya
que con el tiempo genera problemas de salinidad, empobrecimiento de
nutrientes y disminución de actividad
microbiana (Bonanomi y col., 2020; Yáñez-Ocampo y
col., 2020). Actualmente se han comenzado a utilizar diversas fuentes de materia orgánica (MO), como estiércoles
de bovino, equino y gallinaza de animales, que tiene el propio productor, humus
de lombriz, composta, pajas y desechos de cultivos, en cantidades
variables, con el objetivo de disminuir
principalmente costos en la compra de fertilizantes sintéticos, pero también
para mantener la salud y calidad de los suelos y mejorar su productividad; sin
embargo, se desconocen las propiedades físicas, químicas y microbiológicas de
los abonos orgánicos (AO) que incorporan.
La aplicación de los AO al suelo se considera una práctica agrícola
sustentable, porque contribuye a mantenerlos sanos y fértiles (Scotti y col., 2015; Vilkienė y
col., 2016; Bonanomi y col., 2020) debido a que son
fuente de nutrimentos, principalmente N, P, K, calcio (Ca) y magnesio (Mg), y
porque mejoran las características físicas del suelo, como la textura, densidad
aparente, formación y estabilidad de agregados, y características
químicas como potencial de hidrógeno (pH), conductividad eléctrica (CE),
saturación de bases intercambiables, aporte de MO y nutrimentos del suelo y, en
consecuencia, la productividad de los cultivos (Dikr
y Belete, 2017; Cai y col., 2019).
Dentro de las cualidades que tienen los AO se considera el valor agronómico
y, por lo tanto, el aporte nutrimental, microbiológico y atributos como el grado de madurez y/o toxicidad (Pérez
y col., 2008). De manera que la caracterización de los AO es relevante porque
aporta información sobre diferentes procesos edáficos físicos, químicos y biológicos,
que se suscitan cuando estos se incorporan al suelo. Un AO rico en material recalcitrante, como lignina, puede ocasionar un mayor secuestro de carbono
(C) respecto de abonos con compuestos más lábiles, como proteínas y
materiales solubles en agua (Kumar y Goh, 1999); abonos con una relación carbono/nitrógeno (C/N) superior a 30 contribuyen a una inmovilización
de N para el cultivo (Kumar y Goh,
1999; Marzi y col., 2019); una composta poco madura
puede afectar la germinación de las semillas y el crecimiento y desarrollo de las plantas (Diacono y Montemurro, 2010; Tooba y col.,
2014); asimismo, la aplicación de compostas que involucran estiércoles de animales como ovino, bovino, porcino,
equino y gallinaza, que no alcanzaron las temperaturas adecuadas o cuyo proceso de elaboración fue corto, pueden
provocar pérdida de nutrientes, como N en forma de NH3 o NO3,
o por otra parte, la introducción de organismos patógenos como Escherichia colio Salmonella spp. (Maffei y col., 2016).
Además de las características de los AO, la cantidad y la frecuencia de
aplicación, así como, el material de origen y su proceso de obtención (Félix-Herrán y col., 2008) tienen un papel importante.
Pérez y col. (2008) examinaron diferentes AO y encontraron diversidad en
pH, CE, MO, carbono orgánico (CO) y N total, así como en la cantidad de hongos y levaduras, atribuibles a la cantidad
y utilización diferencial del material de origen. Pérez y col. (2010) reportaron
que las compostas de pollinaza tienen un alto aporte nutrimental, pero también pérdidas importantes de N por
volatilización. Bashir y col. (2016), al analizar
abonos como compostas de residuos sólidos municipales y estiércoles de aves,
para conocer el impacto sobre los agregados del suelo y la estabilidad,
detectaron una mejora en la formación de los
macroagregados del suelo, después de 2 años de aplicación. Torres y col. (2016) caracterizaron AO y estimaron grandes riesgos de salinización
cuando se emplean en zonas áridas, adjudicados a que el material para su
elaboración tenía altas concentraciones de sodio.
De acuerdo con
lo anterior, contribuir al conocimiento sobre
las características de los AO permitirá proponer su uso adecuado y
sugerir estrategias en sus procesos de obtención, para lograr la conservación y
mantenimiento de suelos sanos como los
destinados a cultivos florícolas.
Los AO del tipo composta designados a suelos florícolas son productos
orgánicos obtenidos por un proceso biológico oxidativo, donde intervienen
microrganismos para degradar los residuos orgánicos en un periodo promedio
de 90 d; en vermicomposta, además de microorganismos intervienen
en el proceso de degradación lombrices, y el tiempo de obtención es de 90
d - 210 d; y en bocashi, se utilizan materiales
diferentes que en la composta, como levadura, pulque o microorganismos del
suelo para acelerar el proceso, que
en promedio es de 40 d, y determinar los
posibles efectos de su uso.
El objetivo de
la presente investigación fue examinar abonos orgánicos destinados a suelos florícolas y determinar los posibles efectos de su
uso.
MATERIALES Y métodos
La recolección
de las muestras se llevó a cabo en 10
sistemas productivos del municipio de Villa Guerrero, en el Estado de México, los cuales
fueron elegidos por la facilidad de acceso y
disposición a colaborar. Se ubicaron en las coordenadas geográficas comprendidas entre los paralelos
18°56’17.1’’ N y 18°59’40.7’’ N y los meridianos
99°39’00.3’’ W y 099°39’46.1’’ W e intervalo altitudinal de 2 044 msnm a
2 233 msnm.
La información
recabada incluyó el tipo de AO catalogado por el productor, materia prima para
su elaboración, tiempo de obtención, cultivo, destino y dosis de aplicación. En
todos los casos se trató de material listo
para ser utilizado. La toma de muestras se realizó en cinco puntos de la
pila del AO, para obtener finalmente una
muestra compuesta de aproximadamente 1 kg, de acuerdo a la Norma
Ambiental para el Distrito Federal (NADF-020.AMBT-2011),
la cual se identificó y se guardó en bolsas tipo “ziploc”
para su análisis en el Laboratorio de Química del Tecnológico de Estudios
Superiores de Villa Guerrero, en el Estado de México, México. Se secó en sombra,
a temperatura ambiente promedio de 25 °C
durante 3 d, para posteriormente tamizar (2 mm) con base a la Norma Mexicana
(NMX-FF-109-SCFI-2008). Las determinaciones para
caracterizar los AO se realizaron por triplicado,
el pH y la CE se midieron en una relación
abono: agua (1:5 p/v) con potenciómetro (Orion Star modelo A211, Iowa, USA). Para la cuantificación de
nitratos (NO3) se utilizó
una relación 1:5 (p/v) en una
disolución de CaCl2 0.01M.
La mezcla se agitó por 30 min en una placa magnética (Thermo-Scientific
CIMAREC, Iowa, USA), enseguida se
filtró usando papel Whatman No. 1 y en la solución filtrada se determinó el contenido de nitratos con tiras Aqua-Check
(HACH®, USA).
Para el contenido
de MO se especificó primero el porcentaje de cenizas a partir de la calcinación de la muestra en una mufla (FELISA,
Jalisco, México) a 550 °C durante 2 h. El porcentaje de CO se obtuvo al dividir
el porcentaje de MO entre 1.724; ambos procedimientos se hicieron como lo
indica la Norma Mexicana NMX-FF-109-SCFI-2008.
La relación C/N se calculó al dividir
el CO entre el contenido de N orgánico
total.
Para la
cuantificación de P y K, la muestra se sometió
primero en disolución de Mehlich (agua, acetato de amonio, ácido nítrico, ácido etilen diaminotetraacético y
fluoruro de amonio). La determinación
de P consistió en tomar 1 mL del extracto y agregar 22 mL
de agua, más 1 mL de molibdato de amonio, y
luego se cuantificó mediante un espectrofotómetro
(Genesys 10s Vis Termo Scientific,
USA). En el caso del K, se usaron 0.10 mL de la disolución extractora y se agregaron 10 mL de
agua destilada, para luego medir
mediante absorción atómica (Analyst 206 Perkin Elmer, USA). El N total se precisó por el método Kjeldahl, la muestra se sometió a una digestión ácida, para conseguir N amoniacal, posteriormente este
fue liberado mediante una destilación con NaOH,
y finalmente se cuantificó por un análisis volumétrico de la Asociación de Químicos Agrícolas Oficiales
(AOAC, por sus siglas en inglés:
Association of Official Agricultural Chemists)
(AOAC, 1990).
Se realizaron pruebas de fitotoxicidad
mediante la germinación de semillas de
rábano (Rapahnus
sativus L.) y maíz (Zea mays
L.) (Haq y col., 2014). Para ello se obtuvieron
extractos con agua destilada al 5 % de cada uno de los 10 AO recolectados, con base en el método propuesto por Zucconi y Bertoldi (1987). El extracto
obtenido se filtró en papel Whatman No. 1 y se guardó
en vasos de plástico ámbar de 200 mL a temperatura
ambiente. En cajas Petri (90 mm de diámetro) se colocó papel filtro y encima 10
semillas de cada especie, enseguida se aplicaron 10 mL
de cada extracto. Por tipo de AO se tuvieron
3 réplicas para cada especie vegetal, bajo
un diseño completamente aleatorizado,
con un tratamiento control, donde no se utilizó extracto de AO,
únicamente agua destilada. Las semillas se mantuvieron a temperatura ambiente
promedio de 25 °C. El índice germinativo
(IG) se cuantificó después de 48 h al
dividir el número de semillas germinadas en cada AO, entre el número de
semillas germinadas en el control (Huerta y col., 2010).
La actividad
microbiana se estimó mediante la liberación de C en forma de C-CO2,
que se genera como resultado de la descomposición de la MO por parte de los
mismos microorganismos, para ello se
mezclaron 100 g de suelo con 2 g de 3 diferentes AO: bocashi
(B1 y B2), composta (C1, C2, C3, C4, C5, C6
y C7) y lombricomposta (LC). Las mezclas se
mantuvieron en frascos herméticos de vidrio con capacidad de 1 L, a una humedad
edáfica de 55 % de espacio poroso lleno de agua y a una temperatura de 26 °C ±
1 °C en una estufa (ELVEC modelo 954-2, México D. F., México) bajo un diseño completamente al azar. El C-CO2
retenido en una solución de NaOH se determinó
por titulación mediante una disolución de HCl 0.05 M (García
y col., 2003). Las mediciones se realizaron
diariamente durante 35 d. El suelo que se utilizó se obtuvo de un
sistema productivo de rosa (Rosa hybrida) de la misma zona, con una textura franco
arenosa, con 66 %, 28 % y 6 % de arena, limo
y arcilla, respectivamente, un pH de
6.6, MO de 2.11 %, contenido de P de 145 ppm, K de 1 200 ppm, Ca de 2
500 ppm y Mg de 1 600 ppm.
En la caracterización de los AO se obtuvo el promedio y el coeficiente
de variación para cada una de las variables
evaluadas. El IG y la respiración
microbiana se evaluaron bajo un diseño completo al azar con tres repeticiones.
Se especificó la homogeneidad de varianza entre tratamientos y la distribución
normal de las observaciones de cada
tratamiento (prueba Shapiro Wilk, P < 0.05),
posteriormente se realizó un análisis de varianza y una comparación de
medias de mínima diferencia significativa
(MDS, P < 0.05). Para cuantificar las tasas de respiración microbiana se utilizó una regresión
lineal. Los datos se examinaron
con el paquete estadístico InfoStat Versión 2016 (Di-Rienzo
y col., 2016).
RESULTADOS Y DISCUSIÓN
El tipo de AO
más abundante fue la composta (70 %), aunque algunos floricultores llegan a elaborar
bocashi (20 %) y, en menor cantidad, lombricomposta (10 %) (Tabla 1). La preparación de los AO
se realiza a partir de los residuos, según la especie florícola que se cultive
en el sistema. Estos pueden incluir residuos de rosal, helechos y crisantemos,
entre otros, mezclados con estiércol, principalmente de equino y bovino, de
acuerdo a la información de los productores de donde se tomaron las muestras.
La dosis de aplicación de los AO varió desde 10 T/ha a 100 T/ha, según el criterio
del floricultor. Estas diferencias, sumadas a las características propias de
cada AO y al tiempo de obtención, que puede ser hasta de 195 d de diferencia
entre uno y otro, hicieron que su impacto en los cultivos fuese diferente (Tabla
1).
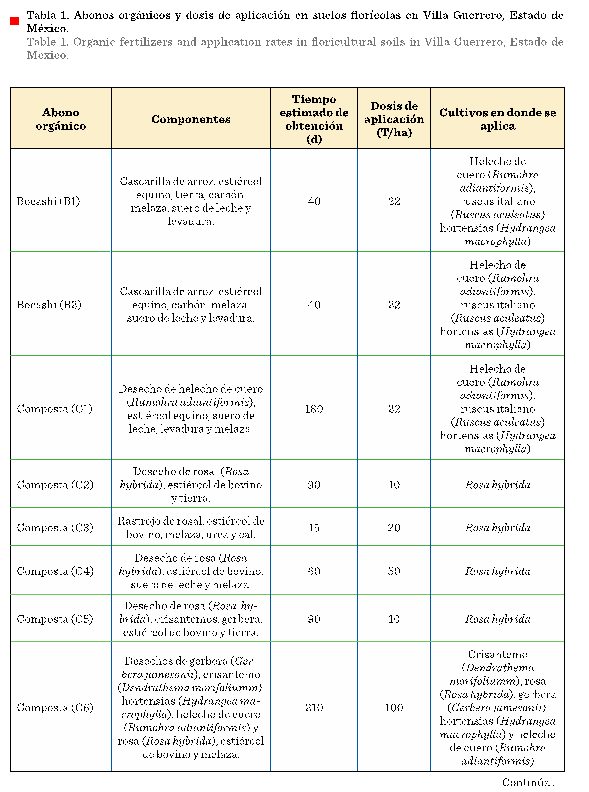

En el caso de la
C3, aunque el proceso de compostaje es corto como un bocashi,
e incompleto, los floricultores lo llegan a
utilizar así. Se denominó como
compostaje, porque no se agregaron materiales que se utilizan para el bocashi (cascarilla de arroz, levadura, pulque cenizas,
entre otros). En el caso de la C4 y C7, se consideraron
compostas porque aunque intentan acelerar el proceso fermentativo con suero
de leche y melaza o gallinaza y melaza, no incorporan productos que caracteriza
a un bocashi (cascarilla
de arroz, cenizas o carbón vegetal, entre otros).
Los pH de los AO
presentaron un valor promedio de 8.23 y un coeficiente de variación de 87 % (Tabla
2). Esta variación tan grande se atribuye a que se elaboran con diferentes materiales
de origen y, sobre todo, porque los tiempos
de obtención y almacenamiento los establece el floricultor. Los valores
de pH registrados (7 a 8.5) en los AO
indicaron que pasaron por un proceso de degradabilidad
aerobia probablemente insuficiente, ya que idealmente, el pH esperado después
de un proceso de compostaje debe ser de
neutro a ligeramente básico, por lo que es posible que los procesos para
la elaboración de AO para este estudio estén relativamente incompletos, probablemente
porque la etapa de enfriamiento final, donde se reinicia la actividad microbiana
mesofílica (Jiang y col.,
2015; Montalvo y col., 2018), no se presenta o es muy corta. La utilización de los AO caracterizados no representa
un problema a mediano plazo, ya que el pH que predomina en los suelos de la zona
de estudio, del tipo andosol, es ácido, con valores
de pH de alrededor de 6, como lo reportan Guadarrama-Nonato y col. (2018); Yáñez-Ocampo y col. (2020). En el caso de LC, el valor de pH fue 7, por lo que es ideal su utilización.
En su mayoría, los AO presentaron valores dentro de lo permitido por la Norma
Mexicana (NMX-FF-109-SCFI-2008) (5.5 a 8.5).
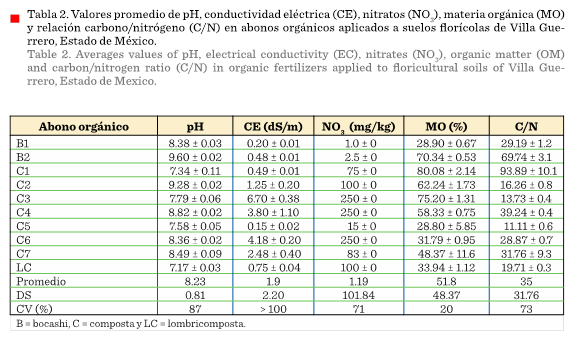
Los valores de
CE se detectaron en un intervalo de 0.15 dS/m a 7 dS/m, es decir, presentaron una variabilidad muy alta, lo
que explica la elevada desviación
estándar (DS) y coeficiente de variación (CV)
(Tabla 2), atribuibles al material de origen y al proceso de obtención
del AO. En el primer caso, la fuente de N que
emplea cada floricultor para elaborarlo es un tipo de estiércol (ovino,
equino o gallinaza) que a su vez está
influenciado por la clase de alimentación, la edad del animal y la cantidad que se utiliza (Torres y col., 2016).
En cuanto a la variabilidad vinculada a la obtención del AO, depende de la
cantidad a usar y del tiempo de compostaje,
ya que, por ejemplo, valores de CE
altos dependen del tiempo de formación y precipitación de sales, como
son iones amonio y carbonatos (Montalvo y col., 2018). De igual forma, el proceso de mineralización de la MO
implica la liberación de sales como cationes Na+,
K+, Ca2+, y Mg2+ y aniones como HCO3-,
Cl- y SO2-, los cuales pueden conformar el 98 % del total de las
sales solubles que están presentes en un AO (Huerta y col., 2010). La CE tiene
gran importancia cuando se aplican al terreno, ya que está relacionada con
cantidad excesiva de sales en el suelo y, en consecuencia, puede limitar procesos
fisiológicos, principalmente vinculados a la absorción de agua y nutrimentos,
alteración en la tasa fotosintética, la transpiración y, por ello, afectar el desarrollo y crecimiento de la
planta (Leogrande y Vitti,
2018). De igual forma, en el curso de germinación la CE impacta, porque valores
altos pueden causar daños físicos, como quemaduras en plántulas, o impedir
directamente el desarrollo de la radícula (Kebrom y
col., 2019).
Aunque
mayoritariamente los AO analizados no suponen un riesgo por efecto de una posible acumulación de sales, hubo 4 AO que registraron
valores de CE por arriba de 2.13 dS/m (Tabla 2), que
según Torres y col. (2016) constituyen un riesgo potencial de salinización
del suelo a largo plazo, sin embargo, de
acuerdo a la Norma Mexicana (NMX-FF-109-SCFI-2008), la mayoría de los AO
presentan una CE permitida (4 dS/m).
Como resultado de la heterogeneidad en la materia prima que utilizan los floricultores para la elaboración de los AO,
conjuntamente con el tiempo que dura el proceso, que incluye periodos de 15
d a 210 d (Tabla 1), los porcentajes de MO
variaron de 28 % a 80 % (Tabla 2), con un coeficiente de variación
relativamente bajo (20 %). En este sentido, el porcentaje de MO presente en
cualquiera de los AO resulta benéfica,
ya que en los suelos florícolas de la zona, su contenido se halla dentro de una
clasificación agronómica mediana (Guadarrama-Nonato
y col., 2018; Yáñez-Ocampo y col., 2020). Sin embargo, lo ideal es que
en los AO la MO sea mayor al 40 % pero menor
al 60 %, de no ser así, significa que el proceso de compostaje puede
estar incompleto, debido a que la MO no está siendo degradada, pero no
necesariamente indica que el resto de sus atributos
del AO no permitan su utilización para los cultivos. Cuando el tiempo de
elaboración es de 90 d o superior, como se
observa en cinco de los abonos caracterizados (C1, C2, C5, C6, y LC), se
considera que la MO que se obtiene es estable, porque se ha dado el tiempo
suficiente para que se mineralice (Vaca y col., 2006); contrariamente, procesos
de elaboración de poco tiempo, como sería el C3, hecho con rastrojo de rosal, generan MO lábil, con una degradabilidad incompta. La Norma
Mexicana (NMX-FF-109-SCFI-2008) fija la
cantidad ideal de aporte de MO de 20 % a 50 %, intervalo que abarcan el
60 % de los AO caracterizados en este trabajo. El exceso de MO presente en
algunos de los abonos orgánicos es indicativo de un proceso fermentativo
incompleto, ya que normalmente gran
parte del CO se pierde en forma de CO2.
Por otra parte, los AO con exceso de MO como B2 y C1 se asocian a
relaciones C/N también muy altas, lo que implica que cuando se incorporan al
suelo puede haber una inmovilización del N por parte de los microorganismos y
hasta después de cierto tiempo alcanzar el equilibrio en el sistema edáfico.
La relación C/N
en promedio fue de 35 (Tabla 2). Los AO que presentan más de 20 pueden tener un
efecto negativo, debido a la inmovilización
de N por los microorganismos como
bacterias y hongos, además, es indicativo de que son ricos todavía en
elemento vegetal difícil de degradar (Montalvo
y col., 2018), como podría ser la parte leñosa de la rosa, que queda como componente principal en el producto
final y que estaría conformado básicamente por material lignocelulósico.
A su vez, la relación C/N dependerá mucho también de la dinámica de N, como la pérdida de N-NH3, la formación
de N-NO-3 y el comportamiento de N-HH4 a lo largo
del proceso de compostaje (Montalvo y col., 2018). Con base en la Norma
Mexicana (NMX-FF-109-SCFI-2008), únicamente 4 de los AO tienen un valor de C/N
adecuado (< 20), que corresponde a las compostas C2 y C5 y la LC. Los bocashi y las compostas obtenidas en tiempos cortos (C3) e
intermedios (C4 y C7) presentaron valores altos de C/N, indicativo de que los
procesos fermentativos pueden estar incompletos. Las compostas tuvieron un alto contenido de nitratos (NO3) con
una diferencia de más de 100 unidades respecto de los bocashi,
esto se atribuye a las diferencias del
proceso. Como lo menciona Cáceres y col. (2017) en las compostas aún en estado de maduración, los
microorganismos mesófilos siguen trabajando,
ocasionando la formación de NO3,
además, factores como la humedad y oxigenación también pueden
intervenir, una humedad adecuada favorece la entrada de oxígeno y la formación
de NO3, situación que el floricultor controla conforme a su experiencia.
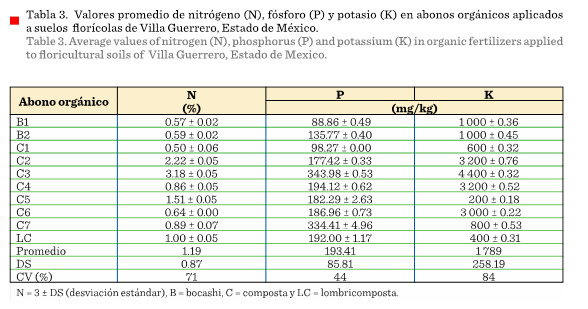
En cuanto al aporte de N, K y P (Tabla 3), el contenido de N
promedio fue similar al de otros AO, pero el P y el K es menor al reportado por
Álvarez-Sánchez y col. (2006); Angelova y col. (2013);
Ávalos y col. (2018). Conforme a la Norma Mexicana (NMX-FF-109-SCFI-2008), el N
debe estar entre 1 % y 4 %, y el promedio obtenido en este estudio se ubica en
ese intervalo, de manera que la aplicación de este tipo de AO es benéfica para
cualquier cultivo florícola.
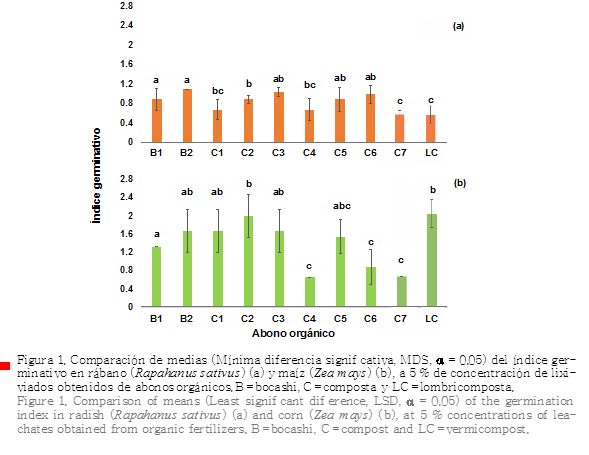
Respecto a las
pruebas de fitotoxicidad en la germinación de las
semillas de rábano, el IG indicó que hubo diferencias estadísticas significativas
(P < 0.05); únicamente el B2 y la C3 tuvieron mayor germinación de semillas que el control (Figura 1a). Estos resultados
muestran que el 80 % de los lixiviados no
tienen un efecto provechoso en la germinación de semillas de rábano. El IG en
semillas de maíz también difirió significativamente (P < 0.05), pero, en
contraste, en las semillas de rábano el IG
fue en el 70 % de los AO > 1
(Figura 1b), lo que denota que la aplicación de lixiviados favoreció la
germinación. Los resultados del IG en el
caso de maíz coinciden con lo
encontrado por Arancon y col. (2012), quienes reportan una germinación mayor
cuando se utilizan extractos de composta respecto del testigo (agua destilada),
atribuido a que en el extracto o lixiviado encuentran ácidos húmicos,
fitohormonas o metabolitos secundarios que se considera que promueven la germinación. En este estudio se observó que
las semillas de maíz fueron estimuladas en su germinación (Figura 1b),
lo cual también se logró en semillas de Vignia
ungiculata (Arunbabu
y col., 2017) y de trigo (Ameen, 2020).
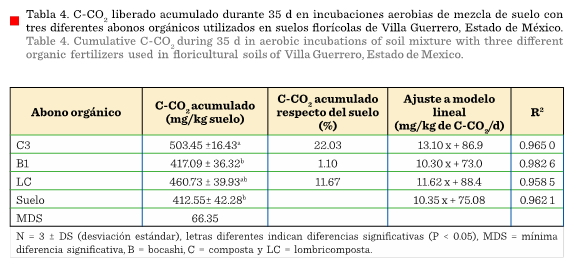
La actividad
microbiana, evaluada a partir de la
liberación de C-CO2, indicó una mayor cantidad acumulada al mezclar
suelo con C3, y fue diferente significativamente respecto de B1, LC y
del suelo control (P < 0.05) (Tabla 4). Este tipo de composta tiene una relación C/N baja (13.73), lo que favorece que la MO sea accesible para los
microorganismos. Por otra parte, B1 fue el AO que liberó más lentamente el C orgánico (10.30 mg/kg en 1 d). Es
posible que la relación C/N alta (29.19) haya contribuido a una baja actividad
microbiana. En este sentido, los resultados
de este estudio contrastan con el de Agüero y Terry (2014), quienes indicaron
que bocashi tiene una aportación importante de carga
microbiana cuando se incorpora al suelo, por lo que se esperaría una mayor liberación
de C-CO2. El C-CO2 liberado al aplicar C3 es indicativo
de que hubo actividad microbiana. Esta
composta elevó en un 22 % la liberación de C-CO2 respecto al suelo
control, lo que resultaría benéfico, porque implica la liberación de nutrimentos que, en condiciones de
campo, el cultivo puede aprovechar. El análisis de regresión lineal indica que
las tasas de liberación de C-CO2 fueron más altas cuando se aplicó
C3 y LC (11.6 mg/kg a 13.10 mg/kg de C-CO2/d),
mientras que la tasa de mineralización
al aplicar B1 es menor y similar al suelo
al que no se aplicó AO (Tabla 4). Cabe mencionar que la biomasa
microbiana actúa sobre la MO del suelo
(Sarmiento y col., 2019) y sobre la que se incorpora en el propio abono, en donde
normalmente predominan actinomicetos
que degradan MO lábil (Yáñez-Ocampo y col., 2020). El hecho de que la C3 mostró una mayor respiración microbiana es
indicativo de que hay una mayor
cantidad de sustrato para ser utilizado por los microorganismos, asociado a la presencia de un material lábil (Carabassa y col.,
2020), e indirectamente también indica poca cantidad de sustrato que los
microorganismos pueden utilizar (Fernández y
col., 2010); ambas características
son importantes de considerar
al momento de aplicarlos en los cultivos. De manera que la incorporación de MO al suelo promoverá la actividad microbiana, pero
depende mucho de su calidad. Cada AO generará una respuesta diferente,
atribuida al grado de madurez, relación C/N, MO lábil, aporte de nutrientes, entre otras características.
CONCLUSIONES
Los resultados
indicaron que los abonos orgánicos preparados por los floricultores y estudiados
en la presente investigación, son preferentemente de tipo composta. Sus
características físicas, químicas y
biológicas muestran una gran variabilidad, atribuida principalmente a la
heterogeneidad del material de origen y al
tiempo de elaboración. Es importante señalar que en algunos casos hay necesidad de completar el proceso
fermentativo para asegurar relaciones
carbono/nitrógeno adecuados. La conductividad eléctrica, potencial de
hidrógeno y contenido de nitrógeno fueron las características que mayor diversidad mostraron. Los abonos orgánicos evaluados no presentan un riesgo al aplicarlos a los suelos florícolas,
por el contrario, aportan mínimamente
10 % de materia orgánica, lo que significa una ventaja para impulsar la actividad microbiana y mantener las propiedades
del suelo en este tipo de sistemas productivos.
Referencias
Agüero, D. y
Terry. E. (2014). Revisión bibliográfica. Generalidades de los abonos orgánicos:
importancia del bocashi como alternativa nutricional
para suelos y plantas. Cultivos Tropicales. 35(4): 52-59.
Álvarez-Sánchez, E., Vázquez-Alarcón,
A., Castellanos, J. Z. y Cueto-Wong, J. (2006). Efectividad biológica de abonos
orgánicos en el crecimiento de trigo. Terra Latinoamericana. 24(2): 261-268.
Ameen, A. (2020). Comparison of crop production efficiency of compost
leachate with chemical fertilizer and evaluating its effect on germination and growth of wheat
crop. African Journal of Biotechnology. 19(5): 282-286.
Angelova, V. R., Akova, V. I., Artinova, N. S., and Ivanov, K. I.
(2013). The effect of organic amendments on soil chemical characteristics. Bulgarian
Journal of Agricultural Science. 19(5): 958-971.
AOAC, Association of Official Agricultural Chemists (1990). Official Methods of
Analysis. Association of Official Analytical Chemists 923.03. Washington: AOAC.
115 Pp.
Arancon, N. Q., Pant, A., Radovich, T., Hue, N. V., Potter, J. K., and
Converse, C. E. (2012). Seed germination and seedling growth of tomato and
lettuce as affected by vermicompost water extracts (Teas). HortScience.
47: 1722-1728.
Arunbabu, V., Indu, S.
K., and Ramasamy, E. V. (2017). Arun Leachate
pollution index as an effective tool in determining the phytotoxicity of
municipal solid waste leachate. Waste Management. 68: 329-336.
Ávalos, M.,
Figueroa, U., García, J. L., Vázquez, C., Gallegos, M. A. y Orona, I.
(2018). Bioinoculantes y abonos orgánicos en la producción
de maíz forrajero. Nova Scientia. 20(10): 170-189.
Bashir, K., Alil, S., Sohail, S., and Ahmad, I. (2016). Effect of organic
amendments on distribution, stability and carbon concentration of soil
aggregates. Pakistan Journal of Agricultural Science. 53(4): 955-961.
Bonanomi, G., De-Filippis, F., Zotti M., Idbellaa, M., Cesaranoa, G., Al-Rowailyc, S., and ElGawadc, A. (2020).
Repeated applications of organic
amendments promote beneficial microbiota,
improve soil fertility and increase crop yield. Applied Soil Ecology. 156: 103714.
Cabrera, R.
I., Solís-Pérez, A. R. y Gómez, G. (2017). Aplicaciones de nutrición vegetal en
cultivos de flor de corte. En R. V. Flórez (Ed.), Consideraciones sobre
producción, manejo y poscosecha de flores de corte
con énfasis en rosa y clavel (pp. 33-47). Bogotá: Editorial Universidad
Nacional de Colombia.
Cáceres, R., Malynska, K., and Marfá, O. (2017). Nitrification within composting:
A review. Waste Management. 72: 119-137.
Cai, A., Xua, M., Wang, B., Zhang, W., Liang, G., Hou, E., and Luo, Y.
(2019). Manure acts as a better fertilizer for increasing crop yields than
synthetic fertilizer does by improving soil fertility. Soil & Tillage
Research. 189: 168-175.
Carabassa, V., Domene, X., and Alcañiz, J. P. (2020). Soil restoration
using compost-like-outputs and digestates from non-source-separated urban waste
as organic amendments: Limitations and
opportunities. Journal of Environmental Management. 255:
109909.
Diacono, M. and Montemurro, F. (2010). Long-term effects of organic
amendments on soil fertility. A review. Agronomy for Sustainable Development.
30: 401-422.
Dikr, W. and Belete, K. (2017). Review on the effect of organic
fertilizers, biofertilizers and inorganic fertilizers (NPK) on growth and
flower yield of marigold (Targetes erecta L.). Academic Research
Journal of Agricultural Science and Research. 5(3): 192-204.
Di-Rienzo, J. A., Casanoves,
F., Balzarini, M. G., González, L., Tablada, M., and Robledo, C. W. (2016). InfoStat (versión 2016). [Software de cómputo]. Córdoba,
Argentina: Grupo InfoStat, FCA, Universidad Nacional
de Córdoba.
Félix-Herrán,
J. A., Sañudo-Torres, R., Rojo-Martínez, G., Martínez-Ruiz, R. y Olalde-Portugal, V. (2008). Importancia de los abonos
orgánicos. Ra Ximhai.
4(1): 57-67.
Fernández, R., Quiroga, A., Zorati, C., and Noellemeyer, E.
(2010). Carbon contents
and respiration rates of aggregate size fractions under no-till and
conventional tillage. Soil & Tillage
Research. 109(2): 103-109.
García, C.,
Gil, F., Hernández, T. y Trasar, C. (2003). Técnicas
de análisis de parámetros bioquímicos en suelos: medida de las actividades
enzimáticas y biomasa microbiana. España: Mundi-Prensa.
371 Pp.
Guadarrama-Nonato, A.,
Mejía-Carranza, J. y Ramírez-Gerardo, M. G.
(2018). Mineralización de la materia orgánica en suelos con manejo diferencial
en cultivo de rosa. Acta Universitaria.
28(32): 33-41.
Haq, T., Ali, T., and Begun, R. (2014). Seed
germination bioassay using maize seeds for phytoxicity
evaluation of different composted
materials. Pakistan Journal of Botany. 46(2): 539-542.
Huerta, O., López, M., and Soliva, M. (2010). Procés de compostatge caracterizació de mostres. Barcelona: Ed. Diputació de
Barcelona. 432 Pp.
Jiang, J., Liu,
X., Huang, Y., and Huang, H. (2015). Inoculation with nitrogen turnover bacterial agent appropriately increasing
nitrogen and promoting maturity in pig manure composting. Waste Management.
39: 78-85.
Kebrom, T., Woldesenbet, S., Bayabil, H., Garcia, M., Gao, M., Ampim,
P., …, and Fares, A. (2019). Evaluation of phytotoxicity of three organic
amendments to collard greens using the seed
germination bioassay. Environmental Science and Pollution Research. 26(6): 5454-5462.
Kumar, K. and Goh, K. M. (1999). Crop residues and management practices:
Effects on soil quality, soil nitrogen dynamics, crop yield, and nitrogen
recovery. Advances in Agronomy. 68: 197-318.
Leogrande, R. and Vitti, C. (2018). Use of organic amendments to reclaim
saline and sodic soils: a review. Arid land and Research and Management.
33(1): 1-21.
Maffei, F., Batalhaa, E., Landgrafa, M., Schaffnerb, D. W., and Franco,
B. (2016). Microbiology of organic and conventionally grown fresh produce. Brazilian
Journal of Microbiology. 47(1):
99-105.
Marzi, M., Ahbazi, K., Kharazi, N., and Rezaei, M. (2019). The influence
of organic amendment source on carbon and nitrogen mineralization in different soils. Journal
of Soil Science and
Plant Nutrition. 20: 177-19.
Montalvo, P. A. J., Dongo, L. F. O., Maraví, J. L. C., Monzón, L. A.
T., Coral, M. F. C. y Figueroa, L. V. (2018). Transformación del nitrógeno durante el compostaje de bosta de caballo. Revista
Producción + Limpia. 13(22): 77-88.
NADF-020.AMBT-2011
(2011). Norma ambiental para el Distrito Federal. Secretaría de Medio Ambiente
del Distrito Federal. [En línea]. Disponible en: http://data.sedema.cdmx.gob.mx/padla/images/stories/normatividaddf/nadf_020_ambt_2011.pdf.
Fecha de consulta: 20 de mayo de 2020.
NMX-FF-109-SCFI-2008
(2008). Norma mexicana humus de lombriz (lombricomposta)
especificaciones y métodos de prueba. [En
línea]. Disponible en: https://www.dof.gob.mx/nota_detalle.php?codigo=5044562&fecha=10/06/2008. Fecha de
consulta: 6 de marzo de 2020.
Pérez, A.,
Céspedes, C. y Núñez, P. (2008). Caracterización física-química y biológica de
enmiendas orgánicas aplicadas en la producción de cultivos en República
Dominicana. R. C. Suelo. Nutrición Vegetal. 8(4): 10-29.
Pérez, C. R.,
Pérez C. A. y Vertel, M. M. (2010). Caracterización nutricional, fisicoquímica y microbiológica de tres abonos orgánicos para uso en agroecosistemas
de pasturas en la subregión Sabanas del departamento de Sucre, Colombia. Revista Tumbaga. 1(5): 27-37.
Sakin, E., Celik, A.,
Dogan, Z., Yalcin, H., and Seyreck, A. (2018).
Comparing carbon pools and some soil quality parameters of soils in organic and
conventional agriculture land. Fresenius Environmental Bulletin. 27(11): 7536-7544.
Sarmiento, G.
J., Amézquita, M. A. y Mena, L. M. (2019). Uso de bocashi y microorganismos eficaces como alternativa ecológica
en el cultivo de fresa en zonas áridas. Scientia Agropecuaria. 10(1): 55-61.
Scotti, R., Bonanomi, G., Scelza, R., Zoina, A., and Rao, M. (2015).
Organic amendments as sustainable tool to recovery fertility in intensive
agricultural systems. Journal of Soil Science and Plant Nutrition.
15(2): 333-352.
Tooba, H., Tasneem, A., and Razia, B. (2014). Seed germination bioassay
using maize seeds for Phytoxicity evaluation of
different composted materials. Pakistan Journal of Botany. 46: 539-542.
Torres, D., Mendoza, B., Marco, L. M. y
Gómez, C. (2016). Riesgos de salinización y solidificación por el uso de abonos
orgánicos en la depresión de Quíbor-Venezuela. Multiciencias. 16(2): 133-142.
Vaca, R., Lugo, J. y Esteller,
A. (2006). Caracterización de la materia orgánica soluble y de los ácidos
húmicos en suelo acondicionado con lodo residual fresco o compostado.
Revista Internacional de Contaminación Ambiental. 22(1): 27-30.
Vilkienė,
M., Ambrazaitienė, D., Karčauskienė,
D., and Dabkevičius, Z. (2016). Assessment of soil organic matter mineralization under various
management practices. Acta Agriculturae
Scandinavica, Section B — Soil & Plant Science. 66(8):
641-646.
Yáñez-Ocampo,
G., Sánchez-González, M. E., De-la-Portilla-López, N.,
Marmolejo-Santillán, Y., Del-Águila-Juárez, P.,
Lugo-de-la-Fuente, J. y Vaca-Paulín, R. (2020).
Densidad poblacional de actinomicetos en suelos florícolas, enmendados con vermicomposta. Terra Latinoamericana. 38: 745-753.
Zucconi, F. and Bertoldi, M. (1987). Compost specification
for the production and characterization of compost from municipal solid waste.
In M. de-Bertoldi, M. P. Ferranti, and F. Zucconi (Eds.), Compost:
production, quality and use (pp. 30-50). Barking: Elsevier Applied Science
Publishers.