Riqueza
de especies de hongos micorrízicos asociados a
plantas de la familia Euphorbiaceae en el Área
Natural Protegida Altas Cumbres, Tamaulipas, México
Species richness of mycorrhizal fungi associated with
plants from the Euphorbiaceae family in the Altas Cumbres Protected Area,
Tamaulipas, Mexico
Riqueza de hongos micorrízicos en Tamaulipas
Víctor Abraham Vargas-Vázquez1,
Ninfa Isabel Sanchez-Rangel1, 2, Laura
Verónica Hernández-Cuevas3, Gonzalo Guevara-Guerrero4*
*Correspondencia:
guevaragg@hotmail.com/ Fecha de recepción: 20 de enero de 2021/Fecha de
aceptación: 23 de abril de 2021/Fecha de publicación: 27 de julio de 2021.
1
Ecological Research Azcatl, Tampico, Tamaulipas, México. 2Centro
Bachillerato Tecnológico Industrial y de Servicio 024, Ciudad Victoria,
Tamaulipas, México. 3Universidad Autónoma de Tlaxcala, Centro de
Investigación en Genética y Ambiente, Laboratorio de Biología Molecular,
Tlaxcala, Tlaxcala, México. 4Tecnológico Nacional de México,
Instituto Tecnológico de Ciudad Victoria, División de Estudios de Posgrado e
Investigación, boulevard Emilio Portes Gil núm. 1301, col. Enrique Cárdenas
González, Ciudad Victoria, Tamaulipas, México, C. P. 87010.
Resumen
Los hongos micorrízicos arbusculares (HMA) son
importantes para el desarrollo y supervivencia de las plantas.
Esto ha motivado el análisis del uso de algunas especies de HMA de uso
comercial como biofertilizantes de cultivos a nivel nacional.
En Tamaulipas, el conocimiento acerca de la diversidad de HMA es escaso.
El objetivo del presente trabajo fue determinar la presencia e identidad
taxonómica de hongos micorrízicos arbusculares asociados a la familia Euphorbiaceae (sensu
lato) en el Área Natural Protegida Altas Cumbres. Las esporas fueron obtenidas
a través de propágulos extraídos de plantas trampa de diferentes especies, cultivadas en suelo y raíces de la zona de estudio. El estatus
micorrízico se determinó mediante la técnica de
tinción de Phillips y Hayman y la identificación de
HMA, a través de la extracción de esporas por
el método de tamizado húmedo con centrifugación con sacarosa, y su
caracterización morfológica. Todas las raíces mostraron estructuras típicas de los HMA, evidenciando la
presencia de esta asociación en los 74 taxones de euforbiáceas. Se registró una riqueza de 9 especies de HMA ubicadas dentro de 6 géneros, 4
familias y 3 órdenes, siendo Glomus (Familia Glomeraceae) el género
con mayor riqueza específica. Se detectó la presencia de los géneros Entrophospora, Funneliformis y Rhizophagus por primera vez en Tamaulipas. Los resultados denotan lo ampliamente
distribuidos que se encuentran los HMA en las plantas de la familia Euphorbiaceae en el Área Natural
Protegida Altas Cumbres y la necesidad
e importancia de continuar con investigaciones sobre las micorrizas arbusculares.
Palabras clave:
endomicorrizas, riqueza de especies, Glomeromycota, Euphorbiaceae.
Abstract
The arbuscular
mycorrhizal fungi (AMF) are important
for the development and survival of plants.
This has motivated the analysis of the use of some AMF species with commercial use as crop biofertilizers at
the national level. In Tamaulipas, knowledge of AMF diversity is scarce. The
objective of this work was to determine the presence and taxonomic identity of
AMF associated with the Euphorbiaceae
family (sensu lato) in the Altas Cumbres Protected Area. The spores were obtained through propagules extracted from trap
plants of different species grown in the soil
and roots of the area under study. The mycorrhizal status was determined
by the Phillips and Hayman staining technique and the identification of AMF
through the extraction of spores by the wet
sieving method with sucrose centrifugation and their morphological characterization. All the roots showed typical
AMF structures, evidencing the presence of this association in the 74 euphorbiaceae taxa. A
rich-ness of 9 AMF species located within 6 genera, 4 families and 3 orders were recorded, with Glomus (Glomeraceae famiy) being the
genus with the highest specific richness. The presence of the genera Entrophospora, Funneliformis
and Rhizophagus was detected for the first
time in Tamaulipas. The results denote how widely distributed AMF are found in
plants of the Euphorbiaceae family in the Altas Cumbres Protected Area,
highlighting the need to continue with investigations on arbuscular
mycorrhizae.
Keywords: endomycorrhizal, species richness, Glomeromycota,
Euphorbiaceae.
INTRODUCCIÓN
Los
hongos micorrízicos arbusculares
(HMA) son uno de los grupos de microorganismos
más importantes para el desarrollo y sobrevivencia de las plantas (Ferlian y col., 2018). Esta asociación es la principal vía
de obtención de nutrientes del suelo, como nitrógeno, potasio, calcio, zinc,
magnesio, fósforo y agua. Asimismo, actúan como una barrera física que impide la pérdida de agua y el ingreso de patógenos
(Noda, 2009). Las micorrizas se clasifican en 7
diferentes tipos, sin embargo, las endomicorrizas o
micorrizas arbusculares son las más frecuentes y
abundantes en algunos ecosistemas (Kumar y col.,
2015; Barman y col., 2016; Brundrett y Tedersoo, 2018). Los HMA se caracterizan por el desarrollo
de estructuras fúngicas al interior de las células del córtex de la raíz denominadas arbúsculos,
especializadas en el intercambio de
nutrientes y en la formación
de estructuras de almacenamiento conocidas
como vesículas en algunas especies de HMA (Oehl
y col., 2011). Los HMA pertenecen exclusivamente al phylum
Glomeromycota (Schüler y
col., 2001; Oehl y col., 2011), el cual se caracteriza por su micelio cenocítico (carente
de septos), ausencia de reproducción sexual
(Schüler y col., 2001) y distribución cosmopolita
(Sturmer y col., 2018), además de ser simbiontes obligados
de organismos fotosintéticos (Schüler y col., 2001).
La mayoría de las especies de plantas,
exceptuando las acuáticas estrictas y algunas familias de plantas terrestres
(Chimal-Sánchez y col., 2016), han sido documentadas como formadoras de HMA.
Debido a su importancia ecológica (Ferlian y col., 2018) y sus múltiples aplicaciones en el sector agropecuario (Rodriguez
y Sanders, 2014; Oliveira y col., 2016) desde hace varias décadas los HMA han generado gran interés en la investigación
científica.
El
phylum Glomeromycota se ha
mantenido con pocas variaciones evolutivas desde su origen en el periodo
Ordovícico debido a la eficiencia en sus
adaptaciones (Davison y col., 2015). Por ello,
posiblemente la diversidad de especies a nivel mundial es menor que la de otros
grupos de hongos (Davison y col., 2015), limitándose
aproximadamente a poco más de 300 especies (Crossay y col., 2017; Álvarez-Lopeztello
y col., 2018) repartidas en 29 géneros, 14 familias, 5 órdenes y 3 clases (Oehl y col., 2011). En México
se han registrado 105 especies de HMA, principalmente en zonas áridas,
semiáridas y tropicales (Chimal-Sánchez y
col., 2016; Álvarez-Lopeztello y col., 2018; 2019), sin embargo, la representatividad
geográfica de ecosistemas y de grupos
de plantas aún es escasa, considerando la gran diversidad biológica del país (Chimal-Sánchez
y col., 2016; Álvarez-Lopeztello y col., 2019). Por
ello, los trabajos relacionados con la diversidad de HMA son indispensables en
México, principalmente en los grupos de
plantas más diversos y dominantes en los ecosistemas, como es el caso de la familia Euphorbiaceae,
la cual se aprecia como la sexta más diversa de Angiospermas a nivel mundial,
después de Orchidaceae, Asteraceae,
Fabaceae, Poaceae y Rubiaceae (Stein-mann, 2002;
Villaseñor, 2016). Su riqueza específica va
desde las 6 600 especies en sensu stricto (ThePlantList,
2020), hasta las 8 700 en sensu
lato (Webster, 1994; Steinmann
y Ramírez-Amezcua, 2016).
En la actualidad, Euphorbiaceae sensu
lato (Webster,
1994) es considerada como 5 familias distintas (Euphorbiaceae
sensu stricto, Phyllanthaceae, Pandaceae, Picrodendraceae
y Putranjivaceae) englobadas dentro del orden Malpighiales (Steinmann y
Ramírez-Amezcua, 2016). Este grupo de plantas, bajo ambos criterios de
clasificación, posee una gran variedad de formas de vida y una distribución
cosmopolita tanto geográfica como a nivel de ecosistemas, siendo con frecuencia
al menos una especie de dicha familia co-dominante dentro de las comunidades (Steinmann,
2002). Además, Euphorbiaceae
es sumamente importante a nivel económico, ya que muchas especies se cultivan para su uso medicinal, industrial, alimenticio y
ornamental (Steinmann, 2002). Por todo ello, a nivel
mundial la familia Euphorbiaceae ha sido utilizada como modelo biológico en el estudio
de las micorrizas tanto con fines ecológicos
como económicos (Ramanankierana y col., 2007; Callejas-Ruiz y col., 2009; Díaz-Hernández
y col., 2013). Partiendo de que esta familia representa uno de los principales
componentes de los ecosistemas por su diversidad y abundancia, así como la
derrama económica que genera en algunas regiones (Steinmann, 2002), precisar las asociaciones que
determinan su resiliencia, como las micorrizas, es indispensable para su
conservación (Liu y col., 2010). Sin embargo, las
asociaciones micorrízicas de dicha familia en el estado de Tamaulipas se desconocen
por completo, ya que las especies regionales no han sido objeto de estudio.
El
conocimiento de las micorrizas en Tamaulipas
se limitó por mucho tiempo a la diversidad e inoculación de macromicetos ectomicorrízicos
(García-Jiménez y col., 2014), muchos de
ellos de hábitos hipogeos (Guevara y col., 2013). Actualmente las
observaciones sobre las micorrizas han girado su atención a la aplicación de
los HMA comerciales para favorecer el crecimiento, fructificación y resistencia
a las sequías en los principales
cultivos del estado, como la col (Díaz-Franco
y col., 2017), el sorgo (Díaz-Franco y col.,
2016a; Díaz-Franco y col., 2016b; Díaz-Franco y col., 2019), el maíz, la soya y el algodón (Díaz-Franco y col., 2019),
aunque han ignorado la diversidad de especies
de HMA nativos. Por otra parte, existen pequeñas contribuciones sobre
diferentes HMA asociados al maguey tequilero (Almaguer-Sierra y col., 2004) y algunas especies de cactáceas
del altiplano tamaulipeco
(Guevara-Guerrero y col., 2011). Así mismo, se han desarrollado algunas tesis respecto al tema, si bien aún no han
sido publicadas (Guevara-Guerrero y col.,
2011; 2014). La gama
de especies de HMA de Tamaulipas se desconoce en un gran porcentaje, incluyendo a los sitios prioritarios de
conservación como lo es el Área Natural
Protegida Altas Cumbres (ANPAC), localizada en la zona centro de
Tamaulipas en una sección de la Sierra Madre
Oriental, caracterizada por una alta diversidad de plantas vasculares (1 164 especies), ecosistemas y ambientes
(García-Morales y col., 2014). Esas
características hacen del ANPAC un sitio óptimo para la exploración de los HMA, siendo el presente análisis el primero al
grupo Glomeromycota en la región de la Sierra Madre
Oriental tamaulipeca.
El
objetivo de este trabajo fue identificar en el Área Natural Protegida Altas
Cumbres el estatus micorrízico, el tipo de micorriza
y las especies de hongos micorrízicos arbusculares asociados a las raíces y al área rizosférica de plantas de la familia Euphorbiaceae
(sensu lato).
MATERIALES
Y MÉTODOS
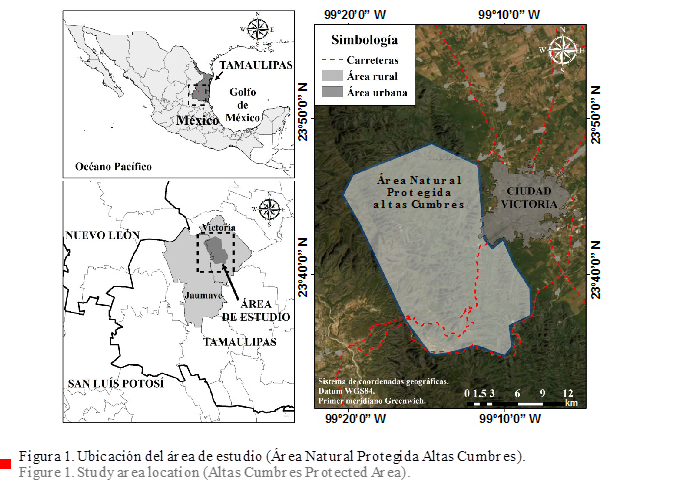
Área
de estudio
El
ANPAC, decretada como tal el 19 de noviembre
de 1997, con una superficie total de 31 251.23 ha, se localiza en los
municipios de Jaumave y Victoria (Figura 1) dentro de la región
de la Sierra Madre Oriental de la zona centro del estado de Tamaulipas, noreste
de México, de acuerdo con la Comisión Nacional para el Conocimiento y Uso de la
Biodiversidad (CONABIO, 2020). Su topografía es diversa debido a la presencia
de la Sierra Madre Oriental, y va desde zonas de lomas y lomeríos hasta altas montañas y profundos cañones, con un
rango de elevación de 350 msnm a 2 200 msnm, de acuerdo con el Instituto Nacional de Estadística y Geografía (INEGI, 2013).
De igual manera, sus suelos son variados, siendo los principales: litosoles, vertisoles pélicos salinos, regosoles éutricos, así como rendzinas petrocálcica y pedregosa (Batjes
y col., 2020). Los climas son semicálido templado subhúmedo ((A)C(w1)
y (A)C(w0)), cálido subhúmedo (Aw1) y semiárido templado (BS1hw) (Cuervo-Robayo y col., 2019). Los tipos de vegetación donde se realizaron los muestreos abarcan matorral
submontano, matorral desértico micrófilo,
matorral espinoso tamaulipeco, selva baja caducifolia, bosque de encino, bosque
de pino-encino, bosque de encino-pino,
vegetación secundaria, bosque de
pino, bosque ripario y áreas de cultivo
(García-Morales y col., 2014).
Muestreo
Se
realizó previamente un inventario florístico de las especies de plantas
pertenecientes a la familia Euphorbiaceae
considerando un muestreo aleatorio estratificado. Para ello, primeramente se generaron
sobre un mapa temático puntos al azar dentro del área de estudio, seleccionando
los cuatro con mayor acceso para cada
combinación de variables, con base en los estratos elevacionales (cada 200 msnm, desde
los 350 msnm hasta los 2 200 msnm) y los 11
tipos de vegetación (INEGI, 2013; García-Morales y col., 2014). Este
proceso fue realizado con el software de sistema de información geográfica
(ArcGIS, por sus siglas en inglés: arc geographic information system) versión 10.6
(ESRI®, 2018). Las visitas se efectuaron en el periodo comprendido de
septiembre de 2012 a octubre de 2013, con un total de 24 salidas y 200 puntos
de colecta, donde los individuos de las especies de euforbiáceas fueron
ubicados en un radio de 5 m, obteniendo una
muestra de material botánico, raíces y suelo del área rizosférica de un ejemplar de cada especie. Se hizo presencia en los sitios una vez en
cada estación del año, durante el periodo de evaluación,
con la finalidad considerar el efecto de la estacionalidad en la composición
florística y con ello asegurar la representatividad de todas las especies
locales de euforbiáceas. Para cada especie
encontrada se seleccionó un único individuo, del cual solo se tomó una única
muestra por parcela circular, independientemente de que se hayan encontrado la misma
especie en otras parcelas. Esto último
considerando tener repeticiones, ya que no es completamente probable
encontrar micorrizas en todas las raíces, por ello, deben revisarse la
mayor cantidad de raíces posibles para poder
aceptar o descartar la presencia de micorrizas en una especie. En la
mayoría de estas parcelas solo se encontró una especie (y por eso solo se tomó una porción de un ejemplar),
aunque en algunas parcelas llegaron a encontrarse hasta un máximo de 5 especies
(y por ende se tomaron 5 porciones). Por la naturaleza de estas especies, el
número de individuos analizados para cada especie fue muy contrastante entre
ellas. Un ejemplo de especies encontradas en
diversas parcelas estudiadas fueron Croton
ciliatoglandulifer (la más abundante, frecuente y ampliamente distribuida)
con 31 muestras, Croton
cortesianus con 24, Euphorbia hirta con 15, Euphorbia
graminea con 13, Phyllanthus
carolinensis y Cnidoscolus
multilobus con 10 cada una y Euphorbia
dentata con 7 muestras. Estas 7 especies
representaron 110 muestras, es decir el 27.5 % del total. En contraste, Euphorbia subpeltata
y Euphorbia macropus
fueron algunas de las especies de las cuales en todo el estudio (incluso hasta
la fecha) solo se lograron encontrar un solo ejemplar.
El
suelo utilizado en los análisis fue extraído del cepellón formado por las
raíces con apoyo de una cuchara para jardín
GTS-SH (Truper®, México, D.F.), cuidando de
tomar solo el perteneciente a la rizósfera,
considerando un radio de 15 cm a partir del centro de la raíz y una profundidad
también de 15 cm. Las raíces se tomaron directamente de la planta con tijeras y una pala, evitando que se mezclaran con
raíces de otras plantas. Ambas muestras se
depositaron en bolsas de papel
estraza. El material botánico fue
procesado y conservado a través del método clásico de prensado y herborizado (Lot y Chiang, 1986), para
su posterior identificación y corroboración taxonómica. Enseguida fue
depositado en el herbario del Instituto de Ecología Aplicada de la Universidad
Autónoma de Tamaulipas (UAT).
Estatus
micorrízico
La determinación del estatus micorrízico
se efectuó mediante la búsqueda de estructuras fúngicas (micelio cenocítico,
vesículas y arbúsculos) en el córtex de las raíces,
teñidas por el método de Phillips y Hayman (1970).
Para ello se utilizaron las raíces finas (de aproximadamente 2 mm de diámetro),
revisando un total de 400 muestras, las cuales se limpiaron con agua corriente, se colocaron en cápsulas de tinción
de tejidos, se aclararon (10 % de KOH y 5 % de H2O2, en
baño María por 1 h) y se acidificaron con 1 %
de HCl por 30 min. Posteriormente se tiñeron con azul tripano (0.05 %) (Brundrett y col., 1996). Con esta técnica, las células de la raíz se aclaran, coloreando de azul intenso las células de los HMA (Castillo-Agüero y col., 2003). Las raíces
teñidas fueron montadas en laminillas, en fragmentos
de 2 cm de longitud, y analizadas a través
de un microscopio modelo Stemi 2000-C (Carl Zeiss®, Gottingen, Alemania) y una cámara
modelo PowerShot G5 (Canon®, Tokio, Japón). Este proceso se
realizó en cada una de las muestras en el laboratorio inmediatamente
después de cada visita a campo para evitar daños al material biológico.
Propagación,
aislamiento e identificación de esporas
Las
muestras de suelo y las de raíces restantes del proceso de tinción se
mantuvieron en refrigeración a 4 °C, para
preservarlas durante el muestreo en campo. Al culminar la fase de campo, tanto el suelo como las raíces secundarias
mencionadas fueron utilizadas para propagar las esporas a través de cultivos
con plantas trampa mixtas. Las propagaciones se hicieron
en recipientes de unicel de 1 L, utilizando como sustrato un compuesto de
arena, grava delgada, tierra para maceta comercial y tezontle pulverizado en proporción
1: 1: 1: 1, el cual fue esterilizado
previamente a la inoculación para
evitar la contaminación por microorganismos antagonistas. Se le
agregaron, para cada especie de euforbiácea, 50 g de la muestra de suelo y
algunas raíces secundarias. Las especies
trampa fueron sorgo (Sorghum vulgare), guajillo (Leucaena
pulverulenta), hierba de la golondrina (E.
hirta), lecheroncilla (E.
graminea), catalina (E. heterophylla)
y polocote (Helianthus
annuus), seleccionadas por ser micotróficas. Los cultivos se mantuvieron en el invernadero
del Tecnológico Nacional de México, campus Ciudad Victoria, con un riego de aproximadamente
350 mL cada 72 h durante 10 meses
Después de 10 meses de desarrollo de las plantas trampa,
las muestras fueron procesadas mediante decantación (tamices de 1 mm, 100m
y 44
m de apertura) y centrifugado en una solución de sacarosa al 44 % y un lavado con apoyo de una membrana
filtro de 22 m. Las esporas fueron aisladas del material procesado de manera manual
utilizando una pipeta Pasteur modificada y un microscopio estereoscópico modelo
SMZ-2b (Nikon®, Tokio, Japón), y posteriormente
montadas en un portaobjetos con 0.1 mL de reactivo de PVLG-Melzer
(1:1) (Castillo-Agüero y col., 2003; Hernández-Cuevas y col., 2003;
Martínez y col., 2009; Álvarez-Lopeztello y col., 2019).
La identidad taxonómica de las especies se realizó con base en bibliografía taxonómica especializada en Glomeromycota (Schenck y Pérez,
1990; Hernández-Cuevas y col., 2003), por comparación
y contrastación de las características
morfológicas de las esporas, observadas con un microscopio óptico con contraste de interferencia de Nomarski modelo Optiphot-2 (Nikon®,
Tokio, Japón). Las esporas identificadas fueron fotografiadas con una cámara Toupcam modelo UCMOS02000KPB y el software ToupView x86 (ToupTek®, Hangzhou, China) adaptada a un microscopio óptico modelo IRO-NC-58
(Iroscope®, Ciudad
de México, México). Las preparaciones
permanentes se depositaron en la
colección del Herbario Micológico “José
Castillo Tovar” del Tecnológico Nacional de México, campus Ciudad Victoria.
RESULTADOS
Y DISCUSIÓN
Los
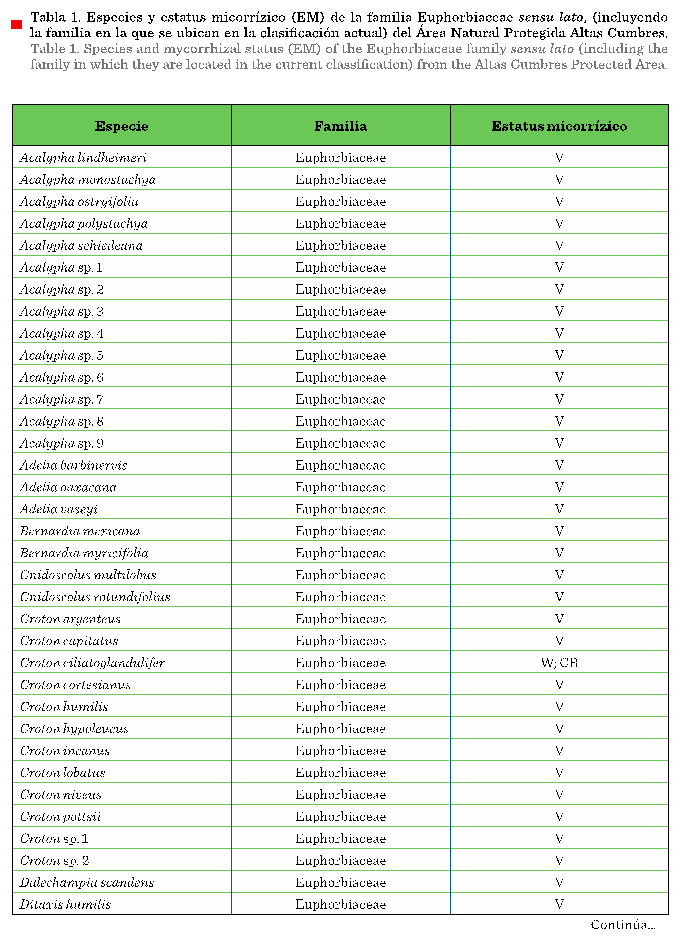
muestreos florísticos permitieron registrar 400
individuos pertenecientes a 74 taxones, dentro de 17 géneros y 62
especies, además de una subespecie y 11 morfotipos
sin identificar (Tabla 1), los cuales
representan el 45 % de las especies de la familia, estimadas para el estado
de Tamaulipas (Villaseñor, 2016). Las raíces de todos los ejemplares
presentaron micelio cenocítico al interior de las células del córtex. También
se observaron algunas células con arbúsculos y con menor frecuencia, vesículas (Figura 2).
Estos indicios demuestran que las especies de euforbiáceas del ANPAC presentan
HMA, los cuales han sido registrados anteriormente entre las especies de
euforbiáceas sudamericanas de los géneros Acalypha
(Urcelay y Battistella,
2007), Adelia, Croton
(Ramos-Montaño y col., 2010), Ricinus
(Zhang y col., 2018; Beltrame y col., 2019), Ditaxis, Drypetes, Euphorbia, Jatropha,
Manihot y Phyllanthus
(Wang y Qiu, 2006; Santhoshkumar
y col., 2018; Su-Kyi y Tin,
2019).

En
México se han explorado las relaciones micorrízicas
en plantas de nochebuena (Euphorbia pulcherrima) debido a su importancia ornamental (Callejas-Ruiz
y col., 2009). En específico, algunas de las euforbiáceas encontradas en esta
investigación han sido reportadas con presencia de HMA en otras regiones
geográficas. En los matorrales xerófilos y selvas bajas del Valle de México y el Valle de Tehuacán-Cuicatlán
se han localizado HMA asociados a C. ciliatoglandulifer, E. dentata y R. communis (Camargo-Ricalde y col., 2003; Castillo-Agüero y col., 2003;
Wang y Qiu, 2006). Esta última especie también cuenta
con registros de micorrización
en cultivos de Israel y China (Zhang
y col., 2018; Beltrame
y col., 2019). Mientras que en las
sabanas del sureste de China se han identificado asociadas con HMA a las especies E. heterophylla y E. hirta
(Tao y col., 2003). En el caso
específico de E. hirta, su asociación con
los HMA ha sido documentada en cultivos de
suelo arenoso de Senegal (Thoen, 1986), en ambientes antropizados
de China (Muthu-kumar y col., 2003) y entre vegetación secundaria
y dentro de instalaciones nucleares de la India (Ganesan
y col., 1991, Thangaswamy y col., 2004). Por su
parte, Phyllanthus niruri
ha sido ubicada como una especie asociada a los HMA en algunos cultivos
de Israel (Thangas-wamy y col., 2004) y en
condiciones antropizadas de regiones aledañas a una central nuclear de
la India (Wang y Qiu, 2006). También se destaca la
presencia de HMA asociados a Euphorbia hypericifolia, ambos como colonizadores primarios, en
rocas volcánicas en islas de Hawaii (Gemma y Koske, 1990). Aunque la
familia Euphorbiaceae se encuentra asociada con mayor
frecuencia a HMA, también pueden presentarse
otros tipos de micorrizas en este grupo. Tal
es el caso de la especie africana Uapaca
bojeri, que desarrolla
ectomicorrizas con especies de macromicetos de la división Basidiomycota, de los géneros
Amanita, Boletus, Cantharellus, Lactarius y Leccinum (Ramanankierana y
col., 2007). De igual manera, las
asociaciones ectomicorrizógenas
han sido localizadas en otras 4 especies del
género Uapaca,
así como en Amperea xiphoclada (Wang y Qiu, 2006). Sin
embargo, en el presente estudio no se registraron características
externas representativas de las ectomicorrizas, como la
formación de un manto en las raicillas o la red de Harting,
lo que sugiere que, al menos en los sitios de muestreo, en las especies
estudiadas, la asociación MA tiene una mayor representatividad que las ectomicorrizas.
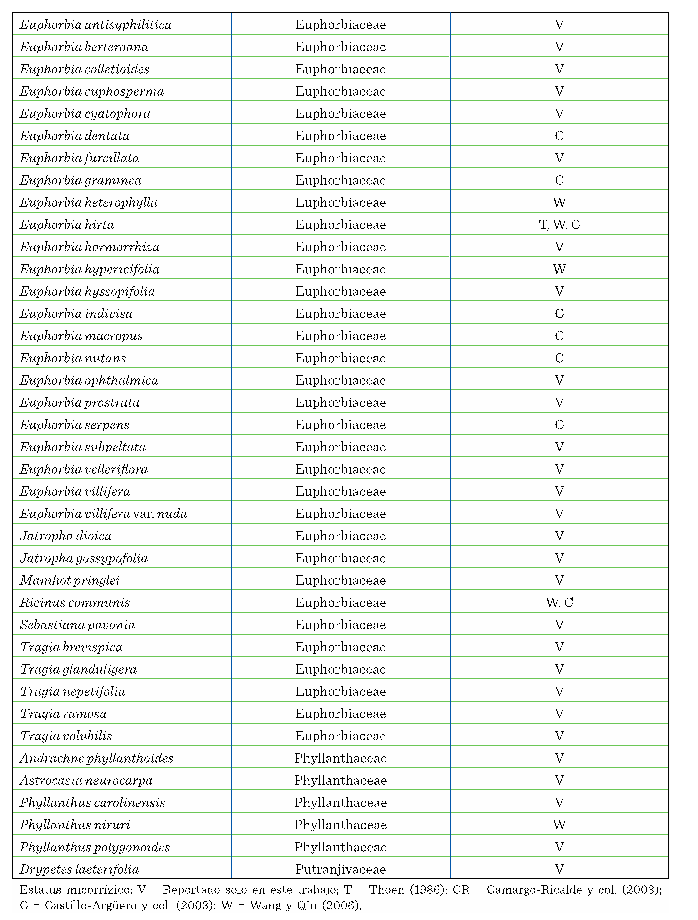
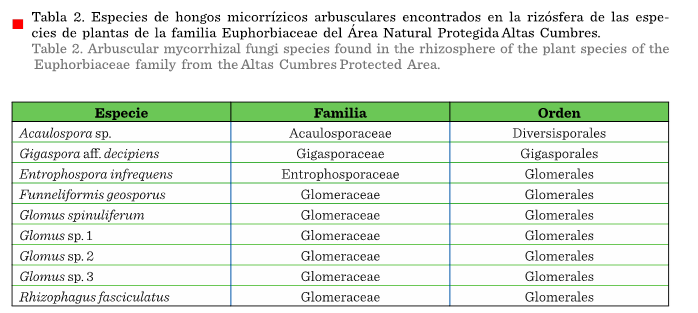
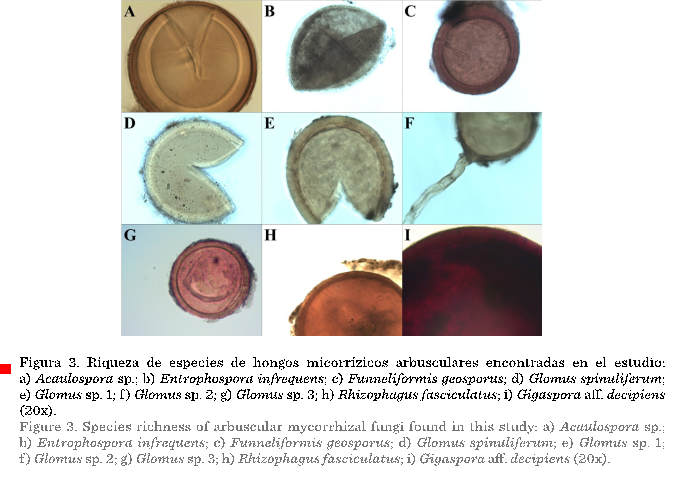
Entre
las esporas extraídas de las muestras de suelo rizosférico
se detectaron 9 taxones, distribuidos en 6 géneros, 4 familias y 3 órdenes (Tabla
2). Sin embargo, las condiciones de deterioro
de algunas esporas durante la realización del análisis microscópico
fueron desfavorables, por ello 4 taxones únicamente pudieron ser determinados hasta nivel de género (Figura 3). El
género con mayor riqueza específica fue Glomus, con 4 especies; el resto (Acaulospora, Entrophospora,
Funneliformis, Rhizophagus
y Gigaspora) estuvieron representados por
solo 1 especie. Los géneros Glomus y Gigaspora habían sido situados como especies asociadas
a la familia Euphorbiaceae en México (Callejas-Ruiz y col., 2009) y en Senegal
(Thoen, 1986),
destacando esta última localidad debido a que coincide con el registro micorrízico para E. hirta.
Mientras que Entrophospora infrequens y Funneliformis
geosporus han sido
reportadas en la Reserva del Pedregal de San Ángel, asociadas a plantas
xerófilas. Para México, E. infrequens también
se ha localizado asociada a otras especies de plantas, como aguacate (Raya-Montaño y col., 2019), café (Bertolini y col., 2020) y maguey mezcalero
(Trinidad-Cruz y col., 2017). Para Tamaulipas, los géneros Acaulospora, Glomus y Gigaspora han sido reconocidos como presentes de manera natural en cultivos
de Agave tequilana (Almaguer-Sierra y col.,
2004) y de cítricos (Garza-Ocañas y col., 2005). Por
otra parte, los géneros Glomus, Scutellospora y Sclerocystis
fueron anteriormente ubicados en
Tamaulipas asociados naturalmente a
especies de cactáceas nativas de la región del altiplano tamaulipeco (Guevara-Guerrero
y col., 2011). Cabe mencionar que los HMA de
Tamaulipas reportados previamente se detectaron a nivel de género. Esta
es la primera investigación donde se lograron
identificaciones a nivel de especie. Aunque los géneros Scutelospora y Sclerocistys
no fueron encontrados en este trabajo, la presencia de Entrophospora,
Funneliformis y Rhizophagus
se registra por primera vez en Tamaulipas, dando así una riqueza total de 8
géneros para el estado hasta el momento.
Por
su adaptación a las condiciones climatológicas, las especies de HMA nativas
documentadas en la presente investigación tienen un uso potencial como biofertilizantes. El desarrollo en los cultivos de maguey
mezcalero, cítricos y maíz ha sido estimulado experimentalmente a través de la
síntesis micorrícica con especies de los géneros Acaulospora, Gigaspora,
Glomus (Almaguer-Sierra y col., 2004; Garza-Ocañas y col., 2005; Hoang-Yen y
col., 2018) y Entrophospora
(Trinidad-Cruz y col., 2017). Esta
última también ha demostrado ser una opción para los cultivos de
aguacate (Raya-Montaño y col., 2019) y café (Bertolini y col., 2020). Por otra
parte, F. geosporus es una especie cuyo efecto
positivo en el desarrollo de los cultivos de trigo ha sido comprobado (Abu-Elsaoud y col., 2017). Finalmente, el uso de Rhizophagus fasciculatus podría ser explorado, dado que otra especie
del mismo género, R. intraradices, ha sido
utilizada favorablemente para estimular el
desarrollo de plantas de soya (Díaz-Franco y col.,
2015), sorgo (Díaz-Franco y col., 2016b) y de col (Díaz-Franco y col.,
2017) en cultivos experimentales de
Tamaulipas. Estas posibles aplicaciones
denotan la importancia del conocimiento de la composición y de la riqueza específica
local como plataformas para el desarrollo de futuras investigaciones. El método
de cultivo trampa, utilizado en este estudio,
tuvo resultados desfavorables debido a la baja densidad y diversidad de
esporas encontradas. Quizás el aislamiento de esporas directamente del suelo de
la rizósfera sea una mejor opción, puesto que
requiere menor inversión de tiempo y registra mejores resultados (Castillo-Agüero y col., 2003;
Hernández-Cuevas y col., 2003; 2008). Por
ello, se recomienda que en nuevas investigaciones en la región se utilice el método de aislamiento directo, considerando el tiempo
máximo de almacenamiento que pueden tener las
muestras (Hernández-Cuevas y col., 2003).
Los resultados del presente trabajo exponen una panorámica
de los HMA en condiciones naturales, así como de la diversidad de la división Glomeromycota en una de las familias vegetales mejor
representadas en el estado de Tamaulipas. Sin embargo, aún falta profundizar en
el conocimiento del papel ecológico y el potencial biotecnológico de las
especies nativas tamaulipecas. Por ello, el incremento de estudios similares a
éste resulta necesario.
CONCLUSIONES
Los 74 taxones de la familia Euphorbiaceae sensu
lato analizados presentaron micorrizas arbusculares, lo que indica que esta familia tiene una estrecha asociación con los hongos micorrízicos
arbusculares (HMA), al menos dentro del Área
Natural Protegida Altas Cumbres (ANPAC). Las especies de hongos identificadas pertenecen a nueve taxones del grupo phylum Glomeromycota,
distribuidos en 6 géneros, 4 familias y 3 órdenes. De estos, la presencia de
los géneros Entrophospora, Funneliformis
y Rhizophagus se reporta por primera vez para el
estado de Tamaulipas. La información obtenida podía ser útil en la elaboración
de biofertilizantes para los cultivos de la región noreste
de México. Esta aportación remarca la necesidad de continuar con estudios sobre
micorrizas en general y en particular con las especies de HMA, las cuales se
encuentran ampliamente distribuidas en las plantas de la familia Euphorbiaceae del ANPAC, tal y como se comprobó en el
presente trabajo.
Referencias
Abu-Elsaoud, A. M., Nafady,
N. A., and Abdel-Azeem, A. M. (2017). Arbuscular mycorrhizal strategy for zinc mycoremediation and diminished translocation to shoots and
grains in wheat. Plos One. 12(11): e0188220.
Almaguer-Sierra, P., Garza-Ocañas, F.,
Guevara-Guerrero, G. y López-Mendoza, F. J. (2004). Estatus micorrícico de Agave tequilana
Weber (Agave tequilero). Tecnointelecto. 1(1):
16-18.
Álvarez-Lopeztello, J., del-Castillo, R. F., Robles, C., and Hernández-Cuevas,
L. V. (2019). Spore diversity of arbuscular mycorrhizal fungi in human-modified neotropical ecosystems. Ecological Research. 34(3):
394-405.
Álvarez-Lopeztello, J., Hernández-Cuevas, L.
V., Del-Castillo, R. F., and Robles, C. (2018). Second world record of Glomus trufemii
(Glomeromycota: Fungi), an arbuscular mycorrhizal
fungus from a Mexican savanna. Revista
Mexicana de Biodiversidad. 89(1): 298-300.
Barman,
J., Samanta, A., Saha, B., Datta, S., and Vidyaniketan, B.
(2016). Mycorrhiza The Oldest Association Between Plant and Fungi. Resonance Journal of Science Education. 21(1): 1093-1104.
Batjes, N. H., Ribeiro,
E., and van-Oostrum, A. (2020). Standardised
soil profile data to support global mapping and modelling (WoSIS
snapshot 2019), Wageningen, The Netherlands, in International
Soil Reference and Information Centre: world
soil information. [En línea]. Disponible en: https://www.soilgrids.org/index.html. Fecha de consulta:
25 de diciembre de 2020.
Beltrame, S. R., Cruz, R. M., Lourenço,
E., and Alberton, O. (2019).
Meta-analysis of ‘Lamiaceae’ and ‘Euphorbiaceae’
medicinal plants inoculated with
Arbuscular mycorrhizal fungi. Australian Journal
of Crop Science. 13(4): 588-598.
Bertolini,
V., Montano, N. M., Salazar-Ortuño, B. L., Chimal-Sánchez, E. y Várela, L.
(2020). Diversidad de hongos micorrizógenos arbusculares en
plantaciones de café (Coffea
arabica) del volcán Tacana, Chiapas, México. Acta Botánica
Mexicana. 127: e1602.
Brundrett,
M., Beegher, N., Dell, B., Groove, T., and Malajczuk, N. (1996). Working with mycorrhizas in
forestry and agriculture. Canberra: Australian Center for
International Agricultural Research. 374 Pp.
Brundrett,
M. C. and Tedersoo, L. (2018). Evolutionary history
of mycorrhizal symbioses and global host plant diversity. New Phytol. 220(4): 1108-1115.
Callejas-Ruiz, B. A., Castillo-González, A. M., Colinas-León, M. T.,
González-Chávez, M. D. C., Pineda-Pineda, J. y Valdez-Aguilar, L. A. (2009).
Sustratos y hongos micorrícicos arbusculares
en la producción de nochebuena. Revista Chapingo. Serie Horticultura. 15(1): 57-66.
Camargo-Ricalde, S. L., Dhillion,
S. S., and Jimenez-Gonzalez, C.
(2003). Mycorrhizal perennials of the “matorral xerofilo” and the “selva baja caducifolia”
communities in the semiarid Tehuacan-Cuicatlan
Valley, Mexico. Mycorrhiza. 13(2):
77-83.
Castillo-Agüero,
S., Guadarrama-Chávez, P., Sánchez-Gallén, I. y
Hernández-Cuevas, L. V. (2003). Ecología de los hongos micorrizógenos
arbusculares de un matorral xerófilo sobre sustrato
volcánico en el Valle de México. En F. J. Álvarez-Sánchez (Ed.), Ecología de
Micorrizas Arbusculares y Restauración del Ecosistema (pp. 73-101). México, D. F.: Facultad de
Ciencias, UNAM.
Chimal-Sánchez,
E., Montaño, N. M., Camargo-Ricalde, S. L., García-Sánchez, R. y Hernández-Cuevas, L.
V. (2016). Nuevos registros
de hongos micorrizógenos arbusculares para México. Revista Mexicana
de Biodiversidad. 87(1): 242-247.
CONABIO,
Comisión Nacional para el Conocimiento y
Uso de la Biodiversidad (2020). Áreas Naturales Protegidas Estatales,
Municipales, Ejidales y Privadas de México 2020, en Geoportal
del Sistema Nacional de Información
sobre Biodiversidad. [En línea].
Disponible en: http://www.conabio.gob.mx/informacion/gis/.
Fecha de consulta: 25 de diciembre de 2020.
Crossay,
T., Antheaume, C., Redecker, D., Bon, L., Chedri, N., Richert, C., …, and Amir, H. (2017). New
method for the identification of arbuscular mycorrhizal fungi by
proteomic-based biotyping of spores using
MALDI-TOF-MS. Scientific Reports. 7(1): 1-16.
Cuervo-Robayo, A. P., Ureta, C.,
Gómez-Albores, M. A., Meneses-Mosquera, A. K., Téllez-Valdés, O. y Martínez-Meyer,
E. (2019). Bioclimas, periodo: 2000 (1980-2009). [En
línea]. Disponible en: http://www.conabio.gob.mx/informacion/gis/. Fecha de
consulta: 23 de diciembre de 2020.
Davison,
J., Moora, M., Öpik, M., Adholeya, A., Ainsaar, L., Bâ, A., …,
and Zobel, M. (2015). Global assessment of arbuscular
mycorrhizal fungus diversity reveals very low endemism. Science. 349(6251): 970-973.
Díaz-Franco, A., Alvarado-Carrillo, M., Alejandro-Allende, F., and
Ortiz-Cháirez, F. E. (2017). Use of organic fertilizer and arbuscular
mycorrhizal fungi in the production of
cabbage. Revista Chapingo, Serie Zonas Áridas. XVI(1): 15-21.
Díaz-Franco,
A., Castillo-Tovar, H., Ortiz-Cháirez, F. E. y Espinosa-Ramírez, M. (2019). Tratamiento químico
combinado de semilla y su influencia
en el crecimiento de plántulas de sorgo,
maíz, soya y algodón. Acta Universitaria. 29(2): e2026.
Díaz-Franco, A., Ortiz-Cháirez, F. E., and
Espinosa-Ramírez, M. (2016a). Mycorrhizal symbiosis and growth of sorghum
plants irrigated with saline
water. Revista Chapingo, Serie Zonas Áridas. XV(1): 55-65.
Díaz-Franco,
A., Espinosa-Ramírez, M. y Ortiz-Cháirez, F. E. (2016b). Promoción de biomasa y contenido de
azúcares en sorgo dulce mediante abonos orgánicos y micorriza arbuscular. Revista Internacional de Contaminación
Ambiental. 32(3): 353-360.
Díaz-Franco,
A., Magallanes-Estala, A., Aguado-Santacruz, A. y Hernández-Mendoza, J. L.
(2015). Respuesta de la soya a inoculantes microbianos en el norte de Tamaulipas, México. Revista Mexicana de Ciencias
Agrícolas. 6(2): 227-238.
Díaz-Hernández,
B. G., Aguirre-Medina, J. F. y Díaz-Fuentes, V. H. (2013). Rendimiento de Jatropha curcas L. inoculada con micorriza y
aplicación de composta de caña. Revista
Mexicana de Ciencias Agrícolas.
4(4): 599-610.
ESRI, Environmental System
Research Institute (2018). n’Query® Advisor Copyright (Versión 10.6) [Software
de computo]. West Redlands, California, Estados
Unidos: Environmental System
Research Institute.
Ferlian, O., Biere, A.,
Bonfante, P., Buscot, F., Eisenhauer, N., Fernandez, I., …, and Martinez-Medina, A.
(2018). Growing Research Networks on
Mycorrhizae for Mutual Benefits. Trends in Plant Science. 23(11):
975-984.
Ganesan, V., Ragupathy, S. Parthipan,
B., Rajini-Rani, D. B., and Mahadevan, A. (1991). Distribution of
vesicular-arbuscular mycorrhizal fungi in coal, lignite, and calcite mine
spoils of India. Biology and Fertility of Soils. 12(2):
131-136.
García-Jiménez,
J., Valenzuela, R., Raymundo, T., García-Morales,
L. J., Guevara-Guerrero, G., Garza-Ocañas, F., ... y Ruiz-Cancino, E.
(2014). Macrohongos asociados a encinares (Quercus spp.) en
algunas localidades del estado de Tamaulipas, México. En A. Correa-Sandoval, J.
V. Horta-Vega, J. García-Jiménez y L. Barrientos-Lozano (Eds.), Biodiversidad
Tamaulipeca Vol. 2 (pp. 103-140). Cd. Victoria, México: Instituto
Tecnológico de Ciudad Victoria.
García-Morales,
L. J., Estrada-Castillón, Á. E., Villarreal-Quintanilla, J. Á., Cantú-Ayala,
C., Jurado-Ybarra, E. y Vargas-Vázquez, V. A. (2014). Florística y Vegetación
del Área Natural Protegida Altas Cumbres, Tamaulipas, México. En A.
Correa-Sandoval, J. V. Horta-Vega, J. García-Jiménez y L. Barrientos-Lozano
(Eds.), Biodiversidad Tamaulipeca Vol. 2 (pp. 15-74). Cd. Victoria, México:
Instituto Tecnológico de Ciudad Victoria.
Garza-Ocañas, F., Guevara-Guerrero, G., Hernández-Jasso, R. E. y
Zúñiga-Medina, A. G. (2005). Hongos micorrizógenos
asociados a cítricos. Tecnointelecto. 2(1):
8-10.
Gemma, J. N.
and Koske, R. E. (1990). Mycorrhizae
in recent volcanic substrates in Hawaii. American Journal of Botany. 77(9): 1193-1200.
Guevara,
G., Bonito, G. y Cázares, E. (2013). Revisión del género Tuber
(Tuberaceae: Pezizales) de México. Revista
Mexicana de Biodiversidad. 84:
39-49.
Guevara-Guerrero,
G., Cázares-González, E., Bonito, G., Healy, R. A.,
García-Jiménez, J., Garza-Ocañas, F., ... y Trappe, J. (2014). Hongos
hipogeos de Tamaulipas, México. En A. Correa-Sando-val,
J. V. Horta-Vega, J. García-Jiménez y L. Barrientos-Lozano (Eds.), Biodiversidad
Tamaulipeca Vol. 2 (pp. 87-102). Cd. Victoria, México: Instituto
Tecnológico de Ciudad Victoria.
Guevara-Guerrero, G., García-Jiménez, J., Almaguer-Sierra, P.y
Martínez-Ávalos, J. G. (2011). Determinación del estatus micorrícico
de once especies de cactáceas del municipio de Tula, Tamaulipas, México. Tecnointelecto. 8(1): 10-15.
Hernández-Cuevas, L. V., Castillo-Agüero, S., Guadarrama-Chávez, P., Martínez-Orea, Y., Romero-Romero, M. A. y Sánchez-Gallén, I. (2003). Hongos micorrizógenos
arbusculares del Pedregal de San Ángel. México,
D. F.: Facultad de Ciencias, UNAM. 84 Pp.
Hernández-Cuevas,
L. V., Guadarrama-Chávez, P., Sánchez-Gallén, I. y
Ramos-Zapata, J. A. (2008). Micorriza Arbuscular. Colonización
intrarradical y extración
de esporas del suelo. En F. J.
Álvarez-Sánchez y A. Monroy-Ata (Eds.), Técnicas de Estudio de las
Asociaciones Micorrícicas y sus Implicaciones en la Restauración (pp. 1-16). México, D. F.: Universidad Nacional Autónoma de
México.
Hoang-Yen,
L. T., Hong-Anh, L., Dam-Linh,
M. T., and Van-Hop, D. (2018). Isolation of mycorrhizal fungi from
maize cultivation soil and the production of biofertilizer from these fungi. Tap Chi khoa Hoc. 34(3):
1-9.
INEGI,
Instituto Nacional de Estadística y Geografia (2013). Continuo de
Elevaciones Mexicano 3.0 (CEM 3.0), México, D. F., en Continuo de Elevaciones Mexicano. [En
línea]. Disponible en:http://www.inegi.org.mx/geo/contenidos/datosrelieve/continental/descarga.aspx. Fecha
de consulta: 25 de marzo de 2019.
Kumar,
A., Dames, J. F., Gupta, A., Sharma, A., Gilbert, J. A., and Ahmad, P. (2015).
Current developments in arbuscular mycorrhizal fungi research and its role
in salinity stress alleviation: a biotechnological perspective. Critical
Reviews in Biotechnology. 35(4): 461-474.
Liu, H., Luo, Y., and Liu, H. (2010). Studies of mycorrhizal fungi of
Chinese Orchids and their role in orchid conservation
in China—A review. The Botanical Review. 76(2): 241-262.
Lot, A. y Chiang, F. (1986). Manual de
herbario: administración y manejo de colecciones, técnicas de
recolección y preparación de ejemplares botánicos. México, D. F.:
Consejo Nacional de Flora de México A. C. 342 Pp.
Martínez, J. L., Hernández-Cuevas, L. V., Santiago-Martínez, M. G., Guerra-De-La-Cruz, V. y Legorreta-Padilla,
F. D. J. (2009). Manual para la
propagación y micorrización de plantas arbustivas silvestres para la restauración de suelos degradados. Tlaxcala,
México: Universidad Autónoma de Tlaxcala. 23 Pp.
Muthukumar, T., Sha, L.,
Yang, X., Cao, M., Tang, J., and Zheng,
Z. (2003). Mycorrhiza of plants in different
vegetation types in tropical ecosystems of Xishuangbanna, southwest China. Mycorrhiza. 13(6): 289-297.
Noda, Y.
(2009). Las micorrizas: Una alternativa de fertilización ecológica en los
pastos. Pastos y Forrajes. 32(2): 1-10.
Oehl, F., Sieverding, E., Palenzuela, J., Ineichen, K., and
Alves-Da-Silva, G. (2011). Advances in Glomeromycota
taxonomy and classification. IMA fungus. 2(2): 191-199.
Oliveira, R. S., Ma, Y., Rocha, I., Carvalho, M. F., Vosátka,
M., and Freitas, H. (2016). Arbuscular mycorrhizal fungi are an alternative to
the application of chemical fertilizer in the production of the medicinal and
aromatic plant Coriandrum sativum L. Journal of Toxicology and Environmental
Health, Part A. 79(7): 320-328.
Phillips, J. M. and Hayman, D. S. (1970).
Improved procedures for clearing roots and staining parasitic and vesiculararbuscular mycororrhizal
fungi for rapid assessment to infection. Transactions of the British
Mycological Society. 55(1): 158-161.
Ramanankierana,
N., Ducousso, M., Rakotoarimanga,
N., Prin, Y., Thioulouse, J., Randrianjohany,
E., …, and Duponnois, R.
(2007). Arbuscular mycorrhizas and ectomycorrhizas
of Uapaca bojeri
L. (Euphorbiaceae): sporophore
diversity, patterns of root colonization, and effects on seedling growth and
soil microbial catabolic diversity. Mycorrhiza. 17(3):
195-208.
Ramos-Montaño,
C., Posada-Almanza, R. H., Ronderos-Figueroa, M. A. y
Penagos-Cañón, G. A. (2010). Relación entre asociación micorrícica
con el estado fitosanitario en el arbolado urbano de Bogotá D. C., Colombia. Acta
Biológica Colombiana. 15(1): 245-258.
Raya-Montaño, Y. A., Apáez-Barrios, P.,
Aguirre-Paleo, S., Vargas-Sandoval, M., Paz-Da Silva, R. y Lara-Chávez, M. B. N.
(2019). Identificación de hongos micorrizógenos arbusculares en
huertos de aguacate de Uruapan, Michoacán. Revista Mexicana de Ciencias
Agrícolas. 10(23): 267-276.
Rodriguez, A. and Sanders, I. R. (2014). The role of community and population ecology in applying mycorrhizal
fungi for improved food security. The ISME Journal. 9(5): 1053-1061.
Santhoshkumar, S., Nagarajan, N., and Santhoshkumar,
S. (2018). Studies on the arbuscular mycorrhizal fungal biodiversity
in the plant species of Kondranghi hills, Dindugul district, Tamil Nadu, India. Kongunadu
Research Journal. 5(2): 34-40.
Schenck, N. C. y Pérez, Y. (1990). Manual
for the Identification of VA
Mycorrhizal Fungi. Gainesville,
USA: Synergistic Publications. 286 Pp.
Schüler, A., Schwarzott, D.,
and Walker, C. (2001). A new fungal phylum, the Glomeromycota: phylogeny and evolution. Mycological Research. 105(12):
1413-1421.
Steinmann, V. W. (2002). Diversidad y endemismo de
la familia Euphorbiaceae en México. Acta Botánica
Mexicana. 61(1): 61-93.
Steinmann, V. W. y Ramírez-Amezcua, Y. (2016). Euforbiáceas (Euphorbiaceae). En Comisión Nacional para el Conocimiento y
Uso de la Biodiversidad (Ed.), La Biodiversidad en Colima. Estudio de Estado
(pp. 238-243). México, D. F.: CONABIO.
Sturmer, S. L., Bever,
J. D., and Morton, J. B. (2018). Biogeography of arbuscular mycorrhizal fungi (Glomeromycota):
a phylogenetic perspective on species distribution patterns. Mycorrhiza. 28(7): 587-603.
Su-Kyi, H. and Tin, K. (2019). Multiplication of mycorrhiza inoculum
from five weed plants and its effect on Lactuca sativa L. Journal of the Myanmar Academy of Arts and Science.
17(4): 675-688.
Tao, L., Jianping, L., and Zhiwei,
Z. (2003). Arbuscular mycorrhizas in a valley-type savanna in southwest China. Mycorrhiza.
14(5): 323-327.
Thangaswamy,
S., Padmanabhan, C., Yu-Jin, J., and Kim, H. (2004). Occurrence of vesicular-arbuscular
mycorrhizal (VAM) fungi and their effect on plant growth in endangered vegetations.
Journal of Microbiology and Biotechnology. 14(4): 885-890.
Theplantlist,
Royal Botanic Gardens Kew, Missouri Botanical
Garden (2020). The Plant List V1.1, Reino Unido, en The Plant List. [En línea]. Disponible en:
http://www.theplantlist.org/. Fecha de consulta: 21 de diciembre de 2020.
Thoen, D. (1986). First
observations on the occurence of vesicular-arbuscular mycorrhizae (VAM) in hydrophytes, hygrophytes, halophytes
and xerophytes in the region of lake Retba
(Cap-Vert, Senegal) during the dry season. Mémoíres de la
Société Royale de Botanique
de Belgique. 9(1): 60-66.
Trinidad-Cruz,
J. R., Quiñones-Aguilar, E. E., Hernández-Cuevas,
L. V., López-Pérez, L. y Rincón-Enríquez, G. (2017). Hongos micorrízicos
arbusculares asociados a la rizosfera
de Agave cupreata en regiones mezcaleras del
estado de Michoacán, México. Revista Mexicana de Micología. 45: 13-25.
Urcelay, C. y Battistella, R. (2007).
Colonización micorrícica en distintos tipos funcionales de plantas herbáceas del centro
de Argentina. Ecología Austral. 17(2): 179-188.
Villaseñor, J. L. (2016). Checklist of the native vascular
plants of Mexico. Revista
Mexicana de Biodiversidad. 87(3): 559-902.
Wang, B. and Qiu, Y. L. (2006). Phylogenetic distribution and evolution of mycorrhizas in land plants. Mycorrhiza. 16(5):
299-363.
Webster, G. L. (1994). Classification of the Euphorbiaceae.
Annals of the Missouri Botanical Garden. 81(1): 3-32.
Zhang, T., Hu, Y., Zhang, K., Tian, C., and Guo, J. (2018). Arbuscular
mycorrhizal fungi improve plant growth of Ricinus communis by altering
photosynthetic properties and increasing pigments under drought and salt
stress. Industrial Crops and Products. 117: 13-19.