Influencia del hábitat en la diversidad de aves insectívoras
en un sistema agroforestal enclavado en un Bosque Mesófilo
de Montaña
Influence of the habitat on the
diversity of insectivorous birds in
agroforestry systems embedded in a
Mountain Mesophilic Forest
Saúl Ugalde-Lezama1*,
Claudio Romero-Díaz2, Luis Antonio Tarango-Arámbula3,
Rosa María García-Núñez2
*Correspondencia:
biologo_ugalde@hotmail.com/Fecha de recepción: 21 de octubre de 2021/Fecha de aceptación: 24 de diciembre de 2021/Fecha de publicación: 28 de enero de 2022.
1Universidad Autónoma Chapingo,
Departamento de Suelos, Área de Recursos Naturales Renovables, Texcoco, Estado
de México, México. 2Universidad Autónoma Chapingo, Departamento de
Suelos, Maestría en Ciencias en Agroforestería para
el Desarrollo Sostenible, carretera federal México-Texcoco km 38.5, Texcoco,
Estado de México, México, C. P. 56230. 3Colegio de Postgraduados,
Campus San Luis Potosí, Postgrado de Innovación en Manejo de Recursos
Naturales, San Luis Potosí, San Luis Potosí, México.
Resumen
Los sistemas agroforestales pueden
representar importantes nichos ecológicos que coadyuven a la conservación de la
diversidad avifaunística. El objetivo de este trabajo
fue estimar y comparar la diversidad y uso de hábitat de aves insectívoras en
sistemas agroforestales enclavados en un bosque mesófilo de montaña. Se efectuó el monitoreo
de aves de agosto de 2018 a enero de 2019 en tres hábitats: café tradicional (CT), potrero (PT) y bosque mesófilo
de montaña (BMM). Se determinaron índices de
abundancia relativa (IAR), riqueza (Jacknife1), similitud (Jaccard) y diversidad (Shannon-Wiener). El IAR presentó valores
bajos para los tres hábitats. El método Jacknife1 denotó una riqueza promedio
considerable para las tres áreas (CT: 33.02, PT: 24.20, BMM: 9.98, CT-PT-BMM:
52.22). La técnica de Jaccard registró poca similitud en la riqueza, reafirmando
el efecto del hábitat, composición y estructura florística como factores
determinantes, al mismo tiempo que estableció promedios de diversidad alta obtenidos mediante el método
de Shannon-Wiener (H´= 3.3; 3.1; 2.27; 3.78, respectivamente), revelando
una diversidad relativamente estable en los tres hábitats. Por su parte, Kruskal-Wallis advirtió diferencias en la diversidad, pero no
para la riqueza y la abundancia. Se evidenció la conformación de clústeres y
agrupaciones que encontraron mayor similitud entre la
riqueza y la abundancia de especies por cada monitoreo aplicado. El análisis de componentes principales
indicó mayor correlación del hábitat y la
vegetación utilizados para la alimentación
en el estrato herbáceo y arbóreo, en alturas que van de 5 m a 10 m,
utilizando el estrato aéreo para vuelo. Los
sistemas agroforestales estudiados constituyeron un nicho de oportunidad
en donde la avifauna halló alimento,
áreas de nidación y reproducción. Se recomienda la implementación de buenas prácticas de manejo agroforestal que coadyuven a la
conservación de especies.
Palabras clave: agroforestería, avifauna insectívora, coexistencia, endemismo, riqueza.
Abstract
Agroforestry systems can represent
important ecological niches that contribute to the conservation of bird diversity. The objective of this
work was to estimate and compare the diversity and habitat use of insectivorous
birds in agroforestry systems located in a montane cloud forest. Bird monitoring was carried out from August 2018 to
January 2019 in three habitats: traditional coffee plantation (CT),
paddock (PT) and montane cloud forest (BMM). Relative abundance (IAR),
richness (Jacknife1), similarity (Jaccard) and diversity (Shannon-Wiener)
indices were determined. The IAR presented low values for the three
habitats. The Jacknife1 method denoted
considerable average richness for the three areas (CT: 33.02, PT: 24.20, BMM: 9.98, CT-PT-BMM: 52.22). The Jaccard
technique recorded little similarity in richness, reaffirming the effect
of habitat, composition and floristic structure as determining factors, which
at the same time established high diversity averages, obtained by the
Shannon-Wiener method (H´= 3.3; 3.1 ; 2.27; 3.78, respectively), revealing a
relatively stable diversity in the three habitats. For his part, Kruskal-Wallis
noticed differences in diversity, but not for richness and abundance. The
formation of clusters and groups that found greater similarity between the
richness and abundance of species for each applied monitoring was evidenced. Principal component analysis indicated a higher
correlation of habitat and vegetation used for feeding in the herbaceous and
arboreal stratum, at heights ranging from 5 m to 10 m, using the aerial stratum for flight. The agroforestry systems
studied constituted a niche of opportunity where the avifauna found food,
nesting and reproduction areas. The implementation of good agroforestry management
practices that contribute to the conservation of species is recommended.
Keywords: agroforestry,
insectivorous birds, coexistence, endemism, richness.
![]()
INTRODUCCIÓN
En el mundo existen alrededor de 9 800 especies de aves, en
su mayoría insectívoras (Ibarra y Cruzado, 2017; Nyffeler
y col., 2018). Sin embargo, los ecosistemas están siendo alterados por acciones antropogénicas, reduciendo hábitats
originales, lo que ha interrumpido procesos
ecológicos, ocasionando la extinción de varias especies de aves
(Da-Ponte y col., 2017; Guzmán-Manrique y Flórez-García, 2019; Xu y col., 2019).
México reporta cerca de 1 150 especies de aves,
principalmente insectívoras (Ramírez-Albores, 2006;
Morales-Martínez y col., 2018; Adame y col., 2019), ocupa el 11.° lugar
de diversidad a nivel mundial y el 4.° lugar
de endemismo (212 especies
endémicas) (Navarro y col., 2014; Fuentes-Moreno y col., 2020). Sin embargo, debido
a una alta presión provocada por el desarrollo industrial y agropecuario,
varios ecosistemas se han visto alterados, causando la disminución y pérdida de
diversidad, revelando 388 especies bajo alguna categoría de riesgo (Ramos y col.,
2016; Ortiz-Pulido, 2018; López-Segoviano
y col., 2019).
Los sistemas agroforestales (SAF) han
resultado una forma sostenible de dar respuesta al problema de alteración de
ecosistemas (Yashmita-Ulman y Kumar,
2018; García-Núñez y col., 2020; Perez y col., 2021).
Entre las diversas funciones que ofrecen dichos sistemas de origen antropogénico
está el generar un equilibrio entre la producción agropecuaria y la
conservación de la biodiversidad a partir de la conexión ecológica
(corredor biológico) de remanentes naturales
fragmentados (Vilchez y col., 2017; Haggar y col., 2019;
Marconi y Armengot, 2020).
Dado el arreglo espacial
(vertical y horizontal) que presentan los SAF, se generan pequeños hábitats, regulando factores como el clima,
la humedad y la temperatura, entre otros. Representan un papel importante como
refugio para la vida silvestre, en el que probablemente las aves (particularmente
insectívoras) pueden desempeñar un papel
sustancial en el equilibrio de
este ambiente, regulando poblaciones
de insectos perjudiciales (García y col., 2015;
Nell
y col., 2018).
Cabe destacar que, dado el comportamiento
ecológico de las aves, se presenta una gran relación en cuanto a las características de estructura
y composición florística al momento de seleccionar su hábitat (Alonso y col.,
2018; Perez y col., 2021). Se ha demostrado que estos dos elementos
intervienen directamente en la riqueza de especies insectívoras y diferentes
gremios tróficos para determinada zona (Cubley y col., 2020; Salas y Mancera-Rodríguez,
2020) debido a la disponibilidad de espacio, alimento, sitios de percha, áreas
de nidación, predación, parasitismo de nidos y
protección contra adversidades climáticas (Tomasevic y Marzluff, 2020).
Con base en ello y dada la composición estructural
que representan los diferentes tipos
de SAF (tradicional, rústico,
policultivo comercial, monocultivo sombreado y monocultivo sin sombra)
(Villavicencio-Enríquez, 2012), posiblemente se logre albergar un gran número de aves insectívoras que podrían coadyuvar en los procesos ecológicos que se desenvuelven
en este medio natural, tal como el control biológico de plagas (García-Flores y
col., 2017; Sow
y col., 2020).
En el municipio de Huatusco, Veracruz, México se encuentra
ubicado un sistema de producción tradicional
de café, inmerso en un Bosque Mesófilo de
Montaña (BMM). Este sistema se constituye por diferentes tipos de vegetación
(herbácea, arbustiva y arbórea), en un arreglo espacial que dispone de nichos
en donde se podría albergar un gran número de
aves, particularmente insectívoras. No obstante, a pesar de la importancia que representa dicho SAF en función
de la conservación de especies, hasta el momento no se tienen investigaciones sobre la diversidad y uso de hábitat de
estos organismos.
El objetivo del presente trabajo fue estimar y comparar la diversidad y uso de hábitat de aves
insectívoras en sistemas agroforestales enclavados en un bosque mesófilo de montaña
en Huatusco, Veracruz,
México.
MATERIALES Y MÉTODOS
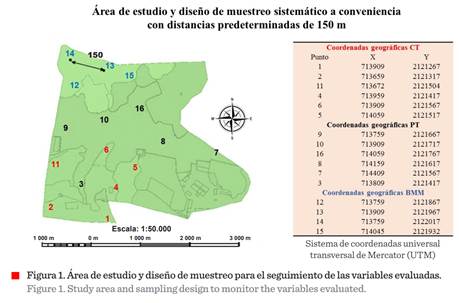
El área evaluada se localiza en el
municipio de Huatusco, Veracruz, México (19º 09’ N y 96º 57’ W. 1 933 msnm). Se
determinaron 16 puntos de monitoreo distribuidos en tres hábitats: café-tradicional
(CT; 6 puntos), potrero (PT; 6 puntos) y bosque mesófilo
de montaña (BMM; 4 puntos), en una superficie total de 32.42 ha (Figura
1). En cada entorno se aplicó un muestreo sistemático a conveniencia con
distancias lineales de 150 m entre cada
punto. El seguimiento de aves se efectuó mensualmente, de agosto de 2018
a enero de 2019, empleando recuento en puntos con radio fijo de 25 m y búsqueda
intensiva, en un horario de las 7 horas a las
16 horas del día. Este seguimiento se llevó acabo en los primeros 6 d de cada mes (Ponce y col., 2012; Alonso y col., 2018; Espejo y Morales,
2019). Conjuntamente, se emplearon Líneas de Canfield,
aplicando ciertas modificaciones para conocer las variables del hábitat
(Bueno y col., 2015). Se determinó índice de abundancia relativa (IAR). La
riqueza de especies insectívoras se estimó mediante el índice de Jacknife1, la
diversidad con Shannon-Wiener y la similitud con el índice de Jaccard; estos índices fueron empleados teniendo en cuenta
el tipo de datos colectados (estocásticos), considerando lo descrito por Moreno (2001), quien propone a estos
índices de mayor precisión y con menor sesgo (Molina y col., 2012; Pérez y
col., 2015; Sandoval, 2019); los índices se
obtuvieron a partir del software Estimates versión 9.1.0 (Colwell, 2013). Para
determinar el estatus de conservación nacional e internacional se consultaron
las bases de datos de La Convención sobre el Comercio Internacional de Especies
Amenazadas de Fauna y Flora Silvestres (CITES, por sus siglas en inglés: The Convention on International Trade
in Endangered Species of Wild Fauna and Flora), la Unión Internacional para
la Conservación de la Naturaleza (IUCN, por sus siglas en inglés: International Union for the Conservation of Nature) y la
NOM-O59-SEMARNAT-2010 (SEMARNAT,2010).
Para observar posibles diferencias estadísticamente significativas por cada índice (considerando
los datos de cada monitoreo aplicado) e inferir si los datos obtenidos son los
que potencialmente se encuentran en el área, se aplicaron análisis de Kruskal-Wallis y X2 (Galicia y col.,
2019), los cuales se obtuvieron mediante el Sistema de Analisis Estadistico (SAS, por sus siglas en inglés: Statistical Analisys System) (SAS,
2009) JMP IN versión 8.0.2. Para visualizar
gráficamente la similitud entre la riqueza y la abundancia de especies
detectadas por cada monitoreo realizado se
efectuaron análisis de conglomerados (clúster), aplicando el método de
Ward y la distancia euclídea
como elementos de similitud y unión.
Así mismo, con el fin de conocer qué
componentes del hábitat y vegetación mostraban correlación con las aves enlistadas, se llevaron a
cabo análisis de componentes principales; para ambos casos se utilizó el software estadístico XLSTAT versión 2018.7.5.
(XLSTAT, 2018; Figueroa y col., 2019).
RESULTADOS Y DISCUSIÓN
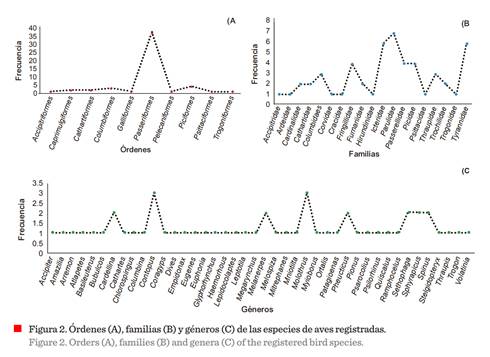
Los muestreos permitieron identificar 52
especies de aves, 50 de ellas insectívoras
(Cathartes aura y Coragyps atratus no
formaron parte de este gremio trófico), considerando a todas a aquellas
especies que integran, al menos temporalmente, un porcentaje de insectos en su dieta (Lopes y col.,
2016; Nyffeler y col., 2018; Olsen y col., 2018; Sherry y col., 2020), 10 órdenes y 19 familias (Figura 2). Estos
hallazgos concuerdan con investigaciones aplicadas en diferentes SAF, que encontraron el mismo número de especies, señalando a los SAF como un elemento que coadyuva a la conservación de dicho grupo taxonómico (Santos y col.,
2013).
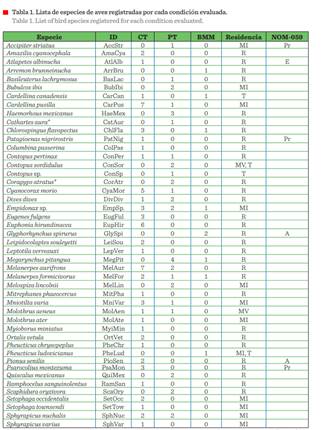
De las 50 especies insectívoras, 21 fueron observadas
exclusivamente en el hábitat de café tradicional (CT), 11 solo en el entorno
potrero (PT) y 5 en el bosque mesófilo de montaña
(BMM). Del total de especies, 15 fueron migratorias, 35 residentes y 4
transitorias, siendo el hábitat de PT quien permite el arribo de un mayor
número de especies migratorias, seguida
del CT, con
una especie menos
(Tabla 1).

Los resultados permiten evidenciar que la estructura y composición
florística de los potreros son elementos importantes que facilitan la llegada
de especies migratorias, ofreciendo nichos ecológicos y espacios de
utilización, tal como lo señalan Wilcox y Murphy
(1985); Tarbox y col. (2018); Chará y
col. (2019); Morales y col. (2021),
quienes además describen a estos
sistemas bioproductivos
como efecto de borde y/o corredor biológico, en donde se dispone de alimento,
refugio y sitios de descanso que coadyuvan a la conservación de dicho grupo
taxonómico; como lo describen la teoría de islas y de metapoblaciones
(MacArthur y Wilson, 1967; Hanski, 1999; Sánchez y
col., 2018; Huang y
col., 2020). Estas teorías sugieren que la pérdida y fragmentación del
hábitat, producto de diversos eventos
intrínsecos y extrínsecos al sistema, podrían originar metapoblaciones faunísticas aisladas en los remanentes de
vegetación natural, mismas que tendrían pocas probabilidades de viabilidad en
el mediano y largo plazo, lo cual podría sugerir que el establecimiento de SAF
y potreros como los explorados en la presente investigación podrían disponer condiciones que permitan establecer
una conexión entre tales remanentes (parches), facilitando el flujo de germoplasma entre metapoblaciones, actuando como
corredores biológicos locales, facilitando la llegada de especies migratorias e incluso permitiendo la coexistencia
simpátrica de algunas especies de aves en la
utilización de nichos
específicos.
De acuerdo con la Norma Oficial Mexicana
(SEMARNAT, 2010), se observó la presencia de 4
especies bajo protección especial: [Accipiter striatus
(PT), Patagioenas nigrirostris
(CT), Psarocolius montezuma
(CT) y Trogon collaris
(BMM)]; una endémica: [Atlapetes albinucha
(CT)], y tres amenazadas: [Glyphorhynchus spirurus (BMM), Pionus senilis (CT)
y Spinus atriceps (BMM)]. Lo anterior, producto de la complejidad en la estructura y
composición de los elementos que integran los hábitats analizados, considerando
que a mayor tiempo de establecimiento, los SAF desarrollan características similares
a espacios conservados, permitiendo el arribo de especies especialistas,
quienes encuentran sitios de oportunidad en el interior de estos medios de
producción, adoptando los recursos disponibles como parte de su nicho ecológico
(Ramírez-Albores, 2010; Botero y
De-la-Ossa, 2011; Cipriano-Anastasio y col., 2017; Naoki
y col., 2017).
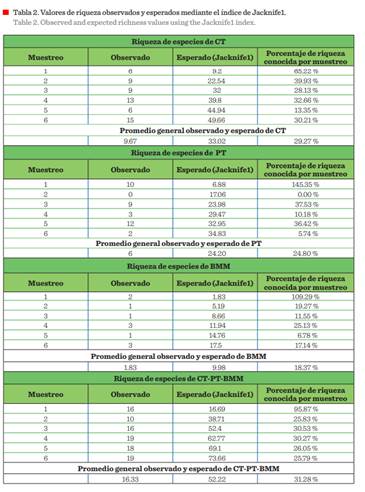
Los valores promedio observados de la riqueza de especies insectívoras fueron: CT: 9.67, PT: 6, BMM:
1.83 y CT-PT-BMM: 16.33. Por su parte, los resultados esperados mediante el estimador Jacknife1muestra medias de 33.02, 24.20,
9.98 y 52.22 especies, respectivamente. Por lo que, hasta ahora, con los valores de riqueza obtenidos,
se conoce un promedio del 29.27 % (CT), 24.80 % (PT), 18.37 % (BMM) y 31.28 %
(CT-PT-BMM), de la avifauna insectívora teóricamente presente
en estos hábitats
(Tabla 2).
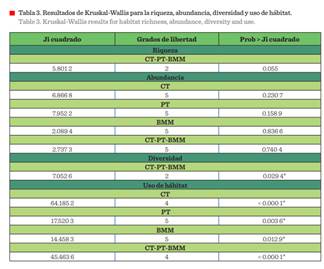
Los resultados de Kruskal-Wallis
para la riqueza y abundancia no describen diferencias significativas. Por el
contrario, la diversidad y las variables en el uso de hábitat muestran diferencias
entre condiciones. Se exhibe que para las tres condiciones la riqueza y
abundancia presentan patrones similares, no así para la diversidad y las
variables que determinan el uso del hábitat (Tabla
3).
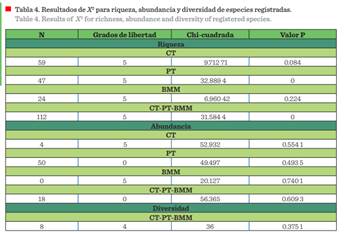
Los resultados de X2 muestran que la riqueza
de especies encontrada no es la que potencialmente se presenta en estos
hábitats. Por su parte, la abundancia y diversidad es la que se distribuye en
las áreas analizadas
(Tabla 4).
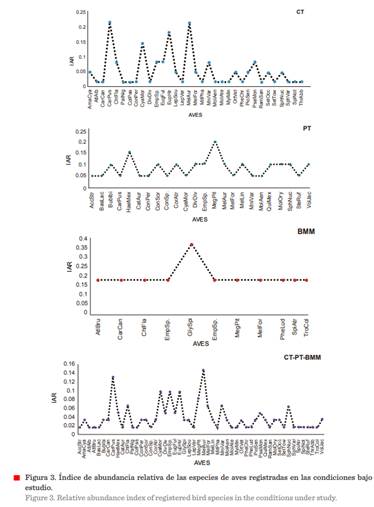
Los resultados del IAR reportaron
valores bajos con mayor abundancia para las
siguientes especies: en CT: Melanerpes aurifrons (MelAur) y Cardellina pusilla (CarPus), en PT: Megarynchus
pitangua (MegPit) y Haemorhous mexicanus (HaeMex), en BMM: Glyphorynchus
spirurus (GlySpi), y en CT-PT-BMM: Melanerpes
aurifrons y Cardellina pusilla (Figura
3).
Los valores porcentuales obtenidos
mediante el índice de Jaccard para la similitud de
riqueza arrojaron los siguientes resultados: CT: 19 %, PT: 16 %, BMM: 10 % y CT-PT-BMM: 23 %, exponiendo
gran disimilitud en la riqueza, reafirmando el efecto que presentaron el hábitat,
la composición y estructura florística como factores determinantes de la
riqueza y diversidad en cada uno de los hábitats (Figura 4) (Perez y col., 2021).
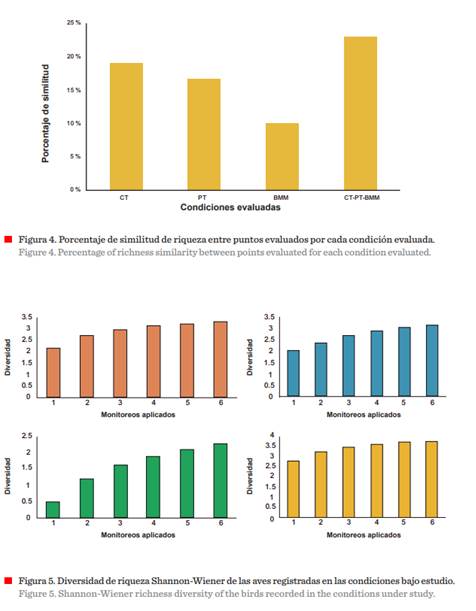
Shannon-Wiener obtuvo valores mínimos y máximos de: H´= 2.15;
1.99; 0.48; 2.79 y H´= 3.3; 3.1; 2.27; 3.78, respectivamente. Con valores promedio de: H´= 2.91; 2.65; 1.59; 3.44, respectivamente (Figura 5). Tales resultados arrojaron
una diversidad alta en los hábitats observados; soportando lo propuesto por Connell (1978) en su hipótesis del disturbio intermedio, en
la que postula que sitios con mediano grado de perturbación, al igual que los
SAF analizados, favorecen el incremento en la riqueza y diversidad, particularmente
de especies generalistas y algunas especialistas, quienes se ven influenciadas
por factores como la competencia, segregación del hábitat, dispersión o recolonización
de nuevos espacios. De igual forma, Sommer y col.
(2018) reportaron que especies flexibles sujetas a cierto disturbio suelen retornar a hábitats fotosintéticamente activos,
tal como se presenta en los SAF estudiados,
que ofrecieron nichos de oportunidad para estos
organismos, sugiriendo estos medios de
producción como modelo sostenible que coadyuva a la conservación de
este grupo taxonómico.
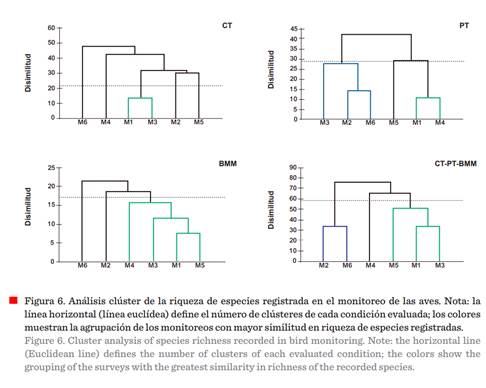
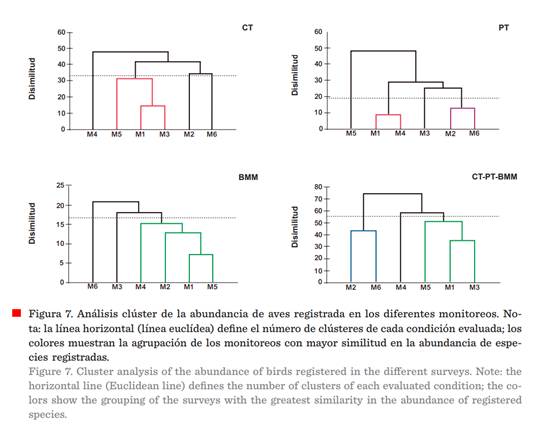
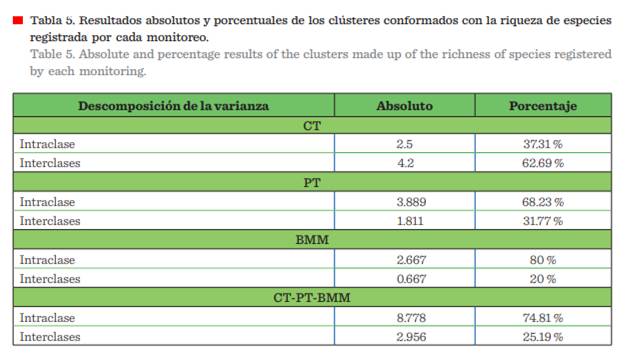
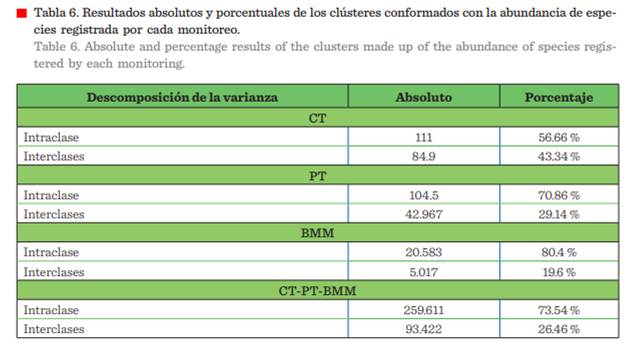
El análisis de conglomerados evidenció
la conformación de diversos clústeres, Riqueza: CT=1, PT = 3, BMM = 3 y CT-PT-BMM = 3 (Figura 6, Tabla 5), y para Abundancia: CT = 2, PT= 2, BMM = 3 y CT-PT-BMM = 3 (Figura 7, Tabla 6), mostrando
diferentes porcentajes de similitud en el
registro de ambos parámetros (riqueza y abundancia). Estos indicios fueron producto del periodo de muestreo, en donde se contemplaron especies residentes,
migratorias y transitorias, que determinaron la variabilidad y similitud de
dichos índices. Un factor que pudo influenciar en dichos resultados se
encuentra ligado al tiempo, por tanto, prolongar el periodo de muestreo permitirá visualizar gráficamente
las fluctuaciones estacionales como elemento determinante en el valor de dichos
índices para los hábitats evaluados (Tobar y col., 2021).
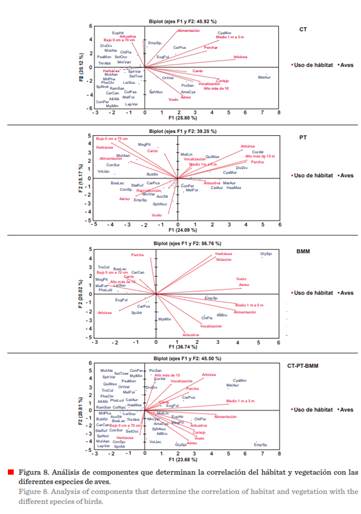
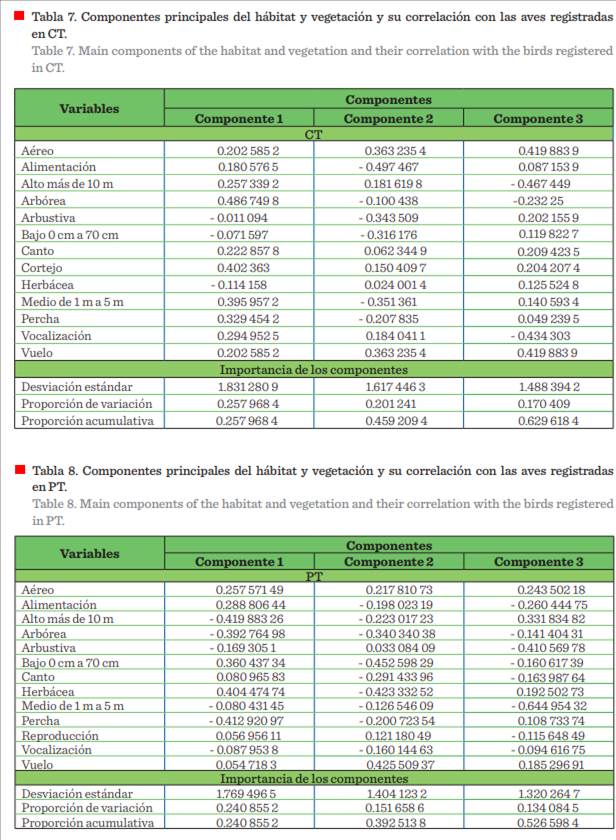
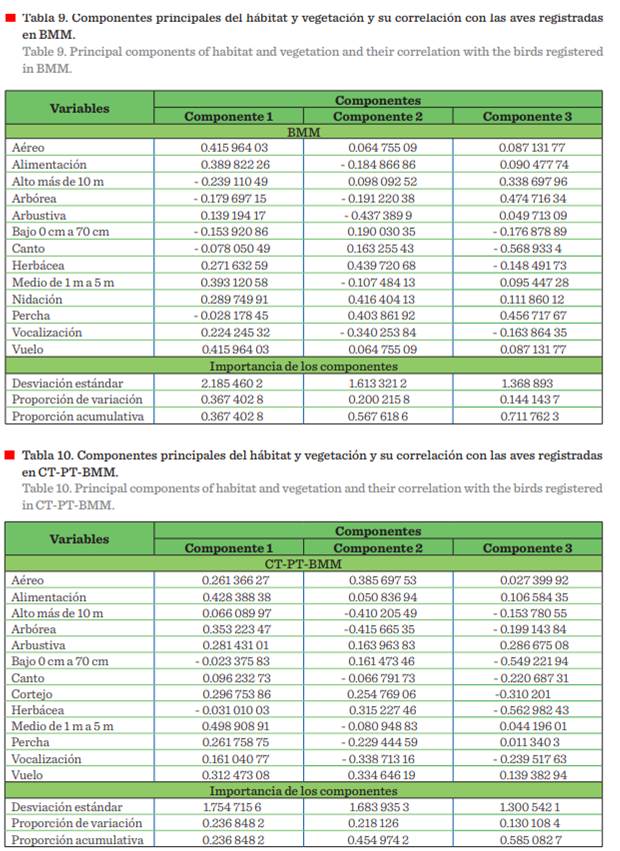
El ACP reportó una proporción de
varianza acumulada en sus tres primeros ejes (componentes); de CT: 62.96 % (Tabla
7); PT: 52.65 % (Tabla 8); BMM: 71.17 % (Tabla 9); y CT-PT-BMM: 58.50 % (Tabla
10). En las tablas mencionadas y en la Figura 8, se explica la variabilidad
presente entre las variables que conforman y determinan la incidencia y uso del
hábitat y vegetación de las aves en los hábitats analizados. Se encontró mayor
correlación del hábitat y vegetación empleado para la
alimentación en el estrato herbáceo y
arbóreo, en alturas de 5 m y 10 m, utilizando el estrato aéreo para vuelo.
Dichos hallazgos han sido detectados
anteriormente, señalando que estos hábitats
también son empleados para la construcción
de nidos, percha, refugio y desplazamiento
(Sánchez y col., 2011; Velásquez y col., 2012; Ordóñez-Delgado y col., 2017;
Alonso y col., 2018; Figueroa y col., 2019; Perez y
col., 2021); no obstante, el presente trabajo es el primero en reportar
especies bajo protección especial alimentándose
en el estrato arbóreo de los SAF referidos; evidenciando cómo la estructura horizontal y vertical
del hábitat en dichos medios de producción
ha desarrollado cierta influencia en el
arribo de especies migratorias y bajo
cierto estatus de conservación, proporcionando recursos que permiten la coexistencia de estas especies.
Lo último coincide con lo reportado por Sánchez (2017) y Medrano-Guzmán
y col. (2020), quienes además hallaron
especies migratorias haciendo uso del
dosel para alimentación y como sitio de descanso. De igual manera, la
relevancia del dosel es soportada por Sáenz y col. (2006) y Narango y col. (2019), quienes mencionaron que esta regula, para algunas especies,
su dinámica y estructura poblacional, tal
como se observó en ciertos individuos de Pionus
senilis, los cuales se detectaron en el dosel perchando
y algunos reproduciéndose. Se propone la
implementación de buenas prácticas de
manejo agroforestal que permitan la diversificación de estratos y sustratos como elementos del
hábitat que coadyuven a la conservación de especies; de igual forma, cuidar el
Bosque Mesófilo de Montaña y no permitir su
degradación, para garantizar la coexistencia de especies con hábitos especialistas.
CONCLUSIONES
La estructura y composición florística
y del hábitat son elementos determinantes en la riqueza y diversidad de aves insectívoras.
Por ello, se puntualiza la importancia que presentan los sistemas agroforestales examinados en el aprovisionamiento de nichos de utilización para alimentación, nidación y reproducción, que coadyuvan a la
conservación de especies amenazadas, bajo protección especial y migratoria. Se propone
para futuras investigaciones contemplar el efecto estacional como un factor determinante en los valores de riqueza y diversidad para los hábitats en esta región particular de México.
AGRADECIMIENTOS
Al Consejo Nacional de Ciencia y Tecnología por el
financiamiento para el desarrollo de este proyecto.
Referencias
Adame,
D., Legaspi, A. y Jiménez-Piedragil,
C. (2019). Avifauna del parque estatal Cerro de la Tortuga, Morelos, México. Revista
Mesoamericana. 23(1): 1-16.
Alonso,
T. Y., Hernández, M. F. R. y Barrero, M. H. (2018). Diversidad de aves residentes
y permanentes asociadas a un pinar natural de Pinus
tropicalis y su relación con la estructura
vertical de la vegetación. Revista Cubana de Ciencias Forestales. 6(1):
31-44.
Botero,
L. y De-la-Ossa, J. (2011). Fauna silvestre asociada a ganado vacuno doble
propósito en sistema de silvopastoreo, Pinto,
Magdalena, Colombia. Revista MVZ Córdoba. 16(3): 27332741.
Bueno,
H. P., Sánchez, C. I., Velásquez, V. M. A., Esquivel, A. G. y Palomo, R. M.
(2015). Caracterización de la vegetación de una microcuenca ubicada en la parte
media de la RH36. Agrofaz. 15(1): 143-149.
Chará, J., Rivera, J., Barahona, R., Murgueitio, E., Calle, Z., and Giraldo, C. (2019). Intensive silvopastoral systems with Leucaena
leucocephala in Latin America. Tropical Grasslands-Forrajes Tropicales.
7(4): 259-266.
Cipriano-Anastasio,
J., López-Mancilla, A., Cabrera-Martínez, D. y Capistrán-Barradas,
A. (2017). Riqueza y diversidad de aves en un paisaje Agropecuario en el ejido Chalahuiyapa, Huejutla, Hidalgo. Revista Científica Biológico
Agropecuaria. 5(1): 105-111.
Connell, J. H. (1978). Diversity in tropical rain
forests and coral reefs. Science. 199(4335): 1302-1310.
Colwell, R. K. (2013). Statistical estimation of
species richness and shared species from samples. Version 9.1.0 user guide and
applications. University of Connecticut, Storrs, C. F. [En
línea]. Disponible en:
http://viceroy.eeb.uconn.edu/estimates. Fecha de consulta: 20 de abril de 2019.
Cubley, E., Bateman, H., Riddle, S., Holmquist-Johnson, C., and Merritt, D.
(2020). Predicting Bird Guilds Using Vegetation Composition and Structure on a
Wild and Scenic River in Arizona. Wetlands. 40(1): 1829-1842.
Da-Ponte, E., Mack, B., Wohlfart, C., Rodas, O.,
Fleckenstein, M., Oppelt, N., ..., and Kuenzer, C. (2017). Assessing forest
cover dynamics and forest perception in the Atlantic Forest of Paraguay, combining remote sensing and house hold
level data. Forests. 8(10): 1-21.
Espejo, N. y Morales, N. (2019). Variación de la
diversidad taxonómica y funcional de la fauna en un bosque seco tropical (bs-T)
en diferentes estados de sucesión en el sur del Valle del Magdalena, Huila,
Colombia. Caldasia. 41(1): 108-123.
Figueroa,
S. B., Pimentel, L. J., Ugalde, L. S., Figueroa, R. O. L., Figueroa, R. K. A. y
Tarango, A. L. A. (2019). Aves en sistemas agrícolas
con labranza de conservación en el centro-norte de México. Revista Mexicana
de Ciencias Agrícolas. 22: 31-42.
Fuentes-Moreno,
A., Mogollón-Serrano, M., Servín-Torres, J. L., Serna-Lagunes,
R., Leyva-Ovalle, O. R., Llarena-Hernández, R. C.,
... y García-Martínez, M. A. (2020). Diversidad de aves en un paisaje antrópico
en el centro del estado de Veracruz, México. Tropical and Subtropical Agroecosystems. 23(1): 1-14.
Galicia,
G. M. T., Romero, B. E. I., Mera, O. G. y López, V. J. (2019). Efecto del hábitat
sobre la avifauna del sistema lagunar costero La Joya-Buenavista, Chiapas,
México. Ecosistemas y Recursos Agropecuarios. 6(17): 317-331.
García,
M. L. E., Valdez, H. J. I., Luna, C. M. y López, M. R. (2015). Estructura y
diversidad arbórea en sistemas agroforestales de café en la Sierra de Atoyac,
Veracruz. Madera y Bosques. 21(3): 69-82.
García-Flores,
A., Mojica-Pedraza, S., Barreto-Sánchez, S. D., Monroy-Ortiz, C. y Monroy-Martínez,
R. (2017). Estudio etnozoológico de las aves y
mamíferos silvestres asociados a huertos frutícolas de Zacualpan de Milpas,
Morelos, México. Revista de Ciencias Ambientales. 51(2): 110-132.
García-Núñez,
R. M., Romero-Díaz, C., Ugalde-Lezama, S. y Tinoco-Rueda, J. A. (2020).
Vegetación y estructura del hábitat que determina la dieta de aves insectívoras
en sistemas agroforestales. Revista Mexicana de Ciencias Agrícolas.
11(4): 853-864.
Guzmán-Manrique, J. y Flórez-García, A.
(2019). Fragmentación del paisaje empleando análisis multitemporal
de imágenes de satélite Landsat TM y ETM+ en el municipio
de Montelíbano, Córdoba-Colombia. Gestión y
Ambiente. 22(1): 31-41.
Haggar, J., Pons, D., Saenz, L., and Vides, M. (2019). Contribution of
agroforestry systems to sustaining biodiversity in fragmented forest
landscapes. Agriculture, Ecosystems and Environment. 283(1): 1-8.
Hanski, I. (1999). Metapopulation Ecology. Oxford
Series in ecology and Evolution. Gran Bretaña: Oxford University Press. 313
Pp.
Huang, R., Pimm, S., and Giri, C. (2020). Using
metapopulation theory for practical conservation of mangrove endemic birds. Conservation Biology. 34(1): 266-275.
Ibarra,
F. de M. M. y Cruzado, C. E. (2017). Avistamiento de aves en el Campus de la
Universidad Ricardo Palma, Lima, Perú. Biotempo. 14(2): 89-99.
Lopes, L., Fernandes, A., Medeiros, M., and Marini, A.
(2016). A classification scheme for avian diet types. Journal Field Ornithology. 87(3): 309-322.
López-Segoviano,
G., Díaz-Verduzco, L., Arenas-Navarro, M. y Arizmendi, M. (2019). Diversidad
estacional de aves en una región prioritaria para la conservación en el centro
oeste de la Sierra Madre Occidental. Revista Mexicana de Biodiversidad.
90(1): e902754.
MacArthur, R. H. and Wilson, E. O. (1967). The
theory of island biogeography. New Jersey, United States: Princeton
University Press. 203 Pp.
Marconi, L. and Armengot, L. (2020). Complex
agroforestry systems against biotic homogenization: The case of plants in the
herbaceous stratum of cocoa production systems. Agriculture, Ecosystems & Environment.
287(1): e106664.
Medrano-Guzmán,
A., Enríquez, P., Zuria, I. y Castellanos-Albores, J.
(2020). Riqueza y abundancia de aves en áreas verdes en la ciudad de San
Cristóbal de las Casas, Chiapas, México. Revista Peruana de Biología.
27(2): 169-182.
Molina,
D., Torres, G. J. y Avelarde, G. M. (2012). Riqueza
de aves del Área Natural Protegida Estero El Salado, Puerto Vallarta, Jalisco,
México. Huitzil. 13(1): 22-38.
Morales,
A., Lizcano, D., Montoya, S., Velásquez, Á., Álvarez, E. y Acevedo-Charry, O. (2021). Diferencias en paisajes sonoros de
sistemas silvopastoriles y potreros tradicionales del
piedemonte llanero, Meta, Colombia. Biota Colombiana. 22(1): 74-95.
Morales-Martínez,
I., Pech-Canché, J. M., Gutiérrez-Vivanco, J., Serrano, A. y
Hernández-Hernández, V. H. (2018). Aves
de Tuxpan, Veracruz, México: diversidad y complementariedad. Huitzil, Revista Mexicana de Ornitología.
19(2): 210-226.
Moreno,
C. E. (2001). Métodos para medir la biodiversidad. M&T– Manuales y Tesis
SEA. Zaragoza, España: Ed. CYTED, ORCYT/UNESCO & SEA. 84 Pp.
Naoki, K., Gómez, M. I. y Schneider, M.
(2017). Selección de diferentes sistemas de producción de cacao (Theobroma cacao, Malvaceae) por
aves en Alto Beni, Bolivia - una prueba de cafetería en el campo. Ecología
en Bolivia. 52(2): 100-115.
Narango,
D., Tallamy, D., Snyder,
K., and Rice, R. (2019). Canopy tree preference by insectivorous birds in
shade-coffee farms: Implications for migratory bird conservation. Biotropica. 51(3): 387-398.
Navarro, S. A. G., Rebón, G. M.
F., Gordillo, M. A., Peterson, A. T., Berlanga, G. H. y Sánchez, G. L. A.
(2014). Biodiversidad de aves en México. Revista Mexicana de Biodiversidad.
85(1): 476-495.
Nell, C., Abdala-Roberts, L., Parra-Tabla, V., and Mooney, K. (2018). Tropical tree diversity
mediates foraging and predatory effects of insectivorous birds. Proceedings
Royal Society Publishing B. 285(1): 1-7.
Nyffeler, M., Şekercioğlu, C., and Whelan, C. (2018).
Insectivorous birds consume an estimated 400–500 million tons of prey annually.
The Science of Nature. 105(1): 47.
Olsen, J., Judge, D., Trost, S., Rose, A., and Debus,
S. (2018). Diets of breeding Brown Goshawks Accipiter fasciatus and Collared
Sparrowhawks A. cirrocephalus near Canberra, Australia and comparisons with
other regions and raptors. Corella. 42(1): 18-28.
Ordóñez-Delgado,
L., Freile, J. F., Guevara, E. A., Cisneros-Heredia, D. y Santander, T. (2017).
Memorias de la V Reunión Ecuatoriana de Ornitología. Revista Ecuatoriana de
Ornitología. 1(1): 1-38.
Ortiz-Pulido,
R. (2018). ¿Qué especies de aves están en riesgo en México? Huitzil,
Revista Mexicana de Ornitología. 19(2): 237-272.
Perez, J., Faria,
D., and Morante-Filho, J. C. (2021). Landscape composition is more important than local
vegetation structure for understory birds in cocoa agroforestry systems. Forest Ecology and Management. 481(1): 1-9.
Pérez,
B. S. H., Hernández, M. F. R., Pérez, H. A. y Cué, R.
M. (2015). Diversidad y abundancia de ensamblajes de aves asociadas a bosques semideciduos y pino encino del parque nacional viñales. Revista
Cubana de Ciencias Forestales. 4(1): 2-17.
Ponce,
C. L. P., Aguilar, V. B. C., Rodríguez, T. D. A., López, P. E. y Santillán, P.
J. (2012). Influencia del fuego sobre la riqueza y diversidad de aves en un
bosque templado en Puebla. Revista Mexicana de Ciencias Forestales.
3(10): 65-76.
Ramírez-Albores,
J. (2006). Variación en la composición de comunidades de aves en la Reserva de
la Biosfera Montes Azules y áreas adyacentes, Chiapas, México. Biota Neotropica. 6(2): 1-19.
Ramírez-Albores,
J. (2010). Diversidad de aves de hábitats naturales y modificados en un paisaje
de la Depresión Central de Chiapas, México. Revista de Biología Tropical.
58(1): 511-528.
Ramos,
R. R., Sánchez, H. R. y Gama, C. L. M. (2016). Análisis de cambios de uso del
suelo en el municipio costero de Comalcalco, Tabasco, México. Ecosistemas y
Recursos Agropecuarios. 3(8): 151-160.
Sáenz,
J. C., Villatoro, F., Ibrahim, M., Fajardo, D. y Pérez, M. (2006). Relación
entre las comunidades de aves y la vegetación en agropaisajes
dominados por la ganadería en Costa Rica, Nicaragua y Colombia. Agroforestería en las Américas. 45(1): 37-48.
Salas,
Á. D. y Mancera-Rodríguez, N. J. (2020). Aves como indicadoras ecológicas de
etapas sucesionales en un bosque secundario,
Antioquia, Colombia. Revista de Biología Tropical. 68(1): 23-39.
Sánchez,
C. V. (2017). Uso de hábitat de aves migratorias en el bosque sucesional de Cocha Cashu (Río
Manu, Perú). Revista Científica de la Facultad de Ciencias Biológicas.
37(1): 36-45.
Sánchez,
D., Vilchez, S. J. y DeClerck,
E. (2011). Complementariedad de la vegetación como provisión de recursos para
la comunidad de aves en el agropaisaje de Copán
Ruinas, Honduras. Agroforestería en las
Américas. 48(1): 130-136.
Sánchez,
G., Gosálvez, R. U. y Florín, M. (2018). Análisis de metapoblaciones de aves acuáticas en la Mancha Húmeda:
importancia de la disponibilidad de humedales. Cuadernos Geográficos.
57(2): 92-112.
Sandoval,
L. (2019). Variación mensual y anual de la riqueza y abundancia de aves en un
mosaico agrícola periurbano tropical. Biología Tropical. 67(2): 298-314.
Santos,
B. A. R., Hernández, R. A. L., Lavariega, M. C. y
Gómez, U. R. M. (2013). Diversidad de aves en cultivares de Santa María Yahuiche, Sierra Madre de Oaxaca, México. Revista
Mexicana de Ciencias Agrícolas. 6: 1241-1250.
SAS, Statistical Analysis System (2009). JMP version 8.0.2.
SAS Institute. Cary,
NC, USA. [En línea]. Disponible en: https://www.jmp.com/es_mx/download-jmp-free-trial.html.
Fecha de consulta: 20 de abril de 2019.
SEMARNAT,
Secretaría de Medio Ambiente y Recursos Naturales (2010). Norma Oficial
Mexicana NOM-059-SEMARNAT-2010, Protección ambiental– Especies nativas de
México de flora y fauna silvestres– Categorías de riesgo y especificaciones
para su inclusión, exclusión o cambio– Lista de especies en riesgo, en Diario
Oficial de la Federación. [En línea]. Disponible en: https://www.dof.gob.mx/nota_detalle.php?codigo=5578808&fecha=14/11/2019.
Fecha de consulta: 6 de febrero de 2021.
Sherry, T., Kent, C., Sánchez, N., and Şekercioğlu, C. (2020). Insectivorous birds in the
Neotropics: Ecological radiations, specialization, and coexistence in
species-rich communities. The Auk:
Ornithological Advances. 137(1):1-27.
Sommer, N., Moody, N. M., Lantz, S. M., Leu, M.,
Karubian, J., and Swaddle, J. P. (2018). Redbacked fairywrens adjust habitat
use in response to dry season fires. Austral Ecology. 43(8): 876-889.
Sow, A., Seye, D., Faye, E., Benoit, L., Galan, M.,
Haran, J., and Brévault, T. (2020).
Birds and bats contribute to natural regulation of the millet head miner
in tree-crop agroforestry systems. Crop Protection. 132(1): 1-8.
Tarbox, B., Robinson, S., Loiselle, B., and Flory, L.
(2018). Foraging ecology and flocking behavior of insectivorous forest birds
inform management of Andean silvopastures for conservation. The Condor Ornithologycal Applications.
120(1): 787-802.
Tobar,
C., Meier, D., Rau, J.,
Ríos-Henríquez, C., Pavés, H. y Santibáñez, A. (2021). Variación estacional de
aves en el humedal de Trumao, centro-sur de Chile. Iheringia Série Zoológica. 111 (1):
e2021002.
Tomasevic, J. A. and Marzluff, J. M. (2020). Roosting,
reproduction, and survivorship of Pileated Woodpeckers (Dryocopus pileatus)
in a suburban setting. Avian Conservation and Ecology.
15(1): 13.
Velásquez,
V. A. Ricaurte, L. F., Lara, F., Cruz, E. J., Tenorio, G. A. y Correa, M. (2012).
Lista anotada de las aves de los humedales de la parte alta del Departamento de
Caqueta. Manejo de fauna silvestre en Amazonía y
Latino-américa. 1(1): 320-329.
Vilchez, S. J., Harvey, C., Sánchez, D.,
Medina, A. y Hernández, B. (2017). Diversidad de aves en un paisaje fragmentado
de bosque seco en Rivas, Nicaragua. Encuentro. 1: 60-75.
Villavicencio-Enríquez,
E. (2012). Caracterización agroforestal en sistemas de café tradicional y
rústico, en San Miguel, Veracruz, México. Revista Chapingo Serie Ciencias
Forestales y del Ambiente. 19(1): 67-80.
Wilcox, B. A. and Murphy, D. D. (1985). Conservation
Strategy: The effects of fragmentation on extinction. The American
Naturalist. 125(6): 879-887.
XLSTAT, Software de Análisis
Estadístico (2018). Statistical and Data Analysis Solution,
by Addinsoft, version 2018.7.5. [En
línea]. Disponible en: https://www.xlstat.com. Fecha de consulta: 20 de abril de 2019.
Xu, Y., Si, Y., Wang, Y., Zhang, Y., Prins, H. H. T.,
Cao, L., and De-Boer, W. F. (2019). Loss of functional connectivity in
migration networks induces population decline in migratory birds. Ecological Applications. 29(7): 1-10.
Yashmita-Ulman, S. y Kumar, A. (2018). Sistemas agroforestales
como hábitat para especies de aves: evaluación de su papel en la conservación. Actas
de la Sociedad Zoológica. 71(1): 127-145.