Alternativas para el
aprovechamiento del cuajilote (Parmentiera edulis): una especie agroindustrial subutilizada
Alternatives for the use of cuajilote (Parmentiera edulis): an underutilized agro-industrial species
Alternativas de uso para
el cuajilote (Parmentiera edulis)
Román Castillo-Ruíz1, José Abelardo Castillo-Archila2,
SanJuana Elizabeth Alemán-Castillo1, Octelina Castillo-Ruiz1, Gabriela Nallely
Trejo-Díaz2*
*Correspondencia: gabriela.trejo@unicach.mx/Fecha de recepción: 8 de octubre de 2021/Fecha de aceptación: 8 de julio de 2022/Fecha de publicación: 21 de julio de 2022.
1Universidad Autónoma de Tamaulipas, Unidad Académica Multidisciplinaria
Reynosa-Aztlán, Laboratorio de Seguridad Alimentaria y Nutrición, Reynosa,
Tamaulipas, México. 2Universidad de Ciencias y Artes de Chiapas,
Facultad de Ciencias de la Nutrición y Alimentos, Libramiento Norte Poniente
s/n, col. Lajas Maciel, Tuxtla Gutiérrez, Chiapas, México, C. P. 29000.
Resumen
El fruto
de la especie Parmentiera edulis, conocida como cuajilote, se produce de forma
abundante por temporada, es rico en nutrientes y puede ser aprovechado para
elaborar alimentos. El objetivo de este trabajo fue establecer la viabilidad
técnica de utilizar el cuajilote en la formulación
de alimentos y bebidas fermentadas
para promover su aprovechamiento comercial. Se determinó la composición
nutricional, el contenido fenólico y su
capacidad antioxidante. Los frutos se deshidrataron y se obtuvo una
harina que se mezcló al 0 % (control), 5 %, 10 % y 15 % con harina de maíz,
para preparar tortillas, y se evaluó su
composición nutricional y aceptación organoléptica. También, se elaboró
una bebida fermentada y una bebida destilada, usando Sacharomyces
cereviseae, a partir de pulpa de fruta con y sin
cáscara. Los mostos para la bebida fermentada se pasteurizaron a 72 ºC/15 s. El fruto presentó alto contenido de proteína (6.5
± 2.5 %) y fibra (3.9 ± 1.6 %), de compuestos fenólicos y capacidad antioxidante.
En las tortillas, al aumentar la cantidad de cuajilote se elevó la cantidad de fibra y proteína. Sensorialmente, las tortillas adicionadas con 5 %
y 10 % de cuajilote fueron mejor aceptadas. En la bebida fermentada no se
encontró diferencia significativa en sus parámetros fisicoquímicos al
elaborarla con y sin cáscara, excepto para la acidez total. Tampoco modificó el
rendimiento de producción de bebida fermentada o de alcohol destilado. El cuajilote es
un fruto poco incorporado a la dieta que presenta propiedades funcionales nutricionales adecuadas y puede ser
aprovechado como materia prima en la elaboración de tortillas, aumentando su
valor nutricional o para producir bebidas fermentadas o alcohol etílico.
Palabras
clave: cuajilote, tortilla de
maíz, bebida fermentada, alcohol etílico.
Abstract
The fruit of the species Parmentiera
edulis, known as cuajilote,
is abundantly produced per season, is rich in nutrients and can be used to make
food. The objective of this work was to establish the technical feasibility of using cuajilote
in the formulation of fermented foods and
beverages to promote its commercial use. The nutritional composition, the phenolic content and its
antioxidant capacity were determined. The fruits were dehydrated and a flour was obtained that
was mixed at 0 % (control), 5 %, 10 % and 15 % with corn flour, to prepare
tortillas, and its nutritional composition and organoleptic acceptance were
evaluated. Also, a fermented beverage and a distilled beverage were elaborated,
using Saccharomyces cereviseae, from fruit pulp with and without shell. The musts for the
fermented beverage were pasteurized at 72 ºC/15 s. The fruit presented a high content of protein (6.5
± 2.5 %) and fiber (3.9 ± 1.6 %) of phenolic compounds and antioxidant
capacity. In tortillas, increasing the amount of cuajilote
increased the amount of fiber and protein. Sensorially, the tortillas added
with 5 % and 10 % cuajilote were better
accepted. In the fermented beverage, no significant difference was found in its physicochemical parameters when it was made
with and without shell, except for total acidity. Nor did it modify the
production yield of fermented beverage or distilled alcohol. Cuajilote is a fruit rarely incorporated into the diet that has adequate functional and nutritional
properties and can be used as a raw material in the manufacture of tortillas,
increasing its nutritional value or to produce fermented beverages or ethyl
alcohol.
Keywords: cuajilote, corn tortilla,
fermented drink, ethyl alcohol.

Introducción
Los modernos y actuales sistemas alimentarios tienen patrones de
consumo. Por ejemplo, los cultivos de cereales más usados son el arroz, trigo,
maíz, mijo y sorgo. Las especies animales mayormente explotadas son las vacas,
ovejas, cabras, cerdos y pollo. En el caso de los peces, son 10 las especies más capturadas, lo que aumenta la vulnerabilidad de los sistemas
alimentarios para obtener una nutrición adecuada, de acuerdo con la
Organización de las Naciones Unidas para la Alimentación y la Agricultura (FAO,
por sus siglas en inglés: Food and agriculture Organization of the United Nations)
(FAO, 2018).
Generalmente las políticas agrícolas y/o los mercados, favorecen a las variedades
de cultivos básicos y de alto rendimiento,
aunque saliendo de los
patrones alimenticios de consumo se puede encontrar una basta biodiversidad que provee los alimentos necesarios para el
bienestar humano (Doval, 2019). Actualmente, ha surgido un interés para las
especies subutilizadas que frecuentemente pasan desapercibidas (Rudebjer y col., 2014). Diversos beneficios
potenciales en seguridad alimentaria,
desarrollo de nuevos productos y la obtención de compuestos bioactivos
de los cultivos de dichas especies, son
razones para conservar la agrobiodiversidad, la cual recibe poca atención,
tanto a nivel nacional como internacional (Johns, 2004). Sin embargo, a nivel local, en las comunidades rurales, estas especies subutilizadas, constantemente con amenaza de
extinción, por el poco conocimiento de sus usos, pueden cumplir un papel fundamental para mejorar la calidad de vida, en
cuanto a nutrición, salud y en la generación de ingresos (Sánchez y col., 2014; Padulosi y
col., 2019). El interés por la búsqueda de alimentos funcionales que
brinden beneficios a la salud ha aumentado
en los últimos años, destacan entre
ellos los de origen vegetal, que tienen un amplio contenido de nutrientes y componentes fitoquímicos diversos, que han demostrado efectos fisiológicos positivos en el organismo humano
(Barrientos-Ramírez y col., 2019; Perfilova y col.,
2020).
La especie Parmentiera edulis es un árbol de traspatio
o silvestre que puede medir de 4 m a 10 m de altura. Es nativa de América Central: México, Belice, Costa Rica, El Salvador, Guatemala
y Honduras (Lim, 2012). En México, es posible encontrarla desde las costas del
golfo de México hasta las del océano
Pacífico. Su producción inicia de 2 a 3 años después del trasplante, con un
rendimiento aproximado de 1 000 a 2 000
frutos al año y forma parte de la vegetación
nativa (Morales-Sánchez y col., 2015). Su fruto comúnmente conocido con
el nombre de “cuajilote, turi, platanillo o pepino de árbol”, pertenece a la familia de las Bignoniaceae (Domínguez-Orta y
Herrera-Martínez, 2018). El fruto es
cilíndrico, recto o curvo, de color
verde y amarillo cuando está maduro, con colores pardos y rojizos en
estados de madurez avanzada. Puede medir de
10 cm a 30 cm. Es jugoso y con sabor dulce, el peso promedio oscila
entre 130 g y 200 g (Álvarez-Olivera y col., 2010; Domínguez-Orta y
Herrera-Martínez, 2018; Juárez-Martínez y col., 2019). La pulpa es fibrosa, de color blanquecino, con numerosas semillas de color negro.
El cuajilote es utilizado como fuente alimenticia complementaria para
potenciar la cría de ganado bovino tropical
(Palma y col., 2019). En México, se
les atribuye uso medicinal a la fruta, corteza, flor y raíz de la
planta, para tratar dolor de cabeza, cálculos biliares, gastroenteritis, gripe o tos, entre otros (Lim, 2012; Estanislao y col., 2016). Sin embargo, su aprovechamiento actual es bajo, debido a que es un fruto de temporada y se pierde por el exceso de humedad, sin poder almacenarse por largos periodos
(Vicente-Flores y col., 2018). En cuanto a su composición nutricional,
contiene fibra cruda, proteína, grasa y extracto libre de nitrógeno, además de
un alto contenido de micronutrientes, como vitamina C, Fe, Zn y Cu
(Álvarez-Olivera y col., 2010; Morales-Sánchez y col., 2015).
El maíz es
el alimento básico en México, además de tener un fuerte contenido socio-cultural, la forma en que se puede consumir varía
enormemente (Massieu-Trigo y Lechuga-Montegro,
2002). Aunque la tortilla de maíz es el producto más importante de la
dieta y la principal forma de consumo de
este cereal (Rodríguez-Calderón y col., 2017). Se estima que 94 % de los mexicanos ingieren tortilla de maíz de
manera regular y les aporta aproximadamente
el 45 % de las calorías diarias (Escobedo-Garrido
y Jaramillo-Villanueva, 2019). Es también fuente importante de proteínas, calcio,
fibra y energía (Chávez-Santoscoy y col., 2016). El
Sistema Mexicano de Alimentos Equivalentes
reporta que una pieza de tortilla aporta 64 kcal, 13.6 g de carbohidratos,
1.4 g de proteínas, 0.5 g de grasa, 0.6 g de fibra, 58.8 mg de calcio y no
contiene sodio (Pérez-Lizaur y col., 2014).
Las bebidas
alcohólicas son el producto resultante de la fermentación alcohólica de
diversas materias primas, especialmente de cereales, frutas u otros productos
con alto contenido de carbohidratos simples, que pueden llevarse a un proceso
posterior de destilación. El contenido alcohólico varía según el tipo de bebida. Para las bebidas alcohólicas destiladas es
de 32 % a 55 % de volumen de alcohol (Alc. Vol) y para las bebidas fermentadas es de 2 % a 20 % Alc. Vol., de acuerdo a la Norma
Oficial Mexicana (NOM-199-SCFI-2017). Los azúcares
simples pueden estar presentes de manera natural o se generan a partir del
procesamiento previo de la materia prima, es
decir, por escisión hidrolítica de
almidones, dextrinas, disacáridos, y otros (Sánchez y Cardona, 2005).
Las
bebidas alcohólicas más consumidas incluyen
las bebidas fermentadas, como la cerveza,
el vino y la sidra; y bebidas fermentadas-destiladas como el tequila, el
whisky y el vodka
(Peña y Arango, 2009). El etanol obtenido por procesos fermentativos además
de su uso en bebidas alcohólicas,
puede utilizarse para la producción de energía y aplicaciones diversas en otras ramas industriales, como la agroalimentaria,
farmacéutica y química, por mencionar algunas (Vázquez y Dacosta,
2007).
Las
materias primas son un elemento clave en la producción de alcohol, en cuyo
caso, se prefieren materiales con abundante contenido de azúcares fermentables
o complejos de fácil degradación (Arumugam y col.,
2011). Históricamente, las materias primas más utilizadas han sido la caña de azúcar y la remolacha azucarera, que contienen una alta biodisponibilidad de
azúcares fermentables. Los granos de maíz y de trigo representan otra fuente
importante aprovechable. Los tubérculos, específicamente las papas, suelen ser
materias primas destinadas a la producción
de alcohol (Alonso-Gómez y Bello-Pérez, 2018). En general, cualquier
residuo orgánico vegetal o recurso lignocelulósico puede ser utilizado como
materia prima para la fermentación, siempre
y cuando se someta a procesos degradativos que permitan generar cantidades importantes de azúcares fermentables (Vázquez y Dacosta,
2007). Estos últimos han sido motivo de estudio gracias a su extraordinaria abundancia, ya sea porque se trata de residuos de la actividad agroindustrial,
agrícola o forestal, o por el hecho
de que son materias primas con bajos costos de adquisición (Almenares-Verdecia y Serrat-Díaz, 2008). El uso del cuajilote como
materia prima para la producción de alcohol podría ser una alternativa dada su composición química y por el
hecho de ser un producto agrícola abundante en
algunas regiones, por temporada. Se puede encontrar en huertos
familiares o cerca de las viviendas,
a la orilla de caminos, en parcelas agrícolas, cercos ganaderos, agostaderos y
dispersa en potreros. Es considerado para
los humanos y para el ganado de traspatio como soporte de la seguridad
alimentaria (Torres-Rivera, 2018).
El objetivo de este trabajo fue establecer la viabilidad de aprovechar el
cuajilote como materia prima en la formulación de diferentes productos alimenticios y bebidas fermentadas para
su aprovechamiento comercial.
MATERIALES Y
MÉTODOS
Obtención
del fruto
Los frutos
fueron recolectados en el municipio de Suchiapa, Chiapas, México, en la
temporada de verano (agosto-septiembre 2020). Se utilizaron frutos sin
magulladuras, sin picaduras de insectos, en
estado de madurez óptimo, limpios y desinfectados.
Análisis
composicional del fruto
Se trabajó
con una muestra de 5 g de fruto para realizar análisis basados en los métodos
de la Asociación de Químicos Analíticos Oficiales (AOAC, por sus siglas en inglés: Association of Official Analytical Chemists) (AOAC,
1995). El contenido total de proteínas se determinó utilizando el método de Kjeldhal (método oficial
950.36), junto con la humedad (método oficial 935.36), cenizas (método oficial
950.22), fibra (método oficial 950.37) y grasa (método oficial 935.38). El extracto libre de nitrógeno se calculó por diferencia. Los análisis se realizaron
por triplicado.
Elaboración
de los extractos de cuajilote
Los extractos se obtuvieron para el análisis de fenoles totales y
capacidad antioxidante. Se pesaron 1.25 g de muestra seca de cuajilote y se les
agregaron 25 mL de solución (agua, metanol y etanol 50/50 v/v). Se
procedió a extraer los compuestos de interés mediante tres métodos
diferentes, maceración (90 min/60 °C/150 rpm), ultrasonido (90 min/60 °C) y soxleth (90 min/ 60
°C). Posteriormente se filtraron los
extractos (Watman N° 40) y centrifugaron
(LABNET HERMLE Z-323-K, Alemania) a 10 000 rpm/10 min a 4 °C. El sobrenadante
se almacenó en viales en condiciones
de oscuridad hasta su uso. Las muestras obtenidas conteniendo compuestos
fenólicos solubles se denominaron extracto acuoso de cuajilote (EAC), extracto metanólico de cuajilote
(EMC) y extracto etanólico de cuajilote (EEC).
Cuantificación
de fenoles totales del fruto de cuajilote
El contenido de fenoles totales del fruto de cuajilote
se determinó espectrofotométricamente por el método de Folin-Ciocalteu según Parola-Contreras y col. (2021),
utilizando ácido gálico como estándar. Se mezclaron 140 mL
del extracto EAC, EMC y EEC (0.5 mg/mL) con 460
mL de agua destilada y 250 mL
del reactivo de Folin-Ciocalteu (1 N). Después de 5
min, se añadieron 1 250 mL de carbonato de sodio al
20 % (peso/volumen). La mezcla se agitó en un vortex y se incubó durante 2 h en la oscuridad. La absorbancia se midió a 760
nm. Los resultados se expresaron en mg
equivalentes de ácido gálico por gramo de peso fresco (mg de
EAG/g).
Capacidad
antioxidante del fruto de cuajilote
Para la
evaluación de la capacidad antioxidante se utilizó el método radical
1,1-difenil-2-picrilhidrazil (DPPH) y el
método radical libre 2,2-azinobis
(3-etilbenzotiazoline-6-ácido sulfónico) (ABTS). Para determinar DPPH, se empleó
el método reportado por Ordoñez-Gómez y col. (2018), 100 mL
de extractos de las muestras (0.5 mg/mL a 5 mg/mL) se hizo
reaccionar con 900 mL de DPPH (Sigma) a 100 mM en ambiente oscuro y se registró la absorbancia a 517 nm
(Espectro-fotómetro Velab®,
VE-5100UV, México) después de 6 min, en la que se observó valor de absorbancia
constante. El porcentaje de inhibición del radical DPPH fue calculado con la
ecuación:
% Inhibición DPPH = [(Ac – Am)/Ac] x 100
Donde:
Ac:
Absorbancia del control
Am:
Absorbancia de la muestra en función del tiempo (5 min)
En el método ABTS, la actividad eliminadora
de radicales (ARSA, por sus siglas en inglés: ABTS radical scavenging activity) de las
muestras se determinó según el método descrito por Parola-Contreras y col.
(2021). Se generó el radical catiónico ABTS mezclando la solución madre de ABTS
(7 mM) con persulfato
de potasio (2.45 mM). Y se dejó reposar en la oscuridad durante 16 h a temperatura ambiente.
Luego, la solución radical ABTS se diluyó en solución
salina tamponada con fosfato (PBS, 0.15 M, pH 7.4) para obtener una absorbancia
de 0.70 ± 0.02 nm a 734 nm. Para el ensayo se
mezclaron 230 mL de esta solución diluida con 20 mL del extracto (EAC, EMC y EEC). La absorbancia se
midió a 730 nm de 1 min a 6 min después de la mezcla inicial, en condiciones de oscuridad. Se usó PBS en lugar
de ABTS para el blanco. Se utilizó agua destilada en lugar del extracto para el
control. El ARSA se calculó mediante la
siguiente ecuación:
ARSA (%) =
[1−(Amuestra −Ablanco/Acontrol)]
× 100
Donde:
A = es el
valor de absorbancia a l 730 nm.
Obtención
de la harina de cuajilote
Los frutos
se cortaron en rodajas para deshidratar las en horno de convección a 60 ºC. Se molieron en una licuadora industrial hasta obtener
la harina de cuajilote (HC) y se tamizó usando malla n°
40, para la homogenización del tamaño de partícula.
Elaboración
de tortilla de maíz con cuajilote
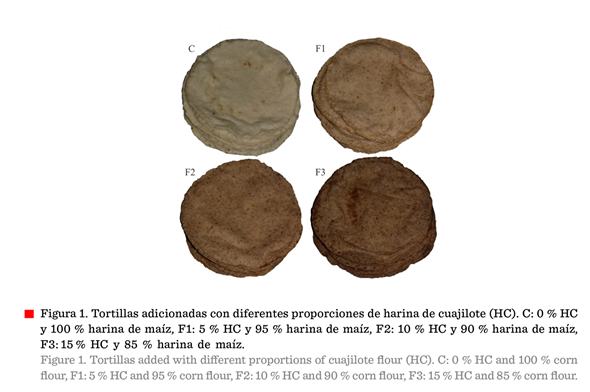
Se diseñaron 4 formulaciones, identificadas como F1 (5 % harina de
cuajilote y 95 % harina de maíz), F2 (10 % harina de cuajilote y 90 % harina de maíz) F3 (15 %
harina de cuajilote y 85 % harina de maíz), y control (100 % harina de maíz)
(Figura 1). Las dos harinas (cuajilote y maíz) se mezclaron uniformemente, para
posteriormente hidratarse al 55 % de humedad hasta obtener una masa suave, con la cual se elaboraron tortillas de
12 cm de diámetro, con un peso de 30 ± 2 g y un espesor de 1.8 mm. Se cocieron y se almacenaron a temperatura ambiente (27 °C) en bolsas de polietileno
para proceder con la evaluación de las características físicas de las
tortillas.
Evaluación
de las características físicas de las tortillas
Para
evaluar la rolabilidad, las muestras de tortillas se
enrollaron alrededor de una varilla de madera (4 cm de diámetro) para
determinar el grado de rotura, de acuerdo con la escala subjetiva de 1 a 5 (1 = 0 %, 2 = 25 %, 3 = 50 %, 4 = 75 % y 5 = 100 % de rotura).
Se midió el inflado de las tortillas durante la cocción,
utilizando una escala subjetiva de 3 puntos (1 = inflado completo,
aproximadamente 70 % a 100 %; 2 = inflado medio, aproximadamente 40 % a 69 %; y
3 = sin inflado, aproximadamente 0 % a 39 %) (Hernández-Chávez y col., 2019).
Color
Se utilizó
un colorímetro Hunter Lab Mini scan
XE Plus previamente calibrado (Modelo
45/0-L; Hunter Assoc., Reston,
VA., EE. UU.), para obtener por triplicado
las variables de color luminosidad (L*), a* y b*. Siguiendo la
metodología descrita por Ramos-Ramos y col. (2019) se determinó el parámetro Hue (H*, ángulo de
matiz) mediante la siguiente ecuación:
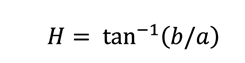
Donde
:
tan-1
= tangente
a = el
valor de a*
b = el
valor de b*
El parámetro Croma (C*) se determinó de acuerdo a los mismos
autores usando la siguiente ecuación:
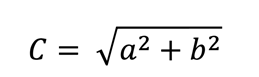
Donde:
b = el
valor de b*
a = el
valor de a*
Evaluación
sensorial
Se
prepararon las tortillas con cada una de las cuatro formulaciones, y después de
20 min se realizó la evaluación sensorial (color,
olor, sabor, grumosidad, grosor, textura,
astringencia, resistencia, apariencia general), en la que participaron
30 jueces no entrenados. Se utilizó una escala hedónica de 5 puntos, 5 = Me
gusta mucho, 4 = me gusta poco, 3 = ni me gusta ni me disgusta, 2 = me
disgusta, 1 = me disgusta mucho (Ramos-Ramos y col., 2019).
Análisis
químico proximal de las tortillas de maíz con cuajilote
Se trabajó
con una muestra de 50 g para cada formulación
de tortilla para realizar análisis basados en los métodos de la AOAC (1995). El
contenido total de proteínas se determinó utilizando el método de Kjeldhal (método oficial 950.36), junto con la humedad
(método oficial 935.36), cenizas (método
oficial 950.22), fibra (método oficial 950.37) y grasa (método oficial 935.38). El extracto libre de nitrógeno se calculó por diferencia. Los análisis se realizaron por triplicado.
Producción
de una bebida fermentada y obtención de alcohol etílico
Se trabajó
con 2.61 kg de fruto y se diseñaron dos formulaciones: (F1) frutos enteros con
cáscara y (F2) frutos enteros sin cáscara (se removió la cáscara
cuidadosamente, procurando retirar la menor cantidad de pulpa). Los frutos de cada formulación se trozaron, molieron y homogenizaron
hasta obtener un mosto color amarillo-verdoso. Los mostos se pasteurizaron a 72 °C durante 15 s y se depositaron dentro de
los reactores del digestor (Anaerobic Digester Armfield, W8-A, Argentina), los cuales se llenaron hasta un 80 % (800 mL)
de su capacidad. Se adicionó la levadura Sacharomyces
cerevisiae (marca comercial Tradi-pan)
al 1 % (p/p) en relación al peso total del
mosto y se procedió a mezclar para dispersarla en cada una de las soluciones.
El proceso se mantuvo a 24 °C en anaerobiosis
por una semana o hasta que los ºBrix permanecieron constantes. Se agitó manualmente
cada 12 h. Pasado este tiempo, el producto se filtró para separar los restos
sólidos. Por último, para la destilación se montó la unidad de extracción
sólido-líquido y se colocó el mosto obtenido de la fermentación en el tanque de almacenamiento inicial a una temperatura
de ebullición de 70 °C a 85 °C. Se alimentó el tanque del equipo de destilación
con líquido obtenido después de la
fermentación del fruto de los tratamientos. Las condiciones de operación
para la destilación fueron de 75 °C, en un tiempo aproximado de 1 h. Al final
del proceso se determinó la cantidad de alcohol obtenida por medio de las
pruebas de alcoholimetría por densidad, utilizando el alcoholímetro de Gay Lussac, graduado a 20 °C (Robsan, TDM-8010020,
México) y el grado alcohólico fue expresado en volumen (cm3
de alcohol etílico en 100 cm3 de líquido a 20 °C), de acuerdo con lo especificado en la norma NOM-199-SCFI-2017.
Los análisis se realizaron por triplicado.
Evaluación
de las propiedades fisicoquímicas de la
bebida fermentada
Los análisis fisicoquímicos de acidez total, acidez volátil, extracto seco, cenizas
y el contenido alcohólico se obtuvieron
mediante los métodos aplicables para vinos mencionados en la NOM-199-SCFI-2017, Bebidas alcohólicas-Denominación, especificaciones fisicoquímicas, información comercial y métodos de prueba. Las pruebas se realizaron por triplicado.
Determinación
de azúcares reductores en los mostos de cuajilote
Se evaluó
el contenido de azúcares reductores en el mosto de cuajilote por medio del
método Miller, por reducción del ácido
dinitrosalicílico (DNS) (Miller, 1959). Para la formulación del reactivo DNS, se disolvieron 800 mg de hidróxido
de sodio en agua destilada, posteriormente se agregaron 15 g de tartrato de
sodio y potasio tetrahidratado; después se
adicionaron 500 mg de ácido 3,5-dinitrosalicílico. La mezcla resultante se
aforó a 50 mL con agua destilada y se almacenó en frasco ámbar a 4 °C. Para determinar la cantidad de azúcares reductores se realizó
una curva de calibración de absorbancia con patrones a concentraciones
conocidas, por lo que se prepararon
soluciones de 100 mg/L hasta 1 500 mg/L, utilizando glucosa como muestra
estándar. A estas soluciones se les agregó el reactivo preparado de DNS y se leyó la absorbancia de cada una de ellas en un
espectrofotómetro UV/Vis (Velab®, VE-5100UV, México) a longitud de onda de 540 nm. Después, se adicionaron 0.5 mL del reactivo DNS preparado a 0.5 mL
de cada una de las muestras de estudio. Se colocaron a ebullición por 5 min en baño maría, y se detuvo el calentamiento
con un baño de agua fría. Finalmente, se disolvieron las muestras con 5 mL de agua destilada, se agitaron, se dejaron reposar por 15 min y se determinó su absorbancia a 540 nm.
El mismo tratamiento se realizó para el blanco con agua destilada. Se
compararon las lecturas de absorbancia de cada una de las muestras con la curva
patrón para determinar la concentración de azúcares reductores.
Análisis
estadístico
Se aplicó
estadística descriptiva (media aritmética y desviación estándar) para reportar
los datos del análisis nutrimental. Se utilizó un análisis de varianza (ANOVA)
de un factor, además de la prueba de Tukey
con un nivel de significancia P ≤ 0.05 para determinar las diferencias
entre las formulaciones de las tortillas, la bebida fermentada y la producción
de alcohol. En el caso del contenido fenólico y capacidad antioxidante se
aplicó un análisis de varianza (ANOVA) de dos factores, con tres niveles cada uno de ellos (3 x 3), además de la
prueba de Tukey con un nivel de significancia P
≤ 0.05, utilizando el programa estadístico para ciencias sociales (SPSS,
por sus siglas en inglés: Statistical
Package for the Social Sciences)
versión 19.
RESULTADOS Y DISCUSIÓN
Análisis
de la composición proximal del fruto de cuajilote
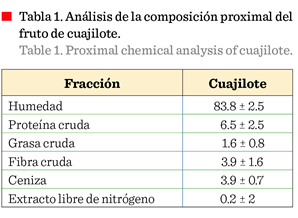
En el análisis proximal
del fruto de cuajilote se observó un alto
contenido de proteína cruda 6.5 %, fibra cruda (3.9 %) y minerales o
ceniza (3.9 %) (Tabla 1). Estos resultados concordaron con los de
Paredes-García y col. (2001), pero fueron más altos que los de Juárez-Martínez
y col. (2019), quienes reportaron mayor contenido de lípidos (6.4 %).
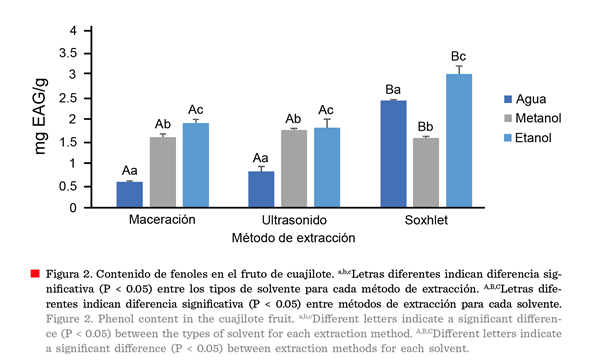
Fenoles
totales
El
solvente utilizado y el método de extracción modificaron significativamente (P
≤ 0.05) el contenido fenólico detectado en el fruto del cuajilote (Figura 2). El etanol fue el disolvente que presentó
concentraciones más elevadas de compuestos fenólicos, seguido por el
metanol y finalmente el agua, excepto para la técnica soxhlet.
El método de extracción que reportó mayores concentraciones de compuestos fenólicos fue el soxhlet,
obteniendo 3.03 mg EAG/g con etanol, seguido
por 2.43 mg EAG/g con agua como disolvente. Esto se debe a la solubilidad de los compuestos fenólicos, como difenoles y polifenos, en agua y alcohol (Muñoz y col., 2015). Un
estudio realizado por Reyad-ul-Ferdous
y col. (2015), en Parmentiera
cereifera, una especie muy cercana a P. edulis, que ha sido más estudiada, mostró un contenido
fenólico de 4.84 g EAG/100 g, usando
una mezcla de metanol y agua como solvente.
Porcentaje
de inhibición de DPPH y ABTS de los extractos del fruto de cuajilote
La capacidad de captación
de radicales libres utilizando DPPH y ABTS, mostraron diferencia significativa
(P ≤ 0.05) según el método y solvente de
extracción (Figura 3). La actividad de eliminación de radicales DPPH, de
los extractos del fruto de cuajilote,
variaron de 21.55 % a 70.09 %. El método que proporcionó el mayor
porcentaje de inhibición en los EAC fue el
método soxhlet con 69.36 %, en los EMC fue por
maceración con 70.09 % y en los EEC fue por medio de soxhlet
con 62.47 %.
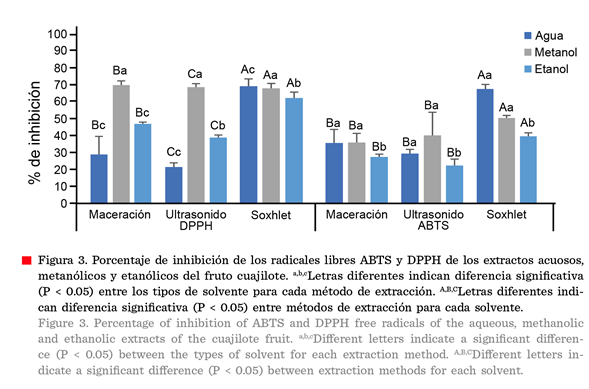
En el ensayo ABTS, los
valores oscilaron entre 22.55 % y 67.60 %,
similares al ensayo de DPPH. El EAC y el EMC obtenidos por soxhlet presentaron la mayor capacidad antioxidante, con
67.60 % y 50.63 % de inhibición de ABTS. Los EEC
mostraron porcentajes bajos de capacidad antioxidante. Dudonne y col. (2009), reportaron que las capacidades
antioxidantes de los extractos de plantas no solo dependen de la composición
del extracto, sino también de las condiciones de la prueba utilizada.
Características
físicas, sensoriales y químicas de las tortillas con cuajilote
Rolabilidad
La rolabilidad
de las tortillas no se vio modificada por la adición de hasta 15 % de harina de
cuajilote. Las mezclas no presentaron ninguna ruptura al momento de enrollarlas
en la varilla de madera. Cortes-Soriano y col. (2016) reportaron resultados
similares a este estudio, con una rolabilidad
excelente en tortillas elaboradas con una mezcla de harina de maíz y hasta 40 % de avena. En tanto que, Argüello-García
y col. (2017), elaboraron tortillas de maíz y
harina de Jatropha en proporciones 95:5,
90:10, 85:15 y 80:20, respectivamente, y reportaron un rompimiento de la
tortilla de 0 % a 25 %.
Grado de inflado
La
adición de harina de cuajilote, al 10 % y 15 %, permitió el inflado promedio de la
tortilla de 90 % y 87.5 %, respectivamente, mientras que el control y la
tortilla del 5 % tuvieron un inflado del 100 %. Argüello-García y col. (2017),
reportaron que al adicionar 20 % de harina de Jatropha
curcas se redujo el inflado de la tortilla en 50 %. Los autores
argumentaron que el alto contenido de proteínas en la formulación de harina de J. curcas puede haber
dificultado el inflado.
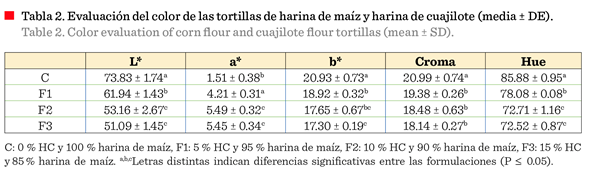
Evaluación del color
El
color es un atributo de gran importancia en los alimentos, debido a que se
asocia con la calidad, tipo de alimento e incluso el valor nutricional (Mendoza y Calvo, 2010). En los parámetros
de color de las formulaciones de tortilla (Tabla 2) se observó que la adición
de harina de cuajilote modificó
significativamente (P ≤ 0.05)
el atributo de luminosidad (L*). En
cuanto al parámetro a*, las formulaciones con mayor adición de
harina de cuajilote (10 % y 15 %) presentaron valores más altos (5.49 ± 0.32 y
5.45 ± 0.34, respectivamente) inclinándose levemente hacia el color rojo,
mientras que el tratamiento con 5 % fue menor. En el parámetro b*,
a mayor adición de harina de cuajilote menor fue el valor de este color, con
diferencia significativa (P ≤ 0.05), orientándose
hacia el color amarillo, con base en el diagrama de coordenadas de
cromaticidad. Los cambios en los atributos a* y b* modifican los valores de Croma (intensidad de calor) y Hue o matiz, que se asocia con el tono o color. Un
valor de Hue cercano a 0 corresponde a un tono rojo,
en tanto que un color cercano a 90 corresponde al amarillo. Es posible apreciar
que el valor de Hue disminuyó significativamente con el incremento de harina de cuajilote adicionada
(Tabla 2), lo que implica una
modificación del color que percibirá el consumidor, como en el caso de este estudio (Figura 3).
También se observó que el valor del croma disminuyó significativamente (Tabla 2), por lo que la intensidad del
tono disminuyó. Esto significa que la tortilla
de maíz pasó de un color amarillo a uno
rojizo de menor intensidad por efecto de la adición de la harina de
cuajilote.
Hernández-Chávez
y col. (2019) elaboraron tortillas
de maíz adicionadas con harina de la leguminosa
Lupinus albus L.
en 2.5 %, 5 % y 7.5 %, y encontraron que el tratamiento del 2.5 % fue
similar al control en todos los parámetros determinados (L*, a*, b*)
(P > 0.05). Los autores concluyeron que una mayor incorporación de harina de
L. albus resultó en cambios significativos (P
< 0.05) tanto en enrojecimiento (a*) como en amarillez (b*),
caso contrario a lo reportado en el presente estudio, donde el control y la F1
(5 % de harina de cuajilote) fueron diferentes
en todos los parámetros. Chávez-Santoscoy y col. (2016) hicieron tortillas de maíz nixtamalizadas siguiendo 3 formulaciones: control (100 %
harina de maíz), y sustitución de extracto etanólico
de la cáscara de frijoles negros en 3 g/kg y
7 g/kg. Los autores reportaron que cuando se adicionó extracto etanólico de frijol, la luminosidad disminuyó
significativamente (P < 0.05) con respecto al control, debido a que el
frijol contiene polifenoles, lo que resultó
en una tonalidad oscura de la tortilla. Los valores b* fueron más
bajos (amarillez) en comparación con las tortillas control (P < 0.05),
resultados diferentes a los reportados en el presente estudio, en el que se
observó que el color de las tortillas puede variar en función de la cantidad de
harina de cuajilote adicionada. El color
también puede cambiar debido a las reacciones de Maillard y
caramelización que suceden durante la cocción (Manayay e Ibarz, 2010).
Evaluación sensorial
La
fórmula F1 (5 % harina de cuajilote) y F2 (10
% harina de cuajilote) presentaron valores de aceptabilidad similares (P
< 0.05) (escala 4, les gusta poco) a la muestra control, en los 9 atributos evaluados: color, olor, sabor, grumosidad, grosor,
textura, astringencia, resistencia, apariencia
general (Figura 4). En el caso de la fórmula F3, el atributo de color,
apariencia general y astringencia
obtuvo valores menores (P < 0.05) en la escala hedónica (Escala 3, ni
les gusta, ni les disgusta). Es importante
mencionar que las tortillas adicionadas
con hasta 5 % y 10 % de harina de cuajilote
no presentaron diferencia significativa (P < 0.05) en los diferentes
atributos evaluados en comparación al control, lo que sugiere que es posible
fortificar las tortillas de harina de maíz con hasta 10 % de harina de cuajilote sin afectar su aceptación por parte del
consumidor.

Cortes-Soriano y col.
(2016) evaluaron tortillas elaboradas con harina integral de avena y harina de
maíz nixtamalizada y reportaron que, tanto los tratamientos con 10 % y 20 % de
harina de avena, así como el tratamiento control, tuvieron mejores propiedades
de sabor, textura y aceptabilidad; tendencia contraria a la que presentaron las
tortillas elaboradas con 30 % y 40 %, en cuyo caso presentaron sabor a avena.
Dicho comportamiento es similar a los resultados de este estudio, ya que se
establece que existe un límite en la
adición de harinas sustituto que no debe rebasarse para no afectar su
aceptación. Rodiles-López y col. (2019) elaboraron una tortilla de maíz con
harina de nopal y aguacate liofilizado y
reportaron que los panelistas tuvieron una amplia aceptación por la tortilla con 2.5 % de harina de aguacate y 2.5 % de harina de nopal, entre menos harina
de aguacate y nopal, mejor aceptación, lo que concuerda
con lo obtenido en el presente estudio.
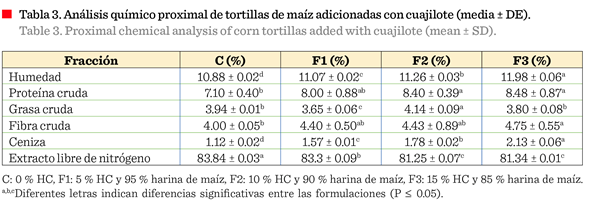
Análisis de la composición proximal de las tortillas de maíz con
cuajilote
En la Tabla 3 se muestra
la composición química de las tortillas. Se observó que a medida que aumentó la
cantidad de harina de cuajilote incrementó la fibra y disminuyó el extracto
libre de nitrógeno. El contenido de grasa fue mayor en el F2 (4.14 ± 0.09) y
menor en el F1 (3.65 ± 0.06). En cuanto a la proteína, fue mayor para la
formulación F3 (8.48 ± 0.87 g) que contiene más porcentaje de harina de
cuajilote.
Cortes-Soriano y col.
(2016) evaluaron la calidad bromatológica y
propiedades sensoriales de tortillas elaboradas con mezclas de harina de
maíz (marca MINSA®) y harina de avena (variedad Obsidiana) (90: 10 %, 80: 20 %,
70: 30 % y 60: 40 %, respectivamente). Las tortillas adicionadas con 40 % de
harina de avena presentaron altos contenidos de proteína y fibra, pero menor
aceptabilidad, datos similares a este trabajo. El incremento en el contenido de
nutrimentos como proteínas, minerales y fibra de las tortillas con cuajilote está asociado a la suma de las harinas
de este fruto a la harina de maíz, dada su composición química proximal (Tabla
1).
Evaluación de las características fisicoquímicas del mosto y de la
bebida fermentada
Propiedades fisicoquímicas de la bebida fermentada
En la Tabla 4 se observan
los resultados obtenidos de la evaluación de las características fisicoquímicas
del mosto y la bebida fermentada. En la formulación con cáscara, la acidez
total fue significativamente mayor con (P < 0.05) respecto a la que no la
contiene. Esta diferencia pudiera deberse a
una mayor concentración de ácidos en la cáscara. Los resultados de acidez volátil se encuentran dentro del límite máximo
permitido en la NOM-199-SCF1-2017 en especificaciones para vinos. El valor de
acidez total, en el tratamiento con cáscara, superó los límites de las
especificaciones de dicha norma. Al respecto,
Pájaro-Escobar y col. (2018) reportaron valores de acidez total y volátil de 5.25 g/L y 0.11 g/L, respectivamente, en un
vino de carambola y tamarindo. Valores de
acidez bajos en vinos pueden
contribuir a una mejor calidad de los
productos, tiene una gran influencia en la degradación de los ésteres frutales
y favorece la oxidación de los compuestos fenólicos
(López y col., 2019).
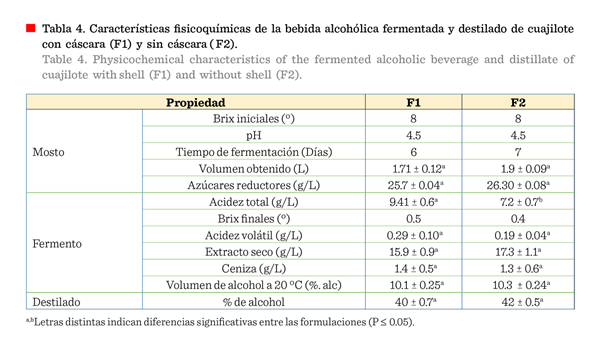
En los mostos de
cuajilote no se encontraron diferencias significativas (P < 0.05) en la concentración de azúcares reductores, determinados
por la técnica de Miller. El mosto obtenido con cáscara presentó 25.71 g/L y el
mosto sin cáscara 26.30 g/L (Tabla 4). La concentración de azúcares reductores
es importante, si se compara con otros frutos, como el mosto de piña y guarapo
de caña, que presentaron un valor promedio de 8.2 g/L aproximadamente, dependiendo
la variedad, en la investigación de Cornejo-Solorzano
y col. (2018); o con manzanas, cuyos valores oscilaron entre 34.8 g/L y 73.8 g/L, según el método de cultivo (Raigón-Ramírez y col., 2006). La uva, por su parte, puede
contener en promedio 200 g/L de azúcares reductores
presentes en el jugo de fruta o en mosto (Xu y
col., 2015; Robles-Calderón y col., 2016).
Tanto
el extracto seco como las cenizas contribuyen a tipificar un vino. En cuanto
al extracto seco y el contenido de ceniza, tampoco se encontraron diferencias
significativas entre los dos tratamientos. Como referencia, los valores para
ceniza se encuentran dentro del intervalo que indica la NOM-199-SCF1-2017 en
especificaciones para vinos. El contenido de extracto seco está muy por encima
del mínimo que indica la misma norma. Aunque no se especifica un máximo, el
contenido de extracto seco puede denotar gran contenido de sólidos, aún en la
bebida fermentada, en cuyo caso puede afectar la apariencia física y su
percepción sensorial. En este sentido, Pájaro-Escobar y col. (2018) reportaron
un contenido de 13.5 g/L para el extracto seco en vino de fruta de carambola y
tamarindo, mientras que García y col. (2016) encontraron valores de 16.377 g/L
para el extracto seco en vino joven de borojó. Estas variaciones están
influenciadas por el tipo de fruto.
Alcohol
etílico
Fermentación del fruto cuajilote
El tratamiento F1
permitió obtener 1.7 L de mosto total después de 6 días, posiblemente debido a
la disponibilidad de los azúcares y la
madurez del fruto, que influyeron en la velocidad de reacción, por lo
que la fermentación se llevó a cabo en menos tiempo, con 0.5 °Brix y 10.1 % de
alcohol. Del tratamiento F2 se obtuvieron 1.9 L de mosto después de 7 d
de fermentación, con 0.4 °Brix y 10.03 % de alcohol
(Tabla 4). La capacidad fermentativa del cuajilote puede ser equiparable al de
otras frutas, como piña y plátano. En un estudio realizado por Páramo y Peck (2006), en donde elaboraron bebidas fermentadas de diversos frutos, como banano, calala, coyolito, granadilla, mango, nancite, papaya, piña
y pitahaya, se encontró que dichas frutas permitían obtener bebidas de 9 % al
16 % de alcohol.
Destilación
y porcentaje de alcohol final
En cuanto al porcentaje
de alcohol, se observó que para F1 se obtuvo 40 % de alcohol y para F2 42 % de
alcohol, bajo las mismas condiciones de proceso. No se observó diferencia
estadística significativa entre ellos. El rendimiento alcohólico no se vio
influenciado por la presencia de la cáscara, lo que puede resultar prometedor,
ya que no es necesario incrementar una operación de despulpado para generar la bebida fermentada. El porcentaje de alcohol se encontró dentro de los límites para bebidas destiladas
(NOM-199-SCF1-2017). Los volúmenes de producción de alcohol pueden
incrementarse con un mayor número de destilaciones, lo que permitiría elevar el
rendimiento.
CONCLUSIONES
El cuajilote (Parmentiera edulis)
es un fruto de temporada rico en proteína y
fibra, compuestos fenólicos y capacidad antioxidante. El fruto puede ser
aprovechado para elaborar harina y fortificar tortillas de maíz, contribuyendo
a enriquecer la dieta de poblaciones de bajos recursos
en zonas rurales. El cuajilote también
puede ser usado como sustrato para la producción de bebidas alcohólicas fermentadas, con características fisicoquímicas dentro de los
valores reportados en normas oficiales
mexicanas. Así mismo, se puede considerar al fruto como una alternativa en la producción de bebidas
destiladas y alcohol, ya que el bajo costo y su abundancia de fruto de temporada, permitirían emplearlo como una
materia prima de interés comercial. La inclusión de la cáscara de la fruta no
representa una complicación para la producción de bebidas fermentadas o
destiladas. El cuajilote es un fruto con potencial para ser aprovechado como
sustrato en alimentos y bebidas, lo que permitiría dar valor agregado a
este recurso agropecuario subutilizado.
AGRADECIMIENTOS
Los
autores agradecen al Consejo Nacional de Ciencia y Tecnología (CONACYT) por la
beca otorgada al primer autor, a la Universidad Autónoma de Tamaulipas por el
equipo proporcionado y a la Universidad de Ciencias y Artes de Chiapas por el apoyo con
los laboratorios.
Referencias
Almenares-Verdecia, J. F.
y Serrat-Díaz, M. (2008). Aspectos tecnológicos generales para la conversión a etanol de la biomasa lignocelulósica. Tecnología
Química. 28(3): 63-70.
Alonso-Gómez, L. A. y Bello-Pérez,
L. A. (2018). Materias primas usadas para la producción de etanol de cuatro generaciones: retos y oportunidades. Agrociencia. 52(7): 967-990.
Álvarez-Olivera P. A.,
Calzada-Almas, E. y Batista-Cruz C. (2010). Etnobotánica y propagación de Parmentiera edulis D.C., árbol de
uso múltiple en Cuba. Revista Forestal Baracoa. 29(1):
77-86.
AOAC,
Association of Official Analytical Chemists (1995). Official methods of
analysis. (Eigtheenth edition). Washington D. C: AOAC International. 486 Pp.
Argüello-García, E.,
Martínez-Herrera, J., Córdova-Téllez, L.,
Sánchez-Sánchez, O., and Corona-Torres, T. (2017). Textural, chemical
and sensorial properties of maize tortillas fortified with nontoxic Jatropha
curcas L. flour. CyTA-Journal
of Food. 15(2): 301- 306.
Arumugam,
R. and Manikandan, M. (2011). Fermentation of pretreated hydrolyzates
of banana and mango fruit wastes for ethanol production. Asian Journal
of Biological and Life Sciences. 2(2): 246-256.
Barrientos-Ramírez, L.,
Arvizu, M. L., Salcedo-Pérez, E., Villanueva-Rodríguez, S., Vargas-Radillo, J.,
Barradas-Reyes, B. A. y Ruiz-López, M. A.
(2019). Contenido de polifenoles y capacidad antioxidante de Physalis chenopodifolia Lam.
silvestre y cultivo. Revista Mexicana de
Ciencias Forestales. 10(51):
182-200.
Chávez-Santoscoy, R. A., Gutiérrez-Uribe, J. A., Serna-Saldivar, S. O., and Perez-Carrillo,
E. (2016). Production of maize tortillas and cookies from nix-tamalized flour enriched with anthocyanins, flavonoids and
saponins extracted from black bean (Phaseolus vulgaris) seed coats. Food Chemistry. 192: 90-97.
Cornejo-Solorzano, L.,
Flores-Vera, M., Zambrano-Vélez, M., Gorozabel-Muñoz, A. y García-Mendoza, J.
(2018). Efecto de tres concentraciones de guarapo de caña de azúcar (Saccharum) sobre las características físico-químicas
en la elaboración de vino de piña (Ananas comosus). La Técnica.
(20): 41-54.
Cortes-Soriano, I.,
Buendía-González, M. O., Palacios-Rojas, N., Martínez-Cruz, E., Villaseñor-Mir,
H. E. y Santa-Rosa, H. (2016). Evaluación de la calidad de tortilla de maíz
adicionada con harina de avena (Avena Sativa L.) nixtamalizada. Revista
Mexicana de Ciencias Agrícolas. 7(7): 1715-1725.
Domínguez-Orta, J. C. y
Herrera-Martínez, G. (2018). Una delicia en el árbol: el pepino kat. Herbario
CICY. 10: 156-159.
Doval,
H. (2019). Healthy diets and sustainable food
production for the health of our population and planet. Revista Argentina de
Cardiología.
87(3): 245-248.
Dudonne, S., Vitrac,
X., Coutière, P., Woillez,
M., and Mérillon, J. M. (2009). Comparative
Study of Antioxidant Properties and Total Phenolic Content of 30 Plant Extracts of Industrial Interest Using
DPPH, ABTS, FRAP, SOD, and ORAC Assays. Journal of Agricultural and Food Chemistry. 57(5): 1768-1774.
Escobedo-Garrido, J. S. y
Jaramillo-Villanueva, J. L. (2019). Las preferencias de los consumidores por
tortillas de maíz. El caso de Puebla, México. Estudios sociales. Revista de
Alimentación Contemporánea y Desarrollo Regional. 29(53): e19627.
Estanislao, C., Ordaz,
C., San-Martín, E., Pérez, N., Pérez, G., and Gómez,
D. (2016). Cytotoxic effect and
apoptotic activity of Parmentiera edulis
DC. hexane extract on the breast
cancer cell line MDA-MB-231. Journal of Applied Pharmaceutical
Science. 6(1): 015-022.
FAO,
Food and Agriculture Organization of the United Nations (2018). Biodiversidad para una
agricultura sostenible. El trabajo de la FAO sobre el uso de la Biodiversidad
en la Alimentación y la Agricultura. [En línea]. Disponible en:
https://www.fao.org/3/CA2227ES/ca2227es.pdf. Fecha de consulta: 2 de diciembre
de 2020.
García, L., Flórez, C.,
Flores, J. y Marrugo, Y. (2016). Elaboración y caracterización fisicoquímica de
un vino joven de fruta de borojó (B patinoi Cuatrec). Ciencia, Docencia y Tecnología. 27(52):
507-519.
Hernández-Chávez, J. F., Guemes-Vera, N., Olguin-Pacheco,
M., Osorio-Diaz, P., Bello-Perez, L. A., and Totosaus-Sánchez, A. (2019). Effect of lupin flour incorporation
of mechanical properties of corn flour tortillas.
Food Science and Technology. 39(3): 704-710.
Johns, T. (2004).
Especies subutilizadas y nuevos retos para la salud global. LEISA Revista de
Agroecología. 20(1): 1-37.
Juárez-Martínez, Y. Y.,
Villanueva-González, G., Veana-Hernández, F. y
Aguilar, P. (2019). Estudio Exploratorio del contenido de nutrimentos de Parmentiera Aculeata. Revista Teczapic. 5(2): 25-28.
Lim,
T. K. (2012). Parmentiera aculeata. Edible Medicinal and Non-Medicinal Plants. Dordrecht: Springer. 506-567 Pp.
López, C., González-Gallardo, C., Guerrero-Ochoa, M. J., Mariño, G., Jácome, B.
y Beltrán-Sinchiguano, E. (2019). Estudio de la
estabilidad de los antioxidantes del vino de flor de jamaica
(Hibiscus sabdariffa
L.) en el almacenamiento. LA GRANJA.
Revista de Ciencias de la Vida. 29(1): 105-118.
Manayay, D. e Ibarz, A. (2010). Modelamiento de la cinética de
reacciones del pardeamiento no enzimático y el comportamiento reológico, en el
proceso térmico de jugos y pulpas de fruta. Scientia
Agropecuaria. 1(2): 155-168.
Massieu-Trigo,
Y. y Lechuga-Montenegro, J. (2002). El maíz en México: biodiversidad y cambios en el consumo. Análisis
Económico. 17(36): 281-303.
Mendoza,
E. y Calvo, C. (2010). Bromatología. Composición y propiedades de los
alimentos.
(Primera edición). México: McGraw-Hill. 318
Pp.
Miller,
G. (1959). Use of dinitrosalicylic acid reagent for
determination of reducing sugar. Analytical Chemistry. 31: 426-428.
Morales-Sánchez, V.,
Osuna-Fernández, H. R., Brechú-Franco, A.,
Laguna-Hernández, G. y Vargas-Solís, R. (2015). Evaluación del efecto antiurolítico del fruto de Parmentiera
aculeata en rata Wistar. Botanical Sciences.
93(2): 293-298.
Muñoz, C. W., Chavez, R. W., Pabón, L. C., Rendón, M. R.,
Patricia-Chaparro, M. y Otálvaro-Álvarez, Á. M. (2015). Extracción de
compuestos fenólicos con actividad antioxidante a partir de Champa (Campomanesia lineatifolia). Revista
CENIC. Ciencias Químicas. 46: 38-46.
NOM-199-SCFI-2017 (2017).
Norma Oficial Mexicana de Bebidas alcohólicas-Denominación, especificaciones
fisicoquímicas, información comercial y
métodos de prueba. [En línea]. Disponible en: http://diariooficial.gob.mx/nota_detalle_popup.php?codigo=5502882.
Fecha de consulta: 28 de julio de 2020.
Ordoñez-Gómez, E. S.,
Reátegui-Díaz, D. y Villanueva-Tiburcio, J.
E. (2018). Polifenoles totales y capacidad antioxidante en cáscara y
hojas de doce cítricos. Scientia
Agropecuaria. 9(1): 113-121.
Padulosi, S., Phrang,
R. y Rosado-May, F. J. (2019). Apoyando una agricultura sensible a la
nutrición, a través de especies olvidadas y subutilizadas - Marco Operacional. Roma (Italia): Bioversity International y
FIDA. 42 Pp.
Pájaro-Escobar, H. A.,
Benedetti, J. y García-Zapateiro, L. A. (2018).
Caracterización fisicoquímica y microbiológica de un vino de frutas a base de
tamarindo (Tamarindus indica L.) y
Carambola (Averrhoa carambola L.). Información
Tecnológica. 29(5): 123-130.
Palma, J. M., Zorrilla,
J. M. y Nahed, J. (2019). Integración de especies
arbóreas con residuales agrícolas y agroindustriales en la generación de
sistemas ganaderos resilientes. Cuban Journal of Agricultural
Science. 53(1): 73-90.
Páramo, L. y Peck, L. (2006). Determinación de
parámetros a nivel de laboratorio para la producción de vinos a partir de
frutas tropicales producidas en Nicaragua. Nexo
Revista Científica. 19(2): 101-107.
Paredes-García, I.,
Valencia-Gutiérrez, M. y Bolívar-Fernández, N. (2001). Estudios de
caracterización poscosecha del pepino kat (Parmentiera aculeata), en XVIII
Congreso Nacional de Biotecnología y Bioingeniería. Veracruz,
México. [En línea]. Disponible en:
https://smbb.mx/congresos%20smbb/veracruz01/TRABAJOS/AREA_XIII/CXIII-57.pdf.
Fecha de consulta: 19 de julio de 2022.
Parola-Contreras, I.,
Guevara-González, R. G., Feregrino-Pérez, A. A., Reynoso-Camacho, R.,
Pérez-Ramírez, I. F., Ocampo-Velázquez, R. V., ..., and Tovar-Pérez, E. G. (2021). Phenolic compounds and antioxidant activity of
methanolic extracts from leaves and flowers of chilcuague
(Heliopsis longipes, Asteraceae). Botanical Sciences. 99(1): 149-160.
Peña, C. y Arango, R.
(2009). Evaluación de la producción de etanol utilizando cepas recombinantes de
Saccharomyces cerevisiae
a partir de melaza de caña de azúcar. Dyna.
76(159): 153-161.
Pérez-Lizaur, A. B.,
Palacios-González B., Castro-Becerra, A. L. y Flores-Galicia I. (2014). Sistema
Mexicano de Alimentos Equivalentes. (Cuarta edición). México: Editorial Ogali. 152 Pp.
Perfilova, O. V., Akishin, D. V., Vinnitskaya, V. F. Danilin,
S. I., and Olikainen, O. V. (2020). Use of vegetable
and fruit powder in the production technology
of functional food snacks. IOP Conf. Series: Earth and
Environmental Science. 548: 082071.
Raigón-Ramírez, M. D., García-Martínez,
M. D., Guerrero, C. y Esteve, P. (2006). Evaluación de la calidad
de manzanas ecológicas y convencionales. Actas electrónicas del VII Congreso de
la SEAE y III Congreso Iberoamericano de Agroecología. Zaragoza, España:
Sociedad Española de Agricultura Ecológica. 63-74 Pp.
Ramos-Ramos, M.,
Rodríguez-Castillejos, G., Santiago-Adame, R., Alemán-Castillo,
S. E., Castillo-Ruiz, O., and Perales-Torres, A. L. (2019). Production
and characterization of a snack based on
maize flour and Atlantic mackerel (Scomber
scombrus). CyTA-Journal
of Food. 17(1): 1006-1013.
Reyad-ul-Ferdous,
M., Hussain, M. I., Mukti, M., Islam, M. A., Islam, M. N., Rahman, M. P., …,
and Sharif, F. (2015). Evaluation of Ex-Vivo Anti-inflammatory and total phenolic
content of fruits of Parmentiera cereifera seem. American Journal of
Bio Science. 3(2-1): 1-4.
Robles-Calderón, R. F.,
Muñoz, O. y Chirre-Flores, J. H. (2016). Estudio del consumo de azúcares
reductores durante la fermentación alcohólica del mosto de uva Italia para la obtención de vino blanco. Industrial
Data. 19(2): 104-110.
Rodiles-López, J. O.,
Arriaga-Martínez, L. P., Martínez-Flores, H. E., Zamora-Vega, R. y
García-Martínez, R. M. (2019). Desarrollo de una tortilla adicionada con
harinas de aguacate y nopal y su efecto en la reducción de colesterol,
triglicéridos y glucosa en ratas. Biotecnia. 21(2): 71-77.
Rodríguez-Calderón, T. D.
J., Chávez-Mejía, M. C., Thomé-Ortiz, H. y
Miranda-Román, G. (2017). Elaboración y consumo de tortillas como patrimonio
cultural de San Pedro del Rosal, México. Región y Sociedad. 29(70):
155-179.
Rudebjer, P., Meldrum,
G., Padulosi, S., Hall, R. y Hermanowicz,
E. (2014). Haciendo realidad la promesa de las especies olvidadas y
subutilizadas. Bioversity International.
12 Pp.
Sánchez, D. V., Muschler, R., Prins, C., Solano,
W. y Astorga, C. (2014). Diversidad de especies vegetales alimenticias en la microregión cacahuatique sur de
el salvador: un enfoque en especies comestibles
subutilizadas y conocimiento local. Agroecología. 9(1 y
2): 101-109.
Sánchez, O. J. y Cardona,
C. A. (2005). Producción biotecnológica de alcohol carburante I: obtención a
partir de diferentes materias primas. Interciencia.
30(11): 671-678.
Torres- Rivera, J. A.
(2018). Parmentiera aculeata
(Kunth) Seem. En J. M. Palma-García y C. González-Rebeles-Islas (Eds.), Recursos
arbóreos y arbustivos tropicales para una ganadería bovina sustentable (pp.
87-95). México: Universidad de Colima.
Vázquez, H. J. y Dacosta, O. (2007). Fermentación alcohólica: Una opción
para la producción de energía renovable a partir de desechos agrícolas. Ingeniería,
Investigación y Tecnología. 8(4): 249-259.
Vicente-Flores, M.,
Güemes-Vera, N., Chanona-Pérez, J. J., Quintero-Lira, A., and Piloni-Martini, J. (2018). Physicochemical
evaluation of parmentiera edulis fruit (cuajilote) during its postharvest storage. Book of
Proceedings Latin Food. 14.
Xu,
F., Xi, Z., Zhang, H., Zhang, C., and Zhang, Z. (2015). Brassinosteroids
are involved in controlling sugar unloading in Vitis vinifera “Cabernet
Sauvignon” berries during véraison. Plant Physiology
and Biochemistry. 94: 197-208.