https://doi.org/10.29059/cienciauat.v17i2.1703
Recubrimiento
biodegradable antifúngico a base de quitosano y aceite esencial de cítricos
para la conservación de papaya (Carica papaya L.) en poscosecha
Biodegradable antifungal coating based on chitosan and
citrus essential oil for the conservation of papaya (Carica
papaya L.) in postharvest
Recubrimiento antifúngico
en papaya poscosecha
María del Rosario
García-Mateos1*, Joel
Corrales-García2, Teresita Cornejo-Vivar2, Lyzbeth Hernández-Ramos3
*Correspondencia: rosgar08@hotmail.com/Fecha de recepción: 15 de junio de 2022/Fecha de aceptación: 22 de septiembre de 2022/Fecha de publicación: 31 de enero de 2023.
1Universidad Autónoma Chapingo, Instituto de
Horticultura, Departamento de Fitotecnia, carretera México-Texcoco km 38.5,
Chapingo, Estado de México, C. P. 56230. 2Universidad Autónoma
Chapingo, Departamento de Ingeniería Agroindustrial, Chapingo, Estado de México,
México. 3Secretaría de Agricultura y Desarrollo Rural, Dirección General de Fomento, Jefatura de
Ornamentales, Ciudad de México, México.
Resumen
La papaya es una fruta
climatérica altamente perecedera. La
antracnosis, enfermedad provocada por
hongos, es una de las principales causas de pérdida poscosecha. La
actividad de extractos vegetales ha permitido la inhibición del desarrollo de microorganismos, en particular se
ha reportado la actividad antifúngica de
aceites esenciales. El objetivo de la presente investigación fue evaluar
el efecto de un recubrimiento biodegradable a
base de quitosano con aceite esencial
de cítricos, aplicado en etapa poscosecha, en las propiedades físicoquímicas, fisiológicas e inhibición del crecimiento
del hongo Colletotrichum gloeosporioides en frutos de papaya (Carica papaya L.). El recubrimiento se preparó con
quitosano, glicerol, ácido acético, aceite esencial de Citrus reticulata (0.5 %, 1.0 % y 1.5 %) y Tween® 80.
La solución se aplicó con una brocha en la epidermis de los frutos de papaya y
se almacenaron a temperatura ambiente (24 °C ± 2 °C) por 10 d, junto con los
frutos testigo. Las variables evaluadas en los frutos fueron color, pH, sólidos solubles totales (SST), firmeza, pérdida de peso, producción de CO2,
de etileno y daño por antracnosis. Se utilizó un modelo estadístico
completamente al azar. Los datos se
sometieron al análisis de varianza (ANOVA) y comparación de medias por
la prueba de Tukey (P < 0.05). El
recubrimiento aplicado retrasó el cambio de color de la epidermis de los
frutos de papaya, la pérdida de peso, firmeza
y SST respecto a los frutos testigo. Los cambios estuvieron asociados a la modificación de la tasa de
respiración y de producción de etileno de los frutos con recubrimiento. La
matriz del quitosano conteniendo aceites esenciales, usada como recubrimiento,
mejoró significativamente la vida de anaquel de la papaya y disminuyó más del 80 % el daño por antracnosis.
Palabras clave: aceite
esencial, cítricos, papaya, quitosano, antracnosis.
Abstract
Papaya
is a highly perishable climacteric fruit. Anthracnose, a disease provoked by
fungus, is one of the main causes of postharvest
losses. The activity of plant extracts has allowed the inhibition of the development of microorganisms;
in particular, the antifungal activity of essential oils has been reported. The
aim of this research was to evaluate the
effect of a biodegradable antifungal coating based on chitosan with citrus essential oil in the physicochemical
and physiological properties and the
antifungal activity of postharvest
papaya (Carica papaya L.). The coating
was prepared with chitosan, glycerol,
acetic acid, essential oil of Citrus reticulata (0.5 %, 1.0 % and 1.5 %) and Tween® 80. The solution was applied with a brush to the epidermis of the postharvest papaya fruits and stored at room
temperature (24 °C ± 2 °C) for 10 d. The variables
evaluated in the fruits were color, pH, °Brix, firmness, weight loss,
production of CO2 and ethylene and anthracnose damage. An analysis
of variance (ANOVA) was performed under a completely randomized design and a
comparison of Tukey means (P < 0.05). The coating applied delayed the color
change of the epidermis of the papaya fruits, these maintained the high
firmness values with respect to the control fruits.
The changes were associated with the modification
of the respiration rate and ethylene production of the coated fruits.
The chitosan matrix containing essential oils used as a coating significantly
improved shelf life of papaya and decreased anthracnose damage by 80 %.
Keywords:
essential oil, citrus, papaya, chitosan, anthracnose.

Introducción
Las frutas y hortalizas
frescas son productos perecederos, susceptibles a sufrir deterioro físico, fisiológico y bioquímico. Su calidad disminuye
durante el manejo poscosecha, lo que afecta
la comercialización (Nayak y col., 2019). El deterioro se debe principalmente a daños provocados por insectos, hongos o bacterias.
Sin embargo, las pudriciones bacterianas y fúngicas
son las que causan la mayor pérdida (Dukare y col., 2018; Singh y col., 2022), ya que alteran la fisiología del fruto, debido en
parte, a un incremento de la producción de etileno y de la respiración.
En
papaya (Carica papaya L.), al igual que en otros frutos
tropicales de importancia comercial, la descomposición por antracnosis, debida
al hongo Colletotrichum gloeosporioides,
es la causa más importante de grandes pérdidas económicas (Ayón-Reyna y col., 2017). El género Carica agrupa
21 especies (Badillo y Leal, 2019), entre las
que destaca C. papaya por su importancia
comercial (Cunha y col., 2018). Los frutos se caracterizan por ser climatéricos, con altas
tasas de respiración y producción de etileno. Su exocarpio es delgado y frágil, por lo tanto, el fruto
es perecedero y susceptible al ataque de hongos, con una vida de anaquel corta (1
a 3 semanas), según su manejo (pre y poscosecha) y las condiciones climáticas del lugar de producción (Vela-Gutiérrez y col., 2016).
Para evitar el daño
causado por hongos en productos
hortofrutícolas, existen estrategias de control, entre las que destaca
la aplicación de fungicidas químicos. Sin
embargo, su uso se ha restringido debido a los efectos adversos
ocasionados en humanos y en el ambiente (Alam
y col., 2017). Además de que, la utilización
indiscriminada de dichos agroquímicos ha propiciado la generación de
fitopatógenos resistentes (Rodríguez-Delgado
y col., 2019). Ante esta problemática, se ha iniciado el estudio de
fungicidas naturales (extractos vegetales) (Alam y col., 2017).
Sharma
y Tripathi (2006) consideran que, dentro de los extractos vegetales, los
aceites esenciales obtenidos de cítricos son una alternativa en la industria de alimentos, por su actividad antifúngica, ser de
origen natural y amigables con el ambiente. Se ha reportado la
incorporación de aceites esenciales a una matriz de recubrimientos
biodegradables para el control de microorganismos y aumento de la vida de
anaquel de productos hortofrutícolas (Ramos
y col., 2010). Una película biodegradable, aplicada por inmersión, sobre
un alimento fresco puede permitirle mayor vida de anaquel y conservar su
calidad, al regular la migración de humedad,
oxígeno y CO2 sin afectar a los compuestos antioxidantes,
aroma y sabor; además de en ocasiones servir
también como empaque (Fernández y col., 2015). Los materiales para la elaboración de recubrimientos biodegradables son numerosos, entre ellos destacan
los polímeros de origen natural obtenidos
mediante el aprovechamiento de productos subutilizados, tales como el
quitosano, derivado de la quitina, la cual se
obtiene de forma comercial
principalmente del caparazón de crustáceos (Philibert y col., 2016). El
quitosano es un producto natural no tóxico y biodegradable. Su uso en la
conservación de frutas y hortalizas durante
el almacenamiento poscosecha, reduce
el desarrollo de pudriciones por Botrytis cinerea, Penicillium expansum,
Penicillium digitatum, Aspergillus niger,
Rhizopus
stolonifer, entre otros (Yuan
y col., 2016; Bauer y col., 2022).
El objetivo
de esta investigación fue elaborar un recubrimiento biodegradable a base de quitosano adicionado con aceite
esencial de cítricos para evaluar su efecto en las propiedades físico químicas, fisiológicas e inhibición del crecimiento de Colletotrichum
gloeosporioides en frutos de papaya (Carica
papaya L.) en poscosecha.
MATERIALES Y MÉTODOS
Extracción de aceite
esencial
Se
recolectaron frutos de tres especies de cítricos: naranja (Citrus sinensis), mandarina (Citrus reticulata), y toronja (Citrus paradisi),
sin daños
físicos o presencia de enfermedades, en el municipio de Tuxpan, Veracruz, México. La extracción del aceite esencial del exocarpio
de cada especie se realizó por hidrodestilación en una trampa Clevenger por 4
h. Las trazas de humedad en los aceites obtenidos se retiraron mediante la
adición de Na2SO4 anhidro, y se almacenaron en refrigeración a 4 °C ± 2 °C. Se calculó el
rendimiento (%) de aceite esencial por especie.
Aislamiento de C. gloeosporioides
El hongo se aisló de
frutos de papaya (C. papaya var. Maradol) con
lesiones características visuales de antracnosis (círculos concéntricos
y mancha oscuras), de acuerdo con lo descrito por Acosta y col. (2001). Los
frutos se adquirieron en un mercado local del municipio de Texcoco, Estado de México. Se obtuvieron fragmentos (5 mm x 5 mm) de la superficie infestada de los frutos de papaya. Cada fragmento se sembró en medio de cultivo
Papa Dextrosa Agar (PDA, BD Bioxon®), con un periodo
de incubación por 3 d, a una temperatura de
28 °C ± 2 °C (Acosta y col., 2001). Se
tomó una muestra pequeña del hongo y se observó
al microscopio (Olympus CX3I, Tokyo, Japón), comparando
la forma de micelios y de conidios con
los reportados en la literatura (Barnett y col., 1998). Una vez
identificado el hongo se procedió a purificar la cepa. Se tomó una muestra del
hongo en desarrollo para obtener un cultivo monoconidial, según la
técnica de dilución descrita por Acosta y col.
(2001), con la finalidad de obtener un inóculo monospórico puro (IP) proveniente
de una sola espora. Cabe mencionar que no se realizó la caracterización molecular del hongo.
Bioensayo in vitro de los aceites
esenciales
Se
utilizó el método de Kirby-Bauer modificado (Bauer y
col., 1966). Se colocaron 4 círculos de papel filtro
esterilizados (6 mm de diámetros) equidistantes,
impregnados con 15 mL de aceite
esencial por especie. Se sembró una alícuota de 100 mL de la suspensión de conidios (3.77 x 108 UFC/mL) de la cepa
fitopatógena en un medio de cultivo Papa Dextrosa Agar (PDA, BD Bioxon®),
según el método descrito por
Acosta y col. (2001). Se utilizó agua destilada esterilizada como
control negativo y un fungicida químico Amistar® (azoxistrobin:
Metil
(E)-2-2-6-(2-cianofenoxi) pirimidin-4-iloxi-fenil-3-metoxiacrilato)
como control positivo.
Se
realizaron cuatro repeticiones por cada tratamiento, en total se obtuvieron 5 tratamientos, 3 aceites esenciales, un control negativo y
un control positivo. Los tratamientos se incubaron
a 28 °C ± 2 °C. A los 7 d de incubación se midieron los halos de inhibición de
crecimiento del hongo (mm) con un pie de
rey (Calibrador Vernier® Mitutoyo 530, Kanagawa Japón). Se promediaron 2
diámetros perpendiculares de cada uno de los discos. Se determinó el porcentaje
de inhibición (% I) de los aceites esenciales, mediante la fórmula:
% I = (Área de crecimiento
tratamiento/Área de testigo) * 100.
Determinación del
grado de desacetilación del quitosano
Se
determinó por el método potenciométrico de titulación (Yuan
y col., 2016). Se pesaron 0.25 g de quitosano, se le adicionaron 10 mL de ácido clorhídrico
(HCl) 0.3 M y se agitó hasta
disolver. La muestra se tituló utilizando hidróxido
de sodio (NaOH) 0.1 N, y se midió el
cambio de pH por cada mL de NaOH añadido,
hasta un volumen igual a 50 mL. Se realizó una gráfica de pH vs
mL de NaOH y se calculó la diferencia entre
los puntos de inflexión de la gráfica. El porcentaje de desacetilación se determinó mediante la ecuación, que expresa la cantidad de grupos aminos (NH2)
formados:
% NH2 = 16.1 (y - x) * (f) (w)
Donde:
y: punto de inflexión
mayor en la gráfica de la primera derivada.
x: punto de inflexión
menor en la gráfica de la primera derivada.
f: normalidad de la solución
de NaOH.
w: peso en gramos de la
muestra.
16.1: factor cuyo valor
está relacionado con el peso equivalente.
Preparación del
recubrimiento biodegradable
Las
características del quitosano utilizado fueron: peso molecular 127 x 10 g/mol,
tamaño de
partícula 0.4 mm < 50 %, masa 1 mm; solubilidad > 99.9 %; fuente, caparazón de jaiba (Callinectes sp). El recubrimiento se
preparó de acuerdo con el método
propuesto por Hernández-Ochoa y col. (2011) modificado, mediante la adición de
ácido acético glacial 1.0 % (v/v) (JT Baker®), glicerol 0.5 % (v/v) y
quitosano 1.0 % (p/v) (proporcionado por el
Centro de Investigación y Desarrollo,
Sonora, México) a 60 °C en agitación
constante por 24 h. A la mezcla fría (35 °C) se le añadió el aceite esencial con mayor efecto antifúngico, en 3 concentraciones:
0.5 %, 1.0 % y 1.5 %, disuelto con Tween® 80 a 0.1 % (v/v). La mezcla se mantuvo en agitación constante por
7 h.
Inoculación del fruto de papaya y
aplicación del recubrimiento
Los frutos de papaya (C.
papaya var. Maradol) de tamaño uniforme (1 000 g a 1 200 g), sin daños físicos y libre
de enfermedades, se obtuvieron de un cultivo
de un huerto familiar ubicado en el municipio de San Pedro Pochutla, Oaxaca, México. Los frutos en estado
de Maduración 2 (escala de maduración
establecida por Santamaría y col. (2009a) se desinfectaron sumergiéndolos en
hipoclorito de sodio (1.0 % v/v) por 5 min, se enjuagaron con agua destilada
esterilizada y se secaron a temperatura ambiente. Se seleccionaron 5 áreas de
la epidermis de cada fruto aleatoriamente, para aplicar una punción de
aproximadamente 2 mm de profundidad, donde se inocularon 20 mL de la suspensión de esporas de C. gloeosporioides
(1 x 108 conidios mL). Después de 2 h, a la epidermis se aplicó el
recubrimiento biodegradable mediante una brocha (Camelus®
2”, BYP BCA20, Monterrey, México) y se dejaron secar por 30 min a temperatura ambiente.
Se realizaron 4 tratamientos (recubrimiento conteniendo aceite esencial a 0.5 %, 1.0 % y 1.5 % y un tratamiento sin recubrimiento (testigo) con 6
repeticiones cada uno, dispuestos en un diseño completamente al azar. Los
frutos se mantuvieron a 24 °C ± 2 °C por 10 d.
Características fisicoquímicas y parámetros
de color
La pérdida de peso (%) del
fruto y el pH de la pulpa se determinaron de acuerdo con la metodología de la Asociación de Químicos Analíticos Oficial (AOAC, por sus siglas en inglés: Association of Official Analytical
Chemist) (AOAC, 1990). El contenido de sólidos solubles
totales (SST) se estableció con un refractómetro manual (Atago N1) a 20
°C ± 2 °C. El resultado se reportó como porcentaje (%) de sólidos solubles.
El color del fruto se
determinó mediante las mediciones de Luminosidad (L), ángulo de tono (Hue) y pureza de color o índice de
cromaticidad (Chroma) en tres áreas de la epidermis. Las lecturas
de L, a* y b* se obtuvieron
con un colorímetro HunterLab (MiniScan
XE Plus45/0-L, Reston,
Virginia, EUA) para identificar las diferencias de color en forma numérica. Se realizó el cálculo de los parámetros
Hue y Chroma con las siguientes ecuaciones:
Hue = tan-1 (a*/b*)
Chroma = (a*2+ b*2) 1/2
Las mediciones se
realizaron cada 2 d en cada fruto almacenado a 24 °C ± 2 °C por 10 d.
Firmeza del fruto
La
firmeza se determinó por el método de punción mediante un texturómetro universal TA.XT2i (Stable Micro Systems UK, Surrey, RU) de
base automática, con una punta cónica de 6 mm
de diámetros, celda de 5 kg, velocidad
de compresión de 0.5 mm/s y distancia
de compresión de 10 mm. La firmeza se midió en la parte ecuatorial central de la papaya y se registró la
fuerza de oposición del tejido a la penetración del punzón, en cinco regiones
del fruto sin exocarpio. Los resultados
se reportaron en newtons (N).
Evaluación de la tasa
de respiración
Se seleccionaron tres
frutos por tratamiento. Los frutos se
colocaron en el interior de un frasco de vidrio por 1 h cada 24 h. Con una jeringa
se extrajeron 5 mL de gas del espacio de cabeza del frasco, se guardaron en
frascos BD Vacutainer® de 5 mL en congelación a
- 4 ºC hasta su análisis (Santamaría y
col., 2009a). Se inyectó 1 mL de cada muestra en un cromatógrafo de gases (Varian® Star 3 400, Palo Alto, California, Estados Unidos), equipado con
una columna Hayesep Q 100/120 (1.8 m longitud x 3.2 mm diámetros) y
detectores en serie de conductividad térmica
(TCD, por sus siglas en inglés: Thermal Conductiviy Detector)
para la cuantificación del contenido de CO2, y de ionización de flama (FID, por sus siglas en inglés: Flame Ionization Detector) para la determinación del contenido de
etileno. Se utilizó helio como gas
acarreador (flujo de 25 mL/min). La temperatura se mantuvo a 70 ºC en ambos detectores. Los resultados
se calcularon a partir de curvas de calibración con estándares de concentración
conocida de CO2 y etileno. Los resultados
se expresaron en mL de CO2 kg /h y mL de etileno kg/h.
Severidad de daño en
el fruto y efectividad de los recubrimientos
Para calcular el
porcentaje de severidad de daño en los frutos de papaya se utilizó la fórmula:
P = [Σ(n*v) /
(CM*N)] *100
Donde:
P =
media ponderada de severidad.
n = número de lesiones por
cada clase de la escala, esto con respecto a las características de la
enfermedad, de acuerdo con grado 5 de daño con base a la escala establecida por
Santamaría y col. (2011).
v = valor numérico de cada clase.
CM = categoría mayor.
N = número total de lesiones evaluadas.
Para
calcular la efectividad biológica de los recubrimientos (%) se utilizó la
fórmula de Abbott (1925):
ET= [(IT - it) / IT] * 100
Donde:
ET = efectividad del tratamiento.
IT = porcentaje de infección en el testigo.
It =
porcentaje de infección en cada tratamiento.
Análisis estadístico
Los
datos obtenidos para cada variable se sometieron a un análisis de varianza
(ANOVA) sin restricciones, correspondiendo a un diseño completamente al azar.
La comparación de medias se hizo de acuerdo con Tukey (P < 0.05), mediante
el Sistema de Análisis Estadístico (SAS, por sus siglas en inglés: Statistical
Analysis System) versión 9.1.3.
RESULTADOS Y DISCUSIÓN
Rendimiento de la
extracción de los aceites esenciales
El
exocarpio de Citrus reticulata (mandarina) proporcionó el mayor
rendimiento de aceite esencial (0.15 %), seguido de C. sinensis (0.07 %) y C. paradisi
(0.03
%). Lota y col. (2001) reportaron rendimientos de aceite esencial en 15
variedades de C. reticulata que fueron de 0.05
% a 0.6 % por kg de cáscara, lo cual concuerda con lo obtenido en la
presente investigación. Por otro lado, Rojas-Fernández y col. (2014) mencionaron
que la diferencia en los rendimientos de aceite esencial en cítricos se debe
principalmente a la variabilidad genética entre especies y al método de extracción. Sin embargo, la composición por especie está también
determinada por diferentes factores edafoclimáticos (luz,
agua, temperatura, suelo), estacionalidad (temporada de producción y cosecha
del fruto) y estado de madurez, que influyen en
los procesos fisiológicos y bioquímicos o en las rutas metabólicas donde
se sintetizan, produciendo modificaciones estructurales y concentraciones en los componentes del aceite esencial (Boaro y col., 2019).
Bioensayo in vitro
de los aceites esenciales
El aceite de mandarina (C.
reticulata) presentó un porcentaje de inhibición
de crecimiento del hongo significativamente
mayor (P < 0.05) que el de los
otros cítricos evaluados y cercano al control positivo (Tabla 1). La
diferencia observada de la actividad antifúngica de los aceites esenciales podría explicarse por una diferencia en el perfil o concentración de los metabolitos presentes en cada especie (Rabari
y col., 2017). Dutra y col. (2016) reportaron 45 componentes en el aceite
esencial de Citrus spp y al limoneno como el monoterpeno de mayor abundancia, y en menor proporción ![]() - y
- y ![]() -pineno, linanol
y terpineno. Estos autores
identificaron a limoneno (94 %) y mirceno (1.6 % a 2.1 %) como los principales
componentes del aceite esencial de C. sinensis,
C. reticulata y C. paradisi.
-pineno, linanol
y terpineno. Estos autores
identificaron a limoneno (94 %) y mirceno (1.6 % a 2.1 %) como los principales
componentes del aceite esencial de C. sinensis,
C. reticulata y C. paradisi.

Los aceites esenciales de
los cítricos evaluados mostraron notables
propiedades antimicrobianas (Tabla 1).
Aunque su mecanismo de acción aún no es totalmente conocido (Burt, 2004; Bosquez-Molina y col., 2010). Wang y col.
(2019) mencionaron que el carácter hidrofóbico de los aceites esenciales se debe a la presencia de los terpenoides
volátiles de bajo peso molecular que,
de manera sinérgica, pueden interactuar con los fosfolípidos de la membrana
celular y de las mitocondrias, aumentando así su permeabilidad, pérdida de la
integridad de membrana y la disipación del gradiente de iones, como el Ca+2.
En conjunto, todos estos efectos provocan la liberación de otros constituyentes
intracelulares que interfieren en muchos
procesos biológicos (Sharifi-Rad y col., 2017), induciendo en consecuencia la muerte celular. También se ha reportado
que la penetración de los aceites esenciales puede afectar la función de las
proteínas y enzimas incrustadas en la
membrana (Rabari y col., 2017).
Grado de desacetilación
del quitosano
Hernández y col. (2009)
indicaron que el valor óptimo de desacetilación para el quitosano debe ser
mayor a 50 %, aunque el quitosano comercial presenta un porcentaje de
desacetilación superior a 60 %. Esto concuerda
con el resultado obtenido de la muestra de quitosano analizado en este estudio
que fue de 57.1 %. Al respecto, Araya y Meneses
(2010) mencionaron que la variación del grado
de desacetilación se debe a la presencia de grupos amino libres en
quitosanos de diferentes crustáceos. Por otro
lado, Calero y col. (2013), argumentaron que el grado de desacetilación
del quitosano, comprendido entre 60 % y 98 %, es un parámetro determinante en
la solubilidad o insolubilidad en medios acuosos, ya que se encuentra cargado positivamente en medios ácidos, siendo los grupos
amino responsables de dicha densidad de carga (positiva) lo que favorece su
solubilidad. Y el carácter hidrofílico e
hidrofóbico del quitosano está asociado a las características
estructurales que convierten al polímero en excelente estabilizador de
emulsiones, además reduce la tensión superficial, actúa como espesante y pude
formar películas con mejores propiedades viscoelásticas (Calero y col., 2013).
Características
fisicoquímicas del fruto con recubrimiento
Los frutos con
recubrimiento mostraron menor pérdida de peso
durante los 10 d de almacenamiento, en comparación con los frutos sin
recubrimiento (Tabla 2). A mayor concentración del aceite esencial hubo menor
pérdida de peso, aunque solo el tratamiento
con 1.5 % de aceite esencial redujo significativamente la pérdida de
peso (P < 0.05) hasta un valor de 2.90 %. Este efecto podría deberse a que el
incremento del contenido de aceite esencial confiere un aumento de la
hidrofobicidad del recubrimiento, lo cual disminuye la transpiración y esta a su vez la pérdida de agua, ya que los
recubrimientos actúan como una barrera
de protección que evita el intercambio de gases con el ambiente,
incluyendo al vapor de agua del fruto, lo que provoca una pérdida de peso más
lenta (Télles-Pichardo y col., 2013).
En el presente trabajo se
observó menor pérdida de peso que lo
reportado por Télles-Pichardo y col. (2013), quienes evaluaron
recubrimientos de cera de candelilla con polifenoles, aplicados en frutos de
papaya almacenados a temperatura ambiente, y la pérdida de peso que encontraron fue aproximadamente de 5 % a
partir del día 6. En tanto que, Miranda
y col. (2014) obtuvieron pérdidas de peso de 9.54 % en el día 9, al
aplicar recubrimientos a base de almidón de yuca al mismo fruto en condiciones similares de almacenamiento.
El
recubrimiento de los frutos no afectó el valor de pH durante su almacenamiento (10 d a temperatura ambiente) (Tabla 2).
Martínez-Tenorio y López-Malo (2011) encontraron un pH alcalino en frutos de
papaya con recubrimiento y aceites
esenciales a los 5 d y 7 d, en comparación
con los que no tuvieron recubrimiento. Asimismo, Miranda y col. (2014)
reportaron el aumento del pH a partir del
día 9. Esto fue atribuido a una reducción del contenido de ácidos orgánicos presentes en el fruto, causado
por la desaceleración de la actividad metabólica. El origen de este fenómeno lo
atribuyeron a que las películas provacaron menor difusión del oxígeno, lo que pudo
ocasionar el decremento de la oxidación metabólica.
El
recubrimiento biodegradable con 1.5 % de aceite esencial redujo
significativamente (P < 0.05) el contenido de sólidos solubles totales
en el fruto tratado, con respecto al testigo, a los 10 d de almacenamiento (Tabla 2). Esta disminución
podría deberse a la poca permeabilidad
de la pared celular por la hidrofobicidad y mayor concentración del aceite, lo
que evitó su ablandamiento y rompimiento de polisacáridos y mayor firmeza de los frutos del T3
(Dos-Passos-Braga y col., 2019). Aunque los cambios de azúcares en los frutos
de papaya poscosecha aún no se encuentran completamente establecidos como
posibles indicadores de calidad, es importante señalar que, el contenido de SST
(10° a 11.5° Brix) permite evaluar el estado de madurez de consumo de la papaya
var. Maradol (Santamaría y col., 2009a).
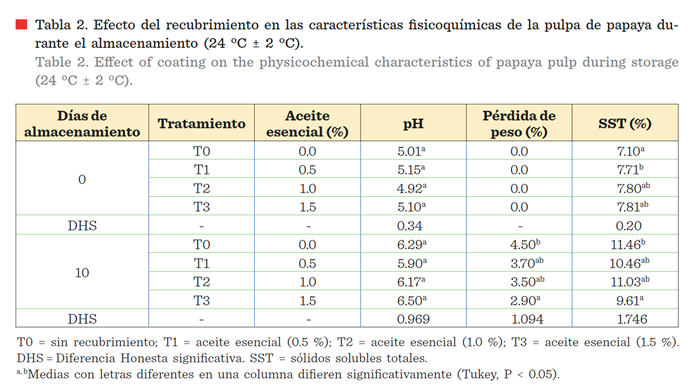
Parámetros de color
En frutos y hortalizas el
color es parte de la calidad, por lo mismo, puede ser factor de preferencia,
aceptación o rechazo por el consumidor y determinante del fracaso o éxito en la
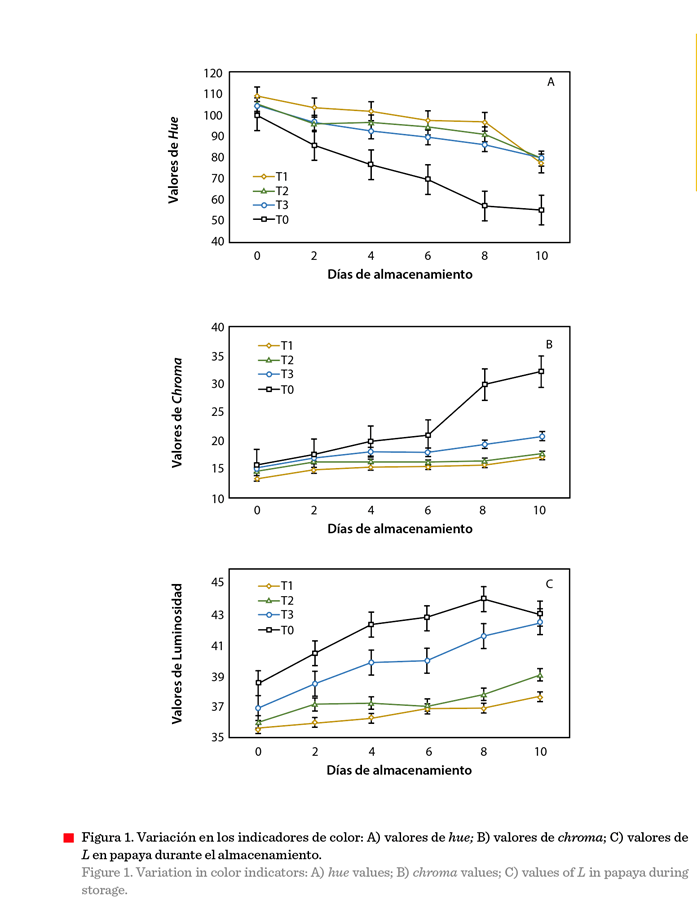
comercialización. En este trabajo, el valor de Hue, en la superficie de
los frutos sin recubrimiento (testigo), presentó una mayor disminución
(aproximadamente 50°) durante el almacenamiento,
en comparación con los frutos con recubrimiento (aproximadamente 27º)
(Figura 1A y Figura 2). Esta diferencia explica
el cambio del color de la epidermis
de verde a anaranjado en los frutos
sin recubrimiento y de verde a verde-amarillo en los frutos tratados
(Figura 2). La manifestación del color
naranja durante la maduración de los frutos está relacionada con los
cambios en el contenido de pigmentos, principalmente
por la degradación de clorofilas, como consecuencia de procesos oxidativos y por
la síntesis de otros pigmentos anaranjados y amarillos (carotenoides)
(Shakya y Lal, 2018).
La
saturación de color (chroma) en la epidermis fue significativamente
menor en los frutos con recubrimiento (Figuras 1B y Figura
2), que en los frutos sin recubrimiento después de los 6 d de almacenamiento. Valores mayores de chroma
indican mayor intensidad de color y
significan que el color es más definido. Es importante destacar que, aunque
los frutos con recubrimiento mostraron
valores bajos de chroma, esto no implica que perderán su
atractivo para el consumidor, ya que, en esta etapa, el retraso en la
instalación del color naranja intenso característico del fruto,
se asocia con una instalación tardía de la maduración, es decir, una mayor vida
de anaquel. El contenido de aceite esencial en el recubrimiento no afectó los valores
de chroma de la epidermis de los frutos, ya que no se encontró diferencia
significativa entre los tratamientos T1, T2 y T3.
Los valores de luminosidad
(L) se incrementaron en los 4 tratamientos (T0, T1, T2 y T3) durante el
almacenamiento (Figura 1C), pero fue mayor en la fruta sin tratamiento, seguido
de la que contenía 1.5 % de aceite esencial (T3). Se observó un incremento en
el cambio de color alrededor del día 6 en los frutos sin recubrimiento, que
podría estar asociado con un inicio del
proceso de maduración. El incremento de luminosidad también fue reportado por Santamaría y col. (2009b) al estudiar la
madurez de consumo de papaya maradol después
de la cosecha en condiciones de almacenamiento.
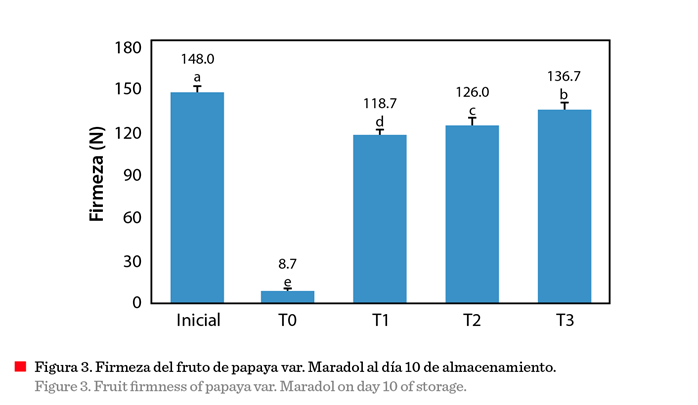
Firmeza
Se
observó una tendencia decreciente en el valor de firmeza en fruta control (T0)
en comparación con los
tratamientos con recubrimiento (T1, T2 y T3)
durante el almacenamiento. Este efecto está asociado a la maduración de los
frutos, que induce su ablandamiento (Barragán-Iglesias y col., 2018), debido al proceso de desorganización de los tejidos; lo que provoca menor
resistencia a la deformación. A los 10 d de
almacenamiento se observaron diferencias significativas entre los
frutos con y sin recubrimiento (Figura 3).
Osuna-García y col. (2005) mencionaron que, a mayor retención del valor
de firmeza, los frutos presentan mayor vida
de anaquel, lo que contribuye, por un lado, a alcanzar mercados más distantes y por el otro a disminuir pérdidas.
La firmeza inicial (148 ± 2 N) de los frutos, en todos los tratamientos,
resultó similar (144 ± 5 N) a lo reportado por Sañudo y col. (2008). La
firmeza de la pulpa de papaya var. Maradol entre 4.7 N y 6.9 N es indicador de madurez de consumo (Santamaría y col., 2009b).
Utilizando la escala propuesta por Santamaría y col. (2009b), fue posible establecer que, los frutos tratados con las películas alcanzaron a los 10 d una madurez grado
4, menor a la del fruto control (grado 6), lo
que indica una prolongación de la vida de anaquel.
Respiración
Los
frutos sin recubrimiento presentaron un pico máximo (45.6 mg de CO2
kg/h) de producción de CO2 a los 6 d de almacenamiento
(Figura 4A). Este patrón de respiración corresponde,
como se esperaba, a un fruto climatérico,
caracterizado por un patrón oscilatorio en la producción de CO2
y un aumento en la producción de etileno
(Sañudo y col., 2008; Velasco-Ulloa y col., 2012).
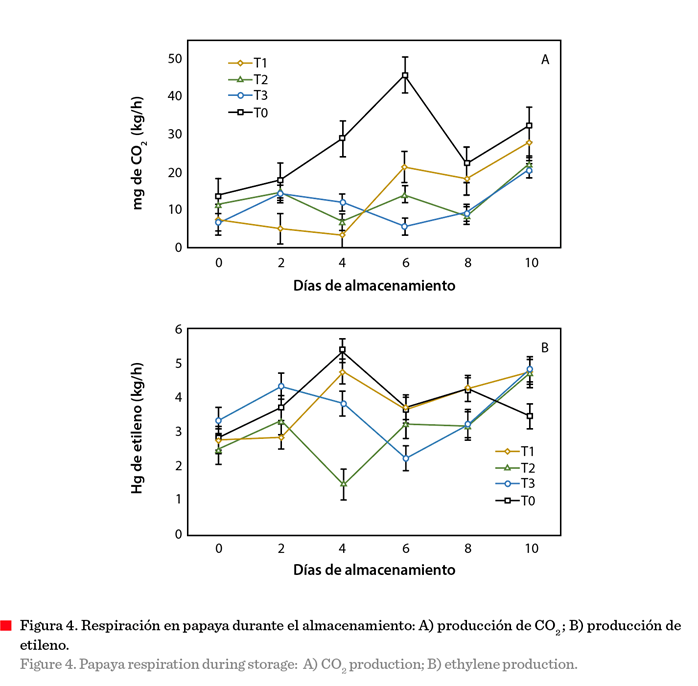
La producción de CO2
fue menor en los frutos con recubrimiento, con diferencias significativas en su
tendencia oscilatoria (Figura 4A). El fruto con el T1 presentó un pico máximo
en el día 6 y a partir de ahí se mantuvo con la mayor tasa de producción de CO2.
Los frutos con T2 reportaron dos picos
elevados los días 2 y 6, y su valor
máximo el día 10. En tanto que los frutos con T3 presentaron un pico
máximo el día 2 y después de alcanzar su
mínimo el día 6 incrementaron su producción de CO2 hasta
alcanzar el máximo el día 10. Este
comportamiento sugiere que, aunque no perdieron su característica
climatérica, los tratamientos disminuyeron
sus tasas de respiración, con producción máxima de 27.9 mg de CO2
kg/h, retrasando la maduración, lo cual concuerda con los datos observados en
los cambios de color, firmeza y SST.
Las
concentraciones de CO2 fueron similares a las reportadas por
Mercado-Ruiz y col. (2014),
quienes utilizaron una composición diferente
de recubrimiento (cera comestible) aplicado a frutos de papaya
almacenados a temperatura ambiente por 12 d.
Concluyeron que la producción de CO2 dependió principalmente
de la variedad y de los componentes del
recubrimiento. En el presente estudio,
la aplicación del
recubrimiento de quitosano y aceite esencial
de cítrico permitió controlar la tasa de producción de CO2 (Figura
4A). No obstante, la aplicación de
recubrimientos no siempre permite
mejorar la vida de anaquel de un producto.
Pontigo-Suárez y col. (2015) encontraron
que la tasa respiratoria se elevó (165.4 mg de CO2 kg/h) y con ello
la velocidad de maduración, en los frutos con recubrimiento a base de carboximetilcelulosa y aceite esencial de orégano,
debido posiblemente al estrés que se provocó en los frutos durante la
aplicación del recubrimiento.
La presencia de compuestos
activos, añadidos a los recubrimientos, permiten retardar la senescencia del
fruto. Esto se atribuye principalmente a la naturaleza hidrofóbica que se
confiere al recubrimiento de la barrera física formada; a la modificación de la
permeabilidad de la película, lo que permite
regular la concentración de O2 y CO2 que recibe y libera el fruto; la reducción del número de poros
por el cual el vapor de agua y otros gases se intercambian; y a la presencia de
compuestos con actividad antioxidante y antifúngica (Télles-Pichardo y col.,
2013).
Los
recubrimientos en frutos actúan como una barrera semipermeable, modificando el intercambio gaseoso del interior de la fruta con el
medio exterior, el recubrimiento provocó una disminución en la tasa respiratoria y transpiración, por lo tanto, una prolongación de la vida poscosecha de producto (Rahimi y col.,
2019).
La
producción de etileno se muestra en la Figura 4B. Los tratamientos control (T0)
y T1 presentaron un comportamiento muy parecido, con un pico de producción de etileno (4.7 mL/kg/h y 5.3 mL/kg/h,
respectivamente) a los 4 d, que no fue diferente significativamente (P < 0.05). En tanto que, los T2 y
T3 presentaron un pico de etileno en el día
2 con disminución gradual al día 4 y
6, respectivamente, para volver a
incrementar y alcanzar su
máximo nivel. Este comportamiento coincidió
con el de la oscilación de la tasa respiratoria que mostraron ambos
frutos (Figura 4A). La variación de la
producción de etileno en los frutos
fue similar a lo reportado por Sañudo
y col. (2008); y Santamaría y col. (2009a), con un patrón respiratorio observado para frutas climatéricas, con oscilaciones constantes durante
el periodo de almacenamiento (Sañudo y col., 2008; Velasco-Ulloa y col., 2012).
Efectividad de los recubrimientos en el control C.
gloeosporioides
La aplicación de los
recubrimientos biodegradables en los frutos inoculados con C. gloeosporioides mostraron una reducción significativa
de los síntomas de la enfermedad con respecto al testigo (mayor al 80 %) (Tabla
3). Las diferentes concentraciones del aceite esencial no mostraron diferencia significativa (P <
0.05) sobre los porcentajes de
severidad y efectividad en la inhibición de C. gloeosporioides,
por lo que, el efecto de los tratamientos
posiblemente esté asociado más a la capacidad inhibitoria del quitosano,
que de los aceites. El efecto inhibidor de
este polímero depende de su
concentración, el grado de polimerización de la cadena de glucosamina, el grado de desacetilación (en este estudio de 18.2 ± 2.9), el porcentaje
de acetilación (57.1 %) e incluso, el tiempo
de exposición sobre la célula fúngica (Hernández-Lauzardo y col., 2005).
Es importante considerar que los hongos presentan diferente sensibilidad al
quitosano y esto puede ser debido a la composición de fosfolípidos de membrana
y particularmente a la naturaleza de sus cargas (Palma-Guerrero y col., 2008;
Ramos y col., 2010). La interacción del quitosano con los grupos de cabeza de
fosfolípidos cargados o las proteínas que componen la pared celular permite su
capacidad para entrar e interactuar con el ADN y con ello, alterar su
conformación e inhibir la síntesis de ARN y de proteína (El-Ghaouth y col.,
1992; Hernández-Lauzardo y col., 2005). El uso del quitosano para el control de
las enfermedades poscosecha promete ser una nueva alternativa de conservación
de los productos hortícolas durante el almacenamiento sin riesgos ecológicos; sin embargo, es necesario continuar profundizando en los diferentes aspectos básicos
que contribuyen a explicar el efecto de
la aplicación de este biopolímero en las frutas y hortalizas. Dos-Passos-Braga
y col. (2019) reportaron una
disminución de 49 % a 100 %, en los
síntomas de antracnosis en papaya, a 25 °C ± 0.5 °C durante 10 d, con un
recubrimiento a base de quitosano (5 mg/mL)
y aceite esencial de Mentha piperita L
(1.25 mL/mL). En este estudio la disminución de síntomas de antracnosis varió de 80.7 % a 84 %, almacenados a
una temperatura de 24 °C ± 0.2 °C durante 10 d (Tabla 3).
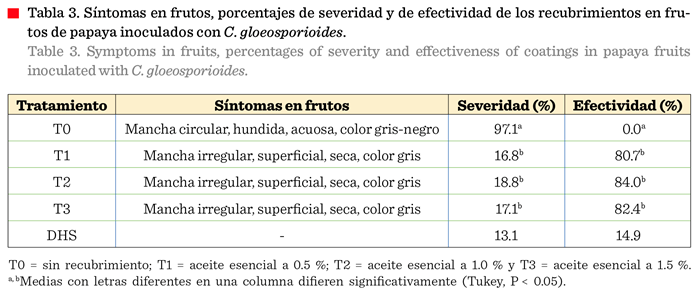
Los porcentajes de control
del hongo para los frutos con recubrimiento fueron de 60 %. Los resultados
fueron similares a lo reportado por Bosquez-Molina y col. (2010), quienes
lograron reducir 60 % la antracnosis en papayas con recubrimiento adicionado
con aceite esencial de limón mexicano a 0.1
%. Los mismos autores observaron que
la concentración de aceite esencial utilizado en la formulación del
recubrimiento no fue un factor determinante en la reducción del desarrollo del
hongo.
Integridad del
recubrimiento
En todos los tratamientos
con recubrimiento se observó un desprendimiento del mismo
a los 10 d de almacenamiento (Figura 5). Varios factores pudieron ocasionar el desprendimiento, como la pérdida
de peso del fruto, la naturaleza química de los componentes del recubrimiento
y/o la concentración del aceite esencial en la formulación del recubrimiento.
Pontigo-Suárez y col. (2015) observaron a los 7 d, el desprendimiento de los
recubrimientos aplicados en papaya a base de carboximetilcelulosa y aceite
esencial de clavo y canela, matriz diferente a la evaluada en la presente
investigación. Por lo tanto, se requieren más estudios para mejorar las
condiciones de aplicación de este tipo de recubrimientos en frutas y
hortalizas, así como, evaluar las propiedades fisicoquímicas, mecánicas y
térmicas que pudieran condicionar la calidad
del fruto en relación con su vida de
anaquel y preferencias de los consumidores.

CONCLUSIONES
El aceite esencial de Citrus
reticulata registró mejor rendimiento y mayor
actividad antifúngica in vitro contra Colletotrichum
gloeosporioides en comparación con los aceites de
C. sinensis y C. paradisi.
Los frutos con recubrimiento presentaron
mayor vida de anaquel respecto al
control, el cual alcanzó su madurez en los 10 d que duró el estudio. El uso de
recubrimientos biodegradables, combinando quitosano con aceite esencial de C. reticulata,
aplicados en frutos de papaya en etapa poscosecha, demostró ser eficaz,
por lo que podría ser una alternativa para
darles mayor vida de anaquel por su capacidad de controlar la antracnosis, disminuir la pérdida de peso y
firmeza, y retrasar el cambio de color
de verde a anaranjado de la
epidermis del fruto sin afectar la producción de sólidos solubles totales.
AGRADECIMIENTOS
Los autores de la presente
investigación agradecen al Centro de Investigación y Desarrollo, Sonora,
México, por la donación de quitosano para elaborar el recubrimiento utilizado
como parte del objetivo de este trabajo.
Referencias
Abbott, W. S. (1925). A method of
computing the effectiveness of an insecticide. Journal of Economic Entomology. 18(2):
265-267.
Acosta, R. M., Nieto-Ángel, D., Domínguez-Álvarez, J. L. y Delgadillo-Sánchez, F. (2001). Calidad y
tolerancia en frutos de papaya (Carica papaya L.) a la inoculación del
hongo Colletotricum gloeosporioides
Penz., en postcosecha. Revista Chapingo Serie Horticultura. 7(1): 119-124.
Alam, A., Tripathi,
A., Sharma, V., and Sharma, N. (2017). Essential oils: A novel consumer and ecofriendly
approach to combat postharvest phytopathogens.
Journal of Advances in Biology & Biotechnology. 11(1): 1-16.
AOAC,
Association of Official Analytical Chemist (1990). Official Methods of
Analysis. (Thirtenth edition). Washington D.C., USA: AOAC.1023 Pp.
Araya, A. y Meneses, L. (2010). Influencia de algunos ácidos
sobre las propiedades Físico-químicas de películas de
quitosano obtenidas a partir de desechos de cangrejo. Revista Tecnológica
ESPOL. 23(1): 143-148.
Ayón-Reyna, L. E., González-Robles, A., Rendón-Maldonado, J.
G., Báez-Flores, M. E., López-López, M. E., and Vega-García, M.
O. (2017). Application of a hydrothermal-calcium chloride treatment to inhibit
postharvest anthracnose development in papaya. Postharvest Biology
and Technology. 124: 85-90.
Badillo, V. M. and Leal, F. (2019).
Taxonomy and botany of the Caricaceae. Horticultural
Reviews. 47: 289-323.
Barnett, H. L.
and Hunter, B. B. (1998). Illustrated Genera of Imperfect Fungi. (Fourth
edition). APS Press, St. Paul. 218 Pp.
Barragán-Iglesias,
J., Méndez-Lagunas, L. L., and Rodríguez-Ramírez, J. (2018). Ripeness indexes
and physicochemical changes of papaya (Carica
papaya L. cv. Maradol) during ripening on-tree. Scientia
Horticulturae. 236: 272-278.
Bauer, A. W.,
Kirby, M. M., Sherris, J. C., and Turck, M. (1966).
Antibiotic susceptibility testing by a standardized single disk method. American
Journal Clinical Pathology. 45: 493-496.
Bauer, J. L., Villegas, L. F., and Zucchetti, A. (2022). Applications
of chitosan in agriculture, industry, and health. South Florida
Journal of Environmental and Animal Science. 2(2): 37-45.
Boaro, C. S. F.,
Vieira, M. A. R., Campos, F. G., Ferreira,G., Chacón, I. D. C., and Marques, M.
O. M. (2019). Factors influencing the
production and chemical composition of
essential oils in aromatic plants from Brazil, in Essential Oil
Research. [En línea]. Disponible en:
https://doi.org/10.1007/978-3-030-16546-8_2.
Fecha de consulta: 20 de enero de 2020.
Bosquez-Molina, E.,
Ronquillo-de-Jesús, E., Bautista-Baños, S., Verde-Calvo, J. R., and
Morales-López, J. (2010). Evaluation of the inhibitory effect
of essential oils against Colletotrichum gloeosporioides
and Rhizopus stolonifer in stored papaya fruit and their possible application
in coatings. Postharvest Biology
and Technology. 57(2): 132-137.
Burt, S. A. (2004). Essential oils:
their antibacterial properties and potential applications in foods – a review. International
Journal of Food Microbiology. 94: 223-253.
Calero, N., Muñoz, J. y Guerrero, A.
(2013). Efecto del pH en emulsiones
o/w formuladas con proteína de patata y quitosano. Grasas y Aceites.
64(1): 15-21.
Cunha, M., Passos, F. R., Mendes, F. Q., Pigozzi, M. T.,
and Carvalho, A. M. X. (2018). Propolis extract from different
botanical sources in postharvest conservation of papaya, in Acta Scientiarum. Technology. [En
línea]. Disponible en: https://doi.org/10.4025/actascitechnol.v40i1.31074.
Fecha de consulta: 20 de enero de 2020.
Dos-Passos-Braga, S., Lundgren, G.
A., Macedo, S. A., Tavares, J. F., dos-Santos-Vieira W. A., Câmara,
M. P. S., and de-Souza, E. L. (2019). Application of coatings formed by chitosan and Mentha essential oils to control anthracnose caused by Colletotrichum
gloesporioides and C. brevisporum
in papaya (Carica papaya L.) fruit. International Journal of Biological Macromolecules. 139: 631-639.
Dukare, A. S., Paul, S.,
Nambi, V. E., Gupta, R. H., Singh, R., Sharma, K., and
Vishwakarma, R. K. (2018). Exploitation of microbial antagonists for the
control of postharvest diseases of fruits: a review. Critical Reviews in
Food Science and Nutrition. 59(9): 1498-1513.
Dutra, K., de-Oliveira, J. V.,
Navarro, D. M. D. A. F., and Santos, J. P.
O. (2016). Control of Callosobruchus
maculatus (FABR.) (Coleoptera: Chrysomelidae: Bruchinae) in
Vigna unguiculata (L.)
WALP. with essential oils from four Citrus
spp. plants. Journal of Stored Products Research. 68: 25-32.
El-Ghaouth,
A., Arul, J., Asselin, A., and Benhamou, N. (1992). Antifungal activity of
chitosan on post-harvest pathogens: induction of morphological and cytological
alterations in Rhizopus stolonifer. Mycological Research.
96: 769-772.
Fernández, V., Bautista, B., Fernández, V., Ocampo, R., García, P. y Falcón, R. (2015). Películas y
recubrimientos comestibles: una
alternativa favorable en la conservación poscosecha
de frutas y hortalizas. Revista Ciencias Técnicas Agropecuarias. 24(3):
52-57.
Hernández, C. H., Águila, A. E., Flores, A. O., Viveros, N.,
E. L. y Ramos, C. E. (2009). Obtención y caracterización de quitosano a partir
de exoesqueletos de camarón. Superficies y Vacío. 22(3): 57-60.
Hernández-Lauzardo, A. N.,
Bautista-Baños, S., Velázquez-del-Valle, M. G., Rodríguez-Ambriz, A. L., Corona-Rangel, M. L., Solano-Navarro, A. y Bosquez-Molina,
E. (2005). Potencial del quitosano en el control de las enfermedades
postcosecha. Revista Mexicana de Fitopatología. 23(2): 198-205.
Hernández-Ochoa, L., Gonzáles-Gonzáles, A., Gutiérrez-Méndez, N., Muñoz-Castellanos, L. N. y
Quintero-Ramos, A. (2011). Estudio de la actividad antibacteriana de
películas elaboradas con quitosano a diferentes pesos moleculares incorporando aceites
esenciales y extractos de especias como agentes antimicrobianos. Revista
Mexicana de Ingeniería Química. 10(3): 455-463.
Lota, M. L., Serra, D. R., Tomi, F., and
Casanova, J. (2001). Chemical variability of peel and leaf essential oils of 15 species of mandarins. Journal of Applied Polymer Science. 112: 2166-2178.
Martínez-Tenorio, Y. y López-Malo, V. (2011). Envases activos con agentes antimicrobianos y su
aplicación en los alimentos. Temas
selectos de Ingeniería de Alimentos. 5(2): 1-12.
Mercado-Ruiz, J. N., Guzmán-Reyes, I. C., García-Robles, J.
M., Salinas-Hernández, R. M. y Báez-Sañudo, R. (2014). Efecto del recubrimiento
con ceras comestibles en fruto de papaya (Carica papaya L.) sobre su calidad
durante el almacenamiento. Revista
Iberoamericana de Tecnología Poscosecha.
15(1): 31-40.
Miranda, A. D., Alvis, A. y Arrazola, G.
(2014). Efectos de dos recubrimientos sobre la
calidad de la papaya (Carica papaya L.) variedad Tainung.
Temas Agrarios. 19(1): 7-18.
Nayak, S. L., Sethi, S., Sharma, R.
R., and Prajapati, U. (2019). Active edible coatings for fresh fruits and
vegetables. In T. Gutiérrez (Ed.), Polymers for AgriFood
Applications (pp. 417-432). USA. Springer
International Publishing, Cham.
Osuna-García, J. A., Beltrán, J. A. y
Pérez-Barraza, M. H. (2005). Mejoramiento de vida de anaquel y calidad de papaya
“Maradol” con 1-metilciclopropeno (1-MCP). Revista
Chapingo Serie Horticultura. 11(1): 7-12.
Palma-Guerreo, J., Jansson, H., Salinas, J., and López-Llorca, L. (2008). Effect of chitosan on hyphal and
spore germination of plant pathogenic and biocontrol fungi. Journal of
Applied Microbiology. 104(2): 541-553.
Philibert, T., Lee, B. H., and
Fabien, N. (2016). Current Status and New
Perspectives on Chitin and Chitosan as Functional
Biopolymers. Applied Biochemistry and Biotechnology. 181(4): 1314-1337.
Pontigo-Suárez, A. G., Trejo-Márquez, M. A. y Lira-Vargas, A. A. (2015). Desarrollo de un recubrimiento
con efecto antifúngico y antibacterial a base
de aceite de orégano para conservación de papaya maradol.
Revista Iberoamericana de Tecnología Poscosecha. 16(1): 58-63.
Rabari, V. P., Chudashama, K. S.,
and Thaker V. S. (2017). In vitro Screening of 75 Essential Oils Against Colletotrichum gloeosporioides: A Causal Agent of Anthracnose Disease of Mango. International Journal of Fruit Science.
18(1): 1-13.
Rahimi, R., ValizadehKaji, B., Khadivi, A.,
and Shahrjerdi, I. (2019). Effect of chitosan and thymol essential oil on quality
maintenance and shelf-life extension of peach
fruits cv. ‘Zaferani’. Journal of Horticulture
and Postharvest Research. 2(2): 143-156.
Ramos, G. M., Bautista, B. S.,
Barrera, N. L., Bosquez, M. E., Alia, T. I. A. y
Estrada, C. M. (2010). Compuestos antimicrobianos
adicionados en recubrimientos comestibles
para uso en productos hortofrutícolas. Revista Mexicana de
Fitopatología. 28(1): 44-57.
Rojas-Fernández, M. M., Corzo-López, M., Sánchez-Pérez, Y.,
Brito, D., Montes-de-Oca, R., Martínez, Y. y Pino-Pérez, O. (2014). Actividad antibacteriana de aceites esenciales
sobre Pectobacterium carotovorum subbsp. carotovorum.
Revista Protección Vegetal. 29(3): 197-203.
Rodríguez-Delgado, M. M., Martinez-Ledezma,
C., and Villarreal-Chiu, J. F.
(2019). Advances in biocoaters
for nanoparticles and biodegradable delivery
systems in agriculture and food industry: Toward a safer and eco-friendly nanotechnology.
[En
línea]. Disponible en: https://doi.org/10.1007/978-3-030-17061-5_14. Fecha de
consulta: 21 de enero de 2020.
Sharifi-Rad, J., Sureda,
A., Tenore, J. C., Daglia,
M., Sharifi-Rad, M., Valussi, M., …, and Iriti, M. (2017). Biological
activities of essential oils: From plant chemoecology
to traditional healing systems. Molecules. 22(1): 70.
Sharma, N. and
Tripathi, A. (2006). Fungitoxicity of the essential oil of Citrus sinensis on
post-harvest pathogens. World Journal of Microbiology and Biotechnology.
22(6): 587-593.
Santamaría, B. F., Díaz, P. R.,
Gutiérrez, A. O., Santamaría, F. J. y Larqué, S. A. (2011). Control de dos especies de Colletotricum
causantes de antracnosis en frutos de papaya maradol. Revista Mexicana de Ciencias Agrícolas.
2(5): 631-643.
Santamaría, B. F., Díaz, P. R., Sauri, D. E., Espadas, G. F.,
Santamaría, J. M. y Larqué, S. A. (2009b). Características de calidad de frutos
de papaya maradol en la madurez de consumo. Agricultura Técnica en México. 35(3):
347-353.
Santamaría, B. F., Sauri, D. E., Espadas, G. E., Díaz, P. R.,
Larqué, S. A., and Santamaría, J. M. (2009a). Postharverst
ripening and maturity
indexes for maradol papaya. Interciencia.
34(8): 583-588.
Sañudo, B. J. A., Siller, C. J., Osuna, E. T., Muy, R. M.,
López, A. G. y Labavitch, J. (2008). Control de la
maduración en frutos de papaya (Carica papaya L.) con
1-metilciclopropeno y ácido 2-cloroetil fosfónico. Revista
Fitotecnia Mexicana. 31(2): 141-147.
Shakya, R. and Lal, M. A. (2018). Fruit
Development and Ripening. In Plant
Physiology, Development and Metabolism. Springer, Singapur. 857-883 Pp.
Singh, M., Pandey, K. D., Rathore, A.
C., Sharma, S. P., and Kumar, R. (2022). Bacterial antagonists: Effective tools for the management of postharvest diseases
in fruits, vegetables, and food grains. In A. Kumar (Ed.), Microbial
Biocontrol: Food Security and
Post-Harvest Management (pp.
259-309). USA. Springer International Publishing, Cham.
Télles-Pichardo, R., Cruz-Aldaco, K., Ochoa-Reyes, E., Aguilar, C. N. y Rojas,
R. (2013). Cubiertas comestibles de cera y polifenoles de candelilla:
una alternativa de conservación de papaya (Carica
papaya L.). Revista Científica de la Universidad Autónoma
de Coahuila. 5(10): 1-7.
Vela-Gutiérrez, G., Del-Ángel-Coronel, O. A., Cabrera-Ponce, J. L., Gómez-Lim, M. A. y
García-Galindo, H. S. (2016). Transformación de embriones de papaya maradol (Carica papaya L.) con el gen 9/13 de la
lipoxigenasa. Revista Internacional de Investigación e Innovación
Tecnológica. 4(22): 1-14.
Velasco-Ulloa, B., Mercado-Ruiz, J. N.,
García-Robles, J. M. y Báez-Sañudo, R. (2012). Respuesta física y fisiológica a
la aplicación de cera comestibleen mangos (Magnifera indica L.) cvs.
Tommy Atkins y Keitt. Revista Iberoamericana de
Tecnología Postcosecha. 13(2): 130-139.
Wang, D., Zhang, J., Jia, X., Xin, L., and Zhai, H. (2019). Antifungal
effects and potential mechanism of essential oils on Collelotrichum
gloeosporioides in vitro and in vivo.
Molecules. 24(18): 3386.
Yuan, G., Chen, X., and Li, D.
(2016). Chitosan films and coatings containing essential oils: The antioxidant and antimicrobial activity, and application in
food systems. Food Research International. 89: 117-128.