https://doi.org/10.29059/cienciauat.v18i1.1749
Alertamientos y movimientos
periódicos de las piernas durante las etapas de sueño y deterioro cognitivo
leve en adultos mayores. Estudio
preliminar
Arousals
and periodic leg movements during sleep stages and mild cognitive impairment in
older adults: a preliminary study
Sueño
y deterioro cognitivo leve
Alejandra Rosales-Lagarde1,2*, Claudia Isabel
Martínez-Alcalá1,3, Erika Elizabeth Rodríguez-Torres4,
Lourdes Cubero-Rego5
1Consejo
Nacional de Humanidades, Ciencias y Tecnologías, Dirección Adjunta de
Desarrollo Científico, Av. Insurgentes sur núm. 1582, 4º piso ala sur, col.
Crédito Constructor, Alcaldía Benito Juárez, Ciudad de México, México, C. P.
03940. 2Instituto Nacional de Psiquiatría Ramón de la Fuente Muñiz,
Servicios Clínicos, Alcaldía Tlalpan, Ciudad de México, México. 3Universidad
Autónoma del Estado de Hidalgo, Instituto de Ciencias de la Salud, Municipio
San Agustín Tlaxiaca, Hidalgo, México. 4Universidad Autónoma del
Estado de Hidalgo, Instituto de Ciencias Básicas e Ingeniería, Área Académica
de Matemáticas y Física, Municipio Mineral de la Reforma, Hidalgo, México. 5Universidad
Nacional Autónoma de México, Unidad de Investigaciones en Neurodesarrollo,
Juriquilla, Querétaro, México.
RESUMEN
La
fragmentación del sueño puede asociarse con distintas enfermedades, entre
ellas, la demencia. En este sentido, la fragmentación de sueño, indicada por el
índice de alertamientos y/o movimientos periódicos de las piernas (MPP), podría
ser un marcador temprano de deterioro cognitivo leve (DCL), un síndrome
precursor de la demencia. El objetivo del presente estudio fue medir el índice
de prevalencia de los alertamientos y de los MPP durante el sueño en un grupo
control y un grupo con DCL, así como determinar si hay diferencia entre los
grupos en ambos índices y establecer si existe una correlación entre los dos
fenómenos. En 9 participantes (3 mujeres controles y 3 mujeres con DCL; y 3
hombres con DCL) (edad: 69.1 ± 5; años de educación: 8 ± 2) se registró una noche
de polisomnografía. Se obtuvieron los índices por hora de alertamientos y para
cada etapa de sueño, así como los MPP globales y por hora; además se realizaron
análisis entre y dentro de cada grupo. Se encontró una correlación positiva y
un mayor número de MPP que de alertamientos durante toda la noche en los
participantes con DCL. Conocer la prevalencia y asociación de ambos fenómenos
contribuye en la formulación de una evaluación más cuidadosa y profunda de los
adultos mayores en riesgo de desarrollar DCL y/o demencia.
PALABRAS
CLAVE: deterioro cognitivo leve, sueño, polisomnografía, movimientos periódicos
de las piernas, alertamientos.
ABSTRACT
Sleep fragmentation may be associated with several diseases, including dementia. In this sense, sleep
fragmentation, indicated by the rates
of arousals and/or periodic leg
movements (PLM), could be an early marker
of Mild Cognitive Impairment (MCI), a syndromic stage prior to dementia. Therefore,
the objective of this study was to compare the index of PLM with that of
arousals and correlate both indexes in people with MCI and without MCI during
all sleep stages. In 9 participants (3 control women and 3 women with MCI; and
3 men with MCI) (ages: 69.1 ± 5; years of education: 8 ± 2), one night of
polysomnography was performed. Hourly rates of arousals and PLM were scored
from each sleep stage. Analyses were performed within and between PLM and
arousals for each group. Significant differences and a positive correlation
were found between the arousal and the PLM rates for the group with MCI during
the whole night. Knowledge of the prevalence and the association of both
phenomena may contribute to a more careful and thorough evaluation of older
adults at risk of developing MCI and/or dementia.
KEYWORDS:
mild cognitive impairment, sleep, polysomnography, periodic leg movements,
arousals

INTRODUCCIÓN
Desde un punto de vista
fisiológico, el sueño es un proceso complejo (Corsi-Cabrera, 2018). Intrincadas
redes de neuronas (McGinty y Szymusiak,
2017) generan potenciales eléctricos, representados en una gráfica de voltaje
sobre el tiempo, medidos desde el cuero cabelludo mediante sensores llamados
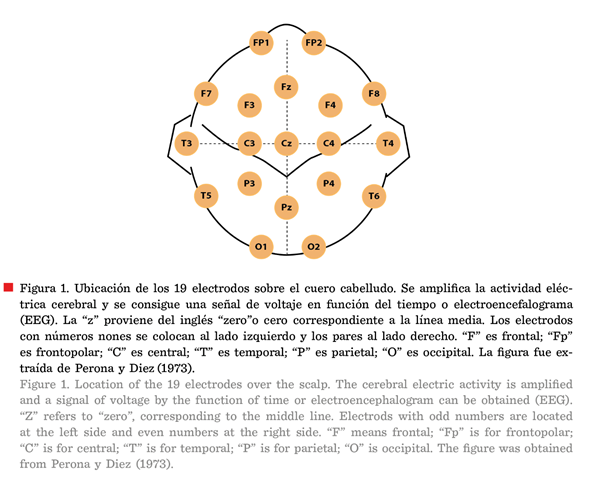
electrodos (Paniagua e Iznaola, 2015). Es posible
colocar 19 electrodos sobre el cuero cabelludo de acuerdo con un sistema
internacional llamado “10-20”, según la proporción de cada cabeza respecto a
puntos estándar fácilmente localizables (Ferré y Sagalés,
2015) (Figura 1).
Además del registro de la
actividad eléctrica cerebral o electroencefalograma (EEG), la técnica no
invasiva de la polisomnografía (PSG) –o registro de múltiples componentes
durante el sueño– comprende la medición de la actividad eléctrica ocular o electrooculograma (EOG) (Ferré y Lainez,
2015), para lo cual se colocan al menos dos electrodos cerca de los cantos de
los ojos; también de la actividad muscular o electromiograma (EMG), situando
dos electrodos sobre los músculos del mentón (Ferré y Lainez,
2015). La señal obtenida durante el sueño, a partir del EEG, EOG y EMG, cambia
su morfología de acuerdo con las áreas cerebrales registradas: frontales,
centrales, parietales u occipitales y de sus referencias (o electrodos
adicionales auxiliares).
El sueño se clasifica en dos:
el sueño de movimientos oculares rápidos (sueño MOR) (Siegel, 2017) y, el de no
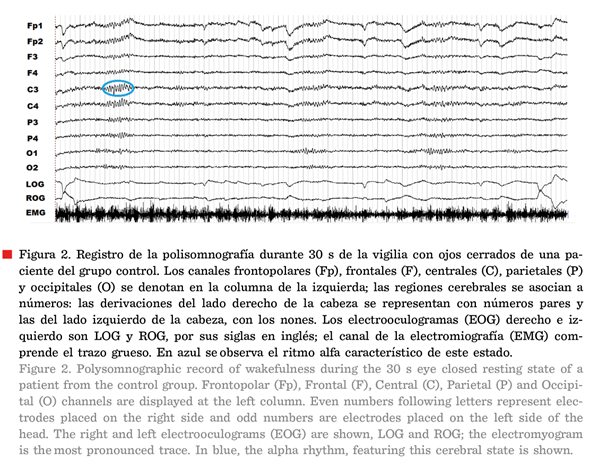
MOR (sueño NMOR). El sueño NMOR se divide a su vez en etapas 1, 2 y 3 (Ferré y Lainez, 2015). Cuando se está despierto o en el estado de
vigilia con ojos cerrados se puede observar un registro en donde predomina un
EEG con oscilaciones denominadas “ritmo alfa” y un tono muscular alto (Figura
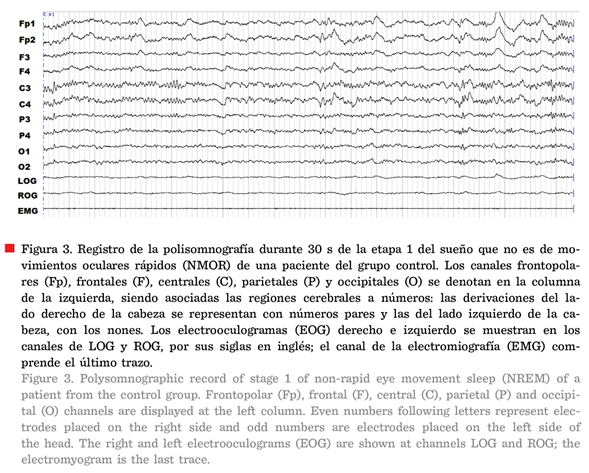
2). En cambio, cuando el sueño propiamente comienza, es decir, en un registro
de la etapa 1 del sueño NMOR, se observan frecuencias mezcladas, hay
disminución del ritmo alfa y el tono muscular es menor que en vigilia (Figura
3) (AASM, 2007; Ferré y Lainez, 2015).
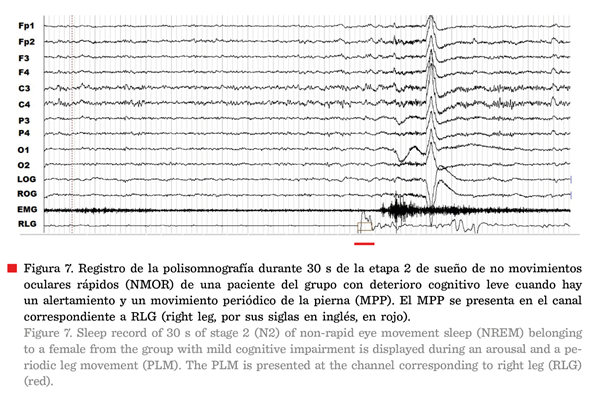
En la Figura 4 se presenta el
registro de un paciente control en la etapa 2 de sueño NMOR, cuyos
grafo-elementos principales son los husos de sueño y
los complejos K. Los husos de sueño son ondas
oscilatorias sinusales de 7 Hz a 14 Hz con una duración de 1 s a 2 s y los
complejos K son ondas bifásicas seguidas o no de un huso de sueño (Nuñez y Rodri go, 2015). Ambos
grafo-elementos representan a un fenómeno que podría resumirse como un estado
cerebral de marcapasos en un organismo con “puertas cerradas” por un bloqueo de
los mecanismos del despertar y la presencia de circuitos neuronales con
tendencia inhibitoria (McGinty y Szymusiak,
2017). En ocasiones es posible observar el surgimiento de ambos fenómenos ante
estímulos del medio, sin embargo, por lo general su presencia implica una falla
en la transmisión de información entre los circuitos neuronales (Corsi-Cabrera,
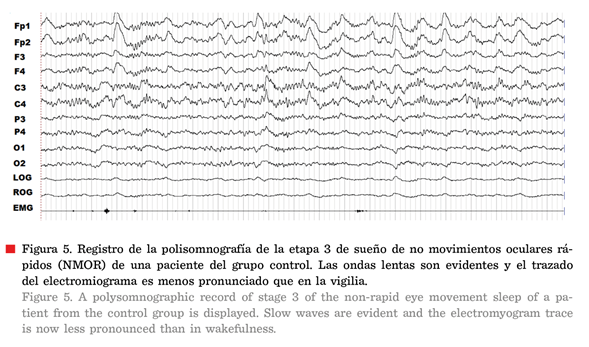
2018). La etapa 3 contiene ondas lentas (Figura 5) (McGinty
y Szymusiak, 2017) y la amplia sincronía de la
actividad neuronal favorece una transmisión de la información pobre y
fragmentada (Corsi-Cabrera, 2018). 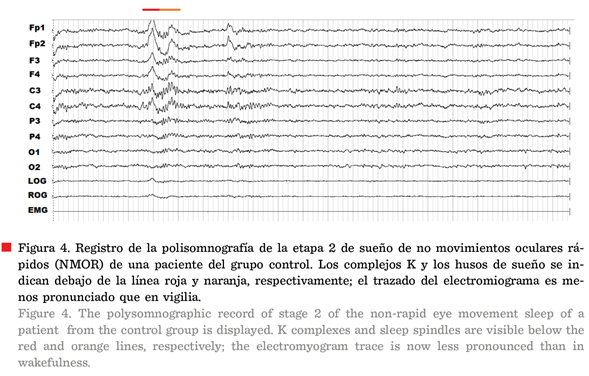
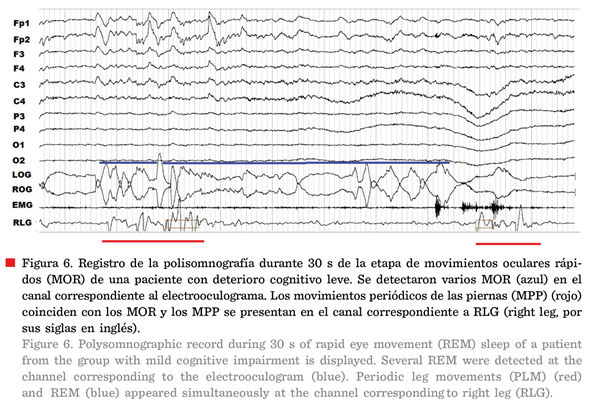
Tanto para el sueño NMOR como
para el MOR hay dos posibles indicadores de la fragmentación: los movimientos
periódicos de las piernas (MPP) y los arousals o
alertamientos. Los MPP se observan en vigilia, el sueño NMOR y MOR, incluso
cuando hay movimientos oculares rápidos. En esta última etapa de sueño MOR
(Figura 6) se detectan proporcionalmente menos MPP que durante el sueño NMOR
(Figura 7), debido a su atonía muscular característica (Rosales-Lagarde y col.,
2009; Calvo y García-Borreguero, 2015). Los MPP y los alertamientos son
fenómenos relacionados con las activaciones simpáticas del sistema nervioso y
la frontera entre su caracterización como fenómenos normales o anormales
continúa en debate (Ferri y Fulda, 2017; Parrino y Terzano, 2017). La frecuencia y las
manifestaciones subjetivas de una mala calidad de sueño y/o la sensación de
malestar en las piernas, son especialmente características del síndrome de
piernas inquietas (SPI) (Ashbrook y During, 2017). El SPI implica el movimiento de las piernas
involuntario con parestesias y dolor (Ashbrook y During, 2017).
Los MPP representan
contracciones periódicas de los músculos tibiales anteriores y de otros
músculos cercanos (Calvo y García-Borreguero, 2015), ligados a incrementos de
la presión sanguínea (Pennestri y col., 2007; Ferri y
col., 2015; Sieminski y col., 2017a; 2017b). Su
significado clínico depende de la frecuencia y puede variar según los
estándares de puntuación que sean utilizados (Ferri y Fulda,
2017). Los criterios existentes incluyen un grupo de 5, o más recientemente, 15
MPP consecutivos en 1 h, con al menos 4 movimientos de las piernas consecutivos
con duración de al menos 0.5 s a 5 s, y un intervalo de los movimientos entre 4
s a 90 s (Ferri y Fulda, 2017). Los MPP pueden
ocurrir frecuentemente en sujetos sin quejas subjetivas de sueño (Boehm y col.,
2009; Claman y col., 2013; Frauscher y col., 2014).
Los alertamientos son otros
fenómenos ligados a la fragmentación de sueño, y son considerados fenómenos
espontáneos y benignos, dependientes de la madurez y de la edad (Parrino y Terzano, 2017). Los alertamientos también se han
relacionado con un estado de alerta fisiológica con influencias perjudiciales
para la salud, porque un índice abundante se asocia con varios desórdenes del
sueño, como insomnio y somnolencia excesiva diurna, de acuerdo con información
de la Asociación Americana de Medicina del Sueño (AASM, por sus siglas en inglés:
American Association of Sleep Medicine) (AASM, 2007; Claman y col., 2013).
El deterioro cognitivo leve (DCL)
es un padecimiento asociado a la pérdida de la memoria o de la capacidad
cognitiva (lenguaje, percepción visual o espacial), que se manifiesta de forma
temprana sin afectar la capacidad del individuo de realizar sus actividades
diarias de manera independiente (Parada-Muñoz y col., 2022). Se considera una
etapa intermedia entre la normalidad y la demencia que es posible detectar de
manera prematura, ya que antes de la alteración en las funciones psicológicas,
ocurren cambios en la fisiología cerebral. La demencia es un síndrome que
implica la pérdida parcial o combinada de funciones cognitivas junto con una
imposibilidad de ser independiente, por lo que es vital detectarla
tempranamente antes de su aparición (López-Álvarez y col., 2015). Las muertes
totales debidas a demencia fueron en un 65 % de mujeres, de acuerdo con la
Organización Mundial de la Salud (OMS, 2023). En México, el número estimado de
personas que tendrán demencia alcanzará los 3.5 millones para el 2050
(Gutiérrez-Robledo y col., 2017).
El conocimiento del vínculo
entre los MPP y los alertamientos es escaso en personas con DCL sin problemas
graves en el sueño y sin una sintomatología del SPI (RosalesLagarde
y col., 2019), tampoco se ha estudiado ampliamente su asociación con el riesgo
de desarrollar demencia. Es por ello la importancia de detectar a tiempo el DCL
en los adultos mayores y la aplicación oportuna de baterías neuropsicológicas
(López-Álvarez y col., 2015).
El objetivo de este trabajo
fue determinar la prevalencia de los alertamientos y de los movimientos
periódicos de piernas durante el sueño en un grupo control y un grupo con
deterioro cognitivo leve, así como conocer si hay diferencias entre los grupos
en ambos índices y establecer si existe una correlación entre ambos fenómenos.
MATERIALES Y MÉTODOS
Esta investigación consistió
en un estudio piloto ligado al programa de Cátedras-Consejo Nacional de Ciencia
y Tecnología (CONACYT) en la Universidad Autónoma del Estado de Hidalgo (UAEH)
en México. Se trató de un estudio transversal, no aleatorizado y exploratorio.
Invitación a participar
Se abrieron varias
convocatorias dirigidas a los adultos mayores, quienes acudieron por voluntad
propia. Se invitó a los adultos mayores del Centro Gerontológico Integral de
Punta Azul, en el Estado de Hidalgo, México. Adicionalmente se realizaron
invitaciones en el transcurso de la impartición de los talleres de
alfabetización digital y otras más fueron dirigidas a los alumnos de la UAEH
para convocar a sus abuelos.
Fase 1
Esta fase pretendía evaluar
al adulto mayor interesado en conocer su estado de salud mental. Era de acceso
abierto y los criterios de exclusión fueron los déficits pronunciados no
corregidos de la audición y la visión. Los 115 adultos mayores fueron
entrevistados y se obtuvo su edad, sexo y años de educación. Se administraron
varias escalas en sus versiones en español (Ugalde, 2010). Entre las escalas se
encontraban el test de Katz de las actividades de la
vida diaria (ADL, por sus siglas en inglés: Activities
of Daily Living), y la
Evaluación Mini del Estado Mental (MMSE, por sus siglas en inglés: Mini-Mental State Examination), usadas
comúnmente para diagnosticar demencia y DCL. El MMSE en su versión “Consenso
Mexicano para el Síndrome de Deterioro Intelectual” es una prueba de cribado
con 30 preguntas (Ugalde, 2010), que permite diagnosticar DCL en pacientes con
escolaridad de 8 a 12 años si solo alcanzan 21 a 22 puntos en sus respuestas.
Se determinó la posible presencia de depresión de acuerdo con la Escala
Geriátrica de Depresión (GDS, por sus siglas en inglés: Geriatric
Depression Scale), y de
ansiedad de acuerdo al Test Corto de Cribado de Ansiedad (SAST, por sus siglas
en inglés: Short Anxiety Screening Test), porque
estas variables tienen mayor prevalencia en adultos mayores con DCL (Zlatar y col., 2018) y pacientes con SPI (Fulda y col., 2010), en concurrencia con un tiempo de sueño
disminuido (Montplaisir y col., 2011). También se
administró el Neuropsi (Ostrosky y col., 1999) para
detectar DCL. El Neuropsi es una batería neuropsicológica
que además incluye en su protocolo un cuestionario sobre el estado de salud
(enfermedades, antecedentes de riesgo neurológico: traumatismos
craneoencefálicos con pérdida de conocimiento, entre otros) y se investigó
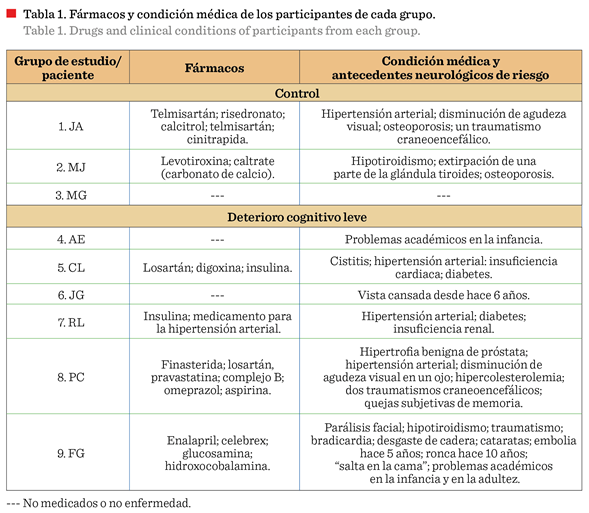
sobre los medicamentos que ingerían. Como antecedentes neurológicos de riesgo,
se consideraron, entre otros, a los problemas académicos en la infancia y en la
adultez de acuerdo con Harmony y col. (1990) (Tabla 1).
Fase 2
De los 115 participantes de
la fase 1, se acercaron a las investigadoras 21 adultos mayores que tuvieron
interés en conocer más sobre su salud y/o fueron exhortados por la coordinadora
del Centro Gerontológico Integral y/o por las propias investigadoras.
La fase 2 se centró en el
estudio psicológico y psicofisiológico del sueño y de la vigilia. La vigilia
fue investigada de diferentes formas: en reposo con ojos cerrados (Rodríguez-Torres
y col., 2020; 2023); durante tareas emocionales (Rosales-Lagarde y col., 2017)
y tareas ejecutivas (Rosales-Lagarde y col., 2021).
La investigadora principal y
una estudiante de maestría preguntaron a los adultos mayores interesados si su
sueño era bueno, regular o malo, de acuerdo con un cuestionario señalado más
adelante. Debido a que se sabe que los medicamentos para tratar el cáncer
influyen en el sueño, se excluyó a una adulta mayor en tratamiento de cáncer;
otros 2 adultos mayores no llegaron el día convenido al registro de la PSG. De
esta forma, el registro psicofisiológico del estado de vigilia con ojos
cerrados y durante la ejecución de tareas se realizó a 18 adultos mayores, de
los cuales 4 prefirieron ser registrados únicamente durante el estado de
vigilia, por lo tanto, el estudio psicológico y psicofisiológico del sueño se
llevó a cabo en 14 de ellos. De esos 14, en el momento de la colocación de los
electrodos, en 5 adultos mayores la hora indicada de su sueño era inminente. Es
conocido que la colocación de electrodos es un proceso artesanal cuya inversión
en horas deviene en sueño por parte de los adultos mayores, por lo que no
fueron puestos los electrodos de las piernas en 5 de ellos. Por lo tanto, a 9
personas (3 mujeres controles y 3 mujeres con DCL; y 3 hombres con DCL) (edad
de los dos grupos: 69.1 ± 5; años de educación: 8 ± 2) se les colocaron los
electrodos para el registro de MPP. Debido al reducido tamaño de la muestra, no
se realizó un análisis por separado de las variables de interés entre hombres y
mujeres.
Los 9 adultos mayores
cumplieron con los requisitos de inclusión: no tener demencia, depresión (ninguno
de los 9 adultos mayores sobrepasó el puntaje indicativo de depresión de la GDS
que sería mayor o igual a 11 puntos) o ansiedad (22 a 23 puntos en el límite o
mayor de 24 puntos); adicionalmente, que consideraran sus hábitos de sueño como
“buenos” o “regulares”, en el primer cuestionario de sueño aplicado; que no
ingirieran medicamentos que alteraran su sueño y que realizaran con
independencia sus actividades de la vida diaria. En la Tabla 1, se muestran los
fármacos ingeridos por grupo y la condición médica de cada participante, de los
cuales, 3 adultos mayores reportaron no estar bajo ninguna medicación (grupo de
DCL: 2/6; grupo control: 1/3), mientras que 1 de ellos mencionó que tampoco
presentaba ninguna enfermedad (grupo control: 1/3).
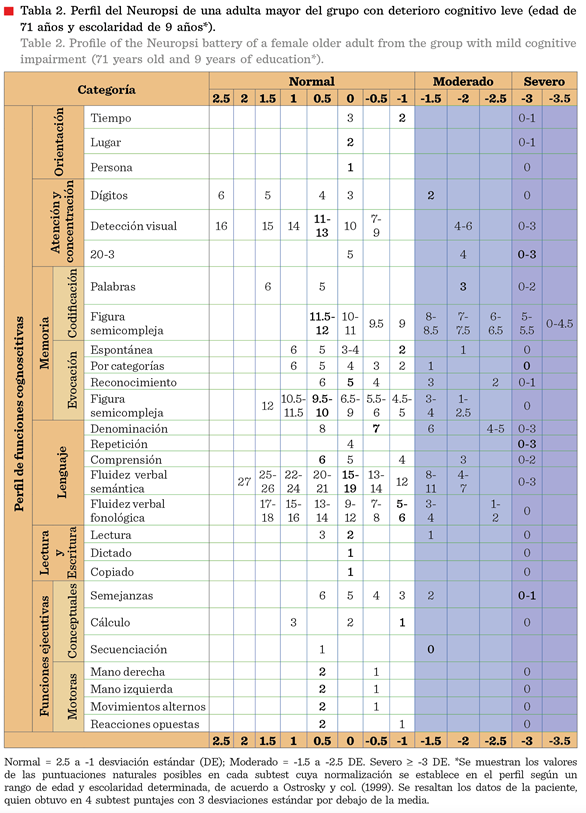
Deterioro cognitivo leve
La batería Neuropsi, con 130 reactivos, fue desarrollada en México e
incluye normas para individuos con educación y analfabetos. Se considera más
sensible en la detección del DCL que el MMSE (Ostrosky y col., 1999; Serrano y
col., 2013). Mide 6 dominios neuropsicológicos con 27 subtests
que suman un total de 130 puntos. Los 27 subtests
evalúan las funciones neuropsicológicas de: orientación (3 subtests);
atención y concentración (3 subtests); memoria en dos
modalidades: codificación (2 subtests) y memoria de
evocación (4 subtests); lenguaje (5 subtests); lectura y escritura (3 subtests)
y funciones ejecutivas (7 subtests) (Tabla 2) (Ostrosky
y col., 1999). Una vez calificados los subtests, se
puede conocer cuáles son las puntuaciones normalizadas al colocar aquellas
naturales en los perfiles específicos en cuanto a la edad y años de educación
particular. Usualmente se consideran pacientes con DCL aquellos que presentan
al menos 1.5 desviaciones estándar por debajo de la media (Tabla 2), en una prueba
cognitiva estandarizada (Petersen, 2004). Sin embargo, en este estudio se
utilizó como criterio para diagnosticar DCL, el presentar 3 desviaciones
estándar por debajo de la media en alguno de los subtests.
Esto vuelve más exigente el criterio y permite evitar considerar con DCL a
pacientes que pudiesen no tenerlo. Se utilizó la clasificación de Petersen
(2016) de DCL, que distingue entre los subtipos amnésico (DCL-a) y no-amnésico
(DCL-na), en dominios únicos o múltiples (DCL-dm)
(Petersen, 2004; 2016). Los sujetos que obtuvieron 3 desviaciones estándar por
debajo de la media en alguno de los subtests de
memoria (memoria en su modalidad de codificación o de evocación) fueron
considerados como amnésicos y en los otros subtests
(orientación, atención y concentración, lenguaje, lectura y escritura y
funciones ejecutivas) no amnésicos. Si poseían 3 desviaciones estándar por
debajo de la media tanto en subtests de memoria y de
alguna otra función considerada “no amnésica” se les clasificó con DCL “mixto”
(Tabla 2).
El subtest
de secuenciación, perteneciente al rubro de funciones ejecutivas, consiste en
una lámina con las siguientes figuras en una línea continua (O + OO ++ OOO…).
Se trata de que el participante siga la secuencia al menos hasta los cinco
círculos (O + OO ++ OOO +++ OOOO ++++ OOOOO +++++). La puntuación normal
depende de la edad y educación particular, es decir, se escoje
el perfil adecuado a esas variables. Si la edad del participante está entre 66
a 85 años, su nivel de escolaridad es de 5 a 9 años, y la respuesta que dio es
incorrecta, el puntaje a otorgarle corresponde a hallarse a 1.5 desviación
estándar por debajo de la media. Por otra parte, si la edad está entre 51 a 65
años y la escolaridad entre 5 a 9 o entre 10 a 24 años, la contestación
correcta implica estar en la normalidad; en cambio, responder de forma
incorrecta supone estar 3 desviaciones estándar por debajo de la media (Ostrosky
y col., 1999).
Cuestionarios de calidad de
sueño
Se administraron 2
cuestionarios para medir el sueño y el llenado de un diario de sueño durante
dos semanas antes del registro. Aunque estos 3 instrumentos no tienen
propiedades psicométricas, su uso representa una herramienta útil para
establecer la percepción de la calidad del sueño por parte de los participantes.
El diario de sueño sólo lo
llenaron apropiadamente dos sujetos controles y un participante con DCL, por lo
que no se reportan los resultados de dicho instrumento.
El primer cuestionario se
aplicó previo a la PSG a los 14 participantes y consistió en preguntas abiertas
sobre cuántas horas duerme habitualmente y a qué hora se levanta y se acuesta
habitualmente; y otras 2 preguntas de opción múltiple sobre cuánto tiempo se
tarda en dormir (opciones: menos de 10 min; entre 11 min y 15 min; entre 16 min
y 20 min; entre 21 min y 25 min; ente 26 min y 44 min y más de 45 min; y si su
sueño es considerado bueno, regular o malo. El segundo cuestionario se aplicó
solo a los 9 participantes en los que se pudo concluir el estudio de la PSG,
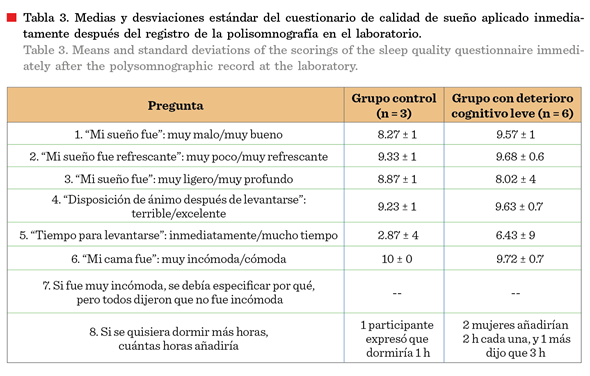
inmediatamente en la mañana al terminar la prueba. Contenía 8 preguntas, 6 de ellas
de tipo escala Likert de 0 a 10: 1. “mi sueño fue”: muy malo/muy bueno); 2. “mi
sueño fue refrescante”: muy poco/muy refrescante; 3. “mi sueño fue”: muy
ligero/muy profundo; 4. “Disposición de ánimo después de levantarse”:
terrible/excelente; 5. “Tiempo para levantarse”: inmediatamente/mucho tiempo;
6. “Mi cama fue”: muy incómoda/cómoda. 7. Si fue muy incómoda, se debía
especificar por qué; y 8. Si se quisiera dormir más horas, cuántas horas
añadiría (Tabla 3).
Del primer cuestionario de
preguntas abiertas, se obtuvieron las frecuencias de las horas de sueño y se
promediaron por cada grupo; se calculó la proporción de los participantes en
cuanto a sus latencias para dormir y a su calidad subjetiva del sueño. Del segundo
cuestionario, se obtuvieron los puntajes a cada pregunta y se calcularon los
promedios por cada grupo.
Estudios psicofisiológicos
Los registros se efectuaron
en el Instituto de Ciencias de la Salud (ICSa) de la
UAEH, ubicado en el municipio de San Agustín Tlaxiaca, en el estado de Hidalgo,
México. Se solicitó a los sujetos lavaran su cabeza con jabón neutro y no tomar
cafeína o bebidas alcohólicas al menos 2 h previas al estudio. Se les pidió la no
suspensión de sus medicamentos y fueron admitidos a las 4 p.m. De acuerdo con el
Sistema Internacional 10/20, los 19 electrodos fueron colocados para medir el
EEG: FP1, FP2, F3, F4, F7, F8, C3, C4, P3, P4, T3, T4, T5, T6, O1, O2, FZ, CZ,
PZ (Figura 1), y cada uno fue referenciado a los lóbulos de las orejas
cortocircuitados. En la parte frontal y central de la cabeza (no mostrado en la
Figura 1) se ubicó el electrodo FPZ, que tiene como función servir como tierra
para eliminar el ruido de los aparatos con respecto a los potenciales
biológicos de interés. El EMG fue registrado con 2 electrodos localizados en el
mentón y éstos fueron referenciados bipolarmente. Para medir los EOG, fueron
colocados 2 electrodos, 1 a la izquierda y 1 a la derecha del canto del ojo;
cada uno tenía la misma referencia que el EEG. Una vez ubicados los electrodos,
los participantes realizaron varias tareas (Rosales-Lagarde y Martínez-Alcalá,
2021) en un orden contrabalanceado, es decir, el orden de las tareas varió de
sujeto a sujeto para eliminar efectos del orden.
Polisomnografía (PSG)
Todos los sujetos se
acostaron en su horario habitual de sueño, y se les comentó que durmieran ad
libitum. Cualquier queja o sugerencia la debían expresar, incluyendo la
necesidad de ir al baño.
El aparato MEDICID-5 (Neuronic) amplificó las señales de todos los electrodos. Se
utilizaron los siguientes filtros: para el EEG, de 0.1 Hz a 70 Hz; de 10 Hz a
70 Hz para el EMG; de 0.3 Hz a 15 Hz para el EOG; y de 0.5 Hz a 30 Hz para los
electrodos de la pierna en particular. La impedancia se mantuvo por debajo de
10 kΩ.
Los datos fueron
digitalizados con una frecuencia de muestreo de 512 Hz, usando un convertidor
de 12-bits, y fueron almacenados en una computadora con un disco duro por el
software MEDICID-5, marca Neuronic de México.
Las etapas de sueño se
clasificaron, de acuerdo con los lineamientos de la AASM (2007). Los
alertamientos y los MPP se detectaron automáticamente usando el software del
equipo Neuronic, siguiendo las instrucciones del Manual
para el análisis de la PSG. De forma subsecuente, se revisaron visualmente los MPP
y los alertamientos.
El porcentaje de sueño de
cada etapa se calculó con respecto al tiempo total de sueño (TTS). El
porcentaje de vigilia se calculó sobre el tiempo de registro total.
Los índices de alertamientos
y de MPP fueron calculados al dividir el tiempo total en la etapa de sueño,
sobre el número de eventos en él, para arrojar un índice de eventos/h de sueño
para cada etapa y cada grupo.
Movimientos periódicos de las
piernas
Se colocaron 2 electrodos
bipolares para medir los MPP en los músculos tibiales de una pierna.
Consideraciones éticas
El Comité de Ética de la
Coordinación de Investigación del ICSa de la UAEH
aprobó el proyecto. A cada participante se le explicó el objetivo del estudio y
firmó dos cartas de consentimiento informado siguiendo los lineamientos de la
Declaración de Helsinki: una sobre la fase 1 y otra para la fase 2. Se les
indicó que podían abandonar la evaluación en cualquier momento que lo desearan
y ninguno abandonó el estudio de la PSG.
Análisis estadístico
Para los datos
sociodemográficos, las escalas, los subtests, los
cuestionarios y las variables polisomnográficas, se
obtuvieron las frecuencias y/o proporciones, y en su caso promedios respectivos
a cada grupo. Se calcularon pruebas estadísticas de U de Mann-Whitney encontradas
en softwares especializados para comparar los puntajes entre los grupos. Se
calcularon pruebas de Wilcoxon entre los alertamientos y los MPP de cada grupo.
Se obtuvieron correlaciones de Spearman entre los índices para el grupo con
DCL; para los controles esto no fue posible debido a que eran tres datos, menos
de los cuatro requeridos para dicho análisis.
Para hacer los cálculos se
utilizaron varios softwares: el Paquete estadístico para ciencias sociales
(SPSS, por sus siglas en inglés: Statistical Package for the
Social Sciences) versión 23, Excel de Microsoft y el
programa estadístico “Estadis-1” del Dr. Daniel Zarabozo de la Facultad de
Psicología de la Universidad Nacional Autónoma de México, de acceso gratuito.
RESULTADOS Y DISCUSIÓN
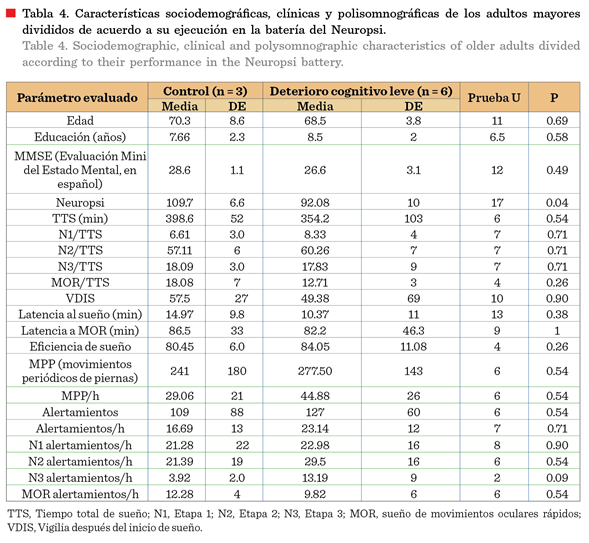
Características
sociodemográficas
La edad promedio y el nivel
de estudio (correspondiente a educación secundaria) no fue diferente
significativamente (P > 0.05) entre ambos grupos de estudio (Tabla 4). Esto
es importante porque ambos parámetros tienen incidencia sobre el SPI, el cual
suele aumentar con la edad y en personas con menores niveles de escolaridad (Didriksen y col., 2017).
Mini Evaluación del Estado
Mental (MMSE)
Los resultados de esta
evaluación no arrojaron diferencias significativas (P > 0.05) entre ambos
grupos (grupo control: 28.6 ± 1.1; grupo con DCL: 26.6 ± 3.1). El puntaje más
bajo fue de 21, correspondiente a un diagnóstico de DCL, de acuerdo con el MMSE
realizado en la fase 1, el cual se presentó en una participante que
adicionalmente manifestó el mayor número de antecedentes neurológicos de riesgo
del grupo, pero con la capacidad manifiesta para realizar de forma
independiente sus actividades en la vida cotidiana.
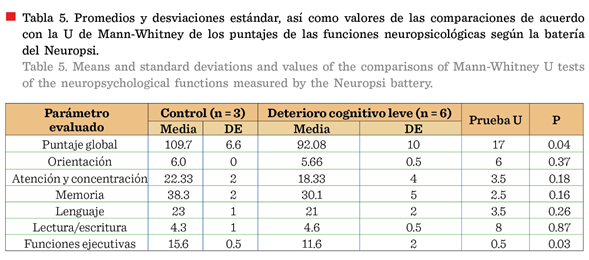
Batería Neuropsi
En este estudio se observó a
6 adultos mayores con 3 desviaciones estándar por debajo de la media en alguno
de los subtest del Neuropsi,
por lo que se consideraron con diagnóstico afirmativo de DCL. Existieron diferencias
significativas (P < 0.05) entre las medias de los puntajes globales y de las
funciones ejecutivas de ambos grupos (Tabla 5), lo cual está de acuerdo con
otros estudios en los que se detectaron fallas en los adultos mayores con DCL a
nivel frontal (RosalesLagarde y Martínez-Alcalá,
2021), ya que las regiones frontales están especializadas en iniciar, mantener,
supervisar y finalizar acciones particulares (Bembibre y Arnedo, 2013).
De los 6 participantes con
DCL, el 33.3 % presentaron DCL-a, 50 % DCL-na y 16.6
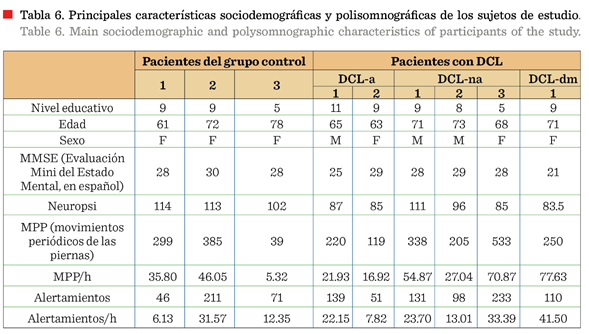
% DCL-dm (Tabla 6). En la prueba de secuenciación, se obtuvo de todos los
participantes una respuesta por debajo del valor estándar considerado normal,
lo que sugiere la necesidad de llevar a cabo más estudios sobre este tema,
puesto que la falta de entendimiento de la implicación que poseen esos puntos
suspensivos en la prueba podría deberse a una falla menor en el índice de
comportamiento lector. Al respecto, es necesario considerar que el presente
estudio se realizó en Hidalgo, el cual es un estado con mayor índice de pobreza
que la Ciudad de México, de acuerdo al Consejo
Nacional de Evaluación de la Política de Desarrollo Social (CONEVAL, 2020). En
la Ciudad de México se obtuvieron las normas del Neuropsi
(Ostrosky y col., 1999). Usualmente a mayor pobreza suele haber menor nivel de
alfabetización y mayores índices de DCL (Rosales-Lagarde y col., 2020).
El criterio actual sobre DCL,
en su modalidad de no demencia, es que el participante presente puntuación por
debajo de la media en al menos dos pruebas (Barroso y col., 2013; Montoro y
col., 2013). En el presente estudio, la mayoría de la muestra obtuvo ese
puntaje bajo en la prueba de secuenciación y en otro subtest.
Los resultados obtenidos por
las pruebas neuropsicológicas permitieron establecer que los participantes presentaron
DCL incipiente. Aunque no se realizó un estudio longitudinal para comparar sus
puntajes, en la demencia tipo Alzheimer y en la frontotemporal hay afectación
en la vida independiente (Barroso y col., 2013; Montoro y col., 2013). En
cambio, en el presente estudio, no la hubo. Además, sólo uno de los
participantes manifestó afectación subjetiva de la memoria.
Calidad del sueño reportada
antes y después de la noche en el laboratorio
En ambos grupos se
presentaron pocas quejas de calidad de sueño, y reportaron dormir 7 h u 8 h,
con excepción de la mujer señalada con DCL en la prueba de MMSE, que refirió
dormir 5 h y que “daba saltos en la cama” (fue incluida en el grupo con DCL,
evaluado mediante Neuropsi). Adicionalmente, una
participante del grupo control mencionó que una vez a la semana no podía dormir
y otra, del mismo grupo, que se acostaba y no podía dormir o se dormía y se
despertaba temprano debido a preocupaciones, con una frecuencia de una vez al
mes.
Sobre la latencia al sueño,
en el grupo control, 2 adultas mayores reportaron tardarse menos de 10 min en
esta fase y 1 más entre 21 min a 25 min.
Del grupo con DCL (n = 6), 2
hombres reportaron tener una latencia corta de sueño de menos de 10 min; 2
mujeres entre 11 min a 15 min; 1 hombre de 16 min a 20 min y la latencia para
la participante con más antecedentes neurológicos fue de 1 h. Del grupo control
1 adulta mencionó dormir bien y 2 de forma regular. En el grupo con DCL, una
dormía de forma regular (la mujer con más antecedentes neurológicos) y los
demás dijeron dormir bien.
El cuestionario aplicado para
evaluar la calidad del sueño, actividad que realizaron en el laboratorio,
inmediatamente después del monitoreo de su actividad polisomnográfica,
indicó que en ambos grupos, se presentó un sueño de
muy buena calidad (Tabla 3).
A la participante con mayores
antecedentes neurológicos se le notificó que tenía una gran cantidad de MPP y
se le preguntó si tenía sensaciones dolorosas. Ella manifestó nuevamente que
“saltaba en la cama” pero no mencionó que tuviera dolores o sensaciones
anómalas en las piernas y añadió que roncaba desde hacía 10 años.
Polisomnografía
En la Tabla 4 pueden
observarse las características sociodemográficas y polisomnográficas
de los participantes y el grupo en el que fueron clasificados control o los
diferentes tipos de DCL. Se observa que no hubo diferencias significativas (P
> 0.05) entre los índices totales de alertamientos, ni de MPP entre los dos
grupos y tampoco manifestaron en los cuestionarios quejas subjetivas para
diagnosticar el SPI. En el reporte de Leng y col. (2016), en una muestra
considerable de 2 636 adultos mayores hombres, aquellos quienes presentaron
problemas en una prueba neuropsicológica y tuvieron 30 MPP o más, eventualmente
tendieron a desarrollar DCL. En el presente estudio algunos de los
participantes presentaron valores más elevados a los reportados en dicha
investigación: una de las participantes control tuvo 31.57 MPP/h y dos adultas
mayores del grupo con DCL, 33.39 MPP/h y 41.50 MPP/h (Tabla 6). Un seguimiento longitudial permitiría una comparación con el estudio de
Leng y col. (2016) para conocer quiénes sí desarrollaron eventualmente el DCL o
la demencia.
Aunque una línea de
investigación se ha centrado en las funciones cognitivas alteradas entre los
pacientes con el SPI (Fulda y col., 2010; Galbiati y col., 2015; Cha y
col., 2017; Zhang y col., 2018), hasta donde se tiene conocimiento, hay un
único estudio sobre el DCL y los MPP (Leng y col., 2016) y no hace referencia
al SPI ni a los alertamientos. En cambio, otras investigaciones se han
focalizado en la actividad del sueño de MOR y el funcionamiento
neuropsicológico en los pacientes con DCL (Chen y col., 2011; Brayet y col., 2015; Rosales-Lagarde y col., 2018; 2019).
La asociación entre los
índices de alertamientos y de MPP del grupo con DCL fue altamente significativa
(coeficiente de correlación de Spearman = 0.94, P = 0.05). A pesar de ser una
muestra pequeña, en el grupo con DCL se pudo observar una cantidad mayor de MPP
en comparación con los alertamientos (Figura 8), ya que existieron diferencias
estadísticamente significativas entre el índice total de alertamientos/h y los
MPP/h, de acuerdo a la prueba de Wilcoxon (Z = - 2.20,
P < 0.02).
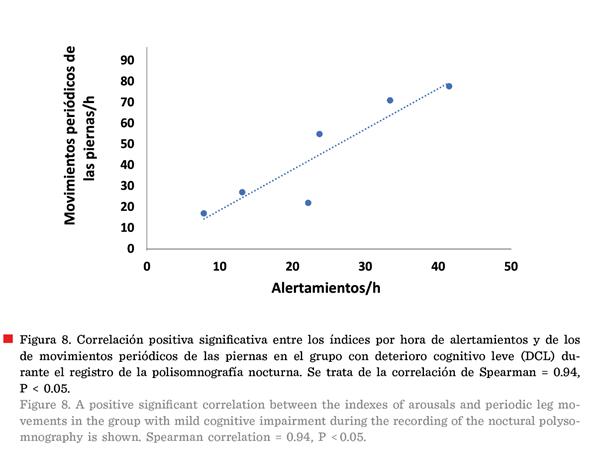
La aparición y asociación
positiva de altos índices de alertamientos y de MPP, en especial de estos
últimos, podrían conducir a una fragmentación de sueño aún mayor. En el grupo
con DCL, el mayor índice de MPP y de alertamientos de algunos participantes
(Tabla 6) probablemente indica una falla en los mecanismos catecolaminérgicos y
colinérgicos del sueño (Corsi-Cabrera, 2018).
En la paciente con más
antecedentes neurológicos, las ejecuciones en el MMSE y el Neuropsi
se encuentran vulneradas y existe un índice mayor de MPP y de alertamientos/h.
Se observó a un participante
del grupo de DCL con puntajes globales altos en el MMSE e incluso en el Neuropsi, con índices elevados de MPP y alertamientos/h
(Tabla 4), pero con quejas subjetivas de memoria y un subtest
con un puntaje con 3 desviaciones por debajo de la media. En este sentido, es
conveniente evaluar con baterías neuropsicológicas completas y normalizadas
como el Neuropsi en contraste con las de cribado como
el MMSE.
Los medicamentos ingeridos
por los adultos mayores no eran psicofármacos o neurofármacos
prescritos para dormir (Tabla 1) y no están reportados con capacidad de influir
significativamente en su sueño y tampoco se sabe que tengan el efecto adverso
de modificarlo. Es decir, se trató de adultos mayores con control médico de sus
padecimientos.
El hallazgo sobre los altos
índices de alertamientos y de MPP en una de las adultas mayores del grupo
control puede ser sugerente de un riesgo mayor de desarrollar DCL, en
comparación con otras de las participantes controles. Es la adulta mayor que sí
tiene más de los 30 MPP/h, mencionada previamente.
La edad es una de las
variables altamente influyente y predictoras del DCL, por lo que las pacientes
controles y en especial aquellas con antecedentes neurológicos, tienen un
riesgo alto de desarrollar DCL en etapas posteriores al estudio (Gutiérrez-Robledo
y col., 2017).
El síndrome obstructivo de
apnea puede incrementar el índice de alertamientos en el sueño MOR entre los
grupos, pero no fue el caso porque los pacientes no lo declararon ni
manifestaron (Durán y col., 2015). Sin embargo es
importante señalar que no se registraron los eventos respiratorios de apneas/hipoapneas que presentaron los participantes durante el
estudio en el laboratorio.
Los MPP se encuentran
presentes en hasta el 80 % de los casos de SPI. Sin embargo, un porcentaje
mucho menor de pacientes con una evidencia PSG de MPP (22.5 %) tienen un SPI
comórbido con otros trastornos del sueño y diversas afecciones médicas
(cardiacas, hepáticas, renales, diabetes, migraña) y varios trastornos neurológicos
y psiquiátricos importantes (Drakatos y col., 2021).
El índice de alertamientos/h
de sueño es de 14.9 a 18.27 en personas con 50 a 64 años de
edad y de 15.3 a 22.3 para aquellas con 65 a 79 años (Boselli y col.,
1998; Jaimchariyatan y col., 2015; Boulos y col., 2019). En el presente estudio 1 mujer del
grupo control sobrepasó el límite superior de 22.3 alertamientos/h, en tanto
que, 2 participantes del grupo con DCL lo sobrepasaron por 10 y 20 puntos.
Los altos índices de
alertamientos, asociados con elevados índices de MPP, pueden conducir a una
severa fragmentación de sueño de quienes lo sufren, con serias afectaciones a
su salud. Se ha reportado que la tasa de MPP: alertamientos suele ser de 3:1 (Drakatos y col. 2021), pero en el presente estudio la
relación promedio encontrada fue cercana a 2.2: 1 (Tabla 4). Esta disminución
en el valor de la tasa encontrada podría estar relacionada con pocas fallas
subjetivas en el sueño, menores eventos cardiacos asociados a los MPP y a que
la muestra estuvo constituida en especial por mujeres (Koo
y col., 2011). Es necesario reproducir el estudio en una muestra mayor y
determinar la secuencia, duración exacta e intervalos de los fenómenos
descritos (Pollmächer y Schulz, 1993; Boehm y col.,
2009).
CONCLUSIONES
Los resultados preliminares
obtenidos señalan la estrecha relación que tienen los movimientos periódicos de
piernas (MPP) con los alertamientos, aunado a un índice mayor de MPP con
respecto a los alertamientos en el grupo con deterioro cognitivo leve (DCL). Es
necesario continuar evaluando si ambos fenómenos podrían
servir como marcadores tempranos de la fragmentación de sueño asociada al DCL y
a la demencia
AGRADECIMIENTOS
El Programa Cátedras CONACyT, ahora “Investigadoras e Investigadores por México”
del Consejo Nacional de Humanidades, Ciencias y Tecnologías, con el proyecto
2162 llamado “Evaluación y diagnóstico de los aspectos biopsicosociales del
adulto mayor y sus cuidadores primarios” financió a ARL y a CIMA durante
2014-2019. El proyecto número 1080 “Manejo multidisciplinario e Integral del
Trastorno Límite de la Personalidad y su comorbilidad”, subvenciona a la Dra.
Rosales desde 2019 hasta la actualidad.
Referencias
AASM, American
Association of Sleep Medicine (2007). The AASM Manual for the Scoring of
Sleep and Associated Events. Rules, Terminology and Technical Specifications. Westchester, IL: AASM. 17 Pp.
Ashbrook, L. and
During, E. H. (2017). “Sleep and Movement Disorders”, in Sleep and neurologic disease. [En
línea]. Disponible en: https://doi.org/10.1016/B978-0-12-804074-4.00013-3.
Fecha de consulta: 26 de julio de 2022.
Barroso, J., Nieto, A., Correia, R. y
Hernández, G. (2013). Demencia frontotemporal variante de conducta. Cuando los
demás desaparecen. En M. Arnedo y J. Bembibre (Eds.), Neuropsicología a
través de casos clínicos (pp. 279-291). España: Editorial Médica
Panamericana.
Bembibre, J. y Arnedo, M. (2013).
Neuropsicología de la corteza dorsolateral II. ¿Mañana...? No sé. En M. Arnedo
y J. Bembibre (Eds.), Neuropsicología a través de casos clínicos (pp.
189-198). España: Editorial Médica Panamericana.
Boehm, G., Wetter, T. C., and Trenkwalder, C.
(2009). Periodic Leg
Movements in RLS Patients as Compared to
Controls: Are There Differences Beyond the PLM Index? Sleep Medicine.
(10): 566-571.
Boselli, M., Parrino, L., Smerieri, A., and Terzano, M. G. (1998). Effect of age on EEG arousals in
normal sleep. Sleep. 21(4): 351-357.
Boulos, M. I.,
Jairam, T., Kendzerska, T., Im,
J., Mekhael, A., and Murray, B. J. (2019). Normal polysomnography
parameters in healthy adults: a systematic review and meta-analysis. The
Lancet. Respiratory Medicine. 7(6): 533-543.
Brayet, P., Petit, D., Frauscher,
B, Gagnon, J. F, Gosselin, N, Gagnon, K, …, and Montplaisir,
J. (2015). Quantitative EEG of Rapid-Eye-Movement sleep: a marker of amnestic Mild Cognitive Impairment. Clinical
EEG and Neuroscience. 47(2): 134-141.
Calvo, E. y García-Borreguero, D. (2015).
Síndrome de piernas inquietas y movimientos periódicos de las piernas (Enfermedad
de Willis-Ekbom). En Sociedad Española de Sueño. Tratado de Medicina
del sueño (pp. 841-846). España: Editorial Médica Panamericana.
Cha, K.
S., Choi, J. W., Jung, K. Y., and Kim, K. H. (2017). Frontal dysfunction in patients with restless legs syndrome
performing a visual oddball task: an event-related potential source imaging
study. Sleep Medicine. 36: 48-54.
Chen, P. C., Wu,
D., Chen, C. C., Chi, N. F., Kang, J. H., and Hu, C. J. (2011). Rapid eye
movement sleep atonia in patients with cognitive impairment. Journal of the
Neurological Sciences. 305(1-2): 34-37.
Claman, D. M., Ewing, S. K., Redline, S., Ancoli-Israel, S., Cauley, J. A.,
and Stone, K. L. (2013). Study of Osteoporotic Fractures Research Group. Periodic leg movements are associated with reduced sleep
quality in older men: the MrOS Sleep Study. Journal
of Clinical Sleep Medicine. 9(11): 1109-1117.
CONEVAL, Consejo Nacional de Evaluación de la
Política de Desarrollo Social (2020). Información de pobreza y evaluación en
las entidades federativas y municipios [En línea]. Disponible en: https://www.coneval.org.mx/coordinacion/entidades/Hidalgo/Paginas/principal.aspx. Fecha de consulta: 26 de junio de 2023.
Corsi-Cabrera, M. (2018). El misterioso origen
de los sueños en el cerebro. En A. Rosales-Lagarde, J. L. Díaz, M. Müller y A.
Jiménez-Anguiano (Eds.), La naturaleza de
los sueños. Cerebro, mente y cultura (pp. 85-120). México: UAM-Iztapalapa, Herder.
Didriksen, M., Rigas, A. S., Allen,
R. P., Burchell, B. J., Di-Angelantonio, E., Nielsen,
M. H., …, and Ullum, H. (2017). Prevalence of
restless legs syndrome and associated factors in an otherwise healthy population: results from the Danish Blood Donor Study.
Sleep Medicine. 36: 55-61.
Drakatos, P., Olaithe, M., Verma,
D., Ilic, K., Cash, D., Fatima, Y., …, and Rosenzweig, I. (2021). Periodic limb
movements during sleep: a narrative review. Journal of Thoracic Disease.
13(11):
6476-6494.
Durán, J., Masa, J. F. y Montserrat, J. M.
(2015). La patología del sueño en neumología. En Sociedad Española de Sueño. Tratado de medicina del sueño
(pp. 554-558). España: Editorial Médica Panamericana.
Ferré, A. y Lainez,
F. (2015). Monitorización del sueño en la edad adulta. En Sociedad Española de
Sueño. Tratado de medicina del sueño (pp. 1034-1042). España: Editorial
Médica Panamericana.
Ferré, A. y Sagalés,
F. (2015). Material utilizado en los
registros polisomnográficos: electrodos y sensores.
En Sociedad Española de Sueño. Tratado de Medicina del sueño (pp.
1024-1033). España: Editorial Médica Panamericana.
Ferri, R. and Fulda, S. (2017). Recording and sco-ring sleep-related movements. In M. Kryger,
T. Roth, and W. C. Dement (Eds.), Principles and practice of sleep medicine
(pp. 1576-1587). USA: Elsevier.
Ferri, R., Rundo, F., Zucconi, M., Manconi, M., Bruni,
O., Ferini, L., and Fulda, S. (2015). An
evidence-based analysis of the association between periodic leg movements
during sleep and arousals in Restless leg syndrome. Sleep.
38(6): 919-924.
Frauscher, B., Gabelia, D., Mitterling, T., Biermayr, M., Bregler, D., Ehrmann, L., ...,
and Högl, B. (2014). Motor events during healthy
sleep: a quantitative polysomnographic study. Sleep. 37(4): 763-773.
Fulda, S., Beitinger, M. E., Reppermund, S.,
Winkelmann, J., and Wetter, T. C. (2010). Short-term attention and verbal
fluency is decreased in restless legs syndrome
patients. Movement Disorders Journal. 25(15): 2641-2648.
Galbiati, A., Marelli, S., Giora,
E., Zucconi, M., Ol-dani,
A., and Ferini-Strambi, L. (2015). Neurocognitive
function in patients with idiopathic Restless Legs
Syndrome before and after treatment with dopamine-agonist. International
Journal of Psychophysiology. 95(3): 304-309.
Gutiérrez-Robledo, L. M. G., García-Peña, M.
C., Roa-Rojas, P. A. y Martínez-Ruiz, A. (2017). La Enfermedad de Alzheimer y
otras demencias como problema nacional de salud. Documento de postura, en Consejo
Nacional de Ciencia y Tecnología (CONACyT), Academia
Nacional de Medicina de México, México. [En línea]. Disponible en: https://www.anmm.org.mx/publicaciones/ultimas_publicaciones/ANM-ALZHEIMER.pdf.
Fecha de consulta: 25 de abril 2023.
Harmony, T., Marosi, E., Díaz-de-León, M. A., Becker,
J., and Fernández, T. (1990). Effect of sex, psychosocial disadvantages and biological risk
factors on EEG maturation. Electroencephalography and Clinical
Neurophysiology. 75(6): 482-491.
Jaimchariyatam, N., Rodriguez, C. L., and Budur,
K. (2015). Sleep-related cortical arousals in
adult subjects with negative polysomnography. Sleep & Breathing. 19(3): 989-996.
Koo, B. B., Blackwell,
T., Ancoli-Israel, S., Stone, K. L., Stefanick, M.
L., Redline, S., and Osteoporotic Fractures in Men (MrOS)
Study Group (2011). Association of incident cardiovascular disease with
periodic limb movements during sleep in older men: outcomes of sleep disorders
in older men (MrOS) study. Circulation. 124(11): 1223-1231.
Leng, Y., Blackwell, T., Stone, K. L., Hoang, T. D.,
Redline, S., and Yaffe, K. (2016). Periodic Limb
Movements in Sleep are Associated with Greater Cognitive Decline in Older Men without
Dementia. Sleep. 39(10):
1807-1810.
López-Álvarez, J.
y Agüera-Ortiz, L. F. (2015). Nuevos criterios diagnósticos de la demencia y la
enfermedad de Alzheimer: una visión desde la psicogeriatría. Psicogeriatría.
5(1): 3-14.
McGinty and Szymusiak (2017). Neural control of sleep
in mammals. In M. Kryger, T. Roth, and W. C.
Dement (Eds.) Principles and practice of sleep medicine (pp. 62-77). USA:
Elsevier.
Montoro, N., Montes, J. y Arnedo, M. (2013).
Demencia tipo Alzheimer. Conservar algo que
me ayude a recordarte. En M. Arnedo y J. Bembibre (Eds.), Neuropsicología
a través de casos clínicos (pp. 257-270). España:
Editorial Médica Panamericana.
Montplaisir, J., Allen, R. P., Walters, A., and Ferini-Strambi, L. (2011). Restless legs syndrome and periodic
limb movements during sleep. In M. Kryger, T. Roth,
and W. C. Dement (Eds.), Principles and practice of sleep medicine (pp.
1026-1037). USA: El-sevier.
Nuñez, A.
y Rodrigo, M. (2015). Mecanismos responsables para la generación de los
patrones electroencefalográmicos en el ciclo vigilia-sueño. En Sociedad
Española de Sueño. Tratado de Medicina del sueño (pp. 76-82). España:
Editorial Médica Panamericana.
OMS, Organización Mundial de la Salud (2023). Demencia.
[En línea]. Disponible en: https://www.who.int/news-room/fact-sheets/detail/dementia.
Fecha de consulta: 25 de abril de 2023.
Ostrosky, F., Ardila, A., and Rosselli, M.
(1999). Neuropsi: A brief neuropsychological test battery in Spanish
with norms by age and educational level. Journal of the International
Neuropsychological Society. 5(5): 413-433.
Paniagua, J. e Iznaola,
M.C. (2015). Características generales del sueño normal en el hombre. En
Sociedad Española de Sueño. Tratado de Medicina del sueño (pp. 15-26).
España: Editorial Médica Panamericana.
Parada-Muñoz, K. R., Guapizaca-Juca,
J. F. y Bueno-Pacheco, G. A. (2022).
Deterioro cognitivo y depresión en adultos mayores: una revisión sistemática de
los últimos 5 años. Revista Científica UISRAEL. 9(2): 77-93.
Parrino, L.
and Terzano, M. G. (2017). Central
nervous system arousals and cyclic alternating patterns. In M. Kryger, T. Roth, and W. C. Dement (Eds.), Principles and
practice of sleep medicine (pp. 1576-1587). USA: Elsevier.
Pennestri, M. H., Montplaisir, J.,
Colombo, R., Lavigne, G., and Lanfranchi, P. A. (2007). Nocturnal blood
pressure changes in patients with restless legs syndrome. Neurology. 68(15):
1213-1218.
Perona, M. E. A. y Diez, B. P. F. (1973). Bioinstrumentación II.
Argentina: Universidad Nacional de San Juan, Facultad de Ingeniería: 10
Pp.
Petersen, R. C.
(2004). Mild Cognitive Impairment as a diagnostic entity. Journal of Internal
Medicine. 256(3): 183-194.
Petersen, R. C.
(2016). Mild Cognitive Impairment. Continuum: Lifelong Leaming
in Neurology. 22(2): 404-418.
Pollmächer, T. and Schulz, H. (1993). Periodic leg movements
(PLM): their relationship to sleep stages. Sleep. 16(6):
572-577.
Rodríguez-Torres, E. E., Rosales-Lagarde, A.,
Vega, C. F. C., Garrido, J. L. O., Rosales, Y. A. P. y Mota, R. S. (2020). Análisis
Fractal del Electroencefalograma Durante la Vigilia en Reposo de Adultos
Mayores Hidalguenses y Deterioro Cognitivo. PÄDI, Boletín Científico de
Ciencias Básicas e Ingenierías del ICBI. 7(14): 10-13.
Rodríguez-Torres, E. E., Rosales-Lagarde, A. y
Noguez-Ruiz, B. F. (2023). Detección del Deterioro Cognitivo en Adultos Mayores
en Reposo por medio de Técnicas Fractales. En G. S. Aguirre-Moreno y R.
Hernández-Pozo (Eds.), Ciencia y transdisciplinariedad (pp. 401-421).
México: Tirant Humanidades.
Rosales-Lagarde, A. and Martínez-Alcalá, C. I.
(2021). Reaction times of
correct and incorrect performances are
highly correlated no matter age groups but older age affects accuracy and speed
relationships in the Wisconsin Card Sorting Test. Alzheimer´s and Dementia. 17(6): e057552.
Rosales-Lagarde, A., del-Río-Portilla, Y.,
Guevara, M. A. y Corsi-Cabrera, M. (2009). Caída abrupta del tono muscular al
entrar a sueño MOR en el hombre. Salud Mental. 32: 117-123.
Rosales-Lagarde, A., Martínez-Alcalá, C.,
Pliego-Pastrana, P. y Zaleta, M. E. (2020). Análisis
y perspectivas en la medición del deterioro cognitivo de adultos mayores
analfabetas en México. En M. Montero, M. Alonso, y C. Sánchez (Coords), Miradas de la vejez: Calidad de vida,
identidad, violencia y trabajo (pp. 25-32). México: UNAM.
Rosales-Lagarde, A., Martínez-Alcalá, C. I.,
Pliego-Pastrana, P., Molina-Trinidad, E. M., and Díaz, J. L. (2017). Bizarreness and emotion identification in Grete Stern
photomontages: gender and age disparities. Frontiers in Psychology. 8(414): 1-12.
Rosales-Lagarde, A., Rodríguez-Torres, E. E., Contreras-Alcalá,
F., Miramontes, P., Itzá-Ortiz, B., Quezada-Tellez,
L. A., …, and Enciso-Alva, J. C. (2019). The inverse relationship between Cognitive Performance
and Non-stationarity during Stage 1 and Rapid Eye Movement Sleep in Older
Adults: Arousals and Leg Movements. Sleep. 42(1):
A42-A43.
Rosales-Lagarde, A., Rodríguez-Torres, E. E.,
Itzá-Ortiz, B., Miramontes, P., Vázquez-Tagle, G., Enciso-Alva, J. C., …, and
López-Noguerola, J. S. (2018). The Color of Noise and Weak Stationarity at the NREM
to REM transition in Mild Cognitive Impaired subjects. Frontiers in Psychology. 9:
1-18.
Serrano, C., Dillon C., Leis,
A., Taragano, F. y Allegri,
R. (2013). Deterioro cognitivo leve: riesgo de demencia según subtipos. Actas
Españolas de Psiquia-tría. 41(6): 330-339.
Siegel, J. M, (2017). Rapid eye movement sleep.
In M. Kryger,
T. Roth, and W. C. Dement (Eds.). Principles and practice of sleep medicine
(pp. 78-95). USA: Elsevier.
Sieminski, M., Chwojnicki, K., and Partinen, M. (2017b). Higher nocturnal systolic blood
pressure in patients with restless legs syndrome compared with patients with insomnia. Sleep Medicine. 32:
229-233.
Sieminski, M., Pyrzowski, J., and Partinen, M. (2017a). Periodic limb movements in sleep are
followed by increases in EEG activity, blood pressure, and heart rate during sleep. Sleep Breath. 21:
497-503.
Ugalde, Ó. (2010).
Guía clínica para el tratamiento de los trastornos psicogeriátricos.
Instituto Nacional de Psiquiatría Ramón de la Fuente, México. [En línea].
Disponible en: http://www.inprf.gob.mx/opencms/export/sites/INPRFM/psicosociales/archivos/guias/tx_trastornos_psicogeriatricos.pdf.
Fecha de consulta: 12 de junio de 2022.
Zhang, R.,
Schrempf, W., Brandt, M. D., Mückschel, M., Beste, C., and Stock, A. K. (2018). RLS patients show
better nocturnal performance in the Simon task due to diminished visuo-motor
priming. Clinical Neurophysiology. 129(1): 112-121.
Zlatar, Z. Z., Muniz, M. C., Espinoza, S. G., Gratianne, R., Gollan, T. H., Galasko,
D., and Salmon, D. P. (2018). Subjective Cognitive Decline, Objective
Cognition, and Depression in Older Hispanics Screened for Memory Impairment. Journal Alzheimer´s
and Disease. 63(3): 949-956.