https://doi.org/10.29059/cienciauat.v17i2.1756
Neoplasia
cervical e infección por virus del papiloma humano como factores de riesgo para
desarrollo de cáncer anal y lesiones precursoras
Cervical neoplasia and human papilloma virus infection
as risk factors for the development of anal cancer and precursor lesions
Neoplasia cervical y riesgo de cáncer anal
Velia Hernández-Márquez1,
Cheryl Díaz-Barrientos2, Verónica Vallejo-Ruiz3*
*Correspondencia: veronica_vallejo@yahoo.com/Fecha
de recepción: 24 de agosto de 2022/Fecha de aceptación: 26 de enero de 2023/Fecha
de publicación: 31 de enero de 2023.
1Instituto
Mexicano del Seguro Social, Hospital General de Zona Num.
20, Puebla, Puebla, México/Benemérita Universidad Autónoma de Puebla, Posgrado en
Ciencias Médicas e Investigación, Puebla, Puebla, México. 2Benemérita
Universidad Autónoma de Puebla, Hospital Universitario, Puebla, Puebla, México. 3Instituto
Mexicano del Seguro Social, Centro de Investigación Biomédica de Oriente, km.
4.5 carretera Federal Atlixco-Metepec s/n, Atlixco, Puebla, México, C. P. 74360.
Resumen
La incidencia del cáncer anal ha presentado un incremento
en los últimos 10 años, sobre todo en población considerada vulnerable. Las
mujeres con antecedentes de infección por Virus del Papiloma Humano (VPH) en el
tracto genital, tienen mayor riesgo de este tipo de cáncer. Se ha demostrado
que, la infección con genotipos de VPH de
alto riesgo (AR), en la región anogenital, desempeña
un papel en la etiopatogenia de dicho cáncer. Se desconocen muchos aspectos de
la historia natural de las lesiones anales, pero se considera que la zona de
transición anal presenta un alto recambio celular, por lo que se ha planteado
un mecanismo fisiopatológico de infección por VPH-AR y desarrollo de
lesiones invasoras, similar al del cáncer
cervical. El objetivo de este trabajo fue mostrar el estado actual sobre la
información epidemiológica que vincula el riesgo de desarrollar cáncer anal en
mujeres con lesiones precursoras de cáncer cervical asociadas a la infección
por VPH. La relevancia de dicha información es proporcionar una base de
recomendaciones para la detección oportuna de cáncer anal en mujeres
consideradas de AR de padecerlo y,
favorecer la realización de estudios prospectivos
en la población.
Palabras
clave: virus del papiloma humano, cáncer anal, neoplasia cervical.
Abstract
The incidence of anal cancer has
increased in the last 10 years, especially in the population considered to be
at risk. Women with a history of infection in the genital tract by Human Papillomavirus
(HPV) have higher risk of developing this type of cancer. The presence of high-risk (HR) HPV genotypes in the anogenital region
has been shown to play a role in the
etiopathogenesis of anal cancer. Many
aspects of the natural history of anal lesions
are unknown, but the anal transition zone is considered to have a high cell replacement. This is why
a pathophysiological mechanism of HR-HPV infection and development of invasive lesions similar to those of cervical
cancer has been suggested. The aim of this
work was to show the current status of the
epidemiological information that links the risk of developing anal cancer in women with cervical cancer precursor lesions
associated with HPV infection. The relevance of this information is to provide a
basis of recommendations for the timely detection of anal cancer in women
considered to be at HR of suffering it, and to encourage more prospective
studies in this population.
Keywords: human papillomavirus, anal cancer, cervical
neoplasia.

INTRODUCCIÓN
La
incidencia global de cáncer anal en mujeres se ha incrementado en los últimos
10 años, y el riesgo a presentarlo varía, de acuerdo con la población
considerada de riesgo para su desarrollo. Su incidencia es mayor en mujeres con
infección por Virus de Inmunodeficiencia Humana (VIH) y con algún tipo de lesión
precursora del tracto genital o cáncer (cérvix, vulva o vagina), estado post-trasplante, enfermedades autoinmunes y enfermedades
inflamatorias crónicas (Moscicki y col., 2015).
La
prevalencia de cáncer anal es más alta en mujeres
con lesiones precursoras de cáncer del tracto genital e infección del
Virus del Papiloma Humano (VPH), sobre todo los considerados de alto riesgo
(VPH-AR), por su potencial acción oncogénica (Bertoli
y col., 2020). Se han reportado tasas de incidencia acumulada (RI, por sus siglas
en inglés: rate of incidence) de lesiones invasoras anales, en mujeres con
lesiones precursoras de cáncer de vulva, de 48/100 000 personas/año (con un
índice de confianza IC 95 % = 38 a 61), RI de 9/100 000 p/a (IC 95 % = 8 a 12)
para cáncer cervical y RI de 10/100 000 p/a (IC 95 % = 3 a 30) para cáncer de
vagina, con una disparidad equivalente después de la presentación de lesiones
precursoras en cada zona anatómica (Clifford y col., 2021). Específicamente, en
el caso de pacientes con historia de lesiones precursoras cervicales de alto
grado (neoplasia intraepitelial cervical, NIC 2 y NIC 3) o cáncer
cervicouterino, los índices de riesgo (HR, por sus siglas en inglés: hazard rate),
para cáncer anal se han calculado de 4.2 (IC 95 % = 3.4 a 5) para NIC 3,
y HR de 2.9 (IC 95 % = 2.0 a 4.1) para NIC 2, con una RI de 6/100 000 mujeres
de 40 a 49 años, y hasta 24/100 000 a partir de los 60 años (Sand y col., 2016).
Las
lesiones precursoras de cáncer anal, llamadas neoplasias intraepiteliales
anales (NIA), cuentan con diferentes grados de atipias celulares, previo al
desarrollo de un cáncer invasor, y su diagnóstico se ha asociado con la
infección por el VPH en forma incidental o asociado a condilomas anales (Elorza
y col., 2016). Estas lesiones son identificadas a través de pruebas de
tamizaje, como la citología de la zona de transición anal e identificación del
genoma del virus. El diagnóstico definitivo se establece a través de anoscopía de alta resolución, con toma de biopsia de las lesiones (Krzowska-Firych
y col., 2019). El tratamiento de este tipo de cáncer es altamente agresivo y
tiene una probabilidad alta de recurrencia y un riesgo elevado de mortalidad a
corto plazo. De ahí que se sugiera dar un seguimiento del paciente con lesiones
precursoras anogenitales, ante el alto
riesgo de progresión a cáncer invasor (Ramírez-Padilla
y col., 2020). La identificación de poblaciones de riesgo para desarrollar
cáncer anal permite diseñar estrategias de tamizaje, para identificar lesiones precursoras, dar un tratamiento
oportuno y evitar así su progresión hacia
un cáncer invasor anal (Clifford y col., 2021).
El objetivo del presente trabajo fue mostrar el estado actual de la información epidemiológica que vincula el riesgo de desarrollar cáncer
anal en mujeres con lesiones precursoras de
cáncer cervical asociadas a la infección por Virus del Papiloma Humano.
Estrategia
de búsqueda de la información
Se
realizó la búsqueda de artículos publicados en
los últimos 7 años (2015-2022), en las plataformas
de Medline, Embase, Pubmed, Research Rabbit, Google académico y World Wide
Science. Se elaboró una síntesis de los hallazgos relevantes sobre
la temática de lesiones precursoras y cáncer
anal, en mujeres con historia de
lesiones de displasia cervical e infección genital por VPH. Se
incluyeron artículos de revisión, trabajos narrativos de expertos, revisiones
sistemáticas y artículos originales que aportan el mayor nivel de evidencia,
sin restricción de región geográfica, en idiomas inglés y español. La búsqueda
se complementó con información específica en páginas web con información
oficial de la Organización Mundial de la Salud (OMS), Centros para el Control y
Prevención de Enfermedades (CDC), Instituto Nacional de Cáncer (NIH, por sus
siglas en inglés: National Cancer
Institute), Instituto Nacional de Estadística y
Geografía (INEGI).
Los términos de búsqueda (términos MesH)
incluyeron “neoplasia anal” (anus
neoplasm) OR “neoplasia intraepitelial anal”
(anal intraepithelial neoplasia) OR “Infección por
Virus del Papiloma Humano” (Human Papillomavirus infection) AND “displasia cervical” (cervical dysplasia) not “Virus de
Inmunodeficiencia Humana” (Human Immunodeficiency
Virus). Al hacer la búsqueda con el último
criterio se obtuvo un número de publicaciones limitado, por lo que, se
decidió incluir en la búsqueda estudios de mujeres con VIH, así como, estudios
que dividieran a la población en dos grupos: con y sin VIH.
Se
realizó una evaluación de la calidad de los trabajos
de acuerdo con el tipo de publicación: para trabajos narrativos,
revisión de expertos y revisiones sistemáticas se consideraron principalmente
las palabras clave descritas previamente; los estudios observacionales se analizaron conforme con la iniciativa STROBE (directrices para la comunicación de
estudios observacionales en epidemiología). Se dio prioridad a publicaciones de
revistas con alto factor de impacto.
Se
obtuvieron datos como incidencia, prevalencia de lesiones precursoras y cáncer
anal, descripción de evolución natural de VPH a nivel anogenital, factores de riesgo asociados para presentación de
lesiones precursoras anales y genitales en conjunto y datos demográficos. El material analizado se organizó siguiendo
la estructura de una revisión narrativa.
Virus
del papiloma humano y cáncer anal
Epidemiología
del cáncer anal
El
cáncer anal se define como una lesión invasora que se desarrolla en la mucosa
del canal anal, a 1 cm o 2 cm de la línea dentada del surco inter-esfinteriano
que separa el margen del canal anal. El 85 % de dicha variante de cáncer son de estirpe escamosa o epitelial, 10
% son adenocarcinomas y el 5 % son tipo melanoma, carcinomas de células
pequeñas y tumores metastásicos de sitios primarios (Nelson y Benson, 2017).
La
incidencia del cáncer anal, a nivel mundial, es de 0.6/100 000 habitantes con
50 865 casos nuevos al año, de los cuales, el 57 % se ha detectado en el sexo
femenino (Sung y col., 2021). En los últimos 10 años se ha incrementado en
forma progresiva, llegándose a reportar por algunos autores, incidencias de hasta 2.5/100 000 habitantes, con una sobrevida calculada a 5 años de 65.7 % (Shiels
y col., 2015; Stier y col., 2015). En México,
la incidencia de cáncer anal se ha estimado en 308 casos nuevos/año y 81
muertes anuales, con una prevalencia a 5 años de 0.64/100 000, situándose en el lugar 33 de causa de muerte entre los
fallecimientos por cáncer en la
población de este país (Globocan, 2020). No se cuenta
con un registro relacionado por estados de la República, ya que dicho tipo de cáncer
se engloba en los cánceres colorrectales, representando del 1 % a 2 % del total de esta clase de cánceres (Mayer, 2019), reportándose una tasa
de mortalidad de cáncer colorrectal en el
estado de Puebla de 0.55/10 000
habitantes (INEGI, 2021).
Virus
del papiloma humano como factor etiológico del cáncer anal
El VPH posee una cápside icosaédrica de 55 nm de
diámetro con un genoma de ADN circular de doble cadena de alrededor de 8 000
pares de bases; dichos virus infectan tanto epitelios cutáneos como mucosos y
generan diferentes espectros clínicos (CDC, 2020). El genoma de estos virus
contiene marcos de lectura que codifican para proteínas, tanto estructurales
como no estructurales. Las proteínas estructurales forman la cápside viral y
las no estructurales desempeñan diversas funciones, tales como: la replicación
del genoma viral, la regulación de la transcripción de los genes virales, la
proliferación celular, la apoptosis, la evasión de la respuesta inmune, entre
otras (Santos-López y col., 2015).
Existen
más de 200 genotipos de VPH, algunos de los cuales se han vinculado con el
desarrollo de lesiones precursoras y cáncer anogenital (Erazo-Luna y
Velásquez-Lopera, 2019). Este tipo de cáncer se ha relacionado con la infección
persistente del VPH, similar al cáncer
cervicouterino, con una carga mundial atribuible de 40 000 nuevos casos,
de los cuales, 35 000 casos (88 %) corresponden a mujeres, con una contribución
relativa del VPH del 88 % (de-Martel y col., 2017).
La clasificación epidemiológica de los VPH considera la
prevalencia de los genotipos virales tanto en lesiones benignas como en los
tumores malignos de cérvix, para determinar su potencial
oncogénico. Esta clasificación tiene ciertas
limitaciones, ya que hace difícil agrupar a los genotipos de baja prevalencia,
además de que la presencia de coinfecciones (infección con más de un
genotipo viral) complica determinar el papel
que pueden tener ciertos genotipos en el desarrollo del cáncer. La clasificación epidemiológica considera cuatro grupos: alto riesgo y probable alto riesgo, que
incluyen cada uno 12 genotipos virales, bajo riesgo que también tiene 12
genotipos y riesgo indeterminado que cuenta con 21 (Tabla 1) (Alarcón-Romero y
col., 2022).
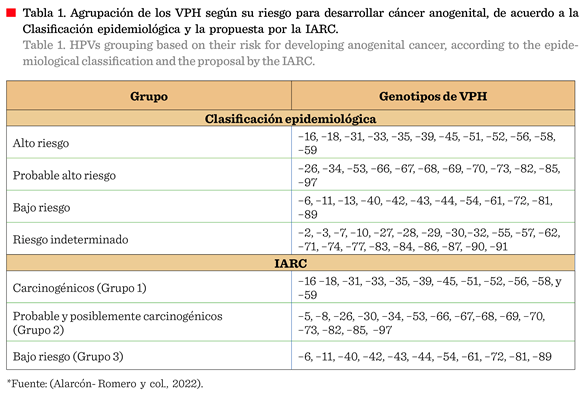
La
Agencia de Investigación Global de Cáncer (IARC, por sus siglas en inglés:
International Agency for Research
on Cancer) clasifica a los
VPH en tres grupos (Tabla 1). Los criterios que considera son: la prevalencia
de los genotipos en los diferentes grupos diagnósticos, la clasificación
filogenética y su presencia en infecciones únicas o coinfecciones, de tal
manera que, utiliza un mayor número de criterios que la clasificación
epidemiológica, lo que le permite agrupar con
mayor certeza a los genotipos virales de baja prevalencia. La IARC considera
los siguientes grupos: carcinogénicos (grupo 1), que incluye a 12 genotipos;
probable y posiblemente carcinogénicos
(grupo 2) que comprende a 15 genotipos; bajo
riesgo carcinogénico (grupo 3) que incluye a 11 (Tabla 1). Los genotipos
de alto riesgo identificados como de mayor prevalencia,
son los del Grupo 1: VPH-16, -18, -31,
-33, -35, -39, -45 y -51, a los que se les atribuye el 96 % de la contribución relativa de cáncer anal, siendo los
dos primeros, los de mayor prevalencia en
lesiones anales a nivel mundial, representando el 80.6 % de dicha contribución (de-Martel y col.,
2017).
Los genotipos del VPH-AR parecen desempeñar un papel
fundamental en la etiopatogenia de cáncer
anal, similar a lo reportado en el
cáncer cervicouterino, promoviendo cambios histológicos de tipo epitelial con diversos grados de profundidad
y atipias o NIA (2 y 3 o de alto grado),
estando presentes en el 88 % a 93 % de
las lesiones anales, siendo los genotipos de AR más prevalentes los
VPH-16, VPH-18 y VPH-31 (Padilla-España y col.,
2016). Los genotipos de VPH-AR más prevalentes, reportados en
mujeres a nivel anal, fueron VPH-16, -45, -52, -18 y -35, los cuales variaron
de acuerdo con ciertas condiciones
estudiadas (mujeres VIH seropositivas, técnica utilizada para identificación de VPH, edad del paciente, lesiones
precursoras genitales). En reportes de cohortes de mujeres predominantemente VIH
seronegativas, la prevalencia de VPH-AR anal, sin ninguna lesión
precursora cervical, se reportó desde un 4 %
a 22 %, en tanto que, se presentaron prevalencias de 23 % a 36 % en
mujeres con patología relacionada con
infección por VPH en vulva, vagina y cuello uterino (Stier
y col., 2015).
En
un estudio multicéntrico que involucró a 24 países, se analizó una cohorte
retrospectiva de 539 muestras histológicas con diagnóstico de cáncer invasivo
anal, lesión de bajo grado (NIA 1) y lesión
de alto grado (NIA 2 y 3), las cuales fueron obtenidas desde 1986 hasta el 2011. Se detectó ADN viral en las
lesiones precursoras, incluyendo genotipos de AR. La prevalencia de VPH fue del
95 % en lesiones precursoras de alto grado
(AG), y una prevalencia del 88 % en cáncer invasivo anal. El VPH-16 fue
el que registró mayor presencia, con 75.4 %
en lesión intraepitelial escamosa de alto grado (LIE-AG) y 80.7 % en
cáncer anal; seguido del VPH-18 (3.6 %), lo que permitió afirmar que, la infección por VPH es una causa para el padecimiento de cáncer anal y cervicouterino
(Alemany y col., 2015).
La persistencia de la infección (mayor a 2 años), está
relacionada con características propias del virus (genotipos de AR), con
reinfecciones del virus (asociado con prácticas de riesgo del hospedero), así
como, con factores del hospedero (estados que condicionan inmunosupresión)
(Della-Fera y col., 2021). Las características antes mencionadas promueven el desarrollo
de lesiones premalignas en la región anogenital
y orofaríngea, que, a largo plazo, pueden
progresar al desarrollo de cánceres invasivos en dichas zonas, llegándose a encontrar
en el 100 % de cánceres epiteliales cervicales, 30 % de vulva, vagina y pene,
80 % a 90 % de cánceres anales y 20 % de orofaríngeos
(Viens y col., 2016; National
Cancer Institute,
2019).
Historia natural de lesiones precursoras y cáncer
invasivo de ano en pacientes con displasias cervicales
Al
igual que las lesiones precursoras del cérvix, las lesiones de ano cuentan con
atipias celulares microscópicas hasta grados diversos de displasia, antes de
progresar a un cáncer invasor (Elorza y col., 2016). Por lo anterior, la NIA,
que es el homólogo de NIC, tiene cierta predilección por la zona de transición
epitelial (70 % a 80 %), esto debido a que ambas regiones tienen el mismo
origen embriológico, compartiendo características histológicas similares
(Nelson y Benson, 2017).
Se desconocen muchos aspectos de la historia
natural de este tipo de lesiones (NIA), pero se
considera que la zona de transición anal presenta un alto recambio celular, por lo que se ha planteado un
mecanismo fisiopatológico de infección por los VPH-AR y desarrollo de lesiones invasores
muy similar al del cáncer cervical (Nelson y Benson, 2017).
La
historia natural de las lesiones invasoras inicia con la infección del virus en
la región anogenital, calculándose que la mayor incidencia de infección por el
virus se manifiesta en los primeros 10 años posterior al inicio de la vida sexual (Sendagorta-Cudós
y col., 2019). La infección por VPH en los epitelios puede presentarse
en dos formas: la productiva o transitoria, en donde se logra la eliminación
del virus sin ocasionar alteraciones displásicas; y la forma persistente, con
un tiempo variable de infección, la cual es característica de los VPH-AR, en
donde el resultado será una estimulación del
desarrollo de lesiones precursoras, cuya historia natural puede
progresar a cáncer invasor (Hernández-Hernández y col., 2015).
Mientras
que el riesgo de padecer cáncer invasor anal en los hombres está relacionado
con las prácticas de sexo anal receptivo, en las mujeres existen otros factores
implicados de mayor relevancia, que se asocian con la presencia del virus en el
epitelio anal y por consecuencia, con mayor riesgo de desarrollo de cáncer anal
(Benevolo y col., 2022). El antecedente de infección
por VPH cervical persistente, reinfecciones en el tracto anogenital o
multi-infección por genotipos de AR, en forma simultánea, a nivel cervical, vulvar, vaginal y anal, así como, la presencia de lesiones
precursoras de alto grado y cáncer cervical han sido reportados desde hace más
de 20 años (Moscicki y col., 2015). Incluso, se ha
planteado la presencia de “autoinoculación” del virus presente en secreciones
cervicovaginales con las márgenes del ano, dependiendo la técnica y hábitos de
limpieza al orinar o defecar (Simpson y col., 2016).
Además de las características relacionadas con la
infección del virus, se ha planteado que, la aparición del cáncer anal en
mujeres es una combinación de factores no virales asociados a la persistencia
del VPH, como son tabaquismo, uso de anticonceptivos hormonales por largos
períodos, multiparidad, co-infecciones de transmisión
sexual y estado inmunológico del huésped, sobre todo en pacientes con inmunidad alterada (mujeres con VIH, estado postransplante,
principalmente hígado y riñón) y lesiones cutáneas tipo condilomas en el área genital
(Krzowska-Firych y col., 2019).
El desarrollo de cáncer anal y cervical se asocia con
infección persistente por VPH-AR y con frecuencia son lesiones intraepiteliales
de espesor total al momento del diagnóstico (Cronin y col., 2016). La
infección persistente, por fenómenos de deficiente aclaramiento del virus, incrementa
hasta un 30 % el riesgo de convertirse en cánceres invasores, en un plazo de 10
a 20 años, si las lesiones no son tratadas en forma oportuna una vez
identificadas (Moscicki
y col., 2015).
Para
el cáncer cervicouterino existen programas de
tamizaje que permiten la detección temprana y el tratamiento de lesiones
precursoras que evitan el desarrollo de la enfermedad, dichos programas han
disminuido la incidencia de este tipo de
cáncer (Instituto Nacional de Cancerología, 2016). Sin embargo, se ha
encontrado que, el diagnóstico del cáncer anal es más tardío que el de cáncer
cervical, con un retraso promedio de más de una década entre ambos (mediana de
edad de 61 contra 49 años) (Stier y Chiao, 2017), esto probablemente relacionado por la falta de cribaje en zona
anal, debido a la ausencia de síntomas
asociados en etapas tempranas, a la incomodidad para la toma de muestras, al desconocimiento de la población
femenina de ser población en riesgo, por no contar con antecedentes de
prácticas sexuales de tipo anal, aun cuando esta última práctica, como
se mencionó previamente, no se ha establecido
como un factor de riesgo independiente para la infección de VPH anal
persistente, lesiones precursoras o cáncer invasor anal en mujeres (Stier y col., 2015). La historia natural de la progresión
de lesiones precursoras anales y cervicales son muy similares y algunos
factores asociados a la presentación de cambios de malignidad asociado a VPH se muestran en la Figura 1.
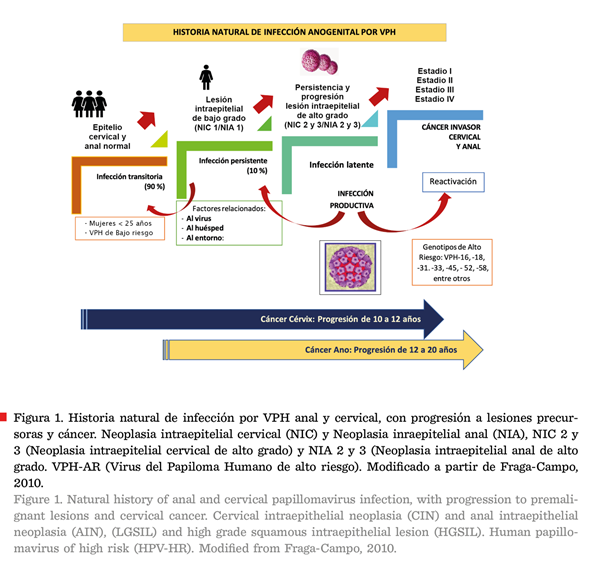
Diagnóstico
de lesiones precursoras, cáncer y detección del VPH a nivel anal
No
existen directrices internacionales unificadas para el diagnóstico de lesiones
precursoras y cáncer anal, solo se cuenta con recomendaciones de organizaciones para detección en las poblaciones
de riesgo para desarrollar este tipo de lesiones (Khattab
y col., 2018). La Sociedad Estadounidense de
Colposcopía y Patología Cervical (ASCCP, por sus siglas en inglés: American Society for Colposcopy of Cervical Pathology) y la Sociedad de Neoplasia Anal, recomiendan practicar detecciones en mujeres
infectadas con VIH, mujeres con detección
previa de displasias cervicales, vaginales y/o vulvares
de alto grado y carcinomas (Moscicki y col., 2015). El
cribaje sugerido se recomienda con examen rectal digital (DARE, por sus siglas
en inglés: digital anal rectal examination), asociado
a citología anal exfoliativa (Papanicolaou, PAP anal, ya sea citología
convencional o en base líquida) y se utiliza la misma descripción de lesiones
citológicas cervicales (sistema Bethesda), catalogando a las lesiones de acuerdo con criterios cito-morfológicos y extensión de la lesión, así como, reportando
algunos cambios morfológicos sugestivos de
infección por VPH como células escamosas atípicas de significado
indeterminado (ASC-US por sus siglas en
inglés: atypcal cells
of uncertain significance), células escamosas anormales que tal
vez pudieran ser de alto grado (ASC-H, por sus siglas en inglés:
abnormal squamous cells may be of high grade), lesiones intraepiteliales
escamosas de bajo grado (LIE-BG) y
lesión intraepitelial escamosa de alto grado (LIE-AG) (Pangarkar, 2022).
La
sensibilidad de la citología anal, en una sola
prueba, para detección de lesiones de AG, ha sido reportada desde un 55 % a 93
%. La especificidad se estima del 32 % a 81 %, con un valor predictivo positivo
(VPP) para lesiones indiferenciadas del 26
% a 57 % y un valor predictivo negativo (VPN) del 82 % a 88 % (Moscicki y col., 2015). En otro estudio más reciente,
documentan una sensibilidad del PAP anal para las NIA del 76 %, una
especificidad del 49 %, un VPP del 62 % y un VPN del 65 %, comparando el diagnóstico histológico vía anoscopía
de alta resolución (Aguiar y col., 2020). El
principal problema con esta clase de evaluación es que se reportan altas tasas de muestras
insatisfactorias, que, en muchos casos, se infiere que son pacientes “negativos
a lesión”. Al respecto, un trabajo
retrospectivo documentó tasas
de hasta 10 % de muestras insatisfactorias, demostrando que, en el seguimiento a un año, el 14 % de estos pacientes
presentaron anomalías citológicas escamosas y el 2 % una lesión de alto grado en reporte histopatológico (Khattab y col., 2018). Es por ello que,
la recomendación es repetir dichos estudios a intervalos regulares, como prueba
de tamizaje. En caso de encontrar alteraciones, los pacientes deberán remitirse para la realización de estudios confirmatorios (Moscicki y col., 2015).
Con
respecto a la detección del VPH, esta se realiza a través de la identificación
de ácidos nucleicos virales en las muestras
clínicas (Elfström y col., 2021). La elección
de la prueba dependerá del propósito de la misma, ya sea si se aportarán resultados para su
utilización en la práctica clínica (aunado al cribado citológico), si se
utilizará para estudios epidemiológicos y
planeación de vacunas o para ensayos de investigación (Sendagorta-Cudós y col., 2019). Existen en el mercado una
amplia variedad de métodos de detección del VPH, las evaluaciones directas
identifican el genoma viral o bien, los transcritos de los oncogenes E6 y E7,
los cuales pueden variar en sensibilidad y
especificidad si se asocian a otras pruebas diagnósticas (Torres-Poveda
y col., 2020). En la actualidad, los estudios de detección de VPH solo han sido
validados para muestras cervicales, y la dificultad para el acceso y el costo,
de algunos de ellos, hacen que no se encuentren disponibles para todo tipo de población, sobre todo, en países en vías
de desarrollo (Torres-Poveda y col., 2020).
Considerando
la alta prevalencia de infección por VPH en mujeres jóvenes, las pruebas
moleculares de detección del virus, como estudio
de tamizaje cervical, no se recomiendan antes de los 30 años (DOF,
2007). Así mismo, no se cuenta con recomendaciones para realizar detección de
VPH en forma conjunta con la citología anal, por lo tanto, se desconoce la
utilidad del uso de la citología y el diagnóstico molecular del VPH en
conjunto, por lo que, el diagnóstico de NIA, al igual que las lesiones
precursoras cervicales, se complementan con
realización de anoscopía de alta resolución
con visualización directa del área afectada y toma de biopsia (Ortiz-Bautista y
Méndez-Cano, 2018). La utilidad de la detección molecular del genoma viral como
prueba de cribaje, fue evaluada, encontrando
una sensibilidad de la prueba molecular Captura de Híbridos para
detección de lesiones precursoras anales (NIA), del 70 %, una especificidad del
31 %, un VPP del 55 % y un VPN del 55 %, no mostrando diferencias entre la
citología anal y la prueba de detección del
VPH (Aguiar y col., 2020). El uso de ambos estudios en el tamizaje de
las NIA podría incrementar la sensibilidad y especificidad, mejorando así el
diagnóstico temprano de esta neoplasia.
La
anoscopía de alta resolución es considerada el estándar de oro para el
diagnóstico de lesiones precursoras y cáncer de ano, llegándose a reportar una
sensibilidad del 100 %, una especificidad del 71 %, un VPP 32 % y un VPN 100 %,
al combinarse con la toma de biopsia (Ortiz-Bautista y Méndez-Cano, 2018). Este
tipo de estudio sirve para realizar diagnósticos de certeza ante otras pruebas
de cribaje positivas y en población de alto
riesgo de lesiones precursoras o cáncer anal. Sin embargo, la anoscopía de alta resolución tiene el inconveniente de ser
costosa y no estar disponible en todos los centros hospitalarios, además de ser operador dependiente (Nelson y
Benson, 2017).
Existe
la modalidad de cromoendoscopía digestiva
magnificada, que es una variante de la anoscopía de
alta resolución, que consiste en introducir un anoscopio
transparente y la tinción de la pared del canal anal. Esta tinción se realiza
con ácido acético al 4 %. Con esta señalización, se procede a realizar biopsias dirigidas de las lesiones aceto-blancas,
para corroborar el diagnóstico histológico
(Aguiar y col., 2018).
La
ecografía endo-anal ayuda a determinar la profundidad
de una lesión invasora anal. Se ha llegado a
reportar una sensibilidad del 100 % y
una precisión del 67 %, en comparación con la toma de biopsia. Así
mismo, se mencionan algunas otras técnicas de imagen, como la tomografía
computada con medio de contraste y la
resonancia magnética, siendo de gran utilidad para imágenes locales, tumores primarios y lesiones recurrentes (Ciombor y
col., 2017).
Riesgo
para lesiones precursoras anales y cáncer invasor en mujeres con displasias
cervicales de alto grado
La
importancia de realizar una detección oportuna
de VPH anal, en mujeres con lesiones precursoras de cáncer cervical,
radica en el comportamiento a largo plazo de desarrollo de malignidad anal
antes mencionado. Para establecer esta
relación, algunos autores han utilizado información retrospectiva de
cánceres incidentales anales de sus registros nacionales de diferentes tipos de cáncer, estimándose modelos de regresión para cálculo de cocientes
de riesgo (Stier y col., 2015).
La
estimación de riesgo durante el primer año para cáncer anal, posterior al
diagnóstico de NIC 3, fue 7 veces mayor (HR 7.9; IC 95 % = 2.6 a 18.8), en
comparación con mujeres no expuestas, riesgo que disminuía después de ese
primer año de diagnóstico, para volver a incrementar
24 años, posteriores al diagnóstico inicial, hasta un HR 4.8 (IC 95 % = 3.3 a
7.0). Dicho riesgo inició en el momento de diagnóstico de displasia
cervical, con una incidencia acumulada de 6/100 000 p/a a
los 40 a 49 años, elevándose hasta 24/100
000 p/a a los 60 años. En el caso de NIC 2, el patrón fue similar, solo con menor riesgo,
reportándose un HR 3.5 (IC 95 % = 2.0 a 2.9) (Sand y
col., 2016).
Lin
y col. (2019), realizaron una estimación de riesgo de prevalencias de lesiones
anales reportadas por cito-histopatología,
asociadas a lesiones precursoras cervicales e infección por VPH,
específicamente el genotipo VPH-16. En esta revisión sistemática se incluyeron 36
estudios, divididos en subpoblaciones, incluyendo a 3 607 mujeres seronegativas
para VIH y 6 468 pacientes con estado de VIH desconocido. Las lesiones de alto
grado de displasia anal se asociaron con reporte de alteraciones de alto grado
de displasia cervical en un 22 % de pacientes VIH negativas, con un índice de
prevalencias (PR de 23.1; IC 95 % = 9.4 a 5.7; P < 0.001), donde el genotipo
VPH-16 se encontró en un 24 % en cérvix, muy superior al 2 % de las pacientes
donde no se encontró al virus (PR 12.6; IC
95 % = 6.7 a 24.8, P < 0.001).
En
un estudio que incluyó un millón de mujeres y cuyo objetivo inicial fue
investigar factores asociados a cáncer de mama, se reportaron también
estimaciones de otros tipos de cáncer, incluyendo el anal. Después de 13 años
de seguimiento, 517 mujeres fueron diagnosticadas con cáncer anal incidental y
el factor de riesgo encontrado en mayor proporción en estas pacientes fue un
historial de diagnóstico previo de NIC 3, con un riesgo relativo (RR) = 4.03
(IC del 95 % = 2.59 a 6.28), después del ajuste de otros factores, como el
tabaquismo, el consumo de alcohol, el índice de masa corporal (IMC), la edad de la menarquia, el uso de anticonceptivos orales, entre otros (Coffey
y col., 2015).
La
combinación de infección por VPH en la región anal con la presencia de lesiones
premalignas cervicales o bien la presencia del virus de forma simultánea en
ambas regiones anatómicas se considera condicionante para el desarrollo de lesiones premalignas anales. Mientras que la
prevalencia de infección anal por el VPH en mujeres sin antecedentes de alteraciones cervicales es en promedio del 6 % (rangos entre 5 % a 22 %) (Tabla 2), la
combinación de infección con VPH-AR anal en mujeres con algún tipo de
lesión cervical se ha reportado entre el 23 % y el 86 % (Stier
y col., 2015).
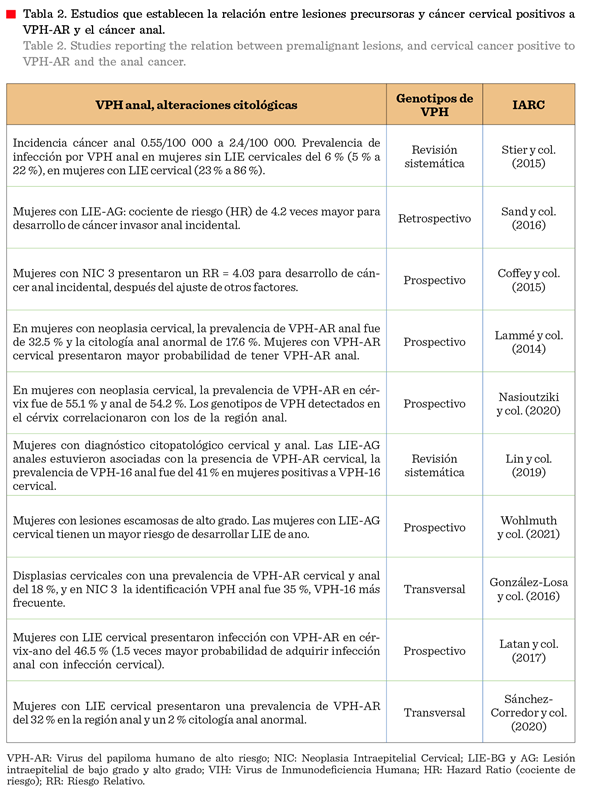
Algunos
estudios documentan rangos de prevalencia de infección por VPH anal asociados a
lesiones de displasia cervical del 50 % a 55 % (Sehnal
y col., 2014; Nasioutziki y col., 2020), incluso, hasta prevalencias calculadas
arriba del 65 % (Donaire y col., 2017). Este
rango de prevalencias tan amplio se ha relacionado con el tipo de población
evaluada, la técnica de detección del VPH, el tipo de prácticas sexuales y
estado inmunológico. En población latina, se han reportado prevalencias del 30 % a 35 % (Sánchez-Corredor y col., 2020)
y la prevalencia de VPH anal en mujeres con lesiones
cervicales de AG y BG del 46.5 % (Latan y col., 2017). En México, un
estudio de 311 pacientes reportó una prevalencia de VPH anal del 30.8 %, una
prevalencia del virus en ambas zonas del 18
%, de los cuales, el 61 % de las
pacientes contaban con el mismo genotipo de VPH en las regiones anal y
cervical (González-Losa y col., 2016).
La infección concomitante a nivel anal y cervical del VPH
se analizó en una cohorte de mujeres con diagnóstico de displasias cervicales
de alto grado, encontrando ADN de VPH en 55.1 % de las muestras cervicales y en
54.2 % en ano (Tabla 2), con una correlación moderada (coeficiente phi >
0.40) para VPH-16, -31, -33, -52 y -58 con valores
estadísticamente significativos (P < 0.001) (Nasioutziki
y col., 2020).
Las
mujeres con infección asociada a VPH-AR cervical pueden tener altas tasas de
infección por VPH anal, con citología anal anormal, sobre todo lesiones de
displasia de alto grado. Por ello, a este grupo se le ha considerado como de
alto riesgo para el desarrollo de cáncer anal. Al respecto, un estudio reportó
que el 18 % de las pacientes con citologías anales anormales presentaron infección simultánea anal y cervical, siendo
las mujeres con lesiones cervicales,
asociadas a infección con VPH-AR, las que tuvieron 3 veces mayor
probabilidad de tener VPH anal (OR 3.6; IC 95 %: 1.9 a 10.77; P < 0.024). La
probabilidad de tener citología anormal anal, con la presencia de infección por
VPH cervical, fue de más de 6 veces (OR 6.5; IC 95 %: 2.74 a
15.60; P < 0.001) (Lammé y col., 2014).
Se ha encontrado una probabilidad 3 veces mayor de tener
una citología anormal asociada a una infección por VPH-AR (OR 3.87; IC 95 %: 2.32 a
6.454; P < 0.001), específicamente con
VPH-16, en pacientes con historia de NIC de AG cervical o cáncer
cervicouterino. Las mujeres con NIC 3 tuvieron mayor probabilidad de
presentar alteraciones de AG en la citología
anal (7.1 % vs 2.8 %, P < 0.030) e infección por VPH (40.5 % vs 15 %, P < 0.001). Las
lesiones más frecuentemente encontradas por anoscopía fueron NIA de AG con un 66.7 % (Wohlmuth y col., 2021).
En cuanto a diferencias entre lesiones cervicales
de AG y BG, un estudio reportó presencia del
VPH en el 71.4 % de las muestras de
cérvix y del 66.7 % en las muestras de
ano. Los genotipos de mayor prevalencia de VPH-BR fueron el VPH-6 y el
-11, y los genotipos de VPH-AR fueron el VPH-16 y -18 (Latan y col., 2017). Así mimo, en Colombia, se encontró una prevalencia
de infección por VPH anal del 32 % en
mujeres con displasia cervical confirmada,
siendo la detección del virus del 54 %
en las mujeres con lesiones cervicales de AG. Los genotipos mayormente
encontrados también fueron el VPH-16 y -18 (Sánchez-Corredor
y col., 2020). En otro estudio, donde solo se incluyeron pacientes inmunocompetentes con reporte de NIC de
AG, se reportó un 10 % de prevalencia de
alteraciones en citología anal y de
éstas, las lesiones de AG tuvieron una prevalencia del 28 %. En este estudio, además, se analizaron otros factores
relacionados con alteraciones cito-histopatológicas, como el promedio de embarazos, partos vaginales y abortos
espontáneos, dichos factores tuvieron diferencias
estadísticamente significativas (P < 0.01) (Brum
y col., 2022).
En
mujeres mexicanas, con reportes de diferentes grados de anormalidades
cervicales, se registró una prevalencia de
infección por el VPH del 41.5 % en las muestras cervicales y del 30.8 %
en las muestras anales (VPH-16, -18, -45 y -58). La infección en ambos lugares
anatómicos fue del 18 % de las mujeres, y de ellas, el 11.25 % presentaron el
mismo genotipo viral, siendo el VPH-16 el de mayor prevalencia (34 %), seguido de VPH-58 (32 %) y del VPH-18 (19 %).
La presencia de estos genotipos en cérvix fue la única variable asociada a la infección por VPH en ano (OR 2.85;
IC 95 %: 1.68 a 4.84, P = 0.000 0) (González-Losa y col., 2016).
Consideraciones
y recomendaciones de detección de cancer anal en
mujeres con historia de displasia cervical
La información disponible en la literatura científica
y discutida previamente permite establecer
que existen varias condiciones importantes a considerar respecto a la
infección por VPH, la presencia de displasia cervical y displasia anal y el
riesgo de desarrollar cáncer invasivo anal (Tabla 1):
•
La incidencia de cáncer anal ha incrementado de 0.55/100 000 a 2.4/100 000
habitantes en los últimos 10 años.
•
La carga atribuible global de VPH-AR en cáncer anal es del 88 % y en lesiones
precursoras anales se estima en 95 %.
• Los genotipos de VPH-AR (VPH-16, -18, -31, -33, -35, -39, -45 y -51) se asocian con el 96 % de los casos de cáncer anal, y los dos
primeros se consideran los de mayor
prevalencia (80.6 %).
•
Las displasias cervicales de AG (NIC 2 y 3) y
cáncer cervical se asocian a un riesgo estimado
de 2.9 y 4.2 veces mayor para el desarrollo de lesiones precursoras a nivel
anal, y dicho riesgo es mayor en personas con más de 60 años.
•
Las mujeres con infección asociada a VPH cervical pueden tener altas tasas de
infección por VPH anal, citología anal anormal y estadíos de displasia anal de AG, condicionando un
riesgo mayor para desarrollo de cáncer anal invasor.
•
La citología anal (PAP anal) es un estudio de cribaje altamente sensible,
pudiendo incrementar especificidad asociado a detección de ADN del VPH. Las
recomendaciones sugeridas en pacientes de riesgo, como las mujeres con lesiones
de displasia cervical, son el de repetir estas pruebas a intervalos regulares
en forma de prueba de tamizaje, asociándose a la exploración digital anal. De
encontrarse alteraciones, las pacientes
deberán remitirse para realización de pruebas confirmatorias.
CONCLUSIONES
La
evidencia científica establece la importancia de realizar citologías anales en mujeres
con lesiones precursoras de cáncer cervical e infección por virus del papiloma
humano (VPH). Es conveniente, por ello,
considerar complementar el actual programa de detección de cáncer cervicouterino, agregando un modelo de prevención
integral, en el que se incluyan pruebas de tamizaje en la región anal, así como
la concientización sobre la prevención de cáncer anal en este grupo de riesgo.
Si bien en diversos países del mundo se recomienda la prueba de cribaje para
cáncer anal en los grupos de riesgo, en México no existen directrices para la
detección temprana de este tipo de cáncer, por lo que se necesitan más estudios
de prevalencia de infección por VPH anal y presencia de lesiones precursoras de
cáncer anal en mujeres con antecedentes de lesiones de displasia de alto grado
cervical, cáncer invasor e infección por VPH en ambas zonas anatómicas, que
sustenten la importancia de realizar la prueba de cribaje, así como la de
implementar la vacunación contra el VPH en los grupos de riesgo.
Referencias
Aguiar,
C., García, L., Boccardo, B, M., Vassel,
M., Arriola, A.,
Jaumandreu, S., …, and Heard, I. (2020). Anal PAP, HPV tests and magnifying chromoendoscopy with biopsies in the diagnosis of anal intraepithelial
neoplasia. Journal of Coloproctology. 40(3): 220-226.
Aguiar,
C., Jaumandreu, S., Álvarez, C. y Rodríguez, M. C.
(2018). Uso de la cromoendoscopía digestiva con
magnificación en el diagnóstico de la neoplasia intraepitelial anal. Acta
Gastroenterología Latinoamérica. 48(3): 206-212.
Alarcón-Romero,
L. D. C., Organista-Nava, J., Gómez-Gómez, Y., Ortiz-Ortiz, J.,
Hernández-Sotelo, D., Del-Moral-Hernández, O., …, and Gómez-Gómez, Y. (2022). Prevalence and distribution of
Human Papillomavirus genotypes (1997–2019) and their association with cervical cancer
and precursor lesions in women from southern Mexico. Cancer Control. 29: 10732748221103331.
Alemany,
L., Saunier, M., Alvarado-Cabrero, I., Quirós, B., Salmeron,
J., Shin, H. R., …, de-Sanjosé, S. (2015). Human papillomavirus DNA prevalence
and type distribution in anal
carcinomas worldwide. International Journal of Cancer. 136(1): 98-107.
Benevolo, M., Latini,
A., Rollo, F., Giuliani, M., Giglio, A., Giuliani, E., …, and Donà, M. G. (2022). Incidence of abnormal anal cytology in
HIV-infected and HIV-uninfected men who have sex with men. Cancer Cytopathol. A head of print.
Bertoli, H. K., Thomsen, L. T., Iftner, T., Dehlendorff, C., and Kjær, S. K. (2020). Risk of vulvar, vaginal, and anal
high-grade intraepithelial neoplasia and cancer according to cervical human
papillomavirus (HPV) status: A population-based prospective cohort study. Gynecologic
Oncology. 157(2): 456-462.
Brum, V. O. R., Tricoti, A. S. O., Pannain, G. D., Drumond, D. G.,
and Leite, I. C. G. (2022). Cytology-based Screening
for Anal Intraepithelial Neoplasia in Immunocompetent Brazilian Women with a
History of High-Grade Cervical Intraepithelial Neoplasia or Cancer. Revista Brasileira de Ginecologia
e Obstetricia. 44(7): 678–685.
CDC,
Centros para el Control y Prevención de Enfermedades (2020). Tasas del cáncer
anal asociado al VPH por raza y grupo étnico | CDC. Base de datos SEER*Stat del Programa Nacional de Registros del Cáncer: Archivo
analítico de incidencia, en Informe Estadísticas del Cáncer en los Estados
Unidos, 1998–2017. [En línea]. Disponible en:
https://www.cdc.gov/spanish/cancer/hpv/statistics/anal.htm. Fecha de consulta:
5 de agosto de 2022.
Ciombor, K. K., Ernst, R. D., and Brown,
G. (2017). Diagnosis and
diagnostic imaging of anal canal cancer. Surgical Oncology Clinics.
26(1): 45-55.
Clifford, G. M., Georges, D., Shiels, M. S., Engels, E. A., Albuquerque,
A., Poynten, I. M., …, and Stier, E. A. (2021). A
meta-analysis of anal cancer incidence by risk group: Toward a unified anal
cancer risk scale. International Journal of Cancer. 148(1): 38-47.
Coffey, K., Beral, V., Green, J., Reeves, G.,
and Barnes, I. (2015). Lifestyle and reproductive risk factors associated with
anal cancer in women aged over 50 years. British Journal of Cancer. 112(9): 1568-1574.
Cronin, B., Bregar, A., Luis, C., Schechter,
S., Disilvestro, P., Pisharodi,
L., …, and Robison, K. (2016). Evaluation of anal cytology and dysplasia in
women with a history of lower genital tract dysplasia and malignancy. Gynecologic
Oncology. 141(3): 492-496.
Della-Fera, A. N., Warburton, A., Coursey, T. L., Khurana, S., and McBride, A. A. (2021).
Persistent Human Papillomavirus Infection. Viruses. 13(2): 321.
De-Martel, C., Plummer, M., Vignat, J., and S.
(2017). Worldwide burden of cancer attributable to HPV by site, country
and HPV type. International Journal of Cancer. 141(4): 664-670.
DOF,
Diario Oficial de la Federación (2007). Modificación a la Norma Oficial
Mexicana NOM-014-SSA2-1994. Para la prevención, detección, diagnóstico,
tratamiento, control y vigilancia epidemiológica del cáncer cérvico uterino. Diario
Oficial de la Federación. Secretaria de Salud. 52-70.
Donaire,
C., Reillo, M., Martínez-Escoriza,
J. C., and López-Fernández, J. A. (2017). Anal study in immuno-competent
women with human papillomavirus related lower genital tract pathology. European
Journal of Obstetrics and Gynecology and Reproductive Biology. 211: 25-20.
Elfström, K. M., Eklund, C., Lamin, H., Öhman, D., Hortlund, M., Elfgren, K., …, and Dillner J.
(2021). Organized primary human papillomavirus-based cervical screening: A
randomized healthcare policy trial. PLoS Med. 18(8): e1003748.
Elorza,
G., Saralegui, Y., Enríquez-Navascués, J. M., Placer, C., and Velaz, L. (2016). Neoplasia intraepitelial anal: una
revisión de conjunto. Revista Española de Enfermedades Digestivas.
108(1): 31-39.
Erazo-Luna,
E. V. and Velásquez-Lopera, M. M. (2019). Immunological response to human papilloma virus. Dermatología Revista Mexicana. 63(1): 40-59.
Fraga-Campo,
S. (2010) HPV. Cribado de cáncer de cérvix
Vacunación. [En línea]. Disponible en: https://www.quironsalud.es/es/comunicacion/agenda-eventos/1-jornada-ginecologia-obstetricia-atencion-primaria.ficheros/461053cribado%20cáncer%20cervix.%20VPH.%20Vacuna.pdfPT. Fecha de consulta: 5 de agosto de 2022.
Globocan (2020). México. The Global Cancer
Observatory. International Agency for Research on Cancer, in World Health
Organization. [En línea]. Disponible
en:
https://gco.iarc.fr/today/data/factsheets/populations/484-mexico-fact-sheets.pdf.
Fecha de consulta: 10 de agosto de 2022.
González-Losa,
M. R., Puerto-Solís, M., Ayora-Talavera, G., Gómez-Carvallo, J., Euán-López,
A., Cisneros-Cutz, J. I., …, and Conde-Ferráez, L. (2016). Prevalence of anal infection due to
high-risk human papillomavirus and analysis of E2 gene integrity among women
with cervical abnormalities. Enfermedades
Infecciosas y Microbiología Clínica. 36(4): 209-213.
Hernández-Hernández,
D. M., Patlán-Pérez, R. Ma., y Apresa-García, T. (2015). Panorama
epidemiológico del cáncer cervicouterino. Revista Médica del Instituto
Mexicano del Seguro Social. 53(2): S154-161.
INCAN,
Instituto Nacional de Cancerología (2016). Programa Integral de Prevención y
Control del Cáncer en México. [En línea]. Disponible en: https://www.iccp-portal.org/system/files/plans/PICCM_FINALINCan_Enero2018.pdf.
Fecha de consulta: 25 de enero de 2023.
INEGI,
Instituto Nacional de Estadística y Geografía (2021). Estadísticas a propósito
del día mundial contra el cáncer. Datos nacionales, en Comunicado de prensa núm. 105/21. [En línea]. Disponible en: https://www.inegi.org.mx/contenidos/saladeprensa/aproposito/2021/cancer2021_Nal.pdf.
Fecha de consulta: 10 de agosto de 2022.
Khattab, R., McMeekin, E., Taege, A. J., Hekman, J. M., Brainard, J. A., Underwood, D., …, and
Sturgis, C. D. (2018).
Unsatisfactory exfoliative anal cytology samples, 15-year experience with
histologic, cytologic, and molecular follow-up. Diagnostic Cytopathology.
46(2): 117-121.
Krzowska-Firych, J., Lucas, G., Lucas, C., Lucas,
N., and Pietrzyk, Ł. (2019). An overview of Human
Papillomavirus (HPV) as an etiological factor of the anal cancer. Journal of
Infection and Public Health. 12(1): 1-6.
Lammé, J., Pattaratornkosohn,
T., Mercado-Abadie, J., Alkhas, A., Robinson, A., and
Lanneau, G. (2014). Concurrent anal human
papillomavirus and abnormal anal cytology in women with known cervical
dysplasia. Obstetrics and Gynecology. 124(2 Pt 1): 242-248.
Latan, J.,
Fernandes, A., López, M., Fermín, M., and Correnti,
M. (2017). Detección de la infección por virus de papiloma humano en ano en
pacientes con lesiones en cuello uterino. Revista de Obstetricia y
Ginecología de Venezuela. 77(2): 92-99.
Lin, C., Slama, J., Gonzalez, P., Goodman,
M. T., Xia, N., Kreimer, A. R., …, and Clifford, G.
M. (2019). Cervical
determinants of anal HPV infection and high-grade anal lesions in women: a
collaborative pooled analysis. The Lancet
Infectious Diseases. 19(8): 880-891.
Mayer, R.
J. (2019). Cánceres de tubo digestivo bajo, en Harrison. Principios de
Medicina. [En línea]. Disponible en: Interna.
https://accessmedicina.mhmedical.com/contentaspx?bookid=1717§ionid=114915201.
Fecha de consulta: 10 de agosto de 2022.
Moscicki, A. B., Darragh, T. M.,
Berry-Lawhorn, J., Roberts, J. M., Khan, M. J., Boardman, L. A., …, and
Palefsky, J. M. (2015). Screening for anal cancer in women. Journal of Lower Genital Tract
Disease. 19(3): S27–S42.
Nasioutziki, M., Chatzistamatiou,
K., Loufopoulos, P. D., Vavoulidis,
E., Tsampazis, N., Pratilas,
G. C., …, and Dinas, K. (2020). Cervical, anal and oral HPV detection and HPV
type concordance among women referred for colposcopy. Infectious Agents and
Cancer. 15(1): 15-22.
National Cancer Institute (2019). SEER Cancer Stat Facts. [En línea]. Disponible en:
https://seer.cancer.gov/statfacts/html/mulmy.html.
Fecha de consulta: 10 de agosto de
2022.
Nelson, V. M. and Benson, A. B. (2017). Epidemiology of anal canal
cancer. In Surgical Oncology Clinics of North America. 26(1): 9-15.
Ortiz-Bautista,
R. J. y Méndez-Cano, V. H. (2018). Tamizaje por citología de lesiones
preneoplásicas del conducto
anal. Patología Revista Latinoamericana. 56(4): 303-309.
Padilla-España,
L., Repiso-Jiménez, J. B., Fernández-Sánchez, F., Pereda, T., Rivas-Ruiz, F.,
Fernández-Morano, T., …, and de-Troya-Martín, M. (2016). Efectividad del genotipado del virus del papiloma humano frente a la
citología anal en la identificación de neoplasia intraepitelial de alto grado. Enfermedades Infecciosas y
Microbiologia Clinica. 34(7): 400-405.
Pangarkar, M. A. (2022). The Bethesda System for reporting cervical
cytology. Cytojournal. 19: 28.
Ramírez-Padilla,
M., Ruiz-López, P., and de-Aguinaga-Inurriaga, A. E.
(2020). Virus del papiloma humano y condilomatosis anogenital. Dermatología
Cosmética, Médica y Quirúrgica. 18(3): 215-227.
Sánchez-Corredor,
C. D., Guerrero-Machado, M., Rubio-Romero, J. A., Diaz-Cruz, L. A., Angel-Muller, E., and Rey-Serrano, G. (2020). Prevalence of high-risk human
papilloma virus infection and abnormal cytology of the anal transformation zone
in women with cervical dysplasia. Revista
Colombiana de Obstetricia y Ginecología. 71(4): 345-355.
Sand, F. L.,
Munk, C., Jensen, S. M., Svahn, M. F., Frederiksen, K., and Kjær, S. K.
(2016). Long-term risk for
noncervical anogenital cancer in women with previously diagnosed high-grade
cervical intraepithelial neoplasia: A Danish nationwide cohort study. Cancer Epidemiology Biomarkers and Prevention. 25(7): 1090-1097.
Santos-López,
G., Márquez-Domínguez, L., Reyes-Leyva, J., y Vallejo-Ruiz, V. (2015). Aspectos
generales de la estructura, la clasificación y la replicación del virus del
papiloma humano. Revista Mexicana del Seguro Social. 53(S2): 166-171.
Sehnal,
B., Dusek, L., Cibula, D., Zima, T., Halaska, M., Driak, D., and Slama, J.
(2014). The relationship
between the cervical and anal HPV infection in women with cervical
intraepithelial neoplasia. Journal of Clinical Virology. 59(1): 18-23.
Sendagorta-Cudós, E., Burgos-Cibrián, J., and Rodríguez-Iglesias, M.
(2019). Genital infections due to the human papillomavirus. Enfermedades Infecciosas y Microbiología Clinica. 37(5): 324-334.
Shiels,
M. S., Kreimer, A. R., Coghill, A. E., Darragh, T. M., and Devesa, S. S.
(2015). Anal cancer
incidence in the United States, 1977-2011: Distinct patterns by histology and behavior. Cancer
Epidemiology Biomarkers and Prevention. 24(10): 1548-1556.
Simpson, S., Blomfield, P., Cornall, A., Tabrizi, S. N., Blizzard, L., and Turner, R.
(2016). Front-to-back & dabbing wiping behaviour post-toilet
associated with anal neoplasia & HR-HPV carriage in women with previous
HPV-mediated gynaecological neoplasia. Cancer
Epidemiology. 42: 124-132.
Stier, E. A. and Chiao, E. Y. (2017). Anal cancer and anal cancer
precursors in women with a history of HPV-related dysplasia and cancer. Seminars
in Colon and Rectal Surgery. 28(2): 97-101.
Stier, E. A., Sebring, M. C., Mendez, A. E., Ba, F. S., Trimble, D. D.,
and Chiao, E. Y. (2015). Prevalence of anal human papillomavirus infection and
anal HPV-related disorders in women: A systematic review. American Journal of Obstetrics and
Gynecology. 213(3): 278-309.
Sung, H., Ferlay, J., Siegel, R. L., Laversanne, M., Soerjomataram,
I., Jemal, A., and Bray, F. (2021). Global Cancer Statistics 2020: GLOBOCAN
Estimates of incidence and mortality worldwide for 36 cancers in 185 countries.
Cancer Journal for
Clinicians. 71(3): 209-249.
Torres-Poveda,
K., Piña-Sánchez, P., Vallejo-Ruiz, V., Lizano, M., Cruz-Valdez, A.,
Juárez-Sánchez, P., …, and Manzo-Merino, J. (2020). Molecular markers for the diagnosis
of high-risk human papillomavirus infection and triage of human
papillomavirus-positive women. Revista de I nvestigacion Clinica. 72(4):
198-212.
Viens,
L. J., Henley, S. J., Watson, M., Markowitz, L. E., Thomas, C. C., Thompson, T.
D., …, and Saraiya, M. (2016). Human Papillomavirus–Associated Cancers — United States, 2008–2012. Morbidity and Mortality Weekly
Report. 65(26): 661-666.
Wohlmuth, C., Ghorab,
Z., Shier, M., Tinmouth, J., Salit,
I. E., Covens, A., …, and Vicus, D. (2021). Cytology-based screening for anal
intraepithelial neoplasia in women with a history of cervical intraepithelial
neoplasia or cancer. Cancer Cytopathology. 129(2): 140-147.