https://doi.org/10.29059/cienciauat.v18i2.1795
La
importancia de la microbiota intestinal en la fisiología
y rendimiento de pollos de engorda y gallinas de postura
The importance of intestinal microbiota on the
physiology and performance of broiler chickens and laying hens
Microbiota intestinal de aves comerciales
Jesús Emiliano Alvarado-López, Elein Hernández*
*Correspondencia:
elein_ht@comunidad.unam.mx/Fecha de
recepción: 13 de marzo de 2023/Fecha de aceptación: 27 de noviembre de 2023 /Fecha
de publicación: 30 de enero de 2024.
Universidad Nacional Autónoma de México, Facultad de
Estudios Superiores Cuautitlán, Departamento de Ciencias Pecuarias, Campo 4,
carretera Cuautitlán-Teoloyucan km 2.5, col. San Sebastián Xhala, Cuautitlán
Izcalli, Estado de México, México, C. P. 54714.
RESUMEN
El
estudio de la microbiota ha adquirido un nuevo enfoque
de interés, ya que interviene en diversos procesos fisiológicos involucrados en
el desarrollo y rendimiento de los animales domésticos. Participa en el eje microbiota-intestino-cerebro,
con procesos que rigen el sistema nervioso hacia el intestino y viceversa. El
objetivo de este trabajo fue identificar la importancia de la
microbiota gastrointestinal de pollos de engorda y gallinas de postura y
su relación con procesos fisiológicos que
afecten el desarrollo, rendimiento, comportamiento y salud. En el tracto
gastrointestinal de estas aves se han identificado alrededor de 17 filos de bacterias, con microorganismos predominantes
según el sitio anatómico dentro del tracto y por ende con diferente función,
por ejemplo, buche: Lactobacillus, Enterobacteriaceae; proventrículo: Clostridiaceae, Enterococcus;
intestino: Escherichia, Streptococcus.
Distintos factores intervienen en la colonización y desarrollo de la microbiota,
desde el programa de alimentación y manejo, tipo de cama y densidad
animal, entre otros. Existen microorganismos potencialmente
patógenos que impactan negativamente en la microbiota
y puedan llegar al consumidor, como Campylobacter jejuni,
Salmonella enteritidis y
Escherichia coli,
de ahí su importancia al momento de
trazar las directrices en las producciones pecuarias.
PALABRAS CLAVE:
microbiota, metabolismo, avicultura, salud animal, gallinas de postura.
ABSTRACT
There
is an increasing interest in microbiota studies due to their relevance in
physiological processes such as animal development and productivity. In
addition, it its involved in the microbiota-intestine-brain axis that regulates
the nervous system to the intestine and vice versa. This paper is aimed at
identifying the importance of the broilers and laying hens’ gastrointestinal microbiota and its relationship with
diverse physiological processes that intervene in the development,
productivity, behavior, and health. There
are 17 filos of bacteria within the poultry
gastrointestinal tract, which are site dependent and have specific functions
(Example; crop: Lactobacillus, Enterobacteriaceae; proventriculus: Clostridiaceae,
Enterococcus; intestine: Escherichia, Streptococcus). In addition, different factors affect the
development of microbiota such as the feeding program, handling, kind of
substrate, stocking density, among others. There are several potentially
pathogenic microorganisms that impact microbiota negatively and may reach the
final consumer such as Campylobacter jejuni, Salmonella
enteritidis and Escherichia coli. Therefore, it is important
to continue supporting poultry microbiota
research and areas of opportunity to improve poultry production.
KEY WORDS: microbiota, metabolism, broiler, animal health,
laying hens.
![]()
INTRODUCCIÓN
El término
“microbiota” se refiere a todos los microorganismos vivos (principalmente
bacterias) que se encuentran en un espacio delimitado (Kogut,
2019). Se compone por bacterias, arquea, virus, protozoarios y hongos. Se
diferencia del término “microbioma”, ya que este
incluye, además de los microorganismos, todo el espectro de moléculas que producen los mismos, ácidos
nucleicos, proteínas, lípidos,
polisacáridos, así como metabolitos y moléculas que se generan de la
interacción con otros microorganismos, con
el organismo o con las condiciones microambientales (Kogut, 2019; Kraimi y col., 2019).
En
años recientes se ha buscado definir una “microbiota
saludable”, ya que esta depende de diversos factores, que son señalados como marcadores para su cumplimiento, y a su vez
son influenciados por distintos factores que
afectan a los animales de forma individual,
como la resistencia (habilidad de las bacterias para resistir perturbaciones del entorno), resiliencia (capacidad
de las bacterias de regresar al estado basal), riqueza (número total de microorganismos en el medio), y diversidad (total de especies de microorganismos en el
medio), la formación de biopelículas (estructuras formadas por comunidades de
microorganismos que se adhieren a una
superficie) e interacción entre microorganismos (relaciones y
comunicación que ocurren entre diferentes
tipos de microorganismos). Algunos de
esos microorganismos pueden convivir en simbiosis
con el organismo, donde este proveerá
de nichos a lo largo del tracto digestivo y del bolo alimenticio, que
les sirve de sustrato (Berding y col., 2021); a su
vez, los microorganismos metabolizarán los
componentes del bolo, lo cual brinda un beneficio al organismo mediante
la producción de ácidos grasos de cadena corta como el butirato y propionato
(Cao y col., 2021). Otros microorganismos presentes en la
microbiota son potenciales patógenos, y a través de algún desequilibrio
en el medio se puede desencadenar su
proliferación provocando enfermedades (Marmion
y col., 2021). La clasificación basada en las funciones que ejercen los
microorganismos en el individuo, los divide en aquellos
que participan en la fermentación de
carbohidratos, degradación de proteínas o lípidos, los que ejercen una
función de barrera, y los que intervienen en la síntesis de neurotransmisores, entre otras funciones (Rowland y
col., 2018; Berding y col., 2021). Otra clasificación propuesta, sugiere dividir a las bacterias que se encuentran presentes
en el lumen y el bolo alimenticio, las cuales tienen o no la acción de
modificar las condiciones microambientales
y de participar en la digestión de los alimentos; están influenciadas
por el paso del contenido intestinal,
sustancias antimicrobianas (antibióticos principalmente) y el tipo de
alimento; separándola de la microbiota que se destaca por su capacidad de
relacionarse con el enterocito en funciones
para la absorción de nutrientes, o bien en condiciones de enfermedad para la destrucción de los mismos (Rowland
y col., 2018; Qamar y col., 2020). También pueden clasificarse de
acuerdo a su temporalidad como “microbiota de tránsito” y “microbiota funcional”. La primera aparece en algún
punto en específico del crecimiento o adición de algún elemento en el
medio ambiente o dieta y puede o no tener una
influencia sobre los procesos
fisiológicos del animal; mientras que la segunda normalmente es estable
por tiempos más prolongados e interviene en
mayor medida en los procesos fisiológicos que desarrolla el organismo (Hammer y col., 2019; Berding y
col., 2021).
El presente trabajo
tuvo como objetivo identificar la relación
que tiene la microbiota del tracto
gastrointestinal de pollos de engorda y gallinas de postura con los procesos
fisiológicos, que afecten el desarrollo, rendimiento, comportamiento y
salud de las aves comerciales.
Metodología de
búsqueda de la literatura
Se enfocó
principalmente en aspectos generales de la microbiota,
orientados hacia pollos y gallinas. Se
utilizaron los términos “microbiota” “microbiota poultry”
“microbiota behaviour” “microbiota environment
poultry” “microbiota
development poultry”
“microbiota broiler”, y “microbiota gut brain axis” en la base de datos de Biblioteca Digital UNAM, Google Académico (Google Scholar)
y Researchgate,
en el periodo de julio de 2020 a enero 2023. La búsqueda y selección del material se basó en la declaración PRISMA 2020 para la
publicación de revisiones sistemáticas, considerando los criterios
de: título, resumen, justificación, objetivos, criterios de
elegibilidad, fuentes de datos, estrategia de búsqueda, proceso de selección de
estudios, proceso de extracción de datos, evaluación del riesgo de sesgo, métodos de síntesis, selección de
estudios y discusión (Page y col., 2021). Se buscó no tener revisiones o investigaciones similares por autor,
eligiendo los documentos más recientes para minimizar la información repetida. Se localizaron 41 trabajos y en el presente documento se plasmaron los elementos
más importantes de los mismos, para un mayor entendimiento del tema.
La
microbiota intestinal de pollos y gallinas de avicultura
El tracto
gastrointestinal es el área con mayor abundancia y diversidad de
microorganismos presentes. Estudios recientes han encontrado evidencia de que
cambios en la microbiota repercuten de manera
significativa en procesos inmunológicos, de crecimiento, metabólicos, desarrollo neurológico, comportamiento, salud, rendimiento y salubridad (Oakley y col.,
2014; Rowland y col., 2018; Kraimi y col., 2019).
En el caso de las
bacterias presentes en el tracto gastrointestinal de las aves domésticas, se
han identificado alrededor de 17 filos, los más dominantes incluyen Firmicutes, Cyano bacteria, Actinobacteria, Proteobacteria y Bacteroidetes, que en conjunto representan el 99 % de la flora presente en el duodeno
e ileón. Sin embargo, los microorganismos
dominantes varían dependiendo de la
estructura anatómica dentro del tracto gastrointestinal (Lv y col., 2021).
En las aves, la
cavidad oral y la faringe forman una cavidad en común llamada orofaringe a
diferencia de los mamíferos que presentan dos cavidades separadas que convergen
en una sola con el mismo nombre. Las aves
toman el alimento con el pico y lo combinan con saliva, aunque la
secreción de esta es muy poca, cumple como
lubricante con la función de humedecer y facilitar el paso del alimento
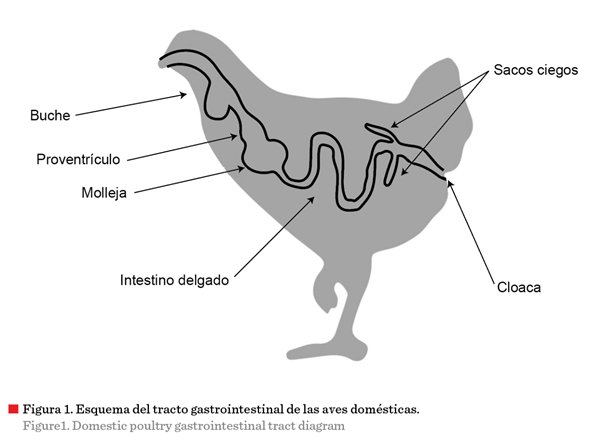
al esófago, que se dispone entre la orofaringe y el estómago glandular, y se
divide en esófago cervical y torácico. En el esófago cervical se encuentra el
buche, cuya función es almacenar alimento para que se reblandezca y favorecer
su posterior digestión; si el ave está en ayuno, el alimento pasa directamente
al proventrículo (estómago glandular), donde
tiene lugar la segregación de los jugos gástricos que actúan sobre las
proteínas, degradándolas para favorecer su posterior absorción. El ventrículo o
molleja tritura y macera el alimento mediante
contracciones musculares, que
posteriormente pasará al intestino delgado, integrado por el duodeno, yeyuno e íleon. En dicha porción del tracto se lleva a cabo la absorción de nutrientes.
Finalmente, pasa al intestino grueso, formado
por un par de sacos ciegos, colon y al
final la cloaca, en donde el alimento es expulsado en forma conjunta con la orina (Yadav y Jha,
2019; Wickramasuriya y col., 2022).
Uno
de
los factores que afectará tanto la función del tracto digestivo, así como la
proliferación de microorganismos en el mismo, es la variación del pH dentro del tracto gastrointestinal. El
pH varía en cada porción del tracto, por factores intrínsecos de la dieta, como
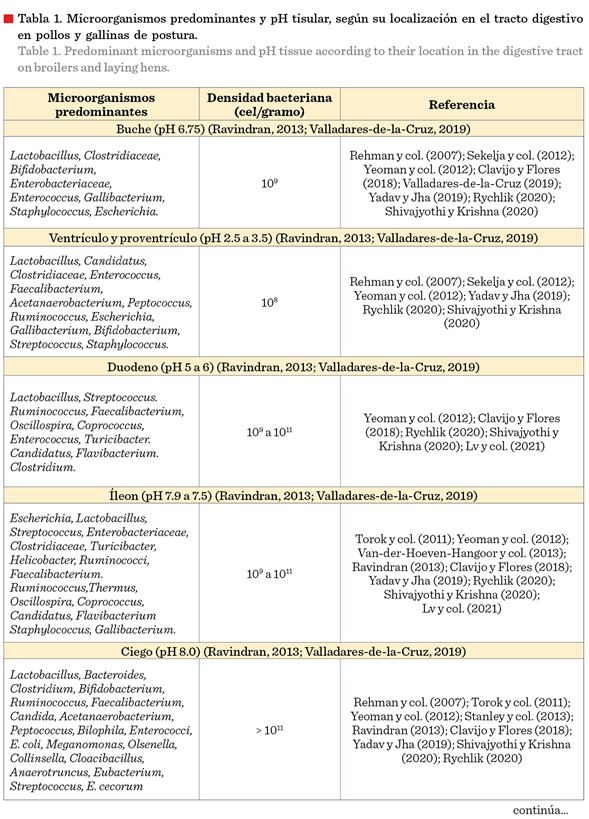
es el tipo de presentación del alimento, o bien, el pH del agua que les es brindada a los animales (Angel
y col., 2013; Valladares-de-la-Cruz, 2019). En la Tabla 1 se puede ver la diferencia de pH a lo largo del
tracto digestivo de los pollos y gallinas de
postura; mientras que en la Figura 1
se puede observar un esquema de su tracto
gastrointestinal.

Cambios de la microbiota por etapas de producción
En
estas aves, el proceso de mejoramiento genético se ha llevado a cabo por décadas, con el objetivo de aumentar la eficiencia
productiva, asociado a una eficiente conversión de alimento en masa
corporal a través de la extracción de nutrientes. Adicionado a esto, se ha
buscado una buena relación entre su metabolismo y funciones bioquímicas con la microbiota intestinal
y los procesos que lleva a cabo, desde la degradación de los
alimentos, hasta la síntesis de componentes, como los ácidos grasos de
cadena corta o vitaminas, con efectos
benéficos, al inducir mayor
rendimiento en tiempos de producción más cortos (Stanley y col., 2014; Qamar y col.,
2020).
La microbiota
de las aves está compuesta por aproximadamente 900 especies diferentes de
microorganismos, y tan solo alrededor del 45 % de ellos pueden, con seguridad,
asignarse a un género conocido (Stanley y
col., 2014). La colonización de dichos microorganismos en el tracto
gastrointestinal ocurre inmediatamente después de la eclosión, incluso el microambiente de la incubadora influirá en las
especies de microorganismos que estarán
presentes, así como el manejo, material de la cama, alimento,
transporte, recursos de enriquecimiento ambiental, agua, y otras aves, por lo
tanto la colonización y el tipo de microbiota que se alojará en el tracto
de las mismas es multifactorial (Stanley y
col., 2014; Qamar y col., 2020; Seidlerova y col., 2020).
Estudios recientes le
han dado seguimiento al establecimiento de la microbiota
en las aves y muestran que la inoculación que empieza inmediatamente después de
la eclosión, llega a una concentración de 108
a 1010 células
microbianas/gramo de muestra, posterior al primer día, siendo bacterias como Lactobacillus spp, Bifidobacterium spp, coliformes y clostridios
las más abundantes en esta edad. Posteriormente alcanza cierta estabilidad
después del día 3, fluctuando con los cambios de alimentación (Stanley y col.,
2014). Luego de la semana de edad, se comienza a ver una clara separación de la
composición de la microbiota en las diferentes partes del tracto, ya que las
bacterias que se alojan ahí ayudan con las actividades específicas que tiene
cada sección, por ejemplo, las bacterias alojadas en mayor abundancia en el
ciego ayudarán con la fermentación de los componentes del bolo alimenticio,
mientras que las que están a lo largo del intestino delgado ayudarán en la degradación de los alimentos a componentes
más simples, favoreciendo su absorción
(Stanley y col., 2014). Dicha microbiota queda
totalmente establecida hasta los 20 d de edad (Marmion
y col., 2021). Autores como Oakley y col. (2014),
mencionaron que a lo largo de la vida de los animales la composición de la microbiota se modifica, principalmente cuando se realizan variaciones en la dieta,
o por la adición de un aditivo en ella, esto debido al cambio en las cantidades
de nutrientes usadas en diferentes etapas
del ciclo de producción (Oakley y col., 2014). Dado lo anterior, autores como
Kayal y col. (2022) evaluaron
la posibilidad de ejercer una modificación temprana y oportuna sobre la
microbiota, mediante la aplicación de un producto probiótico a la recepción de los animales, obtuvieron un
mejor peso en el grupo tratado a comparación del grupo control, y una
composición de la microbiota más diversa y estable, demostrando que se puede
ocupar como herramienta para obtener mejores parámetros productivos e incluso
prevenir la colonización de potenciales patógenos.
Factores que afectan
el establecimiento y diferenciación de la microbiota
Diversos factores
influyen en la colonización de la microbiota, como
manejo (lotificación por edad, bioseguridad,
buenas prácticas pecuarias), alojamiento (pastoreo vs. sistema
intensificado), genética, fin zootécnico, edad, y dieta. Una práctica común de manejo es mantener parvadas de la misma
edad durante el mismo ciclo producción y evitar introducción de
especímenes de diferente origen, es decir,
las aves jóvenes o inmediatamente después de la eclosión, no conviven
con las adultas, lo cual elimina la probabilidad
de que la microbiota de estas últimas sea un inóculo primario através del contacto con las
heces o plumas y tenga un efecto en el desarrollo y establecimiento de la microbiota del ave joven. Las
prácticas enfocadas a la higiene, tanto en la
incubadora como en el alojamiento de los animales, la limpieza y
desinfección está enfocada en eliminar las
altas cargas bacterianas, específicamente bacterias patógenas, como puede ser Salmonella, Escherichia
potencialmente patógena y Mycobacterium
(Stanley y col., 2014). Las buenas prácticas pecuarias de bioseguridad implican
limpieza al entrar en contacto directo con
los animales, así como limpieza de material y de cajas de transporte, ya
que también podrían participar como inóculo
del tipo de microbiota que se alojará en el tracto digestivo. Es por eso que el manejo deberá de ser el adecuado para
propiciar que sean las bacterias benéficas las que colonicen a los animales, por ello muchas veces se opta por la utilización de productos como los probióticos
(Stanley y col., 2014; Shivajyothi y Krishna, 2020; Kayal
y col., 2022).
Las condiciones
ambientales de alojamiento como el sustrato,
materiales de la cama, tipos de comederos y bebederos, condiciones de humedad, temperatura y ventilación, entre otras,
afectan la microbiota e influenciarán el tipo de
microorganismos que colonizan el tracto (Mancabelli y
col., 2016). Seidlerova y col. (2020), reportaron un
menor número de especies bacterianas y diferenciación en las especies que
alojan aves bajo condiciones de producción intensiva, comparado con aquellas en sistema de pastoreo, mostrando estas últimas un notorio incremento de Bacteroidetes
y proteobacterias en comparación con
otros filos bacterianos (Seidlerova y col., 2020). En forma similar, Mancabelli y col. (2016) documentaron diferencias en los
filos del tracto digestivo de pollos bajo distintas condiciones de producción; Firmicutes fueron reportados como microorganismos
predominantes en el sistema tecnificado, mientras Bacteroidetes
predominaron en el de libre pastoreo.
Los factores
intrínsecos de los animales, como las diferencias genéticas de las aves y por
ende el tipo de dieta diseñado específicamente
para el fin zootécnico del ave comercial, también son determinantes para
la colonización (Wickramasuriya y col., 2022). Un
ejemplo es el radio de Bacteroidetes: Actinobacter en las líneas de gallinas reproductoras de la
línea Cobb, que fue más bajo comparado con la línea Ross de pollos de engorda (Marmion y col., 2021). Es decir, el perfil de microbiota se
puede ver afectado por la línea genética y su fin zootécnico, en este caso, las
reproductoras (no destinadas a consumo), comparado con las de abasto, las
cuales requieren nutrientes, alojamiento y
manejo específico para obtener un mejor rendimiento. También se ha observado que en especímenes con una
mayor capacidad de conversión alimenticia
predominan Actinetobacter spp, Bacteroides
spp, Clostridium spp,
Lactobacillus spp y Streptococcus spp, mientras que, en los que presentan conversiones bajas
tienen una mayor abundancia solo en Lactobacillus (Marmion
y col., 2021). El sexo del ave también es
una determinante del tipo de microbiota, ya que se ha reportado que machos y
hembras solo tienen un 30 % de similitud en sus comunidades microbianas,
diferenciándose principalmente en abundancia de Lactobacillus salivarius, L. crispatus,
L. aviaries y Escherichia coli., una causa posible de esta diferencia es por los
criterios de selección; en el caso de los pollos se busca la utilización de
solo machos, y para el caso de líneas de postura
se busca la utilización y mejoramiento de las hembras (Wickramasuriya y col., 2022).
La
edad también influye, se espera que el temprano establecimiento de la microbiota ayude a la maduración del sistema inmune,
por lo tanto, las bacterias que se alojan
primariamente en el tracto no forzosamente estarán a lo largo de la vida
del animal. En dicho sentido, se han
encontrado géneros que están presentes
a lo largo de toda la vida de las aves, los cuales son Halomonas spp,
Lactobacillus spp, Bacteroides spp y Entereococcus
spp (Wickramasuriya y col., 2022).
La
dieta y los elementos que la componen es quizá el factor que más influencia
tiene en el desarrollo y establecimiento de la microbiota de los
animales, no obstante, a lo largo de un
ciclo productivo se ofrecen diversas dietas para lograr el objetivo de
producción y algunos componentes pueden
participar en la colonización y establecimiento de ciertos grupos bacterianos, por ejemplo, un alto contenido de fibra se ha asociado a una mayor colonización
de Bifidobacterium spp, Lactobacillus spp,
Akkermanasia spp,
Feaecalibacterium spp,
Roseburia spp, Bacteroides
spp y Provetela spp, y también se ha indicado que puede
propiciar una reducción en enterobacterias, siendo
la celulosa uno de los componentes de la dieta que más presenta este efecto (Berding y col., 2021).
Los
lípidos tendrán un efecto dependiendo su tipo. Se ha
reportado que ácidos grasos de cadena media pueden incrementar la abundancia de
Bifidobacterium spp,
Bacteroides spp y Prevotella spp
así como una reducción de Clostridium spp. y Helicobacter spp. (Berding y col., 2021). En cuanto a las proteínas y
aminoácidos, las dietas ricas en proteína animal propician la abundancia de Peptostreptococcaceae
spp, Ruminococcaceae spp, Enterococcus spp, Streptococcus spp, Turicibacter spp y Escherichia spp, a comparación de las dietas basadas en proteína vegetal que propician la abundancia
de Bifidobacterium spp,
Roseburia spp y Lactobacillus
spp y en menor
nivel, la de Bacteroides spp y Clostridium
spp (Berding y col., 2021).
Dietas con diferentes
minerales o abundancia de estos afectará cómo y en qué cantidad los microorganismos colonizan el tracto, por ejemplo,
la suplementación con hierro ha demostrado que incrementan la abundancia de
organismos como Bacillus cereus, Staphylococcus
aureus, Clostridium difficile y Salmonella spp,
que contribuyen en procesos de inflamación intestinal (Berding
y col., 2021).
Es probable que los
programas de vacunación tengan un efecto en el desarrollo de
la microbiota. Orso y col. (2021)
identificaron que pollos de engorda vacunados
contra coccidias, mediante una vacuna viva, presentaron una disminución
en el porcentaje de Bacteroidetes, responsables de
producción de ácidos grasos de cadena corta que mejoran la salud intestinal. Lo
cual es consistente con el pobre desempeño productivo observado, comparado con el grupo que recibió un tratamiento de salinomicina. Esto demuestra lo sensible que es dicho medio
y su forma de colonización durante el desarrollo,
e incluso en etapas ya adultas, puesto
que los calendarios de vacunación y alimentación
animal cambian según las diferentes
etapas a lo largo de un ciclo de producción.
Es importante
considerar que las nuevas tendencias de producción al aire libre,
principalmente, participarán de forma diferente en cómo se coloniza la microbiota, y que las bacterias estarán presentes en
mayor abundancia (Berding y col., 2021). Las
diferencias que existen entre los diferentes tipos de ave (línea genética,
sexo, edad, propósito, tipo de dieta), y la microbiota que van a albergar estas
a lo largo del tracto gastrointestinal,
también dependerá de las condiciones microambientales
de cada porción del tracto; cada parte del mismo estará especializada en
una acción, y tendrá una concentración de
pH diferente afectando a los tipos de microorganismos que se pueden
albergar ahí (Tabla 1) (Yeoman y col., 2012; Oakley y col., 2014; Stanley y col., 2014; Kraimi y col., 2019).
Eje
microbiota-intestino-cerebro
La
relación entre la microbiota y el sistema nervioso
de los animales, conocida como “eje microbiota-intestino-cerebro”
(microbiota-gut-brain-axis,
en inglés) y sus acciones, influyen en el desarrollo cerebral, procesos
neuronales, procesos relacionados a la percepción del dolor, eje hipotálamo-hipofisiario y el comportamiento de las
aves, y otros animales, incluyendo al humano (Qi y
col., 2021). Estas acciones son de suma relevancia para el bienestar, por
relacionarse con el estrés, memoria, comportamiento de alimentación, comportamiento social, desarrollo de los animales, crecimiento
y el estado inmunológico, así mismo el cerebro modula la fisiología y
composición de la microbiota y el sistema inmune
entérico, dándose una retroalimentación que ejercen las tres partes del eje, la
microbiota, el tracto digestivo y el sistema
nervioso (Kraimi
y col., 2019; Qi y col., 2021). El eje ha sido bien
documentado, principalmente en mamíferos, pero existe poca información en cómo
impacta en la salud de las aves (Kraimi y col., 2019;
Queiroz y col., 2020; Berding y col; 2021; Cao y
col., 2021; Qi y col., 2021). En estas últimas se ha reportado que los estímulos de
inflamación intestinal, el epitelio, los músculos del tracto y el sistema
inmune transmiten señales al sistema
nervioso, lo cual también propicia la circulación de citocinas hacia el tracto, siendo el nervio vago el que tiene gran
participación en la transmisión de dichas señales.
Estos estímulos activan el eje hipotálamo-pituitario-adrenal que
incrementa los niveles de corticosterona, por lo cual, se da una combinación de
factores que desencadenan al final en una baja en el consumo de alimento,
pérdida de peso, pérdida de movimiento y
aumento en el comportamiento de descanso, que son considerados como signos
de enfermedad (Wickramasuriya
y col., 2022).
También en aves se ha
estudiado la participación del eje en condiciones de enfermedad, es el caso de
la enteritis necrótica, donde se muestra un marcado cambio en el comportamiento
de descanso, caminar, alimentación y el estado estático. Los microorganismos
presentes generan componentes neuro activos
que actúan localmente en el sistema nervioso entérico y que pasarán a la
circulación sanguínea, estas señales llegan al cerebro y modulan la cognición y
el comportamiento, todo derivado de los cambios en la salud del tracto digestivo (Wickramasuriya
y col., 2022). Se demostró que la exposición a Clostridium
perfringens resultó en un aumento en los niveles del
neurotransmisor dopamina, en tanto que, la
exposición a Eimeria spp
indujo una reducción en la producción
de la molécula (Wickramasuriya y col., 2022).
Funciones de la microbiota en el organismo
La participación de la
microbiota en los procesos fisiológicos de un organismo es de muchas maneras
más importante de lo que se puede llegar a pensar, ya que un desequilibrio en
la misma repercute no solo en enfermedades intestinales y/o mantenimiento de la
homeostasis intestinal de los animales (Oakley y col., 2014), sino que, también facilita la
aparición de diversos problemas que se conjuntan con procesos infecciosos,
patógenos y desórdenes metabólicos, como la disbacteriosis
(Kraimi y col.,
2019). Por ejemplo, los sacos ciegos son una porción intestinal
relevante en cuanto a microbiota cecal, ya que es uno de los lugares con mayor
abundancia y diversidad microbiana. En esta porción, el bolo alimenticio pasa
el mayor tiempo de digestión y aquí se
llevan a cabo procesos fisiológicos importantes, incluyendo el reciclaje
del ácido úrico, que es convertido por algunos microorganismos para la
formación de aminoácidos, como la glutamina, además de la regulación del agua y
fermentación de carbohidratos, lo cual tiene una importante contribución en la
salud intestinal, nutrición y eficiencia alimentaria (Oakley
y col., 2014). Es por ello que, la microbiota ejerce
un efecto sobre el organismo y se regula mediante señalización química, procesos endocrinológicos e inmunológicos y
competencia hacia otros microorganismos (Qamar
y col., 2020; Cao y col., 2021).
La interacción entre
el organismo y la microbiota se puede dar por procesos
inmunológicos por competencia, para impedir el establecimiento de patógenos (Rowland y col., 2018; Cao y col., 2021; Qi y col., 2021; Queiroz y col., 2022).
Las señales químicas
que ejercen los microorganismos se dan mediante productos de su metabolismo. Un
ejemplo es la fermentación de ciertos carbohidratos que resultan en la
producción de ácidos grasos de cadena corta, como lo son el butirato, el cual
se ha relacionado con microorganismos
pertenecientes a los Firmicutes, el propionato
que es un recurso energético para las células epiteliales y ha sido
relacionado con especies de Bacteroides spp y algunas especies de Clostridium
spp (Rowland y col., 2018; Cao y col., 2021; Qi y col., 2021; Queiroz y col., 2022).
También se ha señalado
que los microorganismos pueden sintetizar algunos neurotransmisores, por
ejemplo, microorganismos de los géneros Bacteroides
spp, Bifidobacterium
spp, Lactobacillus spp y Escherichia spp producen el
ácido gamma aminobutírico, inhibidor del sistema nervioso; Bacillus
spp y Lactobacillus plantarum
se relacionan con la producción de acetilcolina (neurotransmisor esencial para
la comunicación entre células nerviosas).
Mientras que Streptococcus spp Escherichia spp y Lactococcus spp son relevantes para el metabolismo de triptófano, y por
ende la síntesis de serotonina (neurotransmisor relacionado con el estado de
ánimo, regulación del sueño, apetito y
estrés); en tanto estudios in vitro de bacterias como Escherichia spp y Staphylococcus aureus
han reportado producción de dopamina (neurotransmisor relacionado con las
funciones cognitivas y el estado de ánimo). Por lo que se puede confirmar la
participación de bacterias en la función del sistema nervioso, y el estado
emocional de los animales (Rowland y col.,
2018; Cao y col., 2021; Qi y col., 2021; Queiroz
y col., 2022).
Otro
resultado del metabolismo de los grupos bacterianos son la formación de células
enteroendócrinas que regulan hormonas como la
colecistoquinina, que participa en la modulación del apetito y el mantenimiento
de la homeostasis de la glucosa, o la síntesis de algunos metabolitos
que se comunican con el sistema nervioso como ácidos biliares, que intervienen
en procesos de desintoxicación y la respuesta inmune intestinal (Qi y col., 2021).
En el caso del sistema
inmune, uno de los efectos observados es que la microbiota
media el desarrollo y función de la microglía
(célula del sistema nervioso involucrada en la respuesta inflamatoria con
capacidad fagocitaria), y de las
interleucinas que tienen un papel importante en la comunicación entre células del sistema inmune, participando principalmente en procesos de inflamación (Berding y col., 2021;
Cao y col., 2021; Qi y col., 2021). Algunos
reportes indican que los procesos de inflamación pueden alterar la integridad de la barrera hematoencefálica, que permite
el paso de moléculas que activan la microglía y el potencial proinflamatorio de
los astrocitos, que pueden desencadenar en la destrucción de neuronas e
interrupción de procesos cerebrales y nerviosos, o bien, por competencia contra
microorganismos patógenos, impidiendo que
estos se alojen en el intestino (Berding y
col., 2021; Cao y col., 2021; Qi y col., 2021).
Cuando bacterias consideradas patógenas aumentan su abundancia, pueden
causar problemas como la enteritis necrótica,
que conduce a la reducción y
destrucción de las vellosidades, lo cual repercutirá en el rendimiento
de los animales, esto es el caso de Clostridium
perfringes (Qamar y
col., 2020).
Se ha sugerido que la microbiota puede fungir como mediador o moderador en las
respuestas conductuales del organismo, las cuales no dependen totalmente de la
microbiota, pero participa en cómo se
expresan las conductas del organismo. Esto se ha estudiado mediante la transferencia de microbiota,
de ratones alimentados con dietas altas en grasas hacia ratones con dietas
convencionales, resultando en una alteración
del comportamiento basal de estos últimos ratones (Berding
y col., 2021).
Otro efecto observado,
es el comportamiento y relación de la microbiota
durante el estrés calórico, que es uno de los principales problemas que puede
aquejar a las aves comerciales. Se ha
identificado que el tracto digestivo responde a este tipo de estrés con
cambios en el intestino, tanto en estructura, función
y la composición de su microbiota, donde la prevalencia y proliferación de
organismos patógenos, como Salmonella spp, se incrementa, es decir, por efecto del estrés calórico
se induce una reducción en su apetito e
ingesta de alimento, lo que puede modificar la
microbiota (Cao y col., 2021). Se ha
reportado un incremento de Firmicutes con una
disminución de Proteobacteria, siendo familias como Turicibacteriaceae,
Ruminococcaceae y Enterobacteriaceae,
los microorganismos que proliferan en estas condiciones; en el caso específico
de gallinas de postura, se reporta un incremento en Escherichia
spp, Shigella spp y Clostridium spp (Cao y col., 2021).
El picaje
es otro de los problemas conductuales que más se presenta en las aves, el cual
se da cuando picotean el plumaje de otras, causando un daño que puede ser leve,
a incluso llegar a desencadenar el canibalismo.
Si bien, dicho comportamiento depende de
muchos factores, se ha encontrado evidencia que lo relaciona con la
composición de la microbiota, donde algunas líneas de gallinas están predispuestas a un alto picaje y tienen una
composición en la microbiota diferente a las líneas que manifiestan bajo picaje (Van-der-Eijk y col., 2019). Las primeras tienen una mayor presencia de
clostridios y menor en Lactobacillus spp,
comparado con las de un bajo picaje (Van-der-Eijk y col., 2019).
Los bajos niveles de Lactobacillus
spp en la microbiota pueden modular
algunos comportamientos. En ratones se observó que dietas adicionadas
con Lactobacillus rhamnosus redujeron
comportamientos sugerentes a ansiedad y
depresión (Bravo y col., 2011); por lo que el bajo contenido de estos
microorganismos en líneas genéticas de gallinas, que predisponen al picaje, pueden explicar la sobre expresión de dicho comportamiento no deseado (Van-der-Eijk y col., 2019). No
obstante, la relación entre el picaje y composición
microbiana intestinal ha sido cuestionada,
ya que no fue posible identificar
dicha relación en otro estudio con
gallinas ponedoras (Borda-Molina y col., 2021). Estos últimos resultados
resaltan la importancia de seguir investigando la relación de la microbiota y comportamientos, tanto deseados (baño de
tierra) como no deseados (picaje), para así
encontrar áreas a mejorar en la
avicultura (Borda-Molina y col., 2021).
Uno de los productos
inevitables del metabolismo de la microbiota es la
producción de gases, que es el resultado de la fermentación anaerobia que
realizan los microorganismos dentro del tracto digestivo y que son expulsados
al momento de las deyecciones. El hidrógeno
parecen ser producto de la microbiota asociada a Bacteroides
spp y Clostridium spp. Otro gas de emisión es el dióxido de carbono, el cual
está asociado a algunas especies de Clostridium spp que
producen adicionalmente nitrógeno (Rowland y col., 2018).
Se
ha señalado, que los Bacteroides spp y Propionibacterium spp son especies predominantes que actúan sobre proteínas,
reduciéndolas a péptidos más pequeños o aminoácidos, por sus capacidades de
hidrólisis proteica (Qamar y col., 2020). Algunas
bacterias tienen la capacidad de sintetizar vitaminas, principalmente vitamina
K y algunas vitaminas del complejo B como biotina (B7), cobalamina (B12), ácido
nicotínico (B2), ácido pantoténico (B5), riboflavina
(B2) y tiamina (B1), las cuales no solo son importantes para los
animales, sino también para el metabolismo de la microbiota
(Qamar y col., 2020).
Los animales libres de
microbiota y una dieta sin vitamina K, presentan bajos niveles de protrombina y
desarrollan hemorragias, indicando la
importancia de ambos factores en los procesos de coagulación, por lo que es conveniente
fortificar la dieta con vitamina K. Algunos otros componentes de la microbiota rompen los disacáridos no digestibles,
oligosacáridos y polisacáridos, sintetizando ácidos grasos de cadena corta, que
son una fuente de energía y carbono para el
organismo y para otras comunidades bacterianas (Qamar
y col., 2020). Además, la microbiota tiene una
relación con la actividad de los ácidos biliares, ya que algunos
microorganismos son capaces de modificar la estructura y propiedades de los
ácidos biliares, lo cual confiere ventajas
en sus características antimicrobianas, principalmente en su efecto detergente sobre la membrana bacteriana, limitando la proliferación de algunas bacterias, sobre todo Bacteroides spp, Bifidobacterium
spp, Clostridium spp, Lactobacillus spp y Listeria spp (Rowland y col., 2018).
Otro de los campos que
recientemente se ha explorado es su relación y función ante el viroma, que son los virus que se encuentran presentes en
los animales, aunque el rol del viroma en la salud y la
enfermedad de un organismo no se ha comprendido del todo (Yuan y col., 2020). La forma en que ayuda la
microbiota a lidiar con las enfermedades virales, es mediante mecanismos de competición y regulación de mecanismos de inmunidad antiviral,
como son la producción de interferones y células antiinflamatorias que promueven
la respuesta inmune humoral (Abaidullah y col.,
2019). Por ejemplo, en influenza aviar,
la cepa viral H9N2 causa alteraciones
en la composición de la microbiota intestinal, incrementando los niveles de proteobacterias con
lo que se activa el mecanismo de competición que impide la colonización de
bacterias patógenas para los animales. Una microbiota estable evitará una infección secundaria. Mientras que
en la enfermedad de Newcastle, la microbiota cecal y duodenal presentan un
aumento en las familias Sinobacteraceae y Rhodoplanes. La microbiota
puede propiciar un estímulo hacia las células para la generación de interferón beta o alfa, así como algunas interleucinas
como la IL-22 e IL-17. En la enfermedad de Gumboro,
el efecto de la inmunosupresión que sufre el ave altera la
microbiota, provocando la colonización de Campylobacter jejuni y Salmonella spp (Yuan y col.,
2020). Abaiidullah y col (2019) y Yuan
y col. (2022) mencionaron una relación estadística positiva entre
microorganismos como Collinsella, Faecalibacterium, Oscillibacter,
Holdemanella, Pseudoflavonifractor,
Anaerotruncus, Butyricoccus, Bifidobacterium y la producción de interferones e
interleucinas.
Relación entre la microbiota aviar y la salud humana Campylobacter
jejuni, Salmonella enteritidis y Escherichia coli, bacterias que pueden estar
presentes en la microbiota de las aves, son
capaces de generar enfermedades en el humano, si las prácticas de manejo, matanza y de procesamiento no son las adecuadas, llegando al producto
final y a los consumidores (Oakley y col., 2014; Stanley y col., 2014; Marmion y col.,
2021; Saati-Santamaría y col., 2022). Otro
tema que puede afectar a los consumidores es el uso de antibióticos, por la
generación de resistencia a los mismos por parte de las bacterias. En la
industria avícola se ha utilizado a los antibióticos como promotores de
crecimiento, ya que tienen una acción sobre la microbiota,
donde bacterias potencialmente patógenas pueden generar una resistencia y volverse un problema de salud pública. Debido
a ello, varias disciplinas han propuesto alternativas para la reducción del uso
de antibióticos. Estas han sido aplicadas
eficazmente en el mundo comercial, los productos utilizados
incluyen probióticos, prebióticos y simbióticos, que buscan la
modulación de la microbiota para eficientizar la producción de alimento (Kogut, 2019; Wickramasuriya y col., 2022).
Modulación de la microbiota
Los probióticos y
prebióticos se han convertido en una de las principales opciones para reducir
el uso de antibióticos y hacer más eficiente la producción avícola. Son
usualmente utilizados posteclosión para propiciar una
rápida colonización de bacterias benéficas para
los animales, así mismo, se recomienda suministrarlos durante los cambios de dieta, de iniciación a
crecimiento y de crecimiento a finalización. De igual manera, se recomienda en
casos de disbiosis bacteriana, esto con el fin de buscar un mejor peso,
crecimiento y protección contra posibles
patógenos (Kogut, 2019; Qamar
y col., 2020).
Los
probióticos son definidos como microorganismos vivos que,
cuando son administrados en cantidades
adecuadas, confieren beneficios en la salud del organismo. Usualmente
actúan por exclusión competitiva contra
bacterias patógenas, mejoramiento de la respuesta inmune y de la función
de barrera, producción de bacteriocinas y mejoramiento de la homeostasis
intestinal. Los probióticos que han sido utilizados frecuentemente en la
industria avícola
son Lactobacillus spp, Bacillus spp, Bifidobacterium spp, Enterococcus
spp y Escherichia spp (Kogut, 2019; Qamar y col., 2020).
Los prebióticos son
definidos como componentes de alimentos que confieren un beneficio asociado a cierta microbiota. Deben ser resistentes a la hidrólisis y a la absorción, y tienen que ser
sustratos exclusivos para los microorganismos de interés. Fructooligosacáridos, inulina, manano
oligosacáridos y levaduras han sido utilizados en la industria avícola
para mejorar el crecimiento, la conversión alimenticia y la salud intestinal (Oakley y col., 2014; Kogut,
2019; Qamar y col., 2020).
Los simbióticos son la
combinación de probióticos y prebióticos, están diseñados no solo para
presentar comunidades microbianas benéficas,
sino para promover la proliferación de
esta microbiota y de otras dentro del tracto digestivo
(Kogut, 2019; Qamar y col.,
2020). La microbiota ha sido considerada como un
“órgano funcional” más de los organismos, ya que las actividades que realizan
por si mismas, y en las que participan, son de gran
importancia para la fisiología de los
animales (Kogut, 2019).
CONCLUSIONES
La caracterización de la microbiota gastrointestinal de las aves ha permitido
una mejor comprensión de la simbiosis entre los microorganismos y el organismo.
Entender con mayor profundidad dicha
relación permitirá usar estas
poblaciones de microorganismos como herramientas para mejorar el
rendimiento y las pautas de la producción
animal. Lo anterior incluye la elaboración de nuevos planes de alimentación, el tipo de manejo, el
manejo del entorno, e incluso el tratamiento o prevención de ciertas
enfermedades. La modificación de la microbiota, o de
las condiciones ambientales que favorezcan
una determinada microbiota traerá beneficios no solo productivos, sino
también en salud y bienestar animal. Las estrategias que se pueden implementar incluyen aditivos probióticos, prebióticos
y simbióticos dirigidos a acciones específicas,
con alto impacto en la salud animal, como el correcto funcionamiento de
varios sistemas, no solo el gastrointestinal;
el nervioso y el inmunológico también se verían beneficiados, además de
que podrían minimizarse la presentación de comportamientos no deseados, por lo
que su uso será cada vez más común en la avicultura.
DECLARACIÓN DE INTERESES
Los autores declararon
no tener conflicto de interés alguno.
REFERENCIAS
Abaidullah, M., Peng, S.,
Kamran, M., Yin, Z., and Song,
X. (2019). Current findings on gut microbiota mediated immune
modulation against viral disea-ses in chicken. Viruses. (11): 1-14.
Angel, R., Kim, S.
W., Li, W., and Jimenez-Moreno, E. (2013). Velocidad de paso y pH intestinal en
aves: Implicaciones para la digestión y el uso de enzimas. XXIX Curso de Especialización FEDNA. [En línea]. Disponible: https://www.produccion-animal.com.ar/produccion_aves/produccion_avicola/05-13CAP_VIIItrad.pdf. Fecha de consulta: 28 de enero de 2022.
Berding, K.,
Vlckova, K., Marx, W., Schellekens, H., Stanton, C., Clarke, G., …, and Cryan,
J. F. (2021). Diet and the microbiota-gut-brain axis: Sowing the seeds of good mental health. Advances
in Nutrition. (12): 1239-1285.
Berg, G., Rybakova,
D., Fischer, D., Cernava, T., Ver-gès, M. C. C., Charles, T., …, and Schloter, M.
(2020). Microbiome
definition revisited: old concepts and new challenges.
Microbiome. (8): 1-22.
Borda-Molina, D.,
Iffland, H., Schmid, M., Muller,R., Schad, S., Seifert, J., …, and
Camarinha-Silva, A. (2021).
Gut microbial composition and predicted functions are not associated with
feather pecking and antagonistic behavior in
laying hens. Life. (11): 1-13.
Bravo, J. A.,
Forsythe, P., Chew, M. V., and Cryan J. F. (2011). Ingestion of Lactobacillus
strain regulates emotional behavior and central GABA receptor expression in a mouse via the
vagus nerve. Biological sciences. (38): 16050-16055.
Cao, C., Chowdhury,
V. S., Cline, M. A., and Gilbert, E. R. (2021). The microbiota-gutbrain
axis during heat stress in chickens: A review. Frontiers in Physiology.
(12): 1-11.
Clavijo, V. and
Florez, J. (2018). The gastrointestinal microbiome and its association with the
control of pathogens in broiler chicken production: A review. Poultry
Science. (97): 1006-1021. Hammer, T., Sanders, J., and Fierer, N. (2019).
Not all animals need a microbiome. FEMS Microbiology Letters. (366):
1-11.
Kayal, A., Stanley,
D. Radovanovic, A., Horyanto, D., Bajagai, Y., and Hao-Van, T. (2022).
Controlled intestinal microbiota colonization in broilers under the industrial
production system. Animals. (12): 1-19.
Kraimi, N., Dawkins,
M., Gebhardt-Henrich, S. G., Velge, P., Rychlik, I., Volf, J., …, and
Leterrier, C. (2019). Influence of the microbiota-gut-brain axis on behavior and welfare in farm animals:
A review. Physiology and Behavior.
(210): 1-12.
Kogut, M. H. (2019).
The effect of microbiome modulation on the intestinal health of
poultry. Animal Feed Science
and Technology. (250): 32-40.
Lv, H., Huang, Y.,
Wang, T., Zhai, S., Hou Z., and Chen, S. (2021). Microbial composition in the
duodenum and ileum of yellow broilers with high and low
feed efficiency. Frontiers in Microbiology. (12).
Mancabelli, L., Ferrario,
C., Milani, C., Mangifesta,
M., Turroni, F., Duranti,
S., …, and Ventura, M. (2016). Insights into the biodiversity of the gut microbiota
of broiler chickens. Environmental Microbiology. (18): 4727-4738.
Marmion, M.,
Ferone, M. T., Whyte, P., and Scannell, A. G. M. (2021). The changing
microbiome of poultry meat; from farm to fridge. Food Microbiology.
(99): 1-16.
Oakley, B. B.,
Lillehoj, H. S., Kogut, M. H., Kim, W. K., Maurer, J. J., Pedroso, A., …, and
Cox, N. A. (2014). The chicken gastrointestinal microbiome. FEMS
Microbiology Letters. (360):
100-112.
Orso, C., Stefanello, T. B., Franceschi,
C. H., Mann, M. B., Varela, A. P. M., Catro, I. M. S., ..., and Ribeiro, A. M.
L. (2021). Changes in the ceca microbiota of broilers vaccinated for
coccidiosis or supplemented with
salinomycin. Poultry Science. (100): 1-9.
Page, M. J.,
McKenzie, J. E., Bossuyt, P. M., Boutron, I., Hoffmann, T. C., Mulrow, C. D.,
…, and Moher, D. (2021). The PRISMA 2020 statement: An updated guideline for reporting systematic
reviews. Interna-tional Journal of
Surgery. (88): 1-9.
Qamar, A., Waheed,
J., Hamza, A., Mohyuddin, S. G., Lu, Z., Namula, Z, …, and Chen, J. J. (2020).
The role of intestinal microbiota in chicken health, intestinal physiology and
immunity. Journal of Animal and
Plant Sciences. (31):
342-351.
Qi, M., Tan, B.,
Wang, J., Liao, S., Deng, Y., Ji, P., …, and Yin, Y. (2021). The
microbiota–gut–brain axis: A novel nutritional therapeutic target for growth
retardation. Critical Reviews in Food Science and Nutrition. (62): 4867-4892.
Queiroz, S. A. L., Ton, A. M. M.,
Pereira, T. M. C., Campagnaro, B. P., Martinelli, L.,
Picos, A., …, and Vasquez, E. C. (2022). The gut
microbiota-brain axis: A
new frontier on neuropsychiatric disorders. Frontiers in
Psychiatry. (13): 1-10.
Ravindran V. (2013). Feed enzymes: The
science, practice, and metabolic realities. Poultry Science Association.
(22): 628-636.
Rehman, H. U.,
Vahjen, W., Awad, W. A., and Zentek, J. (2007). Indigenous bacteria and bacterial metabolic products in the
gastrointestinal tract of broiler chickens. Archives
of Animal Nutrition. (61): 319-335.
Rowland, I., Gibson,
G., Heinken, A., Scott, K., Swann, J., Thiele, I., and Tuohy, K. (2018). Gut
microbiota functions: metabolism of nutrients and other food components. European
Journal of Nutrition. (57): 1-24.
Rychlik, I. (2020).
Composition and Function of Chicken Gut Microbiota. Animals. 10(1): 1-20.
Saati-Santamaría, Z., Revilla-Martín, I.,
García-Fraile, P., and Palacios-Riocerezo, C. (2022).
Evolution and
predicted functions of the microbiota of the medium-slow growing chicken during
the first 4 weeks of chick development. Annals of Applied Biology.
(181):9-21.
Seidlerova, Z.,
Kubasova, T., Faldynova, M., Crhanova, M., Karasova, D., Babak, V., and
Rychlik, I. (2020). Environmental impact on differential composition of gut microbiota in indoor
chickens in commercial production and outdoor, backyard chickens. Microorganisms. (8): 1-11.
Sekelja, M., Rud,
I., Knusten, S., Denstadli, V., Westereng, B., Naes, T., and Rudi, K. (2012).
Abrupt temporal fluctuations in the chicken fecal microbiota are explained by
its gastrointestinal origin. Applied Environmental Microbiology. (78):
2941-2948.
Shivajyothi, J. and
Krishna, S. (2020). Poultry gut microbiota - Composition and its role in health, immunity and production performance. Indian Journal
of Animal Health. (52): 164-180.
Stanley, D., Geier, M., Hughes, R.,
Denman, S., and Moore, R. (2013). Highly variable microbiota development in the
chicken gastrointestinal tract. Plos One. (8): 1-7.
Stanley, D., Hughes, R. J., and Moore,
R. J. (2014). Microbiota of the chicken
gastrointestinal tract: Influence on health, productivity and disease. Applied
Microbiology and Biotechnology. (98): 4301-4310.
Torok, V., Hughes,
R., Mikkelsen, L., Perez-Maldonado, R., Balding, K., McAlpine, R., …, and
Ophel-Keller, K (2011).
Identification and characterization of potential performance related gut
microbiota in broiler chickens across various
feeding trials. Applied and
Environmental Microbiology. (77):
5868-5878.
Trawińska, B.,
Chmielowiec-Korzeniowska, A., Nowakowicz-Dębek, B., Tymczyna, L., Bombik, T.,
Pyrz, M., and Tymczyna-Sobotka, M., (2016). Evaluation of microbial
contamination of feces and soil on a laying-hen farm depending on sampling site and season. Revista Brasileria de Zootecnia. (45):190-194.
Valladares-de-la-Cruz, J. C. (2019). Diferencias
Anatómicas, Histológicas y Fisiológicas entre Ma-míferos
y Aves - BM Editores. [En línea]. Disponible en: https://bmeditores.mx/entorno-pecuario/diferencias-anatomicas-histologicas-y-fisiologicas-entre-mamiferos-y-aves-2214/. Fecha de consulta: 12 de febrero de
2023.
Van-der-Eijk, J., de-Vries, H., Kjaer,
J. B., Naguib, M., Kemp, B., Smidt, H., ..., and Lammers, A. (2019).
Differences in gut microbiota composition of laying hen lines divergently selected on feather pecking. Poultry Science. (98): 7009-7021.
Van-der-Hoeven-Hangoor,
E., Van-der-Voosen, J., Shuren, F., Verstegen, M., de-Oliveira, J., Montijin,
R., and Hendriks, W. (2013). Ileal microbiota composition of broilers fed
various commercial diet compositions. Poultry Science. (92): 2713-2723.
Wickramasuriya, S. S., Park, I., Lee,
K., Lee, Y., Kim, W. H., Nam, H., Lillehoj, and H. S. (2022). Role of
physiology, immunity, microbiota, and infectious diseases in the gut health of
poultry.Vaccines. (10): 1-30.
Yadav, S. and Jha, R. (2019). Strategies
to modulate the intestinal microbiota and their effects on nutrient utilization, performance, and health of
poul-try. Journal of Animal Science
and Biotechnology. (10): 1-11.
Yeoman, C. J., Chia,
N., Jeraldo, P., Sipos, M., Goldenfeld, N. D., and White, B. A. (2012). The
microbiome of the chicken gastrointestinal tract. In Animal health research
reviews/Conference of Research Workers in
Animal Diseases. (13): 89-99.
Yuan, L., Hensley, C., Mahsoub, H. M.,
Ramesh, A. K., and Zhou, P. (2020). Microbiota in viral infection and disease
in humans and farm animals. Progress in Molecular Biology
and Translational Science.
(171): 15-60.