https://doi.org/10.29059/cienciauat.v18i2.1797
Efecto de tres métodos de extracción en el
rendimiento,
actividad antioxidante, fenoles totales y
estabilidad de
extractos de hojas de Plectranthus
amboinicus
Effect of three
extraction methods on yield,
antioxidant activity,
total phenols, and stability of
extracts from Plectranthus amboinicus leaves
Extracción de antioxidantes asistida por ultrasonidos
Sheila Briget Malpica-Acosta1, Andrés
Antonio Acosta-Osorio2, José Javier Benedito-Fort3,
Rosa Isela Castillo-Zamudio1*
*Correspondencia:
rosychely@colpos.mx/Fecha de
recepción: 20 de marzo de 2023/Fecha de aceptación: 22 de enero de 2024/Fecha
de publicación: 30 de enero de 2024.
1Colegio de Postgraduados, Campus Veracruz, km 88.5
carretera Federal Xalapa-Veracruz, Veracruz, México, C. P. 91700. 2Tecnológico
Nacional de México, Instituto Tecnológico de Veracruz, Unidad de Investigación
y Desarrollo en Alimentos, Veracruz, México, C. P. 91870. 3Universidad
Politécnica de Valencia, Departamento de Tecnología de Alimentos, Valencia,
España, C. P. 46022.
RESUMEN
Los
métodos de extracción de fitoquímicos convencionales presentan
bajos rendimientos o lar-gos tiempos de proceso. El ultrasonido ofrece alternativas
para incrementar el rendimiento en extractos
vegetales. El objetivo de este trabajo fue evaluar el efecto de tres
métodos de extracción en rendimiento,
composición de compuestos fenólicos, actividad antioxidante y
estabilidad de extractos de hojas de Plectranthus
amboinicus (oreganón).
Los métodos de extracción usados fueron: convencional con agitación (EC), asistida
con baño de ultrasonidos (EABU) y asistida con sonda de ultrasonido (EASU). Se
usó una proporción 1:10 (p/v) orégano: etanol a 35 ± 2 °C. Los rendimientos se
calcularon como materia seca del extracto (%
ms). Se usó un modelo de pseudo-segundo orden
para ajustar las curvas de extracción experimentales de los tres métodos y
obtener los parámetros cinéticos. Se determinaron compuestos fenólicos totales (CFT)
y actividad antioxidante (AA) mediante los
métodos de Folin-Ciocalteau y DPPH, respectivamente.
Se evalúo la estabilidad del CFT y AA durante el almacenamiento. La EASU
aumentó 33.93 % el rendimiento en los
extractos con res-pecto a EC. La mayor concentración de CFT (P ≤ 0.05)
se obtuvo mediante EABU (10.32 mg EAG/ms) y
para AA mediante EC (19.43 mg ET/g ms). El modelo cinético de pseudo-segundo orden ajustó adecuadamente las cinéticas
experimentales. La constante de velocidad (k) de CFT más alta fue de 0.016 g
ms/mg EAG·min para
la EASU, siendo esta técnica la que demostró una disminución significativa de
AA con respecto al tiempo de extracción. Los CFT de los extractos obtenidos mediante EABU, EASU y EC (3.7 mg EAG/g
ms, 4.4 mg EAG/g ms y 7.2 mg EAG/g ms, respectivamente), al igual que la AA se
mantuvieron estables y sin cambios significativos (P ≥ 0.05) durante los 34 d
de almacenamiento, mostrando nuevamente la ventaja
de utilizar la técnica extractiva de ultrasonidos, en función del tiempo.
PALABRAS
CLAVE: Oreganón, extracción, actividad antioxidante, compuestos fenólicos, rendimiento.
ABSTRACT
Conventional phytochemicals extraction methods have shown low yields or very long processing times
for obtaining. The ultrasound offers alternatives to increase the yields of plant extracts. The objective of this work was to
evaluate the effect of three extraction
methods on the yield, phenolic compound composition, antioxidant activity and stability of Plectranthus
amboinicus (oregano) leaf extracts. The
extraction methods used were: conventional
heat-assisted extraction (CE), ultrasound water bath assisted (UBAE) and
ultrasound probe assisted extraction (UPAE). A 1:10 (w/v) oregano: ethanol ratio was used at 35 ± 2 °C.
Yields were calculated as extract dry matter
(% ms). A pseudo-second-order model was used to fit the experimental extraction
curves of the three methods and obtain the kinetic
parameters. Total phenolic compounds (TPC) and antioxidant activity (AA) were
determined by Folin-Ciocalteau and DPPH
methods, respectively. The stability of TPC
and AA was evaluated during storage. UPAE increased
33.93 % yield in extracts concerning CE. The highest concentration of CFT (P ≤ 0.05) was obtained by UBAE
(10.32 mg EAG/ms) and for AA by CE (19.43 mg
ET/g ms). The pseudo-second-order kinetic model adequately
fitted the experimental kinetics. The highest TPC rate constant (k) was 0.016 g ms/mg EAG·min, for UPAE, this technique being the one that
demonstrated a significant decrease in AA with respect to extraction time. The TPC of the extracts obtained by
UBAE, UPAE and CE (3.7 mg EAG/g dms, 4.4 mg
EAG/g dms and 7.2 mg EAG/g ms,
respectively), as well as the AA remained stable and without significant
changes (P ≥ 0.05) during the 34 d of
storage, again showing the advantage of using the ultrasound extractive technique,
as a function of time.
KEYWORDS: Oreganon, extraction, antioxidant activity, phenolic compounds, yield.

INTRODUCCIÓN
El oreganón
(Plectranthus amboinicus
(Lour.) Spreng.) es una
planta suculenta, aromática, perenne, que se encuentra en regiones tropicales y
subtropicales, con origen en Asia y África (Prasad y col., 2020). El oreganón
se ha usado de forma tradicional como aromatizante, condimento y
conservador natural de alimentos debido a su contenido nutricional, intenso olor y sabor (Silalahi,
2018). También se le han conferido propiedades antioxidantes, terapéuticas para el tratamiento de infecciones microbianas, antitusivas, nutritivas y antisépticas
(Kumar y col., 2020). En sus hojas se han
identificado diversos compuestos fenólicos, metabolitos secundarios
resultantes del metabolismo basal de las plantas (Gordo, 2018); los más importantes son los flavonoides:
salvigenina, quercetina, apigenina,
luteolina, eriodictiol y taxifolina (Menéndez y Pavón, 1999).
En
México, son escasas las investigaciones donde se determinen los compuestos
fenólicos y capacidad antioxidante de Plectranthus
amboinicus. En la mayoría se han determinado el contenido de vitaminas como tiamina, riboflavina y ácido ascórbico, así como los
terpenos cariofileno,
humuleno, camfor y limoneno.
Entre los trabajos más destacados se encuentra
el de Morton (1992), quien reportó especies de P. amboinicus
en la ciudad de México y analizó su contenido
fitoquímico; y, posteriormente, el de
Bañuelos-Hernández y col. (2020), quienes colectaron especies en México
e identificaron sus compuestos por espectrometría de masas.
Los antioxidantes son
sustancias químicas
que se caracterizan
por impedir o retrasar el deterioro oxidativo que afecta a las células (Vilaplana, 2007). Moléculas con propiedades
antioxidantes, presentes en extractos de algunas hojas como Murtilla, pueden
ubicarse en las membranas que rodean las células, perturbar su estructura, y afectar el flujo de
entrada al interior, entre ellos el paso de radicales libres (Avello y Suwalsky, 2006). La actividad
antioxidante (AA) es la capacidad de un
compuesto para reducir un radical, el cual acepta un electrón o átomo no
apareado de hidrógeno donado por el sustrato; en dicho mecanismo el
antioxidante presente en la célula anula la reactividad de la sustancia oxidativa y/o inhibe la generación de radicales libres
(Agusti y col., 2014; Galiano, 2019).
Koztowska y col.
(2021), evaluaron el contenido de compuestos fenólicos totales (CFT) de hojas
secas y frescas de oreganón, usando etanol como
solvente, y encontraron que ya deshidratadas cuentan con una mayor concentración
de compuestos fenólicos que frescas. Este
incremento de CFT durante el secado, considerando el aumento de
temperatura, es controversial; algunos
autores han encontrado disminución (Kulbat-Warycha y
col., 2022), sin embargo, otros como Koztowska y col. (2021) e Isah
(2019), indicaron que el aumento de los
CFT en las hojas deshidratadas puede ser atribuido a tres mecanismos: 1) repuesta al estrés debido al
incremento de la temperatura, donde la planta sintetiza estos metabolitos
secundarios; 2) ruptura de paredes vegetales y liberación de compuestos
bioactivos al medio extracelular; y 3)
inactivación de enzimas que degradan los fitoquímicos y por ende, durante largos procesos de almacenamiento, las hojas que reciben tratamiento incrementan
la concentración de CFT. Por otra parte, Patel y col. (2010) evaluaron
la AA de extractos acuosos y etanólicos de P. amboinicus, siendo este último el que mostró una mayor
concentración de compuestos con AA en comparación con el extracto acuoso.
Los compuestos
bioactivos de plantas pueden ser extraídos por distintos métodos, con-diciones y tratamientos del material vegetal, previo al
proceso de extracción, con la finalidad de incrementar su concentración. Bhave y Dasgupta (2018),
concluyeron que someter P. amboinicus a
temperaturas por encima de 60 ºC aumenta la composición de compuestos fenólicos
y directamente la AA, siempre que esta propiedad esté directamente relacionada con la presencia de dichos fenoles. Por lo tanto, usar el método de secado como un proceso
previo a la extracción de las hojas de P. amboinicus
puede favorecer la concentración de compuestos fenólicos y aumentar los rendimientos en el extracto (Pashazadeh
y col., 2021).
En la selección de un
solvente de extracción es importante considerar, la polaridad, selectividad,
seguridad, costo, reactividad, recuperación, viscosidad y temperatura de
ebullición del mismo (Abubakar
y Haque, 2020). El etanol es quizá el solvente polar
más utilizado, ya que puede extraer
metabolitos secundarios importantes a fines a su polaridad, es de baja toxicidad y se recupera fácilmente (Kulbat-Warycha
y col., 2022).
La extracción
convencional (EC), es un pro-ceso de separación de uno o más componentes en el
seno de una mezcla, por la acción de un
solvente. Se basa en fenómenos de transferencia de masa y está en
función de las diferencias de solubilidad de los solutos (López y col., 2005).
La EC consta de tres etapas: 1) la introducción del disolvente en el sólido
para solubilizar los solutos; 2) desplazamiento de la disolución obtenida a la
superficie del sólido; y 3) distribución de la disolución en el disolvente (Ramírez-Reyes y col., 2015).
Trabajos
de EC con P. amboinicus, usando distintos
solventes como agua, etanol o hexano,
reportan rendimientos variables, en función a las diferencias de polaridad. Matias y col. (2019), reportaron que el uso de metanol logra un mayor rendimiento que los solventes
acuosos, lo cual se puede deber a la capacidad del alcohol para romper la célula de la pared vegetal con mayor eficacia. Por
otro lado, Wibisono y col. (2019) realizaron extractos de oreganón
mediante EC, usando agitación y los solventes etanol, agua-hexano y
etanol-agua, siendo esta última combinación, con la que se obtuvo mayor rendimiento. Resultados como éste demuestran que
la implementación de agitación mecánica en la
EC, permite mejores rendimientos y calidad del extracto, en comparación con la técnica
convencional de percolación (Acosta-Martínez y col., 2021).
La extracción asistida
por ultrasonido (EAU) es un método amigable con el ambiente, por la disminución
de los residuos. Ofrece alta productividad, facilidad de uso y disminución en el consumo de energía (Singh-Sengar
y col., 2020). La aplicación de
ultrasonidos de potencia, en los procesos extractivos, intensifica la
velocidad de transferencia de masa, debido a que las burbujas de cavitación,
que implosionan sobre la superficie del sólido, generan rupturas de las células
vegetales, lo que facilita el desplazamiento del disolvente en el sólido y la disolución del soluto de interés;
finalmente, mediante el fenómeno de capilaridad emerge la disolución al medio
de extracción (Corona-Jiménez y col., 2016; Galiano, 2019; Bhagya
y Dash, 2020).
Muhamad y Mat
(2018), realizaron la extracción asistida
con baño de ultrasonidos (EABU) de hojas de P. amboinicus,
en etanol como solvente, con el cual obtuvieron mayor contenido fenólico y AA,
en contraste con los valores obtenidos usando agua y acetato de etilo.
Asimismo, Tungmunnithum y col. (2019) llevaron a cabo
la extracción del ácido rosmarínico, presente en P.
scutellarioides, y reportaron mayor concentración
usando etanol, en comparación a otros solventes evaluados.
El
objetivo de este trabajo fue evaluar el efecto de tres métodos de
extracción en el rendimiento, composición de compuestos fenólicos, actividad
antioxidante y estabilidad durante el almacenamiento de extractos de hojas de oreganón.
MATERIALES Y MÉTODOS
Preparación del
material vegetal
Las
hojas de oreganón (P. amboinicus)
fueron colectadas manualmente durante los meses de mayo y junio de 2022, en
huertos de traspatio, en municipios de Veracruz, México: Jamapa, Manlio Fabio Altamirano, Medellín, Paso de Ovejas
y Veracruz, con temperaturas máximas de 32
°C y mínimas de 25 °C (estación meteorológica del Colegio de Postgraduados,
Campus Veracruz). Las hojas maduras, las cuales presentan una mayor
concentración de metabolitos, fueron
seleccionadas de acuerdo a su largo (Sabra y col., 2018),
se lavaron con agua corriente y escurrieron un día antes de su procesamiento, a fin de garantizar la ausencia de
agua sobre la superficie de la hoja. Posteriormente, se secaron de acuerdo a la metodología propuesta por Pashazadeh y col. (2021), usando un secador de bandejas
(Marca Glint,
Mod-041, Veracruz, México) con control de temperatura del aire a 60 ± 2
°C. El tiempo de secado fue de 4 h para alcanzar una actividad de agua en las hojas aw
≤ 0.4, dicha variable se midió
mediante un higrómetro de rocío
(Marca Aqualab, Modelo CX-2, Decagon Devices Inc., Washington, Estados Unidos).
Las hojas deshidratadas fueron molidas en un molino de tejido vegetal Wiley
(Marca Thomas Scientific,
Modelo 3383-L70, New Jersey, Estados
Unidos) con una malla 20, a fin de
disminuir el tamaño de partícula y aumentar el área de contacto entre el
sólido y el solvente. El producto resultante se almacenó en bolsas Ziploc®,
envueltas en papel aluminio, con el propósito de protegerlas de la luz durante 3 d/4 ºC, previo al proceso de extracción.
Producción de
extractos
Se mezclaron 10 g de
hojas de P. amboinicus deshidratadas y molidas con 100 mL de etanol (proporción 1:10 p/v), en matraces de 125
mL con tapa, envueltos de papel aluminio, a 35 ± 2
°C. Se utilizaron tres métodos de extracción por triplicado: EC, EABU y EASU.
La EC se realizó de acuerdo a la metodología propuesta por Ramírez-Reyes y
col. (2015). Los matraces se colocaron con agitación usando un agitador orbital (Marca Thermo
Scientific, Modelo MaxQ
4450, Ohio, Estados Unidos) a 175 rpm,
durante 9 d y con 2 recambios de solvente
cada 3 d.
La EABU se llevó a
cabo en un baño sonicador (Marca Bransonic®,
Modelo CPXH 3800, Branson, Connecticut,
Estados Unidos) a 40 kHz por 60 min (Galiano, 2019). Se recambió el solvente
en su totalidad cada 10 min (6 recambios) a fin de realizar una extracción
exhaustiva.
La
extracción asistida con sonda de ultrasonido (EASU) se realizó en un sonicador digital (Marca Sonifier® Branson, Modelo 450 Cell Disruptor,
Connecticut, Estados Unidos) por 15 min, empleando una sonda de titanio de un diámetro de 12.7 mm y una amplitud de 50 %,
de acuerdo con la metodología propuesta por Corona-Jiménez y col. (2016). El
recambio de solvente se realizó cada 2.5 min (6 recambios).
En ambos métodos de
extracción asistidos con ultrasonidos, el
calor generado fue disipado sumergiendo los matraces en un baño de agua
con acumuladores rellenos de un refrigerante.
Rendimiento de
extracción
Se
determinó con base al porcentaje de sólidos extraídos (Benítez y
col., 2019) y se expresó como porcentaje, considerando g de extracto/g de oreganón seco (ms) de acuerdo a la
Ecuación 1:

Determinación de
compuestos fenólicos totales
El análisis CFT se
determinó por el método Folin-Ciocalteau descrito por
Palomino y col. (2009). Se mezclaron 1 680 µL de agua destilada, 100 µL de
reactivo Folin-Ciocalteau y una muestra de 20 µL de
extracto etanólico, usando un vórtex (Marca D-LAB,
Modelo MX-S, Beijing, China) y se dejó
reposar la mezcla por 5 min. Posteriormente, se añadió una solución de Na2CO3 al 20
% (p/p), se homogeneizó por 10 s y se incubó por 2 h a temperatura de 35 ± 2 ºC. Las mezclas se analizaron
en un espectrofotómetro UV-Vis (GenesysTM 10S, Thermo Scientific, Wisconsin, Estados Unidos) a 760 nm,
para obtener la absorbancia y calcular la
concentración de CFT a partir de la
curva de calibración, que se realizó usando diferentes diluciones de ácido
gálico, a fin de conocer el coeficiente de correlación,
pendiente e intercepto. Los análisis de los extractos se llevaron a cabo usando
diluciones (1.0 mg/mL, 0.80 mg/mL, 0.60 mg/mL, 0.40 mg/mL, 0.20 mg/mL, 0.1 mg/mL y 0.05 mg/mL) a
partir de una solución madre de ácido gálico (1 mg/mL).
Los resultados se expresaron en mg de
equivalente de ácido gálico (mg EAG) por
gramo de muestra seca (g ms).
Actividad antioxidante
El análisis de la AA
se determinó por el método de solución de radicales libres 1,1-difenil-2-picril-hidrazilo
(DPPH) descrita por Vasco y col. (2008). Se realizó
una solución metanólica madre de DPPH (25 mg/mL) y se diluyó hasta una absorbancia cercana a 0.800; 3.9 mL de esta dilución se mezclaron con 0.1 mL de extracto y se incubaron en la oscuridad por 90 min a
temperatura de 35 ± 2 ºC. Transcurrido el
tiempo, se leyeron las mezclas en un espectrofotómetro UV-Vis (Marca GenesysTM, Modelo 10S, Thermo
Scientific, Wisconsin, Estados Unidos) a 517 nm.
La curva de
calibración se realizó a partir de una solución madre de Trolox
(1 mg/mL) con etanol a diferentes concentraciones
(0.01 mg/mL, 0.025 mg/mL, 0.05 mg/mL, 0.1 mg/mL y 0.2
mg/mL). Los resultados se expresaron como mg de equivalente de Trolox
por gramo de muestra seca (mg ET/g ms).
Vida de almacenamiento
La vida útil de los
extractos, almacenados a 4 ºC, se midió en función de
la concentración de CFT (Método Folin-Ciocalteau) y la AA usando el método DPPH (descritos previamente). Se analizaron tres
muestras de cada tipo de extracto cada 4 d/36 d. Se almacenaron tres muestras, por cada tipo de método de extracción,
en matraces forrados con papel aluminio en una gaveta a 4 ºC
y protegidos de la luz. Los análisis de los
extractos se realizaron por triplicado.
Modelización de las
cinéticas de extracción
La velocidad del
proceso de extracción se analizó de acuerdo a la
concentración de los CFT y AA de los extractos, en función del tiempo de proceso. La tasa de velocidad (k) y la concentración
de saturación del soluto en el solvente (Cs) se obtuvo mediante el modelo cinético
propuesto por Bhagya y Dash
(2020), el cual se presenta en la Ecuación 2:

La ecuación anterior
puede transformarse en la Ecuación 3:
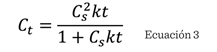
La cual se puede
simplificar en forma lineal en las Ecuaciones 4 y 5:

Análisis
estadístico
El análisis de los
datos se llevó a cabo mediante un análisis de varianza (ANOVA) completamente al
azar, usando el programa SAS® (Statistical Analysis System) versión 9.0,
para cada tipo de variable: rendimiento de extracción, CFT y AA de los extractos.
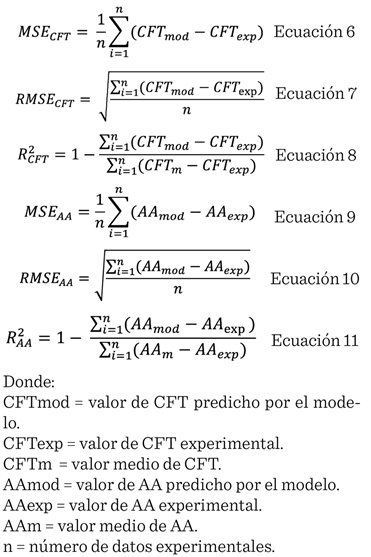
Los parámetros
estadísticos para evaluar la bondad del ajuste entre los datos experimentales y
los predichos por el modelo cinético, para cada curva experimental de CFT y AA,
fueron: cuadrado medio del error (MSE, por sus siglas en inglés: mean-square error), raíz cuadrada del cuadrado medio del error
(RMSE, por sus siglas en inglés: root-mean-square error) y
el coeficiente de determinación (R2), calculados de acuerdo a Bhagya y Dash, (2020) mediante
las ecuaciones 6, 7 y 8, respectiva-mente,
para CFT y las ecuaciones 9, 10 y 11 para obtener los parámetros estadísticos
del ajuste de la AA:
RESULTADOS Y DISCUSIÓN
Determinación del
rendimiento de extracción
El rendimiento más
alto fue el obtenido mediante EASU (20.58 %) (P ≤ 0.05), que representó un
39.33 % más que el de EC (Figura 1); y aunque la EABU obtuvo menor rendimiento (10.11 %), su tiempo de proceso fue 216 veces
menor que el de la EC (60 min vs 216 h) (Figura 2). Estos resultados
pueden ser explicados debido a los mecanismos involucrados en la aplicación de ultrasonidos de potencia. En ambos
métodos se generan ondas ultrasónicas que
viajan a través del medio conductor
(solvente) provocando el fenómeno
denominado cavitación, que genera
burbujas que se impactan y/o crean
presión sobre la superficie del sólido, produciendo erosión,
cizallamiento y fisuras finas en los tejidos
de la matriz vegetal, lo cual permite
que el solvente ingrese más fácilmente
al interior del producto y favorece la liberación
de sustancias intracelulares en el
solvente. Ambas acciones intensifican los fenómenos de trasferencia de masa que
se llevan a cabo durante el
proceso de extracción sólido-líquido, y con
ello, un mayor rendimiento en solutos (peso seco) en el solvente (Kulbat-Warycha y col., 2022). Por su parte, la sonda de
ultrasonidos permite la generación de una mayor
turbulencia del medio donde se difunden, por lo que minimiza la
resistencia al fenómeno de transferencia en la interfase (Azwanida,
2015; Nurafifah y col., 2018), facilitando el proceso
de extracción.
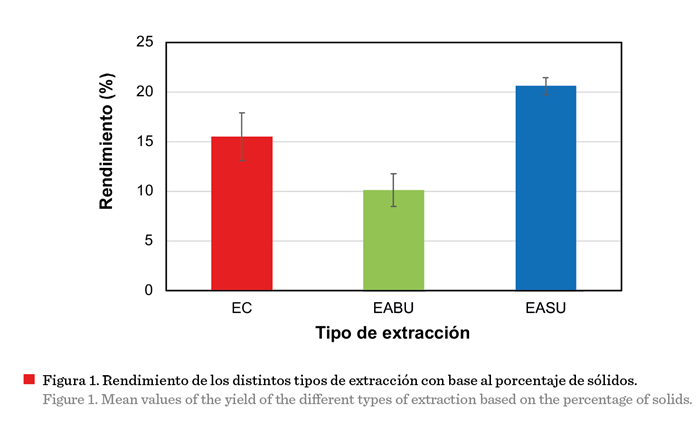
Se
han reportado valores similares a los de este estudio en
extractos etanólicos de hojas de P. amboinicus, mediante extracción por maceración.
Rivas-Pérez y col. (2017), documentaron valores en un intervalo entre el 15 % a
20 % mediante maceración pasiva, en una relación 1:10; y Koztowska
y col. (2021) alcanzaron un rendimiento de
21.97 %, usando extracción convencional con agitación. Por otra parte,
Patel y col. (2010), obtuvieron valores de
rendimiento del 18.10 % usando agua como solvente de extracción y, recientemente, Kulbat-Warycha
y col. (2022) realizaron la extracción asistida con ultrasonidos de Pectranthus barbatus en una combinación agua-etanol como
solvente y encontraron rendimientos de extracción en un intervalo de 24.41 % a
36.36 %, lo cual refleja que, el uso de un
solvente binario, agua-etanol, repercutió positivamente en el rendimiento de la extracción. Esto se debe a la concentración de compuestos polares y apolares presentes
en el material vegetal, que tendrán mayor afinidad con un solvente u otro, lo
que se verá reflejado en el resultado de
materia seca (Wibisono y col., 2019).
Determinación de
compuestos fenólicos y actividad antioxidante
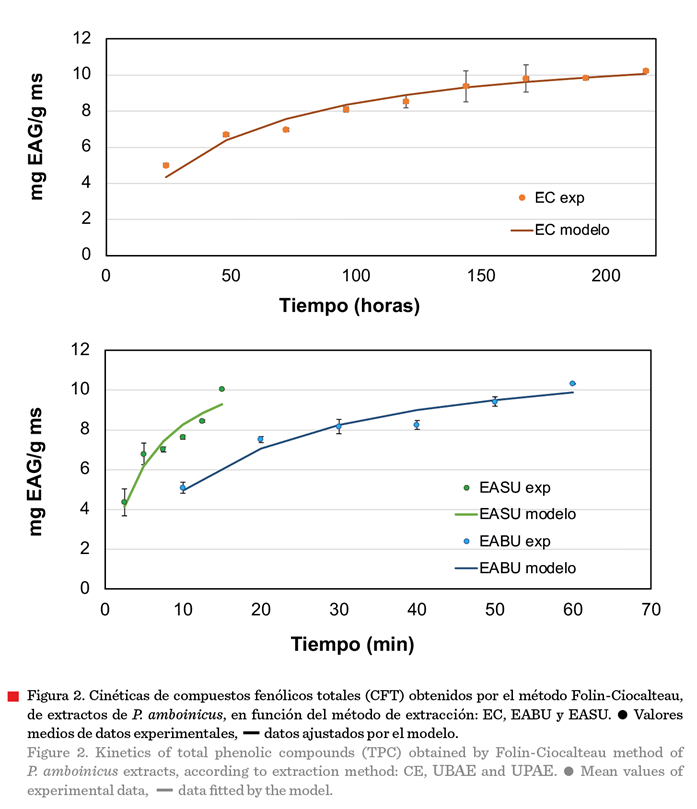
La
Figura 2 muestra que la concentración máxima de CFT alcanzada
por los tres métodos de extracción fue superior a 10 mg EAG/g ms alcanzando el valor máximo de la extracción con
EABU (10.32 mg EAG/g ms). Estas gráficas
presentan la suma acumulada a través de los diferentes recambios
utilizados. El método de extracción no afectó significativamente (P ≤ 0.05) la
cantidad máxima de fenoles extraídos, pero
redujo los tiempos de proceso mediante
ultrasonidos de potencia para alcanzar esta cifra. No obstante, se
incrementó la cantidad de solvente utilizado, de 300 mL en las muestras
tratadas por EC a 700 mL en los procesos con ultrasonido. Cabe mencionar que al
final del proceso los solventes fueron recuperados.
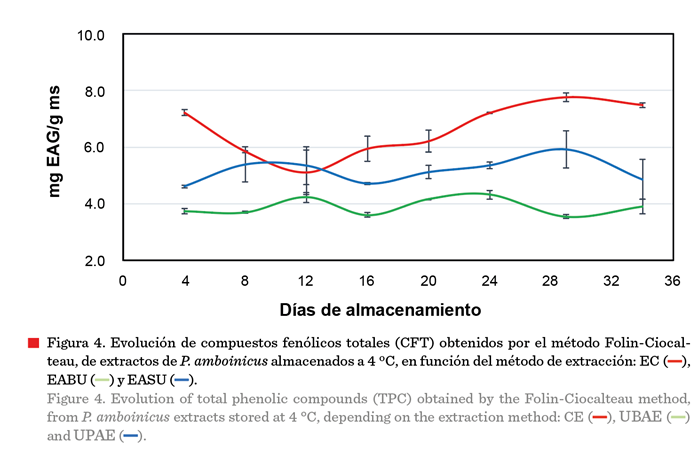
Respecto a la
presencia de CFT en extractos etanólicos de P. amboinicus, algunos autores han reportado concentraciones cercanas a las de este estudio: Patel y col. (2010) encontraron una
concentración máxima de 11.6 mg EAG/g ms, usando hojas de P. amboinicus en varios solventes (éter de petróleo,
cloroformo, etanol y agua) mediante una maceración fría; Koztowska
y col. (2021) obtuvieron un valor promedio de 14.677 mg EAG/g ms. En contraste,
El-hawary y col. (2012) reportaron un valor promedio de
8.4 mg EAG/g ms, el cual es más bajo que los resultados de esta investigación.
Otros autores documentaron concentraciones promedio de CFT más elevadas. Nguyen y col. (2020) obtuvieron 26.84 mg EAG/g ms, usando maceración con
etanol como solvente; en tanto que, Shubha
y Bhatt (2015) reportaron una concentración 11 veces más elevada (313 mg EAG/g ms), empleando
hojas de P. amboinicus, en agua, con una
relación 1:10, usando el proceso de extracción por hidrodestilación durante 1 h
a 90 °C. Recientemente, Koztowska
y col. (2021) documentaron una concentración promedio de 146.77 mg
EAG/g, empleando hojas de P. amboinicus en
etanol al 70 % como solvente, con una
relación 1:15 durante 10 h a 45 °C, mediante
decocción. Estas diferencias pueden estar atribuidas a los tipos y
condiciones de ex-tracción empleados por
cada autor. Como se ha reportado en
otros estudios (Patel y col., 2010; Wibisono y col., 2019), el agua ha mostrado una mayor afinidad con los
compuestos fenólicos presentes en P. amboinicus
y en particular, el vapor de agua, favorece transferencia de masa y de solutos (Moreno y
col., 2010). Otros factores que
afectan el contenido de CFT (aumentando o disminuyendo su concentración)
son las condiciones edafoclimáticas donde
crece P. amboinicus, como la calidad de suelo, disponibilidad de agua y condiciones de estrés a las que fue sometida la planta
y, finalmente, la capacidad de adaptación de
la especie y su componente genético (Kumar y col., 2019).
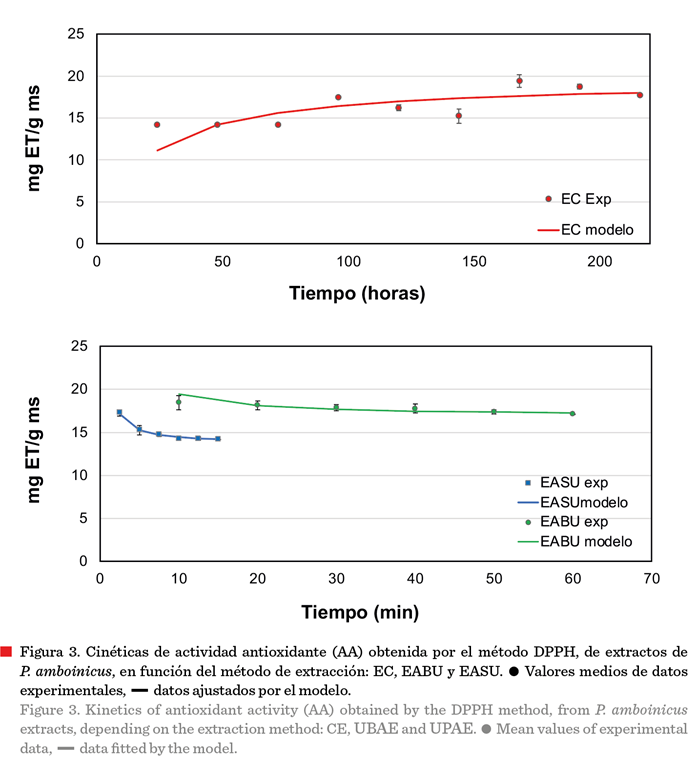
Respecto
a la AA de los extractos, el valor más alto (P ≤ 0.05) obtenido fue en la
EC, con una concentración de 19.43 ± 0.05 mg
ET/g ms (Figura 3), sin embargo, el tiempo
requerido para obtener esa cantidad de compuestos con AA fue de 168 h; por otra parte, usando ultrasonidos
de potencia se alcanzaron los valores máximos
de AA de 18.45 ± 0.42 mg ET/g ms y de
17.15 ± 0.23 mg ET/g ms, obtenidos por EABU
(10 min) y EASU (2.5 min), respectivamente.
Otros autores que han analizado la AA de
extractos de P. amboinicus han sido Rivas-Pérez y col. (2017), quienes reportaron valores de
AA entre 0.4 mg ET/g ms y 0.5 mg ET/g ms en extractos obtenidos mediante maceración pasiva; Samad y col. (2019) alcanzaron valores de 5.48 ± 0.77 mg
ET/g ms mediante el uso de extracción
asistida con ultrasonidos; y Koztowska y col. (2021) documentaron valores de 4.91 mg ET/g ms. Todos los valores de AA antes
citados son muy bajos, en comparación a los resultados encontrados en el
presente trabajo, lo que puede deberse a que
en esta investigación se llevó a cabo un proceso de extracción
exhaustiva con recambio del solvente, para
los tres métodos de extracción, lo que favorece el fenómeno de transferencia
de masa debido al incremento del gradiente de
concentración y la baja saturación del solvente. Por ello, la relevancia de dicha práctica durante el proceso de extracción. Por otra parte, Muhamad y Mat
(2019) reportaron valores de 19.55 mg ET/g ms, 27.41 mg ET/g ms y 48.08
mg ET/g ms para el proceso de extracción
mediante EABU a 30 °C, 60 °C y 120 °C, respectivamente, en los extractos
de hojas de P. amboinicus. Dicha diferencia demuestra que las
condiciones de proceso, particularmente la temperatura, puede favorecer la
extracción de algunos compuestos con AA. El
efecto positivo de la temperatura es debido a la mayor difusividad del solvente dentro de la matriz vegetal
principalmente por variaciones de diferentes
propiedades como viscosidad, tensión superficial y solubilidad del medio
(Bhagya y Dash, 2020). Un
dato interesante que se observó en
los procesos de extracción asistida con
ultrasonidos en la presente investigación fue la disminución de la AA con respecto al tiempo (Figura 3);
algunos autores como M´hiri y col. (2015), reportaron
una disminución de la AA del extracto de
cáscaras de naranja, atribuido a que el uso prolongado de ultrasonido
pudo inducir la formación de radicales libres en el medio líquido, que condujeran
a reacciones sonoquímicas, provocando oxidación y
degradación de los compuestos y a la
formación de especies reactivas de oxígeno y radicales libres, debido al
fenómeno de cavitación.
Análisis de
almacenamiento de los extractos de P. amboinicus
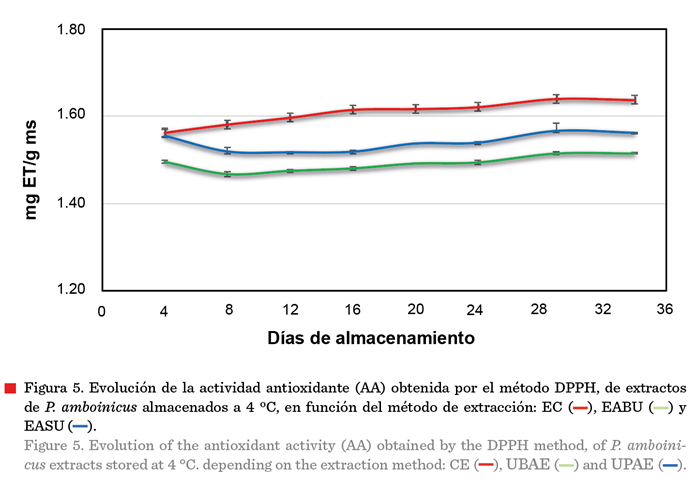
El análisis de la vida
útil de los extractos se estableció mediante la evaluación de la concentración
de CFT (Figura 4) y la evolución de la AA
(Figura 5) con respecto al tiempo de
almacenamiento a 4 ºC. Los valores de CFT de los extractos obtenidos mediante EABU, EASU y EC (con valores iniciales
de 3.7 mg EAG/g ms, 4.4 mg EAG/g ms y
7.2 mg EAG/g ms, respectivamente), se mantuvieron estables y sin cambios significativos (P ≥ 0.05) hasta el final
del almacenamiento durante 34 d. Los valores
de AA también se mantuvieron estables (P ≥ 0.05) en función del tiempo. La estabilidad
de los CFT se ha observado en extractos líquidos de Solanum
tuberosum, donde se mostró que los compuestos
bioactivos se mantienen estables en
condiciones de almacenamiento a 4 °C y en oscuridad (Ercoli
y col., 2021). La estabilidad dependerá en principio de las condiciones del
proceso, ya que el empleo de temperaturas
superiores a la ambiental, durante la
extracción, puede favorecer la inactivación enzimática, causantes de la degradación de metabolitos secundarios durante la fase de almacenamiento (Isah,
2019). Por otra parte, algunos autores
han revelado que el uso de ultrasonidos contribuye a mejorar la
estabilidad de almacenamiento de jugos, en función al contenido de metabolitos, con respecto a los tratamientos térmicos. Este comportamiento
es atribuido probablemente a la eliminación del oxígeno ocluido del medio líquido,
manteniendo la concentración de metabolitos y
algunas vitaminas contenidas en la fruta
naturalmente (Ruiz-de-Anda y col., 2019).
Análisis de los
parámetros cinéticos del pro-ceso de extracción
La velocidad de
extracción de cada método fue evaluada a través de la concentración de saturación
(Cs) y la constante de velocidad (k). La Tabla 1 muestra los resultados de cada
parámetro cinético, de acuerdo a los métodos extractivos evaluados y los parámetros estadísticos (RMSE y R2) obtenidos para evaluar
la bondad del ajuste del modelo cinético de pseudo-segundo
orden, de las curvas experimenta-les de CFT y AA. En su interpretación es importante considerar que, los procesos asistidos
con ultrasonido consideraron un mayor número de intercambios y volumen de solvente, adicional
al efecto del método sónico.
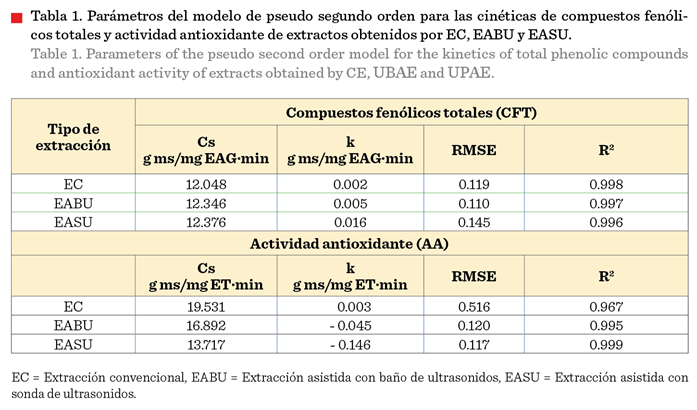
Los valores de Cs y k,
del CFT, en el extracto de P. amboinicus,
fueron mayores para la extracción asistida con sonda de ultrasonidos (Tabla 1).
La concentración de
saturación indica el momento en el cual el
solvente ha llegado a alcanzar su capacidad máxima de extracción. La Cs más alta se alcanzó con la EASU (12.37 mg EAG/g ms),
seguida de la EABU (12.34 mg EAG/g ms) y de la EC (12.04 mg EAG/g ms). En este mismo sentido, los valores de Cs, de
la curva de AA (Tabla 1), oscilaron entre
13.717 mg ET/g ms para la EASU y 19.531 mg ET/g ms para EC. Estos valores son
más altos comparados con los valores de Cs alcanzados
para extracción de fitoquímicos reportados
por Bhagya y col. (2020) que varían entre 9.35 mg
EAG/g ms a 9.62 mg EAG/g ms durante el proceso de extracción con cáscara
de pitahaya.
El efecto provocado
por el uso de ultrasonidos, en el incremento de la Cs, durante la extracción ha
sido ampliamente observado por otros autores. Pingret
y col. (2012), evaluaron la extracción de compuestos fenólicos de la pulpa de
manzana mediante ultrasonidos de potencia en un tanque piloto de extracción de 30 L, acoplado a una salida de ultrasonido cuádruple
de 25 kHz y 200 W, misma potencia de la sonda
de ultrasonidos usada en la presente investigación. Los resultados
mostraron un rendimiento de extracción
15 % más alto que el obtenido por EC, lo
cual fue atribuido a una mayor velocidad en los fenómenos de transporte debido
a la ruptura de la pared celular de
las células vegetales, con el consiguiente aumento de la penetración del disolvente.
La diferencia entre
las Cs en ambos métodos ultrasónicos empleados en esta investigación,
radica en que, el baño de ultrasonido funciona generalmente a una sola
frecuencia entre 20 kHz o 40 kHz y la difusión de las ondas ultrasónicas son
menos eficientes, porque se hace de forma
indirecta en el medio de difusión. Por otro lado, en los sistemas de extracción
por ultrasonido acoplado a una sonda, existe un contacto directo entre la muestra
y el medio de difusión (solvente), lo cual le permite desarrollar una potencia
de hasta 100 veces más que la proporcionada
por el baño de ultrasonido (Corona-Jiménez y col., 2016; Bhagya y Dash, 2020).
Bendicho y col.
(2012), lograron disminuir el tiempo de
extracción de polifenoles de 4 h con la EC a 60 min con la EASU. Esto se
debe al cambiar la fuerza impulsora en los
fenómenos de transferencia: del gradiente de concentración cuando se
pone en contacto el sólido con el líquido durante la EC, a la cavitación acústica provocada por el uso del ultrasonido. Durante
el proceso se llevan a cabo una serie de compresiones y rarefacciones en las
moléculas del solvente, provocando la formación de burbujas, como consecuencia
de los cambios de temperatura y de presión. Este tipo de “cavitación inestable”
o transitoria, puede producir el
cizallamiento de las burbujas que implosionan sobre la superficie de la
matriz vegetal y fuertes turbulencias en la zona de cavitación, por lo cual,
los parámetros cinéticos en la EASU son
significativamente mayores con
respecto a EC y EABU (Ruiz-de-Anda y col., 2019).
La constante de
velocidad (k) obtenida en las cinéticas de CFT de extractos de hojas de oreganón registró su valor más alto para la EASU (0.016 g
ms/mg EAG·min). La constante k obtenida en las
cinéticas de AA, fue positiva (k = 0.003) para la EC, mientras que para EABU y
la EASU se obtuvieron valores de k negativos
(- 0.045 g ms/mg y - 0.146 g ms/mg ET·min, respectivamente).
Los valores negativos de la constante de
velocidad indicaron que la concentración del metabolito disminuyó con el tiempo de exposición a los ultrasonidos. M´hiri y col. (2015) atribuyen este comportamiento a la relación de la cavitación con la formación
de radicales libres y radicales oxhidrilos,
es decir, la hidroxilación en las posiciones orto, meta y para de
algunos metabolitos, lo que conlleva a un
aumento en la concentración de CFT, pero una disminución en los valores de AA
(Ruiz-de-Anda y col., 2019). La obtención de
los parámetros cinéticos se considera
una herramienta útil al momento de extrapolar
las condiciones de proceso de extracción obtenidos en el laboratorio a
condiciones de procesamiento en una escala industrial,
permitiendo establecer el tiempo de procesamiento necesario para alcanzar el valor
de la Cs. Los resultados obtenidos sugieren
que la extracción de compuestos bioactivos mediante la aplicación de
ultrasonidos permitiría, en procesos industriales, la reducción del tiempo de procesamiento sin afectar el rendimiento
de CFT.
CONCLUSIONES
El uso de la sonda de
ultrasonidos incrementó el rendimiento de
compuestos extraíbles (materia seca), respecto a la extracción convencional,
sin modificar la concentración de compuestos
fenólicos y actividad antioxidante. El empleo de recambios de solvente
utilizado para evitar la sobresaturación de solutos y facilitar la extracción
de una mayor cantidad de compuestos redujo el tiempo de proceso. El modelo de pseudo-segundo orden empleado describió adecuadamente los datos experimentales, permitiendo
obtener los valores cinéticos de concentración de saturación y de constante de velocidad. Los extractos se mantuvieron estables durante 34 d de almacenamiento
a 4 ºC y protegidos de la luz.
AGRADECIMIENTOS
Se
agradece al CONACYT por el financiamiento
de la beca de Maestría en Ciencias para la estudiante de
posgrado (Sheila Briget Malpica Acosta). Además, a la
Unidad de Investigación y Desarrollo en Alimentos (UNIDA) del TECNM/Instituto
Tecnológico de Veracruz y al Colegio de Postgraduados Campus Veracruz, por todas las facilidades de infraestructura usadas
en el desarrollo experimental del proyecto.
DECLARACIÓN DE
INTERESES
Los autores declararon
no tener conflicto de interés alguno.
Referencias
Abubakar, A. R. and Haque,
M. (2020). Preparation of medicinal plants: basic extraction and fractionation procedures for
experimental purposes. Journal of Pharmacy & BioAllied Sciences. 12(1):
1-10.
Acosta-Martínez,
D. R., Morales-Zamora, M. y Villanueva-Ramos,
G. (2021). Obtención de extracto fluido de Plectranthus
amboinicus (orégano), utilizando el método de
agitación mecánica. Afinidad. 78(592): 41-47.
Agusti, B. A., Mansur, M. M., and Linde, A. M. (2014). Technical
evaluation of antioxidant activity. Medicinal Chemistry. 4(7): 517-522.
Avello,
M. y Suwalsky, M. (2006). Radicales libres,
antioxidantes naturales y mecanismos de protección. Atenea
(Concepción). (494): 161-172.
Azwanida, N. A. (2015). Review on the extraction methods use in medicinal
plants, principle, strength and limitation. Medicinal
and Aromatic Plants. 4(3): 1-6.
Bañuelos-Hernández, A. E., Azadniya, E.,
Ramírez, M. E., and Morlock, G. E. (2020). Bioprofiling of mexican Plectranthus
amboinicus (Lour.) essential
oil via planar chromatography-effect-directed analysis combined with direct
analysis in real time high-resolution mass
spectrometry. Journal of Liquid Chromatography & Related Technologies. 43(9-10): 344-350.
Bendicho, C., De-La-Calle, I., Pena, F., Costas, M., Cabaleiro, N., and Lavilla, I. (2012). Ultrasound-assisted pretreatment of solid samples in the context
of green analytical chemistry. Trends in Analytical Chemistry. 31:
50-60.
Benítez,
B., Sarria, R., Gallo, J., Pacheco, N., Sandoval, J. y Aristizabal,
C. (2019). Obtención y rendimiento del extracto etanólico
de dos plantas medicinales. Revista Facultad de Ciencias Básicas. 15(1): 31-40.
Bhagya, G. V. S. and Dash, K. K. (2020). Ultrasound-assisted extraction
of phytocompounds from dragon fruit peel: Optimization, kinetics
and thermodynamic studies. Ultrasonic
Sonochemistry. 68: 105180.
Bhave, A. and Dasgupta, S. (2018). Effect of
cooking on total phenol,
total flavonoids and DPPH free
radical scavenging potential of Plectranthus amboinicus. Journal of Medicinal
Plants Studies. 6(3): 82-84.
Corona-Jiménez,
E., Martínez-Navarrete, N., Ruiz-Espinosa, H. y Carranza-Concha, J. (2016).
Extracción asistida por ultrasonido de compuestos fenólicos de semillas de chía
(Salvia hispánica L.) y su actividad antioxidante. Agrociencia.
50(3): 403-412.
El-hawary, S. S., El-sofanya, R. H.,
Abdel-Monema, A. R., Ashoura, R. S., and Sleem, A. A. (2012). Polyphenolics
content and biological activity of Plectranthus amboinicus (Lour.) Spreng growing
in Egypt (Lamiaceae). Pharmacognosy Journal.
4(32): 45-54.
Ercoli, S., Cartes, J., Cornejo, P., Tereucán,
G., Winterhalter, P., Contreras, B., and
Ruiz, A. (2021). Stability of phenolic compounds, antioxidant activity
and colour parameters of a coloured
extract obtained from coloured-flesh potatoes. LWT - Food Science and Technology.
136: 110370.
Galiano,
D. (2019). Determinación de la capacidad antioxidante de Thymus vulgaris.
España: Universidad de Jaén. 49 Pp.
Gordo, D.
(2018). Los compuestos fenólicos: un acercamiento a su biosíntesis, síntesis y
actividad biológica. Revista de Investigación Agraria y Ambiental. 9(1):
81-104.
Isah, T. (2019). Stress and defense responses in plant secondary metabolites production. Biological
Research. 52(39).
Koztowska, M., Scibisz,
I., Przybyl, J. L., Ziarno,
M., Zbikowska, A., and Majewska,
E. (2021). Phenolic contents and antioxidant
activity of extracts of selected fresh and dried herbal materials. Polish
Journal of Food and Nutrition Sciences. 71(3): 269-278.
Kulbat-Warycha, K., Oracz, J., and Zyzelewicz,
D. (2022). Bioactive properties of extracts from Plectranthus
barbatus (Coleus forskohlii) roots received using various extraction methods. Molecules.
27(24): 8986.
Kumar, S., Azam M., Venkatesan K., Anjly P.,
and Kulloli R. (2019). Morphological and Biochemical
Variability in Aloe Germplasm in Hot Arid Region of India. Journal of Herbs, Spices & Medicinal Plants.
25(2): 158-171.
Kumar, P., Sangam, and Kumar, N. (2020). Plectranthus
amboinicus: A review on its pharmacological and pharmacognostical studies. American Journal of
Physiology, Biochemistry and Pharmacology. 10(2): 55-62.
López, S. M., Triana, J., Pérez, F. J. y Torres, M. E. (2005). Métodos
físicos de separación y purificación de sustancias orgánicas. España:
Universidad de las Palmas de Gran Canaria. 52 Pp.
Matias, D., Nicolai, M., Fernandes,
A. S., Saraiva, N., Almeida, J., Saraiva, L. and Rijo, P. (2019). Comparison study of different extracts of Plectranthus
madagascariensis, P. neochilus
and the rare P. porcatus (Lamiaceae):
chemical characterization, antioxidant, antimicrobial and cytotoxic activities.
Biomolecules. 9(5): 179.
Menéndez,
R. A. y Pavón, V. (1999). Plectranthus amboinicus (Lour.) Spreng. Revista Cubana de Plantas Medicinales. 4(3):
110-115.
M’hiri, N., Ioannou,
I., Boudhrioua, N. M., and Ghoul,
M. (2015). Effect of different operating conditions on the extraction of
phenolic compounds in orange peel. Food
and Bioproducts Processing. 96: 161-170.
Moreno, J., López, G. y Siche, R. (2010). Modelación
y optimización del proceso de extracción de aceite esencial de eucalipto (Eucalyptus globulus).
Scientia Agropecuaria. 1(2): 147-154.
Morton, J. F. (1992). Country horage (Coleus
amboinicus Lour) A
potent flavoring and medicinal plant. Journal
Herbs Spices Medicinal Plants. 1(1-2): 77-90.
Muhamad, S. and Mat, A. S. F. Z. (2018). Effect of heating at 95°C on
antioxidant activity and total phenolic
content in extracts of Plectranthus amboinicus leaves. International Journal of
Recent Scientific Research. 9(7): 28096-28099.
Muhamad, S. and Mat, A. S. F. Z. (2019). Boiling increase antioxidant
activity, total phenolic content and total flavonoid content in Plectranthus
amboinicus leaves.
GSC Biological and Pharmaceutical Sciences. 6(3): 024-030.
Nguyen, N. Q., Minh, L. V., Trieu, L. H., Bui, L. M., Lam, T. D., Hieu,
V. Q., …, and Trung, L. N. Y. (2020). Evaluation of total polyphenol content,
total flavonoid content, and antioxidant activity of Plectranthus
amboinicus leaves. Energy Security and Chemical Engineering Congress. Conf. Series: Materials
Science and Engineering. 736(6): 062017.
Nurafifah, F., Luqman, C. A., and Puteri, F. W. M. A. (2018). Drying of Plectranthus amboinicus
(Lour) spreng leaves by
using oven dryer. Engineering in Agriculture, Environment and Food.
11(4): 239-244.
Palomino, G. L. R., García, P. C. M., Gil, G. J. H., Rojano, B. A. y
Durango, R. D. L. (2009). Determinación del contenido de fenoles y evaluación de la actividad antioxidante de propóleos recolectados en
el departamento de Antioquía (Colombia). Universidad de Antioquía Medellín, Colombia. 16(3): 388-395.
Pashazadeh, H., Zannou, O., Galanakis, C. M., Al-dawoud, T. M. S., Ibrahim, S. A., and Koca, I. (2021).
Optimization of drying process for Rosa pimpinellifolia
L. (black rose hips) based on bioactive compounds
and modeling of drying process. International Journal of Food
Properties. 24(1): 1367-1386.
Patel, R. D., Mahobia, N. K., Singh, M. P.,
Singh, A., Sheikh, N. W., Alam, G., and Singh, S. K. (2010). Antioxidant
potential of leaves of Plectranthus amboinicus (Lour) Spreng. Der
Pharmacia Lettre. 2(4): 240-245.
Pingret, D., Fabiano-Tixier, A. S., Le-Bourvellec, C., Renard, C. M., and Chemat,
F. (2012). Lab and pilot-scale ultrasound-assisted water extraction of polyphenols
from apple pomace. Journal of Food Engineering. 111(1): 73-81.
Prasad, N., Basalingappa, K. M., Gopenath, T. S., Razvi, S. M., Murugesan, K., Ashock, G., and Divyashree, K. C. (2020). Nutritional
significance of indian borage (Plectranthus
amboinicus): A review. Plant Archives. 20(2):
3727-3730.
Ramírez-Reyes,
T., Luna-Rodríguez, M., Noa-Carrazana, J. C., Díaz-Fleischeer,
F., Sánchez-Velásquez, L. R., and Flores-Estévez, N. (2015). Influence of season and organ on antibacterial activity of Magnolia
dealbata Zucc. Against two phytopathogenic
bacteria. Chemistry and Ecology. 31(1): 47-52.
Rivas-Pérez, B. N., Leal-Granadillo, I. A.,
Loaiza-Cuauro, L. F., Morillo, Y. E., and Colina-Chirinos, J. C. (2017).
Phenolic compounds and antioxidant activity
in extracts of four oregano spices. Revista Técnica de la Facultad de Ingeniería
Universidad de Zulia. 40(3): 134-142.
Ruiz-de-Anda,
D., Ventura-Lara, M. G., Rodríguez-Hernández, G., and Ozuna, C. (2019). The impact of power ultrasound application on physicochemical,
antioxidant, and microbiological properties of fresh orange and celery juice
blend. Journal of Food Measurement and
Characterization. 13: 3140-3148.
Sabra, A. S., Astatkie, T., Alataway, A., Mahmoud, A. A., Gendy, A. S. H., Said-Al-Ahl,
H. A., and Tkachenko, K. G. (2018). Response of biomass development, essential
oil, and composition of Plectranthus amboinicus (Lour.) Spreng. to
irrigation frequency and harvest time. Chemistry & Biodiversity.
15(3): e1800005.
Samad, N. A., Abang-Zaidel, D. N., Salleh, E., Mohd-Yusof, A. H.,
Dailin, D. J., and Abang-Zaide, D. N. (2019). Optimization of Plectranthus amboinicus
(Lour.) Spreng extraction process using microwave-assisted
technique. Chemical Engineering Transactions. 72: 397-402.
Silalahi, M. (2018). Plectranthus
amboinicus (lour.) Spreng
sebagai bahan pangan dan obat serta bioaktivitasnya. Journal
Dinamika Pendidikan. 11(2): 123-138.
Singh-Sengar, A., Rawson, A., Muthiah, M., and
Kumar-Kalakandan, S. (2020). Comparison of different
ultrasound assisted extraction techniques for pectin
from tomato processing waste. Ultrasonic Sonochemistry.
61: 104812.
Shubha, J. R. and Bhatt, P. (2015). Plectranthus
amboinicus leaves stimulate growth of probiotic
L. plantarum: Evidence for ethnobotanical use in diarrhea. Journal of
Ethnopharmacology. 166: 220-227.
Tungmunnithum, D., Garros, L., Drouet, S., Renouard, S., Lainé, E.,
and Hano, C. (2019). Green ultrasound-assisted
extraction of trans rosmarinic acid from Plectranthus scutellarioides
(L.) R. Br. leaves. Plants. 8(3): 50.
Vasco, C., Ruales, J., and Kamal-Eldin, A. (2008). Total phenolic
compounds and antioxidant capacities of major fruits from Ecuador. Food Chemistry. 111:
816-823.
Vilaplana,
M. (2007). Antioxidantes presentes en los alimentos: vitaminas, minerales y
suplementos. Ámbito Farmacéutico Nutrición. 26(10): 79-86.
Wibisono, K., Aisyah,
S. I., Suhesti, S., and Nurcholis,
W. (2019). Optimization of total flavonoids extraction and A-glucosidase inhibitory activity
from Plectranthus amboinicus
(Lour.) Spreng. Leaves using the simplex-centroid design. Molekul. 14(2):
84-91.