https://doi.org/10.29059/cienciauat.v18i2.1801
Efecto de la fermentación en medio sólido
sobre el contenido de fenoles totales y la capacidad antioxidante del maíz
Effect of solid
medium fermentation on total phenol content and antioxidant capacity of maize
Fermentación
en medio sólido del maíz
Ulises Ramírez-Esparza, Emilio
Ochoa-Reyes, Ramiro Baeza-Jiménez, José Juan Buenrostro-Figueroa*
*Correspondencia: jose.buenrostro@ciad.mx/Fecha de recepción:
30 de abril de 2023/Fecha de aceptación: 6 de noviembre de 2023/Fecha de
publicación: 30 de enero de 2024.
Centro de Investigación en Alimentación y
Desarrollo, Grupo de Biotecnología y Bioingeniería, Avenida 4a sur número 3828,
fraccionamiento Vencedores del Desierto, Delicias, Chihuahua, México, C. P.
33089.
RESUMEN
El maíz contiene un gran número de compuestos antioxidantes,
muchos de ellos unidos a componentes de la pared celular, por lo que requieren tratamientos para liberarlos, como el
uso de enzimas o procesos de fermentación. La
fermentación en medio sólido (FMS) con Rhizopus
oryzae se ha aplicado para aumentar la capacidad antioxidante (CA) y el contenido fenólico en cereales y leguminosas. El objetivo
del presente trabajo fue evaluar el efecto de la FMS con R. oryzae sobre
la CA y el contenido de fenoles totales
(CFT) del maíz. La FMS se realizó en
bolsas ziplock (25 cm2) a 30 °C/72 h, con un inóculo de 1 x 106 esporas/g.
Se tomaron muestras cada 12 h, el extracto se recuperó con etanol al 80
% y se utilizó para determinar el CFT y la
CA (ensayo ABTS+, DPPH y FRAP). Los valores más altos se
obtuvieron a las 60 h de cultivo, con un CFT de 1.92 mg/gramos de materia seca
(gms) y una CA de 1.47 mg de equivalentes Trolox por gramo de
materia seca (mg ET/gms), 1.27 mg ET/gms y 5.8 mg Fe+2/gms
para los ensayos de ABTS+,
DPPH y FRAP, respectivamente. El uso de FMS permitió
aumentar hasta 0.83 y 1.25 veces el CFT y la CA del maíz, con respecto al
tiempo 0 h. El maíz fermentado con R. oryzae
mostró potencial para ser empleado como materia prima para el desarrollo de
alimentos funcionales, al incrementar su CA a través de un bioproceso.
PALABRAS
CLAVE:
bioproceso, Rhizopus oryzae,
antioxidantes, fermentación en medio sólido.
ABSTRACT
Maize contains a large number of antioxidant compounds. However, many of
them are not in free form, as they are bound to components of the cell wall of
maize kernels. For this reason, the use of treatments is required to release them,
such as the use of enzymes or fermentation processes. Fermentation in solid medium
(FMS) with Rhizopus oryzae has been applied to increase the antioxidant
capacity (AC) and phenolic content in cereals and legumes. The objective of the
present work was to evaluate the effect of FMS with R. oryzaeon AC and total
phenolic content (TPC) of maize.
Fermentation on solid medium was carried out in ziplock
bags (25 cm2) at 30 °C for 72 h, with
an inoculum of 1 x 106 spores/g. Sampleswere
taken every 12 h, the extract was recovered with 80 % ethanol, and used to
deter-mine TPC and AC (ABTS+, DPPH and FRAP essay). The highest
values were obtained at 60 h of culture, with a TPC of 1.92 mg/gram dry metter (gdm) and an AC of
1.47 mg TE/gmd, 1.27 mg TE/gdm
and 5.8 mg Fe+2/gdm for the ABTS+,
DPPH and FRAP assays, respectively. The use
of FMS allowed to increase up to 0.83
and 1.25 times the CFT and CA of corn, with respect to time zero. Corn
fermented with R. oryzae showed potential to be used as a raw material for the development of functional foods,
by increase its AC through a bioprocess.
KEYWORDS: bioprocess, Rhizopus
oryzae, antioxidants, solid-state fermentation.

INTRODUCCIÓN
El maíz ha sido la base de la alimentación desde los pueblos
prehispánicos (Cuevas-Mejía, 2014). Dentro de las 220 variedades de maíz que se han descrito en América Latina (Sierra-Macías
y col., 2014), se encuentran los maíces pigmentados, los cuales contienen una
alta cantidad de compuestos
antioxidantes (Bello-Pérez y col., 2016; Bei y col.,
2017), que contribuyen en la
prevención y tratamiento de enfermedades neurodegenerativas, cáncer y diabetes, entre otras (Gul y col., 2016).
Se han reportado diversos compuestos fenólicos en maíces, como cianidina-3-glucósido, pelargonidina-3-glucósido, ácido
2,4,6-trihidroxibenzoico, ácido p-cumárico o ácido p-hidroxicinámico,
ácido cafeico, apigenina-O-hexosido,
luteolina-O-rutinosido (Lao
y Giusti, 2017; Hernández y col., 2018). Sin embargo, muchos de estos compuestos
no están de forma libre, sino ligados a
componentes de la pared celular de las plantas (Streimikyte y col., 2022), por lo que se
requieren tratamientos que permitan
liberarlos, como el uso de enzimas o procesos de fermentación.
Durante la fermentación se presentan cambios en los niveles
de compuestos fenólicos, debido a la acción
de enzimas (celulasas, hemicelulasas, xylanasas,
pectinasas, proteasas,
entre otras) producidas
durante la fase de crecimiento de los microorganismos (Huynh y col., 2014).
Estas enzimas rompen los componentes químicos de la pared celular, resutando en una hidrólisis de los enlaces que unen a los compuestos fenólicos a la pared
celular (Alves-Magro y de-Castro, 2020),
logrando así liberar los compuestos
antioxidantes.
Dentro de los microorganismos más utilizados en la fermentación en medio sólido (FMS),
se encuentran los hongos filamentosos, de los cuales, el género Rhizopus es uno de los más
usados, pertenece a la clase Fitomicetos, orden Mucolares,
familia Mucoraceae (Ibarruri
y Hernández, 2018; Aoki y col., 2020). R. oligosporus, R. stolonifer y R. oryzae
son generalmente reconocidos como
seguros (GRAS, por sus siglas en inglés: Generally Recognized
As Safe), de acuerdo a
la Administración de Alimentos y
Medicamentos (FDA, por sus siglas en inglés: Food and Drug Administration), y pueden ser usados para consumo en humanos (Cantabrana y col., 2015). Entre las características por las
que este género de hongo es interesante para
la aplicación en alimentos, destacan el que crece a un rango amplio de temperatura
(7 °C a 45 °C), y que durante su crecimiento produce hidrolasas como amilasas, proteasas y
lipasas, que pueden ayudar a incrementar la
biodisponibilidad de nutrientes al realizar una hidrólisis en los componentes de
la pared celular del material vegetal (Ghosh y Ray, 2011; Cantabrana
y col., 2015).
Se ha reportado que la FMS de maíz ha sido utilizada para la
obtención de enzimas como la celulasa (Yoon y col.,
2014), compuestos bio-activos como la monacolina K (Zhang y col., 2018), la
cual reduce los niveles de colesterol LDL y ácido cítrico (Tong
y col., 2023). Sin embargo, existen muy pocos estudios sobre su empleo junto a R.
oryzae para la obtención de compuestos fenólicos
a partir del maíz o de su potencial como materia prima para el desarrollo de alimentos
funcionales.
El objetivo del presente estudio fue evaluar el efecto de la
FMS sobre la liberación de compuestos fenólicos con capacidad antioxidante a
partir de granos de maíz utilizando R. oryzae.
MATERIALES Y MÉTODOS
Reactivos
El agar papa dextrosa fue adquirido en BD-BIOXON®.
El ácido clorhídrico, ácido acético glacial, n-butanol, etanol y metanol
absolutos, fueron obtenidos en J. T. Baker®.
El DPPH (2,2-diphenyl-1-picrylhydrazyl), ABTS+ (2, 2’-Azino-bis-3-etil-benzo-tiazolina-6-acido sulfónico), persulfato de potasio (K2S2O8),
Trolox (6-hidroxi-2,5,7,8-tetrametilchroman-2-ácido carboxílico, 97 %), TPTZ (2,4,6-tripiridil-s-triazina), cloruro férrico, catequina, sulfato férrico de amonio, reactivo de Folin-Ciocalteu,
ácido gálico (AG), sulfato de hierro y
carbonato de sodio fueron adquiridos en Sigma Chemical Co.
Microorganismo
Se utilizó la cepa R. oryzae (Colección
Departamento de Investigación en
Alimentos-Universidad Autónoma de Coahuila, Saltillo, México). El microorganismo se conservó en una solución crioprotectora a - 20
°C (leche descremada: glicerol; 9:1). Las esporas se activaron en agar papa dextrosa
a 30 °C/7 d, posteriormente se colectaron con Tween-80 (0.01 %) y se realizó un
conteo en un hematocitómetro (Brand, Alemania).
Material vegetal
Los granos de maíz (Zea mays)
fueron adquiridos en un local comercial en Delicias, Chihuahua, México, en
marzo de 2022. Se llevaron al Laboratorio de Biotecnología y Bioingeniería del Centro de Investigación en Alimentación y Desarrollo
(CIAD), Delicias, donde se descartaron los
granos quebrados, y los seleccionados se desinfectaron mediante radiación
ultravioleta (UV) durante 30 min, y se almacenaron a temperatura ambiente (25 °C) en
contenedores herméticos hasta su uso.
Fermentación en medio sólido
Después de remojar los granos durante 24 h, se cocieron en
agua hasta reventar, se retiraron, se esterilizaron a 121 °C/15 min y se dejaron
enfriar a temperatura ambiente (25 °C). Para
la FMS, se colocaron 12 g de maíz en bolsas
de polipropileno (25 cm2) resellables, se inocularon con 1 x 106 esporas/g de
soporte en condiciones de asepsia y se incubaron a 30 °C/72 h. Los extractos fueron recuperados y extraídos cada
12 h. Para la extracción, se tomaron 4 g de muestra húmeda, y se mezclaron con
20 mL de etanol al 80 % (relación m/v 1:5) durante 5 min, y se filtraron a vacío. Los extractos
obtenidos se congelaron a - 20 °C hasta su análisis.
Contenido de fenoles totales hidrolizables
El contenido fenólico total hidrolizable
(CFTH) se determinó usando el
método de Folin-Ciocalteu, de acuerdo con lo
reportado por Wong-Paz y col. (2014). Se mezclaron 20 mL del extracto con 20 mL de reactivo de Folin-Ciocalteu.
Después de 5 min, se añadieron 20 mL de carbonato de sodio (0.01 M) y se dejó reposar la mezcla
durante 5 min. Finalmente, la solución se diluyó con 125 mL de agua destilada y se registró la absorbancia (790 nm) en un lector de microplaca (Thermo
Scientific, Multiskan
Go, Vantaa, Finlandia). Se
realizó una curva estándar de ácido gálico
(0 mg/L a 200 mg/L; 3.612 5x; R2 = 0.995), y se expresaron los
resultados como equivalentes de ácido gálico por gramo de materia seca (mg EAG/gms).
Contenido de fenoles totales condensados
Se determinó el contenido de fenoles totales condensados
(CFTC) de acuerdo con la técnica reportado
por Hernández y col. (2017) adaptada a microplaca. Se mezclaron en tubos
de tapa roscada 250 mL
de la muestra, 1.5 mL de HCl-n-Butanol (1:9 v/v) y 50 mL de reactivo férrico (1 mL HCl concentrado, 2 g de sulfato férrico
de amonio y aforado a 5 mL con agua destilada) y se calentaron los tubos en
baño de ebullición a 100 °C/40 min. Los tubos se enfriaron hasta llegar a
temperatura ambiente (25 °C), se tomaron 200 mL de cada tubo y se registró la absorbancia a 460 nm, utilizando
un lector de microplaca. Los resultados se
expresaron en equivalentes de catequina por gramo de materia seca (mg
EC/gms), empleando
una curva patrón de catequina (0 mg/L
a 1 000 mg/L; y = 0.279 4x; R2 =
0.993).
Contenido de fenoles totales
El CFT se obtuvo como la suma del CFTH
y el CFTC, y se expresó como mg/gms. Capacidad antioxidante
por el ensayo DPPH. Se basa en la aceptación de un electrón o átomo de hidrógeno por el radical 2,2-difenil-1-picril-hidracilo (DPPH), ocasionando su reducción
por acción de los antioxidantes presentes en la muestra. Se utilizó el ensayo
reportado por Molyneux (2004), adaptado a microplaca. Se mezclaron 7 mL del extracto con 193 mL de solución de DPPH (60 mM), se dejó reposar 30 min y se registró la absorbancia a 517
nm en un lector de microplacas. El resultado
se expresó como equivalentes de Trolox por gramo de materia seca (mg ET/gms) empleando una curva
estándar de Trolox (0 mg/L a 200 mg/L; y =
3.551 6x; R2 = 0.986 4). Capacidad antioxidante por ensayo ABTS+
Se basa en la cuantificación del decoloramiento del
radical ABTS+ [ácido 2,2’-acinobis(3-etilbenzotiazolina-6-sulfónico]
por efecto de su reducción debido a la acción de los antioxidantes presentes en la muestra. Se realizó con base en lo reportado por Torres-León y col. (2019), adaptado a microplaca. Se preparó
el radical ABTS+ mezclando 2.45 mL de ABTS+
7 mM y 12.5 mL de
persulfato de potasio (K2S2O8)
2.45 mM y se incubó la solución en oscuridad por 16 h. Posteriormente, se ajustó la absorbancia a 0.7 ± 0.2 a una longitud
de onda de 734 nm. Para el ensayo, se mezclaron 10 mL de muestra y 190 mL del radical ABTS+. Pasado 1 min de reacción, se
registró la absorbancia en un lector de microplaca.
El resultado se expresó como equivalentes de Trolox
por gramo de materia seca (mg ET/gms)
empleando una curva estándar de Trolox (0 mg/L a 200
mg/L; y = 3.551 5x; R2 =
0.985 7).
Capacidad antioxidante por ensayo FRAP
A diferencia del análisis por DPPH y ABTS+, que
evalúan la capacidad de la muestra para neutralizar radicales libres, el
análisis de la capacidad de reducción férrica del plasma (FRAP, por sus siglas
en inglés: ferricreducing ability of plasma) se basa en el principio de que los
antioxidantes son sustancias capaces de reducir el ion férrico al ion ferroso, es decir, evalúa la capacidad reductora mediante
un mecanismo de transferencia de electrones (Mercado-Mercado y col., 2013) y a su vez simula las condiciones de un sistema
biológico (Benzie y Strain, 1996).
Se determinó de acuerdo con Alvarez-Parrilla
y col. (2005), adaptado a microplaca. El
reactivo FRAP se preparó mezclando 50 mL de una
solución buffer de acetatos 0.3 M y pH 3.6,
5 mL de una
solución 2,4,6-tripiridil-s-triazina (TPTZ)
10 mM y 5 mL de una
solución de
cloruro férrico. La solución se mezcló y
se dejó reposar a 37 °C/30 min. Para el ensayo
se mezclaron 18 mL de agua, 6 mL del extracto y 180 mL de solución FRAP, se dejó reposar a 37 °C/1 h y se registró la absorbancia a 595 nm en un lector de microplaca. Los resultados
se expresaron como mg Fe+2/gms utilizando una curva estándar de sulfato de hierro (0 mg/L a 800 mg/L; y = 1.272 1x; R2 =
0.004).
Análisis estadístico
Se trabajó con un diseño completamente al azar para determinar el efecto del tiempo de fermentación
sobre el CFT y capacidad antioxidante (CA) del maíz; cada tratamiento se evaluó
por triplicado, y se reportó el promedio y su desviación estándar. Se realizó
un análisis de varianza (ANOVA) y una prueba de diferencia mínima significativa
(LSD, por sus siglas en inglés: Least significant difference) (P ≤ 0.05) para establecer las diferencias significativas
entre tratamientos, empleando el programa Statistica 7.0 (Stat Soft, Tulsa, Ok, EUA).
Para el análisis de la asociación entre el CFT y la CA se
empleó los coeficientes de correlación de Pearson.
RESULTADOS Y DISCUSIÓN
Fermentación en medio sólido
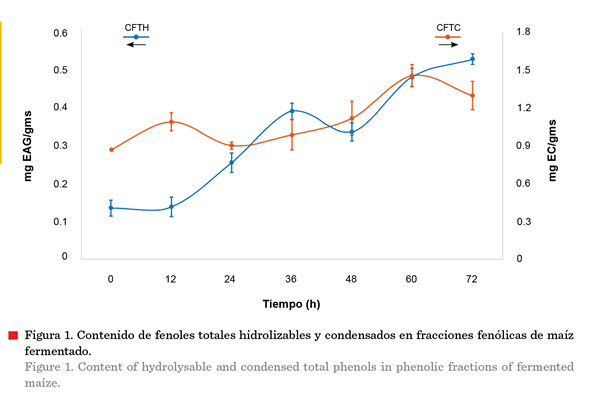
El CFTC, después de un incremento inicial durante
las primeras 12 h, mostró un decremento de 0.18 mg EC/gms en
comparación con el tiempo anterior
(Figura 1). Posteriormente volvió a aumentar
(aunque presentó otra breve fase de
disminución después de las 60 h) para alcanzar un incremento total a las 60 hde 0.58 mg EC/gms con
respecto al tiempo inicial (0 h). El CFTH, que
empezó a aumentar después de las 12 h, mostró un decremento en su contenido, posterior a las 36 h con
un incremento global de 0.39 mg EAG/gms respecto al tiempo inicial. Chen y col. (2021), reportaron un comportamiento similar en
un proceso de FMS con varios microorganismos y
maíz blanco, al aumentar el contenido de fenoles en el material fermentado de
hasta 1.25 veces. Así mismo, Buenrostro-Figueroa
y col. (2017), utilizando R. oryzae e
higo, lograron incrementar el contenido de fenoles hasta 4.93 veces. Estos aumentos se
deben a la acción de las enzimas celulasas,
xy lanasas, lipasas, proteasas y amilasas, producidas por el
microorganismo durante el proceso de fermentación
(López y col., 2010; Darman y col., 2011; Kaur y col., 2015; Behnam y col.,
2016).
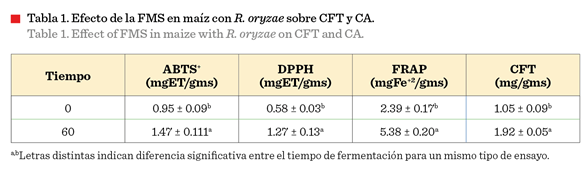
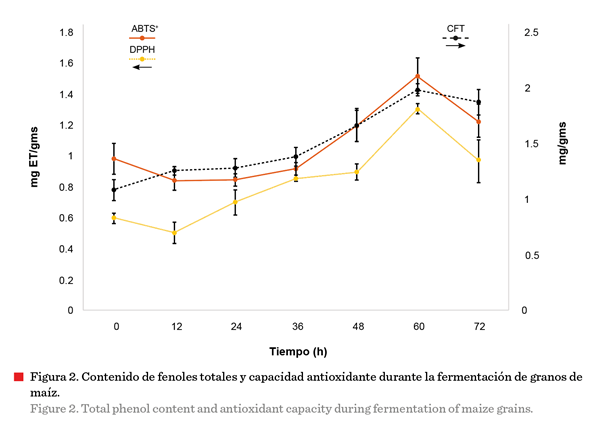
El valor más alto de CFT se obtuvo a las 60 h, con un
incremento de 0.83 veces con respecto al tiempo 0 h (Figura 2) (Tabla 1). Estos
resultados son 1.31 veces superiores a los reportados por Sánchez-Magaña y col.
(2019), al mismo tiempo de fermentación en
granos de maíz variedad Pioneer utilizando R. oligosporus. El tiempo de máxima CFT coincide con lo documentado por Buenrostro-Figueroa y col. (2017) para la FMS de cáscara de higo con R. oryzae, donde pasadas las 60 h disminuyó el CFT, lo
cual se puede atribuir a la degradación de
los compuestos por enzimas del mismo hongo (Starzyńska-Janiszewska
y col., 2021).
Capacidad antioxidante
El proceso de FMS de maíz empleando R. oryzae
presentó un efecto significativo sobre la CA
a las 60 h (Tabla 1) (Figura 2). El proceso de fermentación aumentó
considerablemente
la CA del maíz en el ensayo
ABTS+, 0.55 veces, comparado con el tiempo 0 h de proceso, mientras que
en las mismas condiciones, la FMS frente al
radical DPPH incrementó 1.19 veces y para el análisis FRAP aumentó 1.25
veces, con respecto al tiempo 0. Dichos incrementos
están relacionados con la liberación de compuestos fenólicos durante el proceso
de fermentación (Bei y col., 2017).
Diversos estudios han demostrado el efecto positivo de la FMS sobre el incremento en la CA.
Queiroz-Santos y col. (2018), reportaron un
aumento de 1.7 veces de la CA (DPPH) en granos de soya fermentados con Saccharomyces cerevisiae.
En orujo de uva sometido a FMS con R. oryzae, Leite y col. (2019), re-gistraron
un incremento de 2.7 veces la CA en relación al
material no fermentado. Wu y col. (2022)
desarrollaron un proceso de FMS utilizado avena como sustrato, empleando
como inóculo una mezcla de Lactobacillus plantatum
y R. Oryzae,
y reportaron incrementos en la CA del material fermentado después de 72 h, con
valores de 2.04, 2.10 y 2.72 veces superiores comparado al material sin fermentar. Esos resultados, si bien fueron más altos al del presente estudio,
mostraron una tendencia similar a aumentar la CA del producto fermentado.
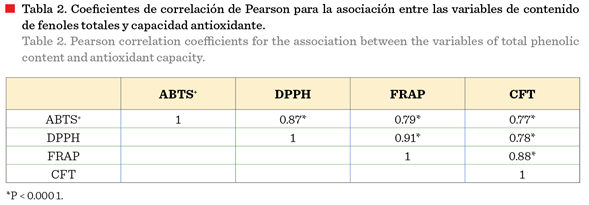
Finalmente, se observó una fuerte correlación entre
el CFT y la actividad antioxidante en los tres ensayos evaluados (DPPH, ABTS+
y FRAP) (Tabla 2), lo cual confirma que el aumento de la CA se debe al
aumento de los FT liberados durante el proceso de FMS con R. oryzae.
CONCLUSIONES
El proceso de fermentación en medio sólido con R. oryzae
mostró ser un método simple y eficaz para incrementar el contenido de
fenoles totales (CFT) y la capacidad antioxidante
(CA) del maíz, ya que mejoró el valor biológico del cereal, al
incrementar hasta 0.83 y 1.25 veces el CFT y CA del maíz, respectivamente, a
las 60 h de proceso. El grano bioprocesado muestra
potencial para ser empleado como
materia prima en el desarrollo de alimentos funcionales, debido a su propiedad antioxidante. Se requieren estudios adicionales que permitan
evidenciar el incremento en el valor funcional del maíz bioprocesado
con R. oryzae.
AGRADECIMIENTOS
Ulises Ramírez agradece al Consejo Nacio-nal de Humanidades, Ciencias y Tecnologías (CONAHCYT) por la beca
otorgada (CVU No. 1151315) y al Centro de Investigación en Alimentación
y Desarrollo (CIAD) por las facilidades otorgadas para el desarrollo del estudio.
DECLARACIÓN DE INTERESES
Los autores declararon no tener conflicto de interés alguno.
REFERENCIAS
Alvarez-Parrilla, E., Rosa, L. A. D. L.,
Torres-Rivas, F., Rodrigo-Garcia, J., and González-Aguilar, G. A.
(2005). Complexation of apple antioxidants: chlorogenic acid, quercetin and
rutin by b-Cyclodextrin (b-CD). Journal of Inclusion
Phenomena and Macrocyclic Chemistry. 53(1): 121-129.
Alves-Magro,
A. E. and de-Castro, R. J. S. (2020). Effects
of solid-state fermentation and extraction solvents on the antioxidant
properties of len-tils. Biocatalysis and Agricultural Biotechnology.
28: 101753.
Aoki, H., Chuma, S., Iba, Y., Tashiro, H., Watanabe,
N., and Oyama, H. (2020). Comparison of bioactive components in tempeh produced
by three different Rhizopus starters and immunomodulatory effect of tempeh on
atopic dermatitis mice. Food Science and Technology Research. 26(5):
665-672.
Behnam, S., Karimi, K., Khanahmadi, M., and Salimian,
Z. (2016). Optimization of xylanase pro-duction by Mucor indicus, Mucor
hiemalis, and Rhizopus oryzae through solid state fermentation. Biological
Journal of Microorganisms. 16: 1-10.
Bei, Q., Liu, Y., Wang, L., Chen, G., and Wu, Z.
(2017). Improving free, conjugated, and bound phenolic fractions in fermented oats
(Avena sativa L.) with Monascus anka and
their antioxidant activity. Journal of Functional Foods. 32: 185-194.
Bello-Pérez,
L. A., Camelo-Mendez, G. A., Agama-Acevedo, E. y Utrilla-Coello, R. G. (2016). Aspecto nutracéuticos de los maíces pigmentados: digestibilidad de los carbohidratos y antocianinas. Agro-ciencia. 50(8): 1041-1063.
Benzie, I. F. and Strain, J. J. (1996). The ferric
reducing ability of plasma (FRAP) as a measure of “antioxidant power”: the FRAP
assay. Anal
Biochem. 239(1): 70-76.
Buenrostro-Figueroa,
J. J., Velázquez, M., Flores-Ortega, O., Ascacio-Valdés,
J. A., Huerta-Ochoa, S., Aguilar, C. N., and
Prado-Barragán, L. A. (2017). Solid state fermentation of fig (Ficus carica L.)
by-products using fungi to obtain phenolic compounds with antioxidant activity
and qualitative evaluation of phenolics obtained. Process Biochemistry.
62: 16-23.
Cantabrana, I., Perise, R., and Hernández, I. (2015). Uses
of Rhizopus oryzae in the kitchen. International Journal of Gastronomy and Food
Science.
2(2): 103-111.
Chen, G., Chen, B., and Song, D. (2021).
Comicro-biological regulation of phenolic release through solid-state
fermentation of corn kernels (Zea mays L.) to improve their antioxidant
activity. LWT. 142:
111003.
Cuevas-Mejía, J. d. J.
(2014). Maíz: Alimento fundamental en las
tradiciones y costumbres mexicanas. Pasos Revista de Turismo y Patrimonio
Cultural. 12(2): 425-432.
Darman, R. D., Ngang, J., and Etoa, F. (2011). Cassava
solid-state fermentation with a starter culture of Lactobacillus plantarum and
Rhyzopus oryzae for cellulase production. African Journal of
Microbiology Research. 5(27):
4866-4872.
Ghosh, B. and Ray, R. R. (2011). Current commer-cial perspective of
Rhizopus oryzae: a review. Journal of Applied
Science. 11(14): 2470-2486.
Gul, K., Singh, A. K., and Jabeen, R. (2016). Nu-traceuticals and functional foods: The foods for
the
future world. Critical Reviews in Food Science and Nutrition. 56(16): 2617-2627.
Hernández,
C., Ascacio-Valdés, J., De-la-Garza,
H., Wong-Paz, J., Aguilar, C. N., Martínez-Ávila,
G.
C., ..., and Aguilera-Carbó, A. (2017). Polyphenolic content, in vitro
antioxidant activity and chemical composition of extract from Nephelium lappaceum L. (Mexican rambutan) husk. Asian Pacific
Journal of Tropical Medicine. 10(12):
1201-1205.
Hernández,
M., Ventura, J., Castro, C., Boone, V., Rojas, R., Ascacio-Valdés,
J., and Martínez-Ávila, G. (2018). UPLC-ESI-QTOF-MS2-Based
identification and antioxidant activity assessment of
phenolic compounds
from red corn cob (Zea mays L.). Molecules. 23(6): 1425.
Huynh, N. T., Van-Camp, J., Smagghe, G., and Raes, K. (2014).
Improved release and metabolism of flavonoids by steered fermentation
processes: A review. International Journal of Molecular Sciences. 15(11):
19369-19388.
Ibarruri,
J. and Hernández, I. (2018). Rhizopus oryzae as fermentation agent in food
derived sub-products. Waste and Biomass
Valorization. 9(11): 2107-2115.
Kaur, H., Arora, M., Bhatia, S., and Alam, M. (2015). Optimization of a-amylase and glucoamylase production
in solid state fermentation of deoiled rice bran (DRB) by Rhizopus oryzae. Int J Pure App
Biosc. 3: 249-256.
Lao,
F. and Giusti, M. M. (2017). The effect of pigment matrix, temperature
and amount of carrier on the yield and final color properties of spray dried purple corn (Zea mays L.) cob anthocyanin
powders. Food Chemistry. 227: 376-382.
Leite,
P., Silva, C., Salgado, J. M., and Belo, I. (2019). Simultaneous production of
lignocelluloly-
tic
enzymes and extraction of antioxidant compounds by solid-state fermentation of
agro-indus-
trial wastes. Industrial
Crops and Products. 137: 315-322.
López,
E., Deive, F. J., Longo, M. A., and Sanromán, M. A. (2010). Strategies for
utilization of food-processing wastes to produce lipases in solid-state cultures of Rhizopus oryzae. Bioprocess and Biosystems Engineering. 33(8): 929-935.
Mercado-Mercado, G.,
Rosa-Carrillo, L. d. l., Wall-Medrano, A., López-Díaz, J. A. y
Álvarez-Parrilla, E. (2013). Compuestos polifenólicos
y capacidad antioxidante de especias típicas consumidas en México. Nutrición
Hospitalaria. 28: 36-46.
Molyneux, P. (2004). The use of the
stable free radical diphenylpicrylhydrazyl (DPPH) for estima-ting antioxidant activity. Songklanakarin
Journal of Science an. Ttechnology. 26(2): 211-219.
Queiroz-Santos,
V., Nascimento, C., Schmidt, C., Mantovani, D., and Dekker, R. (2018). H., and
da-Cunha, M. A. A. (2018). Solid-state fermentation of soybean okara:
Isoflavones biotransformation, antioxidant activity and enhancement of
nutritional quality. LWT. 92: 509-515.
Sánchez-Magana, L. M., Reyes-Moreno, C., Milán-Carrillo, J., Mora-Rochin, S., Leon-Lopez, L., Gutierrez-Dorado,
R., and Cuevas-Rodríguez, E. O. (2019). Influence of solid-state
bioconversion by Rhizopus oligosporus on antioxidant activity and phenolic
compounds of maize (Zea Mays L.). Agrociencia. 53: 45-57.
Sierra-Macías, M.,
Andrés-Meza, P., Palafox-Caballero, A., Meneses-Márquez, I., Francisco-Nicolás,
N., Zambada-Martínez, A., ..., and Tadeo-Robledo, M. (2014). Variación
morfológica de maíces nativos (Zea mays L.) en
el estado de Veracruz, México. AGROProductividad.
7(1): 58-66.
Starzyńska-Janiszewska,
A., Stodolak, B., Micko-wska, B., and Socha,
R. (2021). Fermentation with edible Rhizopus strains as a beneficial
alternative method in wheat germ cake processing. Journal of Cereal Science.
102: 103309.
Streimikyte,
P., Viskelis, P., and Viskelis, J. (2022). Enzymes-assisted extraction of
plants for sustaina-ble and functional applications. International Journal
of Molecular Sciences. 23(4): 2359.
Tong,
Z., Tong, Y., Wang, D., and Shi, Y. C. (2023). Whole maize flour and isolated
maize starch for production of citric acid by Aspergillus niger:
A review. Starch–Stärke. 75(3-4): 2000014.
Torres-León, C.,
Ramírez-Guzmán, N., Ascacio-Valdés, J., Serna-Cock, L., dos-Santos-Correia, M. T., …, and Aguilar, C. N. (2019).
Solid-state fermentation with Aspergillus niger
to enhance the phenolic contents and antioxidative activity of Mexican mango
seed: A promising source of natural antioxidants. LWT.
112: 108236.
Wong-Paz, J. E.,
Muñiz-Márquez, D. B., Aguilar-Zárate, P., Rodríguez-Herrera, R., and Aguilar,
C. N. (2014). Microplate
quantification of total phenolic content from plant extracts obtained by
conventio-nal and ultrasound methods. Phytochemical
Analysis. 25(5): 439-444.
Wu,
H., Liu, H. N., Ma, A. M., Zhou, J. Z., and Xia, X. D. (2022). Synergetic
effects of Lactobacillus plantarum and Rhizopus oryzae on physicochemical,
nutritional and antioxidant properties of whole-grain oats (Avena sativa L.)
during solid-state fer-mentation. LWT. 154: 112687.
Yoon,
L. W., Ang, T. N., Ngoh, G. C., and Chua, A. S. M. (2014). Fungal solid-state
fermentation and various methods of enhancement in cellulase production. Biomass
and Bioenergy. 67: 319-338.
Zhang,
B. B., Xing, H. B., Jiang, B. J., Chen, L., Xu, G. R., Jiang, Y., and Zhang, D.
Y. (2018). Using millet as substrate for efficient production of monacolin K by
solid state fermentation of Monascus ruber. Journal of
Bioscience and Bioengineering. 125(3): 333-338.