https://doi.org/10.29059/cienciauat.v18i2.1803
Aloe
vera: capacidad antioxidante y uso potencial
como agente terapéutico en el tratamiento del Alzheimer mediante evaluación in
silico
Aloe
vera: antioxidant capacity and potential use as therapeutic agent in the
treatment of Alzheimer’s through in silico evaluation
Aloe vera potencial terapia del Alzheimer
Arturo Alberto Velázquez-López*, Vanessa García-Rojas,
Antonio Tornero-Martínez, Rosalva Mora-Escobedo
*Correspondencia:
arturo.velazquez2302@gmail.com/Fecha de recepción: 30 de abril de 2023/Fecha de
aceptación: 8 de enero de 2024/Fecha de publicación: 30 de enero de 2024.
Instituto Politécnico Nacional, Escuela Nacional de
Ciencias Biológicas, Departamento de Ingeniería Bioquímica, Av. Wilfrido
Massieu núm. 399, Nueva Industrial Vallejo, Gustavo A. Madero, Ciudad de
México, México, C. P. 07738.
RESUMEN
El
gel de Aloe vera es considerado una fuente natural de múltiples
beneficios, originados por la acción combinada de vitaminas, aminoácidos, compuestos
fenólicos, enzimas, minerales, ácidos
orgánicos, lípidos y carbohidratos, que se relacionan con la mejora de
enfermedades neuro-degenerativas como Alzheimer. Los ensayos in vitro e in
silico permiten confirmar e identificar
posibles beneficios de esta planta y sus compuestos en enfermedades. El objetivo del
presente trabajo fue evaluar la actividad
antioxidante del gel de A. vera y mediante análisis in silico, establecer el potencial terapéutico de sus
compuestos bioactivos en la enfermedad de Alzheimer. Se obtuvieron hojas de A.
vera, de las que se extrajo el gel, retirando el exocarpio, se liofilizó y
almacenó hasta su uso. Se caracterizó la capacidad antioxidante, se
cuantificaron los compuestos fenólicos y flavonoides y se analizó la relación que existe entre los
parámetros mediante correlación de Pearson. Mediante análisis in silico se evaluó el potencial de interacción de 8 compuestos del gel con la proteína
gamma secretasa. El gel de A. vera obtuvo alta capacidad antioxidante por ABTS, DPPH,
radical OH y poder reductor, usando bajas concentraciones para inhibir el 50 % de los radicales, y correlaciones positivas con fenoles
totales y flavonoides. En el estudio in silico
el compuesto que presentó mejor unión con gamma secretasa
fue aloe-emodina, con menor energía libre de
unión y menor concentración de constante de inhibición, sugiriendo su potencial uso como coadyuvante en el tratamiento
de la enfermedad de Alzheimer.
PALABRAS CLAVE: Aloe
vera, antioxidante, Alzheimer, bioinformática, aloe-emodina.
ABSTRACT
Aloe
vera gel is considered a natural source
of multiple benefits, originated by the combined action of vitamins, amino
acids, phenolic compounds, enzymes, minerals, organic acids, lipids
and carbohydrates, which are related to the
improvement of neuro-degenerative diseases such as Alzheimer’s. In vitro and in silico tests allow us
to confirm and identify possible benefits of this plant and its compounds in
diseases. The objective of the present study
was to evaluate the antioxidant activity of A. vera gel and, through
in silico analysis, to establish the therapeutic
potential of its bioactive compounds in Alzheimer’s disease. A. vera
leaves were obtained, from which the gel was extracted, removing the exocarp,
lyophilized and stored until use. The
antioxidant capacity was characterized, the phenolic compounds and
flavonoids were quantified, and the relationship
between the parameters was analyzed
using Pearson correlation. The interaction potential of 8 compounds in the gel with the gamma secretase protein was evaluated through in silico
analysis. The A. vera gel obtained high antioxidant capacity due to ABTS, DPPH,
OH radical and reducing power, using low concentrations to inhibit 50 % of the radicals, and positive
correlations with total phenols and
flavonoids. In the in silico study, the
compound that showed the best binding
with gamma secretase was aloe-emodin,
with lower binding free energy and lower inhibition constant concentration,
suggesting its potential use as an adjuvant in the treatment of Alzheimer’s disease.
KEYWORDS: Aloe vera, antioxidant, Alzheimer’s disease,
bioinformatics, aloe-emodin.

INTRODUCCIÓN
La enfermedad de Alzheimer
(EA), se caracteriza fisiopatológicamente por
el desarrollo de estrés oxidativo en
el cerebro, afectando las neuronas, dañando proteínas, ácidos nucleicos
y peroxidación lipídica de los ácidos grasos poliinsaturados
de membrana. El exceso de las especies reactivas de oxígeno (ERS)
provocan mutaciones en proteínas que inducen el desarrollo de la enfermedad, promoviendo la agregación de placas b-amiloides
e hiperfosforilación de la proteína Tau, causando apoptosis de las
neuronas. La gamma secretasa escinde proteínas en el dominio
transmembrana, sin embargo, mutaciones de
esta enzima causan hidrólisis de proteínas precursoras de amiloide, produciendo el péptido b-amiloide (39 a 42
aminoácidos) que adquiere una conformación b-plegada; la acumulación de dicho
péptido es el componente principal de las placas seniles, mientras que la
acumulación de la proteína Tau forma los ovillos neurofibrilares (Wolfe, 2019;
Han y col., 2021; Lonescu-Tucker y Cotman, 2021). Este trastorno es crónico y progresivo, y se identifica por el deterioro de habilidades
conductuales y cognitivas (Clementi y col., 2015).
Los compuestos
presentes en diferentes plantas presentan propiedades antiinflamatorias y antioxidantes
que podrían funcionar en la prevención del daño celular en trastornos neurodegenerativos.
Recientes estudios han demostrado que la familia
Asphodelaceae, principalmente la especie Aloe, posee actividad inmunoestimulante,
anticancerígena y neuroprotectora
(Li y col., 2021b; Mitra y col., 2022;
Pasala y col., 2022).
El
Aloe vera es una fuente natural de múltiples beneficios, por acción
de los compuestos con-tenidos en la planta (vitaminas, aminoácidos, compuestos fenólicos, enzimas, entre otros),
posee más de 70 compuestos bioactivos, que se relacionan con la mejora de la
salud al consumirse. Es una planta perenne, suculenta y arbustiva con hojas
características, las hojas son verdes triangulares, generalmente carnosas y con espinas en los bordes, que consisten
en una epidermis gruesa cubierta por una cutícula que rodea el gel (Maan y col., 2018). Generalmente, de esta especie se
utilizan dos elementos, el látex o acíbar y el gel. El látex es una sustancia
amarilla exudada por el pericarpio de la hoja, dicha sustancia presenta un olor
característico, mientras que el gel o parénquima se localiza en el interior de la hoja, rodeada por el pericarpio de la misma, y generalmente es transparente, viscoso e inodoro (Domínguez-Fernández y col.,
2012). Tradicionalmente, el látex se usa como laxante para tratar el estreñimiento, y el gel, por sus efectos
antiinflamatorios, se utiliza para tratar
problemas relacionados con la piel, además
participa en procesos de cicatrización. Actualmente el A. vera se
aplica en productos farmacéuticos,
cosméticos y elaboración de alimentos funcionales (Majumder
y col., 2019).
Los principales
fitoquímicos presentes en el A. vera son antraquinonas, naftalenonas, polisácaridos,
proteínas, enzimas y ácidos orgánicos, distribuidos en toda la planta, por
ejemplo, en el látex, predominan las antraquinonas y antronas, que representan
el 30 % de su peso seco y le proporcionan el color amarillo característico, mientras que el gel está constituido en su
mayoría por polisacáridos de glucosa-manosa, conocidos como mananos, de
los cuales algunos son parcialmente acetilados (acemanano), y
corresponden a los predominantes (Maan y col.,
2021).
Existen otros
compuestos bioactivos presentes en la
planta, como la lectina de aloe, aloesina, umbeliferona y esculetina, aloína, aloe-emodina, celulasa, catalasa y
superóxido dismutasa (Majumder
y col., 2019; Baldi y col., 2020). La aloína, es el glucósido de antrona con mayor
presencia en el látex, el cual se transforma en derivados hidroxilados;
las antraquinonas son similares a las antronas, pero presentan una cetona
adicional en el anillo central (Baldi y col., 2020). De estos compuestos, uno
de los que ha tomado gran interés en la investigación es la aloe-emodina,
derivada de las antraquinonas, ya que posee
numerosas actividades farmacológicas, por ejemplo, se ha reportado efecto antitumoral, antiangiogénesis,
antimetástasis, antiinflamatorio y antioxidante (Gao
y col., 2021).
Los compuestos
contenidos en el A. vera poseen propiedades benéficas cuando son
consumidos, por ejemplo, inhiben tumores cancerosos, tienen efecto inmunomodulatorio y disminuyen citocinas proinflamatorias y
daño histopatológico en el estómago (Fehrmann-Cartes
y col., 2019). La aloe-emodina y aloína inhiben células cancerosas a través de
la vía mitocondrial, poseen propiedades homeostáticas, antibacterianas,
antiinflamatorias, antioxidantes, y son neuroprotectores (Baruah y col.,
2016; Borges-Argáez y col., 2019). La aloe-emodina se ha utilizado en el
tratamiento de la enfermedad de Alzheimer, disminuyendo la concentración de malondialdehído, así
como la actividad de algunas proteínas catalíticas y transmembranales, y
aumentando la presencia de células neuronales
y producción de acetilcolina (Presenilina-1,
Presenilina-2 y gamma secretasa) (Mijatovic y col., 2005; Wang y
col., 2019).
También los compuestos
de A. vera presentan inhibición sobre el Factor de Necrosis Tumoral
(TNF-a), caspasa-3 y óxido nítrico sintasa, lo que sugiere un efecto protector
contra radicales libres que pueden inducir lesiones cerebrales (Farrugia y col., 2019; Pasala y col.,
2022). Gran parte de las acciones benéficas que poseen los compuestos se
deben al efecto sinérgico que presentan, ya que, difícilmente se pueden
encontrar las moléculas libres o puras, por ejemplo, los compuestos fenólicos
se unen a moléculas solubles como carbohidratos,
proteínas y algunos lípidos, mediante esterificación en el resto carboxílico.
Generalmente los fenoles insolubles se unen covalentemente a polímeros, como
polisacáridos y ligninas, a través de un enlace éster y se liberan mediante
hidrólisis ácida, alcalina o enzimática, sin
embargo, en conjunto suelen representar la mayor actividad benéfica (Kumar
y col., 2019).
La tecnología de
acoplamiento molecular es un método de investigación in silico
(modelados o simulaciones obtenidos en biología computacional), utilizado en el
descubrimiento y detección de compuestos con funciones farmacológicas. Estudios in silico
indican que compuestos antraquinónicos del A. vera poseen propiedades
de importancia en la salud como anticancerígena,
antiinflamatoria, cardioprotectora, antimicrobiana, inmunosupresora, hepatoprotectora y neuroprotectora (Majumder y col., 2019; Pasala y
col., 2022; Bendjedid y Benouchenne, 2023). Esta técnica
se basa en el principio “llave y cerradura”, y permite identificar los sitios
activos entre el ligando y receptor, obteniendo la conformación adecuada,
analizando la estructura de ligando y receptor mediante el uso de software
especializado (Li y col., 2021a).
El objetivo de este
trabajo fue evaluar la actividad antioxidante del gel de Aloe vera y
realizar un estudio in silico para evidenciar
el potencial efecto terapéutico de algunos
de sus compuestos en la enfermedad de
Alzheimer.
MATERIALES Y MÉTODOS
Materia prima
Se
adquirieron plantas de A. vera (3 años de edad) de mercados en la
Ciudad de México, México. Posteriormente, se cortaron las rosetas
para obtener las hojas, estas se lavaron con agua y jabón, y se
desinfectaron con solución clorada (10 ppm).
El gel se extrajo quitando el exocarpio (corteza) de las hojas y se
congeló a - 20 ºC para su posterior liofilización y almacenamiento hasta su
uso.
Preparación de las
muestras
Se
prepararon soluciones de 1 mg/mL a 10 mg/mL de gel
liofilizado disuelto en metanol (Baker®) al
80 %, pasados por baño ultrasónico (Cole parmer,
8892, EUA) durante 10 min, para la determinación
de la concentración mínima inhibitoria
(IC50, por sus siglas en inglés: Median Inhibitory Concentration),
y se almacenaron en frascos ámbar hasta su empleo (16 h).
Ensayo ABTS
La
actividad antioxidante por ABTS (ácido 3-etil benzotiazol-6-sulfónico) se determinó de acuerdo a Leite y col. (2021) con modificaciones. El radical ABTS se
obtuvo por reacción de 7 mmol/L de solución
ABTS con 2.25 mm/L de persulfato de sodio en oscuridad, almacenado a
temperatura ambiente durante 16 h antes de su uso. La solución obtenida se diluyó con agua destilada hasta una absorbancia de 0.700 nm a 0.754 nm. Se utilizaron 50
mL de muestra (1 mg/mL a 10 mg/mL solución de gel) y 250 mL de ABTS diluido; 6
min después se leyó a 754 nm en un lector de microplacas (Thermo
Fisher, Multiskan Go, España). Los
resultados se expresaron en porcentaje de inhibición (Ecuación 1).
Ensayo DPPH
La actividad
antioxidante por DPPH (2,2-difenil-1-picrilhidrazilo)
se determinó directamente en
microplaca. Se adicionaron 20 mL demuestra con 180 mL de solución metanólica de DPPH (150 mMol/L en metanol: agua en
proporción 80:20). Se mezclaron y se dejaron reposar bajo oscuridad durante 40
min. Posteriormente se leyó a una
absorbancia de 515 nm en un lector de microplacas (Thermo
Fisher, Multiskan Go, España). Los
resultados se expresaron en porcentaje de inhibición (Ecuación 1)
(Bobo-García y col., 2015).
Radical OH
Para el ensayo del
radical hidroxilo se utilizó el método
descrito por Li y col. (2008) con modificaciones. Se midieron 50 mL de la
muestra y se colocaron en una microplaca de 96 pozos, posteriormente se adicionaron 50 mL de 1, 10-fenantrolina
y FeSO4 3 mM. Para iniciar la reacción
se añadieron 50 mL de H2O2, la mezcla se agitó e incubó a
37 °C por 60 min. La absorbancia se leyó en un lector de microplacas a 536 nm. Los resultados se expresaron en
porcentaje de inhibición (Ecuación 1).
Poder reductor
Las muestras se
mezclaron con 2.5 mL de regulador de fosfato de sodio de 200 mmol/L (pH 6.6) y
2.5 mL de ferrocianuro de potasio al 1 %. La mezcla se incubó a 50 °C/20 min.
Después de añadir 2.5 mL de ácido tricloroacético al 10 % (p/v), la mezcla se
centrifugó a 650 rpm/10 min, el sobrenadante (5 mL) se mezcló con 5 mL de agua
desionizada y 1 mL de cloruro férrico al 0.1 %. El poder reductor se midió a
700 nm (Oyaizu, 1986); la obtención de mayor
absorbancia significa un mayor poder reductor. Los resultados se expresaron en porcentaje de inhibición (Ecuación 1).
Concentración mínima
inhibitoria
Se determinó la
concentración mínima inhibitoria (IC50) del gel de A. vera con
la ecuación de la recta a partir de los porcentajes de inhibición (ABTS y DPPH) y las actividades relativas (Radical OH y poder
reductor) y la concentración el gel de Aloe.
Estimación total de
polifenoles
Para la determinación
de los compuestos fenólicos de las muestras se añadieron 100 mL del reactivo de
Folin-Ciocalteu diluido (1:4) y 75 mL de solución
saturada (10 %) de carbono de sodio y agua. Después de 60 min, se midió la
absorbancia a 760 nm, previamente se realizó una curva de calibración con ácido
gálico (0 mg/mL a 0.1 mg/mL). La
concentración de compuestos fenólicos totales se expresó en mg equivalentes de ácido gálico
(EAG)/100 g de muestra (Cruzado y col.,
2013). Se utilizó la ecuación de la recta para calcular la concentración
de las muestras analizadas, los resultados se expresaron en mg EAG/g de muestra
liofilizada de gel.
Estimación total de
flavonoides
Para la determinación
de la concentración de flavonoides se añadieron 50 mL de las muestras a
analizar y se agregaron 5 mL de nitrato de sodio al 5 %. Después de 5 min se
adicionaron 150 mL de cloruro de aluminio al 10 % y se dejaron reaccionar por 6
min. Pasado el tiempo se adicionaron 500 mL
de hidróxido de sodio 1 mM y se añadió agua destilada hasta 5 mL. Los flavonoides se cuantificaron a una
longitud de onda de 510 nm contra un blanco.
Se utilizó quercetina para la curva estándar y se empleó la ecuación de la
recta para calcular la concentración de las muestras analizadas. Los resultados se expresaron como mg
equivalentes de quercetina (EQ)/g muestra liofilizada de gel (Nalimu y col., 2021).
Estudio in silico
Para desarrollar el
análisis bioinformático se utilizó el programa Rstudio
1.4.2.1, con múltiples paquetes (Geoquery, lima, dplyr, ggplot2, entre otros). Se trabajó con información de
la base de datos NCBI Gene Expression Omnibus: GSE138260 (análisis de expresión diferencial
de muestras de cerebro humano con en-fermedad de
Alzheimer frente a muestras de control
sanas) con el fin de realizar meta análisis de la expresión de genes en la enfermedad de
Alzheimer.
La expresión de los
genes se obtuvo aplicando al inicio una
normalización robusta con funciones “spline”, posteriormente se determinaron las
correlaciones de Pearson para cada muestra y se anotaron los genes
participantes en el Alzheimer por expresión diferencial.
Se
realizó el análisis jerárquico de los datos mediante la aplicación
de clúster y normalización de datos, finalizando con un análisis de
enriquecimiento de la anotación de genes definiendo grupos, ajustando el modelo
aplicado y contraste de interés, que es una técnica de validación de bases de datos biológicas (Priness y col., 2007).
Acoplamiento molecular
Las
estructuras cristalinas de la gamma secretasa (código PDB:
5A63) se obtuvieron del RSCB Protein Data Bank (PDB). Para
preparar las estructuras de la simulación del acoplamiento molecular se
emplearon los programas Avogadro 1.2.0, AutodockTools
1.5.7 y UCSF Chimera
1.15. Se analizó la solvatación, deprotonación de las proteínas
analizadas, y estabilidad de la unión (cambios de pH y cambios de energía)
mediante UCSF Chimera para la selección de los ligandos adecuados,
obtenidos estos de la literatura científica como presentes en A. vera y
registrados en la lista de compuestos del software.
Análisis estadístico
Los ensayos de la
caracterización química se realizaron por triplicado y se expresaron como
valores promedio y sus desviaciones estándar. En todas las muestras se utilizó
un nivel de significancia P ≤ 0.05. Los datos se analizaron con Rstudio versión 1.4.2.1.
RESULTADOS Y DISCUSIÓN
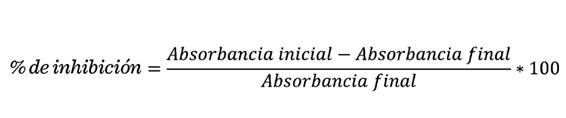
Actividad antioxidante
Al aumentar la
concentración de las soluciones del gel de A. vera aumentó la actividad
antioxidante determinada mediante los ensayos de ABTS, DPPH, Radical OH y poder
reductor (Figura 1), lo que explica el mayor porcentaje de inhibición de los
radicales estudiados. Dicha actividad se
asocia directamente con los compuestos bioactivos presentes en esta
especie vegetal, por ejemplo, flavonoides, terpenoides,
lectinas, ácidos grasos, antraquinonas, antronas, cromonas, taninos, esteroles,
polisacáridos de interés, entre otros. Sin embargo, los compuestos con mayor
capacidad antioxidante y antiradical son las antraquinonas, antronas y
cromonas, destacando la aloe-emodina, ácido
aloético, antranol, aloína A y B, feralolida y ácido cinámico (Hęś y col., 2019; Khan
y col., 2022).
El gel presentó
porcentajes máximos de inhibición similares
para los radicales ABTS y DPPH con
valores de 61.35 ± 1.05 y 66.48 ± 0.34, respectivamente (Figura 1A y 1B). La
máxima actividad relativa de radical
OH fue baja (57.14 ± 0.85) (Figura 1C)
comparado con su poder reductor,
alcanzando un valor de 118.61 ± 0.32 (Figura
1D). El poder reductor evalúa el efecto
combinado de los compuestos antioxidantes no enzimáticos que se
encuentran en la planta, indicando la
capacidad que tienen de resistir al daño oxidante de los radicales libres
(Benítez-Estrada y col., 2020).
Los valores de IC50
del gel A. vera, determinados mediante la ecuación de la recta,
representan la concentración del gel (mg/mL) necesaria para obtener el 50 % de
actividad inhibitoria y relativa (Figura 1).
La concentración IC50 para
ABTS fue de 16.553 mg/mL (Figura
1A) y DPPH de 14.832 mg/mL (Figura 1B),
en tanto que para radical OH y poder reductor
fueron de 18.926 mg/mL y 6.359 mg/mL, respectivamente (Figura 1C y 1D). Los
valores de IC50 para ABTS y DPPH en este estudio fueron similares, y semejantes con los de Benzidia y col. (2018), quienes realizaron fraccionamiento
por cromatografía en capa fina del gel de A. vera, obteniendo IC50
cercano a 12 mg/mL. Valores bajos de IC50 indican mayor actividad antioxidante de las soluciones analizadas (Hęś y col., 2019).
El
valor más alto de IC50 obtenido fue para el radical OH, mostrando
que es necesario mayor concentración del gel para inhibir los sustratos
oxidantes presentes (Tariq y col., 2019). El valor más bajo se obtuvo para inhibir el hierro activo, mediante la determinación del
poder reductor del gel.
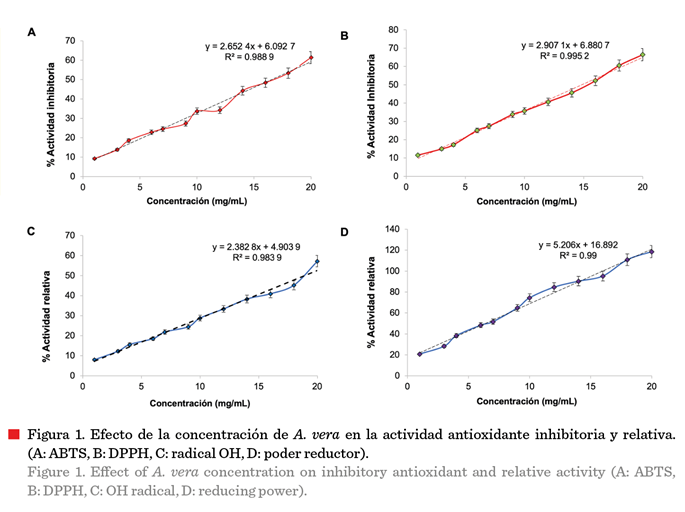
Análisis del contenido
de polifenoles y flavonoides
El
contenido de polifenoles disueltos incrementó
al aumentar la concentración, obteniéndose
un máximo de 7.07 ± 0.05 mg EAG/100 g de gel liofilizado
(Figura 2A).
El gel contiene 3
tipos principales de polifenoles, antraquinonas, antronas y cromonas. El
compuesto fenólico que destaca es aloe-emodina, cuyo consumo se relaciona con
un efecto antiinflamatorio por la disminución de la producción de citocinas proinflamatorias como el factor de
necrosis tumoral e interleuci-na-1 (Akhtar y col., 2020). Además, disminuye la
producción de óxido nítrico, IL-6 e IL-1b, la fosforilación de ERK (quinasa),
de proteína 38 y JNK (quinasa) (Dong y col., 2019). También, los polifenoles contenidos en el gel al consumirse son
liberados y metabolizados en el intestino grueso (colon) por la
microbiota, produciendo metabolitos con funciones neuromodulares y neurotransmisoras como glutamato, ácidos grasos de cadena
corta, aminas biogénicas, serotonina, dopamina, histamina, homocisteína, ácido
gamma aminobutírico y triptófano (Pluta y col., 2020).
Martin
y col. (2017) mencionaron que, una dieta suplementada con gel de A. vera
mejora el aprendizaje y memoria de personas
con Alzheimer, regulando el factor de crecimiento derivado del cerebro (BNDF,
por sus siglas en inglés: Brainderived neurotrophic
factor).
El contenido de
flavonoides (Figura 2B) presentó un comportamiento similar al del contenido de
polifenoles. Al aumentar la concentración
incrementó su contenido hasta 744.81 ± 0.31 mg EQ/100 g de gel
liofilizado.
El gel contiene
principalmente flavonoles, un tipo de flavonoide con actividad antioxidante,
que disminuyen los procesos inflamatorios por la inhibición de la producción de
óxido de nitrógeno (NO) (Gebashe y col., 2019). Añibarro-Ortega y col. (2019) reportaron diversas antronas
y antraquinonas, como aloína A, aloína B, ácido clorogénico, ácido p-cumárico, api-genina-6-glucósido,
apigenina-7-glucósido, emodina,
entre otros. Cabe destacar que el contenido
de compuestos antioxidantes varía dependiendo de la edad de la planta,
cuando se llevan a cabo los análisis correspondientes y factores ambientales donde se desarrolla la planta, nutrientes,
clima, zona geográfica, entre otros factores (Ozsoy y
col., 2009).
El
análisis de correlación de Pearson determinó
que los polifenoles y flavonoides obtuvieron asociaciones
positivas con los valores de inhibición de actividad antioxidante, pero las
correlaciones de los polifenoles fueron mayores
a las de los flavonoides (Tabla 1), lo que
sugiere mayor participación en la actividad antioxidante.

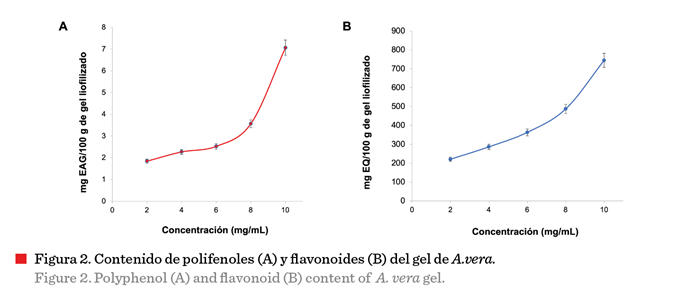
Análisis de expresión
de genes en la enfermedad de Alzheimer
En
la Figura 3 se observa la expresión de 39 genes que
participan en la enfermedad de Alzheimer. Se indican por grupo control
(personas sanas) y grupo problema (muestras de cerebros humanos con enfermedad
de Alzheimer) (Nitsche y col., 2021). Los genes de
las personas con Alzheimer presentan correlaciones positivas, mientras que en las personas
control obtienen correlaciones negativas. Los
dendogramas obtenidos con base en la expresión de los genes forman dos conjuntos. En la Figura 3 se
aprecian los grupos de cerebros de personas
con Alzheimer, uno con alta correlación positiva (lado izquierdo, con coloraciones amarillas a rojizas predominantes) y otro
con correlaciones cercanas a 0 (lado derecho).
El tercer grupo es el control (al centro y primeras dos columnas del lado derecho) que presentan
correlación negativa y se observan con coloraciones azules predominantes. La diferencia en el tipo y grado de correlación se
asocia con el hecho de que la enfermedad de Alzheimer se desarrolla de
diferente manera en las personas, los síntomas varían mucho, y la expresión de genes puede ser distinta
de persona a persona (Soria-Lopez y col., 2019).
Los genes C14orf135,
PAR4, SLC4A9, KLK8, CASP1, OR7C1, CD207 y PDE4A son los que presentaron mayor
correlación en el presente estudio (datos no
mostrados), en el grupo de personas con Alzheimer, relacionados con la
pérdida de memoria. Dentro de este grupo destaca el gen C14orf135 asociado con
la expresión de proteínas transmembranales,
de las cuales, una de las principales
es la gamma secretasa, cuya actividad modificada se relaciona con la
enfermedad (Wang y col., 2019).
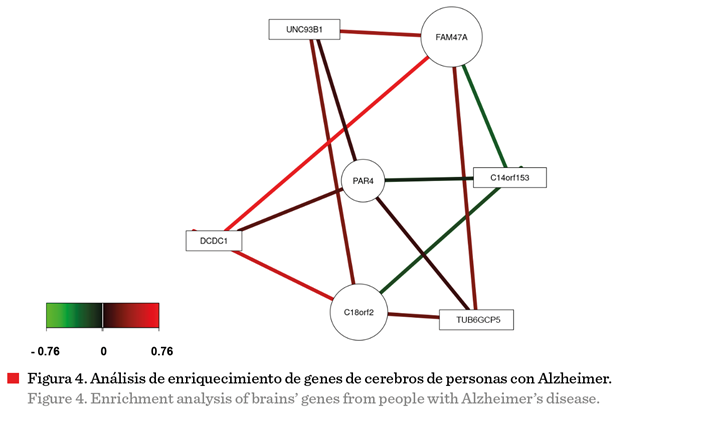
Análisis de
enriquecimiento
El análisis de
enriquecimiento de los genes que se expresan en la enfermedad de Alzheimer se
muestra en la Figura 4, en la cual se observa que existen genes que se
relacionan entre sí por compartir expresiones proteicas y rutas bioquímicas. FAM47A, una familia de genes que codifica proteínas durante la mitosis, se
asocia negativamente con C14orf153 (citocromo
c oxidasa), es decir, al expresar-se FAM47A disminuye C14orf153. Además,
se relaciona positivamente con UNC93B1 (asociado
con la respuesta inmune) y DCDC1 (regulación de polimerización de microtúbulos) (Ji y col., 2016). C18orf2 (gen promotor) se
relaciona positivamente con DCD1,
TUB6GCP5 y UNC93B1, y negativamenre con C14orf153. C18orf2 regula la expresión de proteínas asociadas
con la polimerización de microtúbulos (Vuoristo y col., 2001). El conjunto de genes PAR4,
DCDC1 y TUB6GCP5 se relacionan positivamente con la mitosis de las células y se encuentran sobre expresados en el hipocampo en
pacientes con Alzheimer (Guo y col., 1998).
Acoplamiento molecular
Para el acoplamiento
molecular se seleccionó la proteína transmembranal gamma secretasa, expresada
por los genes de la familia C14orf153, que en el presente estudio se
identificó como un gen de interés. Esta familia de genes participa en la síntesis del péptido beta-amiloide, cuyo incremento
se ha asociado con la presencia de placas
amiloides relacionadas con el desarrollo de Alzheimer (Schmidt y col.,
2022).
El
acoplamiento molecular se utiliza para predecir la actividad de ligandos hacia
una proteína o un objetivo de interés (Pinzi y Rastelli, 2019). De los 8 ligandos, seleccionados con mayor
estabilidad, presentes en el A. vera (Tabla 2), la aloe-emodina resultó
adecuada para el acoplamiento. Los demás ligandos no fueron resistentes a la
solvatación, cambios de pH, o cambios de energía que presentan estos compuestos
cuando pasan a través del sistema digestivo.
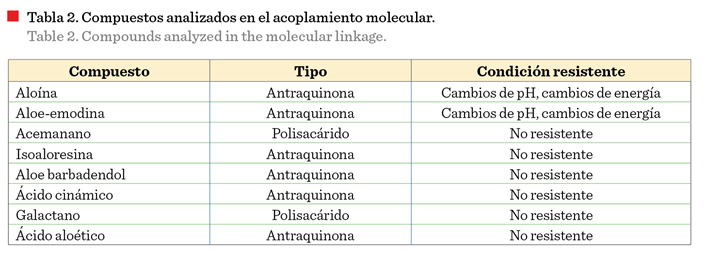
La aloína es una
antraquinona abundante en el A. vera, que presenta una unidad de glucosa
en su estructura, por ello las bacterias del intestino delgado hidrolizan el
enlace glucosídico, convirtiendo la aloína
en aloe-emodina (Yang y col., 2022).
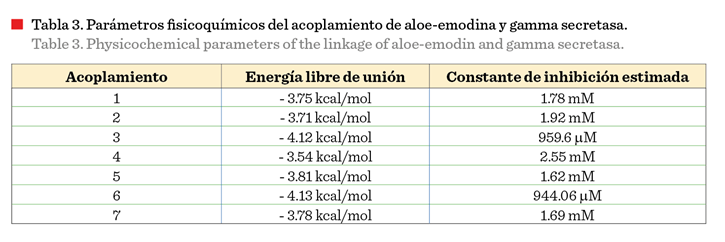
Durante el análisis in
silico se obtuvieron 7 acoplamientos estables
entre aloe-emodina y gamma secretasa, en los que, los aminoácidos histidina,
valina, alanina y prolina participaron
activamente en la unión, ya que se encuentran en mayor frecuencia en las
uniones analizadas. En la Tabla 3 se observa
que los acoplamientos 3 y 6 presentaron las menores energías
de acoplamiento (- 4.12 y - 4.13, respectivamente), y constantes de inhibición
bajas (< 1 mM). La energía libre de unión representa la afinidad
que poseen un compuesto con capacidad inhibitoria
con el sitio activo de unión presente en la proteína de interés, a menor
energía de unión mayor afinidad y mejor será el acoplamiento (Meneses y Cuesta, 2015).
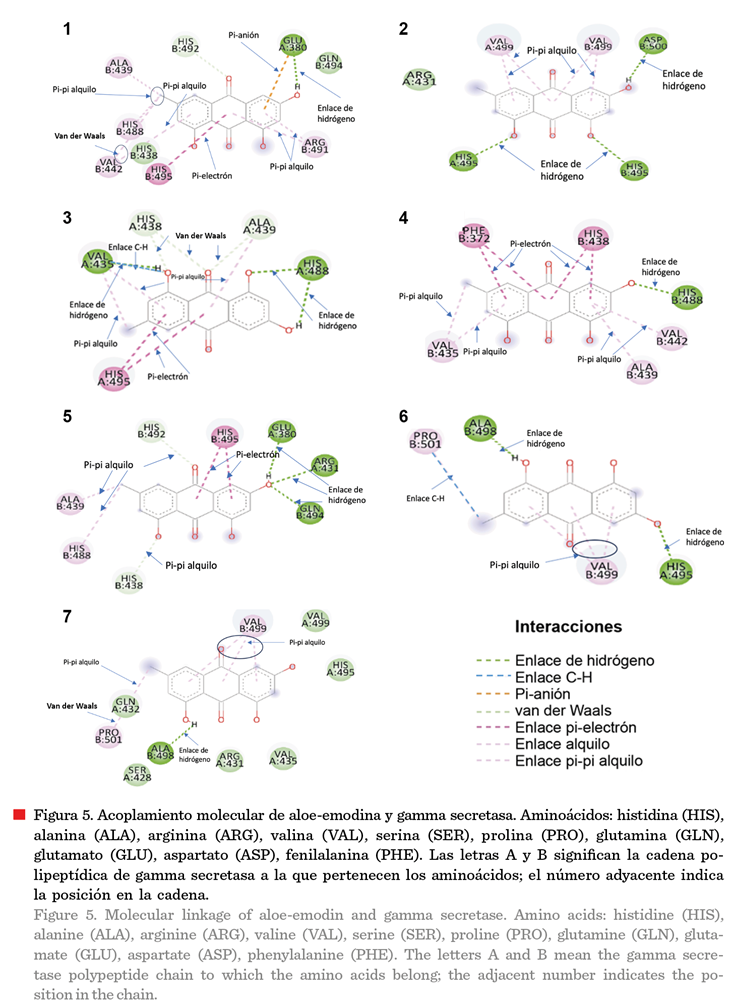
La Figura 5 muestra los 7 acoplamientos estables
para gamma secretasa. Se puede apreciar la existencia enlaces de
hidrógeno, C-H, π-anión, π-electrón, alquilo,
y π-π alquilo. Cada enlace mencionado permite la estabilidad del enlace y
determina la energía de unión existente entre la aloe-emodina y la gamma
secretasa. La ausencia de enlaces con mayor energía sugiere que la aloe-emodina
no se une al sitio activo de la gamma secretasa,
por lo que su unión a la enzima, en caso de modificar su actividad
enzimática (acción no probada en este
estudio) le permitiría actuar como inhibidor competitivo, es decir,
modificando su estructura tridimensional y afectando con ello su actividad enzimática, lo cual disminuiría la
síntesis de péptidos b-amiloide y a su
vez la acumulación del mismo para la formación de la proteína Tau. De acuerdo
con Mitra y col. (2022), la aloe-emodina posee un efecto inhibitorio sobre la
agregación del péptido b-amiloide, por regulación de la enzima serina/treonina cinasa. Tratamientos con
aloe-emodina de 25 mM y 50 mM, disminuyen la
apoptosis inducida por el péptido b-amiloide,
además se reducen los marcadores de apoptosis, caspasa-3, caspasa-8 y caspasa-9 (Li y col., 2021b).
Los resultados
obtenidos sugieren que A. ve-ra podría
funcionar como candidato a fármaco para el tratamiento de la enfermedad de
Alzheimer, por su actividad antioxidante, correlación positiva de los
polifenoles y flavonoides con la actividad
antioxidante, y la unión de aloe-emodina con gamma secretasa.
CONCLUSIONES
El gel de A. vera posee
actividad antioxidante, inhibiendo los
radicales ABTS y DPPH, además, de actividad contra radicales OH y
capacidad de reducción de hierro, por lo que se
podría utilizar como tratamiento contra cierto tipo de enfermedades que
involucren generación de radicales libres. La capacidad antioxidante, se
relaciona directamente, con las altas concentraciones de polifenoles y
flavonoides presentes en el gel, los cuales se asocian directamente con la
inhibición de radicales libres (Radical OH). El estudio in silico demostró que
la enfermedad de Alzheimer presenta mayor expresión de genes que
codifican proteínas transmembranales, como gamma secretasa relacionada con la
formación de las placas seniles presentes. El acoplamiento es-table
aloe-emodina-gamma secretasa, sugiere que podría funcionar como coadyuvante
farmacéutico en el tratamiento de la enfermedad de Alzheimer, en caso de actuar
como inhibidor de su actividad.
DECLARACIÓN DE
INTERESES
Los autores declararon
no tener conflicto de interés alguno.
Referencias
Akhtar, M. F., Saleem, A., Rasul, A., Baig, M. M. F. A., Bin-Jumah, M.,
and Daim, M. M. A. (2020). Anticancer natural medicines: An
overview of cell signaling and other targets
of anticancer phytochemicals. European Journal of Pharmacology. 888: 173488.
Añibarro-Ortega, M., Pinela, J., Barros, L., Ćirić, A., Silva, S. P., Coelho, E., …, and Ferreira, I. C.
F. R. (2019). Compositional features and bioactive properties of Aloe vera leaf (Fillet, Mucilage, and Rind) and Flower. Antioxidants. 8(10):
444.
Baldi,
A., Sommella, E., Campiglia,
P., and Daglia, M. (2020). Aloe gelbase
food products: Chemical, toxicological, and regulatory aspects. Regulatory Toxicology and Pharmacology.
119: 104818.
Baruah, A., Bordoloi,
M., and Baruah, H. P. D. (2016). Aloe
vera: A multipurpose industrial crop. Industrial Crops and Products. 94: 951-963.
Benzidia, B., Barbouchi,
M., Hammouch, H., Belahbib,
N., Zouarhi, M., Erramli,
H., …, and Hajjaji, N. (2018). Chemical
composition and antioxidant activity of tannins extract from green rind of Aloe
vera (L.) Burm. F. Journal of King Saud University - Science. 31(4):
1175-1181.
Bendjedid, S. and Benouchenne, D. (2023). In silico studies for assessing physicochemical, pharmacokinetic and
cytotoxic properties of bioactive molecules
identified by LC-MS in Aloe vera leaf extracts.
South African Journal of Botany. 157: 75-81.
Benítez-Estrada, A., Villanueva-Sánchez, J., González-Rosendo,
G., Alcántar-Rodríguez, V., Puga-Díaz, R. y
Quintero-Gutiérrez, A. (2020). Determinación de la capacidad antioxidante total
de alimentos y plasma humano por fotoquimiolumnisencia: Correlación con ensayos fluorométricos (ORAC) y espectrofotométricos (FRAP). Revista Especializada en
Ciencias Químico-Biológicas. 23: 1-9.
Bobo-García,
G., Davidov-Pardo, G., Arroqui,
C., Vírseda, P., Marín-Arroyo, M. R., and Navarro, M.
(2015). Intralaboratory validation of microplate methods for
total phenolic content and antioxidant
activity on polyphenolic extracts, and comparison with conventional
spectrophotometric methods. Journal
of the Science
of Food and Agriculture. 95(1): 204-209.
Borges-Argáez,
R., Chan-Balan, R., Cetina-Montejo, L., Ayora-Talavera, G., Sansores-Peraza,
P., Gómez-Carballo, J., and Cáceres-Farfán, M. (2019). In
vitro evaluation of anthraquinones from Aloe vera (Aloe barbadensis Miller)
roots and several derivatives against strains of influenza virus. Industrial
Crops and Products. 132:
468-475.
Clementi, M., Tringali,
G., Triggiani, D., and Giardina,
B. (2015). Aloe arborescens extract protects IMR-32
cells against Alzheimer amyloid beta peptide via inhibition of radical peroxide
production. Natural Product Comunications. 10(11):
1993-1995.
Cruzado,
M., Pastor, A., Castro, N. y Cedron, J. (2013).
Determinación de compuestos fenólicos y actividad
antioxidante de extractos de alcachofa (Cynara scolymus
L.). Revista de la Sociedad Química del Perú. 79(1): 57-63.
Domínguez-Fernández,
R. N., Arzate-Vázquez, I., Chanona-Pérez, J., Welti-Chanes,
J., Alvarado-González, J., Calderón-Domínguez, G., … y Gutiérrez-López, F.
(2012). El gel de Aloe vera: Estructura, composición química,
procesamiento, actividad biológica e importancia en la industria farmacéutica y
alimentaria. Revista Mexicana de Ingeniería Química. 11(1): 23-43.
Dong, X., Zeng, Y., Liu, Y., You, L., Yin, X., Fu, J., and Ni, J. (2019).
Aloe-amodin: A review of its pharmacology, toxicity, and pharmacokinetics. Phytotherapy
Reseaarch. 34(2): 270-281.
Farrugia,
C. J. E., Burke, E. S., Haley, M. E., Bedi, K. T., and Gandhi, M. A. (2019). The use of aloe vera in cancer radiation: An updated comprehensive review. Complementary Therapies
in Clinical Practice. 35:
126-130.
Fehrmann-Cartes, K., Coronado, M., Hernández, A.
J., Allende, M. L., and Feijoo, C. G. (2019). Anti-inflammatory
effects of Aloe vera on soy mealinduced intestinal inflammation in zebrafish. Fish
& Shellfish Immunology. 95: 564-573.
Gao, Y., Zhang, X., Li, X., Qi, R., Han, Y., Kang, Y., ..., and Qi, Y.
(2021). Aloe-emodin, a naturally occurring anthraquinone, is a highly potent
mast cell stabilizer through activating mitochondrial calcium uniporter. Biochemical Pharmacology. 186:
114476.
Gebashe, F., Baskaran, P., and Van-Staden, J.
(2019). Pharmacology and polyphenolic contents of in vitro propagated Aloe
pruinosa Reynolds grown ex vitro. South African Journal of Botany. 122: 504-509.
Guo, Q., Fu, W., Xie, J., Luo, H., Sells, S. F., Geddes, J. W., …, and
Mattson, M. P. (1998). Par-4 is a mediator of
neuronal degeneration associated with the pathogenesis of Alzheimer
disease. Nature Medicine. 4(8): 957-962.
Han, J., Hyun, J., Park. J., Jung, S., Oh, Y., Kim, Y., …, and Jung., Y.
(2021). Aberrant role of pyruvate kina-se M2
in the regulation of gamma-secretase and memory deficits in Alzheimer’s
disease. Cell Reports. 37: 110102.
Hęś, M., Dziedzic, K., Górecka, D., Jędrusek-Golińska, A., and Gujska, E.
(2019). Aloe vera (L.) Webb.:
Natural Sources of Antioxidants – A Review. Plant Foods for Human Nutrition. 74(3): 255-265.
Ji, J., Qin, Y., Wang, R., Huang, Z., Zhang, Y., Zhou, R., …, and Lu, C.
(2016). Copy number gain of VCX, X-linked multicopy gene, leads to cell
proliferation and apoptosis during spermatogenesis. Oncotarget. 7(48):
78532-78540.
Khan, I.,
Mohanta, T. K., Ihsan, N., Halim, S. A., Khan, A., Rehman, N. U., ..., and Al-Harrasi, A. (2022). Antiamnesic Effects of Feralolide
Isolated from Aloe vera Resin Miller against
Learning Impairments
Induced in Mice. Antioxidants. 12(162): 1-18.
Kumar,
R., Singh, A. K., Gupta, A., Bishayee, A., and
Pandey, A. K. (2019). Therapeutic potential of Aloe vera
-A miracle gift of nature. Phytomedicine. 60:
152996.
Leite, D. O. D., Camilo, C. J., Nonato, C. F.
A., Carvalho, N. K. G., Salazar, G. J. T., de-Morais, S. M., and Costa, J. G.
M. D. (2021). Chemical profile and evaluation of the
antioxidant and anti-acetylcho-linesterase activities of Annona squamosa
L. (Annonaceae) Extracts. Foods. 10(10): 2343.
Li, T., Guo, R., Zong, Q., and Ling, G. (2021a). Application of molecular
docking in elaborating molecular mechanisms and interactions of supra molecular
cyclodextrin. Carbohydrate Polymers. 276: 118644.
Li, Y., Jiang, B., Zhang, T., Mu, W., and Liu, J. (2008). Antioxidant and
free radical-scavenging ac-tivities of
chickpea protein hydrolysate (CPH). Food Chemistry. 106(2):
444-450.
Li, Z., Bi, H., Jiang, H., Song, J., Meng, Q., Zhang, Y., and Fei, X.
(2021b). Neuroprotective effect of emodin
against Alzheimer’s disease via Nrf2 signaling in U251 cells and APP/PS1 mice. Molecular Medicine Reports. 23(2): 108-117.
Lonescu-Tucker, A. and Cotman,
C. W. (2021). Emerging roles of oxidative stress in
brain aging and Alzheimer’s disease. Neurobiology of Aging. 107: 86-95.
Maan, A. A., Nazir, A., Khan, M. K. I., Ahmad, T., Zia, R., Murid, M., and
Abrar, M. (2018). The therapeutic properties and applications of Aloe vera:
A review. Journal of Herbal
Medicine. 12: 1-10.
Maan, A. A., Reiad-Ahmed, Z. F., Iqbal-Khan, M. K., Riaz, A., and Nazir, A.
(2021). Aloe vera gel, an excellent base material for edible films and coatings. Trends in Food Science & Technology. 116: 329-341.
Majumder, R., Das, C. K., and Mandal, M. (2019). Lead bioactive compounds
of Aloe vera as potential anticancer agent. Pharmacological Research.
148: 104416.
Martin, A., Stillman, J., Miguez, M., McDaniel, R., Konefal, J., Woolger,
J., and Lewis, J. (2017). The effect of dietary supplementation on
brain-derived neurotrophic factor and cognitive functioning in Alzheimer’s
dementia. Journal of Clinical and Transational Research. 3(3):
337-343.
Meneses,
L. y Cuesta, S. (2015). Determinación computacional de la afinidad y eficiencia
de enlace de antiinflamatorios no esteroideos inhibidores de la
ciclooxigensas-2. Revista Ecuatoriana de Medicina y Ciencias Biológicas.
36(2): 17-25.
Mijatovic, S., Maksimovic,
D., Radovic, J., Miljkovic,
Dj., Harhaji, Lj., Vuckovic, O., ..., and Trajkovic,
V. (2005). Anti-glioma action of aloe emodin: the
role of ERK inhibition. Cellular and Molecular Life Sciences. 62: 589-598.
Mitra,
S., Anjum, J., Muni, M., Das, R., Rauf,
A., Islam, F., …, and Wilairatana,
P. (2022). Exploring the journey of emodin as a
potential neuroprotective agent: Novel therapeutic insighits with molecular
mechanism of action. Biomedicine & Pharmacotherapy. 149: 112877.
Nalimu, F., Oloro, J., Kahwa, I., and Ogwang, P. E. (2021). Review on the
phytochemistry and toxicological profiles of Aloe vera and Aloe ferox.
Fture Journal of Pharmaceutical Sciences. 7: 1-21.
Nitsche, A., Arnold, C., Ueberham, U., Reiche, K., Fallmann, J.,
Hackermüller, J., …, and Arendt, T. (2021). Alzheimer-related genes show accelerated evolution. Molecular Psychiatry. 26(10): 5790-5796.
Oyaizu, M. (1986). Studies on products of browning reactions: Antioxidative
activities of product of browning reaction prepared from glucosamine. Japan Journal
of Nutrition. 44: 307-315.
Ozsoy, N., Candoken, E., and Akev, N. (2009). Implications for degenerative
disorders: Antioxidative activity, total phenols, flavonoids, ascorbic acid, b-carotene and a-tocopherol in Aloe vera. Oxidative
Medicine and Cellular Longevity. 2(2): 99-106.
Pasala, P. K., Abbas-Shaik, R., Rudrapal, M., Khan, J., Alaidarous, M. A.,
Jagdish-Khairnar, S., …, and Walode, S. G.
(2022). Cerebroprotective effect of aloe emodin: In silico and in vivo studies.
Saudi Journal of Biological Sciences. 29(2): 998-1005.
Pinzi, L. and Rastelli, G. (2019). Molecular docking: Shifting paradigms in
drug discovery. International Journal of Molecular Sciences. 20(18):
4331.
Pluta, R., Koziol, M., Januszewski, S., and Czuczwar, S. (2020). Gut
microbiota and pro/prebiotics in Alzheimer´s disease. Aging. 12(6):
5539-5550.
Priness, I., Maimon, O., and Ben-Gal, I. (2007). Evaluation of geneexpression
clustering via mutual information distance measure. BMC Bioinformatics.
8(111): 1-12.
Schmidt, F., Fitz, K., Feilen, L., Okochi, M., Steiner, H., and Langosh, D.
(2022). Different transmem-brane domain determine the specificity and efficiency of the cleavage activity of the g-secretase subunit
presenilin. Journal of Biochemical Chemical. 299(5): 104626.
Soria-Lopez, J. A., González, H. M., and Léger,
G. C. (2019). Alzheimer’s disease. Handbook of
Clinical Neurology. 167: 231-255.
Tariq, H., Zia, M., Ihsanul-Haq, Muhammad, S. A., Khan, S. A., Fatima, N.,
…, and Zhang, M. (2019). Antioxidant,
antimicrobial, cytotoxic, and protein kinase inhibition potential in Aloe
vera L. BioMed Research International.
2019: 1-14.
Vuoristo, J. T., Berrettini, W. H., and Ala-Kokko, L. (2001). C18orf2, a novel, highly conserved intronless gene
within intron 5 of the GNAL gene on chromosome
18p11. Cytogenetics and Cell Genetics. 93(1-2): 19–22.
Wang, Z. T., Tan, C. C., Tan, L., and Yu, J. T. (2019). Systems biology and
gene networks in Alzheimer’s disease. Neuroscience
and Biobehavioral Reviews. 96: 31-44.
Wolfe, M. (2019). Structure and Function of the g-Secretase Complex. Biochemistry. 58(27):
2953-2966.
Yang, Y., Wu, J. J., Xia, J., Wan, Y., Xu, J. F.,
Zhang, L., ..., and Peng, C. (2022). Can aloin develop to
medicines or healthcare products? Biomedicine
& Pharmacotherapy. 153: 113421.