https://doi.org/10.29059/cienciauat.v18i2.1833
Participación
del transporte simplástico de las auxinas durante el desarrollo de las plantas
Symplastic transport participation of auxins during plant development
Desarrollo vegetal regulado por transporte simplástico
Elizabeth Carrillo-Flores, Asdrúbal
Aguilera-Méndez, Ma. Elena Mellado-Rojas, Elda Beltrán-Peña*
*Correspondencia:
eldabelt@umich.mx/Fecha de recepción:
20 de septiembre de 2023/Fecha de aceptación: 24 de enero de 2024/Fecha de
publicación: 30 de enero de 2024.
Universidad Michoacana de San Nicolás de Hidalgo,
Instituto de Investigaciones Químico Biológicas,
Avenida Francisco J. Múgica s/n, Ciudad, Universitaria, colonia Felicitas del
Rio, Morelia, Michoacán, México, C. P. 58030.
RESUMEN
La
apropiada organogénesis de las plantas, durante su
ciclo de vida, propicia su desarrollo y la
adaptación a diferentes condiciones ambientales. Diversas fitohormonas
regulan el desarrollo vegetal, pero la auxina denominada ácido indol-3-acético
(AIA) es una de las más importantes.
El AIA se sintetiza en la parte aérea de la planta y se moviliza a los tejidos
demandantes por un transporte rápido que utiliza
el floema y por el transporte polar de auxinas (TPA). Recientemente, se
ha demostrado que las auxinas también se movilizan mediante el transporte
simplástico (TS) a través de los plasmodesmos
(PD), cuya apertura o cierre está regulada
respectivamente por la degradación o
la deposición de la callosa. El objetivo del presente trabajo fue profundizar
en los avances sobre la participación
del transporte simplástico de las auxinas durante el desarrollo vegetal, así
como la degradación o deposición de la callosa,
en el cierre o apertura de los PD, para regular el desarrollo de algunos
órganos de Arabidopsis thaliana. La intervención de las proteínas PDLP5 es
determinante para la deposición de la callosa en los PD, lo que regula la
distribución de la auxina e impacta en la formación radicular, especialmente en
las raíces laterales. La participación del TS es importante para desarrollar la
actividad de las auxinas, lo cual favorece la formación radicular, necesaria en la mejora de absorción de nutrientes de las
plantas. Este conocimiento puede ser utilizado para mejorar las plantas de
interés agronómico.
PALABRAS
CLAVE: auxinas, callosa, desarrollo vegetal, plasmodesmos,
transporte simplástico.
ABSTRACT
The
appropriate organogenesis of plants during their life cycle promotes their
development and adaptation to different
environmental conditions. Various
phytohormones regulate plant development but auxin, called Indole-3-Acetic Acid
(IAA), is one of the most important.
IAA is synthesized in the aerial part of plant and is mobilized to the
demanding tissues by a rapid transport using
the phloem and by the polar auxin transport (PAT). Recently, it has been shown that auxins also are mobilized by a symplastic transport
(ST) through plasmodesmata (PD), which
opening or closing is regulated by the callose degradation or deposition
respectively. The objective of the present work was to deepen the analysis on
the participation of symplastic transport of auxins
during plant development, as well in the callose degradation or deposition, in
the closing or opening of the PD, that regulates the development of some organs
of Arabidopsis thaliana. The intervention of PDLP5 proteins is decisive
for the callose deposition in the PD, which regulates the auxin distribution
and impacts root formation, especially at the lateral roots. The participation
of TS is important to develop the auxin activity, which favors root formation,
necessary for the improvement plant nutrient absorption. This knowledge can be used to improve development
plants of agronomic interest.
KEYWORDS: auxins, callose,
plant development, plasmodesmata, symplastic
transport.

INTRODUCCIÓN
Las plantas están
formadas por un sistema radicular y un
sistema aéreo. El primero se origina a partir del meristemo apical de la
raíz (MAR), y sus funciones principales consisten en anclar la planta al suelo
y adquirir agua y nutrientes. Mientras que el sistema aéreo, que se origina a
partir del meristemo apical del brote (MAB),
lleva a cabo, entre otras funciones, la fotosíntesis y la biosíntesis de
auxinas (Gaillochet
y Lohmann, 2015). Las auxinas, hormonas vegetales asociadas a la elongación de las plantas, son sintetizadas en la
parte aérea y se transportan a la raíz por el floema y
por el transporte polar de auxinas (TPA).
Este último permite la creación de una concentración
máxima de auxinas necesaria para el desarrollo adecuado del sistema
radicular. Las auxinas además de movilizarse por el TPA, también lo hacen
mediante el transporte simplástico (TS), a través de los plasmodesmos (PD) (Band, 2021). El TS está regulado por la
síntesis, deposición o degradación de
la callosa en el cuello de los PD, lo que
respectivamente permite el cierre o
apertura de los mismos
(Wu y col., 2018). La callosa es un polímero de glucosas unidas por enlaces
glucosídicos b-1,3 que participa en la formación de las placas del tamiz del
floema y controla el cierre o la apertura de los PD durante el desarrollo y la
maduración de los estambres y las anteras (Nishikawa
y col., 2005). En las plantas perennes como
el álamo, el ácido abscísico incrementa la síntesis de callosa en las puntas de los brotes y de esta manera disminuye la actividad
meristemática y la latencia de las yemas (Tylewicz y
col., 2018). Otros reportes señalan el papel de la callosa en el desarrollo
vegetal y en las interacciones ambientales
(Li y col., 2023).
En este trabajo se
aborda como el cierre o apertura de los PD, a través de la callosa, regula el
desarrollo de algunos órganos de Arabidopsis
thaliana.
Desarrollo vegetal
Las plantas poseen
estructuras especializadas que les permiten
su desarrollo y reproducción. Durante
la formación del embrión se originan dos
polos, donde se localizan el MAB y el MAR (Scheres,
2007; Chang y col., 2020). El MAB da lugar a las hojas, tallos y flores (Chang y
col., 2020; Li y col., 2022a), mientras que el MAR da origen al sistema
radicular (Strotmann y Stahl, 2021). En las plantas
maduras, el MAB y el MAR se localizan en la
punta de la parte aérea y de la raíz,
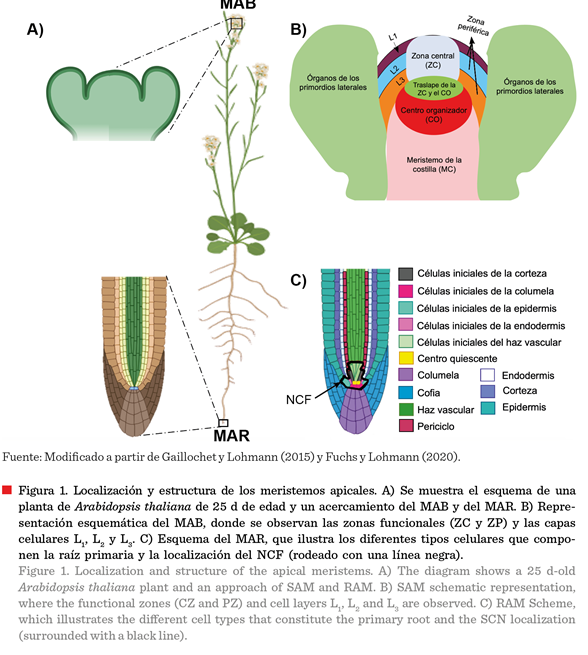
respectivamente (Figura 1A). El MAB
se subdivide en diferentes zonas y capas
(Figura 1B). La capa externa, denominada L1, da origen a la epidermis; la capa L2 genera el tejido
fundamental y; la L3, que es la capa más interna, produce la vasculatura (Gaillochet y Lohmann, 2015). Mientras que la zona central (ZC)
presenta una baja división celular, en la zona periférica (ZP), al igual que la
zona que corresponde al meristemo de la
costilla (MC), las divisiones son
más rápidas (Uchida y Torii, 2019). En la Figura 1B, se observa que el centro
organizador (CO) está rodeado por las tres zonas antes mencionadas. Cabe
señalar que el CO está formado por un conjunto de células que raramente
se dividen, al igual que el centro quiescente (CQ) del MAR (Gaillochet
y Lohmann, 2015; Uchida y Torii,
2019).
La
actividad y el mantenimiento del CO regula el
tamaño y el funcionamiento correcto del MAB (Vázquez-Chimalhua y col., 2018; Wang y Jiao,
2023). Por otra parte, el MAR muestra una organización de cilindros
concéntricos altamente estructurada, donde al conjunto de células iniciales que
rodean al CQ se le conoce como el nicho de células fuente (NCF),
el cual da origen a las diferentes capas que conforman la raíz primaria (García-Gómez y col., 2021). En la Figura 1C se puede observar el arreglo radial de
las capas de la raíz, donde una capa denominada
periciclo rodea la estela o haz vascular; enseguida se localiza la endodermis,
las células de la corteza y la epidermis (capa externa de la raíz). Debajo del NCF, se encuentran la cofia y la columela, que protegen a la punta de la
raíz de la fricción durante la exploración del suelo (Kumar e Iyer-Pascuzzi, 2020).
Vía de respuesta a las
auxinas
La palabra auxina
proviene del griego auxein que significa “crecer” y su posible existencia fue
sugerida por Charles y Francis Darwin en 1880, al observar el doblamiento del
coleóptilo de Phalaris canariensis
hacia la luz. Años más tarde, se demostró que este efecto se de-bía a la acumulación de auxinas en la zona del doblamiento del tejido (Taiz
y Zeiger, 2010). Ahora se sabe que,
prácticamente todo el desarrollo vegetal está regulado por las auxinas (Peris y
col., 2010; Scarpella y col., 2010; Ros-uete y col., 2012; Mishra y col., 2022; Zhang y col.,
2022). El efecto de estos compuestos, a través de la vía de respuesta a las
auxinas, es un fenómeno muy complejo que comprende los siguientes eventos: i) homeostasis, ii)
transporte y, iii) percepción y señalización (Figura 2).
La homeostasis de auxinas mantiene el equilibrio interno de la
fitohormona, que se establece a través de ajustes múltiples y dinámicos en la
síntesis, el catabolismo y la conjugación de
la auxina denominada Ácido Índol-3-Ácético (AIA), lo que permite el
desarrollo y adaptación de las plantas a
estímulos ambientales (Zhang y Peer,
2017). En A. thaliana, en la vía de síntesis
del AIA dependiente del triptófano (Trp), el Trp se convierte por la
acción de las trp aminotransferasas (TAA) a ácido indol-3-pirúvico (IPA). Posteriormente, el IPA
es transformado por las flavin monooxigenasas YUCCA (YUC) a AIA (Figura 2) (Cao y col., 2019). El catabolismo del AIA (Figura 2), se efectúa entre
otros procesos por la oxidación del AIA a oxiAIA
(Rosquete y col., 2012).
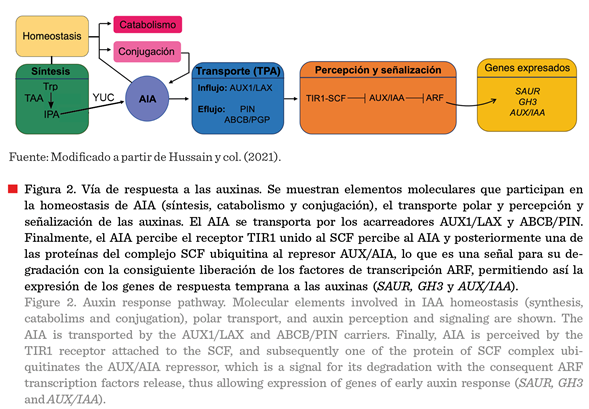
El AIA en las plantas
se distribuye desde los tejidos de síntesis a los demandantes a través del floema y por el TPA, el cual genera gradientes
en distancias cortas. Para que se lleve a
cabo el TPA, se requiere de los acarreadores de influjo AUXIN1/LIKE-AUX1
(AUX1/LAX) y de eflujo PIN-FORMED (PIN) y ATP-Binding
Cassette/P-glycoprotein
(ABCB/PGP) (Figura 2) (Sauer y Kleine-Vehn, 2019).
Respecto a los eventos
de la percepción y señalización de las auxinas se sabe que, cuando la concentración de auxinas es baja, la respuesta a esta fitohormona está inhibida por los represores denominados Auxin/Indole-3-Acetic Acid (AUX/IAA) que
secuestran a los factores de respuesta a
auxinas ARF (ARF, por sus siglas en inglés: Auxin Response Factor) y con ello
impiden la expresión de los genes de respuesta temprana a las auxinas. Mientras
que altas concentraciones de auxinas son
percibidas por el receptor nuclear de
respuesta de inhibición al transporte TIR1 (TIR1, por sus siglas en inglés:
Transport Inhibitor
Response1) que está unido al complejo SCF (S-PHASE KINASE-ASSOCIATED PROTEIN1 (SKP1), CULLIN1 (CUL1), RING BOX PROTEIN1 (RBX1) y una F-box ligasa E3 de ubiquitina, lo que ocasiona que las auxinas unan a
los represores AUX/IAA con el complejo
SCF. Cuando esto sucede, los AUX/IAA son marcados por la ubiquitina-ligasa E3 (forma parte del SCF) y degradados vía el proteosoma, con la
consiguiente liberación de los
factores de transcripción ARF y la expresión de los genes de respuesta temprana a las
auxinas: SMALL AUXIN-UPREGULATEDRNA (SAUR), GRETCHEN HAGEN3 (GH3) y AUX/IAA
(Robert y Friml, 2009; Schaller
y col., 2015; Leyser,
2018) (Figura 2).
La participación del
TPA durante el desarrollo vegetal ha sido demostrada ampliamente (Michniewicz y col., 2007; Habets
y Offringa, 2014; Ötvos y
col., 2019; Sauer y Kleine-Vehn, 2019; Lee y col.,
2020; Han y col., 2021; García-Gómez y col.,
2021; Mishra y col., 2022) y recientemente, se ha reportado que el TS de
las auxinas complementa al TPA (Rutschow y col., 2011; Gao y col., 2020; Mellor y col., 2020; Band, 2021).
Transporte polar de
auxinas (TPA)
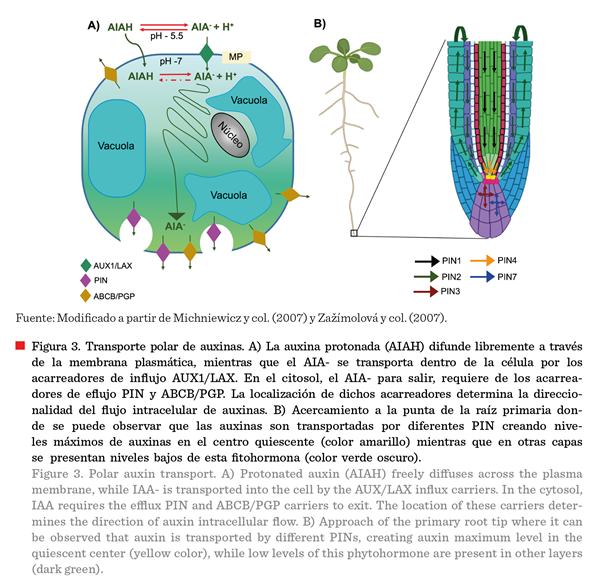
En forma aniónica
(AIA-), el AIA es transportado por los
acarreadores de influjo AUX1/LAX y de eflujo PIN y ABCB/PGP (Robert y Friml, 2009; Han y col., 2021) (Figura 3A). En Arabidopsis, la familia de los acarreadores de eflujo
PIN está integrada por ocho miembros. En la punta de la raíz primaria, las
auxinas que llegan a través del floema son redistribuidas por diferentes PIN,
estableciendo con ello un gradiente
indispensable para crear una concentración máxima de auxinas en el MAR,
que es esencial para el crecimiento indeterminado de la raíz. En la Figura 3B, se observa que PIN1 participa en
el movimiento de las auxinas a través del haz vascular; PIN4 las concentra en
el CQ; PIN3 y PIN7 las redistribuyen en la región de la columela y PIN2 sube a
las auxinas por la cofia hacia la epidermis y las regresa a través de las
células de la corteza hacia el CQ para mantener una concentración máxima de auxinas en la punta de la raíz,
necesaria para la función correcta del NCF
(Figura 3B). También, se ha reportado que, en el desarrollo de las
raíces laterales están involucrados los acarreadores de eflujo PIN1 y
PIN3 (Finet y Jaillais,
2012; Lee y col., 2020).
Transporte simplástico
de las auxinas a través de los plasmodesmos
La
caracterización de la dinámica de la auxina es esencial para
entender cómo participa esta fitohormona en la regulación del desarrollo
vegetal. Se ha reportado que el TS de las
auxinas está involucrado en el fototropismo, la emergencia de las raíces laterales y la hiponastia de las hojas (Band, 2021). Mellor y col. (2020), observaron que
al comparar el nivel experimental de auxinas
en la raíz de A. thaliana
in vivo con el nivel predicho por experimentos
in silico, ambas distribuciones mostraban discrepancias muy grandes entre las concentraciones de auxinas cuando se consideraba solo el TPA. Mientras que, cuando
tomaron en cuenta tanto el TPA como el TS, ambas
distribuciones presentaron una alta
concordancia. Esto les permitió a los autores recomendar que, en cualquier
proceso del desarrollo vegetal que involucre el transporte de auxinas, se debe
de considerar tanto al TPA como el TS.
Estructura y
regulación de la apertura y cierre de los plasmodesmos
Los PD son canales nanoscópicos que atraviesan la pared celular y conectan el
citoplasma de células vecinas. El movimiento de las moléculas a través de los PD depende de su permeabilidad, característica
conocida como límite del tamaño de exclusión
(LTE), que se define por el tamaño máximo que tiene una molécula capaz
de atravesar el PD (Zambryski, 2004; Faulkner, 2018; Peters y col., 2021; Barr
y Tilsne, 2023). El LTE, a su vez, depende del
gradiente de concentración entre las células adyacentes.
Por estos PD se transportan proteínas, RNAs, virus,
AIA y moléculas con un peso de hasta 80 kDa (Brunkard, 2020).
La permeabilidad de
los PD está regulada por mecanismos
dependientes e independientes de la callosa depositada en los cuellos de
los PD (Figura 4). Los mecanismos
dependientes de callosa involucran la síntesis y degradación del polímero,
en tanto que, los independientes incluyen la
alteración del número de PD y el cambio de estructura de los PD de
simples a ramificados (Wu y col., 2018). Los
PD simples conectan el citoplasma de dos células, mientras que los ramificados, que consisten
de la fusión de varios PD
simples, presentan varias cavidades que aumentan el TS (Zambryski y Crawford, 2000). Por otra parte, se ha observado que altos
niveles de callosa en el cuello del PD lo cierran, y restringen el TS, y que dicho
nivel depende de las enzimas CALLOSE SYNTHASE/GLUCAN SYNTHASE-LIKE (CALS/GSL) (Hernández-Hernández
y col., 2020).
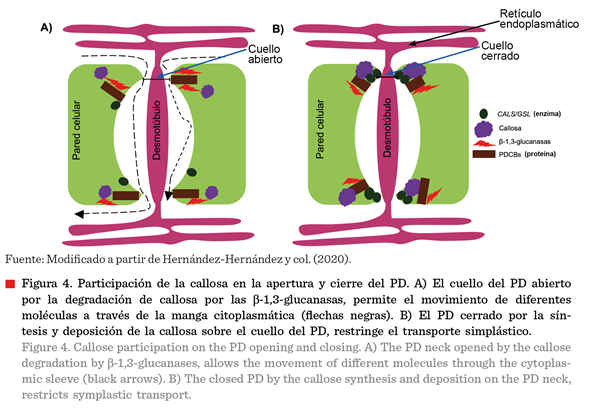
En el cierre de los
PD, también están involucradas las proteínas que ayudan al posicionamiento de
la callosa sobre el cuello de los PD, como las PD-CALLOSE BINDING PROTEIN
(PDCB) (Simpson y col., 2009; Amsbury y col., 2018) y
las PLASMODESMATAL-LOCATED PROTEIN (PDLP) (Thomas y col., 2008; Li y col.,
2022b) (Figura 4B). Por otra parte, la remoción de la callosa que resulta en la
apertura de los PD está mediada por las b-1,3-glucanasas (Figura 4A)
(Hernández-Hernández y col., 2020).
Participación
de la callosa en la defensa de las plantas
Una
de las primeras funciones reportada de los PD se relaciona con
la defensa vegetal, debido a que virus, hongos y bacterias usan a los PD para invadir a la planta (Zambryski
y Crawford, 2000; Liu y col., 2021). Para enfrentar a las infecciones, las plantas incrementan la expresión
de los genes CALS/GSL, PDLP5 y PDCB
que codifican respectivamente para
las proteínas CALS/GSL, PDLP5 y PDCB, y que forman una estructura conocida como papillae,
que además contiene fitoalexinas, especies reactivas de oxígeno y
defensinas (Wang, 2021). La deposición de callosa en los PD en respuesta al ataque de patógenos está regulada
por el ácido salicílico, ocasionando con
ello una disminución del LTE (Zavaliev y col.,
2011; Jiang y col., 2021).
Nie y col. (2017),
reportaron un aumento en la acumulación de
callosa en A. thaliana expuesta a Botrytis cinerea.
En otro estudio, se observó un
incremento de callosa en hojas de fresa
expuestas a la interacción física y a los compuestos volátiles de Botrytis methylotrophicus
(Vicente-Hernández y col., 2019). Los resultados
antes mencionados, sugieren que el cierre de los PD es un mecanismo que
se lleva a cabo para impedir la propagación del patógeno al resto de la planta.
Recientemente, Tee y col. (2023) señalaron que, las plantas para iniciar y
ejecutar su defensa contra el ataque de patógenos emplean una serie de cascadas de señalización, cada
una con componentes moleculares específicos. Estos autores indicaron que
diversas cascadas de señalización iniciadas por diferentes electores,
convergen en la síntesis de callosa que resulta en el cierre de los PD.
Participación de la
callosa durante el desarrollo vegetal
La
callosa es sintetizada por un complejo multiproteico que se
localiza en la membrana celular, sin embargo, la subunidad catalítica crítica
es la sintasa de callosa CALS/GSL (Li y col., 2023). El genoma de A. thaliana contiene doce genes de sintasas de callosa CALS/GSL
(Chen y col., 2009). Han y col. (2014) reportaron
que la mutante gsl8 de A. thaliana
impide la acumulación de callosa en
los PD y altera el desarrollo de estomas.
Como la mutación gsl8 también ocasionó otras alteraciones del
desarrollo, para poder analizar el efecto de la callosa sobre la respuesta del hipocótilo a la luz y a la gravedad, se
crearon mutantes gsl8 condicionadas a dexametasona (dsGSL8 RNAi). Adicionalmente, observaron que, los hipocótilos de plántulas dsGSL8 RNAi, en presencia de dexametasona, no presentaron
el doblamiento característico en respuesta a la gravedad y a la luz, ni la
acumulación de callosa en dicha zona. Así que, sus resultados señalaron que la acumulación
de callosa fue necesaria para el doblamiento
del hipocótilo en respuesta a los dos
tropismos evaluados.
Vatén y col. (2011)
reportaron que, el gen CALS3, que codifica para la sintasa de callosa,
se expresa en el haz vascular y en el RAM, y que las raíces de las mutantes
de ganancia de función CALS3 que
incluyen a cals3-1d, cals3-2d y cals3-3d,
denominadas colectivamente cals3-d, presentaban un patrón aberrante de
la proteína verde fluorescente (PVF) (GFP, por
sus siglas en inglés: Green Fluorescent Protein) que marca el movimiento, codificada por pSUC2::GFP. Estos investigadores, además observaron que GFP
se movilizó en el haz vascular en las plántulas control pSUC2::GFP, en tanto que en la línea cals3-1d
homocigota, la GFP desapareció y su movimiento se restableció parcialmente en
la línea heterocigota cals3-1d/+. Y también documentaron que las
plántulas cals3-d presentaron una raíz
primaria extremadamente corta y una
mayor acumulación de callosa (detectada por tinción con azul de anilina) respecto a la línea silvestre.
La callosa influye en
el desarrollo de las raíces laterales, las cuales se inducen a partir de los
primordios existentes en ellas y cuyo desarrollo transcurre a través de siete etapas.
En la etapa I, las células fundadoras del periciclo son marcadas con auxinas;
posteriormente, en las etapas II-VII, las células se van dividiendo y formando
un domo que, conforme crece, va rompiendo sucesivamente las capas de la
endodermis, la corteza, hasta llegar a la epidermis. Este desarrollo está
regulado por las auxinas que, en primer lugar, marcan a las células del periciclo que van a dar lugar a
los primordios y posteriormente las auxinas
se movilizan hacia la punta del domo conforme crece el primordio hasta
llegar a los meristemos de las raíces
laterales (Malamy y Benfey,
1997; Torres-Martínez y col., 2019).
Las
proteínas PDLP5 ayudan al posicionamiento de la callosa en el cuello de los
PD y por lo tanto contribuyen al cierre del canal. Sager y col. (2020)
observaron que, en las etapas I-II del
desarrollo de los primordios de las raíces laterales (PRL), las PDLP5 se
loca-liaron en la endodermis, mientras que en las etapas IV-VI, se
identificaron en la corteza y en la
epidermis, que es cuando ya ha emergido la RL. También detectaron que el
patrón de localización de las PDLP5 fue
similar al del transportador de influjo de las auxinas LAX3 durante el
desarrollo de los PRL y posteriormente
comprobaron que la expresión de PDPL5 depende de las auxinas.
LAX3 regula el flujo de auxinas hacia las
células que rodean al PRL y al cerrar los PD se impide la disipación de auxinas y con ello se asegura la emergencia de las RL. Estos investigadores, además observaron
un fenotipo contrastante entre las mutantes pdlp5-1 y las líneas de
sobreexpresión PDLP5OE. Las plántulas de la mutante pdlp5-1 mostraron
un mayor número de raíces laterales largas,
en tanto que las plántulas PDLP5OE presentaron raíces laterales
escasas y cortas, comportamiento que
atribuyeron a un desarrollo acelerado de los PRL en pdlp5-1 y a un retraso
en dicho desarrollo en la línea PDLP5OE.
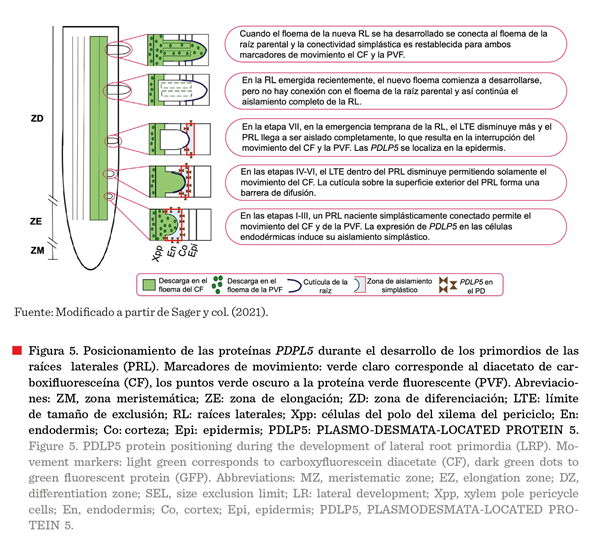
Sager y col. (2021),
establecieron un modelo que propone que en diferentes etapas del desarrollo de
los PRL se presenta un aislamiento simplástico transitorio. En las etapas
I-III, el PRL está conectado al floema de la raíz primaria y las proteínas
PDLP5 se posicionan sobre las células de la
endodermis. En los estadios IV-VI, las PDPL5 se localizan en la corteza
impidiendo el movimiento de la GFP, mientras
que en la etapa VII, las PDLP5 se posicionan en la epidermis quedando el
PRL aislado simplásticamente
del floema de la raíz primaria. Una vez que la raíz lateral emerge, esta
desarrolla su floema y se restablece la conexión simplástica entre la raíz
lateral y el floema de la raíz primaria (Figura 5).
Otro ejemplo de la
participación de la callosa en el desarrollo de las RL,
fue el observado en las plántulas pdbg1,2 (mutantes dobles de las glucanasas, donde los PD están cerrados debido a que no hay
degradación de callosa).
Estas plántulas
presentaron en el haz vascular de la raíz primaria una mayor acumulación de callosa y un incremento en la densidad de
las raíces laterales respecto a las plántulas silvestres. Al observar
con más detalle plántulas de estas mutantes, notaron que, en el sitio donde
normalmente se forma un PRL aparecen varios,
lo que resulta en un mayor número y densidad de raíces laterales. Los autores concluyeron que el transporte simplástico
a través de los PD es crítico para la iniciación y el posicionamiento adecuado de los PRL (Benitez-Alfonso
y col., 2013).
CONCLUSIONES
Las auxinas,
fitohormonas generadas en la parte aérea de la planta, se distribuyen a través del
transporte polar (TPA) y simplástico (TS) hacia todos los tejidos. Su
transporte, distribución y regulación son esenciales para el desarrollo de las plantas, por su función organogénica. En Arabidopsis
thaliana, el aislamiento simplástico
transitorio de las auxinas en el floema de la
raíz primaria, es determinante para la
emergencia de las raíces laterales. Esta acción se regula a través de las
proteínas PDLP5, que ayudan al posicionamiento de la callosa en el cuello de
los plasmodesmos (induciendo su cerrado); además de que el flujo de las auxinas hacia las células que rodean los primordios
de las raíces laterales es ajustado por
LAX3. Una vez que la raíz lateral emerge, esta desarrolla su floema y se restablece
la conexión simplástica entre la raíz lateral
y el floema de la raíz primaria. Adicional al TPA, el TS de las auxinas
coadyuva al desarrollo vegetal. Entender los mecanismos moleculares que regulan la arquitectura radicular es importante para mejorar la eficiencia
en la adsorción de nutrientes y por su potencial impacto en el rendimiento de
cultivos de importancia agronómica.
AGRADECIMIENTOS
Este
trabajo fue apoyado por la Coordinación de la Investigación Científica de la Universidad Michoacana
de San Nicolás de Hidalgo (UMSNH), E.
C. F., es becario del CONAHCYT, México (801093).
Declaración
de conflicto de intereses
Los autores declararon no tener conflictos
de intereses de ningún tipo.
Referencias
Amsbury, S., Kirk, P., and Benítez-Alfonso, Y. (2018). Emerging models on the regulation of intracellular
transport by plasmodesmata-associated callose. Journal of Experimental
Botany. 69(1): 105-115.
Band, R. L. (2021). Auxin fluxes through plasmodesmata. New
Phytologist. 231(5): 1686-1692.
Barr, Z. and Tilsne, J. (2023). Cell-to-cell
connectivity assays for the analysis of
cytoskeletal and other regulators of
plasmodesmata. Methods in Molecular Biology. 2604:
193-202.
Benitez-Alfonso, Y., Faulkner, C., Pendle, A., Miyashima, S., Helariuta, Y., and Maule, A. (2013). Symplastic
intercellular connectivity regulates lateral root patterning. Development
Cell. 26(2): 136-147.
Brunkard, J. O. (2020). Exaptive evolution of target
of rapamycin signaling in multicellular eukaryotes. Development Cell.
54(2): 142-155.
Cao, X., Yang, H., Shang, C., Sang, M., Liu, L., and Cheng, J. (2019). The roles of auxin biosynthesis YUCCA
gene family in plants. International Journal of Molecular Science.
20(24): 6343.
Chang, W., Guo, Y., Zhang, H., Liu, X., and Guo, L. (2020). Same actor in different stages: Genes in shoot apical
meristem maintenance and floral meristem determinacy in Arabidopsis.
Frontiers in Ecology and Evolution. 8: 89.
Chen, X. Y., Liu, L., Lee, E., Han, X., Rim, Y., Chu, H., and Kim, J. Y.
(2009). The Arabidopsis callose synthase gene GSL8 is required for
cytokinesis and cell patterning. Plant Physiology. 150(1): 105-113.
Faulkner, C. (2018). Plasmodesmata and the symplast. Current Biology. 28(24): R1374-R1378.
Finet, C. and Jaillais, Y. (2012). AUXOLOGY:
When auxin meets plant evo devo. Developmental Biology. 365(1): 19-31.
Fuchs, M. and Lohmann, J. U. (2020). Aiming for the top: non-cell
autonomous control of shoot stem cell in
Arabidopsis. Journal Plant Research. 133: 297-309.
Gaillochet, C. and Lohmann, J. U. (2015). The never-ending story: from pluripotency to plant developmental
plasticity. Development. 142(13): 2237-2249.
Gao, C., Liu, X., De-Storme, N., Jensen, K. H., Xu, Q., Yang, J., …, and
Liesche, J. (2020). Directionality of
plasmodesmata-mediated transport in Arabidopsis leaves support auxin
channeling. Current Biology. 30(10): 1970-1977.
García-Gómez,
M. L., Garay-Arroyo, A., García-Ponce, B.,
Paz-Sánchez, M., and Álvarez-Buylla, E. R. (2021). Hormonal regulation of stem cell proliferation at the Arabidopsis thaliana root stem
cell niche. Frontiers in Plant Science. 12: 628491.
Habets, M. E. J. and Offringa, R. (2014). PIN-driven polar auxin
transport in plant developmental plasticity: a key target for environmental and
endogenous signals. New Phytologist. 203(2): 362-377.
Han, H., Adamowski, M., Qi, L., Alotaibi, S. S., and Friml, J. (2021).
PIN-mediated polar auxin transport regulations
in plant tropic response. New Phytologist. 232: 510-522.
Han, X., Hyun, T. K., Zhang, M., Kumar, R., Koh, E. J., Kang, B. H., and
Kim, J. Y. (2014). Auxin-callose-mediated plasmodesmal
gating is essential for tropic auxin gradient formation and signaling. Developmental
Cell. 28(2): 132-146.
Hernández-Hernández, V., Benítez, M., and Boudaoud, A. (2020). Interplay
between turgor pressure and plasmodesmata
during plant development. Journal of Experimental Botany.
71(3): 768-777.
Hussain, S., Nanda, S., Zhang, J., Rehmani, M. I. A., Suleman, M., Li,
G., and Hou, H. (2021). Auxin and cytokinin interplay during leaf morphogenesis
and phyllotaxy. Plants. 10(8): 1732.
Jiang, Y., Zheng, W., Li, J., Lui, P., Zhong, K., Jin, P., …, and Chen,
J. (2021). NbWRKY40 positively regulates the response of Nicotiana benthamiana to tomato mosaic virus via salicylic acid
signaling. Frontiers in Plant Science. 11: 603518.
Kumar, N. and Iyer-Pascuzzi, A. S. (2020). Shedding the last layer:
Mechanisms of root cap cell release. Plants. 9(3): 308.
Lee, H., Ganguly, A., Lee, R. D., Park, M., and Cho, H. T. (2020).
Intracellular localized PIN-FORMED8 promotes
lateral root emergence in Arabidopsis. Frontiers in Plant Science.
10: 1808.
Leyser, O. (2018). Auxin signaling. Plant Physiology. 176(1):
465-479.
Li, N., Lin, Z., Yu, P., Zeng, Y., Du, S., and Huang, L. J. (2023). The
multifarious role of callose and callose synthase in plants development and
environment interactions. Frontiers in
Plant Science. 14: 1183402.
Li, R., Wei, Z., Li, Y., Shang, X., Cao, Y., Duan, L., …, and Ma., L.
(2022a). Ski-interacting protein interacts with shoot meristem less to regulate
shoot apical meristem formation. Plant
Physiology. 189(4): 2193-2209.
Li, Z., Liu, S. L., Montes-Serey, C., Walley, J. W., and Aung, K.
(2022b). Plasmodesmata-located proteins regulate plasmodesmal
function at specific cell interface in Arabidopsis. BioRxiv.
08.05.50299.
Liu, J., Zhang, L., and Yan, D. (2021). Plasmodes-matainvolved battle against pathogens and potential strategies for
strengthening hosts. Frontiers in Plant Science. 12: 644870.
Malamy, J. E. and Benfey, P. N. (1997).
Organization and cell differentiation in lateral roots of Arabidopsis
thaliana. Development. 124(1): 33-44.
Mellor, N. L., Voß, U., Janes, G., Bennett, M.
J., Wells, D. M., and Band, L. R. (2020). Auxin fluxes through plasmodesmata
modify root-tip auxin distribution. Development. 147(6): dev181669.
Michniewicz, M., Brewer, P. B., and Friml, J. (2007). Polar auxin transport and asymmetric auxin distribution. The
Arabidopsis Book/American Society of Plant Biologists. 5: e0108.
Mishra, B. S., Sharma, M., and Laxmi, A. (2022). Role of sugar and auxin
crosstalk in plant growth and development. Physiologia
Plantarum. 174(1): e13546.
Nie, P., Li, X., Wang, S., Guo, J., Zhao, H., and Niu, D. (2017).
Induced system resistance against Botrytis cinerea by Bacillus cereus
AR156 through a JA/ET-and NPR1-dependent
signaling pathway and activates PAMP-triggers immunity in Arabidopsis.
Frontiers in Plant Science. 8: 238.
Nishikawa, S., Zinkl, G. M., Swanson, R. J., Maruyama, D., and Preuss,
D. (2005). Callose (beta-1 3 glucan) is essential for Arabidopsis pollen wall
patterning, but not tube growth. BMC Plant Biology. 5(1): 1-9.
Ötvos,
K., Marconi, A., Vega, A., O´Brien, J., Johnson, A., Abualia,
R., and Benková, E. (2019). Modulation of plant root
growth by nitrogen source-defined regulation of polar auxin transport. The
EMBO Journal. 40(3): e106862.
Peris, L. C. I., Rademacher, E. H., and Weijers,
D. (2010). Green beginnings-pattern formation in the early plant embryo. Current
Topics in Developmental Biology. 91: 1-27.
Peters, W. S., Jensen, K. H., Stone, H. A., and Knoblauch, K. (2021).
Plasmodesmata and the problems with size: Interpreting the confusion. Journal
of Plant Physiology. 257: 153341.
Robert, H. S. and Friml, J. (2009). Auxin and other signal on the move
in plants. Nature Chemical Biology. 5: 325-332.
Rosquete, M. R., Barbez, E., and Kleine-Vehn, J. (2012). Cellular auxin homeostasis: gatekeeping in
housekeeping. Molecular Plant. 5(4): 772-786.
Rutschow, H. L., Baskin, T. I., and Kramer, E. M. (2011). Regulation of solute
flux through plasmodes mata
in the root meristem. Plant Physiology. 155(4): 1817-1826.
Sager, R., Bennett, M., and Lee, J. Y. (2021). A tale of two domains pushing lateral roots. Trends in
Plant Science. 26(8): 770-779.
Sager, R., Wang, X., Hill, K., Yoo, B. C., Caplan, J., Nedo, A., and Lee, J. Y. (2020). Auxindependent
control of a plasmodesmal regulator creates a
negative feedback loop modulating lateral root emergence. Nature
Communications. 11(1): 364.
Sauer, M. and Kleine-Vehn,
J. (2019). PIN-FORMED and PIN-LIKES auxin transport facilitators. Development. 146(15): dev168088.
Scarpella, E., Barkoulas, M.,
and Tsiantis, M. (2010). Control
of leaf and vein development by auxin. Cold Spring Harbor Perspectives in
Biology. 2(1): a001511.
Schaller, G. E., Bishopp, A., and Kieber, J. J. (2015).
The Yin-Yang of hormones: cytokinin and auxin
interactions in plant development. The Plant Cell. 27(1): 44-63.
Scheres, B. (2007). Stem-cell niches: nursery rhymes across kingdoms. Nature Reviews Molecular Cell Biology.
8(5): 345-354.
Simpson, C., Thomas, C., Findlay, K., Bayer, E., and Maule, A. J.
(2009). An Arabidopsis GPI-anchor plasmodesmal
neck protein with callose binding activity and potential to regulate cell
to-cell trafficking. The Plant Cell. 21(2): 581-594.
Strotmann, A. I. and Stahl, Y. (2021). At the root of quiescence: function and
regulation of the quiescent center. Journal of Experimental Botany.
72(19): 6716-6726.
Taiz, L. and Zeiger, E. (2010). Auxin: The first discovered plant growth
hormone. In L. Taiz, L. and E. Zeiger (Eds.), Plant Physiology, (Fifth
edition). (pp. 545-582). Massachusetts U.S.A. Sinauer Associates Inc,
Publishers.
Tee, E. E., Johnston, M. G., Papp, D., and Faulkner,
C. (2023). A PDLP-NHL3 complex integrates plasmodesmal immune
signaling cascades. Proceedings
of the National
Academy of Sciences. 120(17): e2216397120.
Thomas,
C. L., Mayer, E. M., Ritzenthaler, C., Fernandez-Calvino, L., and Maule, A. J. (2008). Specific targeting of a plasmodesmal protein affecting cell-to-cell
communication. PLoS Biology. 6(1): e7.
Torres-Martínez, H. G., Rodríguez-Alonso, G., Shishkova, S., and Dubrovsky, J.
G. (2019). Lateral root primordium morphogenesis in
angiosperms. Frontiers in Plant Science. 10: 206.
Tylewicz, S., Petterle, A., Marttila, S., Miskolczi, P., Azeez, A., and
Bhalerao, R. P. (2018). Photoperiodic control
of seasonal growth is mediated by ABA ac-tion on cell-cell
communication. Science. 350(6385): 212-215.
Uchida, N. and Torii, K. U. (2019). Stem cells
within the shoot apical meristem: identity, arrangement and communication. Cellular
and Molecular Life Sciences. 76(6): 1067-1080.
Vatén, A., Dettmer, J., Wu, S., Stierhor, Y. D., Miyashima, S., Yadav, S.
R., …, and Helariutta, Y. (2011). Callose
biosynthesis regulates symplastic trafficking during root development. Developmental Cell. 21(6):
1144-1155.
Vázquez-Chimalhua, E., López-Bucio, J., Valencia- Cantero, E. y
Beltrán-Peña, E. (2018). Mecanismos moleculares que controlan el desarrollo de
los meristemos en plantas. En E. Beltrán-Peña, J. López-Bucio y M.
Martínez-Trujillo (Eds.), Fronteras en la biología: Señalización y
comunicación de las plantas (pp. 28-39). Morelia: Morevalladolid.
Vicente-Hernández,
A., Salgado-Garciglia, R., Valencia-Cantero, E.,
Ramírez-García, A., García-Juárez, P., and Macías-Rodríguez, L. (2019). Bacillus methylotrophicus
Ma-96 stimulates the growth of strawberry
(Fragaria X ananassa ‘Aromas’) plants in vitro and slows
Botrytis cinerea infection by two
different methods of interaction. Journal of Plant Growth Regulation.
38(3): 765-777.
Wang, A. (2021). Cell-to-cell movement of plant viruses via plasmodesmata:
a current perspective on potyviruses. Current Opinion in Virology. 48:
10-16.
Wang, Y. and Jiao, Y. (2023). Cell signaling in the
shoot apical meristem. Plant Physiology. 193(1): 70-82.
Wu, S. W., Kumar, R., Iswanto, A. B. B., and Kim, J. Y. (2018). Callose balancing at plasmodesmata. Journal of Experimental
Botany. 69(22): 5325-5339.
Zambryski, P. (2004). Cell-to-cell transport of proteins and fluorescent tracers via plasmodesmata during plant
development. Journal of Cell Biology. 164(2): 165-168.
Zambryski, P. and Crawford, K. (2000). Plasmo-desmata: gatekeepers for
cell-to-cell transport of developmental signals in plants. Annual Review of
Cell and Developmental Biology. 16: 393-421.
Zavaliev, R., Ueki, S., Epel, B. L., and Citovsky, V. (2011). Biology of
callose (ß-1,3-glucan) turnover at plasmodesmata. Protoplasma. 248:
117-130.
Zažímolová, E., Krecek, P., Skůpa, O., Hoyerová, K., and Patrásek, J.
(2007). Polar transport of the plant hormone auxin- the role of PIN-FORMED
(PIN) proteins. Cellular and Molecular Life Sciences. 64(13): 1621-1637.
Zhang, J. and Peer, W. A. (2017). Auxin homeostasis:
the DAO of catabolism. Journal of
Experimental Botany. 68(12): 3145-3154.
Zhang, Y., Yu. J., Xu, X., Wang, R., Liu, Y., Huang, S., …, and Wei, Z.
(2022). Molecular mechanisms of diverse auxin
responses during plant growth and development. International Journal of Molecular Science. 23(20):
12495.