https://doi.org/10.29059/cienciauat.v19i1.1846
Uso de plantas medicinales como una alternativa
para el tratamiento de la fasciolasis
Use of medicinal plants as an
alternative for the
treatment of fasciolasis
Plantas fasciolicidas
Joseline
Licona-Hernández, José Ignacio Olave-Leyva, Deyanira Ojeda-Ramírez*
*Correspondencia:
dojeda@uaeh.edu.mx/Fecha de recepción:
8 de noviembre de 2023/Fecha de aceptación: 6 de marzo de 2024/Fecha de
publicación: 30 de marzo de 2024
Universidad
Autónoma del Estado de Hidalgo, Instituto de Ciencias Agropecuarias, Área
académica de Medicina Veterinaria y Zootecnia, rancho Universitario avenida
Universidad km 1, Ex-Hacienda de Aquetzalpa, Tulancingo, Hidalgo, México, C. P.
43600.
RESUMEN
La fascioliasis es una enfermedad causada por gusanos planos,
parásitos de la clase trematoda y género Fasciola, que afecta a animales
y humanos. A pesar de su considerable impacto en
la salud pública y el sector pecuario, así como a su frecuente
reaparición, se encuentra entre las enfermedades tropicales desatendidas.
Aunado a ello, el uso indiscriminado de fasciolicidas
sintéticos en el ganado ha propiciado resistencia
de este trematodo a los antihelmínticos disponibles en el mercado, por lo que
es necesario contar con nuevas alternativas de tratamiento. El objetivo de este trabajo
fue analizar los avances recientes a nivel mundial sobre las plantas medicinales con efecto sobre Fasciola,
reportadas en las bases de datos PubMed,
Scopus, SciFinder y Google Scholar, entre enero de 2019 y julio de 2023.
Se encontraron reportes sobre el potencial
fasciolicida de 32 plantas, 7 de ellas con actividad sobre huevos, 3
sobre los estadios larvales, 1 sobre juveniles y el resto sobre el estadio
adulto del parásito. Dentro de los metabolitos secundarios responsables de la actividad farmacológica,
se han identificado monoterpenos, alcaloides,
ácidos grasos poliinsaturados
(PUFA’s), artemisina y compuestos fenólicos; destacando la curcumina y la timoquinona. Los resultados encontrados ponen de manifiesto el
potencial uso de las plantas como fuente de nuevos principios activos
fasciolicidas.
PALABRAS CLAVE: Fasciola,
plantas medicinales, extractos,
metabolitos secundarios.
ABSTRACT
Fascioliasis is a disease produced by
parasitic flatworms of the class trematoda
and genus Fasciola that affects animals and humans. Despite
its considerable impact on public health and the livestock, as well as its
frequent reappearance, it is among the neglected tropical diseases.
Furthermore, the indiscriminate use of synthetic fasciolicides in livestock has
led to resistance of this trematode to the anthelmintics available on the
market. For that, it is necessary to have new treatment alternatives. The aim
of this work was to analyze recent advances
worldwide on medicinal plants with an effect
on Fasciola, reported in PubMed, Scopus, SciFinder and Google Scholar databases, between January 2019 and July
2023. We found information of 32 fasciolicide plants: seven of them with
activity on eggs, three on larval stages, one
on juveniles, and the rest on the adult stage of the parasite. Among the secondary
metabolites responsible for the pharmacological activity, monoterpenes,
alkaloids, polyunsaturated fatty acids
(PUFA’s), artemisin and phenolic compounds have been identified, highlighting curcumin and thymoquine. The
findings reveal the potential use of plants as
a source of new fasciolicidal active ingredients.
KEYWORDS: Fasciola, medicinal plants, extracts, secondary
metabolites.

INTRODUCCIÓN
La fascioliasis es una zoonosis de alta
prevalencia causada por gusanos planos, parásitos de la clase trematoda y género Fasciola
(Lalor y col., 2021). La Organización Mundial de la Salud (OMS) estima que al
menos 2.4 millones de personas están infectadas en más de 70 países en todo el
mundo y otros 180 millones tiene riesgo de infección (Lalor y col., 2021; Opio
y col., 2021).
En el ámbito económico, la incidencia de fasciolasis ocasiona pérdidas en el rendimiento de carne (ovinos, caprinos y bovinos) (Encinas-García y col., 2020). La presencia de
parasitosis en estos organismos, provocados por dos especies del género Fasciola,
identificados como los agentes causales de la enfermedad F. hepatica y F. gigantica (Machado-Pereira-da-Silva
y col., 2020), produce mermas en el
rendimiento de la carne estimadas entre el 8 % y 28 %, pérdidas por
decomiso de los hígados en los rastros y una
disminución en la producción láctea (20 % a 80 %) (González-Garduño y
col., 2019).
La estimación global de las pérdidas anuales sufridas por la industria ganadera
en México en el año 2013, debido a hígados confiscados como resultado de la fascioliasis causada por F. hepatica fue de $ 55 076 671 pesos;
y sumándole el efecto que provocaron las pérdidas a los productores ganaderos
de carne y leche en México, la pérdida total
ascendió a $ 1 701 786 489 pesos (Rodríguez-Vivas y col., 2017).
F. hepatica
predomina en América y regiones de clima templado, y F. gigantica en regiones tropicales
de Asia y África (Machado-Pereira-da-Silva y
col., 2020; Opio y col., 2021). A pesar
de su considerable impacto en la salud pública y el sector pecuario, la
fascioliasis se encuentra entre las enfermedades tropicales desatendidas (Lalor
y col., 2021).
La infección de los seres humanos se produce a través del consumo de pescado de agua
dulce, crustáceos y plantas acuáticas, ingeridos crudos o insuficientemente
cocidos (Vale y col., 2020); mientras que la
principal fuente de transmisión de estos parásitos en los animales es el pasto contaminado por las heces
de animales infectados; además, dentro del ciclo biológico intervienen los
caracoles de agua dulce del género Lymnaea spp como hospedadores
intermediarios, los cuales liberan la forma infectante denominada metacercaria (Figura 1) (Pinilla y col., 2020; Lalor
y col., 2021).
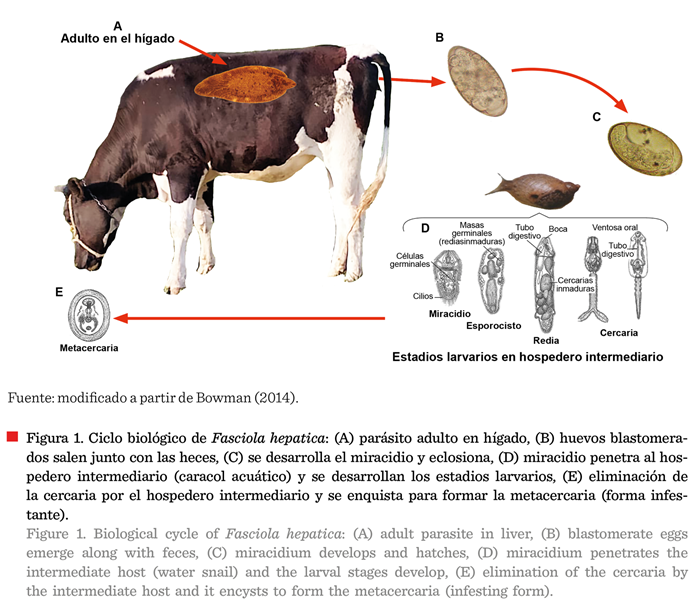
En los animales, este parásito causa lesiones principalmente
en hígado y la signología clínica es gastrointestinal, secundaria a la afectación hepática por la presencia de los estadios juveniles y adultos. En el ser humano los síntomas, en caso de que se produzcan, son múltiples
y variados, como disminución en la absorción
de alimentos, colangitis, colecistopatía crónica, dolor abdominal
localizado en el epigastrio, meteorismo, fiebre, hepatomegalia, náuseas,
anorexia e ictericia (López-Villacís y col., 2017).
La prevención de la fascioliasis se basa en el control del hospedador intermediario; mientras que el tratamiento farmacológico para los humanos y animales infectados se basa en
el uso de fasciolicidas sintéticos (benzimidazoles, fenoles halogenados,
salicilanidinas y sulfonamidas)
(Castro-Hermida y col., 2021); sin embargo, el uso indiscriminado de
éstos en los animales ha generado mecanismos de resistencia en ambas especies del género Fasciola,
provocando que los tratamientos convencionales sean menos efectivos.
Existen reportes de resistencia de F. hepatica y F.
gigantica a benzimidazoles (albendazol, triclabendazol) y salicilanilidas
(closantel y rafoxanida) en ovinos y bovinos (Mas-Coma y col., 2019;
Machado-Pereira-da-Silva y col., 2020; Abdel-Fatah y col., 2022). Aunque no se
ha determinado aún con certeza el mecanismo de la resistencia de F. hepatica
al triclabendazol, los hallazgos científicos apuntan a cambios en la estructura
de la tubulina en los individuos resistentes, que hacen que el triclabendazol o el albendazol no logren actuar sobre ella
como lo hace en los individuos susceptibles (Mas-Coma y col., 2019). Además,
estos fármacos sintéticos tienen la desventaja de generar residuos en la carne
y leche, así como en el medio ambiente (López-Villacís y col., 2017; Machado-Pereira-da-Silva
y col., 2020).
Las plantas medicinales y sus metabolitos
secundarios son candidatos prometedores para
el tratamiento y control de parasitosis en el reino animal, y que además pueden
tener ciertos beneficios sobre los tratamientos veterinarios contemporáneos,
como la susceptibilidad reducida a la resistencia parasitaria, la asequibilidad, la falta de efectos adversos,
la fácil accesibilidad y la disminución de residuos en productos animales y el
medio ambiente (Ahmed y col., 2023; Štrbac y
col., 2023). Gamulo y col. (2022),
realizaron una revisión y metaanálisis de plantas tropicales con efecto in vitro sobre Fasciola,
en éste se incluyeron 10 especies vegetales del trópico (Areca catechu, Berlinia confusa, Buchholzia
coriaceae, Capparis decidua, Cleome
rutidos-perma, Dioscorea bulbifera, Dregea volubilis, Gynandropsis gynandra,
Moringa oleífera y Zingiber
officinale), dejando de lado la información
referente a la actividad fasciolicida in vivo de estas plantas, así
como el potencial efecto fasciolicida
de plantas del resto del mundo.
El objetivo del presente trabajo fue
establecer los
avances recientes a nivel mundial sobre plantas medicinales y sus
componentes con actividad sobre
tremátodos del género Fasciola, evaluadas en modelos in
vitro e in vivo, que no fueron incluidas en el estudio de
Gamulo y col. (2022).
Datos colectados
Se consultaron las bases de datos PubMed, Scopus, SciFinder y Google Scholar. Se usaron las palabras
clave “Fasciola hepatica”, “Fasciola
spp”, “Fasciola gigantica”; “plantas”, “plants”, “extractos”,
“extracts”, “componentes” y “compounds”. Se
encontraron 30, 35, 47 y 254
artículos, respectivamente, publicados entre enero de 2019 y julio de
2023. De ellos, 54 fueron elegibles de
screening (examinación) considerando el título. Después, se revisó
el abstract. Se detectaron 15 artículos repetidos y 20 no cumplieron con los
criterios de elegibilidad. Finalmente, se
incluyeron 19 artículos en la
revisión. Los criterios de inclusión de los artículos fueron: publicaciones en
las que se evaluara la actividad de
extractos de plantas sobre F. hepatica y/o F. gigantica en
ensayos in vitro o in vivo, y artículos
en los que se reportara el efecto de metabolitos secundarios obtenidos
de plantas con actividad contra F. hepatica y/o F. gigantica.
Los criterios de exclusión fueron: artículos donde se reportara el
efecto fasciolicida in vitro de las especies reportadas en el metanálisis
publicado por Gamulo y col. (2022); y artículos donde no se mencionara las
concentraciones o dosis empleadas.
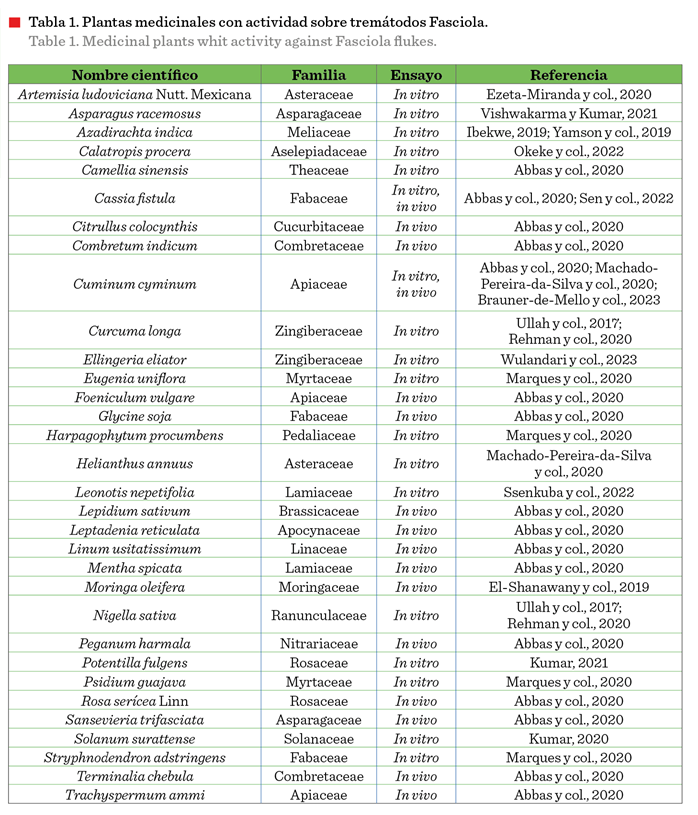
Identificación de especies
Se encontró que 32 plantas de 21 familias
botánicas (Tabla 1) poseen efecto sobre
alguna de las dos especies del género Fasciola, en uno o varios de sus
estadios, lo cual pone de manifiesto la eficacia y potencial uso de las plantas medicinales para tratar dicha zoonosis.
El efecto de estas plantas sobre F. hepatica y F. gigantica, se
dividió en tres categorías: plantas con actividad fasciolicida in vitro,
plantas medicinales evaluadas in vivo y metabolitos secundarios puros
aislados de plantas con efecto fasciolicida.
A su vez, dentro de la primera, se elaboró una clasificación de acuerdo con el estadio del parásito en el cual se realizó el ensayo.
Plantas medicinales con actividad fasciolicida in vitro
Actividad sobre huevos
Cuminum cyminum y Helianthus annuus han sido reportadas sobre huevos
de F. hepatica. En dos estudios realizados en Brasil
(Machado-Pereira-da-Silva y col., 2020; Brauner-de-Mello y col., 2023), el
aceite esencial obtenido de semillas de C. cyminum L. (AECc) fue capaz de disminuir el 100 % de la eclosión de los
huevos a concentración de 0.031 mg/mL y
superiores, tras 14 d de exposición. Mientras que el aceite esterificado obtenido de semillas de H. annuus L.
(AEHa) mostró su máximo efecto sobre la
inhibición (58 %) de la eclosión a una concentración de 2.3 mg/mL. Un
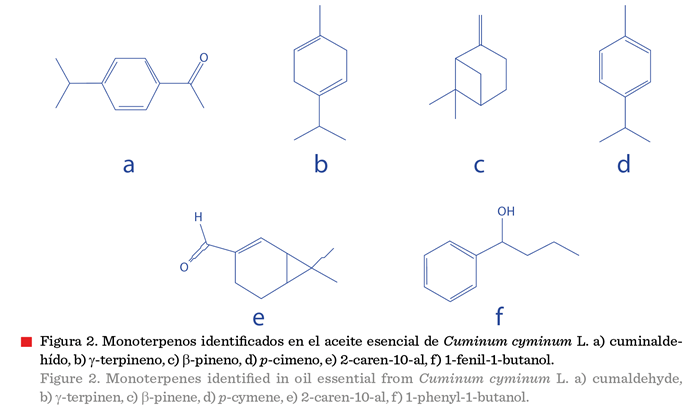
análisis por cromatografía de gases reveló que el AECc se encontraba
constituido principalmente por los monoterpenos [cuminaldehído (26.8 %), g-terpineno
(15.24 %), b-pineno (10.75 %) y p-cimeno (5.56 %)], así como 2-caren-10-al (22.17 %) y 1-fenil-1-butanol (19.47 %) (Figura 2) (Machado-Pereira-da-Silva y col., 2020; Brauner-de-Mello y col., 2023); mientras
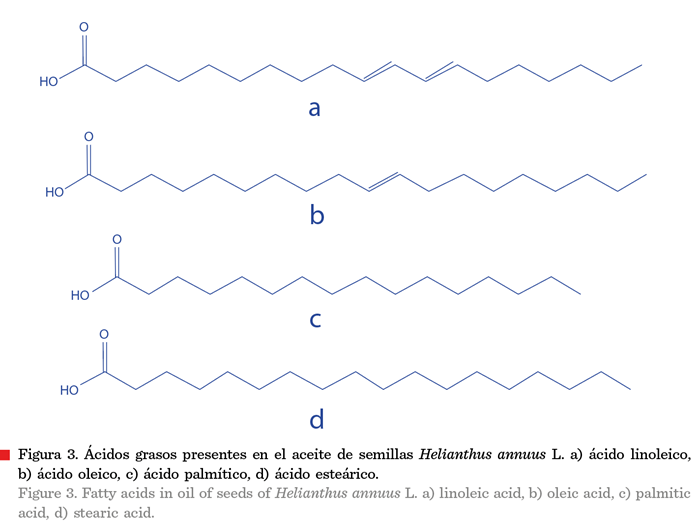
que el AEHa contenía a los ácidos grasos
poliinsaturados (PUFA’s, por sus siglas en inglés: poly unsaturated fatty acids)
linoleico(53.64 %), oleico
(35.80 %), palmítico (5.79 %) y esteárico (4.11 %) (Figura 3), como componentes
mayoritarios (Machado-Pereira-da-Silva y col., 2020).
El mecanismo de acción antiparasitario de los aceites
esenciales y sus terpenos constituyentes está poco estudiado. Sin embargo, se
ha estipulado que al ser moléculas lipofílicas y relativamente pequeñas pueden
atravesar la membrana del parásito e interactuar con las proteínas, inactivar
enzimas y afectar la actividad celular (Morais y col., 2020). Se ha observado
que los aceites esenciales son capaces de inhibir la enzima acetilcolinesterasa
en nemátodos parásitos, generando un incremento
en los niveles del neurotransmisor de acetilcolina (Ach), provocando así
una estimulación excesiva de los receptores nicotínicos de Ach; asimismo un
alto nivel de Ach causa contracción muscular y
parálisis espástica de algunos nemátodos a través de la entrada de Na+,
K+ o Ca2+ y la despolarización de la membrana (Lam y
col., 2020). Por otra parte, se ha evidenciado que los PUFA’s pueden afectar la
integridad de la membrana superficial de trematodos y los receptores de
neurotransmisores ionotrópicos de helmintos (Bonde y col., 2021).
En otro estudio, realizado también en Brasil, se evalúo el efecto de extractos etanólicos obtenidos
de hojas de Eugenia uniflora y Psidium
guajava, raíz de Harpagophytum
procumbens y corteza de Stryphnodendron adstringens, a concentraciones de 1 mg/mL, 2.5 mg/mL y 5
mg/mL, sobre huevos de F. hepatica. Todos los extractos mostraron un
impacto sobre los huevos, algunos inhibieron la eclosión y otros la formación
de miracidio (cría). La mayor eficacia (100
%) se obtuvo con los extractos de S.
adstringens y E. uniflora a 1 mg/mL. Los autores atribuyeron la inhibición de eclosión, así como la alteración del miracidio, a la
presencia de taninos en las plantas,
ya que estos compuestos pueden unirse
a proteínas u otras macromoléculas, o bien a algunos cofactores
enzimáticos (Marques y col., 2020). Dicho efecto fue mayor al observado en Nigeria para el extracto hidroalcohólico (EtOH:H2O
70:30 v/v) de hojas de Calotropis
procera y nanopartículas de plata
funcionalizadas con este extracto, donde el mismo inhibió la eclosión de
huevos de Fasciola spp (CL50 = 1.49 mg/mL y CL90
= 8.42 mg/mL) pero no tuvo impacto
sobre el miracidio; mientras que las nanopartículas fueron efectivas en
ambos casos (CL50 = 0.47 mg/mL y
CL90 = 3.34 mg/mL sobre la
eclosión de huevos; CL50 = 0.30 y CL90 = 0.84 mg/mL sobre el miracidio) (Okeke y
col. ,2022). Los autores adjudicaron
la actividad de reacción del extracto a la presencia de saponinas y taninos que pudieron haber penetrado en los huevos y
detener la eclosión; mientras que el mayor efecto de las nanopartículas
pudo deberse a una mayor dispersión y
liberación del extracto en los huevos.
Finalmente, en Indosesia se evalúo el efecto ovicida del extracto hidroalcohólico (EtOH:H20
96:04 v/v) de flores de Etlingera elatior sobre huevos de
F. gigantica (Wulandari y col., 2023). En ese estudio se demostró que dicho
extracto a una concentración de 50 mg/mL, inhibe el desarrollo de los
blastómeros, propiciando una incompleta formación del miracidio; además de
dañar la membrana del huevo. Esta consecuencia se observó a los 11 d
postratamiento. Los autores atribuyeron el
efecto farmacológico a la presencia de ácido tánico, alcaloides,
saponinas y flavonoides en el extracto; sin embargo, no ha sido demostrado.
Las diferencias en los efectos
observados en los estudios analizados pueden ser atribuidas al contenido
metabólico en las plantas, así como a la capacidad de extracción de estos
compuestos por el solvente utilizado para la obtención de los extractos (Kapadia
y col., 2022).
Actividad sobre esporocito, redia y cercaria
Recientemente, se demostró el efecto sobre el esporocito,
redia y cercaria de F. gigantica de las hojas de Solanum surattense
(Kumar, 2020), así como de la raíz de Asparagus racemosus (Vishwakarma y Kumar, 2021) y Potentilla fulgens
(Kumar, 2021). En esos trabajos, se evalúo el potencial fasciolicida del
material vegetal (hoja o raíz) pulverizado,
así como de 5 extractos orgánicos obtenidos de ambos, utilizando éter,
cloroformo, acetona, etanol o metanol). También usaron una fracción etanólica
extraída de hojas pulverizadas de S. surattense o la raíz pulverizada de
A. racemosus o P. fulgens, la que sometieron a un proceso de purificación mediante cromatografía en columna
abierta, utilizando gel de sílice como fase estacionaria y etanol como
fase móvil. Posteriormente, el etanol fue eliminado del eluato a través
de evaporación a presión reducida, y el
sólido resultante se consideró como una fracción menos compleja para
cada una de las las 3 plantas. Todos los tratamientos mostraron toxicidad sobre
el trematodo en sus 3 estadios larvales de forma dependiente de la dosis y del
tiempo de exposición, pero el mejor efecto
se observó con los extractos y fracciones polares donde se utilizó
etanol como solvente. Las 3 plantas presentaron
un efecto similar con valores de CI50 = 44.5 mg/mL a CI50
= 79.93 mg/mL, y la máxima eficacia se obtuvo
tras 8 h de exposición del parásito a los
tratamientos. Para S. surattense y P. fulgens la mayor actividad farmacológica sobre los 3 estadios (esporocito, redia y cercaria) se obtuvo con la
fracción etanólica menos compleja (CL50 = 48.25 mg/mL, 47.61 mg/mL y 44.15 mg/mL; y CL50 =
54.20 mg/mL, 49.37 mg/mL y
38.13 mg/mL, respectivamente); mientras que para la especie A. racemosus,
el extracto etanólico fue el más eficaz (CL50 = 51.9 mg/mL, 48.05 mg/mL y 49.76 mg/mL sobre larva esporocistica, redial y cercaria, respectivamente). La extracción etanólica
(directa o por cromatografía en columna) mostró mayor actividad fasciolítica,
lo que sugiere que este solvente facilita la disolución de compuestos capaces
de difundirse en el parásito, hasta acumularse a concentraciones tóxicas; o
bien, a la transformación de dichos compuestos
en otras especies tóxicas por las enzimas
del parásito. Sin embargo, esto no ha sido confirmado.
Actividad sobre estadio juvenil y adulto
Se han utilizado extractos íntegros producidos mediante el
uso de solventes polares independientes, como
metanol, etanol o mezclas alcohol: agua; o bien a través de
procedimientos de extracción secuencial del
material vegetal con solventes de polaridad creciente (n-hexano <
acetato de etilo (AcOEt) < acetona <
etanol(EtOH) < metanol), para obtener así extractos menos complejos y
con metabolitos secundarios afines al solvente
utilizado. Además, los modelos farmacológicos
empleados se basan en determinar el efecto de los extractos sobre la
motilidad, muerte y/o daños generados al
tegumento del parásito (Ezeta-Miranda y col, 2020; Sen y col., 2022; Wulandari y col., 2023).
Artemisia ludoviciana Nutt. Mexicana, es una planta medicinal con actividad sobre
estadio juvenil de trematodos Fasciola. En un estudio realizado en
México por Ezeta-Miranda y col. (2020), en el que se hizo una extracción
secuencial de las hojas de esta planta mediante maceración, utilizando hexano como primer disolvente, seguido de
acetato de etilo y metanol, los extractos más
polares (metanol y acetato de etilo) fueron los más activos sobre
juveniles recién exquistados de F.
hepatica (100 % de eficacia a 0.125
mg/mL y 24 h de exposición); mientras que el extracto hexánico mostró su
máximo efecto a las 72 h. Además, el extracto de acetato de etilo causó una disrupción de la ventosa oral y
discontinuidad de las espinas circundantes en la superficie del parásito.
Mediante un estudio químico biodirigido, del extracto de acetato de etilo,
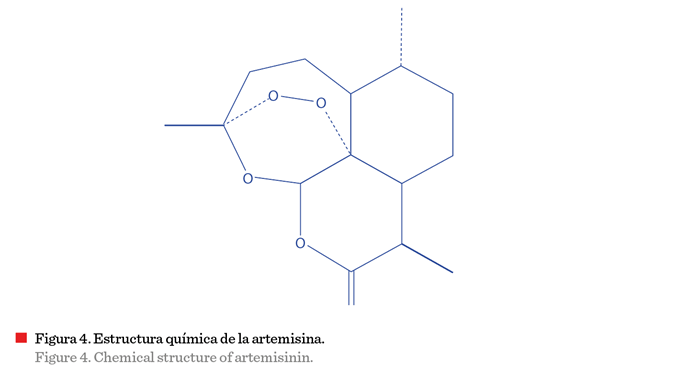
establecieron a la lactona sesquiterpénica artemisina (Figura 4) como el principio fasciolicida presente en las hojas
de A. ludoviciana.
El efecto farmacológico exhibido por los extractos está
influenciado por el solvente utilizado para la extracción, el lugar de colecta
del material vegetal, así como la concentración empleada en el ensayo. Prueba de ello, es el efecto trematocida de
las hojas de Azadirachta indica sobre F. hepatica. En un estudio realizado en Filipinas se evalúo un extracto hidroalcohólico (EtOH:H2O
80:20 v/v) obtenido de esta
especie vegetal, el cual no mostró actividad sobre el trematodo a las concentraciones evaluadas (100 mg/mL a 400
mg/mL) (Yamson y col., 2019); mientras que en un estudio realizado en Nigeria,
el extracto acuoso de estas hojas tuvo una CL50
= 1.44 mg/mL tras 5 h de exposición (Ibekwe, 2019).
Otra planta con actividad sobre parásitos
Fasciola adultos es Cassia fistula, cuyo extracto hidroalcohólico (EtOH:H2O 70:30, v/v)
administrado a una concentración de 50 mg/mL y 15 h de exposición, generó alteraciones (hinchazón, vacuolización y pérdida de espinas)
en el tegumento de estos parásitos, provocando
así su muerte. Sen y col. (2022) mencionaron que dicho efecto puede
deberse a un desequilibrio iónico e hídrico causado posiblemente por el
contenido de saponinas y alcaloides en la planta. Un efecto similar se observó en Indonesia para Ellingeria elatior, donde parásitos adultos de F. gigantica, tratados
con un extracto hidroalcohólico (EtOH:H2O 96:04 v/v) de
flores de esta especie, a una concentración de 200 mg/mL y 80 h de exposición,
mostraron daño en el tegumento, separación de éste con la cutícula, plegamiento
del acetábulo y ventosa ventral, erosión completa y pérdida de la columna en
las partes ventral y dorsal, así como pérdida de epitelio en los intestinos del
parásito (Wulandari y col., 2023).
Parásitos con el tegumento dañado son más susceptibles a los
tratamientos antiparasitarios, pues los fármacos pueden percolar afectando
diversos tejidos y procesos internos de las
fasciolas. En general, se ha establecido que la disrupción del tegumento
puede afectar el transporte de Na+ y K+ dependiente de
energía, incrementando así los niveles de Na+ y agua, lo que conduce
a la inflamación del sincitio en el parásito, reduciendo así su motilidad. Además, el daño tegumentario afecta
los procesos excretores/secretores, la captación
transtegumentaria, altera las vías de señalización y perturba los
procesos metabólicos en el parásito
(Faixová y col., 2021).
Los extractos hidroalcohólicos (EtOH:H2O
70:30, v/v) y acuosos, obtenidos de
hojas de Leonotis nepetifolia, poseen toxicidad sobre F. gigantica
adultos. Siendo el extracto acuoso el más activo (CL90 = 4.435
mg/mL, tras 5.51 h de exposición). Los autores atribuyeron este efecto a una mayor
concentración de taninos en el extracto acuoso comparado con
el etanólico (0.236 ± 0.002 mg/mL y 0.005 ±
0.001 mg/mL, respectivamente) (Ssenkuba y col., 2022). El efecto
antihelmíntico de los taninos, se ha asociado con su capacidad de formar
complejos con proteínas y alterar la alimentación, la motilidad, la fecundidad;
además de una variedad de funciones bioquímicas mediadas por enzimas en los
nemátodos. También, pueden causar daños físicos a las estructuras internas y externas
de los parásitos, induciendo su muerte (Acevedo-Ramírez y col., 2019).
Se ha evaluado el efecto adulticida de aceites esenciales sobre trematodos del género Fasciola.
Brauner-de-Mello y col. (2023), reportaron que el aceite esencial de C.
cyminum, a una concentración de 0.062 mg/mL y 15 h de exposición, inactivó
a la totalidad de parásitos adultos de F. hepatica tratados. Además,
dañó el tegumento en toda la superficie del trematodo, generando una marcada
vacuolización cerca de la lámina basal del sincitio tegumentario, y una gran
cantidad de microvesículas alrededor de las espinas.
Los autores atribuyeron dicho efecto a la presencia del monoterpeno
cuminaldehído (Figura 2a), principal
constituyente de este aceite esencial, que induce daño físico mediado por estrés oxidativo y conduce a la muerte de otros helmintos.
Plantas medicinales con actividad
fasciolicida in vivo
El efecto de plantas medicinales sobre trematodos del género Fasciola,
en modelos in vivo ha sido poco estudiado. En este trabajo sólo se
encontraron dos reportes, el primero realizado
por El-Shanawany y col. (2019), donde el extracto acuoso de hojas de Moringa
oleifera fue administrado vía oral a una dosis de 150 mg/kg cada 48 h
durante 21 d, a ovejas coinfectadas naturalmente con F. gigantica y Clostridium
novyi. El extracto logró el 99 % de disminución de presencia de huevos, en
las heces de los animales con alta carga
parasitaria, al día 21. Además, propició una degeneración de los huevos
y la presencia de un embrión oscuro después de la primera dosis de tratamiento;
y al final del experimento, el huevo se mostró vacío, sin células ni embrión.
De igual manera, se observó una mayor ganancia de peso (± 4 kg), así como una
disminución de los niveles séricos de IgG, IL-2, IL-7 e IL-10 en los animales
que recibieron el extracto, comparado con el
grupo control. Los autores adjudicaron dichos efectos, a la presencia de
saponinas, taninos y flavonoides en el
extracto; sin embargo, esto no ha sido demostrado.
Abbas y col. (2020), evaluaron en cabras infectadas
naturalmente con F. hepatica, la eficacia de una mezcla de 17 plantas
molidas: Mentha spicata, Combretum indicum, Terminalia
chebula, Rosa serícea, Foeniculum vulgare, Trachyspermum ammi, Cuminum cyminum,
Glycine soja, Sansevieria trifasciata, Cassia fistula, Sweria L, Linum
usitatissimum, Peganum harmala, Leptadenia reticulata, Camellia sinensis,
Lepidium sativum y Citrullus colocynthis. La mezcla herbal fue
suministrada vía oral en 3 dosis distintas según el grupo de estudio (1 g/kg,
1.2 g/kg, y 1.4 g/kg) los días 0, 7, 14 y 21. Todos los tratamientos redujeron
la cantidad de huevos en las heces, siendo
la dosis más alta, la más activa (82.33 % de reducción a los 30 d).
Además, las cabras de este grupo no mostraron
signos de toxicidad y tuvieron una ganancia de peso del 4.05 % (5 veces
más comparado con el grupo control), así como un incremento en el conteo de
eritrocitos, llenado capilar y concentración de hemoglobina.
Metabolitos secundarios puros obtenidos de plantas con actividad sobre Fasciola gigantica
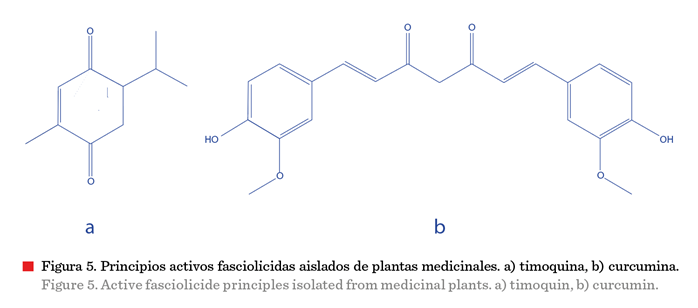
Timoquina y curcumina (Figura 5), han demostrado actividad in
vitro sobre F. gigantica. El primero es un derivado monoterpénico y
componente principal del aceite esencial de semillas
de Nigella sativa; mientras que la curcumina es el principal
curcuminoide del rizoma de Curcuma longa (Ullah y col., 2017). Ambos
compuestos inducen la formación de especies reactivas de oxígeno (ERO) en los parásitos, de forma dependiente de la concentración,
siendo mayor el efecto observado para la timoquinona, al duplicar la
concentración de ERO, comparado con el control. Además, ambos compuestos a una
concentración de 60 mM incrementaron la condensación de la cromatina en las
células un 60 % y 20 %, respectivamente. El nivel de condensación de la
cromatina, así como la fragmentación del ADN
en el núcleo celular, son marcadores claves de inducción a la apoptosis
(Rehman y col., 2020). En el mismo estudio se evidenció que la curcumina es
capaz de fragmentar el ADN en las células
del trematodo, e inhibir en un 80 % la expresión del gen GST, el cual
está involucrado en el proceso de desintoxicación,
al ayudar a la conjugación del glutatión con compuestos xenobióticos.
CONCLUSIONES
Las plantas medicinales representan actualmente una
alternativa potencial para el control de la fascioliasis. Sus metabolitos
secundarios, son capaces de producir varios efectos contra los parásitos, como
reducción en la eclosión del huevo,
fertilidad y alimentación,
interrupción del desarrollo y daños estructurales, que inducen su
muerte. Sin embargo, en algunos casos, como E.
uniflora, S. adstringens, P. fulgens, A. racemosus y C. fistula
aún faltan realizar estudios químicos para identificar los principios
activos responsables de la actividad trematocida.
Además, en la mayoría de los estudios, se encontró que la actividad antiparasitaria de los extractos depende del
lugar de colecta de la planta, tipo de extracto, la concentración, así como del
tiempo en que se exponen las fasciolas. La evidencia de la actividad
fasciolicida in vivo es reducida respecto a las investigaciones del
efecto de los extractos de plantas y/o compuestos puros sobre F. hepatica
y F. gigantica en modelos in vitro, por lo que es necesario el
desarrollo de protocolos para determinar su seguridad y eficacia terapéutica
previo al desarrollo de fitomedicamentos seguros y eficaces que reemplacen el
uso de fasciolicidas sintéticos en el tratamiento de esta enfermedad, lo que constituye un gran reto para la comunidad
científica internacional.
DECLARACIÓN DE CONFLICTO DE
INTERESES
Los autores declararon no tener
conflictos de intereses de ningún tipo.
Referencias
Abbas, R. Z., Zaman, M. A., Sindhu, Z.
U. D., Sharif, M., Rafique, A.,
Saeed, Z., Rehman, T. U., Siddique, F., Zaheer, T., Khan, M. K., Akram, M. S.,
Chattha, A. J., Fatima, U., Munir, T., &
Ahmad, M. (2020). Anthelmintic
effects and toxicity analysis of herbal dewormer
against the infection of Haemonchus contortus and Fasciola
hepatica in goat. Pakistan Veterinary Journal, 40(4), 455-460. http://dx.doi.org/10.29261/pakvetj/2020.083
Abdel-Fatah, O. R., Arafa, W. M.,
Wahba, A. A., & El‑Dakhly, K. M.
(2022). Tegumental alterations and resistance of Fasciola gigantica adult worms
exposed to flukicides in Egypt. Beni-Suef
University Journal of Basic and Applied Sciences, 11, 106.
https://doi.org/10.1186/s43088-022-00287-z
Acevedo-Ramírez, P. M. D. C., Hallal-Calleros, C.,
Flores-Pérez, I., Alba-Hurtado, F., Mendoza-Garfías, M. B., Castro-Del-Campo,
N., & Barajas, R. (2019). Anthelmintic
effect and tissue alterations induced in vitro by hydrolysable tannins
on the adult stage of the gastrointestinal nematode Haemonchus contortus.
Veterinary Parasitology, 266, 1-6. https://doi.org/10.1016/j.vetpar.2018.12.008
Ahmed, H., Kilinc, S. G., Celik, F.,
Kesik, H. K., Simsek, S., Ahmad, K. S., Afzal, M. S., Farrakh, S., Safdar, W.,
Pervaiz, F., Sadia, L., S., Zhang, J., & Cao, J. (2023). An inventory of anthelmintic plants across the globe. Pathogens,
12, 131. https://doi.org/10.3390/pathogens12010131
Bonde, C. S., Bornancin, L., Lu, Y., Simonsen, H. T.,
Martínez-Valladares, M., Peña-Espinoza, M., Mejer, H., Williams, A. R., &
Thamsborg, S. M. (2021). Bioguided
fractionation and molecular networking reveal fatty acids to be principal
anti-parasitic compounds in Nordic seaweeds. Frontiers in Pharmacology,
12, 674520. https://doi.org/10.3389/fphar.2021.674520
Bowman, D. D. (2014). Georgis´
Parasitology for Veterinarians. (Ninth edition). Elsevier. 77 Pp.
Brauner-de-Mello, A., Baccega, B., Obelar-Martins, F.,
Ignês-de-Santi, I., Islabão, Y. W., de-Giacometi, M., Pereira-Soares, M., da-Rosa-Farias, N. A., & Belmonte-Oliveira,
C. (2023). Activity
of cumin essential oil to control fascioliasis: Efficacy and changes in the
tegument of Fasciola hepatica. Experimental parasitology, 252, 108587. https://doi.org/10.1016/j.exppara.2023.108587
Castro-Hermida, J. A., González-Warleta,
M., Martínez-Sernández, V., Ubeira, F. M., & Mezo, M. (2021). Current
challenges for Fasciolicide treatment in ruminant livestock. Trends in
Parasitology, 37(5), 430-444.
https://doi.org/10.1016/j.pt.2020.12.003
El-Shanawany, E. E., Fouad, E. A.,
Keshta, H. G., Hassan, S. E., Hegazi, A. G., & Abdel-Rahman, E. H. (2019).
Immunomodulatory effects of Moringa oleifera leaves aqueous extract in
sheep naturally coinfected with Fasciola gigantica and Clostridium
novyi. Journal of Parasitic
Diseases, 43, 583-591. https://doi:10.1007/s12639-019-01130-6
Encinas-García, R., Quiroz-Romero, H., Guerrero-Molina, C. y
Ochoa-Galván, P. (2020). Frecuencia de fasciolasis hepática e impacto económico
en bovinos sacrificados en Ferrería, México, D.F. Veterinaria México OA,
7(3), 928. https://doi.org/10.22201/fmvz.24486760e.2020.3.928
Ezeta-Miranda, A., Vera-Montenegro, Y.,
Avila-Acevedo, J. G., García-Bores, A. M.,
Estrella-Parra, E. A., Francisco-Marquez, G., & Ibarra-Velarde, F. (2020). Efficacy of purified fractions of Artemisia
ludoviciana Nutt. mexicana and ultraestructural damage to newly
excysted juveniles of Fasciola hepatica in vitro. Veterinary
Parasitology, 285, 109184. https://10.1016/j.vetpar.2020.109184
Faixová, D., Hrčková, G., Kubašková,
T. M., & Mudroňová, D. (2021). Antiparasitic effects of selected isoflavones on flatworms. Helminthologia, 58,
1-16. https://doi.org/10.2478/helm-2021-0004
Gamulo, J. V., Bolina, M. P., Brion, J. S., Rosa, V. C. N.
D., Maglaya, R. F., Tan, C. L., & Chang, A. C. (2022). Fascioliasis phytotherapy using tropical plant extracts: a systematic review
with meta-analysis. The Journal of Advances in Parasitology, 9(1),
12-28. http://dx.doi.org/10.17582/journal.jap/2022/9.1.12.28
González-Garduño, R., Hernández-Hernández, J. D. C., Torres-Hernández, G. y Ortiz-Pérez, D. O.
(2019). Comportamiento hematológico de bovinos infectados por trematodos
en un clima cálido húmedo de México. Pastos y Forrajes, 42(3), 197-201.
Ibekwe, H. A. (2019). In vitro anthelmintic activities of
aqueous crude extract of Azadirachta indica on Paramphistomum cervi and Fasciola
hepatica. International Journal of Veterinary Sciences and Animal Husbandry,
4(1), 14-18.
Kumar, P. (2020). Helminth control: In
vitro anthelmintic and larvicidal activities of Solanum surattense
against Fasciola gigantica (Sporocyst, Redia, and Cercaria) larvae. International
Journal of Medical Parasitology and Epidemiology Sciences, 1(4), 85-90. https://doi.org/10.34172/ijmpes.2020.24
Kapadia, P., Newell, A. S.,
Cunningham, J., Roberts, M. R., & Hardy, J. G. (2022). Extraction of
highvalue chemicals from plants for technical and medical applications. International
Journal of Molecular Sciences, 23(18), 10334. https://doi.org/10.3390/ijms231810334
Kumar, P. (2021). Medicinal plant Potentilla
fulgens and its effect in vitro against Fasciola gigantica.
Insights Clin Cell Immunology, 5, 4-7. https://doi.org/10.29328/journal.icci.1001018
Lam, N. S., Long, X., Su, X. Z.,
& Lu, F. (2020). Melaleuca alternifolia (tea tree) oil and its
monoterpene constituents in treating protozoan and helminthic infections. Biomedicine
& Pharmacotherapy, 130, 110624. https://doi.org/10.1016/j.biopha.2020.110624
Lalor, R., Cwiklinski, K., Calvani, N. E. D., Dorey, A.,
Hamon, S., Corrales, J. L., Dalton, J. P., & De-Marco Verissimo, C. (2021). Pathogenicity and virulence of the
liver flukes Fasciola hepatica and Fasciola gigantica that cause the
zoonosis Fasciolosis. Virulence, 12(1), 2839-2867. https://doi.org/10.1080/21505594.2021.1996520
López-Villacís, I. C., Artieda-Rojas, J. R., Mera-Andrade, R.
I., Muñoz-Espinoza, M. S., Rivera-Guerra, V. E., Cuadrado-Guevara, A. C.,
Zurita-Vásquez, J. H. y Montero-Recalde, M. A. (2017). Fasciola hepatica:
aspectos relevantes en la salud animal. Journal of the Selva Andina Animal Science. 4(2), 137-146.
Machado-Pereira-Da-Silva, M. A., Zehetmeyr, F. K., Pereira,
K. M., Pacheco, B. S., Freitag, R. A., Pinto,
N. B., Machado, R. H., Villarreal-Villarreal, J. P., de-Oliveira-Hubner,
S., Aires-Berne, M. E., & da-Silva-Nascente,
P. (2020). Ovicidal
in vitro activity of the fixed oil of Helianthus annus L. and the
essential oil of Cuminum cyminum L. against Fasciola hepatica
(Linnaeus, 1758). Experimental
Parasitology, 218, 107984. https://doi.org/10.1016/j.exppara.2020.107984
Marques, L. T., Guedes, R. A., Rodrigues, W. D., Archanjo, A. B., Severi, J. A., & Martins, I.
V. F. (2020). Chemical
composition of various plant extracts and their in vitro efficacy in
control of Fasciola hepatica eggs. Ciência Rural, 50(5), e20190363. https://doi.org/10.1590/0103-8478cr20190363
Mas-Coma, S., Valero, M. A., &
Bargues, M. D. (2019). Fascioliasis. Advances in
Experimental Medicine and Biology, 1154, 71-103. https://doi.org/10.1007/978-3-030-18616-6_4
Morais, M. C., Souza, J. V., da-Silva-Maia-Bezerra-Filho, C.,
Dolabella, S. S., & Sousa, D. P. (2020). Trypanocidal
essential oils: A review. Molecules, 25(19), 4568. https://doi.org/10.3390/molecules25194568
Okeke, I. J., Oyeyemi, O. T., &
Morenikeji, O. A. (2022). Ovicidal and miracicidal activities of Calotropis
procera and its green-synthesized nanotized derivative: A quest for new antifasciola agents. Acta tropica, 236,
106700. https://doi.org/10.1016/j.actatropica.2022.106700
Opio, L. G., Abdel‑Fatah, E. M., Terry, J., Odongo, S., & Okello, E. (2021).
Prevalence of
Fascioliasis and associated economic losses in cattle slaughtered at Lira
municipality Abattoir in Northern Uganda. Animals (Basel),
11, 681. https://doi.org/10.3390/ani11030681
Pinilla, J. C., Florez-Muñoz, A. A., & Uribe-Delgado, N. (2020). Prevalence and risk factors
associated with liver fluke Fasciola hepatica in cattle and sheep in three municipalities in the Colombian
Northeastern Mountains. Veterinary Parasitology: Regional
Studies and Reports, 19, 100364. https://doi.org/10.1016/j.vprsr.2019.100364
Rehman, A., Ullah, R., Gupta, D.,
Khan, M. A. H., Rehman, L., Beg, M. A., Khan, A. U., & Abidi, S. M. A. (2020). Generation of oxidative stress and
induction of apoptotic like events in
curcumin and thymoquinone treated
adult Fasciola gigantica worms. Experimental Parasitology. 209, 107810. https://doi.org/10.1016/j.exppara.2019.107810
Rodríguez-Vivas, R. I., Grisi, L., Pérez-de-León, A. A.,
Silva-Villela, H., Torres-Acosta, J. F. D. J., Fragoso-Sánchez, H.,
Romero-Salas, D., Rosario-Cruz, R., Saldierna, F., & García-Carrasco, D.
(2017). Potential economic
impact assessment for cattle parasites in Mexico. Review. Revista Mexicana de Ciencias Pecuarias, 8, 61-74. https://doi.org/10.22319/rmcp.v8i1.4305
Sen, H., Raj-Narayan-Damor, R. D.,
& Swarnakar, G. (2022). In-vitro anthelmintic effects of medicinal
plant Cassia fistula extract on the tegument of Fasciola gigantica
by light microscope. International Journal of Pharmaceutical Sciences and
Research (IJPSR), 12, 6736-6743. https://doi.org/10.13040/IJPSR.0975-8232.12(12).6736-43
Ssenkuba, F., Komujuni, C., &
Tumusiime, J. (2022). In vitro anthelmintic activity of Leonotis
nepetifolia ethanolic and
aqueous leaf extracts on Fasciola gigantica. Journal of Veterinary Medicine
and Animal Health, 14(4), 82-90. https://doi.org/10.5897/JVMAH2022.1011
Štrbac, F., Krnjajić, S., Stojanović,
D., Novakov, N., Bosco, A., Simin, N., Ratajac, R., Stanković, S., Cringoli, G., & Rinaldi, L. (2023). Botanical
control of parasites in veterinary medicine. One Health Triad,
3(31), 215-222. https://doi.org/10.47278/book.oht/2023.98
Ullah, R., Rehman, A., Zafeer, M. F.,
Rehman, L., Khan, Y. A., Khan, M. A., Khan, S. N., Khan, A. U., & Abidi, S. M. (2017). Anthelmintic potential of
Thymoquinone and Curcumin on Fasciola gigantica. PLoS One, 12, e0171267.
https://doi.org/10.1371/journal.pone.0171267
Vale, N.,
Gouveia, M. J., Gärtner, F., & Brindley, P. J. (2020). Oxysterols of
helminth parasites and pathogenesis of foodborne hepatic trematodiasis caused
by Opisthorchis and Fasciola species. Parasitology Research, 119, 1443-1453. https://doi.org/10.1007/s00436-020-06640-4
Vishwakarma, K.
& Kumar, P. (2021). In vivo anthelmintic activity of medicinal plant
Asparagus racemosus against larva of Fasciola gigantica. Research Journal of Agricultural Sciences, 12(2), 675-680.
Wulandari, A.
R., Nurlaelasari, A., Nugroho, H. A., Cahyadi, M., Kurniawan, W., & Hamid,
P. H. (2023). Ethanolic extract of Etlingera elatior flower exhibits
anthelmintic properties to Fasciola gigantica in vitro. Open
Veterinary Journal, 13(5), 576–587. https://doi.org/10.5455/OVJ.2023.v13.i5.10
Yamson, E. C.,
Tubalinal, G. A. S., Viloria, V. V., & Mingala, C. N. (2019). Anthelmintic
effect of betel nut (Areca catechu) and neem (Azadirachta indica)
extract against liver fluke (Fasciola spp.). Journal of Advanced Veterinary Research, 6, 44-49.
https://doi.org/10.5455/javar.2019.e310