https://doi.org/10.29059/cienciauat.v19i1.1861
Enriquecimiento de aceite de oliva con carotenoides del
pimiento rojo (Capsicum anuum
L.) por maceración enzimática
Enrichment of olive oil with carotenoids from red
pepper
(Capsicum anuum L.)
by enzymatic maceration
Aceite de oliva enriquecido con
carotenoides
Erik Alberto Báez-Hernández, Samuel
García-Díaz, Frixia Galán-Méndez, Laura Acosta-Domínguez*
*Correspondencia: lacosta@uv.mx/Fecha
de recepción: 28 de noviembre de 2023/Fecha de aceptación: 25 de junio de
2024/Fecha de publicación: 10 de julio de 2024
Universidad
Veracruzana, Facultad de Ciencias Químicas, Circuito Gonzalo Aguirre Beltrán
s/n, zona Universitaria, Xalapa, Veracruz, México, C. P. 91000.
RESUMEN
Los carotenoides pueden incorporarse en los aceites vegetales
comestibles mediante maceración, esto permite mejorar la estabilidad de los carotenoides y el enriquecimiento del aceite, aunque
la eficiencia de extracción es baja. El objetivo
del presente trabajo fue mejorar el proceso de enriquecimiento del
aceite de oliva con carotenoides del pimiento
rojo (Capsicum
anuum L.)
mediante la maceración, empleando una hidrólisis enzimática previa al tratamiento. El aceite de oliva se
enriqueció con carotenoides extraídos por maceración enzimática (AOME) o maceración directa (AOMD). La estabilidad de ambos aceites a 8 °C, 25 °C y 45 °C fue evaluada semanalmente durante
6 semanas midiendo la degradación de
carotenoides y la aparición de peróxidos, modelando su cinética de
reacción a cada temperatura. AOME reportó mayor cantidad de carotenoides desde el inicio (11.5 %) y a lo largo del estudio. Ambos aceites presentaron la
menor tasa de degradación de carotenoides y formación de peróxidos a 8 °C de almacenamiento (4 %), e
incremento en la formación de peróxidos a 25 °C y 45 °C, durante las 6 semanas, con una mayor tasa para
AOMD. El índice de peróxidos aumentó
considerablemente al calentar a 150 °C y 200 °C las muestras de los dos
tratamientos mantenidas a 8 °C y 25 °C. Se presentó un valor menor de peróxidos
en ambas muestras almacenadas a 45 ºC y sometidas a
calentamiento, fenómeno asociado con la formación de productos de degradación
de peróxidos. La hidrólisis enzimática como pretratamiento mejoró los índices
de extracción de carotenoides durante la
maceración en aceite de oliva, así como su estabilidad en el
almacenamiento. El proceso evaluado representa una alternativa de enriquecimiento del aceite con carotenoides como
compuestos bioactivos, cuando el aceite no
esté destinado a ser usado en altas temperaturas.
PALABRAS CLAVE: maceración enzimática, carotenoides, aceite
comestible.
ABSTRACT
Carotenoids can be incorporated into
edible vegetable oils through maceration. This improves the stability of
carotenoids and the enrichment of oil, although the extraction efficiency is low. The objective of this work was to improve the
process of enriching olive oil with carotenoids from red pepper (Capsicum anuum L.) through maceration,
using enzymatic hydrolysis prior to treatment.
The olive was enriched with carotenoids
extracted by enzymatic maceration
(AOME) or direct maceration (AOMD). The stability of both oils at 8 °C, 25 °C and 45 °C was evaluated
weekly for 6 weeks by measuring the
degradation of carotenoids and the appearance of peroxides, modeling their reaction kinetics at each temperature. AOME
reported a higher amount of carotenoids from the beginning (11.5 %)
and throughout the study. Both oils presented the lowest rate of carotenoid degradation and peroxide formation at 8
°C storage (4 %), and increase in the formation of peroxides at 25 °C and 45 °C, during the 6 weeks, with a higher rate
for AOMD. The peroxide index increased considerably when the samples from the two treatments
kept at 8 °C and 25 °C were heated to 150 °C and 200 °C. A lower value of
peroxides was present in both samples
stored at 45 ºC and subjected to heating, a phenomenon associated with the formation of peroxide degradation products.
Enzymatic hydrolysis as a pretreatment improved the carotenoid extraction rates during maceration in olive
oil, as well as its storage stability. The evaluated process represents an alternative for enriching oil
with carotenoids as bioactive compounds,
when the oil is not intended to be
used at high temperatures.
KEYWORDS: enzymatic
maceration, carotenoids, edible oil.

INTRODUCCIÓN
Los aceites vegetales comestibles pueden ser enriquecidos con
carotenoides, luego de ser extraídos por
maceración con solventes orgánicos.
Sin embargo, este tipo de disolventes son volátiles, inflamables y
tóxicos. Por ello, se han estudiado alternativas que aprovechan las características lipófilas de los carotenoides para esparcirlos en disolventes verdes, como
los aceites vegetales, donde se utiliza la maceración directa como metodología
de extracción (Caporaso y col., 2013; Cavazza y col., 2015; Liu
y col., 2021; Portillo-López y col.,
2021).
Los carotenoides son compuestos que pueden degradarse fácilmente, por diversos factores, como temperatura y pH, por lo que, una alternativa
para mejorar su estabilidad es incorporarlos
a aceites vegetales comestibles, los cuales retrasan su degradación
(Cerecedo-Cruz y col., 2018; Otálora-Orrego y col., 2021). La extracción y estabilidad de los carotenoides,
en el enriquecimiento de aceites por maceración directa, se ven influenciadas por el tipo
y longitud de la cadena, siendo los de cadena larga
y alta saturación los que facilitan su liberación (Liu y col., 2021). El
aceite de oliva se considera un buen disolvente lipofílico, ya que presenta
alto contenido en ácidos grasos
monoinsaturados de cadena larga (Xia y col., 2020). Ha mostrado buenos
resultados en algunas investigaciones, como disovente
para la extracción de carotenoides (Kehili y col.,
2019; Teramukai y col., 2020). Además, puede mejorar
eficazmente la biodisponibilidad del b-caroteno,
ya que se digiere más rápida y
completamente en la fase del intestino delgado; como resultado, más b-caroteno
se libera (Xia y col., 2020).
Los aceites se consideran disolventes verdes, ya que no contienen contaminantes y previenen
la degradación oxidativa de los carotenoides durante la extracción. Sin
embargo, la alta viscosidad de los aceites
disminuye su efectividad, debido a que induce baja difusividad y, en consecuencia, provoca una baja extracción,
en comparación con el uso de solventes orgánicos como acetato de etilo y
etanol, entre otros. El aceite se puede
calentar para reducir su viscosidad y mejorar su difusividad, pero si se
utiliza una temperatura muy alta, durante mucho tiempo, puede haber degradación
de los carotenoides (Chutia y Mahanta,
2020). En este sentido, es necesario modificar la metodología de maceración
directa o aplicar pretratamientos que mejoren las tasas de extracción de
carotenoides durante la maceración, por ejemplo, ultrasonido, microondas y fluido supercrítico (Sales-Silva y Martinez, 2014;
da-Silva y col., 2018; Suo y col.,
2023).
El uso de enzimas hidrolíticas como pretratamiento, en el proceso de extracción con aceites
comestibles, facilita la ruptura de la estructura
de la pared vegetal del fruto (Nath y col., 2016; Mendoza y col., 2020). Existen diversos trabajos sobre la extracción de
aceites u oleorresinas asistidas con enzimas como celulasa, pectinasa, amilasa,
lacasas o lipasas, entre
otras (Baby y Ranganathan, 2016; Cortés-Ferré y col., 2021). También se utilizan
preparados enzimáticos, con más de un tipo de
enzima, para degradar diferentes compuestos específicos de la pared de la
planta y extraer la oleorresina mucho más
fácilmente (Stoica y col., 2016; Walczak y col., 2018).
Se han realizado pocos trabajos relacionados con el uso de
pretratamientos enzimáticos para la
extracción de carotenoides, uno de ellos
es el de Jalali-Jivan y col. (2021), quienes los extrajeron de zanahoria, utilizando pectinasa comercial y elaboraron nanoemulsiones de aceite y agua. Sin embargo, respecto al
enriquecimiento de aceites comestibles
mediante maceración enzimática no existen investigaciones.
Este trabajo tuvo como objetivo enriquecer un aceite de oliva
con carotenoides procedentes de pimiento
rojo (Capsicum anuum
L.) mediante maceración enzimática
para determinar si es posible aumentar la
tasa de extracción de carotenoides y
mejorar su estabilidad en almacenamiento y durante la fritura.
MATERIALES Y MÉTODOS
Materiales
Se utilizaron pimientos rojos en un
estado de madurez óptimo, con un color
totalmente rojo y textura firme, obtenidos frescos del mercado de verduras de
Xalapa, Veracruz, México. Se usó aceite de oliva extra virgen marca Carbonell, adquirido en la tienda de autoservicio Wallmart (Xalapa, Veracruz, México). Se utilizó la mezcla comercial de enzimas celulasas SAE0020
con densidad de 1 g/mL a 1.3 g/mL (Sigma Aldrich, México).
Obtención de la pulpa del pimiento
Los pimientos se lavaron con solución jabonosa, se les quitó
el pedúnculo y las semillas, para ser blanqueados a 80 °C durante 1 min.
Posteriormente, se molieron en una licuadora (Oster Oesterizer,
400 W, Estados Unidos) durante 30 s; se
determinó su humedad y se mantuvieron
a una temperatura de - 70 °C, para su posterior uso.
Maceración directa
La pulpa de pimiento rojo se mezcló con aceite de oliva en
una proporción 1:3 (p/v) y se mantuvo en
agitación constante (150 rpm) durante 24 h, protegido de la luz a 25 °C
en una incubadora (Novatech EI45-AID, México).
Finalmente se centrifugó (HERMLE 2300k, Wehingen, Alemania) a 3 900 rpm a 4 °C durante 20 min para obtener el
aceite enriquecido (AOMD; aceite de oliva por maceración directa).
Hidrolizado
La mezcla comercial de enzimas (1 % con
respecto al peso seco del pimiento) se añadió a la pulpa del pimiento rojo y se
incubó a 45 °C. Los azúcares reductores fueron cuantificados cada 10 min por el método de DNS (ácido 3,5-dinitrosalicílico), para
determinar la etapa de mayor capacidad de hidrólisis de las enzimas (Baby y Ranganathan, 2016). Para ello, se usó un espectrofotómetro
UV-vis (Thermo scientific Genesys 20, USA) y se siguió la metodología de Núñez y col.
(2012).
Maceración enzimática
El hidrolizado se mezcló con aceite de
oliva en una proporción 1:3 (p/v) y
se mantuvo en agitación constante (150 rpm) durante 24 h, protegido de la luz a
25 °C en una incubadora (Novatech EI45-AID, México).
Finalmente, se centrifugó (HERMLE 2300k, Wehingen,
Alemania) a 3 900 rpm a 4 °C durante 20 min para
obtener el aceite enriquecido (AOME; aceite de oliva por maceración
enzimática).
Almacenamiento de los aceites enriquecidos
Los aceites (AOMD y AOME) se almacenaron a 8 °C (refrigerador
Thermo Scientific, México),
25 °C (incubadora Novatech EI45-AID, México) y 45 °C (incubadora Yamato IC103CW, Japón) durante 6 sem.
Las temperaturas fueron seleccionadas para prolongar la vida de anaquel
(temperatura de refrigeración), emular su manejo comercial (temperatura ambiente) y para acelerar el proceso de oxidación
(45 °C).
Carotenoides totales
La degradación de carotenoides se evaluó mediante la metodología reportada por Hornero-Méndez y Mínguez-Mosquera (2001). Se tomaron
alícuotas de 100 mL de AOMD y AOME, y se diluyeron en 5 mL de acetona.
El con-tenido de carotenoides se cuantificó mediante espectrofotometrías UV-vis
(Thermo scientific Genesys 20, USA) a 472 nm y 508 nm, utilizando acetona como blanco. Los carotenoides totales se
expresaron siguiendo la ley de Lambert Beer con las siguientes ecuaciones.

Donde:
A =
Absorbancia a la longitud de onda indicada
CT = carotenoides totales
CR = carotenoides de la fracción roja
CY = carotenoides de la fracción amarilla
Análisis de peróxidos
El valor de peróxidos se evaluó siguiendo
la metodología
oficial de la American Oils Chemists
Society (AOCS cd 8-53) reportada por Cerecedo-Cruz y col. (2018). Se tomó una muestra (0.5 g) en un matraz Erlenmeyer de 50 mL y
se mezclaron con 3 mL de ácido acético-cloroformo (3:2). Se agregaron 0.05 mL de solución saturada de yoduro de potasio y se agitó durante 1 min antes de adicionar 3 mL
de agua. Se tituló con tiosulfato de sodio 0.001 M, agitando lentamente hasta
disminuir el color amarillo. Se
agregaron 0.05 mL de solución de almidón al 1
%, continuando la titulación hasta desaparecer el color azul. El resultado se expresó en miliequivalentes de peróxido de oxígeno activo por kilogramo de aceite.
Modelo cinético y ecuación de Arrhenius
En este estudio, el
contenido de carotenoides e índice de peróxidos se evaluaron con la cinética de primer orden en forma lineal (Ec. 4), como lo
reporta Cerecedo-Cruz y col. (2018).
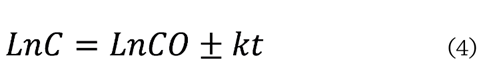
Donde:
C = el
contenido de carotenoides o peróxido total presente en la oleorresina en el
momento t
t = el tiempo de almacenamiento
k = la constante cinética para la
degradación de carotenoides
o la formación de peróxido
C0 = el contenido de carotenoides o índice
de peróxido en el momento inicial
Se utilizó la ecuación de Arrhenius para
determinar la energía de
activación de la cinética de la reacción (Ec. 5).
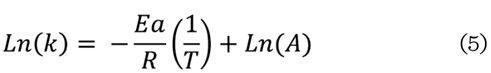
Donde
k = la
constante cinética
Ea = la
energía de activación
A = el factor
de frecuencia
T = la
temperatura
R = la
constante de los gases
Estabilidad de carotenoides y peróxidos a
150 °C y 200 °C
Los aceites (AOME y AOMD) se calentaron a 150 °C y 200 °C
durante 5 min, se enfriaron, y posteriormente
se realizó la medición de carotenoides totales y se determinó el índice de peróxidos con las metodologías descritas anteriormente.
Análisis estadístico
Se realizó un Análisis de Varianza (ANOVA, por sus siglas en
inglés: Analysis of Variance) de 3 vías para ver diferencias significativas entre los valores de carotenoides según el método
utilizado para la extracción, la temperatura
y el tiempo de almacenamiento. El análisis se realizó mediante el paquete de análisis
estadístico SigmaStat (programa estadístico para
análisis de datos científicos) versión 3.5.
RESULTADOS Y DISCUSIÓN
Hidrólisis del pimiento rojo
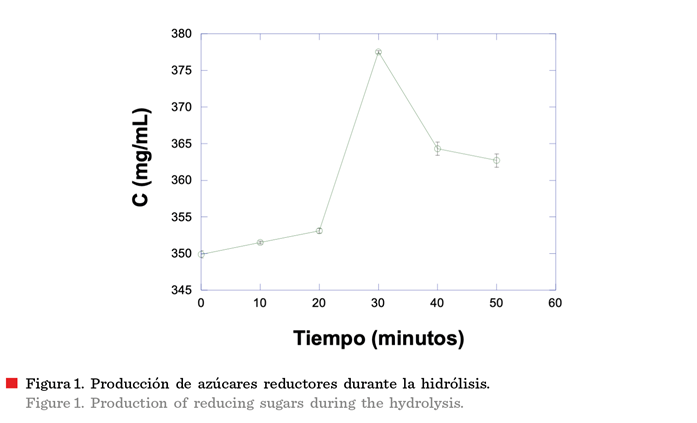
Las enzimas mostraron el mayor nivel de hidrólisis a los 30
min (377.5 mg/mL) (Figura 1), generando la mayor cantidad de azucares reductores. El
máximo nivel de hidrólisis obtenido en este
estudio fue menor al reportado por Baby y Ranganathan
(2016), quienes elaborando salsa
estilo tabasco, consideraron 90 min como tiempo de incubación para la hidrólisis al pimiento rojo. Esta diferencia se debe a que el grado de hidrólisis depende
de las enzimas usadas y condiciones de incubación del pimiento
(Molina-Peñate y col., 2022).
Contenido de carotenoides en el almacenamiento
El método enzimático mejoró la extracción de carotenoides, ya
que en AOME se presentaron porcentajes mayores de estos compuestos que
oscilaron entre un 9 % y 11.5 % con respecto
a AOMD al inicio y durante todo el tiempo de almacenamiento, los cuales
representaron diferencias significativas
entre el método de extracción utilizado (P < 0.05). Este valor es inferior a los de-Farias y col. (2020), quienes
mostraron un aumento del 16.83 % en el contenido de carotenoides en una salsa tabasco tratada con hidrólisis enzimática. Las diferencias
se deben a que ellos no realizaron una maceración en aceite, ya que su objetivo
solo fue mejorar la disponibilidad de
carotenoides en la propia salsa.
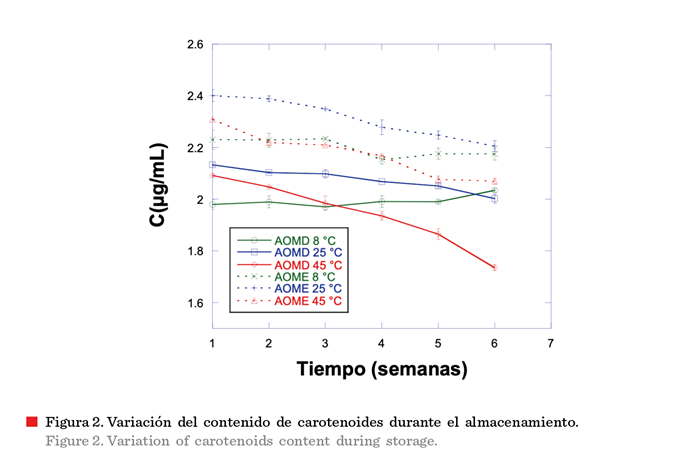
Con respecto al tiempo de almacenamiento, el
contenido de carotenoides se redujo en las
tres temperaturas estudiadas (a excepción de 8 °C en AOMD), sin embargo, las muestras mostraron una clara disminución en el contenido de carotenoides a 25 °C y 45 °C, mientras
que la degradación fue menos evidente a 8 °C en AOME (Figura 2). Por lo tanto, la temperatura de almacenamiento también
influyó en la estabilidad de los aceites, ya
que se presentaron diferencias significativas (P < 0.05) en la reducción del contenido de carotenoides en las
tres temperaturas. Los resultados de carotenoides totales de las
muestras de AOMD y AOME almacenadas a 45 °C
mostraron una degradación mayor que a 25 °C durante las 6 sem de almacenamiento, perdiendo aproximadamente el 19 % y 9 %, respectivamente, con relación a
su concentración inicial. El AOME almacenado a 8 °C mostró una alta
estabilidad porque se produjo una menor disminución en la concentración de
carotenoides en comparación con las otras temperaturas, lo que es esperable en un
ambiente sin luz para el aceite de oliva, ya
que se ha demostrado que es bastante estable en estas condiciones de
almacenamiento. Resultados similares tuvieron Liu y col. (2021), quienes estudiaron la degradación de carotenoides en 4 tipos de aceites, encontrando que los
carotenoides disminuyeron con el aumento de la temperatura de almacenamiento y la extensión del tiempo de
almacenamiento, mientras que la tasa de
retención de carotenoides se mantuvo constante en ambiente sin luz a 5 °C.
Modelo cinético y ecuación de Arrhenius
de la degradación de
carotenoides A mayor temperatura corresponde una mayor constante cinética (k)
y, por lo tanto, más rápida es la degradación de los carotenoides (Tabla 1).
Resultados similares se presentaron en el
trabajo de Cerecedo-Cruz y col. (2018), quienes estudiaron el efecto de
los carotenoides en la estabilidad oxidativa del aceite de aguacate.
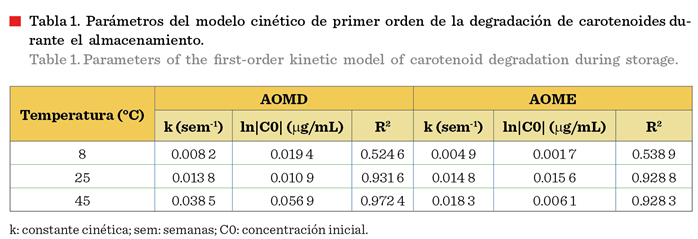
Los valores de concentración de carotenoides tanto en AOME como en AOMD se comportaron de
manera similar a 8 °C, ya que no disminuyeron en el tiempo analizado, por lo que la cinética de reacción de primer
orden de AOMD y AOME a 8 °C no presentó
una buena correlación durante el ajuste
(R2 = 0.538 9 para AOME y R2 = 0.524 6 para
AOMD) debido a que los carotenoides registraron una mayor estabilidad a
dicha temperatura. Los valores de constante
cinética de AOME en este trabajo
(0.004 9 sem-1, 0.014 8 sem-1 y 0.018 3 sem-1 para 8 °C, 25 °C y 45 °C, respectivamente) fueron inferiores a los encontrados en el estudio
de Cerecedo-Cruz y col. (2018), donde obtuvieron 0.024 2 sem-1, 0.031
4 sem-1, 0.038 3 sem-1 para temperaturas de 6 °C, 25 °C y 45 °C, respectivamente. Esto se debe a que el aceite de oliva
confirió una mayor estabilidad a los
carotenoides y disminuyó la degradación de estos, por lo que el aceite de oliva proporciona una mejor protección
a los carotenoides, provocando un efecto
sinérgico beneficioso entre los carotenoides y el aceite de oliva. Por otro
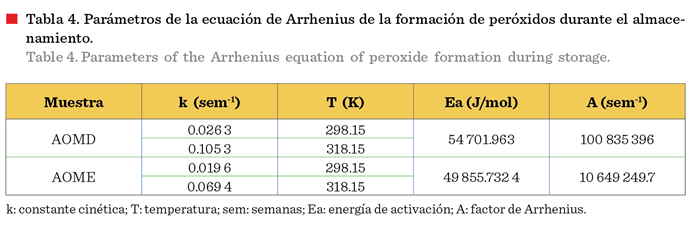
lado, en cuanto a los parámetros de la ecuación de Arrhenius, AOME tuvo una Ea mayor que
AOMD (Tabla 2), por lo que es más sensible a
los cambios de temperatura.
Formación de peróxidos durante el almacenamiento
La concentración de peróxidos (Figura 3) a 8 °C presentó un valor menor en ambas muestras
(AOME y AOMD) con respecto a 25 °C y 45 °C, y esta concentración se mantuvo sin
cambios significativos en el tiempo de almacenamiento. Las muestras almacenadas a 45 °C
mostraron un aumento mayor en el contenido de peróxidos totales, por lo que a
más alta temperatura hubo una mayor formación de peróxidos en ambos aceites.
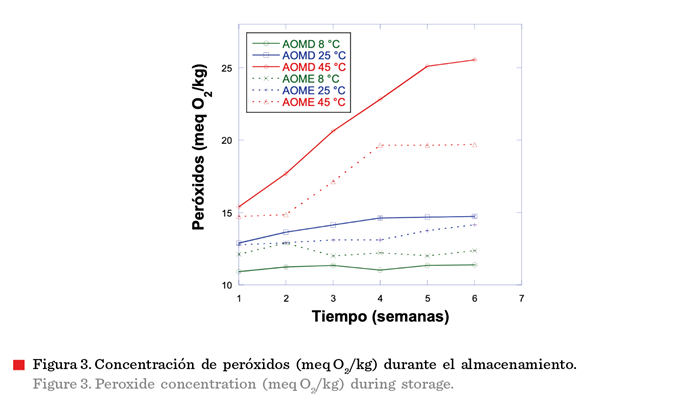
Los valores de los índices de peróxidos
en el AOME mostraron concentraciones absolutas finales inferiores a las encontradas en AOMD, en las
temperaturas de 25 °C y 45 °C, ya que el aumento de la concentración de
carotenoides provocó un mejor efecto antioxidante en el aceite, provocando una
mayor estabilidad del aceite en el
almacenamiento. Al respecto, Sánchez-Camargo y col. (2019) adicionaron extracto
de carotenoides provenientes de cáscara de mango a un aceite de girasol,
registrando que los carotenoides protegían el aceite
contra la oxidación lipídica. Por otra parte, Treto-Alemán y col. (2021) suplementaron aceite de cártamo con
chile piquín, encontrando que, este incrementó el valor antioxidante del aceite, ya que la muestra de chile
piquín enriqueció al aceite comestible con
antioxidantes naturales, retrasando la formación de peróxidos.
Modelo cinético y ecuación de Arrhenius de la formación de
peróxidos
Respecto a los parámetros del modelo cinético de primer orden,
que corresponden a la formación de peróxidos en AOME y AOMD, mostraron una
mejor correlación a 45 °C (Tabla 3), esto
debido a que existe una mayor velocidad de formación de peróxidos a esta
temperatura, lo que permite realizar un mejor ajuste
de los datos con el modelo cinético.
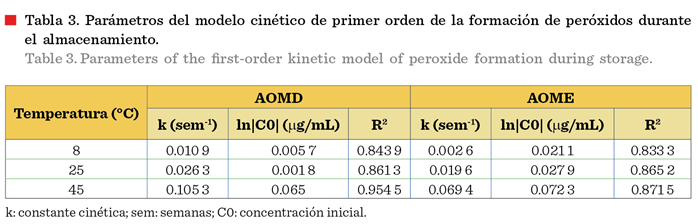
Los valores de la constante cinética (k) fueron inferiores a los reportados por Cerecedo-Cruz y
col., 2018, ya que ellos registra-ron 0.393 5 sem-1, 0.092 6 sem-1
y 0.051 3 sem-1 en las temperaturas de 45 °C, 25 °C y 6 °C,
respectivamente, lo cual indica que la reacción de formación de peróxidos en el
aceite de oliva es más lenta en el rango de las temperaturas estudiadas que en el aceite de aguacate, lo que puede
deberse al efecto antioxidante de los
carotenoides presentes y a la composición
química propia del aceite de oliva, que provoca un efecto sinérgico de protección a la oxidación del aceite.
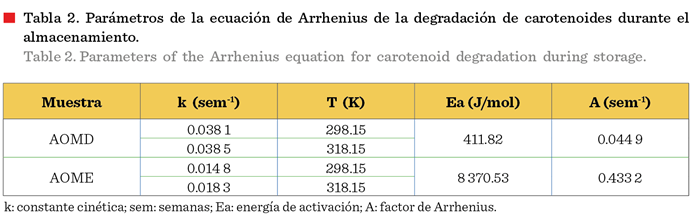
En cuanto a los parámetros de la ecuación de Arrhenius para AOME y AOMD, los valores de energía
de activación fueron 49 855.129 J/mol y
54 701.963 J/mol, respectivamente, mostrando valores de energía de
activación mayores a lo reportado por Cerecedo-Cruz y col. (2018) (38 337
J/mol), quienes obtuvieron un aceite de aguacate enriquecido con carotenoides
por maceración directa. Por lo tanto, los
carotenoides en el aceite de oliva
presentaron una mayor estabilidad en el almacenamiento que en el aceite
de aguacate, ya que se necesita mayor
energía para que inicie la degradación. Sin embargo, AOME registró un valor menor de Ea
que AOMD (Tabla 4), lo cual puede indicar que la formación de peróxidos
en AOMD es más sensible a los cambios de temperatura.
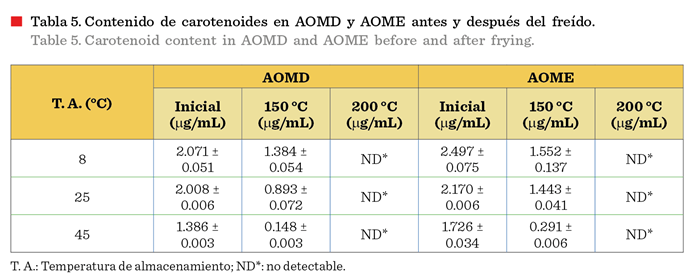
Evaluación de carotenoides y peróxidos a 150 °C y 200 °C
El contenido de carotenoides se redujo con el aumento de la
temperatura (Tabla 5). A 150 °C los carotenoides disminuyeron abruptamente y a 200 °C el contenido de carotenoides
fue inmensurable. Las muestras almacenadas a 45 °C que fueron sometidas a 150
°C presentaron una disminución mucho mayor,
en comparación con las otras dos temperaturas
de almacenamiento a 8 °C y 25 °C. Estos
resultados sugieren que el aceite de oliva enriquecido con carotenoides
no debe so-meterse a 150 °C o 200 °C, en las
actividades culinarias como el freído, horneado o la cocción, que se realizan a temperaturas altas. Los aceites
almacenados a temperaturas más bajas tuvieron una menor pérdida de carotenoides que los almacenados a 45 °C, después del tratamiento a temperaturas
altas (150 ºC y 200 ºC), esto es
debido a que inicialmente los aceites
almacenados a 45 °C, ya presentaban
un grado de oxidación mayor, es decir, una cantidad inicial de peróxidos
más alta que los otros almacenados a 8 °C y
25 °C, y al ser calentados a 150 °C y 200 °C, se provocó una mayor velocidad de
oxidación, afectando directamente el contenido de carotenoides.
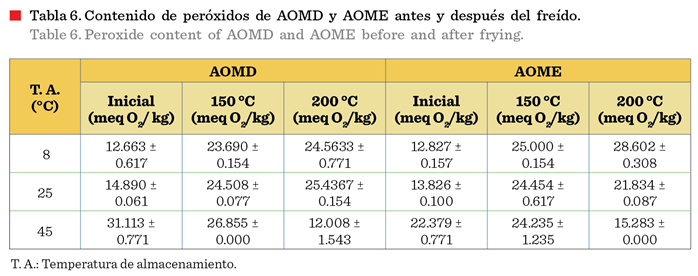
Los resultados del contenido de peróxidos
después de calentar las muestras a 150 °C y 200 °C se muestran en la Tabla 6,
donde se observa que tanto AOMD como AOME tuvieron un aumento significativo con
respecto a su contenido inicial de peróxidos, después de su almacenamiento a 8
°C y 25 °C (a excepción de AOME a 25 °C). Sin embargo, las muestras almacenadas
a 45 °C y sometidas a 200 °C mostraron
una disminución en su valor de concentración,
lo cual se debe a la formación de
otros productos de degradación que terminan el ciclo de oxidación de los aceites,
disminuyendo la concentración de peróxidos
debido a su descomposición y formación de otros productos volátiles
(Zhang y col., 2023).
CONCLUSIONES
La utilización de una mezcla de enzimas celulasas con una densidad de 1 g/mL a 1.3 g/mL
antes de la maceración del fruto en el aceite de oliva permitió aumentar el
rendimiento de extracción de los carotenoides del pimiento rojo, por lo que puede funcionar como pretratamiento
para el enriquecimiento de aceites vegetales con estos compuestos. El aceite enriquecido por maceración enzimática (AOME)
presentó una menor velocidad de oxidación durante el almacenamiento, que el
aceite enriquecido por maceración directa
(AOMD), debido a la presencia de un mayor contenido de carotenoides que
disminuye la velocidad de formación de peróxidos. Por lo tanto, el
enriquecimiento de aceites comestibles es una opción para la preservación de los mismos, y de los carotenoides durante su almacenamiento a temperaturas inferiores a 45 °C, siendo
no adecuado su calentamiento a temperaturas
altas, ya que se generan altas concentraciones de peróxidos y otros
productos de degradación. Actualmente existe una demanda alta de productos alimenticios saludables en
muchos países industriales, por lo que el
AOMD o AOME puede ser uno de ellos y puede ser usado o consumido en la
formulación de productos alimenticios que no requieran ser calentados a
altas temperaturas.
DECLARACIÓN DE INTERESES
Los autores declararon no tener
conflicto de interés alguno.
Referencias
Baby, C. K. & Ranganathan, T. V.
(2016). Effect of enzyme pretreatment on yield and quality of fresh green chilli (Capsicum annuum L) oleoresin and its major capsaicinoids. Biocatalysis and agricultural
biotechnology, 7, 95-101. https://doi.org/10.1016/j.bcab.
2016.05.010
Caporaso, N., Paduano, A., Nicoletti,
G., & Sacchi, R. (2013). Capsaicinoids,
antioxidant activity, and volatile compounds in olive oil flavored with dried
chili pepper (Capsicum annuum L.). European journal of lipid science
and technology, 115(12), 1434-1442. https://doi.org/10.1002/ejlt.201300158
Cavazza, A., Corti, S., Mancinelli, C., Bignardi, C., & Corradini, C.
(2015). Effect
of the addition of chili pepper powder on vegetable oils oxidative stability. Journal
of the american oil chemists' society, 92(11),
1593-1599. https://doi.org/10.1007/s11746-015-27389
Cerecedo-Cruz, L., Azuara-Nieto, E., Hernández-Álvarez, A.
J., González-González, C. R., & Melgar-Lalanne, G. (2018). Evaluation of the oxidative stability
of Chipotle chili (Capsicum annuum L.) oleoresins in avocado oil. Grasas y aceites, 69(1), 240. https://doi.org/10.3989/gya.0884171
Chutia, H. & Mahanta, C. L. (2020). Green ultra-sound and microwave
extraction of carotenoids from passion fruit peel using vegetable oils as a
solvent: Optimization, comparison, kinetics, and thermodynamic studies. Innovative
food science and emerging technologies, 67, 102547. https://doi.org/10.1016/jifset.2020.102547
Cortés-Ferré, H. E., Guajardo-Flores, D., Romero-De-La-Vega,
G., & Gutierrez-Uribe, J. A. (2021). Recovery of Capsaicinoids
and Other Phytochemicals Involved With TRPV-1 Receptor to Re-valorize Chili
Pepper Waste and Produce Nutraceuticals. Frontiers in sustainable food
systems, 4, 303. https://doi.org/10.3389/fsufs.2020.588534
Da-Silva, P. H. R., da-Silva, C.,
& Cervejeira-Bo-lanho,
B. (2018). Ultrasonic-assisted extraction of betalains
from red beet (Beta vulgaris L.). Journal of food process engineering, 41(6)1-6.
https://doi.org/10.1111/jfpe.12833
De-Farias, V. L., da-Silva-Araújo, I. M., da-Rocha, R. F. J.,
dos-Santos-Garruti, D., & Pinto, G. A. S. (2020).
Enzymatic
Maceration of Tabasco Pepper: Effect on the Yield, Chemical and Sensory Aspects
of the Sauce. LWT, 127, 109311. https://doi.org/10.1016/j.lwt.2020.109311
Hornero-Méndez, D. & Mínguez-Mosquera, M. I. (2001). Rapid Spectrophotometric
Determination of Red and Yellow Isochromic Carotenoid
Fractions in Paprika and Red Pepper Oleoresins. Journal of agricultural and
Food chemistry, 49(8), 3584-3588. https://doi.org/10.1021/jf010400l
Jalali-Jivan, M. J., Fathi-Achachlouei, B., Ahmadi-Gavlighi,
H., & Jafari, S. M. (2021). Improving the extraction efficiency and
stability of b-carotene from carrot by enzyme-assisted green nanoemulsification. Innovative food science &
emerging technologies, 74. 102836. https://doi.org/10.1016/j.ifset.2021.102836
Kehili, M., Sayadi, S., Frikka, F., Zammel, A., & Allouche,
N. (2019). Optimization of lycopene extraction from tomato peels
industrial by-product using maceration in
refined olive oil. Food and bioproducts processing, 117,
321-328. https://doi.org/10.1016/j.fbp.2019.08.004
Liu, Y., Zhang, C., Cui, B., Wang,
M., Fu, H., & Wang, Y. (2021). Carotenoid-enriched oil preparation and
stability analysis during storage: Influence of oils’ chain length and fatty
acid saturation. LWT - Food science and technology, 151, 112163. https://doi.org/10.1016/j.lwt.2021.112163
Mendoza, N. N. G., Rodríguez, S. A. V., & Lima, B. L. R.
(2020). Improvement
of the extraction of carotenoids and capsaicinoids of
chili pepper native (Capsicum baccatum), assisted
with cellulolytic en-zymes. Revista peruana de biología, 27(1), 055-060. https://doi.org/10.15381/rpb.v27i1.17588
Molina-Peñate, E., Sánchez A., & Artola, A. (2022). Enzymatic hydrolysis of the organic
fraction of municipal solid waste: Optimization and valorization of the solid
fraction for Bacillus thuringiensis biopesticide production through solid-state
fer-mentation. Waste management, 137, 304-311. https://doi.org/10.1016/j.wasman.2021.11.014
Nath, P., Kaur,
C., Rudra, S. G., & Varghese, E. (2016). Enzyme-assisted extraction of
carotenoid-rich extract from red capsicum (Capsicum annuum). Agricultural research, 5, 193-204. https://doi.org/10.1007/s40003-015-0201-7
Núñez, R. Á., Pérez, B. R., Motzezak,
R. H. y Chirinos, M. (2012). Contenido de azúcares totales, re-ductores
y no reductores en Agave cocui Trelease. Multiciencias,
12(2), 129-135.
Otálora-Orrego, D. y Martin, D. A. (2021). Técnicas
emergentes de extracción de b-caroteno para la valorización de subproductos agroindustriales de la zanahoria (Daucus carota L.): una revisión. Informador técnico,
85(1), 83-106. https://doi.org/10.23850/22565035.2857
Portillo-López, R., Morales-Contreras, B. E., Lozano-Guzmán,
E., Basilio-Heredia, J., Muy-Rangel, M. D., Ochoa-Martínez, L. A., &
Morales-Castro, J. (2021). Vegetable oils as green solvents for carotenoid extraction from pumpkin
(Cucurbita argyrosperma Huber) byproducts:
Optimization of extraction parameters. Journal of food science, 86(7),
3122-3136. 10.1111/1750-3841.15815
Sales-Silva, L. P. & Martínez, J.
(2014) Mathema-tical modeling of mass transfer in supercritical fluid
extraction of oleoresin from red pepper. Journal of food engineering,
133, 30-39. https://doi.org/10.1016/j.jfoodeng.2014.02.013
Sánchez-Camargo, A. P., Gutierrez, L.
F., Milena, S., Martínez, H., Parada, F., & Narváez, C. E. (2019). Valorisation of mango peel: Proximate composition,
supercritical fluid extraction of carotenoids, and application as an
antioxidant additive for an edible oil. Journal
of supercritical fluids, 152, 104574. https://doi.org/10.1016/j.supflu.2019.104574
Stoica, R., Moscovici, M., Tomulescu, C.,
& Băbeanu, N.
(2016). Extraction and analytical methods of capsaicinoids
- a review. Scientific bulletin series F. biotechnologies, 20, 93-98.
Suo, A., Fan, G., Wu, C., Li, T.,
& Cong, K. (2023). Green extraction of carotenoids from apricot flesh by
ultrasound assisted corn oil extraction: Optimization, identification, and
application. Food chemistry, 420, 136096. https://doi.org/10.1016/j.foodchem.2023.136096
Teramukai, K., Kakui,
S., Beppu, F., Hosokawa, M., & Miyashita, K. (2020). Effective extraction
of carotenoids from brown seaweeds and
vegetable leaves with edible oils. Innovative food science and
emerging technologie, 60, 2-7. https://doi.org/10.1016/j.ifset.2020.102302
Treto-Alemán, K. M., Torres-Castillo, J.
A., Contreras-Toledo, A. R. y Moreno-Ramírez, Y. R. (2021). Enriquecimiento del
aceite comestible por compuestos fenólicos y
antioxidantes de chile piquín (Capsicum annuum var. glabriusculum).
CienciaUAT, 15(2),
156-168. https://doi.org/10.29059/cienciauat.v15i2.1459
Walczak, J., Buszewski,
B., Krakowska, A., & Rafinska, K. (2018).
Enzyme-assisted optimized supercritical fluid extraction to improve Medicago
sativa polyphenolics isolation. Industrial
crops and products, 124, 931-940. https://doi.org/10.1016/j.indcrop.2018.08.004
Xia, Z., Han, Y., Du, H., McClements,
D. J., Tang, Z., & Xiao, H. (2020). Exploring the effects of carrier oil
type on in vitro bioavailability of b-carotene: A cell culture study of carotenoid-enriched nanoemulsions, LWT-Food science and
technology, 134, 110224. https://doi.org/10.1016/j.lwt.2020.110224
Zhang, J., Zhang, M., Chen, K.,
Bhandari, B., & Deng, D. (2023). Impact of cooking methods on the quality, sensory and flavor compounds of Sichuan
pepper oleoresin. Food chemistry, 427, 136639.
https://doi.org/10.1016/j.foodchem.2023.136639