https://doi.org/10.29059/cienciauat.v19i1.1872
Péptidos bioactivos derivados de las semillas de frijol (Phaseolus vulgaris L.)
Bioactive peptides derived from bean seeds (Phaseolus vulgaris
L.)
Péptidos de las semillas de frijol
Raúl Reyes-Bautista*, José de Jesús
Flores-Sierra, Luis Ángel Xoca-Oroxco
*Correspondencia:
raul.rb@purisima.tecnm.mx/Fecha de
recepción: 22 de enero de 2024/Fecha de aceptación: 12 de julio de 2024/Fecha
de publicación: 19 de julio de 2024.
Tecnológico Nacional de México/ITS de Purísima del
Rincón, Laboratorio de Bioprocesos, División de Ingeniería Bioquímica,
boulevard del Valle núm. 2301, Guardarrayas, Purísima del Rincón, Guanajuato,
México, C. P. 36425.
RESUMEN
Diversos compuestos de
origen vegetal pueden coadyuvar en el control y prevención de las enfermedades consideradas como un problema de
salud pública, entre ellas las crónico-degenerativas. Las proteínas de origen
vegetal representan una excelente alternativa frente a las de origen animal
debido a la menor huella de carbono. Se les considera una excelente fuente de
péptidos funcionales, que presentan diferentes
actividades biológicas. El objetivo de este trabajo fue analizar los
avances en el estudio de los hidrolizados proteínicos, para la obtención de péptidos bioactivos, que se encuentran
encriptados en las proteínas de almacenamiento de las semillas del frijol común
(Phaseolus
vulgaris L.). Los estudios se han enfocado
a mejorar el proceso de obtención a través de hidrólisis enzimática,
fermentación microbiana e incluso métodos sintéticos. También se tienen
adelantos en su purificación, identificación y en la evidencia de su actividad
funcional, tales como: propiedades anti-oxidantes,
antihipertensivas y antidiabéticas. Las
investigaciones localizadas están dirigidas a lograr que los
hidrolizados proteínicos, derivados del frijol, con potencial nutracéutico o
terapéutico, por haberse demostrado su actividad
biológica in vitro e in vivo, puedan incorporarse en el desarrollo de alimentos funcionales.
PALABRAS
CLAVE: frijol, biopéptidos,
actividad biológica, hidrolizados proteínicos.
ABSTRACT
Various
compounds of plant origin can contribute to the control and prevention of
diseases considered a public health problem, including chronic-degenerative
diseases. Plant-based proteins are an excellent alternative compared to those
of animal origin due to their lower carbon footprint, and they are also an
excellent source of peptides that have different biological activities. The aim of this work was to analyze the research
progress on the protein hydrolysates/peptides
that are encrypted in the storage proteins of the seeds of the common
bean (Phaseolus vulgaris L.). Studies have focused on its production
process (enzymatic hydrolysis, microbial
fermentation, and met-hod synthetic), purification and identification
and evidence of its functional activities such as antioxidant, antihypertensive, antidiabetic among others. The
research that has been carried out and that is concentrated in this document
aim that in the future protein hydrolysates
derived from the bean that have demonstrated biological activity (in
vitro and in vivo) can offer nutraceutical and therapeutic potential
in addition to their incorporation into the development of functional foods.
KEYWORDS: beans,
biopeptides, biological activity, protein hydrolysates.

INTRODUCCIÓN
El impacto ambiental
que genera la producción de alimentos de origen vegetal es menor comparado con
los de origen animal, debido a la huella de carbono; medida del efecto
ambiental, en términos de la cantidad de gases de efecto invernadero generados
(CO2, CH4, entre otros). La carne tiene una huella de
carbono que es de varias decenas de veces
mayor que la de la mayoría de las frutas y verduras (Shabir
y col., 2023). Los alimentos de origen vegetal están surgiendo como un nuevo
horizonte en la industria agrícola, siendo una alternativa a los alimentos de
origen animal (la carne, el pescado, los huevos, la leche, el queso y el
yogur), debido a que pueden satisfacer las necesidades de los seres humanos (McClements
y Grossmann, 2021; Mullins y Arjmandi,
2021; Goldstein y Reifen, 2022). Actualmente, los
consumidores prestan mayor atención en la calidad de los alimentos, debido a
que existe una mejor educación sanitaria y una mayor conciencia sobre los
beneficios para la salud de los productos alimenticios, además de la creación
de nuevas tendencias dietéticas en las generaciones de jóvenes y adultos
mayores (Baker y col., 2022).
Las legumbres, que son
el fruto de las leguminosas, forman parte de la alimentación humana y se
remontan al año 5500 a.C; su cultivo tiene una historia larga y diversa, asociada con el
desarrollo de prácticas agrícolas y la satisfacción de las necesidades
nutricionales humanas. Se cree que fueron de las primeras plantas cultivadas y
consumidas por los humanos, las cuales
también se utilizaban para alimentar a los animales (Siddiq
y col., 2022). Estos cultivos alimentarios tienen diferentes orígenes de domesticación. Muchas legumbres (e.g. lentejas y garbanzos) generalmente se obtuvieron y cultivaron en las regiones de Medio Oriente,
mientras que los frijoles comunes o secos (Phaseolus
vulgaris L.) se conocen como cultivos del “nuevo
mundo” (Miklas y col., 2022).
La inclusión dietética
y el consumo regular de legumbres se asocia
con muchos beneficios para la salud. Los compuestos contenidos en estas
plantas ejercen efectos antioxidantes, hipocolesterolémicos,
hipoglucemiantes, anticancerígenos, antiobesidad y reguladores hormonales (Grdeń y Jakubczyk, 2023).
Según la Organización
Mundial de la Salud (WHO, por sus siglas en inglés: World
Health Organization), reportó
que las enfermedades no transmisibles
(ENT) continúan causando la mayor carga de morbilidad en todo el mundo.
El impacto de las ENT generó en 2019 el 74 % de las muertes mundiales (41
millones). Las cuatro principales ENT, que generaron en conjunto alrededor de
33.3 millones de muertes, fueron las enfermedades cardiovasculares (17.9 millones), el cáncer (9.3 millones), las
enfermedades respiratorias crónicas (4.1 millones) y la diabetes (2.0 millones)
(WHO, 2023).
Las ENT ocurren como
resultado de la interacción de un conjunto
multifactorial de exposición, que incluyen factores de riesgo conductuales,
metabólicos y ambientales. Una gran
proporción de estas enfermedades se puede
prevenir reduciendo los principales factores de riesgo, tales como, una
nutrición poco saludable, baja actividad
física, el tabaquismo y el consumo de alcohol (Alidoost
y col., 2021). Por lo tanto, la búsqueda de
alimentos que coadyuven a controlar los principales problemas de salud pública,
a través de sus componentes bioactivos con diversas actividades, tales
como, antioxidantes, antihipertensivos, antidiabéticos, antitrombóticos, entre
otros (Granato y col., 2020), los cuales están
presentes en la dieta, es un reto que se ha expuesto durante los últimos años y
que es objeto de estudio de diversos
investigadores en distintas áreas del conocimiento, en particular, el
desarrollo de alimentos funcionales (Vignesh y col.,
2024); síntesis y mecanismos de acción (Akbarian y
col., 2022) así como biodisponibilidad y seguridad (Bhandari y col., 2020).
El objetivo del
presente trabajo fue analizar la evidencia científica de los péptidos
bioactivos obtenidos por hidrólisis enzimática, derivados de las semillas del
frijol común (Phaseolus vulgaris
L.) y los mecanismos de su actividad farmacológica evaluados de forma in
vitro e in vivo, con la finalidad de reconocer su papel como
potenciales nutracéuticos.
Frijol (Phaseolus vulgaris
L.)
Según la Organización
de las Naciones Unidas para la Alimentación y la Agricultura (FAO, por sus siglas en inglés: Food and Agriculture Organization of the United
Nations), la
producción de frijol seco en 2022 fue
superior a 28 millones de T, en donde América
representa aproximadamente el 32 % de
participación en la producción mundial. En este continente, los principales
producto-res de frijol son Brasil (3 millones de T), Estados Unidos de
América (1.2 millones de T) y México (1.1
millones de T), ocupando el segundo,
el quinto y el sexto lugar a nivel mundial, respectivamente (FAO, 2022).
Se considera que el
frijol común fue domesticado en
Centroamérica hace casi 7000 años, en dos regiones principales:
Mesoamérica y los Andes. Sin embargo, varios estudios moleculares recientes
sugieren la evolución del acervo genético
andino a partir del germoplasma
mesoamericano, lo que demuestra que el
acervo genético mesoamericano es una fuente importante de diversidad
genética (Bitocchi y col., 2012; Choudhary
y col., 2022). Existen alrededor de 80 especies cultivadas y silvestres del
género Phaseolus, de las cuales P. vulgaris, perteneciente a la familia de plantas Fabaceae, es la especie de leguminosa más cultivada en el mundo (Freytag
y Debouck, 2002; Porch
y col., 2013).
Los frijoles comunes
presentan tipos de semillas pequeñas (e.g. blanco,
negro, pinto) provenientes de la región mesoamericana y tipos de semillas
grandes (e.g. riñón, arándano, Mayacoba) de origen andino (Miklas y col., 2022). Estas semillas son una fuente
excelente de proteína (16 % a 33 %), fibra, compuestos fenólicos y fitoquímicos
asociados con efectos benéficos para la salud (Figura 1). Al igual que otras
leguminosas, el frijol acumula grandes cantidades de proteínas en sus semillas,
la mayoría de las cuales son proteínas de almacenamiento, las cuales reciben
ese nombre porque son movilizadas desde compartimentos subcelulares
especializados para proporcionar nutrientes para el crecimiento de nuevas
plantas durante el proceso de germinación (de-Fátima-Garcia
y col., 2021). Dichas proteínas se pueden clasificar de acuerdo con su
solubilidad (Osborne, 1924) siendo las
globulinas (solubles en soluciones salinas) y albúminas (solubles en
agua) las más abundantes. La faseolina (una globulina) es la principal proteína de almacenamiento en los frijoles secos, representando
hasta la mitad de la proteína total de la semilla (Montoya y col.,
2010).
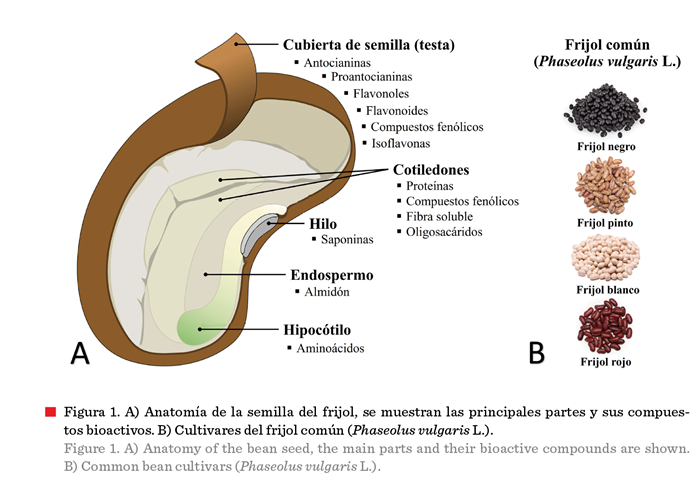
Herrera-Hernández y
col. (2023) realizaron un estudio para evaluar la composición de aminoácidos
esenciales y no esenciales, así como el contenido proteínico de 23 variedades
de frijol producidas y consumidas en México; encontraron variedades con un
contenido de proteína del 17 % al 30 %; además
determinaron que los aminoácidos esenciales más destacados en las
variedades de frijol mexicano fueron: lisina y leucina. La lisina participa en
la construcción de masa muscular,
recuperación de lesiones y heridas, producción de hormonas, enzimas y
anticuerpos; absorbe calcio y estimula la liberación de la hormona del
crecimiento. Por su parte, la leucina mitiga
la destrucción muscular, y proporciona energía a los músculos y órganos
del cuerpo. En humanos, comer frijoles se podría correlacionar con un menor riesgo de desarrollar cáncer, debido a que puede
inducir la detención del ciclo celular y la apoptosis en cultivos celulares, e
inhibir la carcinogénesis en modelos animales
(Bessada y col., 2019; de-Fátima-Garcia y col., 2021).
Péptidos bioactivos
Los péptidos son
compuestos de dos o más aminoácidos unidos por enlaces peptídicos que
desempeñan un papel fisiológico importante en el organismo. Los péptidos que
presentan actividad biológica se denominan péptidos bioactivos (PBA) y suelen
constar de 2 a 20 residuos de aminoácidos (Maestri y
col., 2019). Se ha demostrado que tienen múltiples funciones fisiológicas,
tales como, antioxidante, antihipertensiva, antidiabética, anticancerígena, inmunomoduladora, antimicrobiana e hipocolesterolémica (Wen y col., 2020; Zhu y col., 2023) que contribuyen
a regular las funciones fisiológicas y prevenir determinadas enfermedades
crónicas, asimismo pueden aplicarse al desarrollo de alimentos funcionales
(Sánchez y Vázquez, 2017). Además, presentan un efecto positivo sobre el sabor,
las propiedades tecnofuncionales, la composición nutricional de los alimentos y prolongan
la vida útil de los alimentos (Yuan y col., 2022).
Métodos
de obtención de los PBA
Las proteínas
vegetales son ricas en PBA, que deben liberarse de las proteínas para exhibir actividad funcional. Por lo tanto, el método de preparación de los péptidos es especialmente
crucial. Los métodos comunes incluyen principalmente hidrólisis enzimática,
fermentación microbiana y métodos sintéticos (químicos y recombinación
genética) (Kent, 2019; Cruz-Casas y col.,
2021), sin embargo, existen tecnologías emergentes, tales como: extracción asistida por microondas y ultrasonido,
alta presión hidrostática, campos eléctricos pulsados, agua subcrítica y
disolventes eutécticos profundos (Rogalinski y col.,
2005; Balasubramaniam y col., 2015; Su y col., 2015; Hernández-Corroto y col., 2020). No obstan-te, estas nuevas tecnologías se encuentran desarrolladas a nivel
laboratorio e incluso algunas de ellas serían muy costosas de implementarse a
nivel industrial (Ulug y col., 2021).
Hidrólisis
enzimática
Para exhibir actividad
biológica, los péptidos deben liberarse de la
estructura primaria de la proteína. La hidrólisis enzimática es uno de los métodos más utilizados, esta
requiere condiciones específicas, tales como:
actividad enzimática, concentración de sus-trato, temperatura y pH (Naeem y col., 2022). La alcalasa®
ha demostrado ser una de las enzimas más eficientes para la preparación de PBA.
Es una "serina endopeptidasa" obtenida originalmente de Bacillus subtilis y
conocida como "subtilisina Carlsberg". Se
pro-duce principalmente mediante fermentación sumergida
en lote alimentado, utilizando Bacillus licheniformis (Tacias-Pascacio
y col., 2020). Una de las propiedades
más relevantes de esta proteasa es que tiene la capacidad de producir
péptidos hidrofóbicos a pH´s alcalinos (9 - 11) (Adamson y Reynolds, 1996).
Diferentes
investigadores han utilizado enzimas digestivas in vitro (pepsina,
tripsina, quimotripsina) para producir péptidos, con el fin de predecir su
formación durante la digestión humana (Marciniak y col.,
2018). La hidrólisis enzimática puede realizarse usando una sola enzima, así como mediante hidrólisis secuenciales con
múltiples enzimas, con la finalidad de
generar una mayor cantidad de péptidos con diversas características
estructurales que al final puedan exhibir
diferentes actividades biológicas (Tak y col.,
2021).
Fermentación
microbiana
La fermentación es un
proceso más económico, comparado con la hidrólisis enzimática, en la cual se utilizan microorganismos
generalmente reconocidos como seguros (GRAS,
por sus siglas en inglés: Generally Recognized as Safe). Es una forma
eficaz de generar PBA y proteínas hidrolizadas mediante enzimas microbianas producidas por levaduras,
bacterias y hongos (Cruz-Casas y col., 2021). El
género de bacterias más usado, para la preparación de PBA mediante el
método de fermentación, es Lactobacillus. El ácido láctico producido por
la fermentación de Lactobacillus puede acidificar rápidamente los
alimentos, proporcionando así seguridad alimentaria
y calidad sensorial (De-Vuyst y Leroy, 2007).
Este género puede influir en la calidad de los polipéptidos al controlar la
hidrólisis de las proteínas intracelulares
(Zhu y col., 2023). Además de bacterias ácido-lácticas se han usado otro tipo de bacterias (Bacillus subtilis) y hongos (Aspergillus flavipes y Aspergillus oryzae)
para producir PBA en soya y leche, respectivamente
(Tak y col., 2021; Naeem
y col., 2022). En general, la fermentación
microbiana es un método prometedor para la preparación de PBA. Es importante
señalar que el tipo y la cantidad de estos péptidos generados dependen
principalmente del microorganismo utilizado para la fermentación (Babini y col., 2017).
Método sintético
Los métodos de
síntesis química incluyen la síntesis
en fase sólida y la síntesis en fase soluble.
El método de fase sólida se basa en la reacción de aminoácidos que se
recubren y no reaccionan en grupos en presencia de sustancias insolubles (Mourtas y col., 2023); esta estrategia se utiliza para
dirigir la reacción hacia el camino deseado. Dicho método supera la desventaja
de la síntesis en fase soluble que requiere purificación en cada paso y mejora
la eficiencia en la producción de péptidos, sin embargo, el proceso de producción debe estar sobrecargado de materias primas, lo que conduce al desperdicio de recursos.
Este método puede sintetizar péptidos de hasta 50 aminoácidos, a diferencia del
método de fase soluble en el cual se pueden sintetizar únicamente
oligopéptidos, con un máximo de 20 unidades de aminoácidos (Kaur, 2018; Zamyatnin, 2018; Akbarian y col., 2022).
El método de
recombinación genética se ha convertido en uno de los más eficaces para la
producción de PBA específicos en la actualidad. Las cepas genéticamente
modificadas, comúnmente utilizadas, son
levaduras (e.g. Saccharomyces
cerevisiae) y bacterias (e.g.
Escherichia coli);
ambas son económicas y fáciles de cultivar, por lo que se pueden preparar PBA
en grandes cantidades, con excelente
eficiencia y alta pureza (Ozawa y col., 2007).
Purificación e
identificación de los PBA
Los hidrolizados de
proteínas son mezclas de péptidos, proteínas no degradadas y aminoácidos
libres, debido a esto se requiere de un proceso de purificación, el cual tiene
como objetivo que diversos compuestos del medio no interfieran en su actividad
biológica y faciliten la identificación estructural de los PBA. Se han
reportado diferentes métodos de purificación como la ultrafiltración y diferentes técnicas de cromatografía (e.g.
filtración en gel, intercambio iónico, fase reversa, afinidad).
La
ultrafiltración utiliza la tecnología de una membrana porosa que se
encuentra presurizada, la cual es semipermeable para retener las proteínas y los péptidos con pesos moleculares
de entre 1 kDa y 500 kDa.
En este método existe una diferencia de presión entre la entrada y la salida de
la membrana, la cual actúa como fuerza impulsora, para la retención de acuerdo
con el diámetro de corte. Dicho proceso permite conservar las fracciones peptídicas
con excelente actividad biológica (Olagunju y col.,
2018; Aondona y col., 2021).
La cromatografía es el
método más utilizado para la separación de péptidos, existen diversos tipos y
cada uno de ellos ofrece ciertas
características estructurales que le confieren al péptido una relación
estructura: actividad. La cromatografía de filtración en gel realiza una
separación por tamaño molecular. Es
aplicable cuando se busca separar fracciones peptídicas con masas
moleculares entre 1 kDa y 200 kDa;
permite una alta recuperación de péptidos y una buena preservación de la
actividad biológica (Piovesana y col., 2018; Yang y
col., 2021). La cromatografía de intercambio iónico se fundamenta en separar
moléculas cargadas, existen dos tipos de
resinas intercambiadoras: catiónicas y aniónicas. Presenta una alta resolución,
sin embargo, la fuerza iónica del eluyente tiene un gran impacto sobre la actividad de la fracción peptídica obtenida (Zhu
y col., 2023). La cromatografía líquida de alta
resolución en fase reversa (RP-HPLC, por sus siglas en inglés: Reversed-Phase High-Performance Liquid Chromatography), tiene la capacidad de separar PBA
en función de su hidrofobicidad, debido a que
consta de una fase estacionaria no
polar y una fase móvil polar (Piovesana y col., 2019). Por último, la cromatografía de
afinidad se basa en el principio de interacción molecular específica para la
purificación de péptidos, los péptidos diana pueden unirse selectivamente a
algún grupo portador de la fase estacionaria,
logrando así la separación de otros péptidos, las ventajas significativas de
este método son la alta especificidad
y resolución, sin embargo, su rango
de aplicabilidad es pequeño y se utiliza principalmente para la purificación de glicoproteínas y
anticuerpos (Barredo-Vacchelli y col., 2021; Su y
col., 2023).
Para la identificación
de los PBA se ha empleado la espectrometría de masas (MS, por sus siglas en
inglés: Mass Spectrometry),
debido a su alta sensibilidad, precisión y facilidad de operación. En la MS se
bombardean los péptidos para convertirlos en iones y fragmentarlos, y así poder
detectarlos según su relación carga-masa. Existen di-versas modificaciones en
la técnica, una de ellas es la MS en tándem (MS/MS) con la cual se pueden medir
con precisión su masa molecular y secuencia
de aminoácidos (Mora y Toldrá, 2021). Las
técnicas de ionización suave como la espectrometría de masas por tiempo de
vuelo con desorción/ionización de láser asistida por matriz (MALDI-TOF-MS, por sus siglas en inglés: Matrix Assisted Laser Desorption Ionization -Time of Flight Mass Spectrometry) los iones
moleculares y fragmentados de la muestra pasan a través de una serie de separadores y lentes electrostáticos hacia un analizador
de masas. La técnica presenta una sensibilidad de intervalo de masa entre 2 Da y 20 000 Da, con una exactitud 10 ppm
a 100 ppm (Ahamad y col., 2022).
Actividades biológicas
Durante las últimas
dos décadas, el frijol común (Phaseolus vulgaris
L.) ha sido objeto de una gran cantidad de estudios, debido a que es una
leguminosa que ha estado presente en la alimentación del ser humano de forma
milenaria, pero que actualmente, debido a los
usos y costumbres que prevalecen en países desarrollados y en vías de desarrollo, han hecho que su consumo per cápita
disminuya de forma considerable (Gha-ribzahedi y col., 2024).
Este cambio en los hábitos alimenticios, con una tendencia hacia la
comida rápida, se ha asociado con el desarrollo de las ENT (Wang y Wang, 2020).
Por lo que los investigadores se encuentran interesados en rescatar diversos
componentes de los alimentos que actualmente
son subutilizados, como es el caso de las proteínas del frijol. En la
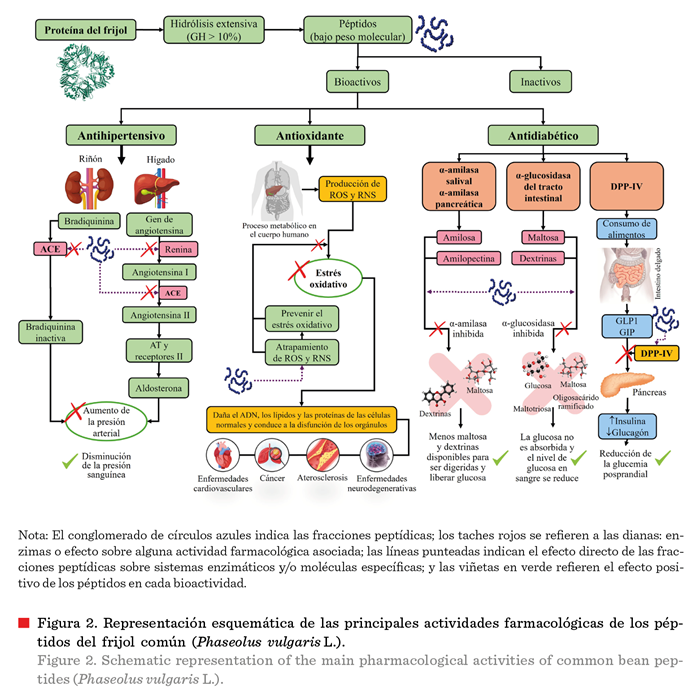
Figura 2 se presenta el papel que desempeñan
los PBA identificados en el frijol, asociados con su efecto antihipertensivo,
antioxidante y antidiabético; se muestran cuáles son las enzimas diana y/o
moléculas en donde los péptidos pueden
ejercer su efecto farmacológico en el organismo. El efecto de los
péptidos inhibidores sobre las principales enzimas diana, tales como: la enzima
convertidora de angiotensina (ACE, por sus
siglas en inglés: Angiotensin Converting Enzyme), encargada de
la modulación de la presión arterial y generar por lo tanto un efecto
antihipertensivo, está modulado por la inhibición de compuestos que incrementan
la presión arterial, como son, bradiquininas
inactivas y la angiotensina II, los cuales son potentes vasoconstrictores, por lo tanto, la inhibición de ACE produce
una reducción en la presión arterial (Tawalbeh y
col., 2023). Por otro lado, el papel de los péptidos con funcionalidad
antioxidante es prevenir el estrés oxidativo (proceso que ocurre cuando existe
un desequilibrio entre la producción de radicales libres y la capacidad del
organismo para neutralizarlos), debido al atrapamiento de especies reactivas de oxígeno y nitrógeno, las cuales se
producen de forma endógena y exógena, y son responsables del daño
celular que puede desencadenar en distintas enfermedades crónico-degenerativas
(Tak y col., 2021). Por último, el efecto
antidiabético se ha demostrado mediante la
aplicación de las fracciones peptídicas del frijol en la inhibición las
enzimas a-amilasa y a-glucosidasa; encargadas de la
absorción de glucosa en el tracto gastrointestinal, y la enzima dipeptidil peptidasa: DPP
– IV, responsable de modular la actividad de dos hormonas llamadas
incretinas (GLP-1: el péptido I, similar al glucagón; y GPI: péptido insulinotrópico
dependiente de glucosa), de manera postprandial, por lo que la inhibición de estas enzimas dará como resultado una
reducción significativa en los niveles de glucosa en sangre (Rahmi y Arcot, 2023).
Actividad antioxidante
Las especies reactivas
de nitrógeno (RNS, por sus siglas en inglés: Reactive Nitrogen
Species) o especies reactivas de oxígeno (ROS, por
sus siglas en inglés: Reactive Oxygen Species), en su forma de radicales y no radicales, se producen durante el proceso metabólico
normal de las células. Si dichas especies aumentan a nivel celular,
causan una alteración en el equilibrio oxidativo y conducen a la condición
denominada estrés oxidativo (Mudgil y col., 2019). El estrés oxidativo está
relacionado con el desarrollo de ENT, como
el cáncer, la aterosclerosis, las enfermedades cardiovasculares y las neurodegenerativas (e.g.
Alzheimer) (Uttara y col., 2009; Tak y col.,
2021; Naeem y col., 2022; Karami
y Duangmal, 2023). La producción excesiva de
radicales libres pueden dañar el ADN, los lípidos y las proteínas de las
células normales (Lorenzo y col., 2018; Li y col., 2020). Los péptidos con
propiedades antioxidantes se pueden utilizar
para prevenir ese daño oxidativo, debido a su capacidad para atrapar y
neutralizar los radicales libres. Peighambardoust y
col. (2021) informaron que factores como la
polaridad, el efecto estérico, la
hidrofobicidad, los enlaces de hidrógeno, la secuencia de aminoácidos y su impacto en la estructura secundaria, están
relacionados con las funciones bioactivas de
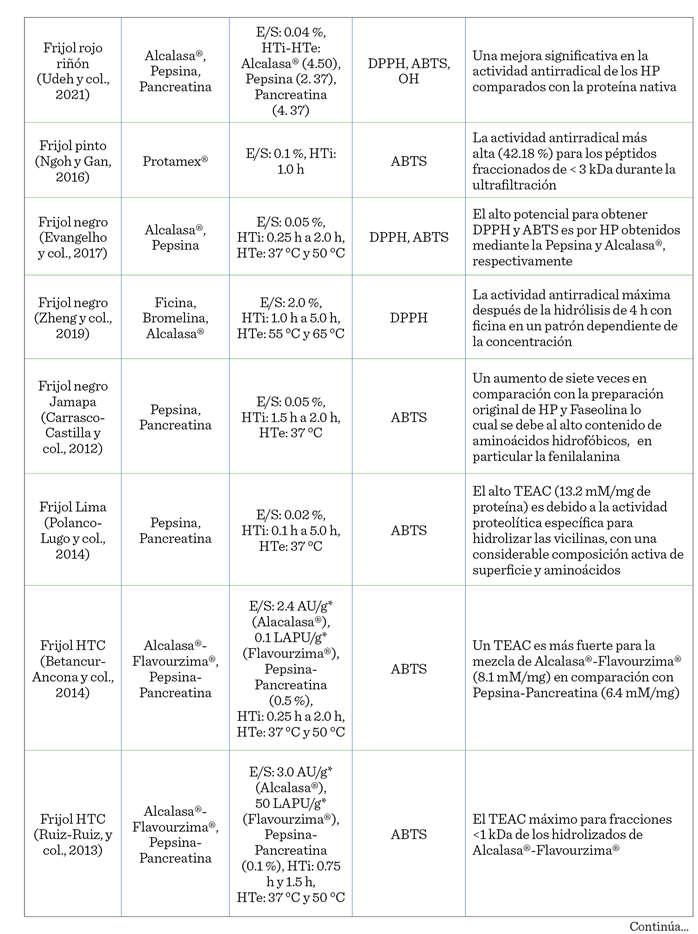
los péptidos. En la Tabla 1 se encuentra
concentrada la información
correspondiente a la actividad antioxidante evaluada en los hidrolizados del frijol común.

Para evaluar el efecto
antioxidante de los péptidos in vitro se han utilizado diversos métodos químicos, entre los cuales destacan los
ensayos como la eliminación del radical libre 2,2-difenil-1-picrilhidracilo
(DPPH•) y el radical catiónico
2,2-azinobis-(3-etilbenzotiazolina-6-sulfonato) (ABTS•+); la
capacidad de absorción de radicales de oxígeno (ORAC, por sus siglas en inglés:
Oxygen Radical Absor-bance Capacity), reduciendo la actividad mediante
voltamperometría cíclica (CV, por sus siglas en inglés: Ciclic
Voltammetry), por colorimetría midiendo la capacidad
de reducción férrica del plasma (FRAP, por
sus siglas en inglés: Ferric Reducing
Ability of Plasma); y
la capacidad antioxidante reductora del cobre (CUPRAC, por sus siglas en
inglés: Cupric Reducing Antioxidant Capacity);
respectivamente, el potencial antioxidante total de captura de radicales (TRAP,
por sus siglas en inglés: Total Reactive Antioxidant Potential), poder reductor (RP, por sus siglas en inglés: Reducing Power) e inhibición de
la oxidación de lipoproteínas de baja
densidad (Gulcin,
2020).
Aguilar
y col. (2019) utilizando hidrolizados proteínicos (HP) del
frijol negro informaron que mejoraba su actividad antioxidante hasta en un 70 % en el RP, usando una mezcla de proteasas (alcalasa® y flavourzyme®). Otros investigadores utilizando dos proteasas de la familia de las subtilisinas: alcalasa® y savinasa, encontraron hidrolizados con potentes actividades
eliminadoras de radicales libres (326 mmol a
348 mmol TE/g) cuando se utilizó alcalasa® durante 2 h de hidrólisis (Garcia-Mora y col., 2015). La alcalasa® puede
producir péptidos antioxidantes de manera efectiva debido a su amplia
especificidad y sitios de corte de aminoácidos
hidrofóbicos que actúan como donantes de hidrógeno. Los PBA reportados fueron: SGAM, DSSG, LLAH, YVAT,
EPTE y KPKL con propiedades antioxidantes obtenidos de cultivares de frijol (Phaseolus
vulgaris
L.), cuyas masas moleculares determinadas
por cromatografía de líquidos acoplado a
espectrometría de masas/masas (LC-MS/MS, por sus siglas en inglés: Liquid Chromatography Mass Spectrometry/Mass Spectrometry)
osciló entre 300 Da y 1 500 Da (Mojica
y de-Mejía, 2015). Zheng y col. (2019) evaluaron
la actividad antioxidante de HP del frijol negro usando proteasas vegetales
(e.g. ficina y bromelina) y
microbianas (e.g. alcalasa®)
durante 5 h de hidrólisis, donde se encontró,
que los hidrolizados con mayor capacidad antioxidante fueron obtenidos con alcalasa®,
evaluado como capacidad de eliminar el radical DPPH (IC50
21.11 mg/mL), así como de quelar el ion ferroso (IC50 6.82 mg/mL). Por otro lado, algunos investigadores, utilizando
el frijol rojo riñón, aplicando tecnologías emergentes como alta presión
hidrostática (300 MPa) acoplado a hidrólisis enzimática utilizando alcalasa® (1 % E/S), durante 15 min, obtuvieron un valor de
30.1 % en la capacidad para eliminar el radical DPPH, en comparación con la
hidrólisis enzimática, la cual fue de 24.7 % (Al-Ruwaih
y col., 2019).
Evangelho y col.
(2017) utilizando hidrolizados enzimáticos del frijol negro, mediante pepsina y
alcalasa® (1:20 E/S), durante 2 h, encontraron que la
actividad eliminadora del radical DPPH fue mayor (» 44 %) para la pepsina
comparado con alcalasa® (» 37 %), sin embargo, al
evaluar la actividad eliminadora del radical ABTS•+ observaron que
los hidrolizados obtenidos con alcalasa® presentaron un valor mayor de 64 % comparado con
la pepsina, que fue de 47 %. Estudios recientes han demostrado que, fraccionar
las proteínas del frijol rojo riñón en albúminas y globulinas antes de hidrolizarlas, permite inducir diferentes efectos;
la fracción de globulinas mostró mayor
capacidad antioxidante: atrapamiento de los radicales (•OH, DPPH•
y ABTS•+), quelación de metales y FRAP, que asociaron a un carácter
más hidrofóbico, resultante del mayor contenido de enlaces disulfuro presentes
en la globulina en comparación con las glicoproteínas de la albúmina. Sin
embargo, cuando la fracción proteínica
original fue hidrolizada mediante alcalasa® y
la combinación pepsina-pancreatina se encontró un aumento de »
88 %, 80 % y 73 % en el atrapamiento de los radicales •OH, DPPH•
y ABTS•+, respectivamente, para los hidrolizados realizados con
pepsina-pancreatina. Los autores mencionaron que la hidrólisis dio como
resultado un aumento del contenido de aminoácidos aromáticos e hidrofóbicos,
los cuales, al estar presentes en los
hidrolizados, sus péptidos manifiestan una
alta capacidad para transferir electrones,
quelar o para neutralizar las ROS y RNS (Udeh y col., 2021).
Actividad
antihipertensiva
La hipertensión
representa una amenaza grave y creciente para la salud humana, puede causar
muchas enfermedades graves, como insuficiencia cardíaca, accidente
cerebrovascular e insuficiencia renal (Wei y col., 2019); a nivel mundial
afecta entre el 10 % al 20 % de los adultos y del 40 % al 50 % de las personas
de edad avanzada (Das y Hati, 2022). Los estilos de
vida poco saludables, un elevado estrés psicológico y los cambios en las
funciones físicas debido al envejecimiento y la
obesidad son responsables de la alta prevalencia de la hipertensión (Xiang y col., 2023). Para regular la presión arterial en
humanos y otros mamíferos existen dos sistemas endócrinos: renina-angiotensina
y calicreínacinina, en donde la enzima convertidora
de angiotensina ACE presenta un papel
clave en modulación de la presión arterial al convertir la angiotensina-I en
angiotensina-II, un potente vasoconstrictor,
lo que provoca un aumento de la presión arterial (Jogi
y col., 2022; Tawalbeh y col., 2023). Por lo tanto,
la inhibición de esta enzima se ha considerado como una forma crucial de
reducir la presión arterial, así como ajustes en el estilo de vida, enfoques
dietéticos y terapia farmacológica.
Diversos autores han
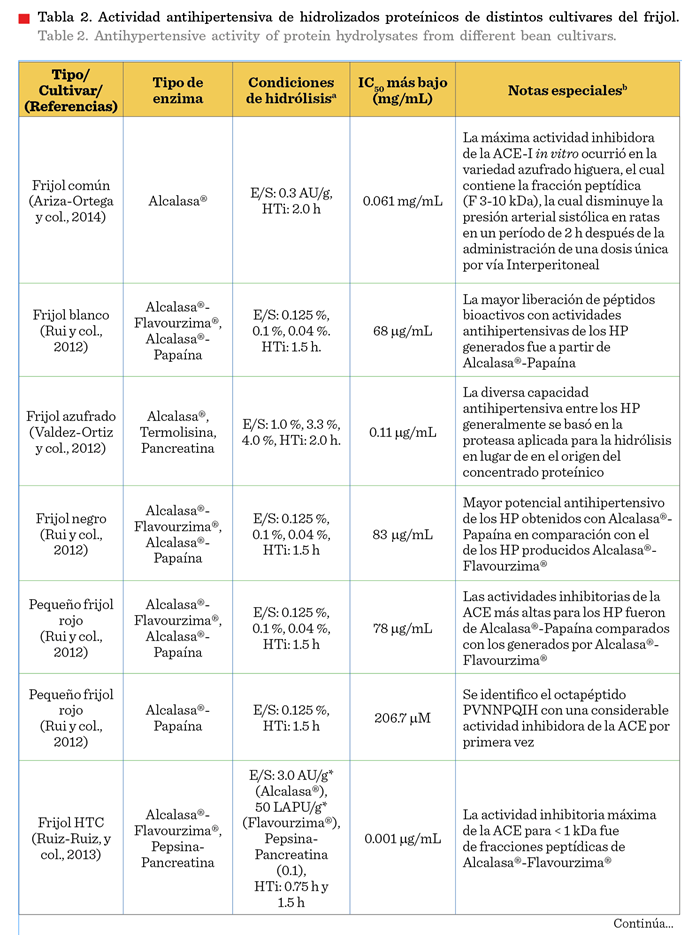
utilizado hidrólisis enzimática para producir péptidos inhibidores de la ACE. Udeh y col. (2021) realizaron hidrolizados proteínicos (HP)
del frijol rojo riñón, encontrando un incremento en la actividad inhibitoria de
la ACE (i-ACE) de 93 % y 85 % cuando se usó
pepsina-pancreatina y alcalasa®,
respectivamente; se reportó que después de 4 h de hidrólisis, la mayor
actividad i-ACE se presentó en el sistema proteolítico conjugado
(pepsina-pancreatina), debido a las actividades duales de endo
y exopeptidasa. Rui y col. (2012) evaluaron las actividades i-ACE de los HP
obtenidos de frijoles rojos, blancos y negros calentados o sin calentar en un
sistema de digestión secuencial de alcalasa®-flavourzyme® o alcalasa®-papaína.
Los resultados mostraron que el uso de pre-tratamiento térmico y una mezcla de alcalasa®-papaína podría degradar rápidamente las proteínas
del frijol en péptidos más pequeños en las primeras etapas de la digestión, lo
que generó a una mayor actividad antihipertensiva. Los autores reportaron, la
actividad inhibidora media máxima (IC50) de la ACE para los
hidrolizados con alcalasa®-papaína durante 95 min a
100 min de frijoles calentados, obteniendo
los siguientes valores: blancos (IC50 = 68 mg/mL), rojos (IC50
= 78 mg/mL) y negros (IC50 = 83mg/mL).
Estos hallazgos demostraron que el mecanismo de escisión de la proteasa
específico de la papaína acelera la liberación de péptidos con actividades de
i-ACE a partir de las proteínas del frijol.
Por otro lado, Akıllıoğlu y Karakaya (2009),
reportaron un incremento en la
actividad i-ACE en los HP de frijol
común y pinto al aplicar calor a 121 °C en varios momentos antes de la
digestión gastrointestinal (GI) in vitro, debido a una mayor liberación de PBA. Rui y col. (2013) también evaluaron la actividad i-ACE (IC50 =67.2
mg/mL) de HP del frijol rojo producidos por digestión secuencial con alcalasa®-papaína seguida de simulación GI in vitro.
La purificación y el fraccionamiento en tres pasos de los hidrolizados del
frijol rojo condujeron a la detección de
péptidos de 5 kDa con una actividad i-ACE del 78.2 %. Ruiz-Ruiz y col.
(2013), usando frijol negro común (Phaseolus vulgaris
L.) var. Jamapa, difíciles de cocinar, realizaron HP
utilizando dos sistemas enzimáticos
secuenciales de pepsina-pancreatina y alcalasa®-flavourzyme®.
Posteriormente se fraccionaron en varias secuencias de péptidos con diferentes masas moleculares, las fracciones
peptídicas que tenían de entre 9 a 11 aminoácidos (1.1 kDa
a 1.3 kDa) presentaron actividades i-ACE más altas,
por lo que los investigadores indicaron una correlación ente la masa del
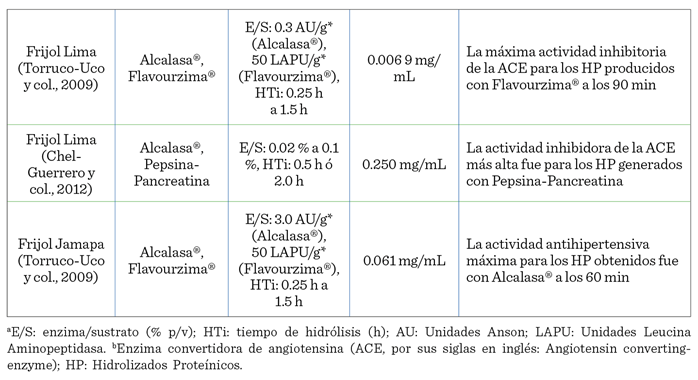
péptido y la actividad i-ACE. En la Tabla 2 se encuentra concentrada la información correspondiente a la actividad
antihipertensiva evaluada en los hidrolizados del frijol común.
Actividad
antidiabética
La diabetes mellitus
(DM) es una enfermedad crónica de distribución mundial causada por una hiperglucemia
crónica, resultante de defectos en la secreción y/o acción de la insulina, que
afecta el metabolismo de los carbohidratos,
los lípidos y las proteínas, causando una morbilidad y mortalidad
impresionantes en todo el mundo. Se encuentra dentro de las 10 principales
causas de muerte a nivel mundial (Lin y col.,
2020). La Asociación Americana de Diabetes (ADA, 2021), informó que los
efectos de la DM a largo plazo están asociados a un gran número de
complicaciones, tales como enfermedades cardiovasculares (ECV), enfermedad
renal, hipertensión, neuropatías (enfermedad de los nervios) y ceguera (retinopatías). Existen varios tipos de
DM, sin embargo, los tipos más representativos de dicha enfermedad a
nivel mundial son: el tipo 1 y 2, y la
gestacional, ocupando el 90 %, 5 % a 7 % y 2 % a 3 %, respectivamente
(Antony y Vijayan, 2021). En 2021, 537 millones de
personas padecían diabetes, se prevé que esta cifra alcance los 643 millones en 2030 y los 783 millones en 2045. Además, 541 millones de personas presentaron intolerancia a la glucosa en 2021, según los datos de la Federación Internacional de Diabetes (IDF,
2021).
Debido al impacto que
representa la DM a nivel mundial, siendo la tipo 2 la
de mayor prevalencia en la población, existen diversos medicamentos con efecto
hipoglucemiante y que son bien tolerados vía oral. Los hipoglucemiantes orales
ayudan a controlar los niveles de glucosa en sangre por diversos mecanismos,
entre los cuales se encuentran las biguanidas (metformina), la cual reduce la
resistencia a la insulina en el hígado y disminuye la producción de glucosa
hepática; tiazolidinedionas, que mejoran la sensibilidad
a la insulina; sulfonilureas y meglitinidas; que son secretagogos de insulina; gliflozinas:
inhibidores del cotransportador sodio-glucosa tipo 2 (SGLT2, por sus siglas en inglés: Sodium-Glucose co-Transporter-2); acarbosa y miglitol: inhibidores
de la a-glucosidasa; acarbosa:
inhibidor de la a-amilasa y; gliptinas: inhibidores de la dipeptidil
peptidasa - IV (DPP-IV) (ADA, 2020; Moreno-Valdespino y col., 2020; Hu y col., 2023; Rahmi y Arcot, 2023).
La DPP-IV, la a-glucosidasa y la a-amilasa son algunas de las enzimas
implicadas en el metabolismo de la glucosa. La DPP-IV degrada dos hormonas
llamadas incretinas (GLP1 y GPI) que
estimulan la liberación de insulina durante una comida, responsables de hasta
el 70 % de liberación de esta hormona de forma posprandial (Barati y col., 2020). Por el papel que representa la DPP-IV, la inhibición de dicha enzima es una
estrategia para tratar la diabetes. Otra forma de controlar la enferme-dad es
inhibir la actividad de la a-glucosidasa o a-amilasa,
con ello se retardará la liberación de glucosa, debido a que estas enzimas son
cruciales para controlar la absorción de glucosa
en el intestino delgado (Acquah y col., 2022).
En la Tabla 3 se encuentra concentrada la información correspondiente a la
actividad antidiabética evaluada en los hidrolizados del frijol común.
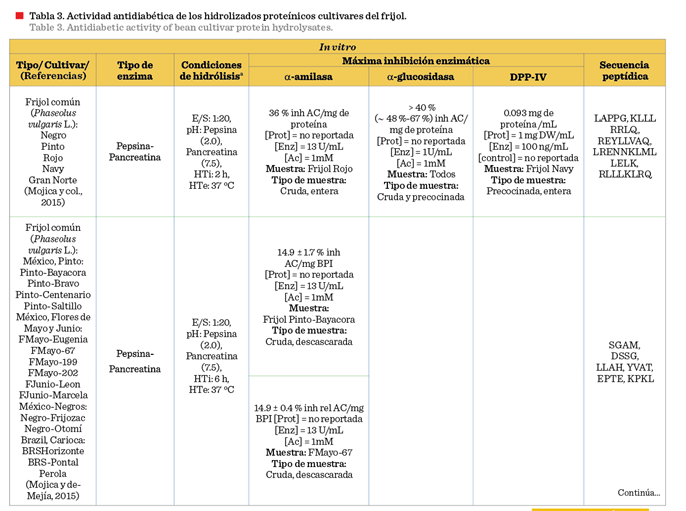
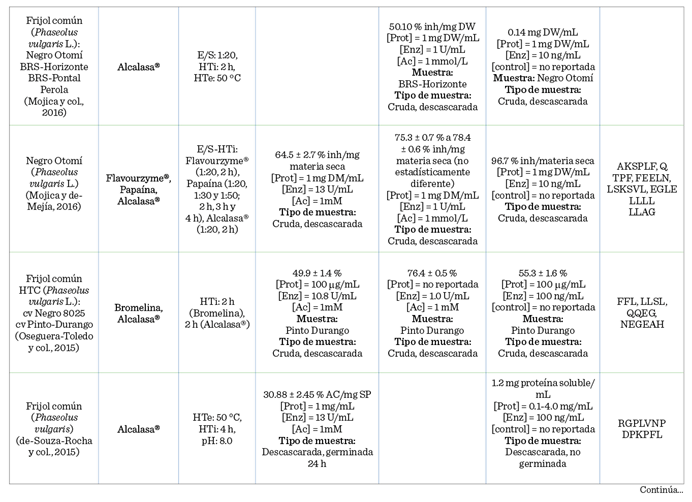
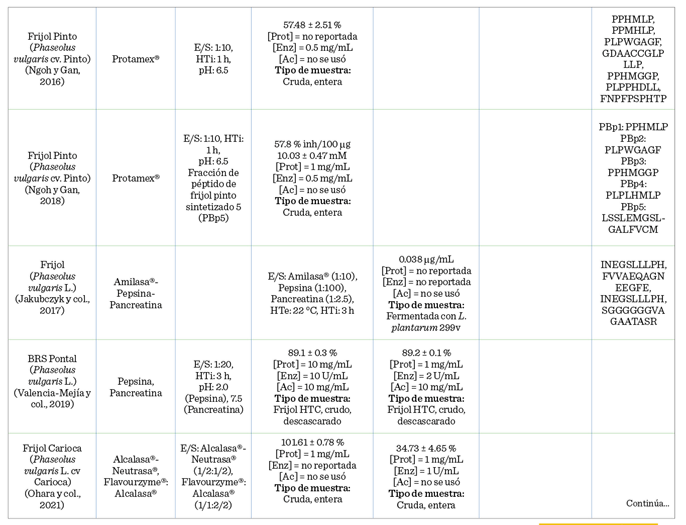
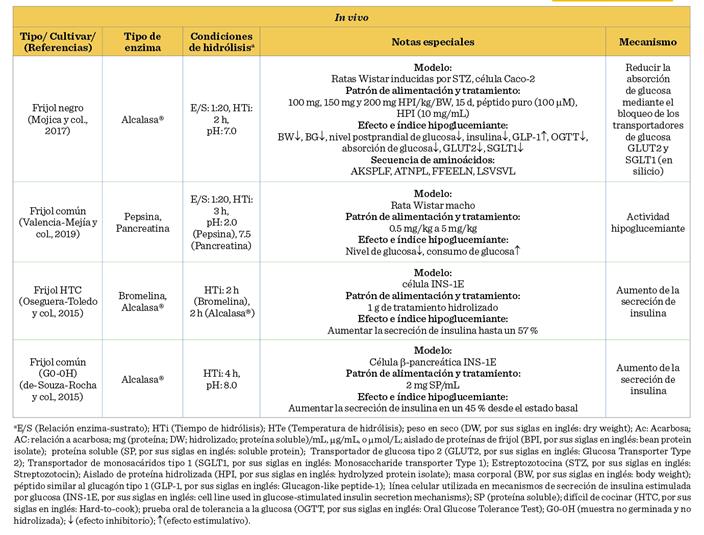
Los HP de frijoles
(Pinto Durango y Negro 8025) difíciles de cocinar (Phaseolus
vulgaris L.)
fueron evaluados como fuente de péptidos antidiabéticos por
Oseguera-Toledo y col. (2015), quienes demostraron que las fracciones con un
peso molecular inferior a 1 kDa de los hidrolizados de frijol, obtenidos por alcalasa® y bromelina, presentaron potencial antidiabético.
Se demostró que la fracción < 1 kDa del
frijol pinto Durango-bromelaína mostró la
mejor inhibición de la a-amilasa (49.9 ± 1.4 %), y la fracción < 1 kDa del frijol pinto Durango-alcalasa®
inhibió tanto la a-glucosidasa (76.4 ± 0.5 %) como la
DPP-IV (55.3 ± 1.6 %); y las secuencias peptídicas de LLSL, QQEG y NEGEAH se
identificaron a partir de las fracciones más potentes. Además, encontraron que
los hidrolizados y las fracciones (< 1 y 1 kDa a 3
kDa) aumentaron la secreción de insulina, estimulada
por glucosa en las células iNS-1E hasta un 57 % en comparación con el control
de glucosa. Se ha demostrado que los péptidos antidiabéticos, con los
aminoácidos: prolina, glicina, serina, leucina, valina y alanina; en la
posición N-terminal, inhiben el sitio catalítico de las enzimas a-amilasa, a-glucosidasa y DPP-IV. El cambio de los aminoácidos en esta
ubicación, así como la estructura y conformación de la cadena peptídica, dio
como resultado un potencial inhibidor variado (Castañeda-Pérez y col., 2019).
En un estudio de frijol común (variedades negro, pinto, rojo, blanco y gran norte), los HP de frijol blanco,
elaborados con pepsina-pancreatina, exhibieron la mayor actividad inhibidora de
la DPP-IV. Las secuencias identificadas fueron QQRRLLRRK y LRENNKLMLLELK, las cuales se identificó que obstaculizaban el sitio catalítico de las enzimas a-amilasa, a-glucosidasa
y DPP-IV, y por lo tanto su función (Mojica y col., 2015). Por otro lado, Mojica y de-Mejía (2016), evaluando HP del frijol negro (Phaseolus
vulgaris
L.), encontraron que, utilizando alcalasa® durante 2
h (E/S 1:20), se obtuvo la mayor cantidad de péptidos antidiabéticos para
DPP-IV (96.7 %), a-amilasa (53.4 %) y a-glucosidasa (66.1 %). Los autores evaluaron mediante un análisis de acoplamiento
molecular las secuencias peptídicas:
EGLELLLLLLAG, AKSPLF y FEELN (inhibieron
la DPP-IV), TTGGKGGK (inhibió la a-glucosidasa), así como AKSPLF y WEVM (inhibieron la a-amilasa). También reportaron que las
principales uniones en el sitio catalítico fueron con los aminoácidos Asp192,
Glu192 y Arg253 para la enzima DPP-IV; Tyr151,
His201 e Ile235 para la a-amilasa;
y Asp34, Thr83 y Asn32 con la a-glucosidasa. En
otro estudio de revisión se argumentó que los
residuos de aminoácidos de: histidina, triptófano, tirosina y arginina
mostraron potencial de inhibición de la a-amilasa.
Estos residuos, identificados en fracciones peptídicas, se unían al sitio
catalítico de la enzima mediante interacciones hidrofóbicas que impidieron a la enzima ligarse con el respectivo
sustrato (Obiro y col., 2008). Mojica y col. (2017),
sometieron frijol negro mexicano y carioca
brasileño a digestión con pepsina/pancreatina, y encontraron que la
concentración media máxima inhibitoria (IC50) para la DPP-IV fue
entre 0.03 mg/mL a 0.87 mg/mL (presentando inhibición del tipo competitivo) y
para la a-amilasa 36.3 % a 50.1 %.
También probaron la actividad de 4 péptidos puros, previamente aislados de los frijoles analizados, encontrando uno que mostró
mayor actividad inhibitoria (P < 0.05) para la DPP-IV, el cual fue KTYGL.
Otras bioactividades
Algunos trabajos de
investigación han mostrado evidencia de otras actividades en los HP del frijol
común. Luna-Vital y col. (2014), utilizando
péptidos presentes en las fracciones no
digeribles (FND) del frijol común, los cuales fueron obtenidos mediante
hidrólisis enzimática, evaluaron su actividad anticancerígena, específicamente su acción antiproliferativa
sobre las células de cáncer colorrectal humano. Encontraron cinco
péptidos con actividad antiproliferativa (GLTSK, LSGNK, GEGSGA, MPACGSS y MTEEY), de
las dos líneas celulares estudiadas: HCT116 y RKO, los extractos que mostraron mayor grado de inhibición fueron los del frijol azufrado Higuera (IC50 = 0.53 mg/mL) y bayo Madero (IC50
= 0.51 mg/mL), respectivamente. Además, ambos cultivares aumentaron
significativamente (P < 0.05) la
expresión de p53 en la línea celular HCT116 en un 76 % y 68 %,
respectivamente. Los resultados sugieren que los péptidos presentes en FND del
frijol común contribuyeron al efecto antiproliferativo
en las células de cáncer colorrectal humano, al modificar las moléculas
involucradas en la detención del ciclo
celular o la apoptosis.
La actividad antiiflamatoria de HP del frijol pinto (Phaseolus
vulgaris L.), obtenidos mediante la acción de dos
subtilisinas (alcalasa® y savinasa), aumentó al incrementar la concentración de
péptidos de bajo peso molecular, después de 120 min con alcalasa®,
así como, con el incremento simultáneo del contenido de ácidos hidroxicinámicos y flavonoides en los hidrolizados, después
de 90 min, utilizando savinasa, debido a su mayor
actividad esterasa. En el estudio se usaron células del miofibroblasto (CCD-18Co)
inducidas por la Interleucina 1 beta (IL-1b), sobre la expresión de la
Interleucina 6 (IL-6) utilizada como marcador proinflamatorio. El hidrolizado
obtenido por alcalasa® (120 min) fue el que inhibió
con mayor potencia la secreción de IL-6 con un valor del 28 % de inhibición vs.
con-trol, seguido de los hidrolizados producidos por alcalasa®
(15 min) y savinasa (60 min o 90 min) siendo del 16 %
de inhibición vs control (Garcia-Mora y col.,
2015).
Roy y col. (2020)
evaluaron el efecto antimicrobiano de hidrolizados proteínicos de frijol rojo
riñón obtenidos por pepsina (DPH-1) y papaína (DPH-2). Los investigadores
encontraron que el hidrolizado de DPH-1 podría inhibir fuertemente dos
bacterias Gram-negativas como Escherichia
coli y Pseudomonas ae-ruginosa,
con un diámetro de zona de inhibición de
20.26 mm y 19.23 mm, respectivamente.
Aunque se observó una ligera actividad bactericida, tanto de DPH-1 como
de DPH-2 contra B. subtilis y Staphylococcus aureus,
estos hidrolizados no pudieron prevenir el crecimiento de bacterias Gram
positivas como Proteus mirabilis y Klebsiella pneumoniae y
especies de hongos como Aspergillus y Penicillium.
Por otro lado, se ha evaluado la actividad antimicrobiana, en el mismo frijol
rojo riñón utilizando el método de difusión en disco, evaluando una
concentración de 100 mg/mL de HP de frijol con diversos grados de hidrólisis
(GH). La actividad antimicrobiana máxima in situ e in vitro se
encontró para los hidrolizados con un GH del 33.7 %. Los hidrolizados de frijol
inhibieron el crecimiento celular de
bacterias Gram negativas (E. coli O157:H7 y E. coli
E32511) y Gram positivas (B. licheniformis y
B. thuringiensis) en un 78 % a 80 % y un 70 %
a 75 %, respectivamente (Roy y col., 2020).
Referente
a la actividad hipocolesterolémica, Gomes y
col. (2020) demostraron que, el uso de HP de
frijol común, en ratones BALB/c alimentados con una dieta aterogénica,
podría prevenir de forma adecuada la
disfunción endotelial al modular el
metabolismo de los lípidos. Los
autores concluyeron que el HP del frijol
mostró actividad hipocolesterolémica, previniendo la
inflamación y disfunción del endotelio vascular, además de disminuir el
estrés oxidativo, indicando un efecto
coadyuvante en la reducción del riesgo aterogénico.
La
producción de péptidos vía hidrólisis enzimática ha sido el
mejor método para la generación de bioactividades en las proteínas de origen
vegetal, sin embargo, debido a la disponibilidad de microorganismos
fermentativos, se están explorando nuevas formas de producción de biopéptidos. El método
de purificación que tiene un mayor
costo/beneficio es el de ultrafiltración, debido a que existen equipos a nivel
industrial que permiten una correcta separación. Las proteínas
“subutilizadas” encontradas en las semillas de frijol, han demostrado presentar
una serie de bioactividades, tales como, antioxidantes, antihipertensivas, antidiabéticas, anticancerígena, antiinflamatoria
y antimicrobiana, las cuales pueden ser obtenidas mediante acción proteolítica, lo que hace que los alimentos de origen vegetal
sean de interés para una alimentación saludable;
dichos alimentos han demostrado tener una excelente biodisponibilidad,
además de ser seguros para el ser
humano.
CONCLUSIONES
Los hidrolizados
proteínicos del frijol común (Phaseolus vulgaris L.) y sus respectivos péptidos derivados
presentan diferentes propie-dades bioactivas. La hidrólisis enzimática
representa un excelente método para la obtención de péptidos bioactivos. En
particular, la enzima alcalasa® o la combinación de
esta con alguna proteasa comercial o gastrointestinal, podría ser utilizada con
éxito, debido a la liberación de hidrolizados proteínicos/péptidos bioactivos,
los cuales podrían ser incorporados en suplementos alimenticios con la finalidad
de prevenir o reducir el aumento de la glucosa,
el colesterol o los triglicéridos en sangre y con ello reducir el riesgo
de desarrollar enfermedades crónicas, como las cardiovasculares, el cáncer y la
diabetes mellitus tipo 2. Entre las
actividades que presentan los péptidos bioactivos se encuentran las que
podrían tener un impacto sobre patologías involucradas con los procesos de
inflamación y estrés oxidativo. La evidencia científica acumulada indica que,
el uso de hidrolizados proteínicos,
derivados de las semillas de frijol, es
adecuado para el desarrollo de aditivos bioactivos, productos
nutracéuticos y alimentos funcionales, ya que se ha demostrado que son, además
de efectivos, seguros.
Agradecimientos
Los autores agradecen
al Tecnológico Nacional de México por el financiamiento otorgado al proyecto
con clave 16886.23-PD.
DECLARACIÓN DE
INTERESES
Los
autores declararon no tener conflicto de interés alguno.
Referencias
Acquah, C., Dzuvor,
C. K. O., Tosh, S., & Agyei, D. (2022). Anti-diabetic effects of bioactive
peptides: recent advances and clinical implications. Critical reviews in
food science and nutrition, 62(8), 2158-2171.
https://doi.org/10.1080/10408398.2020.1851168
ADA, American Diabetes Association
(2020). 9. Pharmacologic Approaches to Glycemic Treatment: Standards of Medical
Care in Diabetes—2020. Diabetes Care, 43(Supplement_1), S98-S110. https://doi.org/10.2337/dc20-S009
ADA, American Diabetes Association
(2021). 2. Classification and Diagnosis of Diabetes: Standards of Medical Care
in Diabetes—2021. Diabetes Care, 44(Supplement_1), S15-S33. https://doi.org/10.2337/dc21-S002
Adamson, N. J. & Reynolds, E. C.
(1996). Characterization of casein phosphopeptides
prepared using alcalase: Determination of enzyme
specificity. Enzyme and microbial technology, 19(3), 202–207. https://doi.org/10.1016/0141-0229(95)00232-4
Aguilar, J. G., dos, S.,
Granato-Cason, V., & de-Castro, R. J. S. (2019). Improving antioxidant
activity of black bean protein by hydrolysis with protease combinations. International Journal of food science
& technology, 54(1), 34-41. https://doi.org/10.1111/ijfs.13898
Ahamad, J., Ali, F., Sayed, M. A.,
Ahmad, J., & Nollet, L. M. L. (2022). Basic Principles and Fundamental
Aspects of Mass Spectrometry. In L. Nollet & R. Winkler (Eds.), Mass
spectrometry in food analysis (pp. 3-17). CRC Press. https://doi.org/10.1201/9781003091226-2
Akbarian, M., Khani, A., Eghbalpour, S., & Uversky, V.
N. (2022). Bioactive Peptides: Synthesis, Sources, Applications, and Proposed
Mechanisms of Action. International Journal of molecular sciences,
23(3), 1445–1474. https://doi.org/10.3390/ijms23031445
Akıllıoğlu, H. G. & Karakaya, S. (2009).
Effects of heat treatment and in vitro digestion on the Angiotensin converting
enzyme inhibitory activity of some legume species. European food research
and technology, 229(6), 915-921. https://doi.org/10.1007/s00217-009-1133-x
Alidoost, S., Maleki, M., & Pourasghari, H. (2021). Identifying drivers and factors
affecting behavioral risk factors of noncommunicable diseases: A scoping review. Journal of education and health promotion,
10, 398-406. https://doi.org/10.4103/jehp.jehp_1379_20
Al-Ruwaih,
N., Ahmed, J., Mulla, M. F., & Arfat, Y. A. (2019). High-pressure assisted
enzymatic proteolysis of kidney beans protein isolates and characterization of
hydrolysates by functional, structural, rheological
and antioxidant properties. LWT, 100, 231-236. https://doi.org/10.1016/j.lwt.2018.10.074
Antony, P. & Vijayan, R.
(2021). Bioactive
Peptides as Potential Nutraceuticals for Diabetes Therapy: A Comprehensive
Review. International journal of molecular sciences, 22(16), 9059. https://doi.org/10.3390/ijms22169059
Aondona, M. M., Ikya, J. K., Ukeyima, M. T., Gborigo, T. J.
A., Aluko, R. E., & Girgih, A. T. (2021). In
vitro antioxidant and antihypertensive properties of sesame seed enzymatic
protein hydrolysate and ultrafiltration peptide fractions. Journal of food biochemistry, 45(1), e13587–e13599. https://doi.org/10.1111/jfbc.13587
Ariza-Ortega, T. D. J., Zenón-Briones, E. Y.,
Castrejón-Flores, J. L., Yáñez-Fernández, J., Gómez-Gómez, Y. D. L. M., &
Oliver-Salvador, M. D. C. (2014). Angiotensin-I-converting enzyme inhibitory,
antimicrobial, and antioxidant effect of bioactive peptides obtained from
different varieties of common beans
(Phaseolus vulgaris L.) with in vivo antihypertensive
activity in spontaneously hypertensive rats. European food research
and technology, 239(5). https://doi.org/10.1007/s00217-014-2271-3
Babini, E., Tagliazucchi,
D., Martini, S., Dei-Più, L., & Gianotti, A.
(2017). LC-ESI-QTOF-MS identification of novel antioxidant peptides obtained by
enzymatic and microbial hydrolysis of
vegetable proteins. Food chemistry, 228, 186–196. https://doi.org/10.1016/j.foodchem.2017.01.143
Baker, M. T., Lu, P., Parrella, J.
A., & Leggette, H. R. (2022). Consumer Acceptance toward Functional Foods:
A Scoping Review. International Journal of environmental research and public
health, 19(3), 1217. https://doi.org/10.3390/ijerph19031217
Balasubramaniam, V. M., Martínez-Monteagudo, S. I., & Gupta, R. (2015). Principles and
Application
of High Pressure–Based Technologies in the Food Industry. Annual review of
food science and technology, 6(1), 435-462. https://doi.org/10.1146/annurev-food-022814-015539
Barati, M., Javanmardi, F., Mousavi-Jazayeri,
S. M. H., Jabbari, M., Rahmani, J., Barati, F., Nickho,
H., Davoodi, S. H., Roshanravan,
N., & Mousavi-Khaneghah,
A. (2020). Techniques, perspectives, and challenges of bioactive peptide
generation: A comprehensive systematic review. Comprehensive Reviews in Food
Science and Food Safety, 19(4), 1488-1520. https://doi.org/10.1111/1541-4337.12578
Barredo-Vacchelli, G. R., Giudicessi, S. L., Martínez-Ceron,
M. C., Cascone, O., & Camperi,
S. A. (2021). Peptide
Affinity Chromatography Applied to Therapeutic Antibodies Purification. International
journal of peptide research and therapeutics, 27(4), 2905–2921. https://doi.org/10.1007/s10989-021-10299-5
Bessada, S. M. F., Barreira, J. C. M.,
& Oliveira, M. B. P.
P. (2019). Pulses
and food security: Dietary protein, digestibility, bioactive and functional properties. Trends in food science &
technology, 93, 53-68. https://doi.org/10.1016/j.tifs.2019.08.022
Betancur-Ancona, D., Sosa-Espinoza, T.,
Ruiz-Ruiz, J., Segura-Campos, M., & Chel-Guerrero, L. (2014). Enzymatic hydrolysis of hard-to-cook
bean (Phaseolus vulgaris L.) protein
concentrates and its effects on biological and functional properties. International
journal of food science and technology, 49(1), 2-8. https://doi.org/10.1111/ijfs.12267
Bhandari, D., Rafiq, S., Gat, Y.,
Gat, P., Waghmare, R., & Kumar, V. (2020). A Review on Bioactive Peptides:
Physiological Functions, Bioavailability and Safety. International journal
of peptide research and therapeutics, 26(1), 139-150. https://doi.org/10.1007/s10989-019-09823-5
Bitocchi, E., Nanni, L., Bellucci, E.,
Rossi, M., Giardini, A., Zeuli, P. S., Logozzo, G., Stougaard, J., McClean, P., Attene,
G., & Papa, R. (2012). Mesoamerican origin of the common bean (Phaseolus
vulgaris L.) is revealed by sequence data. Proceedings of the national academy of sciences, 109(14), E788-E796. https://doi.org/10.1073/pnas.1108973109
Carrasco-Castilla, J., Hernández-Álvarez, A. J., Jiménez-Martínez, C., Jacinto-Hernández, C., Alaiz, M., Girón-Calle, J., Vioque,
J., & Dávila-Ortiz, G. (2012). Antioxidant and metal chelating activities of peptide
fractions from phaseolin and bean protein
hydrolysates. Food chemistry, 135(3), 1789-1795. https://doi.org/10.1016/j.foodchem.2012.06.016
Castañeda-Pérez, E., Jiménez-Morales,
K., Quintal-Novelo, C., Moo-Puc, R., Chel-Guerrero, L., & Betancur-Ancona, D. (2019). Enzymatic protein hydrolysates and
ultrafiltered peptide fractions from Cowpea Vigna unguiculata L bean
with in vitro antidiabetic potential. Journal of the iranian
chemical society, 16(8), 1773-1781. https://doi.org/10.1007/s13738-019-01651-0
Chel-Guerrero, L., Domínguez-Magaña, M., Martínez-Ayala, A.,
Dávila-Ortiz, G., & Betancur-Ancona, D. (2012). Lima Bean (<i>Phaseolus
lunatus</i>)
Protein Hydrolysates with ACE-I Inhibitory
Activity. Food and nutrition sciences, 03(04), 511-521. https://doi.org/10.4236/fns.2012.34072
Choudhary, N., Anjali, Gupta, M.,
Shafi, S., Jan, S., Hamid-Mir, A., Singh, B., & Rouf-Mir, R. (2022).
Molecular diversity and nutriment studies of common bean (Phaseolus vulgaris
L.) from the two hot-spots of Western Himalayas of
Jammu and Kashmir. Crop & pasture science, 73(3), 249-262.
https://doi.org/10.1071/CP21347
Cruz-Casas, D. E., Aguilar, C. N., Ascacio-Valdés,
J. A., Rodríguez-Herrera, R., Chávez-González, M. L., & Flores-Gallegos, A. C. (2021). Enzymatic hydrolysis and microbial
fermentation: The most favorable biotechnological methods for the release of bioactive peptides. Food chemistry: molecular
sciences, 3, 100047-100058. https://doi.org/10.1016/j.fochms.2021.100047
Das, S. & Hati, S. (2022). Food
derived ACE inhibitory peptides: science to application. In D. Bagchi & S. E. Ohia (Eds.), Nutrition and
Functional Foods in Boosting Digestion, Metabolism and Immune
Health (pp. 39-54). Elsevier.
https://doi.org/10.1016/B978-0-12-821232-5.00006-9
De-Souza-Rocha, T., Hernandez, L.
M. R., Mojica, L., Johnson, M. H., Chang, Y. K., & González-de-Mejía, E.
(2015). Germination
of Phaseolus vulgaris and alcalase hydrolysis of its
proteins produced bioactive peptides capable of improving markers related to
type-2 diabetes in vitro. Food research international, 76(P1), 150-159. https://doi.org/10.1016/j.foodres.2015.04.041
De-Vuyst, L. & Leroy, F. (2007).
Bacteriocins from Lactic Acid Bacteria: Production, Purification, and Food
Applications. Microbial
physiology, 13(4), 194-199. https://doi.org/10.1159/000104752
De-Fátima-Garcia,
B., de-Barros, M., & de-Souza-Rocha, T. (2021). Bioactive peptides from beans with
the potential to decrease the risk of developing noncommunicable chronic
diseases. Critical reviews in food science and nutrition, 61(12),
2003-2021. https://doi.org/10.1080/10408398.2020.1768047
Evangelho, J. A., Vanier, N. L., Pinto, V. Z., Berrios, J. J. D., Dias, A. R. G.,
& Zavareze, E. R. (2017). Black bean (Phaseolus vulgaris.
L.) protein hydrolysates: Physicochemical and functional properties. Food
chemistry, 214, 460-467. https://doi.org/10.1016/j.foodchem.2016.07.046
FAO, Food and Agriculture
Organization of the United Nations (2022). FAOSTAT. CROPS. [En línea]. Disponible en:
http://www.fao.org/faostat/en/#data/QC/visualize. Fecha de consulta: 22 de
enero de 2024.
Freytag, G. F. & Debouck,
D. G. (2002). Taxonomy,
distribution, and ecology of the genus Phaseolus
(Leguminosae-Papilionoideae) in North America,
Mexico and Central America. [En línea].
Disponible en:
https://api.semanticscholar.org/CorpusID:130456466. Fecha de consulta:
22 de enero de 2024.
Garcia-Mora, P., Frias, J., Peñas, E., Zieliński, H., Giménez-Bastida, J. A., Wiczkowski,
W., Zielińska, D., & Martínez-Villaluenga, C.
(2015). Simultaneous
release of peptides and phenolics with antioxidant, ACE-inhibitory and anti-inflammatory activities from pinto bean (Phaseolus
vulgaris L. var. pinto) proteins by subtilisins. Journal
of functional foods, 18, 319-332. https://doi.org/10.1016/j.jff.2015.07.010
Gharibzahedi, S. M. T., Smith, B., &
Altintas, Z. (2024). Bioactive and health-promoting properties of enzymatic
hydrolysates of legume proteins: a review. Critical reviews in food science
and nutrition, 64(9), 2548-2578
Goldstein, N. & Reifen, R. (2022). The potential of legume-derived proteins
in the food industry. Grain & oil science and technology, 5(4),
167-178. https://doi.org/10.1016/j.gaost.2022.06.002
Gomes, M. J. C., Lima, S. L. S., Alves, N. E. G., Assis, A., Moreira, M. E. C., Toledo, R. C. L., Rosa, C. O.
B., Teixeira, O. R., Bassinello, P. Z., de-Mejía, E.
G., & Martino, H. S. D. (2020). Common bean protein hydrolysate modulates lipid
metabolism and prevents endothelial dysfunction in BALB/c mice fed an
atherogenic diet. Nutrition, metabolism and cardiovascular diseases,
30(1), 141-150. https://doi.org/10.1016/j.numecd.2019.07.020
Granato, D., Barba, F. J., Bursać-Kovačević,
D., Lorenzo, J. M., Cruz, A. G., & Putnik, P.
(2020). Functional
Foods: Product Development, Technological Trends, Efficacy Testing, and Safety.
Annual review of food science and technology, 11(1), 93-118. https://doi.org/10.1146/annurev-food-032519-051708
Grdeń, P. & Jakubczyk, A. (2023).
Health benefits of legume seeds. Journal of the science of food and agriculture, 103(11), 5213-5220. https://doi.org/10.1002/jsfa.12585
Gulcin, İ. (2020). Antioxidants and
antioxidant methods:
an updated overview. Archives of toxicology, 94(3), 651-715. https://doi.org/10.1007/s00204-020-02689-3
Hernández-Corroto,
E., Plaza, M., Marina, M. L., & García, M. C. (2020). Sustainable
extraction of proteins and bioactive substances from pomegranate peel (Punica
granatum L.) using pressurized liquids and deep eutectic solvents. Innovative
food science & emerging technologies, 60, 102314–102324. https://doi.org/10.1016/j.ifset.2020.102314
Herrera-Hernández, I. M., Sánchez, E., Ramírez-Estrada, C.
A., Anchondo-Páez, J. C., & Pérez-Álvarez, S. (2023). Supply of essential and nonessential amino acids,
proteins, antioxidants, iron and zinc from the main varieties of beans consumed
in Mexico and their potential for
biofortification. Notulae scientia biologicae,
15(4), 11733. https://doi.org/10.55779/nsb15411733
Hu, K., Huang, H., Li, H., Wei, Y.,
& Yao, C. (2023). Legume-Derived Bioactive Peptides in Type 2 Diabetes: Opportunities and Challenges. Nutrients,
15(5), 1096. https://doi.org/10.3390/nu15051096
IDF,
International Diabetes Federation (2021). IDF Diabetes Atlas (Tenth edition). International Diabetes Federation.
[En línea]. Disponible en: https://diabetesatlas.org/atlas/tenth-edition/.
Fecha de consulta: 22 de enero de 2024.
Jakubczyk, A., Karaś, M., Złotek, U., & Szymanowska, U.
(2017). Identification
of potential inhibitory peptides of enzymes involved in the metabolic syndrome obtained by simulated gastrointestinal
digestion of fermented bean (Phaseolus vulgaris L.) seeds. Food
research international, 100, 489-496. https://doi.org/10.1016/j.foodres.2017.07.046
Jogi, N., Yathisha,
U. G., Bhat, I., & Mamatha, B. S. (2022). Antihypertensive activity of
orally consumed ACE-I inhibitory peptides. Critical reviews in food science
and nutrition, 62(32), 8986-8999. https://doi.org/10.1080/10408398.2021.1938508
Karami, Z. & Duangmal,
K. (2023). Health Promoting and Functional Activities of Peptides from Vigna
Bean and Common Bean Hydrolysates: Process to
Increase Activities and Challenges. Food reviews
international, 39(9), 6537-6567. https://doi.org/10.1080/87559129.2022.2122988
Kaur, N. (2018). Solid-phase
synthesis of sulfur containing heterocycles. Journal of sulfur chemistry,
39(5), 544–577. https://doi.org/10.1080/17415993.2018.1457673
Kent, S. B. H. (2019). Novel protein
science enabled by total chemical synthesis. Protein
science, 28(2), 313–328. https://doi.org/10.1002/pro.3533
Li, T., Shi, C.,
Zhou, C., Sun, X., Ang, Y., Dong, X., Huang, M., & Zhou, G. (2020).
Purification and characterization of novel antioxidant peptides from duck breast protein hydrolysates. LWT,
125, 109215-109227. https://doi.org/10.1016/j.lwt.2020.109215
Lin, X., Xu, Y., Pan, X., Xu, J.,
Ding, Y., Sun, X., Song, X., Ren, Y., & Shan, P. F. (2020). Global,
regional, and national burden and trend of diabetes in 195 countries and territories: an analysis from 1990 to 2025. Scientific reports, 10(1), 14790. https://doi.org/10.1038/s41598-020-71908-9
Lorenzo, J. M., Munekata,
P. E. S., Gómez, B., Barba, F.
J., Mora, L., Pérez-Santaescolástica, C., & Toldrá, F. (2018). Bioactive peptides as natural
antioxidants in food products – A review. Trends in food science &
technology, 79, 136-147. https://doi.org/10.1016/j.tifs.2018.07.003
Luna-Vital, D. A., González-de-Mejía, E., Dia, V. P., & Loarca-Piña, G. (2014). Peptides in common bean fractions inhibit human colorectal cancer cells.
Food chemistry, 157, 347-355. https://doi.org/10.1016/j.foodchem.2014.02.050
Maestri, E., Pavlicevic,
M., Montorsi, M., & Marmiroli,
N. (2019). Meta-Analysis for Correlating Structure of Bioactive Peptides in
Foods of Animal Origin with
Regard to Effect and Stability. Comprehensive reviews in food
science and food safety, 18(1), 3-30. https://doi.org/10.1111/1541-4337.12402
Marciniak, A., Suwal, S., Naderi, N.,
Pouliot, Y., & Doyen, A. (2018). Enhancing enzymatic hydrolysis of food
proteins and production of bioactive peptides using high hydrostatic pressure
technology. Trends in food science &
technology, 80, 187–198. https://doi.org/10.1016/j.tifs.2018.08.013
McClements, D. J. & Grossmann, L.
(2021). The science of plant-based foods: Constructing next-generation meat,
fish, milk, and egg analogs. Comprehensive reviews in food science and food
safety, 20(4), 4049-4100. https://doi.org/10.1111/1541-4337.12771
Miklas, P. N., Kelly, J. D., &
Cichy, K. A. (2022). Dry Bean Breeding and Production Technologies. In M.
Siddiq & M. A. Uebersax (Eds.), Dry Beans and Pulses (pp. 29-56). Wiley. https://doi.org/10.1002/9781119776802.ch2
Mojica, L., Chen, K., & de-Mejía, E.
G. (2015). Impact
of Commercial Precooking of Common Bean (Phaseolus vulgaris) on the Generation
of Peptides, After Pepsin-Pancreatin Hydrolysis, Capable to Inhibit Dipeptidyl
Peptidase-IV. Journal of food science, 80(1). https://doi.org/10.1111/1750-3841.12726
Mojica, L. & de-Mejía, E. G.
(2015). Characterization and Comparison of Protein and Peptide Profiles and
their Biological Activities of Improved Common Bean Cultivars (Phaseolus
vulgaris L.) from Mexico and Brazil. Plant foods for human nutrition,
70(2), 105-112. https://doi.org/10.1007/s11130-015-0477-6
Mojica, L. & de-Mejía, E. G.
(2016). Optimization of enzymatic production of antidiabetic peptides from
black bean (Phaseolus vulgaris L.) proteins, their characterization and
biological potential. Food and function, 7(2). https://doi.org/10.1039/c5fo01204j
Mojica, L., de-Mejia, E. G.,
Menjivar, M., & Granados-Silvestre, M. Á. (2016). Antidiabetic Effect of
Black Bean Peptides through Reduction of Glucose Absorption and Modulation of
SGLT1, GLUT2 and DPP-IV in in vitro and in vivo Models. The
FASEB journal, 30(S1). https://doi.org/10.1096/fasebj.30.1_supplement.125.6
Mojica, L., Luna-Vital, D. A., &
González-de-Mejía, E. (2017). Characterization of peptides from common bean
protein isolates and their potential to inhibit markers of type-2 diabetes,
hypertension and oxidative stress. Journal of the science of food and
agriculture, 97(8), 2401-2410. https://doi.org/10.1002/jsfa.8053
Montoya, C. A., Lallès,
J. P., Beebe, S., & Leterme,
P. (2010). Phaseolin diversity as a possible strategy to improve the nutritional value of
common beans (Phaseolus vulgaris). Food research international, 43(2),
443–449. https://doi.org/10.1016/j.foodres.2009.09.040
Mora, L. & Toldrá,
F. (2021). Methodologies for peptidomics:
Identification and quantification. In F. Toldrá &
J. Wu (Eds.), Biologically Active Peptides (pp. 87-102). Elsevier. https://doi.org/10.1016/B978-0-12-821389-6.00010-8
Moreno-Valdespino, C. A., Luna-Vital,
D., Camacho-Ruiz, R. M., & Mojica, L. (2020). Bioactive proteins and
phytochemicals from legumes: Mechanisms of action preventing obesity and type-2
diabetes. Food research international, 130, 108905. https://doi.org/10.1016/j.foodres.2019.108905
Mourtas, S., Athanasopoulos, V., Gatos, D.,
& Barlos, K. (2023). Solid-Phase Synthesis of
2-Benzothi
azolyl and 2-(Aminophenyl)benzothiazolyl Amino Acids and Peptides. Molecules, 28(14),
5412–5431. https://doi.org/10.3390/molecules28145412
Mudgil, P., Baby, B., Ngoh, Y. Y., Kamal, H., Vijayan, R., Gan, C.
Y., & Maqsood, S. (2019). Molecular binding mechanism and
identification of novel antihypertensive and
anti-inflammatory bioactive peptides from camel milk protein hydrolysates. LWT,
112, 108193-108204. https://doi.org/10.1016/j.lwt.2019.05.091
Mullins, A. P. & Arjmandi, B. H. (2021). Health Benefits of Plant-Based
Nutrition: Focus on Beans in Cardiometabolic Diseases. Nutrients, 13(2),
519. https://doi.org/10.3390/nu13020519
Naeem, M., Malik, M. I., Umar, T.,
Ashraf, S., & Ahmad, A. (2022). A Comprehensive Review About Bioactive
Peptides: Sources to Future Perspective. International journal of peptide
research and therapeutics, 28(6), 155-175. https://doi.org/10.1007/s10989-022-10465-3
Ngoh, Y. Y. & Gan, C. Y. (2016).
Enzyme-assisted extraction and identification of antioxidative and a-amylase
inhibitory peptides from Pinto beans (Phaseolus vulgaris cv. Pinto). Food
chemistry, 190, 331-337. https://doi.org/10.1016/j.foodchem.2015.05.120
Ngoh, Y. Y. & Gan, C. Y. (2018).
Identification of Pinto bean peptides with inhibitory effects on a-amylase and angiotensin converting enzyme (ACE) activities
using an integrated bioinformatics-assisted approach. Food chemistry,
267, 124-131. https://doi.org/10.1016/j.foodchem.2017.04.166
Obiro, W. C., Zhang, T., & Jiang, B.
(2008). The nutraceutical role of the Phaseolus vulgaris a-amylase
inhibitor. British journal of nutrition, 100(1), 1-12. https://doi.org/10.1017/S0007114508879135
Ohara, A., Cason, V. G., Nishide, T. G., Miranda-de-Matos, F., & de-Castro, R.
J. S. (2021). Improving the antioxidant and antidiabetic properties of common
bean proteins by enzymatic hydrolysis using a
blend of proteases. Biocatalysis and biotransformation,
39(2), 100-108. https://doi.org/10.1080/10242422.2020.1789114
Olagunju, A. I., Omoba,
O. S., Enujiugha, V. N., Alashi,
A. M., & Aluko, R. E. (2018). Pigeon pea enzymatic protein hydrolysates and
ultrafiltration peptide fractions as potential sources of antioxidant peptides:
An in vitro study. LWT, 97, 269–278. https://doi.org/10.1016/j.lwt.2018.07.003
Osborne, T. B.
(1924). The vegetable proteins. Longmans,
Green and Company.
Oseguera-Toledo, M. E., Gonzalez-de-Mejia, E., & Amaya-Llano, S. L. (2015). Hard-to-cook bean (Phaseolus
vulgaris L.) proteins hydrolyzed by alcalase
and bromelain produced bioactive peptide fractions that inhibit targets of
type-2 diabetes and oxidative stress. Food
research international, 76, 839-851. https://doi.org/10.1016/j.foodres.2015.07.046
Ozawa, A., Cai, Y., & Lindberg,
I. (2007). Production of bioactive peptides in an in vitro system. Analytical
biochemistry, 366(2), 182–189. https://doi.org/10.1016/j.ab.2007.04.020
Peighambardoust, S. H., Karami, Z., Pateiro, M., & Lorenzo, J. M. (2021). A Review on
Health-Promoting, Biological, and Functional Aspects of Bioactive Peptides in
Food Applications. Biomolecules,
11(5), 631-651. https://doi.org/10.3390/biom11050631
Piovesana, S., Capriotti, A. L., Cavaliere, C., La Barbera, G., Montone,
C. M., Zenezini Chiozzi,
R., & Laganà, A. (2018). Recent trends and analytical
challenges in plant bioactive peptide separation, identification and
validation. Analytical and Bioanalytical Chemistry, 410(15), 3425–3444. https://doi.org/10.1007/s00216-018-0852-x
Piovesana, S., Capriotti, A. L., Cavaliere,
C., La-Barbera, G., Montone, C. M., Zenezini-Chiozzi,
R., & Laganà, A. (2019). Sensitive untargeted identification of short
hydrophilic peptides by high performance liquid chromatography on porous
graphitic carbon coupled to high resolution mass spectrometry. Journal of
chromatography A, 1590, 73–79. https://doi.org/10.1016/j.chroma.2018.12.066
Polanco-Lugo, E., Dávila-Ortiz, G.,
Betancur-Ancona, D. A., & Chel-Guerrero, L. A. (2014). Effects of
sequential enzymatic hydrolysis on structural, bioactive and functional
properties of Phaseolus lunatus protein isolate. Food science and
technology, 34(3), 441-448. https://doi.org/10.1590/1678-457x.6349
Porch, T., Beaver, J., Debouck, D., Jackson, S., Kelly, J., & Dempewolf, H.
(2013). Use of Wild Relatives and Closely Related Species to Adapt Common Bean
to Climate Change. Agronomy, 3(2), 433-461. https://doi.org/10.3390/agronomy3020433
Rahmi, A. & Arcot, J. (2023). In
Vitro Assessment Methods for Antidiabetic Peptides from Legumes: A Review.
Foods, 12(3), 631. https://doi.org/10.3390/foods12030631
Rogalinski, T., Herrmann, S., &
Brunner, G. (2005). Production of amino acids from bovine serum albumin by
continuous sub-critical water hydrolysis. The journal of supercritical
fluids, 36(1), 49–58. https://doi.org/10.1016/j.supflu.2005.03.001
Roy, M., Sarker, A., Azad, M. A. K., Shaheb, M. R., & Hoque, M. M. (2020). Evaluation of
antioxidant and antimicrobial properties of dark red kidney bean (Phaseolus vulgaris) protein
hydrolysates. Journal of food measurement and characterization,
14(1), 303-313. https://doi.org/10.1007/s11694-019-00292-4
Rui, X., Boye, J. I., Simpson, B. K.,
& Prasher, S. O. (2012). Angiotensin I-converting
enzyme inhibitory properties of Phaseolus vulgaris bean hydrolysates: Effects
of different thermal and enzymatic digestion treatments. Food research
international, 49(2), 739-746. https://doi.org/10.1016/j.foodres.2012.09.025
Rui, X., Boye, J. I., Simpson, B. K.,
& Prasher, S. O. (2013). Purification and
characterization of angiotensin I-converting enzyme inhibitory peptides of
small red bean (Phaseolus vulgaris) hydrolysates. Journal of functional foods, 5(3), 1116-1124. https://doi.org/10.1016/j.jff.2013.03.008
Ruiz-Ruiz, J., Davila-Ortiz, G.,
Chel-Guerrero, L., & Betancur-Ancona, D. (2013). Angiotensin i-con-verting enzyme inhibitory and antioxidant peptide
fractions from hard-to-cook bean enzymatic hydrolysates.
Journal of food biochemistry, 37(1), 26-35. https://doi.org/10.1111/j.1745-4514.2011.00594.x
Saad, A. M., Osman, A. O. M.,
Mohamed, A. S., & Ramadan, M. F. (2020). Enzymatic Hydrolysis of Phaseolus
vulgaris Protein Isolate: Characterization of Hydrolysates and Effect on the
Quality of Minced Beef During Cold Storage. International
journal of peptide research and therapeutics, 26(1), 567–577.
https://doi.org/10.1007/s10989-019-09863-x
Sánchez, A. & Vázquez, A. (2017).
Bioactive peptides: A review. Food
quality and safety, 1(1), 29–46. https://doi.org/10.1093/fqs/fyx006
Shabir, I., Dash, K. K., Dar, A. H.,
Pandey, V. K., Fayaz, U., Srivastava,
S., & Nisha, R. (2023). Carbon footprints evaluation for
sustainable food processing system development: A comprehensive review. Future
Foods, 7, 100215. https://doi.org/10.1016/j.fufo.2023.100215
Siddiq, M., Uebersax, M. A., &
Siddiq, F. (2022). Global Production, Trade, Processing and Nutritional Profile
of Dry Beans and Other Pulses. In M. Siddiq & M. A. Uebersax (Eds.), Dry
Beans and Pulses (pp. 1–28). Wiley. https://doi.org/10.1002/9781119776802.ch1
Su, L., Shi, Y., Yan, M., Xi, Y., & Su, X. (2015). Anticancer bioactive peptides
suppress human colorectal tumor cell growth and induce apoptosis via modulating
the PARP-p53-Mcl-1 signaling pathway. Acta pharmacologica
sinica, 36(12), 1514–1519. https://doi.org/10.1038/aps.2015.80
Su, Y., Chen, S., Liu, S., Wang, Y.,
Chen, X., Xu, M., Cai, S., Pan, N., Qiao, K., Chen, B., Yang, S., & Liu, Z.
(2023). Affinity Purification and Molecular Characterization of
Angiotensin-Converting Enzyme (ACE)-Inhibitory Peptides from Takifugu flavidus. Marine drugs, 21(10), 522–536. https://doi.org/10.3390/md21100522
Tacias-Pascacio, V. G., Morellon-Sterling,
R., Siar, E. H., Tavano,
O., Berenguer-Murcia, Á., & Fernandez-Lafuente,
R. (2020). Use
of Alcalase in the production of bioactive peptides:
A review. International journal of biological macromolecules, 165, 2143-2196. https://doi.org/10.1016/j.ijbiomac.2020.10.060
Tak, Y., Kaur, M., Amarowicz, R., Bhatia, S. & Gautam, C. (2021). Pulse
Derived Bioactive Peptides as Novel Nutraceuticals: A Review. International
journal of peptide research and therapeutics, 27(3), 2057-2068. https://doi.org/10.1007/s10989-021-10234-8
Tawalbeh, D., Al-U’datt,
M. H., Wan-Ahmad, W. A. N., Ahmad, F., & Sarbon,
N. M. (2023). Recent Advances in In Vitro and In Vivo Studies of Antioxidant,
ACE-Inhibitory and Anti-Inflammatory Peptides from Legume Protein Hydrolysates.
Molecules, 28(6), 2423-2446. https://doi.org/10.3390/molecules28062423
Torruco-Uco, J., Chel-Guerrero, L., Martínez-Ayala, A., Dávila-Ortíz, G., & Betancur-Ancona, D. (2009). Angiotensin-I converting enzyme
inhibitory and antioxidant activities of protein hydrolysates from Phaseolus
lunatus and Phaseolus vulgaris seeds. LWT, 42(10),
1597-1604. https://doi.org/10.1016/j.lwt.2009.06.006
Udeh, C., Ifie, I., Akpodiete, J., &
Malomo, S. (2021). Kidney
bean protein products as potential antioxidative and antihypertensive
alternatives for non-pharmacological
inhibition of angiotensin-converting enzymes. Scientific African, 11, e00693–e00715. https://doi.org/10.1016/j.sciaf.2021.e00693
Ulug, S. K., Jahandideh, F., & Wu,
J. (2021). Novel
technologies for the production of bioactive peptides.
Trends in food science & technology, 108, 27–39. https://doi.org/10.1016/j.tifs.2020.12.002
Uttara, B., Singh, A., Zamboni, P., &
Mahajan, R. (2009). Oxidative Stress and
Neurodegenerative Diseases: A Review of Upstream and Downstream Antioxidant Therapeutic Options. Current neuropharmacology, 7(1),
65-74. https://doi.org/10.2174/157015909787602823
Valdez-Ortiz, A., Fuentes-Gutiérrez, C. I., Germán-Báez, L.
J., Gutiérrez-Dorado, R., & Medina-Godoy, S. (2012). Protein hydrolysates obtained from Azufrado (sulphur yellow) beans
(Phaseolus vulgaris): Nutritional, ACE-inhibitory and antioxidative
characterization. LWT, 46(1), 91-96. https://doi.org/10.1016/j.lwt.2011.10.021
Valencia-Mejía, E., Batista, K. A., Fernández, J. J. A.,
& Fernandes, K. F. (2019). Antihyperglycemic and hypoglycemic
activity of naturally occurring peptides and protein hydrolysates from easy-to-cook and hard-to-cook beans (Phaseolus vulgaris
L.). Food research international, 121, 238-246. https://doi.org/10.1016/j.foodres.2019.03.043
Vignesh,
A., Amal, T. C., Sarvalingam, A., & Vasanth, K.
(2024). A review on the influence of nutraceuticals and functional foods on
health. Food chemistry advances, 5, 100749.https://doi.org/10.1016/j.focha.2
024.100749
Wang, Y. & Wang, J. (2020).
Modelling and prediction of global noncommunicable diseases. BMC public
health, 20(1), 822. https://doi.org/10.1186/s12889-020-08890-4
Wei, H., Xiao, Y., Tong, Y., Chen,
Y., Luo, X., Wang, Y.,
Jin, P., Ma, C., Fu, Z., Guo, H., Zhao, X., & Li, Y. (2019). Therapeutic effect of
angelica and its compound formulas for hypertension and the complications:
Evidence mapping. Phytomedicine, 59, 152767-152794. https://doi.org/10.1016/j.phymed.2018.11.027
Wen, C., Zhang, J., Zhang, H., Duan,
Y., & Ma, H. (2020). Plant protein-derived antioxidant peptides: Isolation,
identification, mechanism of action and application in food systems: A review. Trends
in food science & technology, 105, 308–322. https://doi.org/10.1016/j.tifs.2020.09.019
WHO, World health
statistics (2023). World Health Statistics 2023: Monitoring Health for the SDGs, Sustainable Development Goals. World Health Organization.
[En línea]. Disponible en:
https://reliefweb.int/report/world/world-health-statistics-2023-monitoring-health-sdgs-sustainable-developmentgoals?gad_source=1&gclid=CjwKCAiAlcyuBhBnEiwAOGZ2S9HCWFC6XncrPKW5OLUHDQ38OXeAKLAdOeJgqlZPscHTBQ1xUIBHBoCCSIQAvD_BwE Fecha de consulta: 22 de enero de 2024.
Xiang, L., Qiu, Z., Zhao, R., Zheng, Z.,
& Qiao, X. (2023). Advancement and prospects of
production, transport, functional activity and structure-activity relationship
of food-derived angiotensin converting enzyme (ACE) inhibitory peptides. Critical
reviews in food science and nutrition, 63(10), 1437-1463. https://doi.org/10.1080/10408398.2021.1964433
Yang, F., Chen, X., Huang, M., Yang,
Q., Cai, X., Chen, X., Du, M., Huang, J., & Wang, S. (2021). Molecular
characteristics and structure–activity relationships of food-derived bioactive
peptides. Journal of integrative agriculture, 20(9), 2313-2332. https://doi.org/10.1016/S2095-3119(20)63463-3
Yuan, H., Luo, Z., Ban, Z., Reiter,
R. J., Ma, Q., Liang, Z., Yang, M., Li, X., & Li, L. (2022). Bioactive
peptides of plant origin: distribution, functionality, and evidence of benefits
in food and health. Food & function, 13(6), 3133-3158. https://doi.org/10.1039/D1FO04077D
Zamyatnin, A. A. (2018). Structural–functional
diversity of the natural oligopeptides. Progress in Biophysics and molecular biology, 133, 1-8. https://doi.org/10.1016/j.pbiomolbio.2017.09.024
Zheng, Z., Li, J., Li, J., Sun, H.,
& Liu, Y. (2019). Physicochemical and antioxidative characteristics of
black bean protein hydrolysates obtained from different enzymes. Food
hydrocolloids, 97, 105222-105235. https://doi.org/10.1016/j.foodhyd.2019.105222
Zhu, F., Cao, J., Song, Y., Yu, P.,
& Su, E. (2023). Plant Protein-Derived Active Peptides: A Comprehensive Review. Journal of agricultural and
food chemistry, 71(51), 20479-20499.
https://doi.org/10.1021/acs.jafc.3c06882