https://doi.org/10.29059/cienciauat.v19i2.1910
Metabolitos secundarios en plantas herbáceas de la
Huasteca veracruzana, México
Secondary metabolites in herbaceous plants from
the
Huasteca veracruzana, Mexico
Metabolitos secundarios en plantas herbáceas
Lorena Casanova-Pérez1*,
Hugo Brígido Barrios-García2, Verónica Rosales-Martínez3
*Correspondencia: lorena.casanova@uthh.edu.mx/Fecha de
recepción: 28 de abril de 2024/Fecha de aceptación: 11 de octubre de 2024/Fecha
de publicación: 25 de octubre de 2024.
1Universidad
Tecnológica de la Huasteca Hidalguense, Programa Educativo Agrobiotecnología,
carretera Huejutla-Chalahuiyapa s/n, colonia Tepoxteco, Huejutla de Reyes, Hidalgo, México, C. P. 43000.
2Universidad Autónoma de Tamaulipas, Facultad de Medicina
Veterinaria y Zootecnia "Dr. Norberto Treviño Zapata", Ciudad
Victoria, Tamaulipas, México, C. P. 87274. 3Colegio de Postgraduados
Campus Campeche, Posgrado en Bioprospección y Sustentabilidad Agrícola en el
Trópico, Champoton, Campeche, México, C. P. 24450.
RESUMEN
El papel de la agrobiotecnología ha sido fundamental en los
últimos años para la búsqueda e implementación de buenas prácticas que
conduzcan a una agricultura sustentable. Ello
representa una oportunidad para que los metabolitos secundarios, de origen vegetal, sean utilizados en cultivos de interés. El
objetivo de esta investigación fue evaluar los metabolitos secundarios
asociados a 54 especies de plantas
herbáceas identificadas como plantas medicinales en la Huasteca veracruzana, México y su potencial uso en el desarrollo de productos agrobiotecnológicos. Se revisaron fuentes
bibliográficas para obtener información sobre el tipo de metabolitos
encontrados en cada especie herbácea con uso medicinal identificada en la región, el órgano utilizado y el método de
extracción realizada. Se encontró información de 46 especies, de las cuales, el
41 % fue reportada por poseer al menos un grupo funcional de metabolitos
secundarios; el 26 % mostró la presencia de dos grupos funcionales, mientras
que, el 18 % y el 15 % de las especies poseen tres y cuatro grupos funcionales
de metabolitos, respectivamente. Solo 6 de las especies analizadas han sido
estudiadas con fines de establecer su
potencial uso agrobiotecnológico. Si bien, la mayoría de las plantas se
analizan para establecer su potencial empleo farmacológico, esta información es
sumamente valiosa porque brinda indicios sobre el potencial de dichas especies
y sus metabolitos secundarios como base para la elaboración de productos
agrobiotecnológicos, cuyo uso favorezca el manejo sustentable de la agricultura.
PALABRAS
CLAVE:
agricultura, bioproductos,
cultivos, seguridad alimentaria, cambio climático.
ABSTRACT
In recent years, agrobiotechnology
has played a pivotal role in the pursuit and implementation of sustainable
agricultural practices. This presents a potential opportunity for the
utilization of secondary metabolites derived from plants in the cultivation of
crops of interest. The objective of this research was to evaluate the secondary
metabolites associated with 54 species of herbaceous plants identified as medicinal plants in the Huasteca veracruzana, Mexico,
and to assess their potential use in the development of agrobiotechnological
products. A review of the bibliographic
sources was conducted to obtain information on the type of metabolites
found in each herbaceous species with medicinal use identified in the region,
the organ used, and the extraction method employed. Information was obtained
for 46 species, 41 % of which were reported to possess at least one functional
group of secondary metabolites. Additionally, 26 % of the species showed the presence of two functional groups, while 18 % and
15 % of the species possessed three and four functional groups of metabolites,
respectively. Only 6 of the analyzed species
have been studied with the objective
of establishing their potential agrobiotechnological use. While the majority of the plants are analyzed to ascertain their
potential pharmacological applications, this information is of significant
value as it provides insights into the
potential of these species and their secondary metabolites as a foundation for the development of agrobiotechnological
products.
KEYWORDS: agriculture, bioproducts, crops,
food security, climate change.

INTRODUCCIÓN
La Huasteca, es una región cultural en México considerada
como un área de alta diversidad biológica, característica asociada a su
compleja fisiografía y la presencia de grupos originarios, quienes, por
generaciones, han usado diversas especies que forman su patrimonio biocultural
(Ávila y González, 1998). Dichas especies
tienen diversos usos, siendo los principales, el alimenticio y el
medicinal y tienen un gradiente de manejo que va desde aquellas cultivadas
hasta las recolectadas, considerándose estas últimas, parte de poblaciones
naturales amenazadas por el cambio del uso del suelo y las sequías, situación
que puede ocasionar su desaparición en los próximos años (Chávez-Acuña y col.,
2022).
Las investigaciones sobre estas plantas, y en particular,
sobre sus características fitoquímicas son escasas, puesto
que al no ser plantas valoradas, desde una perspectiva económica, han
sido excluidas de la agenda científica tecnológica (Osuna, 2015). Sin embargo,
resultan un recurso potencial para el desarrollo
de productos agrobiotecnológicos destinados al manejo sostenible de la
agricultura (Romo-Rico y col., 2022), que puedan ser adquiridos o producidos por los pequeños productores mediante
técnicas rústicas, siendo ambos una alternativa desde una perspectiva económica
(insumos asequibles y baratos) y ambiental (nulo o limitado impacto negativo al suelo y las fuentes de agua) (Senthil-Nathan y col., 2022).
El desarrollo de bioproductos de origen vegetal requiere, en
primer lugar, que las especies de interés sean identificadas botánicamente;
posteriormente, debe realizarse la revisión bibliográfica de su uso real y
potencial, con base en los metabolitos secundarios que le son inherentes, y por
último, su validación en diferentes protocolos de investigación, que permitan
la generación y verificación de conocimiento útil en el diseño de productos en
caminados a la bioestimulación de cultivos, control de malezas, asimismo, al
control y prevención de plagas y enfermedades (Bano y
col., 2023).
Es importante mencionar que los metabolitos secundarios son
compuestos de naturaleza química distinta, y juegan un papel importante en la
adaptación al estrés ambiental y en la defensa ante potenciales predadores y
patógenos de las plantas (Lustre, 2022), en contraste con los metabolitos
primarios, que están implicados en el crecimiento, desarrollo y reproducción
del cultivo (azúcares, proteínas, aminoácidos y ácidos nucleicos).
El presente trabajo tuvo como objetivo describir los
metabolitos secundarios asociados a 54
especies herbáceas clasificadas como plantas medicinales en la Huasteca
de veracruzana, México y su potencial uso en el desarrollo de productos agrobiotecnológicos.
MATERIALES Y MÉTODOS
Esta investigación es de carácter cualitativo, basada en la
revisión de fuentes secundarias (artículos científicos, capítulos de libro,
tesis de licenciatura y posgrado), siendo la continuación de una investigación
realizada de julio a diciembre de 2017, en la cual se identificaron
botánicamente 158 especies utilizadas como parte de la medicina tradicional en
cinco localidades de la Huasteca, específicamente en el municipio de Tantoyuca,
Veracruz, México (Casanova-Pérez y col., 2022) (Figura 1).

Del total de especies identificadas, se
eligieron 54 especies de plantas clasificadas
por su forma biológica como herbáceas, las cuales son obtenidas por la
población a partir de la recolección o a través de su cultivo en la parcela o
el patio familiar. La búsqueda de información sobre los metabolitos secundarios
asociados a cada especie se realizó durante el segundo semestre de 2023. Esto
requirió el uso de motores de búsqueda y del uso de conjugaciones de palabras
clave como: metabolitos secundarios, el nombre científico de cada especie, caracterización fitoquímica, tamizaje
químico, entre otras. De esta búsqueda, se
eligieron 54 fuentes. El 87 % fueron investigaciones de carácter
experimental y 13 % revisiones de alguna especie en particular.
La identificación de los metabolitos secundarios, asociados a
cada especie, se realizó con base en su estructura química (terpenos, fenólicos, glicósidos y alcaloides)
(Kennedy, 2019). Además, se obtuvo
información sobre el órgano utilizado para la extracción de los metabolitos,
el tipo de extracción, el país en dónde se
realizó la investigación. Esta información fue sistematizada y analizada
en Excel versión 2016.
RESULTADOS Y DISCUSIÓN
La revisión bibliográfica permitió obtener información fitoquímica de 46 especies de plantas herbáceas, mientras que de 8 no se obtuvo
dicha información: Hymenocallis americana Roem., Rawolfia heterophylla Roem. & Shult, Mandevilla subsagittata (R. & P.) Woods., Acalypha phleoides Cav., Lasiacis
ruscifolia (H.B.K.) Hitch., Solanum
sp, Urtica chamaedryoides Pursh.
y Priva aspera H.B.K.
De las 48 especies de las que
si se obtuvo información, se identificó que en 9 de estas, sus metabolitos
secundarios tienen una aplicación en la industria alimentaria, mientras que 30
un uso farmacéutico y únicamente en 5, sus metabolitos secundarios se asociaron
a al uso agrobiotecnológico.
En las especies de Xanthosoma robustum, Teloxys ambrosioides, Tagetes erecta, Capsicum annuum, Solanum torvum y Euphorbbia hipercifolia (Tabla 1), se
abordó su uso agrobiotecnológico, con temas como la capacidad de los metabolitos secundarios como biofungicidas,
bioplaguicidas, biobactericidas y bioproductos capaces de inhibir malezas. En 30 especies se tuvo como propósito evaluar su capacidad
antioxidante, antidiabética, hepatoprotectora, antinociceptiva, antiinflamatoria, neuroprotectora
y cardioprotectora,
entre otras (Nirmala y col., 2022). Hallazgos
valiosos desde el enfoque de estudio farmacéutico, pero que
indirectamente brindan información sobre las
posibilidades de uso de estas especies y sus metabolitos asociados en la
agrobiotecnología (Tabla 1). Si bien, estos datos son alentadores, también
evidencian la escasa exploración sobre el uso específico de estas biomoléculas,
incluyendo su capacidad potencial como
antivirales, antinematícidas,
antibacterianos, antifúngicos, repelentes, bioestimulantes, antioxidante, o como promotores de la tolerancia ante la sequía,
como lo sugieren estudios recientes (Chávez-Arias y col., 2022) (Tabla 2).
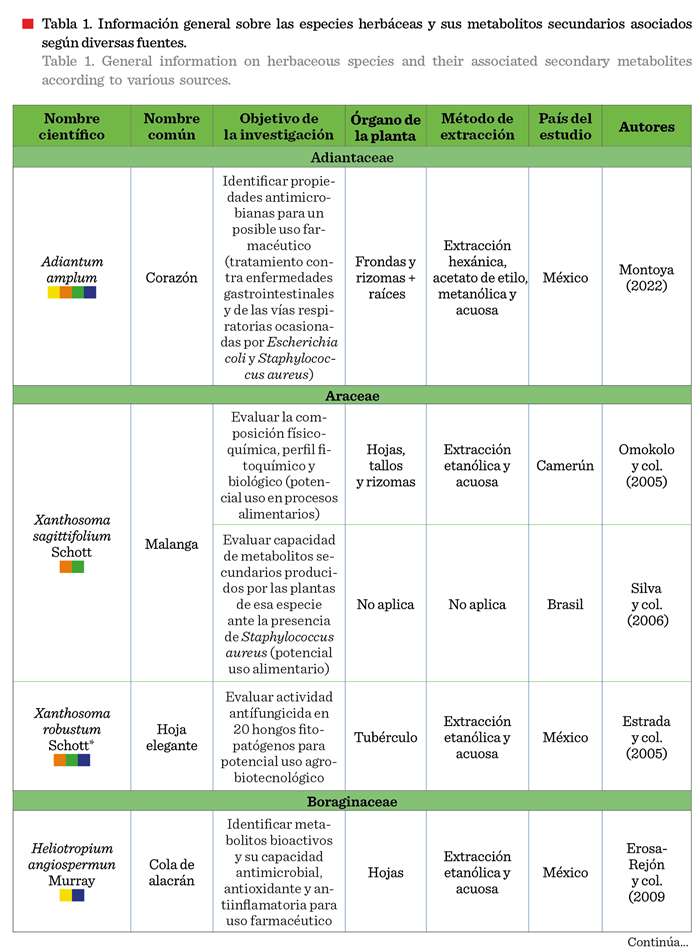
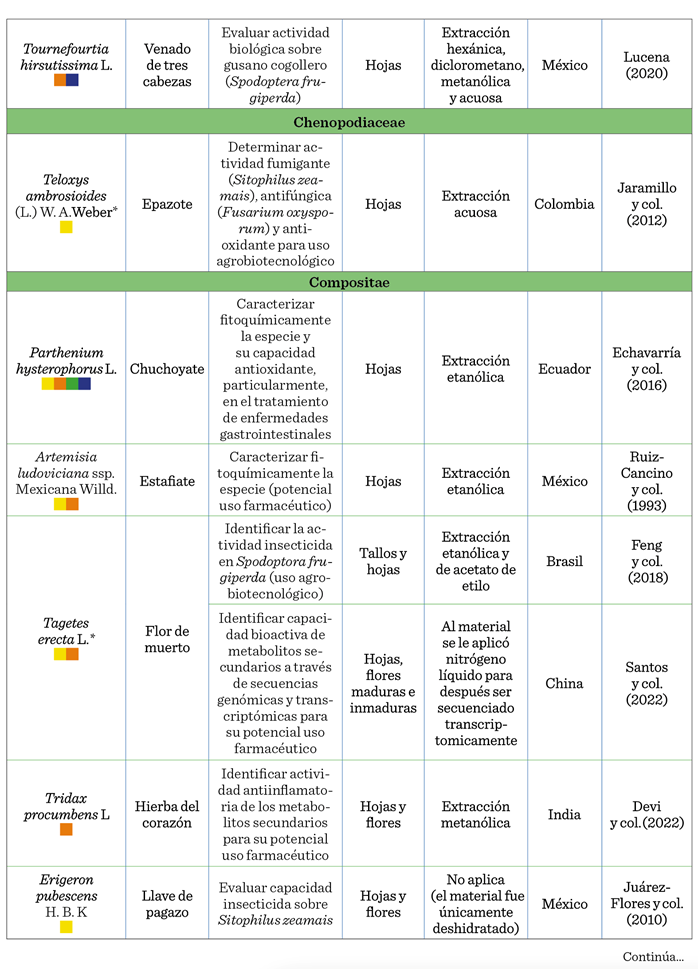





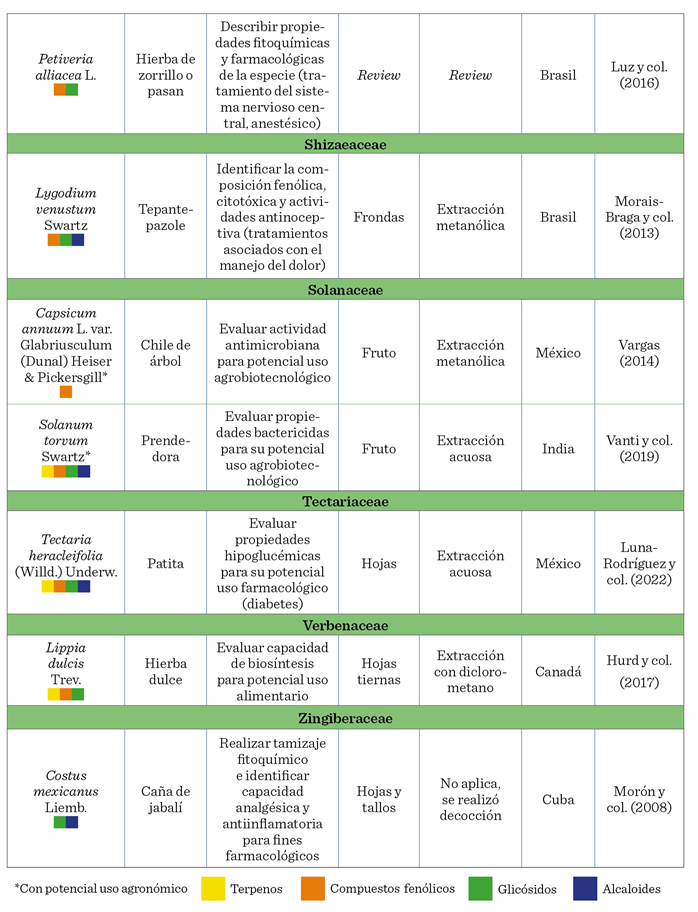

En cuanto al órgano de la planta usado en las investigaciones
revisadas, en el 63.04 % de los casos se utilizaron hojas, 19.56 % tallos y 17.39 % flores o parte de ellas (estigmas). No
obstante, se requieren más investigaciones sobre órganos como frutos, raíces,
bulbos, incluso la savia, puesto que la presencia y concentración de
metabolitos secundarios puede diferir entre éstos (Loza-Cornejo y col., 2017).
La identificación y extracción de metabolitos secundarios en
cada especie está influenciada por los
métodos de extracción (Geller-McGrath y col.,
2023). Matrose y col. (2021) plantean que las
diferentes técnicas, incluido el solvente utilizado, influyen en la posibilidad
de obtención o no de ciertos metabolitos secundarios que pudieran estar
presentes en una especie. Por tanto, la información presentada en la Tabla 1,
si bien, resulta valiosa, deberá considerarse bajo estas limitaciones.
La revisión bibliográfica también mostró que, 41 % de las
especies tuvieron al menos un tipo de
metabolito (Tabla 1), 26 % únicamente 2, 18 % mostraron la presencia de
3, mientras que el 15 % de éstas tuvieron los cuatro tipos. El tipo de
metabolito secundario más abundante, en las
especies vegetales involucradas en
esta revisión, fueron los compuestos
fenólicos (78 %), después los terpenos (50 %), seguidos de los glicósidos (41 %), y en menor cantidad los alcaloides (37
%).
Las especies Adiantum amplum, Parthenium hysterophorus, Euphorbia hypercifolia, Mirabilis jalapa, Solanum torvum, Tectaria heracleifolia y Zea mays, presentaron los cuatro grupos de metabolitos
secundarios (Tabla 2).
Teloxys ambrosioides y Sclerocarpus uniserialis, y otras especies, se asociaron solamente a
la presencia de terpenos; mientras que especies como Tridax
procumbens y Porophyllum
ruderale fueron reportadas únicamente con compuestos fenólicos. Bidens
odorata y Cymbopogon citratus registraron presencia de glicósidos, en tanto
que, Phyllanthus acuminatus,
Lygodium venustum
y Martynia
annua, entre otras especies, contaron con presencia de
alcaloides, además de otros metabolitos secundarios.
Los terpenos actúan en las plantas como atrayentes para los
polinizadores, pero también como disuasorios tóxicos, evitando el daño a las
plantas por parte de organismos fitopatógenos (Kennedy, 2019). En el grupo de
los terpenos se ubican los esteroles, esteroides, tocoferoles, y terpenoides, considerados como fitohormonas porque
estimulan el crecimiento y desarrollo de la planta. Caso particular son los
brasinoesteroides, reguladores de crecimiento que,
al igual que otras fitohormonas, son producto del metabolismo
secundario, pero actúan como metabolitos primarios. Hernández y García-Martínez (2016) indican que, los brasinoesteroides
influyen sobre la germinación, la rizogénesis, la
floración, la senescencia, la abscisión y en los procesos de maduración del fruto. Asimismo, los carotenoides, en investigaciones
recientes están siendo asociados con la tolerancia de las plantas ante el
cambio climático (Sun y Fernie,
2023).
En relación a los compuestos fenólicos, estos permiten a una planta herida
defenderse del ataque de hongos o bacterias, ya que pueden evitar la generación
de proteínas y elementos vitales para estos patógenos (Martin, 2017); además,
su presencia en las plantas está relacionada con los colores rojo, naranja,
azul, púrpura o violeta en frutas y hortalizas y su capacidad antioxidante
(Zárate-Martínez y col., 2021). Entre los compuestos fenólicos destacan las cumarinas, metabolitos secundarios
que protegen a las plantas, ya que suprimen el apetito de los insectos que las
consumen, pudiendo provocar daños en órganos vitales (Amaral y col., 2015).
Otros compuestos fenólicos son los flavonoides y las antraquinonas, a los cuales se les atribuyen actividades fungicidas y antibacterianas (Estrada y col., 2005).
Los glicósidos son un grupo de metabolitos secundarios que
también ha sido poco explorado para su uso agrobiotecnológico. Son importantes
por su toxicidad ante insectos, porque inhiben la producción de trehalasa, una
enzima clave que controla la disponibilidad de glucosa en sus cuerpos, además,
pueden promover la producción de nódulos en bacterias nitrofijadoras como las del género Rizobium (Silva y col., 2006). Se ha
reportado que, los son sintetizados a partir
de aminoácidos y sus derivados tienen la capacidad de inhibir patógenos
(Quian y col., 2023), entre ellos, algunos hongos que
atacan hortalizas como las solanáceas (Bressan y
col., 2024). Es importante mencionar que, en las 46 especies involucradas en el
estudio, no se identificó la presencia de monofenoles,
polifenoles, fenoles carboxílicos, ácidos fenólicos o de polifenoles
flavonoides como las antocianinas.
Yadav y
col. (2021) analizaron las plantas y su capacidad de biosíntesis de diferentes
tipos de metabolitos secundarios que las protegen de la peroxidación lipídica y
otros daños oxidativos bajo estrés por sequía. También se han estudiado los
metabolitos secundarios volátiles y su papel
en el alertamiento de los tejidos de las plantas para que alcancen
procesos defensivos de mitigación del estrés por sequía (Soubedi
y col., 2023). Ghasemi y col. (2023) señalaron que,
especies expuestas a este fenómeno agrometeorológico tuvieron un aumento significativo de los niveles de betacaroteno,
licopeno, terpenos, antocianina, compuestos fenólicos, flavonoides y
alcaloides, lo que indica un cambio metabólico adaptativo en respuesta a
condiciones adversas.
CONCLUSIONES
Las plantas medicinales utilizadas actualmente en contextos locales, son un recurso fitogenético con potencial
agrobiotecnológico, como en el presente estudio, donde el 13 % de las especies
analizadas reportaron esta característica, la cual, puede favorecer a través
del aprovechamiento de sus metabolitos secundarios, el desarrollo de prácticas
de manejo para una agricultura sustentable. La extracción y utilización de
estas biomoléculas, representan un gran potencial en
la elaboración de bioproductos destinados a
la prevención y control de plagas,
enfermedades, bioestimulación y, con
base en resultados de estudios recientes, en la tolerancia de algunas especies de plantas ante condiciones de sequía. Es importante que, al estudiar a profundidad dicho
potencial, se considere la compleja biosíntesis de estos metabolitos secundarios en las plantas y su alta especificidad en algunas especies. Se recomienda el desarrollo y
establecimiento de protocolos de
investigación para cada una las especies involucradas, que contemplen el
uso de diferentes órganos y métodos de extracción óptimos, que conduzcan a la
elaboración y evaluación de bioproductos que
sean eficaces y asequibles para los agricultores en el mediano plazo.
Declaración de conflicto de
intereses
Los autores declararon no tener
conflictos de intereses de ningún tipo.
Referencias
Abirami,
S., Priyalakshmi, M., Soundariya, A., Samrot, A. V., Saigeetha, S., Emilin, R. R., Dhiva S., & Inbathamizh, L.
(2021). Antimicrobial activity, antiproliferative activity, amylase
inhibitory activity and phytochemical analysis of ethanol extract of corn (Zea mays L.) silk. Current Research in Green and
Sustainable Chemistry, 4, 100089. https://doi.org/10.1016/j.crgsc.2021.100089
Afifah, I. Q., Wibowo, I., & Ahmad, F. (2023). A
newly identified B-amyrin synthase gene hypothetically involved in oleanane-saponin biosynthesis from Talinum
paniculatum (Jacq.) Gaerth. Helyon, 9(7), 1-9. https://doi.org/10.1016/j.heliyon.2023.e17707
Alrabie, A., Al-Rabie, N. A.,
Al-SAeedy, M., Al-Adhreai, A., Al-Qadsy I., & Farooqui,
M. (2023). Martynia
annua safety and efficacy: heavy metal profile in silicoo
and in vitro approaches on antibacterial and antidiabetic activities. Formerly
Natural Product Letters, 37(6), 1016-1022. https://doi.org/10.1080/14786419.2022.2097227
Amaral,
A. F., Jühlinch, L. M., Takeuti,
K. L., Rolim, V. M., Goncalces, M. A., Da-Cruz, A.
S., Driemeier, D., & De-Barcellos, D. E. (2015). Outbreack of cumarin poisoning in
suckling piglets. Acta Scientiae Veterinariae,
43, 1-9. https://pesquisa.bvsalud.org/portal/resource/pt/vti-13964
Ávila, A. y González,
Á. (1998). Diagnóstico regional de La Huasteca. Proyecto Perfiles Indígenas de
México. [Archivo PDF]. [En línea]. Disponible en:
https://www.aacademica.org/salomon.nahmad.sitton/20.pdf.
Fecha de consulta: 13 de febrero de 2024.
Bano, A., Qadri, T. A., & Khan, M. N. (2023). Bioactive
metabolites of plants and microbes and their role in agricultural
sustainability and mitigation of plant stress. South African Journal of
Botany, 159, 98-109. https://doi.org/10.1016/j.sajb.2023.05.049
Bhuvaneshwari,
K., Gokulanathan, A., Jayanthi, M., Govindasamy, V., Milella, L., Lee, S., Yang, D. C., & Girija, S. (2016).
Can Ocimum basilicum L. and
Ocimum tenuiflorum L. in
vitro culture be a potential source of secondary metabolites? Food
Chemistry, 194, 55-60. https://doi.org/10.1016/j.foodchem.2015.07.136
Borges, P. H. O., Pedreiro, S., Baptista, S. J., Geraldes,
C. F. G. C., Batista, M. T., Silva, M. M. C., & Figueirinha, A. (2021). Inhibition of a-glucosidase by
flavonoids of Cymbopogon citratus (DC) Stapf. Journal
of Ethnopharmacology, 280, 114470. https://doi.org/10.1016/j.jep.2021.114470
Brahmachari,
G., Gorai, D., & Roy, R. (2013). Ar-gemone mexicana: Chemical and pharmacological aspects. Revista Brasileira de
Farmacognosia, 23(3), 559-575.
htps://doi.org/10.1590/S0102-695X2013005000021
Bressan, S., Kutscher, M., Marquez, R., Centero, P. R., Correia, P. P., Das-Chagas, D., Loiola, O. D., Dos- Reis, A., Osório, R., & Brum M. (2024). Screening of alkaloids and withanolides isolated from Solanacea
plants for antifungal properties against non-wild tupe
Sporothrix brasiliensis. Journal
of Medical Mycology, 34(1), 101451. https://doi.org/10.1016/j.mycmed.2023.101451
Canel,
Y. (2012). Actividad
microbiana y antimicótica de los extractos de cinco plantas del género Vernonia nativas del sur-occidente
de Guatemala. [En línea]. Disponible en: http://biblioteca.usac.edu.gt/tesis/06/06_3225.pdf. Fecha de consulta: 11 de
enero de 2024.
Casanova-Pérez, C.,
Delgado-Caballero, C. E., Cruz-Bautista, P. y Casanova-Pérez, L. (2022).
Plantas medicinales usadas por los Tének en la
Huasteca, México. CienciaUAT, 16(2), 40-58. https://doi.org/10.29059/cienciauat.v16i2.1576
Chávez-Acuña, I. J.,
Flores-Flores, J. L., Domínguez-Cortinas, G. y Chávez-García, E. (2022).
Percepción social del papel de la variabilidad y el cambio climático sobre los
sistemas socio-ecológicos en comunidades indígenas y mestizas de la Huasteca
Potosina en México. Estudios Sociales, 32(59), 1-35. https://doi.org/10.24836/es.v32i59.1179
Chávez-Arias, C. C.,
Ramírez-Godoy, A., & Restrepo-Díaz, H. (2022). Influence
of drougth, high temperaturas,
and/or defense against arthropod herbivory on the production of secondary
metabolites in maize plants. A review. Current Plant Biology, 32,
100268. https://doi.org/10.1016/j.cpb.2022.100268
Chen,
X. M., Lu W., Zhang, Z. H., Zhang, J. Y., Luong, T. M., Lio L., Kim, Y. H., Li,
C. H., & Gao, J. M. (2022). Cassane diterpenois from de aerial parts of Caesalpinia pulcherrima
and their antibacterial and anti-glioblastoma activity. Phytochemistry,
196, 113082. https://doi.org/10.1016/j.phytochem.2021.113082
Chomel, M., Guittonny-Larchevêque,
M., Fernandez, C., Gallet, C., Des-Rochers, A., Paré, D., & Baldy, V.
(2016). Plant secondary metabolites: a key driver of litter decomposition and
soil nutrient cycling. Journal of Ecology, 104(6), 1527-1541. https://doi.org/10.1111/1365-2745.12644
Devi,
K., Soni S., Tripathi, V., Pandey, R., & Moharana,
B. (2022). Ethanolic extract of Tridax procumbens
mitigates pulmonary inflammation via inhibition of NF-kB/p65/ERK mediated signalling in an allergic asthma model. Phytomedicine,
99, 154008. https://doi.org/10.1016/j.phymed.2022.154008
Duncan,
C. E., Gorbet, D. W., & Talcott, S. T. (2006). Phytochemical content and
antioxidant capacity of water-soluble isolates from peanuts (Arachis hypogaea
L.). Food Research International, 39(8), 898-904. https://doi.org/10.1016/j.foodres.2006.05.009
Echavarría, A., D´Armas, H., Matute, N., Jarammillo,
C., Rojas, L. y Benítez, R. (2016). Evaluación de la capacidad antioxidante y
metabolitos secundarios de extractos de dieciséis plantas medicinales. Revista
Ciencia Unemi, 9(20), 29-35. https://www.redalyc.org/pdf/5826/582663826005.pdf
Erosa-Rejón, G.,
Peña-Rodríguez, L. M., & Sterner, I. O. (2009). Secondary
metabolites from Heliotropium angiospermum. Journal
of the Mexican Chemical Society, 53(2), 44-47. https://www.redalyc.org/pdf/475/47512080003.pdf
Estrada, E., Ordoñez,
P. y Morales, O. (2005). Validación de la actividad antifúngica del tubérculo
de Xanthosoma robustum y
determinación de metabolitos secundarios responsables de la actividad. Revista
Científica, 9(1), 25-29. https://doi.org/10.54495/Rev.Cientifica.EdicionEspecial2005.198
Fajardo-Romero, A.,
Arroyo-Rivera, A. y Ramírez-Navas, J. S. (2016). Extracción de flavonoides de
la envoltura externa de cebolla roja (Allium
cepa). UG Ciencia, 11, 119-126. https://doi.org/10.18634/ugcj.22v.1i.599
Feng,
G., Huang, S., Liu, Y., Xiao, F., Liu, J., Zhang, Z., Chen, Q., Cao, Y., Chen,
D., Zhou, Y., Liu, G., Liu, Y., & Niu, X. (2018). The transcriptome
analyses of Tagetes erecta provides novel insights
into secondary metabolite biosynthesis during flower development. Gene,
660, 18-27. https://doi.org/10.1016/j.gene.2018.03.051
Geller-McGrath,
D., Mara, P., & Taylor, G. T. (2023). Diverse
secondary metabolites are expressed in particle-associated and free-living
microorganisms of the permanently anoxic Cariaco
Basin. Nature Communications, 14, 656. https://doi.org/10.1038/s41467-023-36026-w
Ghasemi,
S., Kumleh, H., Kordrostami,
M., & Rezadoost, M. H. (2023). Drought
stress-mediated alterations in secondary mteabolites
and biosynthetic gene expresión
in cumin plants: Insights from gene-specific and metabolite analyses. Plant
Stress, 10, 100241. https://doi.org/10.1016/j.stress.
2023.100241
González-Trujano, M.
E., Gutiérrez-Valentino, C., Hernández-Arámburo, M., Díaz-Reval,
M. I., & Pellicer, F. (2019). Identification
of some bioactive metabolites and inhibitory
receptors in the antinociceptive activity of Tagetes lucida Cav. Life Sciences, 231(15), 116523. https://doi.org/10.1016/j.lfs.2019.05.079
Hernández, E. y
García-Martínez, I. (2016). Brasinoesteroides en la agricultura. Revista
Mexicana de Ciencias Agrícolas, 7(2), 41-50. https://doi.org/10.29312/remexca.v7i2.356
Hernández, M. R.,
Méndez, L., & Aguilar, A. A. (2022). Contribution
to the chemical stufdy of Rivina
humilis. Brazilian Journal of Animal and Enviromental
Research, 5(3), 2603-2613. https://ojs.brazilianjournals.com.br/ojs/index.php/BJAER/article/download/50032/37640/124975
INEGI, Instituto
Nacional de Estadística y Geografía (2009). Prontuario de información
geográfica municipal de los Estados Unidos Mexicanos Tantoyuca, Veracruz de
Ignacio de la Llave. [En línea]. Disponible en: http://www3.
inegi.org.mx/contenidos/app/mexicocifras/datos_geogra-ficos/30/30155.pdf. Fecha
de consulta: 21 de julio de 2024.
Hao,
D. C., Gu, X. J., & Xiao, P. G. (2015). Phytochemical and biological research of
Salvia medicinal resources. Medicinal
Plants, 14, 587-639. https://doi.org/10.1016/B978-0-08-100085-4.00014-1
Hurd, M. C., Kwon, M., & Ro, D. K. (2017).
Functional identification of a Lippia dulcis bornyl diphosphate
synthase that contains a duplicated, inhibitory
arginine-rich motif. Biochemical and Biophysical Research Communications, 490(3), 963-968. https://doi.org/10.1016/j.bbrc.2017.06.147
Jaramillo, B. E.,
Duarte, E. y Delgado, W. (2012). Bioactividad del aceite esencial de Chenopodium ambrosioides
colombiano. Revista Cubana de Plantas Medicinales, 17(1), 54-64. http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S1028-47962012000100006&lng=es&tlng=es.
Juárez-Flores,
B. I., Jasso-Pineda, Y., Aguirre-Rivera, J. R. y Jasso-Pineda, I. (2010). Efecto de polvos de Asteráceas sobre el gorgojo del maíz (Sitophilus
Zeamais Motsch). Polibotánica,
30, 123-135. https://core.ac.uk/download/pdf/288192163.pdf
Kennedy,
D. (2019). Plant-derived phytochemicals to enhance cognitive function and
alertness. Sports Science Exchange, 29(193), 1-5. https://www.gssiweb.org/docs/librariesprovider9/sse-pdfs/sse_193_fitoquimicos_derivados_plantas.pdf?sfvrsn=2
Khosakueng, M. & Taweechaisupapong,
S. (2024). Cymbopogon citratus
L. essential oil as a potential anti-biofilm agent active against
antibiotic-resistant bacteria isolated from
chronic rhinosinusitis patients. Biofouling, 29, 1-14. https://doi.org/10.1080/08927014.2024.2305387
Lima,
S. E., Calloi, R. A., Signor, C. A., Macedo, A. A., Isernhagen, M., Pires, L., Oliveira, A., Paes-de-Almedia,
V., Manfron, J., Carvalho, R. I., Carvalho, A.,
Brentan, D., Botelho, E. L., Dalsente, P. R., & Casparoto, A. (2019). Ethnopharmacological approaches to
Talinum paniculatum (Jacq.) Gaerth.
Exploring cardiorenal effects from the Brazilian Cerrado.
Journal of Ethnopharmacology, 28(238), 111873. https://doi.org/10.1016/j.jep.2019.111873
Loza-Cornejo,
S., Aparicio-Fernández, X., Patakfalvi, R. J. y Rosas-Saíto,
G. H. (2017). Caracteres anatómicos y fitoquímicos del tallo y raíz de Mammillaria uncinata
(Cactaceae). Acta Botánica Mexicana,
120, 21-30. https://doi.org/10.21829/abm120.2017.1159
Lucena, A. (2020).
Actividad biológica de Tournefortia hirsutissima sobre larvas de Spodoptera
frugiperda. Tesis de Licenciatura, Universidad
Autónoma del Estado de Morelos, Facultad de Ciencias Biológicas, Cuernavaca, Morelos 58 Pp. [En línea]. Disponible en:
http://riaa.uaem.mx/xmlui/bitstream/handle/20.500.12055/3241/LUCAVZ09.pdf?sequence=1&isAllowed=y.
Fecha de consulta: 3 de mayo de 2024.
Luna-Rodríguez, A. K.,
Zenil-Zenil, M. A., Cristians, S., Osuna-Fernández,
A. M., & Osuna-Fernández, H. R. (2022). Evaluation
for the hypoglycemic effect of Tectaria heracleifolia (Willd.) under in mice with induced type 2
diabetes. Polibotánica, 54, 203-217. https://www.scielo.org.mx/pdf/polib/n54/1405-2768-polib-54-203.pdf
Lustre, H. (2022). Los
superpoderes de las plantas: los metabolitos secundarios en su adaptación y
defensa. Revista Digital Universitaria, 23(2), 1-8. http://doi.org/10.22201/cuaieed.16076079e.2022.23.2.10
Luz, D. A., Pinheiro, A. M., Silva, M. L., Monteiro, M. C., Prediger, R. D., Ferraz-Maia, C. S., & Fontes-Júnior, E. A. (2016). Ethnobotany,
phytochemistry and neuropharmacological effects of Petiveria
alliacea L. (Phytolaccaceae):
A review. Journal of Ethnopharmacology, 185, 182-201. https://doi.org/10.1016/j.jep.2016.02.053
Marie-Magdeleine,
C., Udino, L., Philibert, L., Bo-cage, B., &
Archimede, H. (2014). In vitro effects of Musa x paradisiaca extracts on
four developmental stages of Haemonchus contortus. Research in Veterinary Science, 96(1),
127-132. https://doi.org/10.1016/j.rvsc.2013.12.004
Martin,
D. A. (2017). Los compuestos fenólicos: un acercamiento a su biosíntesis,
síntesis y actividad biológica. RIAA,
9(1), 81-103. https://doi.org/10.22490/21456453.1968
Matrose,
N. A., Obikeze, K., Belay, Z. A., & Caleb, O. J.
(2021). Impact of spatial variation and extraction solvents on bioactive
compounds, secondary metabolites and antifungal efficacy of South African Impepho [Helichrysum odoratissimum
(L.) Sweet]. Food Bioscience, 42, 101139. https://doi.org/10.1016/j.fbio.2021.101139
Montoya,
E. (2022). Actividad
biológica de los grupos de metabolitos secundarios presentes en las
pteridofitos Goniopteris stolzeana (AR
Sm.) salino y TE Alemida y Adiantum amplum C Presi.
Tesis de Licenciatura en Biología. Universidad de Ciencias y Artes de Chiapas,
Tuxtla Gutiérrez, Chiapas, 172 Pp. [En línea]. Disponible en:
https://www.researchgate.net/publication/368461548_Acividad_biologica_de_los_grupos_de_metabolitos_secundarios_presentes_en_los_pteridofitos_Goniopteris_stolzeana_y_Adiantum_amplum.
Fecha de consulta: 23 de febrero de 2024.
Morais-Braga, M. F. B.,
Souza, T. M., Santos, K. K. A., Guedes, G. M. M., Andrade, J. C., Vega, C.,
Rolón, M., Costa, J. G. M., Saraiva, A. F., & Coutinho, H. D. M. (2013). Phenol
composition, cytotoxic and antikinetoplastidae
activities of Lygodium venustum
SW. (Lygodiaceae). Experimental Parasitology, 134
(2),
178-182. https://doi.org/10.1016/j.exppara.2013.03.014
Morales, Q. N. (2018).
Estudio fitoquímico e identificación de compuestos antimicrobianos de dos
plantas de la familia Commelinaceae.
Tesis de Maestría en Ciencias en
Biotecnología aplicada. IPN-CIBA Tlaxcala, México. [En línea].
Disponible en:
https://tesis.ipn.mx/bitstream/handle/123456789/27222/QUETZALI%20NICTE%20MORALES%20RABANALES.pdf?sequence=1&isAllowed=y.
Fecha de consulta: 23 de marzo de 2024.
Morales-Ubaldo, Y.,
Rivero-Pérez, N., Morales-Ubaldo, A. L., Valladares-Carranza, B.,
López-Rodríguez, G. M. y Zaragoza-Bastida, A. (2022). Dalea bicolor: Una
alternativa para el tratamiento de bacterias de importancia en salud pública. Revista
de Investigaciones Veterinarias del Perú, 33(6), 1-6. http://dx.doi.org/10.15381/rivep.v33i6.22863
Morón, F., Victoria, M.
C., Morejón, Z., López, M., García, A. I., Fuentes, V., Robineau,
L. y Campo, C. (2008). Tamizaje fitoquímico, actividad analgésica y
antiinflamatoria de decocción de Costus pictus D. Don. Revista Cubana de Plantas Medicinales,
13(4), [En línea]. Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S1028-47962008000400013&lng=es&tlng=es. Fecha de consulta: 3 de enero de 2024.
Navarro, L. G., Agosto, J. G., & Nolasco, H. (2023). Composición
fitoquímica y propiedades antioxidantes de la planta mala madre (Kalanchoe pinnata). South
Florida Journal of Development, 481, 201-214. https://doi.org/10.46932/sfjdv4n1-014
Ndam,
L. M., Ngone, A. M., Nkongho, R. N., Fongod, A. G., Tening, A. S., & Fujii, T. (2021). Allelopatic
potentiality of Euphorbia hypecicifolia L. on germinaticion and seedling development of sympatric crops
and weeds. International Annals of Science, 10(1), 134-150. https://doi.org/10.21467/ias.10.1.134-150
Nirmala, C., Shahar, B., Dolma, N., Santosh, O. (2022). Promising
underutilized wild plants of cold desert Ladakh, India for nutritional security
and health benefits. Applied Food Research, 2(2), 100145. https://doi.org/10.1016/j.afres.2022.100145.
Omokolo,
N. D., Boudjeko, T., & Whitehead, C. S. (2005).
Comparative analyses of alterations in carbohydrates, amino acids, phenols and
lignin in roots of three cultivars of Xanthosoma sagittifolium infected by
Pythium myriotylum. South African Journal of
Botany, 71(3-4), 432-440. https://doi.org/10.1016/S0254-6299(15)30596-2
Ouakouak,
H., Benchikha, N., Hassani, A., & Ashour, M. L.
(2019). Chemical composition and biological activity of Mentha citrata Ehrh esencial
oils growing in douthern Algeria. Journal of Food Sciencie and Technology, 56(12), 346-535. https://doi.org/10.1007%2Fs13197-019-04005-z
Osuna, A. M. (2015).
Inexistentes las estrategias de cultivo para plantas y árboles medicinales, en Boletín
UNAM. [En línea]. Disponible en:
https://www.comunicacionsocial.uam.mx/boletinesuam/124-15.html. Fecha de
consulta: 10 de febrero de 2024.
Pérez-Méndez, R.,
Jiménez-Quesada, K. y Garro-Monge, G. (2022). Cultivo in vitro de raíces
pilosas del arbusto Phyllanthus acuminatus (Phyllantha-ceae).
Revista de Biología Tropical, 70(1), 647-657. http://dx.doi.org/10.15517/rev.biol.trop.2022.49227
Picking,
D., Delgoda, R., Boulogne, I., & Mitchell, S. (2013). Hyptis
verticillata Jacq: A review of its traditional uses,
phytochemistry, pharmacology and toxicology. Journal
of Ethnopharmacology, 147(1), 16-41. https://doi.org/10.1016/j.jep.2013.01.039
Priya,
S. & Serva, M. (2023). Physicochemical characterization,
polyphenols and flavonoids of different extracts from leaves of four
varieties of tulsi (Ocimum
sp.). South African Journal of Botany, 159, 381-395. https://doi.org/10.1016/j.sajb.2023.06.025
Quian,
L., Chunhong, Z., Huiyong,
F., & Leati, L. (2023). Indispensable biomolecules for plants defense againts pathogens: NBS-LRR and “nitrogen pool” alkaloids. Plant
Science, 334, 111752. https://doi.org/10.1016/j.plantsci.2023.111752
Romo-Rico,
J., Murali, S., Basaka, K., Golledge,
J., & Jacob, M. (2022). Potential of plant secondary metabolite-based polymers to enhance wound healing. Acta Biomateralia, 147, 34-49. https://doi.org/10.1016/j.actbio.2022.05.043
Ruiz-Cancino, A., Cano, A. E., & Delgado, G. (1993). Sesquiterpene
lactones and flavonoids from Artemisia ludoviciana
ssp. mexicana. Phytochemistry, 33(5),
1113-1115. https://doi.org/10.1016/0031-9422(93)85032-M
Santos, P. C., Oliveria, f., Bronzel, J. L., Payarini, R., Pereira, G. M., Chorilli,
M., Reis, C., Pereira, L., & Gonzalves, R. M.
(2022). Insecticidal activity of Tagetes erecta
and Tagetes patula extracts and fractions free and
microencapsulated. Biocatalysis in
Agricultural Biotecnnology, 45, 102511. https://doi.org/10.1016/j.bcab.2022.102511
Senthil-Nathan,
S., Park, S. U., & Day, B. (2022). Plant secondary metabolites as bioactive
substance for the sustainable agriculture. Physiological
and Molecular Plant Pathology, 121, 101890. https://doi.org/10.1016/j.pmpp.2022.101890
Silva, M., Terra, W.
R., & Ferreira, C. (2006). Absorption of
toxic b-glucosides
produced by plants and their effect on tissue trehalases from insects, Comparative Biochemistry and
Physiology Part B: Biochemistry and Molecular Biology, 143(3), 0-373. https://doi.org/10.1016/j.cbpb.2005.12.011
Sivasamugham, L. A., Nimalan, V., & Subramaniam,
G. (2021). Antibacterial effects of Musa sp. ethanolic leaf
extracts against methicillin-resistant and susceptible Staphylococcus aureus. Formerly
Natural Product Letters, 35, 107-110. https://doi.org/10.1016/j.sajce.2020.09.007
Soubedi,
B., Poudel, A., & Aryal, S. (2023). The impact of climate change on insect
pest biology and ecology: Implications for pest management strategies, crop production, and food security. Journal
of Agriculture and Food Research, 14, 100733, https://doi.org/10.1016/j.jafr.2023.100733
Sun,
Y. & Fernie, A. R. (2023). Plant secondary
metabolism in a fluctuating world: climate change perspectives. Trends in Plant Science, 29(5), 560-571. https://doi.org/10.1016/j.tplants.2023.11.008
Suselo, Y. H., Indarto,
D., Wasita, B., & Hartono, H. (2023). Alkaloid fraction of Mirabilis jalapa Linn. Florwers has low
cytotoxicity and increases iron absorption
through Erythropoietin-Matriptase-2-He-pcidim pathway in iron deficiency
hepatocarcinoma cell model. Saudi Journal ob
Biological Sciencies, 30(1), 103508. https://doi.org/10.1016/j.sjbs.2022.103508
Tabarez, A. (2019). Evaluación de la actividad antioxidante de
extractos y xantonas en un modelo químico y celular.
[En línea]. Disponible en: https://tesis.ipn.mx/handle/123456789/27338.
Fecha de consulta: 21 de enero de 2024.
Uysal, S., Gevrenova, R., Sinan, K. I., Bayarslan,
A. U., Altunoglu, Y. C., Zheleva-Dimitrova,
D., Ak, G., Baloglu, M., Etienne, O., Lobine, D., Mahomoodally, M., & Zengin,
G. (2021). New perspectives into the chemical characterization of
Sida acuta Burm. f. extracts with respect to its
anti-cancer, antioxidant and enzyme inhibitory effects. Process Biochemistry,
105, 91-101. https://doi.org/10.1016/j.procbio.2021.03.028
Vanti,
G. L., Kurjogi, M., Basavesha,
K. N., Teradal, N. L., Masaphy,
S., & Nargund, V. B. (2019). Synthesis and antibacterial activity of
solanum torvum mediated silver nanoparticle against
Xanthomonas axonopodis pv. punicae and Ralstonia
solanacearum. Journal of Biotechnology, 309, 20-28. https://doi.org/10.1016/j.jbiotec.2019.12.009
Vargas,
M. (2014). Actividad
microbiana de extractos de chile (Capsicum annum L.)
cultivado en invernadero empleando factores inductores de metabolitos (FIMs). Tesis de Maestría en Ciencias en Ingeniería de
Biosistemas. Universidad Autónoma de Querétaro. Querétaro, Qro.,
88 Pp. [En línea]. Disponible en:
https://ri-ng.uaq.mx/bitstream/123456789/792/1/RI003900.PDF. Fecha de consulta:
17 de abril de 2024.
Yadav, B., Jogawat, A.,
Rahman, S., & Narayan, O. M. (2021). Secondary metabolites in the
drought stress tolerance of crop plants: A review. Gene Reports, 23,
101040. https://doi.org/10.1016/j.genrep.2021.101040.
Zachariah,
S. M., Aleykutty, N. A., Viswanad,
V., Jacob, S., & Prabhakar, V. (2011). In-vitro Antioxidant Potential of
Methanolic Extracts of Mirabilis jalapa Linn. Free
Radicals and Antioxidants, 1(4), 82-86. https://doi.org/10.5530/ax.2011.4.13
Zhang,
C. P., Zhang, J. L., Sun, Z. R., Liu, X. Y., Shu, L. Z., Wu, H., Song, Y.,
& He, D. H. (2022). Genomewide identification and
characterization of terpene synthases genes in Gossypium hirsutum. Gene, 828(20), 146462. https://doi.org/10.1016/j.gene.2022.146462
Zhao, P., Iwamoto, Y., Kouno, I., Egami, Y., & Yamamoto, H. (2004). Stimulating
the production of homoisoflavonoids in cell
suspension cultures of Caesalpinia pulcherrima using cork tissue. Phytochemistry, 65(17), 2455-2461. https://doi.org/10.1016/j.phytochem.2004.08.004
Zárate-Martínez, W.,
González-Morales, S., Ramírez-Godina, F., Robledo-Olivo, A. y Juárez-Maldonado,
A. (2021). Efecto de los ácidos fenólicos en el sistema antioxidante de plantas
de tomare (Solanum lycopersicum Mill.). Agronomía Meso-americana, 32(3), 854-868
https://doi.org/10.15517/am.v32i3.45101