https://doi.org/10.29059/cienciauat.v19i2.1917
Transportadores de Ca2+ y su papel en las características distintivas del cáncer
Ca2+ transporters and
their role in the cancer hallmarks
Importancia de los
transportadores de Ca2+ en cáncer
Indra Nicole Monge-Hernández, Juan Santiago-García*
*Correspondencia: jusantiago@uv.mx/Fecha de recepción:
14 de mayo de 2024/Fecha de aceptación: 22 de agosto de 2024/Fecha de
publicación: 9 de septiembre de 2024.
Universidad Veracruzana, Instituto de Investigaciones
Biológicas, Laboratorio de Biología Molecular, avenida Luis Castelazo Ayala
s/n, Industrial Ánimas, Xalapa, Veracruz, México, C. P. 91190.
Resumen
El
ion calcio (Ca2+) activa diversas vías de señalización importantes
en diferentes procesos celulares como proliferación, progresión del ciclo
celular, apoptosis y expresión génica. La homeostasis de Ca2+ depende de diversas
proteínas, que actúan como canales, bombas, receptores, sitios de unión y almacenamiento de Ca2+, las cuales
son de gran importancia porque regulan el flujo, compartimentación y
concentración del Ca2+ celular, para que las vías de señalización
dependientes de este catión funcionen adecuadamente.
El objetivo del presente trabajo fue analizar la información existente sobre
los cambios en la expresión de transportadores de Ca2+ en cáncer y
su participación en las características distintivas de la enfermedad,
principalmente la proliferación celular
descontrolada, la resistencia a la apoptosis o la activación de la
migración e invasión celular. La evidencia indica que múltiples canales de Ca2+
se sobreexpresan en cáncer, lo que se asocia
con incremento del Ca2+
citoplásmico y activación de las vías de señalización CaM/CaN/NFAT, Akt o
MAPK/ERK, situación que puede conducir a un incremento en la
proliferación, transición epitelio-mesenquimal,
mayor capacidad de migración e invasión celular. Por otro lado, la subexpresión
de bombas de Ca2+ o sobreexpresión de canales mitocondriales
contribuye a la evasión de la apoptosis, a la par que propicia la migración
celular. El estudio de transportadores de Ca2+
con expresión alterada en cáncer puede contribuir a la identificación de
potenciales biomarcadores o blancos terapéuticos que permitan el desarrollo de nuevas terapias.
Palabras clave: cáncer,
transportadores de calcio,
proliferación celular, apoptosis, migración
e invasión celular.
Abstract
Calcium ion (Ca2+) activates crucial
signaling pathways involved in different cellular processes, such as proliferation, cell cycle progression,
apoptosis and gene expression. Ca2+ signaling depends on various
proteins, including channels, pumps, receptors, and binding or storage proteins,
which regulate Ca2+ influx, compartmentalization,
and concentration for Ca2+ dependent signaling pathways to
function properly. This work aimed to
analyze evidence regarding the altered expression of Ca2+
transporters in cancer and their contribution to the hallmarks of the disease,
mainly sustained cellular proliferation, apoptosis resistance, and activation
of migration and invasion. Evidence suggests that overexpression of Ca2+
channels in cancer is associated with increased Ca2+ entry
and activation of CaM/CaN/NFAT, Akt or
MAPK/ERK signaling pathways, leading to cell proliferation, migration,
invasion, and epithelial-mesenchymal transition.
On the other hand, the downregulation of Ca2+ pumps or upregulation
of mitochondrial channels contributes to apoptosis evasion and enhanced
cellular migration. Research on Ca2+ transporters with deregulated
expression in cancer may contribute to the identification of potential
biomarkers and therapeutic targets
for the development of new treatments.
Keywords:
cancer,
calcium transporters, cell proliferation, apoptosis, cell migration and
invasion.
INTRODUCCIÓN
El ion calcio (Ca2+) es un
señalizador universal en las células
eucariotas y participa en procesos celulares esenciales como proliferación,
progresión del ciclo celular, apoptosis, expresión génica, contracción
muscular, transmisión sináptica, entre otros (Berridge y col., 2003; Monteith y
col., 2017). La transición a la vida pluricelular que ocurrió hace 2 000
millones de años, requirió un ion o molécula que actuara como segundo mensajero
(los primeros mensajeros desarrollados fueron en general las hormonas) para que las células pudieran intercambiar señales entre sí y llevar a cabo funciones
específicas dentro de un mismo organismo. El Ca2+ resultó un
señalizador apto, ya que es capaz de interactuar con diversas proteínas y
regular su actividad. Además, puede unirse a proteínas “amortiguadoras” que lo
secuestran y mantienen su concentración citosólica ([Ca2+]c) en niveles
nanomolares, o a proteínas “efectoras y/o sensores” que activan distintas vías
de señalización (Carafoli y Krebs, 2016).
En condiciones
normales, la [Ca2+]c es de 100
nM a 200 nM, mientras que su concentración extracelular es de 1 mM a 1.5 mM
(Berridge y col., 2003; Clapham, 2007; Monteith y col., 2007; Roderick y Cook,
2008; Marchi y col., 2020). La entrada o liberación de Ca2+ en
respuesta a señales intra o extracelulares puede ocasionar el incremento de la
[Ca2+]c basal (hasta
1 mM a 2 mM), lo que activa diversas vías de señalización (Marchi y col., 2020). Una vez
que el Ca2+ ha cumplido su función señalizadora, es necesario
regresar a la [Ca2+]c basal
para que los procesos celulares no continúen activados de manera anormal
(Roderick y Cook, 2008). Para mantener la [Ca2+]c adecuada durante todo este proceso, se
requiere la participación de distintas proteínas presentes en la membrana
plasmática (MP), citosol, retículo endoplásmico (RE), mitocondria, aparato de
Golgi (AG) y lisosomas, a las cuales se denominan en conjunto “maquinaria de la
señalización de Ca2+” (Berridge y
col., 2003; Clapham, 2007; Roderick y
Cook, 2008) y que tienen funciones de:
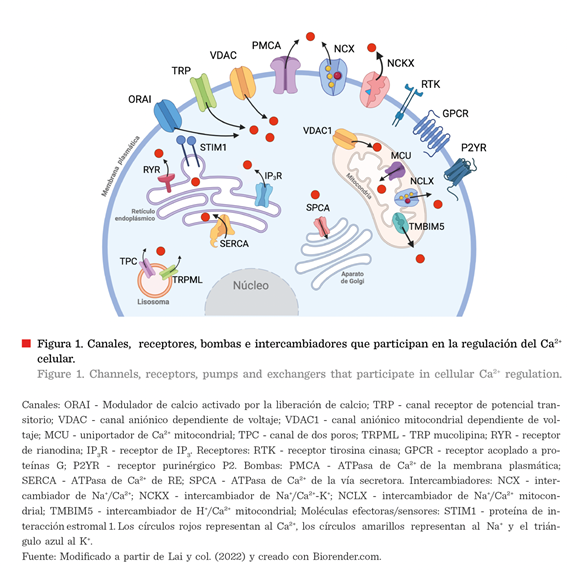
Canales: atraviesan la MP y engloban a los canales
aniónicos dependientes de voltaje (VDAC, por sus siglas en inglés:
Voltage-Dependent Anion Channels), que facilitan la entrada de Ca2+
al citoplasma, gracias a cambios en el potencial de membrana; los canales receptores de potencial transitorio (TRP, por
sus siglas en inglés: Transient Receptor
Potential), que permiten la entrada de Ca2+ al cambiar la
polarización de membrana; los canales
dependientes de depósito, que se activan por la depleción de Ca2+ en
el RE, como ORAI (Modulador de calcio activado por la liberación de calcio);
los canales receptores de inositol 1,4,5-trifosfato (IP3) (IP3R)
y los canales receptores de rianodina (RYR), que permiten la liberación de Ca2+ desde el RE; los canales de
dos poros (TPC, por sus siglas en inglés:
Two Pore Channels), que facilitan la salida de Ca2+ desde los
lisosomas, y el uniportador de Ca2+ mitocondrial (MCU), el
cual se encuentra en la membrana interna de
la mitocondria y facilita la entrada de Ca2+ a este organelo.
Receptores: están presentes en la MP y comprenden a los receptores acoplados a proteínas G (GPCR, por sus
siglas en inglés: G Protein-Coupled Receptors) y los receptores tirosina-cinasa (RTK, por sus siglas en inglés:
Receptor Tyrosine Kinases). Su activación por diversos agonistas ocasiona la
estimulación de fosfolipasas (fosfolipasa C b y g), las cuales escinden al fosfatidilinositol 4,5-bifosfato (PIP2) para
formar al IP3. El IP3 se une a los IP3R, lo
que provoca la liberación de Ca2+ del RE.
Bombas e intercambiadores: están presentes en la MP, RE, AG o mitocondria. Las bombas requieren de una
molécula que les proporcione energía, en este caso el trifosfato de adenosina
(ATP, por sus siglas en inglés: Adenosine Triphosphate) para transportar el Ca2+ al interior del organelo
correspondiente o al espacio extracelular. Entre estas moléculas se
encuentran las ATPasas de Ca2+ de
MP (PMCA, por sus siglas en inglés: Plasma Membrane Calcium ATPase), las
ATPasas de Ca2+ del RE (SERCA, por sus siglas en inglés: Sarco/Endoplasmic Reticulum Calcium ATPase) y las
ATPasas de Ca2+ del AG (SPCA, por sus siglas en inglés: Secretary
Pathway Calcium ATPase). Por
otro lado, los intercambiadores expulsan o
introducen Ca2+ gracias a
diferencias en el gradiente de concentración, entre ellos los intercambiadores de Na+/Ca2+ (NCX) y Na+/Ca2+-
K+ (NCKX) de la MP, y el intercambiador de Na+/Ca2+
de la mitocondria (NCLX).
Moléculas efectoras/sensores: proteínas de unión
a Ca2+ que detectan cambios en la [Ca2+]c, transducen
dicha información y activan diversas vías de señalización, como la
calmodulina (CaM), anexinas (ANXA), cinasas
dependientes de CaM-Ca2+ (CAMK), la molécula de interacción
estromal (STIM), las proteínas S100, entre otras.
Amortiguadores: proteínas
de unión a Ca2+ presentes en citoplasma y RE, que se encargan de
mantener la [Ca2+]c en
niveles bajos (100 nM a 200 nM). Comprende a la parval-búmina (PV), calretinina (CALB2), calsecuestrina (CASQ), calreticulina (CALR), entre otras.
La alteración en la
liberación y movilización del Ca2+, que depende de los
transportadores de este catión (canales, bombas e intercambiadores) (Figura 1), puede ocasionar efectos
negativos en la célula y en los casos más extremos, contribuir al desarrollo de
diversas patologías, entre ellas el cáncer (Hanahan y Weinberg, 2011; Marchi y col., 2020).
El objetivo de este trabajo fue analizar
los cambios en la expresión de transportadores
de Ca2+ en cáncer y su
contribución al mantenimiento de las características distintivas de esta
enfermedad, principalmente la proliferación celular descontrolada, la resistencia a la apoptosis o la activación de la migración
e invasión celular.
Procedimiento de búsqueda de la información
Los artículos consultados se obtuvieron
mediante la búsqueda en PubMed con los siguientes
términos: “señalización de calcio” (calcium
signaling), “remodelación de calcio en cáncer” (calcium remodeling in cancer), “características distintivas del cáncer”
(cancer hallmarks), “expresión diferencial
de genes en cáncer” (differential gene expression in cancer) y la
abreviatura de cada transportador (canal,
bomba o intercambiador) seguido de “proliferación” (proliferation),
“apoptosis”, “migración e invasión celular” (cellular migration
and invasion) y “cáncer” (cancer) (por ejemplo, “TRPC6 AND proliferation
AND cancer”). Se incluyeron tanto artículos originales como revisiones publicadas en los últimos 15 años y algunas
referencias clásicas, dando mayor énfasis a aquellos trabajos publicados en los últimos 5 años. Se realizó un resumen de
cada artículo tomando en cuenta los resultados
más relevantes, y posteriormente se clasificaron
de acuerdo con la característica distintiva del cáncer analizada
(proliferación celular, apoptosis y/o
migración e invasión celular) y la vía de señalización descrita.
Expresión desregulada de transportadores de Ca2+
y su papel en la proliferación celular
En cáncer, la expresión alterada de
diversos transportadores de Ca2+ se ha asociado con la activación de
la proliferación celular, aunque la mayor parte de la evidencia apunta a la
participación de canales de Ca2+. Específicamente, la sobreexpresión
de estos canales se relaciona con incremento de la [Ca2+]c, ya que facilitan la entrada de este
catión desde el espacio extracelular o su liberación desde los reservorios
intracelulares. Dicho aumento en la [Ca2+] activa diversas vías de
señalización, como CaM/CaN/NFAT, MAPK/ERK
(por sus siglas en inglés: Mitogen-Activated Protein
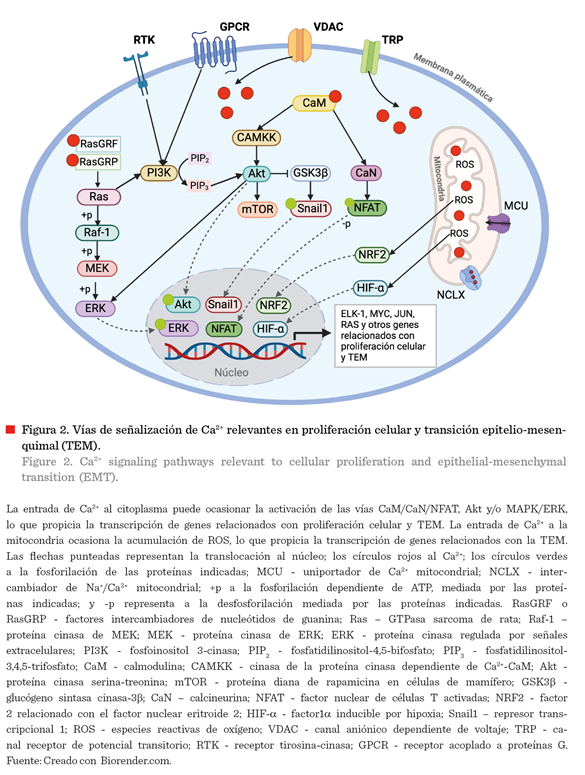
Kinases/Extracellular-Signal-Regulated Kinase) o Akt. En el caso de la vía CaM/CaN/NFAT, el Ca2+ estimula a la CaM, que consecuentemente activa a la calcineurina (CaN), la cual desfosforila
al factor nuclear de células T activadas (NFAT, por sus siglas en inglés:
Nuclear Factor of Activated T-cells) y facilita su translocación hacia el núcleo. Este factor
induce la transcripción de genes como MYC y RAS (Figura 2), que activan a la cinasa dependiente de ciclina E (CDK2), lo que propicia la progresión del
ciclo celular, específicamente de la fase G1
a S, y por consiguiente la proliferación
celular (Humeau y col., 2018).
En este contexto, la sobreexpresión de
los canales receptores de potencial
transitorio (TRP, por sus siglas en inglés: Transient Receptor Potential Cation Channel)
TRPV4 en cáncer nasofaríngeo,
TRPM8 en cáncer esofágico, TRPC3 en cáncer gástrico, ORAI1 en cáncer orofaríngeo y ORAI3 en cáncer de próstata, se
relaciona con aumento en la entrada de Ca2+ al citoplasma, lo que
ocasiona la activación de CaN, translocación de diferentes isoformas de NFAT al
núcleo y estimulación de la proliferación celular (Dubois y col., 2014; Lee y col., 2016; Lan y col., 2019; Lin y col., 2021a;
Zhang y col., 2022a). Asimismo, la sobreexpresión de los canales TRPV6 y TRPC6
se vincula con activación de la transcripción de NFAT en cáncer de próstata y cáncer ovárico (Thebault y col.,
2006; Lehen’kyi y col., 2007; Bouchard y col., 2024).
La sobreexpresión de canales de Ca2+,
también se ha asociado con la activación de
la vía MAPK/ERK en cáncer. Esta vía se regula por múltiples cinasas,
donde el Ca2+ inicialmente activa
a los factores intercambiadores de
nucleótidos de guanina (RasGRF o RasGRP), quienes posteriormente
estimulan a las proteínas Ras y Raf-1 y desencadenan una cascada de señalización que culmina con la fosforilación y
activación de la cinasa ERK. ERK-fosforilada (p-ERK) se transloca al núcleo y
regula la transcripción de genes asociados con la progresión del ciclo celular,
como ELK-1, MYC y JUN (Figura 2) (Bahar y col., 2023). En este sentido, la
sobreexpresión de los canales TRPA1 en cáncer de pulmón y ORAI3 en cáncer de
mama provoca el incremento de [Ca2+]c y activación de ERK, lo que se relaciona con mayor
proliferación y menor viabilidad celular
(Faouzi y col., 2011; Schaefer y col., 2013). Asimismo, la
sobreexpresión de TRPM2 en cáncer de páncreas se vincula con estimulación de la proliferación, probablemente porque el incremento en la entrada de Ca2+
ocasiona la activación de la proteína cinasa Ca (PKCa), la cual fosforila a Raf-1 y
consecuentemente activa a ERK (Lin y col., 2021b). Por otro lado, el
silenciamiento del canal lisosomal TRPML1 se asocia con disminución de p-ERK,
pero únicamente en tumores con mutaciones en el gen HRAS (Jung y col., 2019),
mientras que el silenciamiento de la bomba de
Ca2+ SPCA2 disminuye los niveles de p-ERK en células de
cáncer de mama, lo que a su vez correlaciona con disminución en la translocación
de NFAT al núcleo (Feng y col., 2010).
La expresión elevada
de canales de Ca2+ también
se ha relacionado con la activación de la vía Akt en la condición tumoral. Esta
vía depende de la estimulación de receptores tirosina-cinasa (RTK) o receptores
acoplados a proteínas G (GPCR), que posteriormente activan a la fosfoinositol
3-cinasa (PI3K), que convierte el PIP2
(fosfatidilinositol-4,5-bifosfato) a
PIP3 (fosfatidilinositol-3,4,5-trifosfato). Subsecuentemente,
el PIP3 activa a Akt y dicha proteína estimula a mTOR, que participa
en la síntesis de diversas proteínas (Revathidevi y Munirajan, 2019). Además,
Akt puede activar a ERK u otros factores de transcripción que propician la
expresión de genes relacionados con la proliferación celular, como CREB o NF-kB. El aumento en [Ca2+]c también puede desencadenar esta vía
mediante la estimulación de CAMKK (cinasa de la proteína cinasa dependiente de
Ca2+-CaM), que fosforila a Akt (Figura 2) (Revathidevi y Munirajan, 2019). En este contexto, la sobreexpresión
de los canales RyR1 en carcinoma de útero,
ORAI1 y ORAI2 en cáncer oral, y el intercambiador NCX1 en cáncer gástrico, se
ha relacionado con mayor capacidad proliferativa,
ya que ocasionan incremento en la [Ca2+]c y activación de Akt (Singh y col., 2020;
Wan y col., 2022; Zhang y col., 2022b). Asimismo, se ha demostrado que la
sobreexpresión de TRPC3 en cáncer gástrico ocasiona incremento de p-Akt,
inactivación de GSK3b y
translocación de NFATc2 al núcleo (Lin y col., 2021a). En contraste, la
expresión ectópica del canal TRPC1 en líneas celulares de cáncer de mama se ha
asociado con la disminución de PI3K, p-AKT y
mTOR, y por lo tanto, con menor capacidad proliferativa (Zhang y col.,
2020).
Además, el canal lisosomal TRPML2 se sobreexpresa en glioblastoma y su silenciamiento se asocia con la disminución de p-ERK y p-Akt,
mientras que el silenciamiento de ORAI3
se relaciona con la disminución de p-Akt en cáncer de pulmón (Ay y col.,
2013; Morelli y col., 2016). Por su parte,
la sobreexpresión del canal ORAI1 en este tipo de cáncer se asocia con incremento en la entrada de
Ca2+, activación de Akt y ERK, y
mayor proliferación celular (Jones y Hazlehurst, 2021). Sin embargo, aún
se desconocen los genes relacionados con dicha característica distintiva que se
activan mediante estas vías, o las proteínas
activadas o desactivadas por p-ERK o p-Akt en esos casos.
Aunado a lo anterior, se ha demostrado
que el Ca2+ propicia la
proliferación celular mediante otras vías celulares. Por ejemplo, la
sobreexpresión de TRPM2 en carcinoma hepatocelular (CHC) se vincula con la
entrada de Ca2+ al citoplasma, activación
de CaM y consecuente estimulación de la cinasa dependiente de
calmodulina (CaMKII), que activa a las cinasas dependientes de ciclinas CDK2 y
CDK4, las cuales ocasionan la progresión de la fase G1 a S (Cai y col., 2023). Por otro lado, la sobreexpresión del canal TRPV6,
en cáncer de próstata, se relaciona con mayor
entrada de Ca2+ al citoplasma y consecuente aumento en la
expresión de ciclina D1, CDK4 y el antígeno
de proliferación nuclear (PCNA), lo que se asocia con activación de la
proliferación (Bouchard y col., 2024). Adicionalmente, la sobreexpresión de
ORAI1 en cáncer cervical propicia la expresión de interleucina 6 y
proliferación celular (Pan y col., 2022), mientras que la sobreexpresión de MCU
en cáncer colorrectal eleva la concentración
de Ca2+ mitocondrial ([Ca2+]m), lo que se relaciona con formación de
especies reactivas de oxígeno (ROS) y activación de NF-kB (Liu y col., 2020).
Por otra parte, existen diversos
transportadores de Ca2+ cuya expresión desregulada en cáncer
correlaciona con la proliferación celular, pero se desconocen las vías
celulares involucradas. En algunos casos
únicamente se ha comprobado que su silenciamiento (por “knock-down”) o inhibición farmacológica,
reduce la capacidad proliferativa, como TRPC6 en cáncer de mama
(Diez-Bello y col., 2019; Jardin y col.,
2021); TRPM8 en cáncer de próstata (Di-Donato y col., 2021); TPC2 y
ORAI/STIM1 en CHC, cáncer de pulmón y glioblastoma (Ge y col., 2019; Karacicek
y col., 2019; Tajada y Villalobos, 2020;
Müller y col., 2021); ORAI2 en cáncer de mama (Sanchez-Collado y col., 2022) y CaV3.1 en cáncer oral (Li
y col., 2021).
Expresión desregulada de transportadores de Ca2+
y su papel en la apoptosis
En condiciones
normales, cuando la [Ca2+]c es mayor a ~400
nM este se transporta hacia la mitocondria, a través de sitios de la membrana externa mitocondrial que
interaccionan con zonas de la membrana del RE
ricas en receptores de IP3. En dichas zonas existen canales
mitocondriales que regulan la entrada de Ca2+, como VDAC1 en la
membrana externa y MCU en la membrana interna, el cual cuenta con múltiples
subunidades reguladoras (MICU1/2/3, MCUR1, MCUb y EMRE). El aumento de la [Ca2+]m por arriba de ~100 mM de manera prolongada desata la vía intrínseca de muerte celular programada,
provocada por la apertura del poro de transición de permeabilidad
mitocondrial (PTPm), consecuente liberación
del citocromo C (Cyt-C) al citoplasma
y activación de caspasas proapoptóticas
3, 6, 7 y 9 (Moon, 2023). Una característica de las células tumorales es
la resistencia a la apoptosis gracias a la remodelación en la expresión de los
principales reguladores de la concentración
de Ca2+ citoplásmica y mitocondrial. Por ejemplo, los canales
TRPV4 y TRPML1 se subexpresan en cáncer de pulmón y glioblastoma,
respectivamente, y su sobreexpresión ectópica o activación farmacológica induce la apoptosis, probablemente porque
propician la entrada de Ca2+ a citoplasma y subsecuente sobrecarga
de Ca2+ mitocondrial (Morelli y col., 2019; Zhao y col., 2021). Asimismo, la activación farmacológica
del canal TRPML1 en células de CHC y TRPV1 en cáncer de tiroides ocasiona la sobrecarga de Ca2+ mitocondrial y
consecuente apertura de PTPm (Xu y col., 2020; Siow y col., 2022). Con base en lo anterior, se ha
propuesto a la activación farmacológica de canales de Ca2+ en
la condición tumoral como una alternativa
terapéutica para desatar la apoptosis; sin embargo, esto también podría
ocasionar la activación de transportadores relacionados con proliferación,
migración e invasión celular.
En contraste, la bomba PMCA4 se
sobreexpresa en cáncer de páncreas y se encarga de expulsar Ca2+ del
citoplasma al espacio extracelular, por lo que evita el aumento sostenido de la
[Ca2+]c y se asocia con la evasión de la apoptosis provocada por sobrecarga de Ca2+
mitocondrial (Sritangos y col., 2020). No obstante, la evidencia sugiere que el
incremento sostenido de Ca2+ en
la mitocondria no siempre ocasiona la
muerte celular en las células transformadas, también puede propiciar la migración
e invasión, como se describe a continuación
(Miao y col., 2021; Wang y col., 2022).
Expresión desregulada de transportadores de Ca2+
y su papel en la migración e invasión celular
Las células cancerígenas poseen la
capacidad de migrar desde su lugar de origen hacia otros tejidos u órganos, lo
que se conoce como metástasis (Hanahan y Weinberg, 2011; Jones y Hazlehurst, 2021). Uno de los mecanismos más
estudiados que se asocia con esta característica
es la transición epitelio-mesenquimal (TEM), que engloba a procesos como
la separación de las células de la membrana basal, degradación de la matriz
extracelular y pérdida de las uniones célula-célula. La E-cadherina es la
principal proteína marcadora del fenotipo epitelial (no invasor), mientras que
la N-cadherina, vimentina, metaloproteinasas de la matriz extracelular (MMP) y
factores de transcripción como Snail1 y
ZEB1/2 se asocian con el fenotipo mesenquimal (invasor) (Jones y
Hazlehurst, 2021).
El incremento de Ca2+ en
citoplasma, ocasionado por la expresión alterada de transportadores de Ca2+,
se suele relacionar con la presencia de marcadores mesenquimales en cáncer, por
consiguiente, con la migración e invasión celular. Por ejemplo, la
sobreexpresión de los canales TRPM8 en cáncer de vejiga y mama, TRPV2 en cáncer de próstata y TRPM7 en
múltiples tipos de cáncer se asocia con mayor
presencia de marcadores mesenquimales (vimentina, N-cadherina, Snail1,
MMP2, MMP9) y menor expresión de marcadores epiteliales (E-cadherina), a la par
que su silenciamiento ocasiona la reducción
de la capacidad de migración e invasión celular (Monet y col., 2010; Liu
y col., 2014; Wang y col., 2020a; Chen y col., 2022). Específicamente, la
sobreexpresión de TRPM8 en cáncer de mama se relaciona con incremento del Ca2+
citoplásmico y consecuente fosforilación de Akt, inactivación de GSK3b y traslocación de Snail1 al núcleo, lo
que propicia la transcripción de los genes
relacionados con la TEM (Figura 2) (Liu y col., 2014).
Adicionalmente, se ha demostrado que la
sobreexpresión de STIM1/ORAI1 ocasiona incremento en la migración e invasión
celular en cáncer gástrico, cáncer de mama y glioblastoma (Yang y col., 2009;
Motiani y col., 2013; Xia y col., 2016). En
cáncer gástrico, su sobreexpresión se relaciona con mayor expresión de
vimentina, mientras que su silenciamiento in vivo reduce el tamaño
tumoral y la metástasis hacia los pulmones
(Xia y col., 2016). En contraste, la subexpresión de PMCA4 en este tipo de cáncer provoca la acumulación de Ca2+ en citoplasma y consecuente
translocación de NFATc1 al núcleo, lo que se asocia con la activación
transcripcional de ZEB1 y aumento de vimentina (Wang y col., 2020b). Otros
estudios se han enfocado únicamente en el papel de STIM1 en la migración
celular, pero no existe una tendencia clara acerca de su función en este
proceso. Por ejemplo, su sobreexpresión en cáncer de tiroides, cáncer de
próstata y cáncer de pulmón correlaciona con mayor expresión de marcadores
mesenquimales y capacidad de migración (Wang y col., 2017; Zhou y col., 2017;
Asghar y col., 2021). Adicionalmente, su sobreexpresión
parece estar involucrada en la formación de estructuras celulares
relacionadas con la invasión, como invadopodia o podosomas (Sun y col., 2014; Chen y col., 2017). En cambio, la
subexpresión de STIM1 se asocia con mayor
capacidad de migración en CHC, ya que reduce la entrada de Ca2+
a citoplasma y ocasiona la transición de un metabolismo anabólico hacia uno
catabólico, necesario para mantener el fenotipo
invasor (Zhao y col., 2020).
Múltiples estudios relacionan la
sobreexpresión del canal MCU con incremento
de [Ca2+]m y mayor capacidad de migración e invasión. Por ejemplo, la sobreexpresión de MCU en cáncer
esofágico y gástrico se asocia con mayor presencia de marcadores mesenquimales
(vimentina, N-cadherina, MMP2, HIF-1a,
TGF-b) y menor expresión de marcadores
epiteliales (E-cadherina) (Wang y col., 2020c; Miao y col., 2021). Asimismo, la
sobreexpresión de dicho canal y su subunidad reguladora MCUR1 en CHC y cáncer
de mama se ha relacionado con mayor migración e invasión celular (Ren y col.,
2017; Jin y col., 2019; Gao y col., 2021). Específicamente, el incremento en la
entrada de Ca2+ a la mitocondria inhibe a la enzima superóxido
dismutasa 2, que se encarga de eliminar a las
ROS. La acumulación de ROS correlaciona con la translocación del factor
NRF2 hacia al núcleo (Figura 2), donde induce la transcripción de Notch1, lo
que propicia la acumulación de marcadores
mesenquimales como Snail1 y MMP2 (Jin y col., 2019). Igualmente, se ha demostrado
la expresión elevada de MCU en cáncer de páncreas, donde ocasiona la
sobreexpresión de NRF2 e incremento de la
migración e invasión, aunque se desconoce si Notch1 está involucrado en
esa respuesta (Wang y col., 2022). Lo anterior refleja la capacidad de las células tumorales para evadir la apoptosis que
normalmente ocurre por la sobrecarga de Ca2+mitocondrial.
En cáncer colorrectal, la subexpresión
del intercambiador mitocondrial NCLX también se ha asociado con el incremento
de [Ca2+]m y consecuente
acumulación de ROS y activación de HIF-1a, que induce la expresión de la
hexocinasa 2 (HK2), aldolasa A y lactato deshidrogenasa,
lo que se relaciona con un aumento en el consumo de glucosa y producción
de lactato (Pathak y col., 2020). Esto evidencia que en las células
transformadas ocurre un aumento en la
glucólisis, ya que requieren de un mayor consumo de energía para
mantener el fenotipo invasor. La alta demanda de glucosa por parte de las
células tumorales también se ha observado en cáncer uterino, aunque en este
caso, la sobreexpresión del canal RyR1 induce la liberación de Ca2+ a citoplasma y consecuente
activación de Akt, que propicia la
sobreexpresión de HK2 (Zhang y col., 2022b).
Interesantemente, algunos trabajos
sugieren la implicación de las vías MAPK/ERK y Akt en la migración e invasión
de las células tumorales. Por ejemplo, la
sobrexpresión del canal TRPM7 en cáncer ovárico, ORAI3 en cáncer de pulmón y TRPM2 en cáncer gástrico
se relaciona con el aumento de la [Ca2+]c, activación de Akt y presencia de
marcadores mesenquimales (N-cadherina,
vimentina, MMP1/2/3, Snail1) (Wang y
col., 2014; Almasi y col., 2019; Liu y col., 2019; Daya y col., 2021). Por
otro lado, se ha demostrado que la entrada
de Ca2+, ocasionada por la sobreexpresión de STIM1/ORAI1 en
melanoma, propicia la activación de CaMKII,
estimulación de Raf-1 y fosforilación
de ERK, lo que se asocia con mayor capacidad de migración (Umemura y
col., 2014).
Adicionalmente, la expresión desregulada
de otros canales de Ca2+, en cáncer, se ha asociado con la
activación de la migración e invasión
celular, pero se desconocen las vías celulares
involucradas en esta respuesta. Tal es el caso de la sobreexpresión de ORAI1 y
ORAI2 en cáncer oral (Singh y col., 2020), TPC2 en CHC y cáncer de
vejiga (Müller y col., 2021), y la
subexpresión de TPC2 en melanoma (D’Amore y col., 2020).
CONCLUSIONES
En la manifestación de tumores cancerosos
se sobreexpresan diferentes transportadores de
Ca2+, particularmente y de forma desregulada, lo hacen los canales
de Ca2+. Esta condición ocasiona el aumento sostenido de [Ca2+] citoplásmico, lo cual se ha asociado con la
activación aberrante de distintas vías de señalización, como Ca2+-CaM/CaN/NFAT
MAPK/ERK o Akt, situación que puede propiciar proliferación celular descontrolada, transición epitelio-mesenquimal,
o migración e invasión celular, denominadas
características distintivas del
cáncer. Es importante realizar estudios que conduzcan al desarrollo de
inhibidores farmacológicos con aplicación terapéutica en cáncer. La evidencia también sugiere que las células tumorales son
capaces de evadir la apoptosis ocasionada
por la sobrecarga de Ca2+ mitocondrial,
pero pocos estudios se han enfocado a estudiar este fenómeno. Adicionalmente, la [Ca2+]m por
arriba de los niveles normales propicia la migración e invasión celular.
En pocos casos es posible delimitar si la desregulación de la expresión de
transportadores de Ca2+ es causa o consecuencia de la enfermedad;
sin embargo, la identificación de este tipo de genes/proteínas, con expresión alterada, resulta de gran utilidad para la comprensión
de los mecanismos moleculares y celulares involucrados en el progreso y mantenimiento del cáncer, además de
contribuir a identificar potenciales
biomarcadores que faciliten el
diagnóstico, pronóstico o predicción
de la respuesta al tratamiento, así como blancos terapéuticos que permitan
el desarrollo de terapias específicas y eficaces.
DECLARACIÓN DE CONFLICTO DE
INTERESES
Los autores declararon no tener
conflictos de intereses de ningún tipo.
Referencias
Almasi, S.,
Sterea, A. M., Wasundara, F., Clements, D. R., Marcato, P., Hoskin, D. W., Gujar, S., & El-Hiani, Y.
(2019). TRPM2 ion
channel promotes gastric cancer migration, invasion and tumor growth through
the AKT signaling pathway. Scientific Reports, 9(1), 4182. https://doi.org/10.1038/S41598-019-40330-1
Asghar, M. Y., Lassila, T., Paatero, I., Nguyen, V. D., Kronqvist, P.,
Zhang, J., Slita, A., Löf, C., Zhou, Y., Rosenholm, J., & Törnquist, K.
(2021). Stromal interaction molecule 1 (STIM1) knock down attenuates invasion
and proliferation and enhances the expression of thyroid-specific proteins in
human follicular thyroid cancer cells. Cellular and Molecular Life Sciences, 78(15), 5827-5846. https://doi.org/10.1007/S00018-021-03880-0
Ay, A. S., Benzerdjerb, N., Sevestre, H., Ahidouch, A., &
Ouadid-Ahidouch, H. (2013). Orai3 constitutes a native store-operated calcium
entry that regulates non small cell lung adenocarcinoma cell proliferation. PLoS
One, 8(9), 72889. https://doi.org/10.1371/JOURNAL.PONE.0072889
Bahar, M. E., Kim, H. J., & Kim, D. R. (2023). Targeting the
RAS/RAF/MAPK pathway for cancer therapy: from mechanism to clinical
studies. Signal Transduction and Targeted Therapy, 8(1), 455. https://doi.org/10.1038/S41392-023-01705-Z
Berridge, M. J., Bootman, M. D., & Roderick, H. L. (2003). Calcium
signalling: dynamics, homeostasis and remodelling. Nature Reviews. Molecular
Cell Biology, 4(7), 517-529. https://doi.org/10.1038/nrm1155
Bouchard, M. J., Wang, Y., Deng, X., Zhang, R., Lyu, H., Xiao, S., Guo,
D., Ali, D. W., Michalak, M., Zhou, C., Chen, X. Z., & Tang, J. (2024). The
TRPV6 calcium channel and its relationship with cancer. Biology (Basel),
13(3), 168. https://doi.org/10.3390/BIOLOGY13030168
Cai, X., Yu,
X., Yang, J., Lu, L., Hua, N., Duan, X., Ye, P., Ni, L., Jiang, L., Yang, W., Liang, T., & Yu, P. (2023). TRPM2 regulates cell cycle through
the Ca2+-CaM-CaMKII signaling pathway to promote HCC. Hepatology Communications, 7(5), 1-15. https://doi.org/10.1097/HC9.0000000000000101
Carafoli, E. & Krebs, J. (2016). Why calcium? How calcium became the
best communicator. Journal of Biological Chemistry, 291(40), 20849-20857. https://doi.org/10.1074/jbc.R116.735894
Chen, T. M., Huang, C. M., Hsieh, M. S., Lin, C. S., Lee, W. H., Yeh, C.
T., & Liu, S. C. (2022). TRPM7 via calcineurin/NFAT pathway mediates metastasis and
chemotherapeutic resistance in head and neck squamous cell carcinoma. Aging (Albany NY), 14(12), 5250-5270. https://doi.org/10.18632/AGING.204154
Chen, Y. W., Chen, Y. F., Chiu, W. T., Chen, H. C., & Shen, M. R.
(2017). STIM1-dependent Ca2+ signaling regulates podosome formation
to facilitate cancer cell invasion. Scientific Reports, 7(1), 11523. https://doi.org/10.1038/S41598-017-11273-2
Clapham, D. E. (2007). Calcium signaling. Cell, 131(6),
1047-1058. https://doi.org/10.1016/j.cell.2007.11.028
D’Amore, A.,
Hanbashi, A. A., Di-Agostino, S., Palombi, F., Sacconi, A., Voruganti, A.,
Taggi, M., Canipari, R., Blandino, G., Parrington, J., & Filippini, A. (2020). Loss of two-pore channel 2 (TPC2)
expression increases the metastatic traits of melanoma cells by a mechanism
involving the hippo signalling pathway and store-operated calcium entry. Cancers, 12(9), 2391. https://doi.org/10.3390/cancers12092391
Daya, H. A., Kouba, S., Ouled-Haddou, H., Benzerdjeb, N., Telliez, M.
S., Dayen, C., Sevestre, H., Garçon, L., Hague, F., & Ouadid-Ahidouch, H. (2021). Orai3-mediates
cisplatin-resistance in non-small cell lung cancer cells by enriching cancer
stem cell population through PI3K/AKT pathway. Cancers,
13(10), 2314. https://doi.org/10.3390/CANCERS13102314
Di-Donato, M.,
Ostacolo, C., Giovannelli, P., Di Sarno, V., Monterrey, I. M. G., Campiglia,
P., Migliaccio, A., Bertamino, A., & Castoria, G. (2021). Therapeutic potential of TRPM8
antagonists in prostate cancer. Scientific
Reports, 11(1), 23232. https://doi.org/10.1038/s41598-021-02675-4
Diez-Bello,
R., Jardin, I., Lopez, J. J., El-Haouari, M., Ortega-Vidal, J., Altarejos, J.,
Salido, G. M., Salido, S., & Rosado, J. A. (2019). (−)-Oleocanthal inhibits
proliferation and migration by modulating Ca2+ entry through TRPC6
in breast cancer cells. Biochimica et Biophysica Acta (BBA) - Molecular Cell
Research, 1866(3), 474-485. https://doi.org/10.1016/j.bbamcr.2018.10.010
Dubois, C., Vanden-Abeele, F., Lehen’kyi, V., Gkika, D., Guarmit, B.,
Lepage, G., Slomianny, C., Borowiec, A. S., Bidaux, G., Benahmed, M., Shuba,
Y., & Prevarskaya, N. (2014). Remodeling of channel-forming ORAI proteins
determines an oncogenic switch in
prostate cancer. Cancer Cell, 26(1), 19-32. https://doi.org/10.1016/J.CCR.2014.04.025
Faouzi, M., Hague, F., Potier, M., Ahidouch, A., Sevestre, H., & Ouadid-Ahidouch, H. (2011). Downregulation of Orai3 arrests
cell-cycle progression and induces apoptosis in breast cancer cells but not in normal breast epithelial
cells. Journal of Cellular Physiology, 226(2), 542-551. https://doi.org/10.1002/jcp.22363
Feng, M., Grice, D. M., Faddy, H. M., Nguyen, N., Leitch, S., Wang, Y.,
Muend, S., Kenny, P. A., Suku-mar, S., Roberts-Thomson, S. J., Monteith, G. R.,
& Rao, R. (2010). Store-independent activation of Orai1 by SPCA2 in mammary
tumors. Cell, 143(1), 84-98. https://doi.org/10.1016/j.cell.2010.08.040
Gao, P., Peng, T., Lin, S., Zhi, W., Cao, C., Wu, P., Xi, L., Wu, P.,
Yang, Q., & Ding, W. (2021). Key role of MCUR1 in malignant progression of
breast cancer. Onco
Targets and Therapy, 14, 4163-4175. https://doi.org/10.2147/OTT.S306854
Ge, C., Zeng, B., Li, R., Li, Z., Fu, Q., Wang, W., Wang, Z., Dong, S.,
Lai, Z., Wang, Y., Xue, Y., Guo, J., Di,
T., & Song, X. (2019). Knockdown of STIM1 expression inhibits non-small-cell
lung cancer cell
proliferation in vitro and in nude mouse xenografts. Bioengineered,
10(1), 425-436. https://doi.org/10.1080/21655979.2019.1669518
Hanahan,
D. & Weinberg, R. A. (2011). Hallmarks of cancer: the next generation. Cell, 144(5),
646-674. https://doi.org/10.1016/j.cell.2011.02.013
Humeau, J.,
Bravo-San-Pedro, J. M., Vitale, I., Nuñez, L., Villalobos, C., Kroemer, G.,
& Senovilla, L. (2018). Calcium signaling and cell cycle:
Progression or death. Cell
Calcium, 70, 3-15. https://doi.org/10.1016/j.ceca.2017.07.006
Jardin, I.,
Diez-Bello, R., Falcon, D., Alvarado, S., Regodon, S., Salido, G. M., Smani,
T., & Rosado, J. A.
(2021). Melatonin
downregulates TRPC6, impairing store-operated calcium entry in triple-negative breast cancer cells. Journal
of Biological Chemistry, 296,
100254. https://doi.org/10.1074/jbc.RA120.015769
Jin, M., Wang, J., Ji, X., Cao, H., Zhu, J., Chen, Y., Yang, J., Zhao, Z., Ren, T., & Xing, J. (2019).
MCUR1 facilitates
epithelial-mesenchymal transition and metastasis via the mitochondrial calcium
dependent ROS/Nrf2/Notch pathway in hepatocellular carcinoma. Journal of
Experimental & Clinical Cancer Research, 38(1), 136. https://doi.org/10.1186/S13046-019-1135-X
Jones, C. A.
& Hazlehurst, L. A. (2021). Role of Calcium Homeostasis in
Modulating EMT in Cancer. Biomedicines, 9(9), 1200. https://doi.org/10.3390/biomedicines9091200
Jung, J., Cho, K., Naji, A. K., Clemons, K. N., Wong, C. O., Villanueva,
M., Gregory, S., Karagas, N. E., Tan,
L., Liang, H., Rousseau, M. A., Tomasevich, K. M., Sikora, A. G., Levental,
I., van-der-Hoeven, D., Zhou, Y., Hancock, J. F., & Venkatachalam, K.
(2019). HRAS-driven cancer cells are vulnerable to TRPML1 inhibition. EMBO
Reports, 20(4), e46685. https://doi.org/10.15252/embr.201846685
Karacicek, B.,
Erac, Y., & Tosun, M. (2019). Functional consequences of enhanced expression of
STIM1 and Orai1 in Huh-7 hepatocellular carcinoma tumor-initiating cells. BMC Cancer, 19(1),
751. https://doi.org/10.1186/S12885-019-5947-Z
Lai, H. T., Canoy, R. J., Campanella, M., & Vassetzky, Y. (2022). Ca2+
Transportome and the interorganelle
communication in hepatocellular carcinoma. Cells, 11(5), 815.
https://doi.org/10.3390/cells11050815
Lan, X., Zhao,
J., Song, C., Yuan, Q., & Liu, X. (2019). TRPM8
facilitates proliferation and immune evasion of esophageal cancer cells. Bioscience
Reports, 39(10), BSR20191878. https://doi.org/10.1042/BSR20191878
Lee, S. H., Rigas, N. K., Lee, C. R., Bang, A., Srikanth, S., Gwack, Y.,
Kang, M. K., Kim, R. H., Park, N. H., & Shin, K. H. (2016). Orai1 promotes
tumor progression
by enhancing cancer stemness via NFAT signaling in oral/oropharyngeal squamous cell carcinoma.
Oncotarget, 7(28), 43239-43255. https://doi.org/10.18632/oncotarget.9755
Lehen’kyi, V., Flourakis, M., Skryma, R., & Prevarskaya, N. (2007).
TRPV6 channel controls prostate cancer cell proliferation via Ca(2+)/NFAT-dependent
pathways. Oncogene, 26(52), 7380-7385. https://doi.org/10.1038/sj.onc.1210545
Li, R. F., Man, Q. W., Liu, J. Y., Zheng, Y. Y., Gao, X., & Liu, H.
M. (2021). Overexpression of T-type calcium channel Cav3.1 in oral squamous
cell carcinoma:
association with proliferation and anti-apoptotic activity. Journal of
Molecular Histology, 52(3), 511-520. https://doi.org/10.1007/S10735-020-09937-X
Lin, D. C., Zheng, S. Y., Zhang, Z. G., Luo, J. H., Zhu, Z. L., Li, L.,
Chen, L. S., Lin, X., Sham, J. S. K., Lin, M. J., & Zhou, R. X. (2021a).
TRPC3 promotes tumorigenesis of gastric cancer via the CNB2/GSK3b/NFATc2
signaling pathway. Cancer Letters, 519, 211-225. https://doi.org/10.1016/J.CANLET.2021.07.038
Lin, R., Bao, X., Wang, H., Zhu, S., Liu, Z., Chen, Q., Ai, K., & Shi, B. (2021b).
TRPM2 promotes pancreatic
cancer by PKC/MAPK pathway. Cell Death & Dsease, 12(6), 585. https://doi.org/10.1038/s41419-021-03856-9
Liu, J., Chen, Y., Shuai, S., Ding, D., Li, R., & Luo, R. (2014).
TRPM8 promotes aggressiveness of breast cancer cells by regulating EMT via
activating AKT/GSK-3b pathway. Tumour Biology, 35(9), 8969-8977. https://doi.org/10.1007/S13277-014-2077-8
Liu, L., Wu, N., Wang, Y., Zhang, X., Xia, B., Tang, J., Cai, J., Zhao, Z., Liao, Q., & Wang, J.
(2019). TRPM7
promotes the epithelial-mesenchymal transition in ovarian cancer through the
calcium-related PI3K / AKT oncogenic signaling. Journal of Experimental & Clinical Cancer
Research, 38(1),
106. https://doi.org/10.1186/S13046-019-1061-Y
Liu, Y., Jin, M., Wang, Y., Zhu, J., Tan, R., Zhao, J., Ji, X., Jin, C.,
Jia, Y., Ren, T., & Xing, J. (2020). MCU-induced mitochondrial calcium
uptake promotes
mitochondrial biogenesis and colorectal cancer growth. Signal
Transduction and Targeted Terapy, 5(1), 59. https://doi.org/10.1038/S41392-020-0155-5
Marchi, S., Giorgi, C., Galluzzi, L., & Pinton, P. (2020). Ca2+
Fluxes and Cancer. Molecular Cell, 78(6), 1055-1069. https://doi.org/10.1016/j.molcel.2020.04.017
Miao, Y., Wang, X., Lai, Y., Lin, W., Huang, Y., Yin, H., Hou, R., &
Zhang, F. (2021). Mitochondrial calcium uniporter promotes cell proliferation
and migration in esophageal cancer. Oncology Letters, 22(3), 686. https://doi.org/10.3892/OL.2021.12947
Monet, M., Lehen’kyi, V., Gackiere, F., Firlej, V.,Vandenberghe, M.,
Roudbaraki, M., Gkika, D., Pourtier, A., Bidaux, G., Slomianny, C., Delcourt,
P., Rassendren, F., Bergerat, J. P., Ceraline, J., Cabon, F., Humez, S., &
Prevarskaya, N. (2010). Role of cationic channel TRPV2 in promoting prostate
cancer migration and progression to androgen resistance. Cancer Research,
70(3), 1225-1235.
Monteith,
G. R., Prevarskaya, N., & Roberts-Thomson, S. J. (2017). The
calcium-cancer signalling nexus. Nature Reviews Cancer, 17(6), 367-380. https://doi.org/10.1038/nrc.2017.18
Moon, D. O. (2023). Calcium’s role in orchestrating cancer apoptosis:
Mitochondrial-centric perspective. International Journal of Molecular
Sciences, 24(10), 8982. https://doi.org/10.3390/ijms24108982
Morelli, M. B., Amantini, C., Tomassoni, D., Nabissi, M., Arcella, A.,
& Santoni, G. (2019). Transient Receptor Potential Mucolipin-1 Channels in
Glioblastoma: Role in Patient’s Survival. Cancers, 11(4), 525. https://doi.org/10.3390/CANCERS11040525
Morelli, M.
B., Nabissi, M., Amantini, C., Tomassoni, D., Rossi, F., Cardinali, C.,
Santoni, M., Arcella, A., Oliva, M. A., Santoni, A., Polidori, C., Mariani, M.
P., & Santoni, G. (2016). Overexpression
of transient
receptor potential mucolipin-2 ion channels in gliomas: role in tumor growth
and progression. Oncotarget, 7(28), 43654. https://doi.org/10.18632/ONCOTARGET.9661
Motiani, R. K., Hyzinski-García, M. C., Zhang, X., Henkel, M. M.,
Abdullaev, I. F., Kuo, Y. H., Matrougui, K., Mongin, A. A., & Trebak, M. (2013). STIM1 and Orai1 mediate CRAC
channel activity and are essential for human glioblastoma invasion. Pflugers
Archive: European Journal of Physiology, 465(9), 1249-1260. https://doi.org/10.1007/s00424-013-1254-8
Müller, M., Gerndt, S., Chao, Y. K., Zisis, T., Nguyen, O. N. P.,
Gerwien, A., Urban, N., Müller, C., Gegenfurtner, F. A., Geisslinger, F.,
Ortler, C., Chen, C. C., Zahler, S., Biel, M., Schaefer, M., Grimm, C.,
Bracher, F., Vollmar, A. M., & Bartel, K. (2021). Gene editing and
synthetically accessible inhibitors reveal role for TPC2 in HCC cell
proliferation and tumor growth. Cell Chemical Biology, 28(8), 1119-1131.e27. https://doi.org/10.1016/j.chembiol.2021.01.023
Pan, Y., Huang, J., Liu, K., Xie, C., Chen, H., Guo, Z., Guo, S., &
Chen, Y. (2022). Orai1-mediated store-operated Ca2+ entry promotes
cervical cancer progression through IL-6 signaling. Frontiers in Molecular
Biosciences, 9, 1041674. https://doi.org/10.3389/FMOLB.2022.1041674/BIBTEX
Pathak, T., Gueguinou, M., Walter, V., Delierneux, C., Johnson, M. T.,
Zhang, X., Xin, P., Yoast, R. E., Emrich, S. M., Yochum, G. S., Sekler, I.,
Koltun, W. A., Gill, D. L., Hempel, N.,
& Trebak, M. (2020). Dichotomous role of the human mitochondrial Na+/Ca2+/Li+
exchanger NCLX in colorectal cancer growth and metastasis. eLife, 9,
1-41. https://doi.org/10.7554/eLife.59686
Ren, T., Zhang, H., Wang, J., Zhu, J., Jin, M., Wu, Y., Guo, X., Ji, L.,
Huang, Q., Zhang, H., Yang, H., & Xing, J. (2017). MCU-dependent
mitochondrial Ca2+ inhibits NAD+/SIRT3/SOD2 pathway to promote ROS
production and metastasis of HCC cells. Oncogene, 36(42), 5897-5909. https://doi.org/10.1038/onc.2017.167
Revathidevi,
S. & Munirajan, A. K. (2019). Akt in cancer: Mediator and more. Seminars in Cancer Biology, 59, 80-91. https://doi.org/10.1016/J.SEMCANCER.2019.06.002
Roderick, H. L. & Cook, S. J. (2008). Ca2+ signalling
checkpoints in cancer: remodelling Ca2+ for cancer cell
proliferation and survival. Nature Reviews
Cancer, 8(5), 361-375. https://doi.org/10.1038/nrc2374
Sanchez-Collado,
J., Lopez, J. J., Cantonero, C., Jardin, I., Regodón, S., Redondo, P. C.,
Gordillo, J., Smani, T., Salido, G. M., & Rosado, J. A. (2022). Orai2 modulates store-operated Ca2+ entry
and cell cycle
progression in breast cancer cells. Cancers, 14(1), 114. https://doi.org/10.3390/CANCERS14010114/S1
Schaefer, E. A. M., Stohr, S., Meister, M., Aigner, A., Gudermann, T.,
& Buech, T. R. H. (2013). Stimulation of the chemosensory TRPA1 cation channel by volatile toxic substances
promotes cell survival of small cell lung cancer cells. Biochemical Pharmacology, 85(3), 426-438. https://doi.org/10.1016/j.bcp.2012.11.019
Singh, A. K., Roy, N. K., Bordoloi, D., Padmavathi, G., Banik, K.,
Khwairakpam, A. D., Kunnumakkara, A. B., & Sukumar, P. (2020). Orai-1 and
Orai-2 regulate oral cancer cell migration and colonisation by suppressing
Akt/mTOR/NF-kB signalling. Life Sciences, 261, 118372. https://doi.org/10.1016/J.LFS.2020.118372
Siow, W. X., Kabiri, Y., Tang, R., Chao, Y. K., Plesch, E., Eberhagen,
C., Flenkenthaler, F., Fröhlich, T., Bracher, F., Grimm, C., Biel, M., Zischka,
H., Vollmar, A. M., & Bartel, K. (2022). Lysosomal TRPML1 regulates
mitochondrial function in hepatocellular carcinoma cells. Journal of Cell
Science, 135(6), jcs259455. https://doi.org/10.1242/jcs.259455
Sritangos, P., Pena Alarcon, E., James, A. D., Sultan, A., Richardson,
D. A., & Bruce, J. I. E. (2020). Plasma
membrane Ca2+ ATPase isoform 4 (PMCA4) has an important role in numerous
hallmarks of pancreatic cancer. Cancers, 12(1), 1-22. https://doi.org/10.3390/cancers12010218
Sun, J., Lu, F., He, H., Shen, J., Messina, J., Mathew, R., Wang, D.,
Sarnaik, A. A., Chang, W. C., Kim, M., Cheng, H., & Yang, S. (2014). STIM1-
and Orai1-mediated Ca2+ oscillation orchestrates invadopodium
formation and melanoma invasion. Journal of Cell Biology, 207(4), 535. https://doi.org/10.1083/JCB.201407082
Tajada, S.
& Villalobos, C. (2020). Calcium permeable channels in cancer hallmarks. Frontiers in
Pharmacology, 11, 968. https://doi.org/10.3389/FPHAR.2020.00968
Thebault, S., Flourakis, M., Vanoverberghe, K., Vandermoere, F.,
Roudbaraki, M., Lehen’kyi, V., Slomianny, C., Beck, B., Mariot, P., Bonnal, J.
L., Mauroy, B., Shuba, Y., Capiod, T., Skryma, R., & Prevarskaya, N.
(2006). Differential role of transient
receptor potential channels in Ca2+ entry and proliferation of prostate cancer
epithelial cells. Cancer Research, 66(4), 2038-2047. https://doi.org/10.1158/0008-5472.CAN-05-0376
Umemura, M., Baljinnyam, E., Feske, S., De-Lo-renzo, M. S., Xie, L. H.,
Feng, X., Oda, K., Makino, A., Fujita, T., Yokoyama, U., Iwatsubo, M., Chen,
S., Goydos, J. S., Ishikawa, Y., & Iwatsubo, K. (2014). Store-operated Ca2+
entry (SOCE) regulates melanoma proliferation and cell migration. PloS One,
9(2), e89292. https://doi.org/10.1371/JOURNAL.PONE.0089292
Wan, H., Gao, N., Lu, W., Lu, C., Chen, J., Wang, Y., & Dong, H.
(2022). NCX1 coupled with TRPC1 to
promote gastric cancer via Ca2+/AKT/b-catenin pathway. Oncogene,
41(35), 4169-4182. https://doi.org/10.1038/S41388-022-02412-9
Wang, G., Cao, R., Qian, K., Peng, T., Yuan, L., Chen, L., Cheng, S.,
Xiong, Y., Ju, L., Wang, X., & Xiao, Y. (2020a). TRPM8 inhibition regulates
the proliferation,
migration and ROS metabolism of bladder
cancer cells. Onco Targets and Therapy, 13, 8825-8835. https://doi.org/10.2147/OTT.S257056
Wang, J., Liao, Q. J., Zhang, Y., Zhou, H., Luo, C. H., Tang, J., Wang,
Y., Tang, Y., Zhao, M., Zhao, X. H., Zhang, Q. Y., & Xiao, L. (2014). TRPM7
is required for ovarian cancer cell growth, migration and invasion. Biochemical and Biophysical Research Communications, 454(4), 547–553. https://doi.org/10.1016/J.BBRC.2014.10.118
Wang, T., Li, N., Jin, L., Qi, X., Zhang, C., & Hua, D. (2020b). The
calcium pump PMCA4 prevents epithelial-mesenchymal transition by inhibiting NFATc1-ZEB1 pathway in
gastric cancer. Biochimica et Biophysica Acta
(BBA) - Molecular Cell Research, 1867(12), 118833. https://doi.org/10.1016/J.BBAMCR.2020.118833
Wang, X., Li, Y., Li, Z., Lin, S., Wang, H., Sun, J., Lan, C., Wu, L.,
Sun, D., Huang, C., Singh, P. K., Hempel, N., Trebak, M., De-Nicola, G. M.,
Hao, J., & Yang, S. (2022). Mitochondrial calcium uniporter drives metastasis and confers
a targetable cystine dependency in pancreatic cancer. Cancer Research, 82(12), 2254-2268. https://doi.org/10.1158/0008-5472.CAN-21-3230
Wang, X., Song, X., Cheng, G., Zhang, J., Dong, L., Bai, J., Luo, D.,
Xiong, Y., Li, S., Liu, F., Sun, Y., Wang, X., Li, Y., & Huang, Y. (2020c).
The regulatory mechanism and biological gignificance of mitochondrial calcium
uniporter in the migration, invasion, angiogenesis and growth of gastric cancer. Onco Targets and Therapy, 13,
11781-11794.https://doi.org/10.2147/OTT.S262049
Wang, Y., Wang, H., Pan, T., Li, L., Li, J., & Yang, H. (2017).
STIM1 silencing inhibits the migration and invasion of A549 cells. Molecular
Medicine Reports, 16(3), 3283-3289. https://doi.org/10.3892/MMR.2017.7010
Xia, J., Wang, H., Huang, H., Sun, L., Dong, S., Huang, N., Shi, M.,
Bin, J., Liao, Y., & Liao, W. (2016). Elevated Orai1 and STIM1 expressions
upregulate MACC1 expression to promote tumor cell proliferation, metabolism,
migration, and invasion in human
gastric cancer. Cancer Letters, 381(1), 31-40. https://doi.org/10.1016/j.canlet.2016.07.014
Xu, S., Cheng, X., Wu, L., Zheng, J., Wang, X., Wu, J., Yu, H., Bao, J.,
& Zhang, L. (2020). Capsaicin induces mitochondrial dysfunction and
apoptosis in anaplastic thyroid carcinoma cells via TRPV1-mediated
mitochondrial calcium overload. Cellular Signalling, 75, 109733. https://doi.org/10.1016/j.cellsig.2020.109733
Yang, S., Zhang, J. J., & Huang, X. Y. (2009). Orai1 and STIM1 are
critical for breast tumor cell migration and metastasis. Cancer Cell,
15(2), 124-134. https://doi.org/10.1016/j.ccr.2008.12.019
Zhang, L., Au-Yeung, C. L., Huang, C., Yeung, T. L., Ferri-Borgogno, S.,
Lawson, B. C., Kwan, S. Y., Yin, Z., Wong, S. T., Thomas, V., Lu, K. H., Yip,
K. P., Sham, J. S. K., & Mok, S. C. (2022b). Ryanodine receptor 1-mediated
Ca2+ signaling and mitochondrial reprogramming modulate uterine
serous cancer malignant phenotypes. Journal of Experimental & Clinical
Cancer Research, 41(1), 242. https://doi.org/10.1186/S13046-022-02419-W
Zhang, L. Y., Zhang, Y. Q., Zeng, Y. Z., Zhu, J. L., Chen, H., Wei, X.
L., & Liu, L. J. (2020). TRPC1 inhibits the proliferation and migration of
estrogen receptor-positive Breast cancer and gives a better prognosis by
inhibiting the PI3K/AKT pathway. Breast Cancer Research and Treatment,
182(1), 21-33. https://doi.org/10.1007/S10549-020-05673-8/FIGURES/7
Zhang, P., Li, K., Wang, Z., Wu, Y., Zhang, H., Ma, F., Liu, X. Y.,
Tong, M. C. F., Ru, X., Zhang, X., & Zeng, X. (2022a). Transient receptor
potential vanilloid type 4 (TRPV4) promotes tumorigenesis via NFAT4 activation
in nasopharyngeal carcinoma. Frontiers in Molecular Biosciences, 9,
1064366. https://doi.org/10.3389/FMOLB.2022.1064366/BIBTEX
Zhao, H., Yan, G., Zheng, L., Zhou, Y., Sheng, H., Wu, L., Zhang, Q.,
Lei, J., Zhang, J., Xin, R., Jiang, L., Zhang, X., Chen, Y., Wang, J., Xu, Y.,
Li, D., & Li, Y. (2020). STIM1 is a metabolic checkpoint regulating the
invasion and metastasis of hepatocellular carcinoma. Theranostics, 10(14), 6483-6499. https://doi.org/10.7150/THNO.44025
Zhao, Y., Wang, J., & Liu, X. (2021). TRPV4 induces apoptosis via
p38 MAPK in human lung cancer cells. Brazilian Journal of Medical and
Biological Research, 54(12), e10867. https://doi.org/10.1590/1414-431X2021E10867
Zhou, Y., Gu, P., Li, J., Li, F., Zhu, J., Gao, P., Zang, Y., Wang, Y.,
Shan, Y., & Yang, D. (2017). Suppression of STIM1 inhibits the migration
and invasion of human prostate cancer cells and is associated with PI3K/Akt
signaling inactivation. Oncology
Reports, 38(5), 2629-2636.
https://doi.org/10.3892/OR.2017.5961