https://doi.org/10.29059/cienciauat.v19i2.1918
La rabia
paralítica bovina en el estado de Tamaulipas desde la perspectiva de la
distribución de su principal reservorio, el vampiro común (Desmodus rotundus)
Bovine paralytic rabies in the state of Tamaulipas from the perspective
of the distribution of its main reservoir, the common vampire bat (Desmodus
rotundus)
Rabia
paralítica bovina en Tamaulipas
José
Ignacio Olave-Leyva1,2, Julio Martínez-Burnes1, Leroy
Soria-Díaz1,3, Álvaro Aguilar-Setién4, Nidia Aréchiga-Ceballos5*
*Correspondencia:
nidia.arechiga@salud.gob.mx/Fecha de recepción: 21 de mayo de 2024/Fecha de
aceptación: 15 de noviembre de 2024/Fecha de publicación: 24 de enero de 2025
1Universidad Autónoma de Tamaulipas,
Instituto de Ecología Aplicada, Ciudad Victoria, Tamaulipas, México, C. P.
87019. 2Universidad Autónoma del Estado de Hidalgo, Instituto de
Ciencias Agropecuarias, área Académica de Medicina Veterinaria y Zootecnia,
Hidalgo, México, C. P. 43775. 3Universidad Autónoma de Tamaulipas,
Facultad de Medicina Veterinaria y Zootecnia, Ciudad Victoria, Tamaulipas,
México, C. P. 8727. 4Universidad Nacional Autónoma de México, Unidad
de Posgrado, Coyoacán, Ciudad de México, México, C. P. 04510. 5Secretaría
de Salud, Dirección General de Epidemiología, Instituto de Diagnóstico y
Referencia Epidemiológicos, Francisco de P. Miranda, núm. 157, col. Unidad
Lomas de Plateros, Alcaldía Álvaro Obregón, Ciudad de México, México, C. P.
01480.
Resumen
La rabia es la zoonosis con mayor impacto sobre herbívoros
domésticos, provocando en América Latina pérdidas económicas de aproximadamente
97 millones de dólares anuales. En esta región, el vampiro común (Desmodus rotundus)
es un reservorio del virus de la rabia y se considera
su principal transmisor al ganado. El objetivo de este estudio fue
analizar la progresión de la rabia paralítica bovina (RPB) y su asociación con la presencia y distribución de
D. rotundus en Tamaulipas, México, en función
de factores ambientales (características ecológicas y geográficas) que lo
favorecen. Se analizó la distribución anual de casos detectados de RPB en
Tamaulipas por municipio durante 1999 a 2020. La distribución espacial del
murciélago D. rotundus se estudió considerando
las características biológicas de la especie, así como las de Tamaulipas. La
RPB, asociada a D. rotundus mediante
tipificación de la variante antigénica del
virus, se presentó en 28 de los 43 municipios que comprende el estado, con marcada tendencia a expandirse
desde el sur hacia el norte de la entidad. La ecorregión bosque húmedo
veracruzano concentró el mayor número de casos de RPB y presencia del vampiro,
ambos factores se vieron influenciados por diferentes tipos de vegetación como
áreas agrícolas, pastizales y selvas. La
tendencia observada en los últimos 10 años, de avanzar hacia el norte
del estado de parte de D. rotundus y los
brotes de casos de RPB en esas zonas, sugieren la posibilidad de que la especie
expanda su distribución hacia los Estados
Unidos de América, país actualmente considerado libre de la presencia
del organismo, principalmente hacia el
estado vecino de Texas, debido a que sus características geográficas y
ecológicas son similares a las de la entidad analizada.
Palabras clave: cambio climático, Desmodus rotundus,
rabia, Tamaulipas, zoonosis.
Abstract
Rabies is the zoonosis with the most
significant impact on domestic herbivores, causing economic losses of
approximately 97 million dollars annually in Latin America. In this region, the
common vampire (Desmodus rotundus) is a reservoir of the rabies virus and is
considered its main transmitter to livestock. The objective of this study was to analyze the progression of bovine
paralytic rabies (BPR) and its association with the presence and distribution
of D. rotundus in Tamaulipas, Mexico, focusing
on the environmental factors (ecological and geographical characteristics) that
favor it. Municipalities’ annual distribution
of detected cases of BPR in Tamaulipas from 1999 to 2020 was analyzed.
The spatial distribution of the bat D. rotundus was
studied considering the biological characteristics of the species, as well as
those of Tamaulipas. BPR, associated with D. rotundus
through typification of the antigenic variant of the virus, occurred in 28 of the 43 municipalities comprising the state, with a marked tendency to expand
itself from the south to the north. The
Veracruz humid forest ecoregion concentrated
the highest number of cases of BPR and the presence of the vampire. Both
factors were influenced by different types of vegetation, such as
agricultural areas, pastures, and jungles. The trend observed in the last 10 years of
advancing towards the north of the state on the part of D. rotundus and the
outbreaks of RPB casesin those areas suggests that the species is likely to expand its distribution to the
United States of America, a country currently considered free of the presence of the organism, mainly to the
neighboring state of Texas, because its geographical and ecological
characteristics are similar to those of the state analyzed.
Keywords: climate change, Desmodus
rotundus, rabies, Tamaulipas, zoonoses.
![]()
INTRODUCCIÓN
La mayoría de las enfermedades infecciosas emergentes y
reemergentes que afectan al ser humano son zoonóticas y están causadas por
virus originarios de mamíferos silvestres (Olival y
col., 2017). Las zoonosis víricas son una grave amenaza para la salud pública y
la seguridad mundial, y han causado la
mayoría de las pandemias recientes, como lo fue la de COVID-19 (Jori y col., 2021).
La rabia paralítica bovina (RPB) es una de las enfermedades
zoonóticas con mayor impacto sobre los herbívoros domésticos, con una mortalidad de alrededor de 100 000 individuos por año y que provoca pérdidas económicas anuales de
97 millones de dólares en América Latina (Benavides y col., 2020). Es causada
por el virus de la rabia, y fue descrita por primera vez en el continente
americano a mediados del siglo XX. Los murciélagos conocidos como vampiros
comunes (Desmodus rotundus)
son de gran importancia en la transmisión a otras especies (Acha y col., 1968;
Batalla-Campero y Flores- Crespo, 1998).
Actualmente, están descritas más de 1 400 especies de murciélagos en el mundo, de las cuales
únicamente tres tienen hábitos hematófagos (Burgin y
col., 2018; Simmons y Cirranello, 2022). En México,
existen cerca de 140 especies de este grupo de mamíferos, incluyendo las
tres especies hematófagas (Sil-Berra y
col., 2022): Diaemus youngi
(murciélago vampiro de alas blancas)
y Diphylla ecaudata
(murciélago de patas peludas)
presentan hábitos alimenticios
especializados, consumiendo preferencialmente sangre fresca de aves (Scheffer
y col., 2015), y el vampiro común D. rotundus,
la única con una participación importante en la epidemiología del virus de la
rabia, ya que su fuente primaria de alimento es la sangre de mamíferos.
En Latinoamérica, D. rotundus
es el principal reservorio y transmisor del virus rábico que afecta al ganado y
al ser humano (Brown y Escobar, 2023). Habita en zonas tropicales y
subtropicales del continente, por la vertiente del Pacífico desde el sur de
Sonora; y por el lado del Golfo de México, desde el noreste de Tamaulipas y
Nuevo León; hacia el sur, llega hasta el sur
de Chile, norte de Argentina y Uruguay. También se puede encontrar en las islas
Margarita y Trinidad y Tobago. Dentro de los factores ambientales que
influyen en la distribución de D. rotundus y
el riesgo de rabia a gran escala espacial se incluyen la temperatura, la altitud y la precipitación (Botto-Nuñez y
col., 2020). Actualmente, existe la preocupación de que el cambio climático facilite la llegada de esta especie al sur de Estados Unidos de América
(EUA) (Bodenchuk y Bergman, 2020).
La presencia de D. rotundus,
su capacidad como reservorio del virus rábico (RVR), así como sus hábitos
alimenticios, son los principales factores de riesgo para que la rabia sea
transmitida en las especies ganaderas y el ser humano (Meza y col., 2022; Viana
y col., 2023). En México, del 2000 al 2022 se han reportado 50 casos de rabia
humana, de los cuales 44 (88 %) fueron transmitidos por animales silvestres (quirópteros y zorrillos principalmente)
y solo cuatro (8 %) por perro y dos por gato (4 %) (Aréchiga-Ceballos y col.,
2022).
En el estado de Tamaulipas se distribuyen, de manera natural,
57 especies de murciélagos (Arriaga-Flores, 2010), entre las cuales están
presentes las tres especies hematófagas D. youngi,
D. ecaudata y D. rotundus,
este último, considerado el principal RVR que
afecta a las especies ganaderas. La ganadería es una de las actividades
económicas más importantes en el estado y se caracteriza por la crianza de ganado bovino, de acuerdo con el Sistema
de Información Agroalimentaria y Pesquera (SIAP-SIACON, 2023).
En Tamaulipas, la actividad ganadera enfocada a la crianza de
ganado bovino se desarrolla en 28 municipios principalmente y, en el año 2021, contaba con una población total
de 1 210 055 cabezas de ganado bovino provenientes de 17 924 unidades de producción (SIAP-SIACON, 2023). Los municipios que
destacan por su producción de carne de bovino son: Jiménez, Soto La Marina,
Aldama, González, Ciudad Victoria y Altamira. El ganado ovino también
representa una fuente de ingresos en Tamaulipas, con San Fernando, Méndez, Reynosa, Hidalgo, Ciudad Victoria, Villagrán
y Burgos, como los principales municipios productores. Además, existe un gran
potencial para la crianza de especies
zootécnicas en la zona semiárida y árida del estado, especialmente el
ganado caprino, que se adapta bien a las condiciones de vegetación y clima en
la región del altiplano y el valle de San Fernando. En el 2022, Tamaulipas
obtuvo una producción de 46 166 T de carne de
bovino, 1 464 T de carne de ovino y 1 525 T carne de caprino (Gobierno
del Estado de Tamaulipas, 2023).
El primer registro de rabia en bovinos en Tamaulipas confirmado por laboratorio fue en 1994, como consecuencia de un brote que
se produjo en un rancho ganadero cercano a la
localidad de Aldama, situada a unos 340
km al sur de la frontera de Texas, EUA., y a 10 km del Golfo de México.
Los signos clínicos en el ganado afectado consistían en fiebre, fotofobia,
ptialismo, incoordinación, seguida de
postración, parálisis y pérdida de sensibilidad
cutánea. El diagnóstico se realizó por
histopatología e inmunofluorescencia directa (IFD) (la prueba estándar de oro).
Los resultados del estudio de laboratorio confirmaron que la especie
transmisora fue el murciélago vampiro, mediante la caracterización a través de
un panel de anticuerpos monoclonales, identificando una variante del virus rábico, por el Instituto Nacional de
Investigaciones Forestales, Agrícolas y Pecuarias (INIFAP) y Texas Department of Health
en Austin, Texas, EUA (Martínez-Burnes
y col., 1997).
Dado que la rabia no se había presentado en la zona en los
últimos 25 años (desde 1994), no se practicaba la vacunación, a pesar de que
los murciélagos vampiro eran comunes en la región (Batalla-Campero y Flores Crespo, 1998). A partir del primer brote de rabia bovina se declaró la
circulación del virus rábico en las
poblaciones de murciélagos hematófagos
en Tamaulipas, la cual se ha registrado desde el sur del estado hacia la parte
centro, norte y noreste de Tamaulipas (Martínez-Burnes
y col., 1997).
Al ser la RPB una enfermedad de reporte obligatorio en el
estado de Tamaulipas, le corresponde tomar acciones al Comité Para el Fomento y Protección Pecuaria de Tamaulipas A. C.
(CFPPT), organismo auxiliar de la Secretaría de Agricultura y Desarrollo Rural
(SADER) y del Servicio Nacional de
Sanidad, Inocuidad y Calidad
Agroalimentaria (SENASICA). El CFPPT, opera la “Campaña Nacional para la
Prevención y control de la rabia en bovinos
y especies ganaderas”, de acuerdo a la NOM-067-ZOO-2007 (2007), realizando dos actividades
sustantivas; la vacunación del ganado y atención de casos, así como los
operativos para el control del tamaño de población de D. rotundus,
mediante las capturas realizadas por personal capacitado. Las capturas pueden ser programadas o asociadas a un caso
sospechoso de rabia; se realizan en refugio y en corral, utilizando redes de
niebla. Los murciélagos hematófagos capturados son identificados e impregnados
con un ungüento vampiricida, para después ser
liberados, con el objetivo de controlar el tamaño de la población; lo cual
sucede cuando el organismo liberado contamina con el ungüento a otros
especímenes por contacto, quienes a su vez lo
ingerirán mediante acciones de limpieza de su cuerpo, lo que causa la
muerte en un lapso de 3 a 5 días debido al
efecto anticoagulante. Esta técnica se realiza desde la década de los años 70 en México (Flores-Crespo, 1998).
De acuerdo con la base de datos generada por el sistema de información sobre biodiversidad GBIF.org (2021) (GBIF, por sus siglas en inglés: Global Biodiversity Information Facility), en Tamaulipas, los registros de D. rotundus en el periodo de 1949 a 2007 fueron de 445 individuos, distribuidos en los municipios
de Gómez Farías, Antiguo Morelos, Ciudad Victoria, Jaumave, Llera de
Canales, Mante, Soto la Marina, González,
Padilla, Matamoros, San
Nicolás y San Carlos. Sus informes indican la presencia de D. rotundus en el estado antes de que se originaran los
primeros brotes de rabia en el ganado transmitidos por esta especie.
En el año 2016, en el municipio de Soto La Marina (Ejido 8 de
mayo), Tamaulipas, México, se registró el único caso de rabia humana
transmitido por vampiro. La agresión la sufrió un hombre de 39 años, en la
rodilla derecha, el día 5 de septiembre, y tras padecer un cuadro clínico
complicado y recibir tratamiento antirrábico (vacuna e inmunoglobulina
antirrábica humana) cuando ya había comenzado el cuadro clínico, el paciente
falleció el día 19 de octubre. El Laboratorio Estatal de Salud Pública del
Estado de Tamaulipas (LESP) reportó
resultado positivo de muestra encefálica el 21 de octubre por IFD, y el
Laboratorio de Rabia del Instituto de Diagnóstico y Referencia Epidemiológica (InDRE) caracterizó el caso con la variante antigénica 11
(AgV11, por sus siglas en inglés: antigenic variants), cuyo reservorio es el murciélago vampiro D. rotundus (SSA, 2020; SIRVERA, 2024).
El objetivo del presente estudio fue describir y analizar la
historia de la progresión de la rabia paralítica bovina, la distribución de su
principal reservorio (D. rotundus) en el
estado de Tamaulipas, así como de algunos
factores ambientales que favorecen
la presencia de esta especie y la transmisión de la enfermedad.
MATERIALES Y MÉTODOS
Área de estudio
De acuerdo con el Instituto Nacional de Estadística,
Geografía e Informática (INEGI, 2023), Tamaulipas tiene un territorio de 80 175 km2.
Se divide en 43 municipios, con una población de 3 527 735 habitantes. Está
situado en la región noreste de México; al norte de la llanura costera del
golfo y en la Sierra Madre Oriental, entre las coordenadas 24°17’14” N y
98°33’48” W; colinda por el norte con el Río Bravo que lo separa de los EUA.;
por el este con el Golfo de México (océano
Atlántico); por el oeste con Nuevo León; al sur con Veracruz; y suroeste
con San Luis Potosí.
El 58 % del estado presenta clima cálido subhúmedo, el 38 %
clima seco y semi-seco en el centro, el norte y hacia el suroeste del estado; el 2 % es templado subhúmedo en la
región suroeste, y el 2 % presenta clima cálido húmedo localizado hacia el
suroeste. La temperatura media anual es
alrededor de 23.5 °C, la temperatura máxima promedio de 22 °C y se
registra en los meses de junio a agosto. La temperatura mínima promedio es de
10 °C y se presenta en el mes de enero. La precipitación media estatal es de 780
mm anuales, las lluvias se registran en
verano en los meses de junio a septiembre (INEGI, 2023).
Análisis eco-epidemiológicos
Los registros de
presencia de D. rotundus se obtuvieron a
través del GBIF, SENASICA y de registros generados en los operativos realizados
por el CFPPT para la prevención y control de
la rabia, y el murciélago hematófago, de acuerdo a
la NOM-067-ZOO-2007 (2007), “Campaña Nacional
para la Prevención y control de la rabia en bovinos y especies
ganaderas”. Posteriormente, los reportes de avistamientos georreferenciados
fueron filtrados siguiendo a Cobos y col. (2019), eliminando duplicados,
posibles errores de identificación o incertidumbre en las coordenadas, implementando un umbral espacial (spatial thin)
de 5 km.
Con la base de datos del Laboratorio de Rabia del InDRE y la generada en este estudio, se relacionaron los
casos positivos a rabia en bovinos que fueron agredidos por D. rotundus, y se seleccionaron aquellos que contaran con datos de la localidad, y que se les haya determinado
la AgV. La caracterización antigénica es una técnica
de inmunofluorescencia indirecta que emplea un panel de anticuerpos
monoclonales y se aplica en muestras de interés epidemiológico, para determinar
la especie reservorio más probable en cada brote (Smith, 1989; Smith y col.,
1992).
Análisis de datos
Mediante estadística descriptiva, generando gráficas, se
analizó la distribución de los casos de rabia en bovinos en Tamaulipas en dos
periodos, de 1999 a 2010 y 2011 a 2020; y de
la distribución de los registros de presencia de D. rotundus en el estado de 1987 a 2019.
En Tamaulipas se han descrito siete ecorregiones, que son
unidades geográficas con flora, fauna y ecosistemas característicos (Olson y
col., 2001): matorral de la meseta central, manglares mesoamericanos del golfo
y el Caribe, bosque de pino y encino de la Sierra
Madre Oriental, matorral tamaulipeco, mezquital tamaulipeco, bosque húmedo
veracruzano y pastizales costeros del golfo occidental; pero debe considerarse que, en todas ellas es probable que
exista un cambio en el uso de suelo para
desarrollo de actividades antropogénicas. En el presente estudio, se
realizó una descripción de sus características
ecológicas y geográficas relacionadas con la presencia de D. rotundus y los casos
de RPB en Tamaulipas.
Se utilizó, además, un Sistema de Información Geográfica (SIG) y se realizó una unión espacial
de la base de datos de los registros de D. rotundus
y los casos de RPB generados en este
estudio, con los de la capa de la VI carta del uso de suelo y vegetación
de Tamaulipas (INEGI, 2016) y las ecorregiones terrestres de Olson y col.
(2001). Esto permitió observar la ubicación geográfica de los registros de D.
rotundus y los casos de RPB, asociada a las
características ambientales (ecorregiones y tipo de vegetación), a partir del
método divisible de K medias generalizado para estimar el número de categorías
y las observaciones que lo conforman.
Mediante el análisis de correlación índice de marginalidad
media (OMI, por sus siglas en inglés:
Outlying Mean Indexes), se compararon las condiciones ambientales promedio utilizadas para cada variable, con
respecto a las condiciones promedio de cada sitio de evaluación (Dolédec y col., 2000). El OMI generó un nuevo sistema de
referencia (eje), el cual refleja las condiciones ambientales de las
observaciones que permite analizar las K medias y establecer su correlación.
Finalmente, se asociaron la abundancia de los casos de RPB y la presencia de D.
rotundus en cada uno de los sitios de
observación, con las características ambientales mediante un análisis de
correspondencia simple (AC) (Picard y col. 2012; Vargas-Vázquez
y col., 2019). Se realizó una prueba de
significancia estadística X2 independiente para cada
variable ambiental.
RESULTADOS
Distribución y evolución de la RPB en
Tamaulipas
En el periodo 1999 a 2020, de acuerdo
con los datos reportados por el CFPPT y SENASICA, se presentaron 579
casos de RPB en el estado (Figura 1), lo que
representa una tasa de infección del 0.05 % para el periodo estudiado,
más alta que la tasa de infección a nivel nacional,
la cual, se considera del orden del 0.04 % (Thrusfield,
2005).
El InDRE logró tipificar las
variantes antigénicas de 535 muestras de bovinos positivos a rabia, enviadas
para su análisis en el periodo de 1999 a 2020 (44 muestras no tuvieron las
condiciones para realizar la caracterización). Se establecieron 8 casos de
infección con la variante AgV3 y 522 AgV11, ambas asociadas con D. rotundus como el reservorio natural (Figura 1). En el
mismo periodo, el CFPPT reportó la existencia de 45 casos de rabia en otras
especies ganaderas (sin reporte de la variante antigénica): 38 casos en equinos (6 %), 4 casos en ovinos (0.6 %) y 3 en
caprinos (0.4 %), representando tasas de contagio muy bajas, en comparación con
los casos que se presentaron en ganado
bovino (93 %).
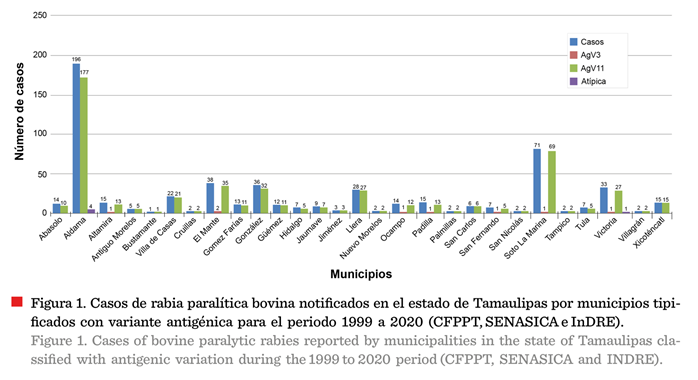
Los casos de RPB se distribuyeron en 28
municipios, con una variación en su incidencia, ya que durante el periodo 1999
a 2010 se registraron 375 casos, en tanto que, de 2011 a 2020 se presentaron
solo 204 casos, indicando una disminución del 64.7 %, con un efecto de
decremento de casos en 7 municipios (Figura 2).
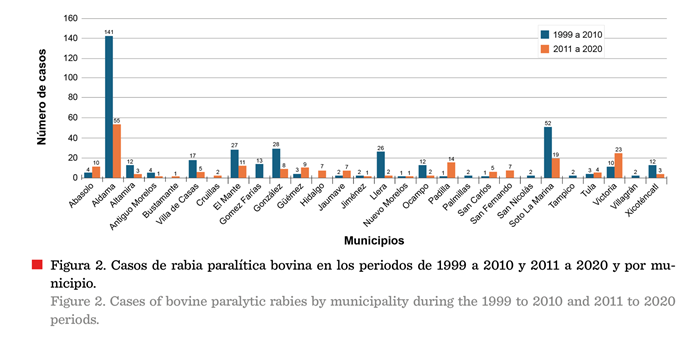
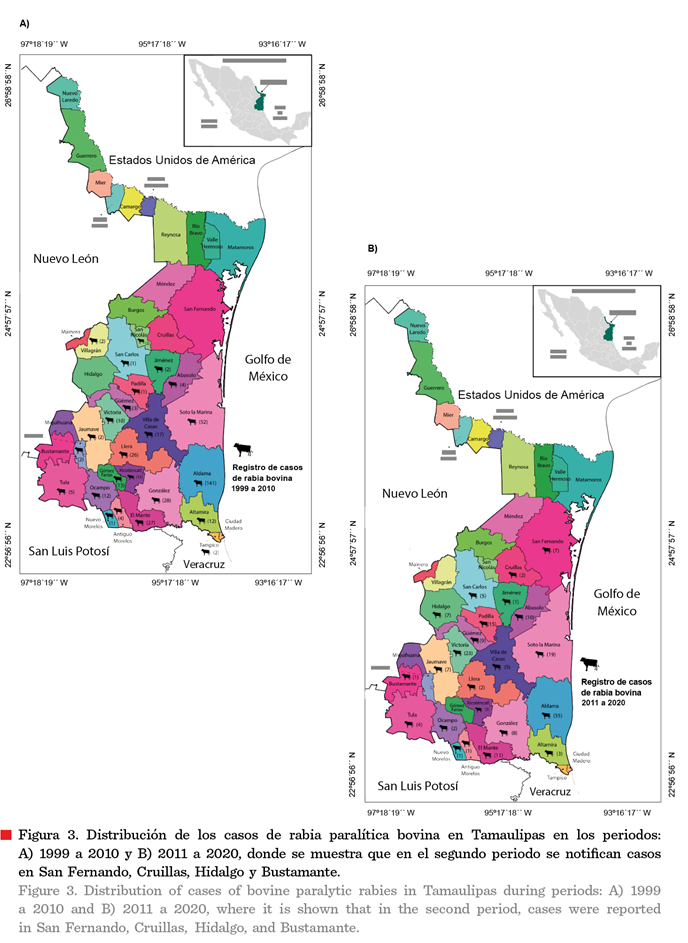
La distribución de los casos también mostró afectación, con
una marcada tendencia a expandirse, durante el segundo periodo, hacia
municipios del norte del estado como Hidalgo, Cruillas y San Fernando,
sugiriendo con ello, una migración del reservorio de la infección; también hubo
un caso en el municipio de Bustamante, ubicado en el sur y que estuvo
libre de casos en el primer periodo (Figuras
2 y 3).
Asociación de la distribución de D. rotundus con los casos de RPB
Se cuenta con 409 registros confirmados y
georreferenciados adecuadamente de la presencia de D. rotundus, distribuidos
en 32 municipios, para el periodo de
1987 a 2019 (GBIF: 7; CFPPT: 183; y SENASICA: 219) (Figura 4) y 579 casos de RPB en el periodo 1999
a 2020, distribuidos en 28 municipios (CFPPT
y SENASICA).
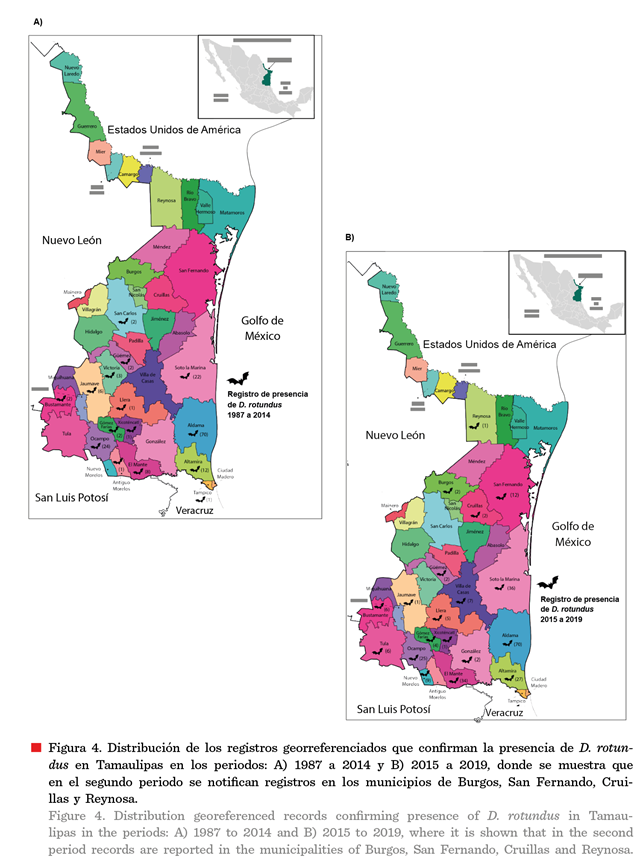
En el mismo periodo, los operativos realizados por el CFPPT,
como parte de las acciones de la Campaña para el control de las poblaciones de D.
rotundus, permitieron registrar la presencia de D.
rotundus en los municipios de Ciudad Madero,
Méndez y Valle Hermoso, pero no fueron
georreferenciados por lo que no se incluyeron en este trabajo. Es
importante destacar que no existen reportes de RPB en esas 3 localidades.
Durante el periodo estudiado (1987 a 2019), el 73.23 % (424)
del total de los casos de RPB, se registró en los municipios de Aldama (196), Soto La Marina (71), Mante (38), González (36), Victoria
(33), Llera (28) y Villa de Casas (22) (Figuras 1 y 3). Localidades
asociadas con una alta presencia del
murciélago vampiro (Figura 4).
Incidencia de RPB y D. rotundus en función de ecorregiones
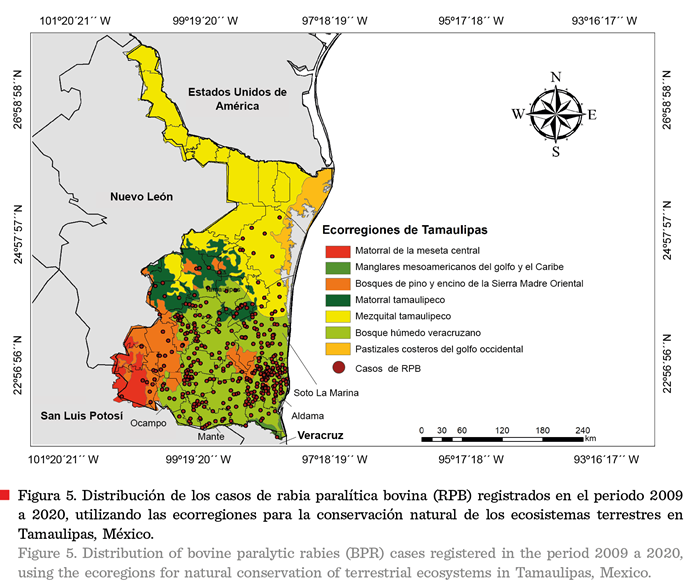
En la ecorregión del bosque húmedo veracruzano, ubicada hacia
el sur del estado, se concentran los municipios con el mayor número de casos de RPB y presencia de D. rotundus (Aldama, Soto La Marina y Mante)
(Figuras 5 y 6). Esta ecorregión se caracteriza por contar con selva baja
caducifolia, bosque de encino, zonas
agrícolas y pastizales cultivados. En ella se localizan también tres de
los 4 municipios que forman parte de la reserva de la Biosfera “El Cielo”,
Ocampo, Llera y Gómez Farías. En este último, en el ejido San José, se ha
reportado por foto trampeo a D. rotundus
alimentándose principalmente de bovinos y otros animales domésticos, como
equinos, que han sido introducidos por los humanos que habitan dentro de la
reserva, arriesgando su salud; pero también se ha observado que se alimentan de algunas especies silvestres, por
ejemplo el temazate o venado cabrito (Mazama temama) (Figura 7), lo que sucede frecuentemente cuando
la cantidad de ganado es menor o inexistente en su área de forrajeo (Benavides
y col., 2020; Scheffer y col., 2022; Brown y Escobar, 2023).
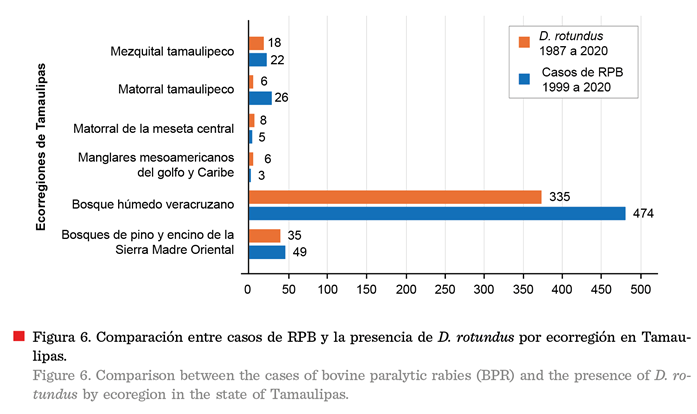

La segunda ecorregión con mayor incidencia de casos de RPB y
presencia del vampiro común fue la de los bosques de pino y encino de la Sierra
Madre Oriental (Figura 6), caracterizados por vegetación de sierras templadas
con elevaciones aisladas.
La tercera ecorregión de mayor incidencia en la presencia del
RVR fue el mezquital tamaulipeco, pero fue la cuarta en cuanto a casos de RPB, los cuales comenzaron a presentarse a
partir del segundo periodo (2011 a 2020). En el caso del municipio de San
Fernando, los casos de RPB iniciaron en 2011, pero los registros georreferenciados de D. rotundus,
en esta ecorregión, de acuerdo con los datos analizados, comenzaron a partir de 2015. Al respecto, es importante
considerar que, algunos de los casos podrían deberse a la movilidad del ganado,
previamente infectado, por la comercialización de los animales.
La cuarta ecorregión que tuvo más casos de RPB fue el
matorral tamaulipeco, que abarca los
municipios de Cruillas, Hidalgo, San Carlos, San Nicolás y Villagrán, por mencionar algunos; pero en ella se registró baja
presencia del vampiro común.
Algunas ecorregiones parecieran tener características que las
hacen menos probables a la presencia del RVR
o de la enfermedad (Figura 5). La ecorregión de pastizales costeros del
golfo occidental fue la única que no presentó
registros de RPB, ni tampoco avistamientos o capturas de D. rotundus. En tanto
que, la ecorregión del mezquital tamaulipeco no presentó incidencia de
RPB en su parte norte. En este ecosistema, la
vegetación nativa corresponde a selva baja caducifolia y selva baja
espinosa, bosques de encino mixtos, así como grandes planicies hacia el noreste
y norte del estado con vegetación xerófila.
Sin embargo, parte de esta vegetación ha sido gradualmente desplazada
por efecto de actividades antropogénicas, como
la agricultura y la ganadería, transformándose en suelos agrícolas y
pastizales cultivados, que constituyen gran
parte del territorio (INEGI, 2023), actividades que suelen asociarse a
la presencia del reservorio, pero que en estas latitudes aún no ha sido el
caso.
Asociación del tipo de vegetación y
ecorregión con la presencia de RPB y D. rotundus
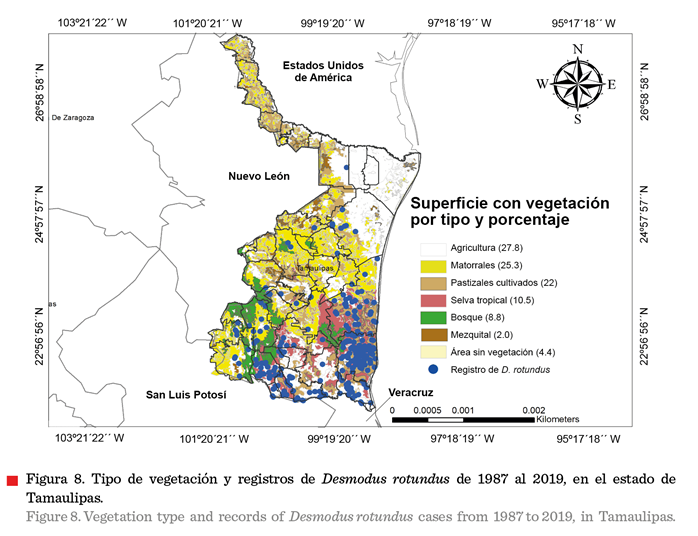
Los 32 municipios en los que se registró
la presencia de D. rotundus se caracterizaron
por contar con vegetación tipo pastizales cultivados (117), áreas agrícolas
(105) y selva tropical (95) (Figuras 8 y 9). El mayor número de registros de
esta especie se observó en el sur del estado.
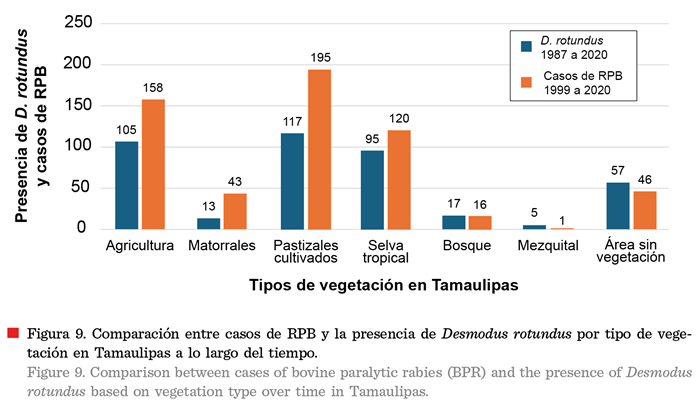
En cuanto al tipo de vegetación fueron las áreas de
pastizales cultivados (195), agricultura
(158) y selva tropical (120) en las que ocurrieron la mayoría de los casos de
RPB (Figura 9).
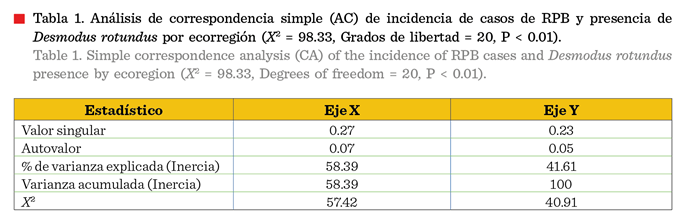
El índice de marginalidad media y
análisis de correspondencia simple (Tabla 1) indicó que la presencia de casos
de RPB estuvo significativamente asociada (Prueba de X2; P
< 0.01) con las ecorregiones terrestres, categorizadas por la Comisión Nacional para el Conocimiento
y Uso de la Biodiversidad (CONABIO) (INEGI, 2016) como selvas cálido-secas.
Estas se caracterizan por contar con selva baja caducifolia (bosque húmedo
veracruzano), localizadas en el sur del
estado, sierras templadas con elevaciones aisladas (bosques de pino y encino de la Sierra Madre Oriental); mientras
que en los plegamientos del Altiplano Zacatecano-Potosino con vegetación
xerófila (matorral de la meseta central) y bosques de encino mixtos, así como grandes planicies hacia el noreste y
norte del estado con vegetación xerófila
(mezquital tamaulipeco), se reportó una reducida o nula presencia de casos. El eje X (número de casos de RPB y presencia
del RVR) explica el 58.39 % de los cambios y el eje Y valor de tipo de
vegetación por ecorregión) explica el 41.61 %.
El índice de marginalidad media y análisis de correspondencia
simple (Tabla 2) indicó que la presencia de casos de rabia estuvo significativamente asociada (Prueba de X2;
P < 0.01) con el tipo de vegetación categorizada por la CONABIO (INEGI, 2016) y la presencia del
reservorio. El eje X (Dimensión 1: número de casos de RPB y presencia del RVR)
explica el 68.83 % de los cambios y el eje Y (Dimensión 2: tipo de vegetación)
explica el 31.17 %. En los desiertos micrófilos existe escasa
o nula presencia del reservorio y en consecuencia ausencia de casos de
RPB. Las selvas, matorrales y bosques están
asociados con los casos positivos de RPB, pero no tan fuerte como los
ambientes que están más cerca de D. rotundus como
las zonas agrícolas y los pastizales cultivados.

El análisis gráfico de correspondencia simple (Figura 10)
indica que los desiertos micrófilos (matorral
desértico rosetófilo y micrófilo), selva media
subcaducifolia y mezquital xerófilo se
asocian con la ausencia de casos de RPB
y se diferencian claramente del resto de las categorías. Esto sugiere
que, en los desiertos hay una menor presencia del D. rotundus, por lo tanto, menos casos positivos.
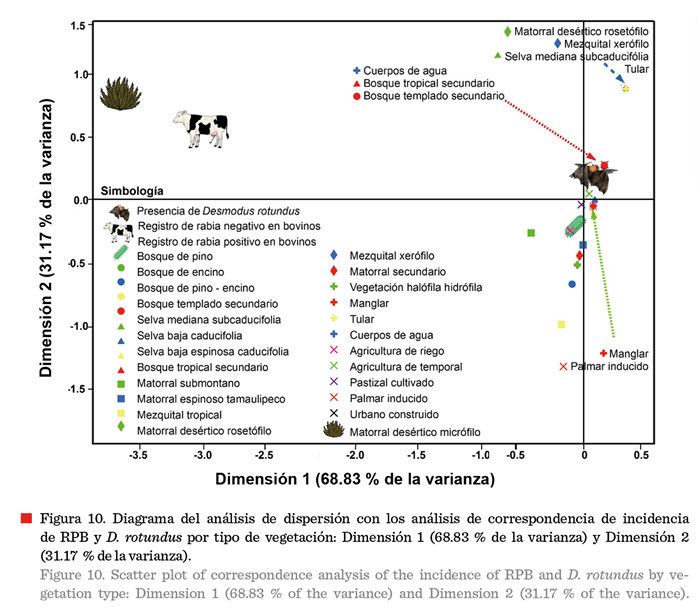
Los casos positivos de RPB estuvieron muy cerca de la
presencia del RVR, indicando una fuerte relación entre la presencia del reservorio y la ocurrencia de la enfermedad. Esto es coherente con el conocimiento de que
D. rotundus es el principal RVR (Brown y
Escobar, 2023).
Los bosques tropicales, selvas mediana subcaducifólea, matorrales secundarios, matorral espinoso
tamaulipeco y el mezquital tropical están asociados con la presencia de D. rotundus y con los casos positivos a rabia. Esto podría
deberse a que estos ambientes proporcionan un hábitat favorable para el RVR
(Benavides y col., 2020).
Los ambientes antropizados se
sitúan entre la presencia del RVR y los casos positivos de RPB como las zonas
agrícolas de temporal y riego, pastizales cultivados y palmar inducido,
sugiriendo que la actividad humana puede estar mediando la relación entre el
RVR y RPB, debido a la ganadería y la posible movilización del ganado.
DISCUSIÓN
En el periodo 1999 a 2020 se presentaron 579
casos de RPB en Tamaulipas, distribuidos en 28 de los 43 municipios del estado.
Burgos, ubicado al norte, en la ecorregión
del mezquital tamaulipeco, fue el único de los 28 municipios considerados
productores de ganado en el estado (SIAP-SIACON, 2023) que no registró casos de RPB (Figuras 2 y 3),
aunque sí la existencia del vampiro común (Figura 4). En contraste, Tampico, en la parte sur, sin actividad
económica relevante en la producción de ganado (SIAP-SIACON, 2023),
presentó 2 casos de RPB (Figuras 2 y 3) y la presencia del vampiro común
(Figura 4). Los casos de rabia en ovinos y caprinos se reportaron en menor
proporción que los casos en bovinos, lo que puede deberse a las preferencias de
alimentación del murciélago vampiro por el ganado de mayor tamaño como son los bovinos (Mialhe,
2014; Benavides y col., 2020; Scheffer y col., 2022).
Desde el primer reporte de casos de rabia
en especies ganaderas, en 1994, en la zona sur de Tamaulipas, se implementaron
medidas epizootiológicas con el objetivo de evitar los casos de RPB, como la
vacunación y el control de las poblaciones del RVR en las áreas donde se
hubiese documentado la presencia del vampiro D. rotondus,
por la CFPPT (NOM-067-ZOO-2007). Los resultados de este estudio muestran que a pesar de las acciones realizadas, no se ha generado
alguna evidencia de que éstas reduzcan los casos de rabia en el ganado (Figuras
2 y 3). Aspecto que sugiere la necesidad de un abordaje más profundo respecto a las estrategias y
medidas de prevención y control de la RPB, ya que históricamente los esfuerzos
prolongados para controlar las poblaciones
de D. rotundus
no han demostrado ser efectivos para erradicar la RPB.
La eliminación selectiva de individuos adultos podría
facilitar la propagación de la rabia al aumentar la dispersión de murciélagos
para ocupar nichos vacíos (Blackwood y col., 2013),
propiciando la dispersión, no solo de las poblaciones de D. rotundus, sino también del virus rábico. En un estudio
realizado en Perú, en el que se compararon las seroprevalencias entre colonias
de D. rotundus con diferentes estrategias de
control, los autores demostraron que los programas de capturas y eliminación no
tuvieron un efecto positivo sobre la disminución de los casos de rabia, debido a que las seroprevalencias del virus
rábico se mantuvieron entre 3 % y 28 % en las poblaciones, siendo mayores en
murciélagos juveniles y subadultos (Streicker y col., 2012).
En el presente estudio, el número de casos disminuyó en el
segundo periodo analizado en Tamaulipas (2011
a 2020), pero es evidente que se registraron casos positivos en
municipios como Cruillas y San Fernando, donde se reportó también la presencia
de D. rotundus en el segundo periodo estudiado
(2015 a 2019). Esto indica la importancia de realizar más estudios para poder
explicar la variabilidad de los casos de rabia en el estado de Tamaulipas,
considerando otras variables como la seroprevalencia del virus en el RVR y el
esfuerzo de las medidas epizoóticas para la prevención y control de la rabia.
La vacunación del ganado en las zonas de riesgo representa
una estrategia a considerar para disminuir la prevalencia de rabia en las
especies ganaderas. Esta medida reduciría el costo que ocasiona la enfermedad
por la alta tasa de mortalidad (100 %) de los
animales enfermos (Rocha y Dias, 2020). No obstante,
su implementación requiere de la
concientización y el esfuerzo coordinado de las organizaciones y agencias
gubernamentales encargadas en el estado de la prevención y control de la
rabia, así como de los ganaderos para seguir
incrementando la cobertura de vacunación en las áreas endémicas a RPB (Johnson y col., 2018; Rojas-Sereno y
col., 2022).
La investigación socioeconómica que aborde el costo/beneficio y las barreras que están
asociadas a la vacunación, deben ser una prioridad
para la salud humana y animal. Abordar el problema de la rabia en las
especies ganaderas y en la fauna silvestre desde el concepto de “Una Salud” significaría un cambio para proponer
nuevas alternativas en las estrategias de
vacunación de reactivas a preventivas (Maldonado-Arias y col., 2024). El
abordaje de la rabia desde “Una Salud” requiere retomar las consideraciones que
Louis Pasteur desde 1885 hacía sobre esta enfermedad, señalando que la única manera de evitar que los humanos se
contagiaran era controlando la enfermedad en
el reservorio a través de la vacunación. En ese tiempo, únicamente los
cánidos eran reconocidos como la principal fuente de transmisión a los humanos
(SSA, 2023). En la actualidad, México ha logrado de manera exitosa controlar la
rabia humana transmitida por perros (que tienen al vampiro común como uno de
sus principales vectores de contagio), mediante
la vacunación de estas mascotas (Calderón y col., 2014).
En el caso de los vampiros comunes, considerados los principales transmisores de la rabia
al ganado, y desde el enfoque de “Una Salud”, las intervenciones que se
hagan deben encaminarse al control de la
rabia en esta especie reservorio, más
que a la eliminación de sus poblaciones, generando estrategias que
permitan su vacunación (Natesan y col., 2023). Diversos estudios han abordado este enfoque
(Aguilar-Setién y col., 1998; 2002; Almeida y col., 2005; 2008;
Cárdenas-Canales y col., 2022) con
resultados prometedores, de manera que se protege a las especies silvestres
y también se evita que éstas infecten a los humanos y a los animales
domésticos. Un pequeño cambio en las
estrategias de control podría representar una transformación en el
panorama epidemiológico en los países que cuentan con distribución natural del
murciélago D. rotundus.
Los casos positivos de RPB y la presencia de D. rotundus parecieron asociarse con ecorregiones que
ofrecen condiciones favorables para la presencia del RVR y la enfermedad, y que
son aquellas con vegetación más rica y diversa, como es el bosque húmedo
veracruzano, selva mediana caducifolia y lomeríos y sierras con matorral
xerófilo y bosques de encino, como es el caso de la Sierra de Maratines (en Aldama). También están presentes lomeríos y
planicies con selva baja caducifolia (Sierra de Cucharas en los límites de
Gómez Farías, Ciudad Mante y Ocampo) y elevaciones aisladas y plegamientos del
Altiplano Zacatecano-Potosino (Mante, Antiguo Morelos y Ocampo) con vegetación
xerófila, bosques de coníferas, de encino y mixtos (CONABIO,
2021).
Los casos positivos a rabia y la presencia del RVR tendieron
a ocurrir en regiones con ambientes antropizados, que
han sufrido cambios considerables en el uso
de suelo y la vegetación por la agricultura y la ganadería, como en los
municipios de Aldama, Altamira y Soto la Marina (INEGI, 2023) (Figuras 5 y 8). Estos entornos parecen jugar un papel
importante en la dinámica del mantenimiento de la enfermedad, lo que sugiere
que los esfuerzos de control deben centrarse en ellas y en las áreas cercanas
para prevenir su propagación.
Los casos negativos de RPB estuvieron asociados con Planicies
del Altiplano Zacatecano-Potosino, lo que sugiere que estas áreas tienen
características que las hacen menos propensas para que ocurran casos de RPB
(por ejemplo, la presencia de matorrales desérticos micrófilos),
lo que podría deberse al tipo de vegetación y la escasa actividad ganadera (Figura
8). En estas áreas hay una menor necesidad de
enfocar esfuerzos de control del RVR, pero se debe mantener un programa
de vigilancia epidemiológica pasiva para la enfermedad.
La probabilidad de que D. rotundus ocupe nuevos nichos en Tamaulipas dependerá de diversos factores
asociados entre sí, como pueden ser, ecogeográficos, ecológicos, comportamiento de la
especie, genéticos, los asociados a las actividades humanas como es la
agricultura y la ganadería, y los efectos de cambio climático (Ortega-Sánchez y
col., 2022; Van-de-Vuurst y col., 2023). Esto puede
observarse en la forma en cómo la distribución de D. rotundus
se ha incrementado hacia el norte y noreste del estado, en la ecorregión
denominada mezquital tamaulipeco, asociado a los registros de casos positivos a
RPB (Figuras 3 y 5), lo que coincide con la investigación de Viana y col.
(2023). En el municipio de San Fernando, en el año 2015, los operativos
realizados por el CFPPT permitieron detectar la presencia de D. rotundus, asociados a casos de RPB. En Reynosa se
localizó su presencia en 2016, aunque aún no hay reportes oficiales de RPB en
el municipio.
Existe un temor de que el cambio climático y el cambio de uso
de suelo en esta ecorregión, para desarrollar actividades de agricultura y
ganadería, favorezcan que el murciélago vampiro
pueda extender su distribución hacia EUA, particularmente al estado de
fronterizo de Texas, ya que las ecorregiones del noreste de México denominadas pastizales costeros del golfo occidental
(en donde no existen aún reportes de RPB ni
de D. rotundus) y mezquital tamaulipeco
(en la que ya hay reportes de ambos), se extienden hacia el sur de Texas, por lo que ofrecen un hábitat contiguo con
una geología y una estructura de vegetación similares (Piaggio y col., 2017),
lo que introduciría en ese país un nuevo vector de casos de rabia (Van-de-Vuurst y col., 2023), de acuerdo con en el modelo de distribución para esta especie de Hayes
y Piaggio (2018).
Van-de-Vuurst y col. (2023)
consideran que D. rotundus se ha expandido
hacia el norte de México a un ritmo promedio de 9.76 km por año y su
desplazamiento podría obedecer a una modificación en la estacionalidad
histórica de la temperatura (es decir, la desviación estándar), variable estrechamente relacionada con los cambios en el
clima y el calentamiento global. En el presente estudio, fue posible establecer que, en Tamaulipas, D.
rotundus muestra estar cambiando su distribución
hacia el norte, infectando de rabia al ganado bovino en regiones donde no había
presencia de la enfermedad (Figuras 3 y 5). Por lo tanto, es importante
mantener acciones de vigilancia epidemiológica para detectar si circula el
virus en las poblaciones ubicadas en los municipios del norte y noreste del
estado, donde actualmente se ha registrado la presencia de D. rotundus, pero no se han registrado casos de rabia.
La posibilidad de una migración hacia al norte ha sido
sugerida por la evidencia en el registro
fósil (alrededor de 5 000 a 35 000 años antes del presente), que sugiere
que especies extintas del género Desmodus
ocupaban algunas áreas de lo que ahora es EUA, desde el norte de California
(Pleistoceno tardío, y son conocidos del área de Big Bend en el oeste de
Texas), de la actual región del archipiélago de Mandrean
de Nuevo México (estimada entre 29 000 y 36 000 años antes del presente); de
Cuba (< 10 000 años antes del presente) y de varios sitios en Florida
(Green-hall y col., 1983; Ray y col., 1998). Sin embargo, no se tiene
información si las condiciones climáticas eran similares o si esas especies
contaban con una fisiología semejante para
adaptarse a los mismos climas.
En los últimos 5 años, posteriores al periodo abarcado en
este estudio, se han registrado 28 nuevos casos de rabia en bovinos, 5 en
equinos y 2 en murciélago hematófago en los municipios de Güemes y Abasolo
(SIRVERA, 2024), indicando que la rabia en especies ganaderas es un problema
que persiste en Tamaulipas. Esto vuelve necesario mantener estudios de la
tendencia de distribución tanto de D. rotundus
como de la RPB, con interés particular en las densidades poblacionales de la especie
en las localidades donde se realizan las capturas y su asociación con los
censos de la población de bovinos. Lo último no fue posible realizarlo en el
presente estudio, debido a que no se cuenta con una capa en la escala espacial
que permitiera desarrollarlo.
CONCLUSIONES
La RPB se encontró presente en 28 de los 43 municipios de
Tamaulipas, mientras que el principal transmisor de rabia en el estado, D. rotundus, se distribuyó en 32. La tendencia de D. rotundus de avanzar hacia el norte del estado,
reflejada en el segundo periodo de estudio, y los brotes de casos de RPB en esa
latitud, abren la posibilidad de que la especie extienda su distribución hacia
Texas, Estados Unidos de América, país actualmente considerado libre de la
presencia de la especie, debido a que sus características geográficas y
ecológicas son similares a las de Tamaulipas.
Entre las variables analizadas, las
características de las ecorregiones, el cambio de uso de suelo y la
vegetación, influyeron en la distribución de D. rotundus.
A su vez, esas mismas variables, más la presencia de D. rotundus
permitieron explicar, al menos parcialmente, la variabilidad de la distribución
de los casos de casos de RPB. El cambio en la distribución del vector y de los
casos de RPB indican la necesidad de seguir estudiando este fenómeno, pero se
debe considerar también como variable la densidad ganadera, ya que las regiones
centro y sur se caracterizan por contar con mayor actividad ganadera en
Tamaulipas, mayor incidencia de D. rotundus y
alta prevalencia de rabia en ganado; por lo que, los análisis posteriores que
incluyan estas variables contribuirán a mejorar los modelos predictivos de distribución
de la especie reservorio y los brotes de RBP.
Agradecimientos
Programa de mejoramiento del Profesorado (PRODEP) de la
Secretaría de Educación Pública del Gobierno Federal, por la Beca otorgada para la realización del doctorado en Ecología
y Manejo de Recursos Naturales del M. en C. José Ignacio Olave Leyva. A la M.
en C. Araceli Casar Solares, del Laboratorio Estatal de Salud Pública (LESP) de
Tamaulipas; y a la directora del Instituto de Diagnóstico y Referencia
Epidemiológica (InDRE), la Biól.
Irma López Martínez, así como al personal adscrito al Laboratorio de Rabia. Al
M. V. Z. Alejandro Jiménez Ramírez, excoordinador de rabia bovina en México,
por los datos aportados para el presente estudio; al Dr. Víctor Abraham Vargas
Vázquez, por sus aportaciones en la revisión del artículo. Al Comité Para el
Fomento y Protección Pecuaria de Tamaulipas, A. C. (CFPPT) y al M. V. Z. Pedro
Zúñiga Pasine, por su colaboración y acceso a la
información.
Declaración de conflicto de intereses
Los autores declararon no tener
conflictos de intereses de ningún tipo.
REFERENCIAS
Acha, P, Acevedo-Whitehouse, K., de-la-Cueva, H., Gulland, F. M.
D., Aurioles-Gamboa, D., Arellano-Carbajal, F. y
Suarez-Güemes, F. (1968). Epidemiología de la rabia bovina paralítica
transmitida por los quirópteros. Boletín de la Oficina Sanitaria
Panamericana, 64, 411–430.
Aguilar-Setién, A., Brochier, B.,
Tordo, N., De-Paz, O., Desmettre, P., Péharpré, D. y Pastoret, P. P.
(1998). Experimental rabies infection and
oral vaccination in vampire bats (Desmodus rotundus). Vaccine,
16(11-12), 1122–1126. https://doi.org/10.1016/s0264-410x(98)80108-4
Aguilar-Setién
A, Campos, Y. L, Cruz, E. T., Kretschmer, R, Brochier,
B, & Pastoret, P. P. (2002). Vaccination of
vampire bats using recombinant vaccinia-rabies
virus. Journal of Wildlife Diseases, 38(3), 539–44.
Almeida, M. F, Martorelli, L. F. A.,
Aires, C. C., Sallum, P. C., & Massad, E. (2005).
Indirect oral immunization of captive vampires, Desmodus
rotundus.
Virus Res, 111(1), 77–82. https://doi.org/10.1016/j.virusres.2005.03.013
Almeida, M. F, Martorelli, L. F.
A., Aires, C. C., Barros, R. F., & Massad, E. (2008). Vaccinating the vampire bat Desmodus
rotundus against rabies. Virus Research,
137(2), 275-277. https://doi.org/10.1016/j.virusres.2008.07.024
Aréchiga-Ceballos, N., Puebla-Rodríguez P., &
Aguilar-Setién, Á. (2022). The New Face of
Human Rabies in Mexico, What’s Next After Eradicating Rabies in Dogs. Vector-Borne and Zoonotic Diseases,
22, 69–75. https://doi.org/10.1089/vbz.2021.0051
Arriaga-Flores,
J. C. (2010). Estudio preliminar
sobre la quiropterofauna del cañón de “La Peregrina”,
municipio de Victoria, Tamaulipas, México. TecnoIntelecto,
1–8.
Batalla-Campero, D. y Flores-Crespo, R. (1998). La rabia en
las diferentes especies, sus transmisores y su control. Rabia Paralítica Bovina (pp.
41-49) INIFAP-SAGAR. Secretaría de
Educación Pública. ISBN 970-92109-0-4.
Benavides, J. A, Valderrama, W., Recuenco,
S., Uieda, W, Suzán, G.,
Ávila-Flores, R., Velasco-Villa, A., Almeida, M., Andrade-Fag,
D., Molina-Flores, B, Vigilato,
M., Pompei, J. C. A., Tizzani,
P, Carrera, J. E., Ibanez, D., & Streicker, D. G. (2020). Defining New Pathways to Manage the Ongoing Emergence of Bat Rabies in
Latin America. Viruses, 12, 1002. https://doi.org/10.3390/v12091002
Blackwood, J. C., Streicker,
D. G., Altizer, S., & Rohani, P. (2013). Resolving the roles of immunity,
pathogenesis, and immigration for rabies persistence in vampire bats. Proceedings
of the National Academy of Sciences, 110, 20837–20842. https://doi.org/10.1073/pnas.1308817110
Bodenchuk, M. J. &
Bergman, D. L. (2020). Vampire Bats: Preparing for range expansion into the U.S.
Proceedings of the Vertebrate Pest Conference, 29, 1–9
Botto-Nuñez, G., Becker, D. J.,
Lawrence, R. L., & Plowright, R. K. (2020). Synergistic Effects of
Grassland Fragmentation and Temperature on Bovine Rabies Emergence. Eco
Health, 17(2), 203–216. https://doi.org/10.1007/s10393-020-01486-9
Brown, N. & Escobar, L. E. (2023). A review of the diet of the common vampire bat (Desmodus rotundus)
in the context of anthropogenic change. Mammalian Biology, 103(4),
433–453. https://doi.org/10.1007/s42991-023-00358-3
Burgin, C. J., Colella, J. P., Kahn,
P. L., & Upham, N. S. (2018). How many species of mammals are there? Journal
of Mammalogy 99, 1–14. https://doi.org/10.1093/jmammal/gyx147
Calderón-Rangel, A., Rodríguez-Rodríguez, V. C., &
Guzmán-Terán, C. A. (2014). Análisis filogenético del virus de la rabia en
mamíferos reportados en Colombia entre 1994 y 2008. Ciencia y Agricultura,
11(2), 69-75.
Cárdenas-Canales, E. M., Velasco-Villa, A., Ellison, J. A., Satheshkumar, P. S., Osorio J. E., & Rocke, T. E. (2022). A recombinant rabies vaccine that prevents viral shedding in rabid common vampire
bats (Desmodus rotundus). PLOS
Neglected Tropical Diseases,
16(8), e0010699.
Cobos, M. E., Peterson, A. T., Barve,
N., & Osorio-Olvera, L. (2019). kuenm: an R package for detailed development of ecological
niche models using Maxent. PeerJ, 7, e6281.
Dolédec, S, Chessel, D., & Gimaret-Carpentier, C. (2000). Niche separation in
community analysis: A new method. Ecology, 81, 2914–2927.
FloreFlores-Crespo, R. (1998). Biología
y control de murciélagos vampiros. En R. Flores-Crespo (Ed.), La rabia en
las diferentes especies, sus transmisores y su control (1a ed., 80-99 pp.).
INIFAP-SAGAR.
Gobierno del Estado de Tamaulipas (2023). Secretaría de
Desarrollo Rural Pesca y Acuacultura, en Temas del sector Ganadería. [En
línea]. Disponible en:
https://www.tamaulipas.gob.mx/desarrollorural/temas-del-sector/ganaderia/.
Fecha de consulta: 11 de septiembre de 2023.
GBIF.org (2021). Base de datos de observaciones de Desmodus rotundus
en su área natural de Distribución. [En línea]. Disponible en:
https://doi.org/10.15468/dl.sb3eg6. Fecha de consulta: 28 de octubre de 2021.
Greenhall, B. A. M., Joermann, G, &
Schmidt, U. (1983). Desmodus Rotundus. The
American Society of Mammalogists, (202), 1-6.
Hayes, M. A. & Piaggio, A. J. (2018). Assessing the potential impacts of a changing climate
on the distribution of a rabies virus vector. Plos One 13, e0192887.
INEGI, Instituto Nacional de Estadística y Geografía (2016).
Uso del suelo y vegetación, escala 1:250000, (2017) serie VI (continuo
nacional). [En línea]. Disponible en:
http://www.conabio.gob.mx/informacion/gis/?vns=gis_root/usv/inegi/usv250s6gw.
Fecha de consulta: 10 de septiembre de 2021.
INEGI, Instituto Nacional de Estadística y Geografía (2023).
Información por entidad: Tamaulipas. [En línea]. Disponible en:
https://cuentame.inegi.org.mx/monografias/informacion/tam/default.aspx?tema=me&e=28
Fecha de consulta: 11 de noviembre de 2023.
Johnson, N. & Montaño-Hirose,
J. A. (2018). The impact of paralytic bovine rabies
transmitted by vampire bats in Latin America and the
Caribbean. Revue Scientifique et Technique
(International Office of Epizootics), 37(2), 451-459.
Jori, F., Hernandez-Jover, M., Magouras, I., Dürr, S., & Brookes, V. J. (2021)
Wildlife–livestock interactions in animal production systems: what are the
biosecurity and health implications? Animal Frontiers, 11, 8–19. https://doi.org/10.1093/af/vfab045
Maldonado-Arias, D. F., Guamán-Rivera, S. A., Mira-Naranjo,
J. M., & Ortiz-Naveda, N. R. (2024). Bovine rabies cases in Ecuador: a
retrospective crosssectional observational study (2007 to 2020). Brazilian
Journal of Biology, 84, 1–10. https://doi.org/10.1590/1519-6984.279112
Martínez-Burnes, J., Lopez, A.,
Medellín, J., Haines, D., Loza, E., & Martínez, M. (1997). An outbreak of
vampire bat-transmitted rabies in cattle in northeastern Mexico. Canadian
Veterinary Journal, 38, 175–177.
Meza, D. K., Mollentze, N., Broos, A., Tello, C., Valderrama, W., Recuenco,
S., Carrera, J. E., Shiva, C., Falcon, N., Viana, M., & Streicker,
D. G. (2022). Ecological determinants of rabies
virus dynamics in vampire bats and spillover
to livestock. Proceedings of the Royal Society B: Biological
Sciences, 289, 20220860. https://doi.org/10.1098/rspb.2022.0860
Mialhe, P. J. (2014). Preferential prey
selection by Desmodus rotundus
(E. Geoffroy, 1810, Chiroptera, Phyllostomidae)
feeding on domestic herbivores in the municipality of São Pedro – SP. Brazilian
Journal of Biology, 74(3), 579–584. https://doi.org/10.1590/bjb.2014.0086
Natesan, K., Isloor,
S., Vinayagamurthy, B., Ramakrishnaiah,
S., Doddamane, R., & Fooks, A. R. (2023).
Developments in Rabies Vaccines: The Path Traversed from Pasteur to the Modern
Era of Immunization. Vaccines. 11(4), 756. https://doi.org/10.3390/vaccines11040756
NOM-067-ZOO-2007 (2007). Campaña nacional para la prevención
y control de la rabia en bovinos y especies ganaderas, en Norma Oficial
Mexicana. [En línea]. Disponible en:
https://dof.gob.mx/nota_detalle.php?codigo=5190251&fecha=20/05/2011#gsc.tab=0.
Fecha de consulta: 11 de agosto de 2024.
Olival, K. J., Hosseini, P. R., Zambrana-Torrelio, C., Ross, N., Bogich,
T. L., & Daszak, P. (2017). Erratum: Host and
viral traits predict zoonotic spillover from mammals. Nature, 548(7669),
612.
Olson, D. M., Dinerstein, E.,
Wikramanayake, E. D., Burgess, N. D., Powell, G. V. N., Underwood, E. C.,
Amico, J. A., Itoua, I., Strand, H. E., Morrison, J.
C., Loucks, C. J., Allnutt, T. F., Ricketts, T. H., Kura, Y., Lamoreux, J. F.,
Wettengel, W. W., Hedao, P., & Kassem, K. R. (2001). Terrestrial ecoregions of the
world: A new map of life on Earth. Bio Science, 51, 933–938.
Ortega-Sánchez, R., Bárcenas-Reyes, I., Cantó-Alarcón, G. J.,
Luna-Cozar, J., Rojas-Anaya, E.,
Contreras-Magallanes, Y. G., González-Ruiz, S., Cortez-García, B., &
Milián-Suazo, F. (2022). Descriptive and
Time-Series Analysis of Rabies in Different Animal Species in Mexico. Frontiers in Veterinary Science, 9, 1–10. https://doi.org/10.3389/fvets.2022.800735
Piaggio, A. J., Russell, A. L.,
Osorio, I. A., Jiménez Ramírez, A., Fischer, J. W., Neuwald, J. L., Tibbels, A.
E., Lecuona, L., & McCracken, G. F. (2017). Genetic demography at the
leading edge of the distribution of a rabies virus vector. Ecology and
Evolution, 7, 5343–5351. https://doi.org/10.1002/ece3.3087
Picard, N., Köhler, P., Mortier, F.,
& Gourlet-Fleury, S. (2012). A comparison of five
classifications of species into functional groups in tropical forests of French
Guiana. Ecological Complexity, 11, 75-83. https://doi.org/10.1016/j.ecocom.2012.03.003
Ray, C. E., Linares, O. J., &
Morgan, G. S. (1998). Paleontology. In Natural History of Vampire Bats.
CRC Press, 19–30 Pp.
Rocha, F. & Dias, R. A. (2020).
The common vampire bat Desmodus rotundus
(Chiroptera: Phyllostomidae)
and the transmission of the rabies virus to livestock: A contact network
approach and recommendations for surveillance and control. Preventive
Veterinary Medicine, 174, 104809. https://doi.org/10.1016/j.prevetmed.2019.104809
Rojas-Sereno, Z. E., Streicker, D. G., Medina-Rodríguez,
A. T., & Benavides, J. A. (2022). Drivers of Spatial
Expansions of Vampire Bat Rabies in Colombia.
Viruses, 14(11), 2318. https://doi.org/10.3390/v14112318
SSA, Secretaría de Salud (2020). Programa de acción
especifico de prevención y control de enfermedades zoonóticas y emergentes
2020-2024. Centro Nacional de Enfermedades Infecciosas. https://www.gob.mx/cms/uploads/attachment/file/738300/PAE_Zoonosis.pdf
SSA, Secretaría de Salud (2023). Secretaría de Salud difunde
aviso epidemiológico sobre rabia humana. [En
línea]. Disponible en: https://www.gob.mx/salud/prensa/017-secretaria-de-salud-difunde-aviso-epidemiologico-sobre-rabia-humana?idiom=es
Fecha de consulta: 7 de octubre de 2024.
Scheffer, K. C., Barros, R. F., Iamamoto.,
K., Mori, E., Asano, K. M, Achkar, S. M., Estevez-García, A. I., Oliveira-Lima, J. Y., & Fahl, W. O. (2015). Diphylla ecaudata y Diaemus youngi: Biología y comportamiento. Acta Zoológica
Mexicana, 31(3), 436-445.
Scheffer, K. C., Barros, R. F., Iamamoto, K., Mori, E., Asano, K.
M., Lima, J. Y. O., Garcia, A. I. E., Cunha-Neto, R.
S, & Fahl, W. O. (2022). Desmodus
rotundus – biología y comportamiento. In Open Science Research
III. Editora Científica Digital. 505-529 Pp.
SIAP, Servicio de Información
Agroalimentaria y Pesquera / SIACON, Servicio de Información Agroalimentaria de
Consulta (2023). Estadística de Producción Agrícola. [En línea]. Disponible en:
http://infosiap.siap.gob.mx/gobmx/datosAbiertos.php. Fecha de consulta: 11 de
noviembre de 2023.
Sil-Berra, L. M., Aguilar-López, M.,
Márquez-Medero, M. A. y Cervantes-Cruz, J. M. (2022). De México para el mundo… los murciélagos endémicos. Therya Ixmana, 1(1), 29-31.
Simmons, N. B., Cirranello,
A. L., Bat, H, Bat, G. S., Gray, C., & Bot, M. Z. (2022). Bats of the
World. American Museum of Natural History, 1–94.
SIRVERA, Sistema de Información Regional Para la Vigilancia
Epidemiológica de la Rabia (2024). [En línea]. Disponible en: https://sirvera.panaftosa.org.br/. Fecha de
consulta: 4 de septiembre de 2024.
Smith J. S. (1989) Rabies Virus Epitopic Variation: Use in Ecologic Studies. 215–253 Pp.
Smith J. S., Orciari,
L. A., Yager, P. A., Seidel, H. D., & Warner, C. K. (1992). Epidemiologic and Historical Relationships among 87 Rabies
Virus Isolates as Determined by Limited Sequence Analysis. Journal of
Infectious Diseases, 166: 296–307. https://doi.org/10.1093/infdis/166.2.296
Streicker, D. G., Recuenco, S., Valderrama, W., Gomez-Benavides, J., Vargas,
I., Pacheco, V., Condori-Condori, R. E., Montgomery, J., Rupprecht, C. E.,
Rohani, P., & Altizer, S. (2012). Ecological and anthropogenic drivers of
rabies exposure in vampire bats: implications for
transmission and control. Proceedings of the Royal Society B: Biological
Sciences, 279, 3384–3392. https://doi.org/10.1098/rspb.2012.0538
Thrusfield, M. (2005).
Veterinary epidemiology Veterinary, Clinical Studies Royal (Dick) School of
Veterinary Studies, Chapter 4. Describing disease occurrence (pp. 46-56).
University of Edinburgh. Publisher Blackwell Science Ltd.
Van-de-Vuurst,
P., Qiao, H., Soler-Tovar D, & Escobar, L. E. (2023). Climate change linked to vampire bat expansion and rabies virus spillover. Ecography,
1–10. https://doi.org/10.1111/ecog.06714
Vargas-Vázquez, V. A., Venegas-Barrera, C. S., Mora-Olivo,
A., Martínez-Ávalos, J. G., Alanís-Rodríguez, E. y De-la-Rosa-Manzano,
E. (2019). Variación en la abundancia de árboles maderables por efecto de borde
en un bosque tropical subcaducifolio. Botanical Sciences. 97, 35–49. https://doi.org/10.17129/botsci.2019
Viana, M., Benavides, J. A., Broos,
A., Ibañez-Loayza, D., Niño, R., Bone,
J., da-Silva-Filipe, A., Orton, R., Valderrama-Bazan,
W., Matthiopoulos, J., & Streicker,
D. G. (2023). Effects of culling vampire bats on
the spatial spread and spillover of rabies virus. Science Advances, 9(10), eadd7437.