https://doi.org/10.29059/cienciauat.v19i2.1933
Extracto de Randia monantha encapsulado con proteína de haba (Vicia
faba): actividad antifúngica in vitro y caracterización
fisicoquímica
Randia
monantha extract encapsulated with faba bean (Vicia faba) protein: in
vitro antifungal activity and physicochemical characterization
Extracto encapsulado
con proteína de haba
Claudia Marcela Guillén-Jiménez, Montserrat
Calderón-Santoyo, Katia Nayely González-Gutiérrez, Juan Arturo Ragazzo-Sánchez*
*Correspondencia:
jragazzo@tepic.tecnm.mx/ Fecha de recepción: 20 de septiembre de 2024/Fecha de
aceptación: 24 de enero de 2025/Fecha de publicación: 31 de enero de 2025.
Tecnológico Nacional
de México, Instituto Tecnológico de Tepic, Laboratorio Integral de Investigación
en Alimentos, Av. Tecnológico núm. 2595, Lagos del Country, Tepic, Nayarit,
México, C. P. 63175.
Resumen
Las proteínas
vegetales han sido empleadas en diversos estudios como material de pared en la
encapsulación de compuestos de alto valor biológico, debido a su buena
accesibilidad y a la fácil liberación del principio activo. El haba (Vicia faba)
es una legumbre con alto contenido de proteínas susceptible de ser
utilizada como material encapsulante. Randia
monantha contiene compuestos con actividad
antifúngica, por lo que su extracción y encapsulación representa una
alternativa para poder usarlos en el control post-cosecha de hongos
fitopatógenos. El objetivo del presente trabajo fue encapsular por secado por
aspersión un extracto etanólico de R. monantha utilizando como material de pared proteína de
haba para el control de Colletotrichum gloeosporioides. El extracto se obtuvo mediante
extracción etanólica asistida por ultrasonido y se
encapsuló usando secado por aspersión con diferentes
concentraciones de proteína de haba (15 %, 20 %, 25 % y 30 %).
Posteriormente, se evaluó la actividad antifúngica del extracto encapsulado y
se realizó la caracterización térmica y fisicoquímica de las cápsulas. El
extracto encapsulado con proteína al 30 % presentó la mayor inhibición de la
germinación de esporas (65.4 %) y del crecimiento micelial de C. gloeosporioides (55.23 %) y estabilidad a la temperatura y a la radiación UV. Las cápsulas
registraron alta eficiencia de encapsulación y solubilidad, con baja actividad de agua e higroscopicidad, características deseables
para un producto en polvo. La proteína de haba, como material encapsulante,
mostró ser una alternativa prometedora para su uso en el control de C. gloeosporioides, ya que preservó la capacidad antifúngica del extracto de R. monantha,
presentó propiedades fotoprotectoras y termoprotectoras y las cápsulas cumplieron con los parámetros fisicoquímicos de un producto en polvo.
Palabras
clave: proteína vegetal, secado por aspersión, encapsulación, capacidad inhibitoria.
Abstract
Vegetable proteins have been used in various studies
as wall material in the encapsulation of high biological value compounds, due
to their good accessibility and the easy release of the active substance. Haba
(Vicia faba) is a legume with a high protein content that can be used as
an encapsulating material. Randia monantha contains compounds with antifungal activity, therefore their extraction and encapsulation represent an alternative for use in the
postharvest control of phytopathogenic fungi. The objective of the present work
was to encapsulate by spray drying an ethanolic extract of R. monantha using faba bean protein as a wall material for
the control of Colletotrichum gloeosporioides.
The extract was obtained through ultrasound-assisted ethanolic extraction and
was encapsulated by spray drying
with different concentrations of
faba bean protein (15 %, 20 %, 25 %, and 30 %). Subsequently, the antifungal activity of the encapsulated extract was evaluated, and the thermal and physicochemical characterization of the capsules was performed. The 30 % protein-encapsulated extract showed the highest inhibition of spore germination (65.4
%) and mycelial growth of C. gloeosporioides
(55.23 %) and stability to
temperature and UV radiation. The capsules
registered high encapsulation efficiency and solubility, with low water activity and hygroscopicity, desirable characteristics for a powder product. Faba bean protein, as an encapsulating material, proved to be a promising alternative for use in the control of C. gloeosporioides
since it preserved the antifungal capacity of
the R. monantha extract, presented photoprotective
and thermoprotective properties and the capsules
achieved the physicochemical parameters of a powder product.
Keywords: vegetable protein, spray drying, encapsulation, inhibitory capacity.

INTRODUCCIÓN
La
accesibilidad de las proteínas derivadas de los productos vegetales las ha
hecho cada vez más populares para su aprovechamiento. Entre sus aplicaciones se
encuentra la sustitución de la proteína animal, en la elaboración de piensos
(alimento para ganado) y como materiales de pared para la encapsulación de
compuestos de alto valor biológico (CAVB), aunado a que se consideran
biodegradables y con propiedades foto y termo protectoras (Ismail y col., 2020;
Kumar y col. 2022).
Las
proteínas como material de pared crean una coraza que actúa como agente
estabilizante en la encapsulación y ayuda a proteger el núcleo. Entre las
ventajas de utilizar proteínas vegetales destaca que son consideradas GRAS (por
sus siglas en inglés: generally recognized
as safe), de fácil accesibilidad, sostenibles y
respetuosas con el medio ambiente (Dissanayake y Bandara, 2024). Entre las proteínas que se han utilizado
como material de pared para encapsular CAVB, están las de lenteja (Wang y col.,
2022), maíz (zeína), quinoa y el aislado de soya (Mahdi-Jafari
y col., 2017). Sin embargo, existen proteínas que aún no han sido investigadas,
tal es el caso de la proteína de haba (Vicia faba).
El
haba es una de las legumbres más producidas a nivel mundial, ocupa una cuota
anual de mercado de aproximadamente 4.84
millones de T de acuerdo a la Organización de las Naciones Unidas para
la Alimentación y la Agricultura
(FAO, por sus siglas en inglés: Food and Agriculture
Organization of the United Nations) (FAO, 2021). Las habas
se caracterizan por su composición de minerales, carbohidratos, fibra, lípidos,
pero sobre todo destaca por su alta composición de proteínas (Rodiño y col., 2005; Karkanis y col.,
2018). Existen diversos reportes del contenido de proteína de haba. Schumacher
y col. (2011) indicaron un rango de 18 % a 29 % y Hacisalihoglu
y col. (2020) documentaron dicho contenido en un rango de 12.6 % a 33.1 %. Su
fracción proteica mayoritaria la representan las globulinas (42 %
aproximadamente), constituidas por las fracciones legúmina, vicilina y convicilina
(Duodu y Apea-Bah, 2017), mismas que se
consideran proteínas de reserva y se encuentran en los cuerpos proteicos. Otras
proteínas de reserva presentes son las albúminas (20 %), caracterizadas por
tener un elevado número de aminoácidos
azufrados. Las glutelinas constituyen el 15 % y en menor proporción se encuentran
las prolaminas con un 5 % (Duodu y Apea-Bah, 2017).
Este alto contenido de proteínas la hace apta para la encapsulación, debido a
que le confiere capacidad de formar una
estructura tridimensional, con adecuada estabilidad, tamaño y forma (Warsame y col., 2020; Żmudziński
y col., 2021).
Existen
diversas tecnologías para la encapsulación, como los procesos electrohidrodinámicos electrospraying
(electropulverización) y electrospinning
(electrohilado) (Alehosseini
y col., 2018), la coacervación, extrusión,
emulsificación y secado por aspersión (Yan y col., 2022). Esta última se
considera una de las más usadas a nivel industrial y destaca por su
factibilidad, capacidad para obtener mayor rendimiento en tiempos más cortos de
proceso, producción de partículas uniformes, mejorar la conservación del
producto al evitar la descomposición de componentes sensibles al calor y
posibilidad de ser escalada y operada como un proceso continuo y cerrado (Chamudeshwari y col., 2024).
El
secado por aspersión transforma una solución polimérica en polvo mediante una
corriente de aire caliente. Durante este proceso, el equipo, a través del uso
de un atomizador, dispersa la solución en
microgotas que se ponen en contacto con el aire caliente en la cámara de
secado, deshidratándolo. Posteriormente, el producto seco se recolecta en el
ciclón. Las cápsulas obtenidas pueden tener diversos
usos, ya sea para aplicación en el área de la industria de los alimentos
o en usos nutracéuticos (Fatnassi y col., 2013).
Actualmente,
las prácticas agrícolas para el control de hongos en las frutas utilizan, por
lo general, fungicidas sintéticos elaborados a base de sustancias químicas
(Mariscal-Amaro y col., 2020), que causan problemas de toxicidad tanto en los
seres humanos como en el medio ambiente. Debido a esto, se han desarrollado estrategias alternativas conocidas como biofungicidas
o agentes naturales con actividad antifúngica, los cuales están elaborados a
partir de productos o subproductos naturales. Existen productos vegetales
subutilizados, que son una fuente importante de CAVB, tales como flavonoides, saponinas y fenoles, entre otros, que presentan actividad antifúngica (Gatto y col., 2011; Ojeda-Ayala y col., 2022). Estos
compuestos bioactivos podrían ser encapsulados mediante secado por aspersión y
las cápsulas podrían ser utilizadas para el
control de las enfermedades fúngicas que presentan los frutos.
Estudios
recientes han demostrado que los CAVB identificados en el extracto etanólico de R. monantha
inhiben hongos fitopatógenos, tales como Collectotrichum
gloeosporioides y Penicillium
digitatum, agentes causales de la antracnosis y
moho verde, respectivamente (Vilchis-Gómez y col., 2024). R. monantha es conocida comúnmente como “crucetillo” en localidades que van desde el sur de México
hasta Panamá. Su fruto contiene una pulpa oscura, con presencia de compuestos
fenólicos con actividad antioxidante, que incluyen el ácido clorogénico (81.11
mg/g de extracto), quercetina (1.61 mg/g de extracto), rutina (51.61 mg/g de
extracto), ácido 4-cumárico (30.29 mg/g de extracto) y ácido cafeico (21.95
mg/g de extracto) (Méndez-Ventura y Hernández-Medel, 2009; Juárez-Trujillo y
col., 2018). Se ha reportado que, de forma
individual, estos compuestos presentan actividad antifúngica sobre las
membranas celulares de los hongos, debido a
su capacidad para interactuar con los lípidos y proteínas de la
membrana, así como para reducir el pH extracelular e inhibir a la 1.6-b- y
1.3-b-glucano sintetasa (Simonetti y col., 2020; Oulahal
y Degraeve, 2022).
La
escasa información sobre la posible aplicación de la proteína de haba como
material encapsulante abre una oportunidad y perspectiva novedosa para explorar su potencial en la encapsulación de extractos vegetales como R.
monantha para ser destinado al control de hongos fitopatógenos. Además, la utilización de la
proteína de haba como material encapsulante podría ofrecer una alternativa más
sostenible y económica en comparación con otros materiales de encapsulación sintéticos. Este enfoque también
contribuye a la búsqueda de soluciones innovadoras para el control biológico de enfermedades fúngicas, alineándose
con las tendencias actuales de utilizar recursos
naturales y sostenibles en la agricultura (Pandit y col., 2022).
El
objetivo del presente trabajo fue encapsular mediante secado por aspersión un
extracto etanólico de R. monantha,
empleando como material de pared las proteínas de haba, así como caracterizar
las propiedades fisicoquímicas y térmicas de
las cápsulas y determinar el efecto inhibitorio del extracto encapsulado
sobre el hongo C. gloeosporioides.
MATERIALES Y MÉTODOS
Material
vegetal
El
fruto de R. monantha fue obtenido de un huerto
en La Vigueta, Tecolutla, Veracruz, México (20°20’11’’ N y 96°52’50’’ W). Los
frutos fueron lavados con agua corriente y secados a 50 °C en un horno de convección (Novatech, HS60-AID, Jalisco,
México) durante 25 h. La proteína de haba fue obtenida de Quebec, Canadá, de la empresa AGT Food
and Ingredients.
Obtención
del extracto de R. monantha
Para
obtener el extracto, se empleó la metodología
propuesta por Vilchis-Gómez y col. (2024). Los frutos, previamente
deshidratados, se pulverizaron en un molino eléctrico (Gutstark,
2000 G, Ciudad de México, México) y el polvo
obtenido se tamizó con una malla No. 100 (ASTM: 100; 150 mm.
Posteriormente, para extraer los CAVB se mezcló el polvo del fruto con disolvente etanólico
al 80 % en una proporción 1:30 (p/v).
Después, para mejorar la extracción,
se empleó ultrasonido (Branson Ultrasonics Corporation, 150D, Connecticut, EE. UU.) con una
amplitud del 60 % durante 7.5 min. Finalmente, se filtró con un papel filtro
Whatman No. 1 (diámetro 150 mm) (Sigma-Aldrich, St. Louis, MO, EE. UU) y el extracto se concentró en un rotavapor (IKA, RV10, Flawil, Suiza) a 50 °C con una presión de vacío de 90 kPa.
Encapsulación
del extracto de R. monantha mediante secado
por aspersión
Determinación
de la temperatura de entrada al secador
Para
determinar la temperatura de secado se empleó la calorimetría diferencial de
barrido (DSC, por sus siglas en inglés: Differential Scanning
Calorimetry) (TA-Instruments, DSC 250, New Castle, EE.
UU). Se colocaron 4 mg de proteína de haba en una charola de aluminio hermética.
Se utilizó una charola de aluminio vacía como referencia. Se programó una rampa
de calentamiento de 10 °C/min y el análisis se llevó a cabo de 25 °C hasta 400
°C/min, bajo atmósfera de nitrógeno y un
caudal de 40 mL/min. La temperatura de transición vítrea (Tg) se determinó
calculando el punto medio de la región de transición en la señal del
flujo de calor. Los datos obtenidos se analizaron mediante el software TRIOS,
5.0.0.44616 (Ramos-Hernández y col., 2023).
Preparación
de la solución polimérica
La
proteína de haba se disolvió en agua destilada estéril, en un frasco ámbar, por
30 min a 22 °C a diferentes concentraciones (15 %, 20 %, 25 % y 30 %, p/p).
Después, se le añadió el extracto de R. monantha
al 3 % p/p y se homogeneizó en un agitador magnético (Prendo, PCA-1500, Puebla,
México) por 4 h a 22 °C. La solución se sometió al proceso de secado por
aspersión.
Proceso
de secado por aspersión
La
solución polimérica, previamente preparada, se usó para alimentar un secador
por aspersión Mini Spray Dreyer (Labortechnik, Büchi B-290, Flawil, Suiza). La
solución se atomizó mediante una boquilla (Labortechnik,
Büchi B-290-0.7mm, Flawil,
Suiza) bajo las siguientes condiciones: temperatura del aire de entrada
al secador de 115 °C, flujo de alimentación de la muestra 3 mL/min, caudal de
aire 35 m3/h y presión de aire de 0.5 MPa. La solución polimérica se
mantuvo en agitación constante a 120 rpm y 22 ± 1 °C. Una vez terminado el
proceso, las cápsulas se recolectaron del vaso colector del equipo y se
conservaron en tubos falcón estériles dentro de un desecador para sus posteriores análisis.
Estudio
de fotoprotección de las cápsulas
Se
utilizó una lámpara de 300 W (Osram, Ultra Vitalux, Munich, Alemania) para simular la radiación de la luz
solar. El procedimiento se realizó en una cámara oscura; la distancia entre la
lámpara y la muestra fue de 40 cm. Se expusieron a la luz UV, 2.5 g de extracto
crudo y extracto encapsulado (a las 4 concentraciones de proteína de haba). Se
determinó, en cada muestra, la capacidad de
oxidación relativa del radical de ABTS+, al finalizar cada
tiempo de exposición UV (0 h, 6 h, 12 h, 24 h y 48 h), mediante lectura a 734
nm en un espectrofotómetro (Varian, Cary 50 Bio UV-Visible, Mulgrave, Australia), utilizando ABTS+
previamente preparado y ajustado a un radical de 0.70 con agua destilada. Para cada tiempo de exposición a radiación UV se aplicó un
diseño estadístico unifactorial y la variable de respuesta evaluada fue la
oxidación relativa. El análisis se realizó por triplicado y los resultados se
representaron en una gráfica, de acuerdo con
el porcentaje de oxidación de ABTS+ respecto al tiempo
transcurrido (Calderón-Santoyo y col., 2022).
Análisis
termogravimétrico (TGA) de las cápsulas
Las
variaciones de masa y las temperaturas de descomposición de la proteína de
haba, extracto y extracto encapsulado se determinaron mediante un análisis
termogravimétrico en un equipo TGA (TA Instruments, TGA 550, New Castle, EE.UU.). Se
colocaron 5 mg de muestra en una
charola de platino de alta temperatura. La velocidad de calentamiento
fue de 10 °C/min, en un rango de 25 °C a 800 °C bajo una atmósfera de
nitrógeno. La pérdida de peso y la
temperatura de descomposición (Td) se
analizaron con el software TRIOS, 5.0.0.44616 (TA Instruments Universal Analysis, New Castle, EE. UU.)
(Iñiguez-Moreno y col., 2022).
Eficiencia
de carga
La
eficiencia de carga (EC) se determinó según
los datos obtenidos en el TGA con el software TRIOS 5.0.0.44616, utilizando la ecuación 1.

Eficiencia
de encapsulación
Se
homogeneizaron 5 mg de cápsulas con 1 mL de agua y se agitaron en vortex por 1 min a temperatura ambiente. Posteriormente, la
mezcla se centrifugó (Hermle, Z326K, Wehingen, Alemania) a 10
000 rpm durante 1 min. Después, se separó la fracción soluble
(sobrenadante) y se le determinó la
absorbancia a 210 nm utilizando un espectrofotómetro (Varian, Cary 50
Bio UV-Visible, Mulgrave, Australia). Se consideró el
% EC para calcular la cantidad de fracción cargada (ecuación 2). Una vez
obtenidos los valores, se calculó el % de eficiencia de encapsulación (EE)
según la ecuación 3. Se aplicó un diseño estadístico unifactorial, se consideró
como variable independiente la concentración
de proteína de haba y como variable dependiente la EC y EE.

Donde:
Fracción
en la superficie = cantidad de extracto en la superficie de las cápsulas.
Fracción
cargada = cantidad total de extracto en las cápsulas.
Caracterización
fisicoquímica de las cápsulas
Actividad
de agua
Se
utilizó un equipo Aqualab 4TEV (Decagon
Devices Inc., WA, EE.UU.). Se colocaron 5 g de
muestra dentro de la cámara y la lectura se
realizó a 25 °C. La actividad de agua (Aw) se
determinó mediante el principio del punto de rocío.
Humedad
Se
determinó por el método de TGA. Se colocaron 5 mg del polvo en una charola de
platino de alta temperatura. La velocidad de calentamiento fue de 10 °C/min en
un rango de 25 °C a 800 °C bajo una atmósfera de nitrógeno. Los datos obtenidos
se analizaron con el software TRIOS 5.0.0.44616.
Solubilidad
Se
determinó siguiendo la metodología de Jiménez-Sánchez y col. (2018). Se diluyó
un gramo de polvo en 100 mL de agua destilada, se agitó manualmente hasta
solubilizar toda la muestra y se centrifugó durante 5 min. Se tomó una alícuota
de 25 mL del sobrenadante y se colocó en
cajas Petri. Finalmente, se secó en estufa (Novatech,
HS60-AID, Jalisco, México) a 100 °C durante 5 h. La solubilidad (%) se calculó
por diferencia de peso.
Densidad
aparente
Se
colocó 1 g de cápsulas en una probeta graduada de 10 mL. La probeta se movió
hacia arriba y hacia abajo durante 1 min hasta que se obtuvo una lectura
constante del volumen de polvo. La densidad se calculó con la ecuación 4 y se
expresó en g/mL.

Higroscopicidad
Se
colocó 1 g de cápsulas en cajas Petri a peso constante y se almacenaron en un
desecador de vidrio a una temperatura ambiente de 24 °C y 75 % de humedad
relativa (36 g NaCl en 100 mL de agua). El peso del polvo se registró una vez
al día durante 5 d. La higroscopicidad se determinó con la ecuación 5 y se
expresó en gramos de agua absorbida por 100 g de muestra seca.

Donde
mf = Peso en gramos del polvo al final del proceso
mi
= Peso inicial del polvo (g)
Evaluación antifúngica in vitro del extracto encapsulado
Preparación
del hongo fitopatógeno
C.
gloeosporioides LMA-Mi01 (Número de
acceso: MZ254665) fue aislado del epicarpio del fruto de mango y caracterizado
filogenética y morfológicamente por López-Cruz y col. (2020). El hongo fue crioconservado
en glicerol al 80 % (v/v) a - 80 °C hasta su uso. C. gloeosporioides se cultivó en cajas de Petri con Agar
Papa Dextrosa (APD) (BD Bioxon, Estado de México, México) y se incubó durante 8 d a 28
°C. La suspensión de esporas se preparó a partir de un cultivo de 15 d de
antigüedad, al cual se le añadieron 10 mL de solución NaCl 0.85 % estéril y se
raspó con un asa estéril. El líquido se filtró con una gasa estéril y se
recuperó en un tubo cónico. La concentración de esporas se ajustó a 1 × 105
esporas/mL con un hemocitómetro (LO-Laboroptik Ltd, Lancing, Reino Unido)
(González-Gutiérrez y col., 2023).
Evaluación
antifúngica in vitro
Se
realizó de acuerdo a la metodología propuesta
por González-Gutiérrez y col. (2024). Se disolvieron cápsulas en 10 mL
de agua estéril; la cantidad de cápsulas en cada tratamiento se calculó para obtener la concentración mínima
inhibitoria del extracto (17.65 mg/mL), previamente reportada por Vilchis-Gómez
y col. (2024) para la inhibición de C. gloeosporioides).
Posteriormente, se añadieron 500 mL sobre cajas de Petri con APD previamente
solidificado. La solución se esparció con ayuda de una varilla estéril y las
cajas se dejaron secar por 1 h. Posteriormente, se perforó el centro de cada
una de las cajas (7 mm) y se colocaron 20 mL de suspensión de esporas (1 × 105
esporas/mL) o un tapón de micelio de C. gloeosporioides.
Después, las cajas Petri se sellaron con parafilm y
se incubaron durante 8 d a 28 °C. Para el tratamiento control, solo se inoculó
el patógeno. Se aplicó un diseño estadístico unifactorial para la prueba con
esporas y micelio, en ambos casos. La variable de respuesta evaluada fue el
porcentaje de inhibición in vitro. El experimento se repitió 3 veces con
5 réplicas por tratamiento. La inhibición del crecimiento se calculó con la
ecuación 6.
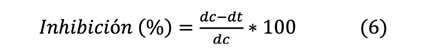
Donde:
dc = diámetro en centímetros de la colonia fúngica en el
control.
dt = diámetro en centímetros de la colonia fúngica en el
tratamiento.
Análisis
estadístico
Los
parámetros fisicoquímicos se analizaron mediante una prueba t para poblaciones
independientes. El resto de los
experimentos se llevaron a cabo mediante análisis de varianza de una vía (ANOVA, por sus siglas en inglés: Analysis of Variance).
Para la comparación de medias (± desviación estándar) se utilizó la
prueba Post-hoc de diferencia mínima significativa (LSD, por sus siglas
en inglés: least significance
difference) de Fisher (P < 0.05). El análisis
estadístico de los datos se realizó con el software
STATISTICA v. 12, StatSoft, Inc.
RESULTADOS Y DISCUSIÓN
Calorimetría
diferencial de barrido
En
el termograma DSC de la proteína de haba (Figura 1)
se puede observar que, la primera disrupción de la línea base se debió a la
temperatura de transición vítrea (Tg) a 127.01 °C,
que indica el cambio del polímero de un estado duro o vítreo a un estado blando
o gomoso (Meng y Zhang, 2014). Posteriormente, se
observaron dos picos endotérmicos, el primero a 149.57 °C, asociado con la evaporación del agua libre y ligada
(Calderón-Santoyo y col., 2022) y el segundo a 174.49 °C, que se atribuye a la
temperatura de fusión (Tm) (Alpizar-Reyes y col.,
2018) del material polimérico. Se ha reportado como 130 °C el valor de Tg para la proteína de haba (Saldanha-do-Carmo
y col., 2021). Las diferencias respecto a este estudio pueden estar asociadas
con la procedencia, la composición de las muestras y/o el procesamiento al cual
ha sido sometida la proteína de haba.
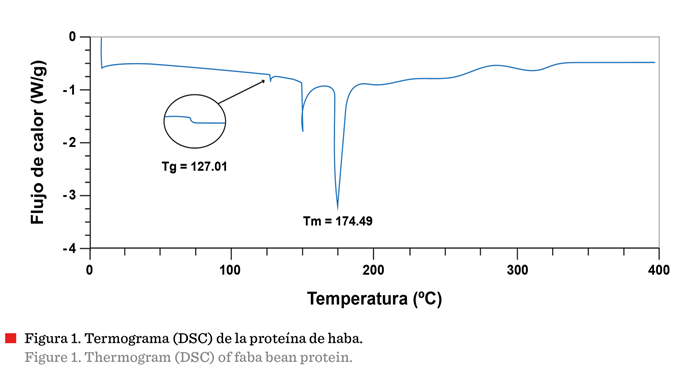
El
valor obtenido de la Tg permitió establecer en 115 ºC
la temperatura de entrada del aire al secador, para pulverizar la solución
polimérica sin que pasara de su estado vítreo a uno gomoso, lo cual sucedería a
los 127.01 °C, y provocaría que la proteína se aglomerase en la cámara de
secado. Esto ocasiona que mejore su función como material de pared en las
cápsulas, para el extracto.
Evaluación
de la fotoprotección de las cápsulas con extracto de R.
monantha
En
el análisis del efecto de la UV en el extracto crudo, se observó una pérdida
del 58 % de su capacidad antioxidante inicial (ABTS+), después de 48
h de exposición a la luz UV (Figura 2). Las cápsulas mostraron capacidad fotoprotectora, que aumentó con la concentración
proteica, pasando de conservar el 69 % de su capacidad antioxidante en la
muestra con la menor concentración de proteína (15 %), a un 90 % (P < 0.05), en las cápsulas con 30 % de proteína, es
decir, una oxidación relativa del 10 %.
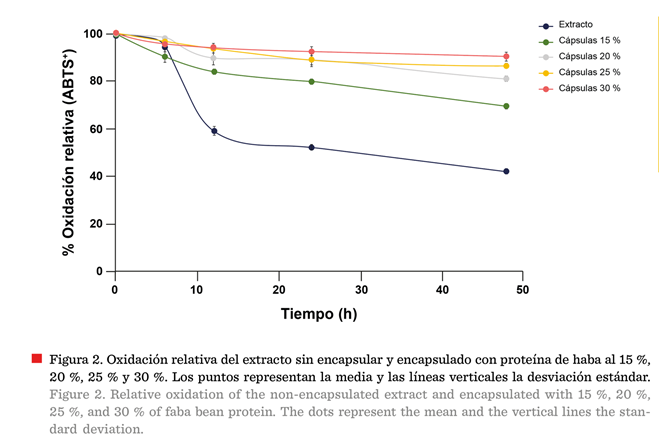
El
efecto fotoprotector del material encapsulante, sobre los CAVB contenidos en el
extracto de R. monantha, proporcional a la
concentración proteica, podría deberse a que algunas estructuras moleculares de
las proteínas vegetales pueden absorber la luz UV. Específicamente, la proteína
de haba se caracteriza por contener aminoácidos azufrados, que son aminoácidos
con cadenas laterales que contienen azufre. Cuando estos aminoácidos se exponen
a la luz UV pueden provocar reacciones fotoquímicas. Estas reacciones implican
la absorción de fotones UV por el átomo de azufre
(Stampfli y Seebeck, 2020), lo que le confiere a la leguminosa esta capacidad fotoprotectora.
Estudios
previos han reportado proteínas vegetales con efectos positivos sobre fotoprotección a compuestos, tal es el caso de
González-Cruz y col. (2022), quienes documentaron que, la zeína utilizada como
material encapsulante brindó una buena protección de hasta el 86 % ante la radiación UV. Así mismo, Vilchis-Gómez
y col. (2024), documentaron la aplicación de la proteína de hoja de jaca como
material emulsionante para el extracto de R. monantha,
la cual brindó una protección de hasta el 90 % ante la radiación UV.
Análisis
termogravimétrico (TGA) de las cápsulas
Se
obtuvieron las temperaturas de descomposición y las variaciones de masa de las
cápsulas y del extracto (Tabla 1). La primera disminución de peso del extracto (1.11 %) se atribuyó a la pérdida de
humedad; y la segunda disminución (57.18 %) se atribuyó a la descomposición de la materia del extracto (Td = 211.85 °C). En el
caso de las cápsulas con y sin
extracto, la primera reducción de peso se debió a la pérdida de humedad
con 4.97 % y 5.93 %, respectivamente. Para las cápsulas vacías, la segunda
pérdida de peso (54.55 %) se atribuyó a la descomposición de las globulinas,
albúminas y glutelinas (Td = 274.16 °C), mientras que
para las cápsulas con extracto, la segunda pérdida de peso (54.49 %) se debió a
la descomposición del extracto y de la proteína (Td =
290.09 °C). La Td del extracto encapsulado (290.09
°C) fue superior a la Td del extracto crudo (211.85
°C). No se observó un evento simultáneo de descomposición (TGA) y fusión (DSC).
Este comportamiento evidencia una mayor estabilidad de las cápsulas vacías y
con extracto a temperaturas de 230.71 °C y 260.67 °C (inicio de la descomposición por TGA), las cuales son superiores
a la Tm registrada en el DSC (174.49 °C) para la proteína de haba (Figura 1).
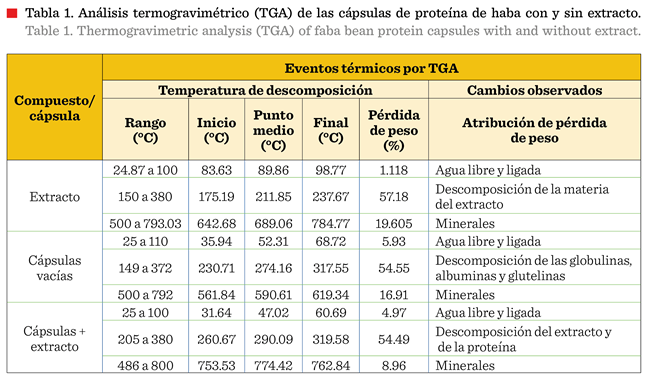
Los
hallazgos muestran que la proteína de haba ejerce un efecto termoprotector
sobre el extracto de R. monantha, con un
incremento de Td = 78.24 °C. Por otra parte, la Td de las cápsulas vacías fue menor que la de las cápsulas
con extracto, el incremento de 15.93 °C muestra que el extracto encapsulado es
más estable térmicamente que las cápsulas vacías. Por lo tanto, una vez que las
cápsulas sean aplicadas en el epicarpio de los frutos, la proteína de haba podrá favorecer la conservación del
extracto, brindando termoestabilidad a los compuestos
fenólicos para ejercer su acción contra C. gloeosporioides.
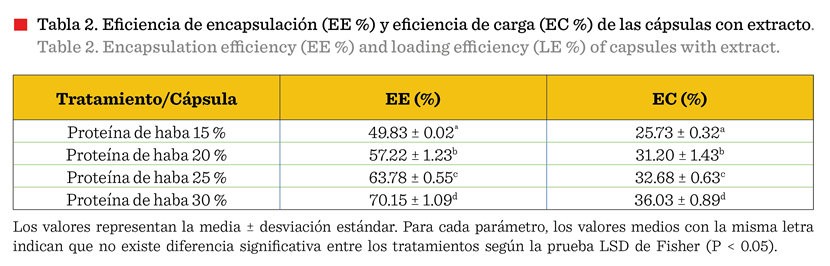
Eficiencia de encapsulación y eficiencia de carga
Los
datos obtenidos indican que a medida que aumentó el porcentaje de proteína,
tanto la EE, como la de carga incrementaron (Tabla 2). Las cápsulas con el
porcentaje más alto de proteína alcanzaron
hasta un 70.15 % de EE, mientras que el mayor valor de EC alcanzó hasta
un 36.03 %. Dicho comportamiento es debido a las interacciones mejoradas entre
la proteína de haba y el extracto, ya que, al momento de aplicar mayor
porcentaje de polímero, este crea enlaces intermoleculares que forman una
coraza más gruesa, que induce una encapsulación más eficiente (Selim y col.,
2021). Los presentes hallazgos evidencian que el cambio de los porcentajes
utilizados de la composición del material de la pared es una estrategia eficaz
para mejorar la EE de las cápsulas a base de proteínas. Los resultados fueron
mejores a los reportados por Suárez y Brito (2020), quienes obtuvieron una EE
de 32.83 %, al utilizar proteína de zeína
para encapsular antocianinas.
Caracterización
fisicoquímica de las cápsulas
Se
realizó la caracterización de las cápsulas al 30 % de proteína, ya que estas
fueron las que obtuvieron mejores resultados en cuanto a la EE, EC, fotoprotección y
consecuentemente, fueron las que presentaron mayor potencial de
inhibición fúngica.
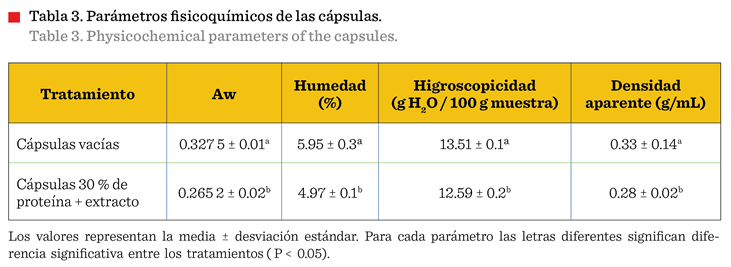
Actividad
de agua
Todas las muestras presentaron una baja actividad
de agua (Aw) (Tabla 3) indicando que eran estables,
con reducida susceptibilidad a presentar desarrollo microbiano, o reacciones
bioquímicas que deteriorasen el producto en polvo (Gabas y col., 2009),
resultados esperados en la encapsulación mediante secado por aspersión, proceso
que permite la estabilidad del extracto. Las cápsulas vacías presentaron mayor
valor (P < 0.05) de Aw (0.32) y contenido de
humedad (5.95 %) que las cápsulas con extracto (Aw =
0.26; 4.97 %) (Tabla 3). Esto indica que, la incorporación del extracto provocó
un aumento en el contenido de sólidos, e indujo interacciones soluto-líquido,
entre el extracto y los componentes de la cápsula (Gharsallaoui
y col., 2012) que modificaron la cantidad de
agua libre. En otros estudios, se han reportado valores de Aw
menores de 0.70 en proteínas aplicadas como material de pared, lo cual
favorecen su conservación y evita el crecimiento
de microorganismos (Dumitrașcu y col., 2021).
Determinación
de humedad
El porcentaje de humedad de las cápsulas con extracto fue
menor (P < 0.05) respecto a las cápsulas vacías (Tabla
3), ya que el extracto tenía una humedad
inicial baja (1.11 %), por lo que no provocó un incremento en el
contenido de humedad (Ulfa y col., 2023). Además, la
adición de extracto aumentó el contenido de sólidos, lo que llevó a una
disminución en el contenido de humedad de
las cápsulas. Por otro lado, se ha reportado que los compuestos fenólicos tienen la capacidad de retener agua
estructural mediante enlaces de hidrógeno fuertes (OH-O) y débiles (CH-O), así
como favorecer la deshidratación durante el proceso de encapsulación (Malloum y Conradie, 2023).
Solubilidad de las cápsulas
Las
cápsulas con extracto, así como las cápsulas
vacías mostraron una solubilidad del 100 % (datos no mostrados en
Tablas), lo que permite determinar qué se obtendrá una eficaz liberación del
encapsulado. Esta alta solubilidad en agua de las cápsulas se atribuye al
material encapsulante, ya que, como se ha reportado, la proteína de haba es
totalmente soluble en agua, debido a su composición de aminoácidos, el tipo de
enlaces intermoleculares (hidrofílicos) y la conformación estructural (Zhu y
Huang, 2019).
Higroscopicidad
de las cápsulas
Las
cápsulas sin extracto presentaron mayor higroscopicidad (13.51 %), en
comparación con las cápsulas que contenían
el extracto (12.59 %) (P < 0.05) (Tabla 3). Una posible explicación
es que el extracto podría haber actuado como una barrera contra la humedad,
reduciendo la capacidad de la cápsula para absorber agua del entorno
circundante (Sarabandi y col., 2018). Además, cuando
se aplica el extracto, este puede formar enlaces intermoleculares que pueden
evitar la interacción de los grupos OH de la proteína de haba con el agua del
ambiente, afectando su capacidad de absorción
de agua (Ramos-Hernández y col., 2021).
Densidad
aparente
Las
cápsulas con extracto presentaron densidad aparente de 0.28 g/mL, mientras que
en las cápsulas vacías fue de 0.33 g/mL (Tabla 3). La diferencia pudo ser
causada por distintos factores, como la presencia del extracto, contenido de
humedad y la viscosidad de la solución polimérica. En estudios previos Wu y
col. (2022) reportaron que la higroscopicidad puede afectar significativamente
la densidad aparente del polvo, ya que la tendencia de un material a absorber
humedad del entorno circundante puede impactar en su densidad aparente. A medida que aumenta la naturaleza higroscópica
de un polvo puede conducir a la formación de una fina película de agua
adsorbida en la superficie de las partículas. Esta película de agua puede
llenar los huecos entre ellas, lo que resulta en el aumento de la densidad
aparente del polvo (Mendoza-Corvis y col.,2016).
Inhibición
antifúngica in vitro del extracto de R. monantha
encapsulado
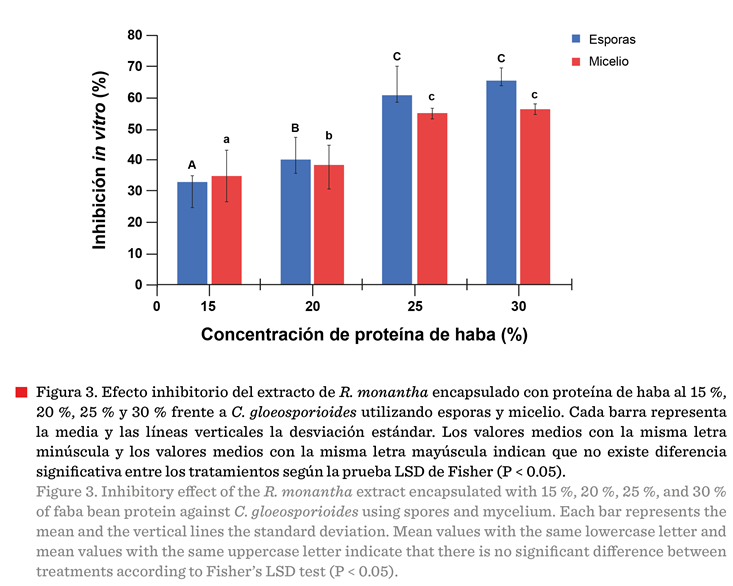
A
medida que la concentración de proteína incrementó, se registró un aumento del
porcentaje de inhibición (P < 0.05), con mayor efecto en la inhibición de la
germinación de esporas que en la inhibición del crecimiento micelial (Figura
3). Lo anterior puede atribuirse al estado fisiológico del hongo; en el caso
del micelio, la inhibición fue menor, debido a que el hongo se encuentra en su
estado activo, en una etapa de desarrollo más avanzada y con una pared celular
más resistente (Iñiguez-Moreno y col., 2020). Esta característica le confiere
una mayor resistencia frente a factores externos, lo que dificulta la acción de
los compuestos fenólicos. Por el contrario, las esporas representan una de las
primeras etapas del ciclo de vida del hongo y requieren germinar primero para
iniciar el desarrollo del micelio.
Las
esporas son más sensibles a los compuestos fenólicos debido a su menor
desarrollo estructural. En este sentido, la escopoletina
y la quercetina pueden interferir directamente en la inhibición de la
germinación de esporas (Beyer y col., 2019). Sin embargo, las cápsulas con 25 %
de proteína presentaron una inhibición del 60.54 % y 55.03 % con esporas y
micelio, respectivamente, que no fueron significativamente diferentes (P <
0.05) a las obtenidas con 30 % de proteína
(65.4 % y 55.23 %, con esporas y micelio, respectivamente), indicando
que ambas concentraciones presentaron una
capacidad similar para inhibir el hongo C. gloeosporioides.
El
incremento en la capacidad de inhibición del hongo, asociado con una mayor
concentración proteica, podría deberse a la formación de una cápsula con una
pared más gruesa y estructurada, lo que induce una mayor protección de los CAVBs. De acuerdo con Ramos y col. (2022) la proteína crea una barrera mediante enlaces
intermoleculares, lo que resulta en una mayor eficiencia de encapsulación
utilizando concentraciones más altas de polímero.
Vilchis-Gómez
y col. (2024) utilizaron un extracto etanólico de R.
monantha para inhibir el hongo C. gloesporioides y atribuyeron la actividad antifúngica del extracto a los compuestos
fenólicos, como la escopoletina y la quercetina, que son capaces de interferir con la
estructura de la pared celular del hongo y modificar su permeabilidad.
Se ha establecido que la escopoletina aumenta la
permeabilidad de la membrana celular fúngica, debido a la explosión de especias
reactivas de oxígeno (ROS, por sus siglas en inglés: reactive oxygen species) que dañan la
membrana celular (Beyer y col., 2019). Las ROS como el peróxido de hidrógeno,
el radical superóxido y el radical hidroxilo,
incrementan significativamente su concentración dentro de las células fúngicas
en respuesta al estrés oxidativo inducido por compuestos fenólicos. Al
interactuar entre sí y con componentes celulares, como proteínas y ácidos
nucleicos, las ROS generan daños en los lípidos de la membrana celular, lo que
compromete su integridad estructural y funcional, provocando la apoptosis del hongo (Castano-Duque
y col., 2024). Por otro lado, la quercetina puede interferir con la síntesis de
la pared celular y alterar la permeabilidad de la membrana celular de los
hongos fitopatógenos, causando la fuga de micronutrientes de la célula y finalmente la lisis (Aguilar-Veloz y col., 2020).
Ambos compuestos son susceptibles a cambios estructurales por efecto de la
temperatura y la radiación UV, que disminuyen su efecto antifúngico
(Vilchis-Gómez y col., 2024), por lo que es importante desarrollar estrategias
de fotoprotección, como el encapsulamiento.
CONCLUSIONES
El
secado por aspersión de la proteína de haba fue adecuado para la encapsulación
del extracto de R. monantha. El uso de 30 % de
proteína de haba permitió obtener alta eficiencia de encapsulación (70.15 %) y muy
buenas propiedades termoproetctoras (~ 78.24 °C) y
fotoprotectoras (10 % de oxidación relativa) sobre los CAVBs
del extracto. Estas cápsulas preservaron la capacidad antifúngica in vitro
del extracto, por lo que fueron adecuadas para
el control de C. gloeosporioides, con una inhibición
de la germinación de esporas del 65.4 %. Además, presentaron calidad fisico-química adecuada en cuanto a actividad de agua,
solubilidad, higroscopicidad y densidad aparente, lo que sugiere su uso
potencial en campo. Las características de estabilidad del encapsulado
posicionan a la proteína de haba como una alternativa prometedora para ser utilizada como material encapsulante en otras sustancias
bioactivas, con aplicaciones en la industria alimenticia y farmaceútica,
en función de las propiedades biológicas de
los compuestos que se busque proteger.
AGRADECIMIENTOS
Los autores agradecen a la Secretaría de Ciencia,
Humanidades, Tecnología e Innovación (SECIHTI)
por la beca otorgada a Claudia Marcela Guillén-Jiménez para la
realización de este trabajo.
Declaración de conflicto de intereses
Los autores declararon no tener conflictos de intereses de
ningún tipo.
REFERENCIAS
Aguilar-Veloz,
L. M., Calderón-Santoyo, M., Váz-quez-González,
Y., & Ragazzo-Sánchez, J. A. (2020). Application of essential oils and polyphenols as na-tural antimicrobial agents in postharvest treatments: Advances and
challenges. Food Science & Nutrition, 8(6), 2555-2568. https://doi:10.1002/fsn3.1437
Alehosseini, A., Ghorani, B., Sarabi-Jamab,
M., & Tucker, N. (2018). Principles of electrospraying:
A new approach in protection of bioactive compounds in foods. Critical
Reviews in Food Science and Nutrition, 58(14), 2346-2363. https://doi.org/10.1080/10408398.2017.1323723.
Alpizar-Reyes, E., Castaño, J., Carrillo-Navas,
H., Alvarez-Ramírez, J., Gallardo-Rivera,
R., Pérez-Alonso, C., & Guadarrama-Lezama, A. Y. (2018). Thermodynamic sorption analysis and glass transition temperature of faba
bean (Vicia faba L.) protein. Journal of Food Science and Technology,
55(3), 935-943. doi:10.1007/s13197-017-3001-1
Beyer, S. F., Beesley, A., Rohmann, P. F., Schultheiss, H., Conrath, U., & Langenbach, C. J.
(2019). The Arabidopsis
non-host defence-associated coumarin scopoletin protects soybean from asian
soybean rust. The Plant Journal, 99(3), 397-413. https://doi.org/10.1111/tpj.14426
Calderón-Santoyo, M., Iñiguez-Moreno, M.,
Barros-Castillo, J. C., Miss-Zacarías, D. M., Díaz, J. A., &
Ragazzo-Sánchez, J. A. (2022). Microencapsulation of citral
with Arabic gum and sodium alginate for the control of Fusarium pseudocircinatum in bananas. Iranian Polymer Journal,
31(5), 665-676. https://doi.org/10.1007/s13726-022-01033-z
Castano-Duque, L., Lebar, M. D., Mack, B. M., Lohmar, J.
M., & Carter-Wientjes, C. (2024). Investigating the
impact of flavonoids on Aspergillus flavus: Insights into cell wall
damage and biofilms. Journal of Fungi, 10(9), 665. https://doi.org/10.3390/jof10090665
Chamudeshwari, J., Parthasarathi, S., & Ali, R. (2024). Chapter 4 - Spray drying of
milk and milk products. In S. Mahdi-Jafari & K. Samborska (Eds.), Spray drying for the food industry (pp. 87-123). Woodhead Publishing. https://doi.org/10.1016/B978-0-12-819799-8.00002-8
Dissanayake, T. & Bandara, N. (2024). Protein-based encapsulation systems for codelivery of
bioactive compounds: Recent studies and potential applications. Current
Opinion in Food Science, 57, 101181. https://doi.org/10.1016/j.cofs.2024.101181
Dumitrașcu, L., Stănciuc, N., & Aprodu,
I. (2021). Encapsulation of anthocyanins from cornelian cherry fruits using
heated or non-heated soy proteins. Foods,
10(6), 1342. https://doi.org/10.3390/foods10061342
Duodu, K. G. & Apea-Bah, F. B. (2017). African legumes: Nutritional and health-promoting attributes. In R. N. John
& J. M. Taylor (Eds.), Gluten-Free ancient grains (pp. 223-269).
Elsevier. Woodhead Publishing Series in Food Science, Technology and Nutrition.
FAO, Food and Agriculture Organization of the United
Nations (2021). Cultivos y productos de ganadería. [En línea]. Disponible en:
https://www.fao.org/faostat/es/#data/QCL. Fecha de consulta: 16 de mayo de
2023.
Fatnassi, M., Tourné-Péteilh,
C., Peralta, P., Cacciaguerra, T., Dieudonné, P., Devoisselle, J.
M., & Alonso, B. (2013). Encapsulation of complementary model
drugs in spray-dried nanostructured materials.
Journal of Sol-Gel Science and Technology, 68(2), 307-316. https://doi.org/10.1007/s10971-013-3170-y
Gabas,
A. L., Telis-Romero, J., Giraldo-Gómez, G.I., & Telis, V. R. N. (2009). Propiedades termodinámicas de
sorción de agua de la pulpa de lulo en polvo con encapsulantes. Food Science and Technology, 29(4), 911-918. https://doi.org/10.1590/s0101-20612009000400032
Gatto, M. A., Ippolito,
A., Linsalata, V., Cascarano,
N. A., Nigro, F., Vanadia,
S., & Di-Venere, D. (2011). Activity of extracts from wild edible
herbs against postharvest fungal diseases of fruit and vegetables. Postharvest
Biology and Technology, 61(1), 72-82.
Htps://doi:10.1016/j.postharvbio.2011.02.005
Gharsallaoui, A., Saurel, R., Chambin, O., & Voilley,
A. (2012). Pea (Pisum sativum, L.) protein isolate stabilized emulsions:
A novel system for microencapsulation of lipophilic ingredients by spray
drying. Food and Bioprocess Technology, 5, 2211-2221. https://doi.org/10.1007/s11947-010-0497-z
González-Cruz, E., Andrade-Gonzales, I., Prieto, C.,
Cálderon-Santoyo, M., & Ragazzo-Sánchez, J. (2022). Nanoencapsulation of polyphenolic-rich extract from
biloxi blueberries (Vaccinium corymbosum L.) by electrospraying using
zein as encapsulating material. Biointerface Research in Applied Chemistry, 13(1), 78. https://doi.org/10.33263/BRIAC131.078
González-Gutiérrez,
K. N., Ragazzo-Sánchez, J. A., Barros-Castillo, J.
C., Narváez-Zapata, J. A., & Calderón-Santoyo, M. (2023). Yeasts with potential
biocontrol of Colletotrichum gloeosporioides
in avocado (Persea americana Mill. cv. Hass) and characterization of Yamadazyma mexicana mechanisms. European Journal of Plant Pathology, 165(3), 525-543. https://doi.org/10.1007/s10658-022-02625-4
González-Gutiérrez,
K. N., Ragazzo-Sánchez, J. A., &
Calderón-Santoyo, M. (2024). Bioformulation of Yamadazyma mexicana
LPa14 by electrospraying process: Anthracnose control and effect on postharvest
quality of avocado fruit. Biological
Control, 190, 105449. https://doi.org/10.1016/j.biocontrol.2024.105449
Hacisalihoglu, G., Freeman, J.,
Armstrong, P. R., Seabourn, B. W., Porter, L. D., Settles, A. M., & Gustin, J.
L. (2020). Protein, weight, and oil prediction by
single-seed near-infrared spectroscopy for selection
of seed quality and yield traits in pea (Pisum sativum). Journal
of the Science of Food and Agriculture, 100(8), 3488-3497. https://doi.org/10.1002/jsfa.10389
Iñiguez-Moreno,
M., Calderón-Santoyo, M., Barros-Castillo, J. C., Miss-Zacarías, D. M., Díaz,
J. A., & Ragazzo-Sánchez, J. A. (2022). Nanofibers added with citral: Characterization and their application to
postharvest control of Fusarium pseudocircinatum in bananas. Journal
of Food Processing and Preservation, 46(12). https://doi.org/10.1111/jfpp.17188
Iñiguez-Moreno,
M., Ragazzo-Sánchez, J. A., Barros-Castillo, J. C.,
Sandoval-Contreras, T., & Calderón-Santoyo,
M. (2020). Sodium alginate coatings added with Meyerozyma caribbica: Postharvest biocontrol of Colletotrichum
gloeosporioides in avocado (Persea
americana Mill. cv. Hass).
Postharvest Biology and Technology, 163, 111123. https://doi.org/10.1016/j.postharvbio.2020.111123
Ismail, B. P., Senaratne-Lenagala, L., Stube, A., &
Brackenridge, A. (2020). Protein demand: Review of plant and animal proteins used in alternative protein product
development and production. Animal
Frontiers,
10(4), 53-63. https://doi.org/10.1093/af/vfaa040
Jiménez-Sánchez,
D. E., Calderón-Santoyo, M., Ortiz-Basurto, R. I., Bautista-Rosales, P. U.,
& Ragazzo-Sánchez,
J. A. (2018). Effect of maltodextrin reduction and
native agave fructans addition on the physicochemical properties of spray-dried
mango and pineapple juices. Food Science and Technology
International, 24(6), 519-532. https://doi.org/10.1177/1082013218769168
Juárez-Trujillo,
N., Monribot-Villanueva, J. L., Alvarado-Olivarez, M., Luna-Solano, G., Guerrero-Analco, J. A.,
& Jiménez-Fernández, M. (2018). Phenolic profile and
antioxidative properties of pulp and seeds of Randia monantha Benth. Industrial
Crops and Products, 124, 53-58. https://doi.org/10.1016/j.indcrop.2018.07.052
Karkanis, A., Ntatsi, G., Lepse, L., Fernández, J. A.,
Vågen, I. M., Rewald, B., Alsiņa, I., Kronberga, A., Balliu, A., Olle, M.,
Bodner, G., Dubova, L., Rosa, E., &
Savvas, D. (2018). Faba bean cultivation – Revealing novel managing
practices for more sustainable and competitive European cropping Systems. Frontiersin
Plant Science, 9. https://doi.org/10.3389/fpls.2018.01115
Kumar, M., Tomar, M., Punia, S., Dhakane-Lad, J., Dhumal,
S., Changan, S., Senapathy, M., Berwal, M. K., Sampathrajan, V., Sayed, A. A.
S., Chandran, D., Pandiselvam, R., Rais, N., Mahato, D. K., Udikeri, S. S.,
Satankar, V., Anitha, T., Reetu, R., & Kennedy, J. F. (2022). Plant-based
proteins and their multifaceted industrial applications. LWT- Food Science
and Technology, 154, 112620. https://doi.org/10.1016/j.lwt.2021.112620
López-Cruz,
R., Ragazzo-Sánchez, J. A., & Cal-derón-Santoyo, M. (2020). Microencapsulation of Meyerozyma
guilliermondii by spray drying using sodium alginate
and soy protein isolate as wall materials: A biocontrol formulation for
anthracnose disease of mango. Biocontrol
Science and Technology, 30(10), 1116-1132. https://doi.org/10.1080/09583157.2020.1793910
Mahdi-Jafari, S. (2017). An overview of nanoencapsulation techniques and their classification.
In S. Mahdi-Jafari (Ed.), Nanoencapsulation technologies for the food
and nutraceutical industries (pp. 1-34). Academic Press. https://doi.org/10.1016/B978-0-12-809436-5.00001-X
Malloum, A. & Conradie, J. (2023). Microsolvation of
phenol in water: Structures, hydration free energy
and enthalpy. Molecular Simulation, 49(4), 403-414. https://doi.org/10.1080/08927022.2022.2163674
Mariscal-Amaro,
L. A., Villaseñor-Mir, H. E., Solís-Moya, E., Hortelano-Santa Rosa, R. y
Martínez-Cruz, E. (2020). Efecto de fungicidas sobre caracteres agronómicos,
rendimiento y tizones foliares en trigo de temporal en México. Revista
Fitotecnia Mexicana, 43(1), 71. https://doi.org/10.35196/rfm.2020.1.71
Méndez-Ventura, L. y Hernández-Medel, M. (2009).
Evaluación de la toxicidad del fruto de Randia
monantha Benth. Revista
Médica de la Universidad Veracruzana, 9(1), 41-45.
Mendoza-Corvis, F., Arteaga-Martinez, M.
y Perez-Solis, O. (2016). Comportamiento de la
vitamina c en un producto a base de lactosuero y pulpa de mango variedad
magdalena river (Mangífera
indica L.) durante el secado por aspersión. Revista Chilena de Nutrición,
43(2), 8. https://doi.org/10.4067/s0717-75182016000200008
Meng,
Y. & Zhang, X. (2014). Nanostructure formation in
Thermoset/Block copolymer and Thermoset/Hyperbranched
polymer blends. In S. Thomas, R. Shanks & S. Chandrasekharakurup
(Eds.), Nanostructured Polymer Blends (pp. 161-194). Elsevier, London.
Ojeda-Ayala,
M., Gaxiola-Camacho, S. M., & Delgado-Vargas, F. (2022). Phytochemical composition and biological activities of the plants of the
genus Randia. Botanical Sciences, 100(4), 779-796. https://doi.org/10.17129/botsci.3004
Oulahal, N. & Degraeve,
P. (2022). Phenolic-rich plant extracts with
antimicrobial Activity: An alternative to food preservatives and biocides? Frontiers
in Microbiology, 12(1). https://doi.org/10.3389/fmicb.2021.753518
Pandit, M. A., Kumar, J., Gulati, S., Bhandari, N., Mehta, P., Katyal, R., Rawat, C. D., Mishra, V.,
& Kaur, J. (2022). Major
biological control strategies for plant pathogens. Pathogens,
11(2), 273. https://doi.org/10.3390/pathogens11020273
Ramos-Hernández,
J. A., Calderón-Santoyo, M., Prieto, C., Lagarón, J.
M., Navarro-Ocaña, A., & Ragazzo-Sanchez,
J. A. (2023). Encapsulation with
HDPAF-WP of the hexane fraction of sea grape (Coccoloba uvifera L.) leaf extract by electrospraying.
Polymer Bulletin,
80(1), 959-975. 10.1007/s00289-022-04088-3
Ramos-Hernández,
J. A., Lagarón, J. M., Calderón-Santoyo, M., Prieto,
C., & Ragazzo-Sánchez, J. A. (2021). Enhancing hygroscopic stability of agave fructans capsules obtained by electrospraying. Journal of Food Science and Technology,
58(4), 15931603. https://doi.org/10.1007/s13197-020-04672-3
Ramos,
R., Bernard, J., Ganachaud, F., & Miserez, A. (2022). Protein-based
encapsulation strategies: Toward micro- and nanoscale carriers with increased
functionality. Small Science,
2(3). https://doi.org//smsc.202100095
Rodiño, P., Santalla, M., De-Ron M, A., & Drevon-Jacques, J. (2005). Variability
in symbiotic nitrogen fixation among white landraces of common bean from the
Iberian peninsula. Symbiosis, 2, 69-78.
Saldanha-do-Carmo, C., Knutsen, S.
H., Malizia, G., Dessev, T., Geny, A., Zobel, H., Myhrer,
K. S., Varela, P., & Sahlstrøm, S. (2021). Meat analogues from a faba bean concentrate can be generated by high
moisture extrusion. Future Foods, 3, 100014. https://doi.org/10.1016/j.fufo.2021.100014
Sarabandi, K., Sadeghi-Mahoonak, A., Hamishe-kar, H.,
Ghorbani, M., & Jafari, S. M. (2018). Microencapsulation of casein
hydrolysates: Physicochemical, antioxidant
and microstructure properties. Journal of Food Engineering, 237,
86-95. https://doi.org/10.1016/j.jfoodeng.2018.05.036
Schumacher, H., Paulsen, H. M., Gau, A. E., Link, W.,
Jürgens, H. U., Sass, O., & Dieterich, R. (2011). Seed protein amino acid
composition of important local grain legumes Lupinus angustifolius L., Lupinus
luteus L., Pisum
sativum L. and Vicia faba L. Plant Breeding, 130(2), 156-164. https://doi:10.1111/j.1439-0523.2010.01832.x
Selim,
K. A., Alharthi, S. S., Abu El-Hassan, A. M., Elneairy, N. A., Rabee, L. A., & Abdel-Razek, A. G. (2021). The effect of wall
material type on the encapsulation efficiency and oxidative stability of fish
oils. Molecules, 26(20), 6-19. https://doi.org/10.3390/molecules26206109
Simonetti,
G., Brasili, E., & Pasqua,
G. (2020). Antifungal activity of phenolic and
polyphenolic compounds from different matrices of Vitis vinifera L.
against human pathogens. Molecules, 25(16),
37-48. https://doi.org/10.3390/molecules25163748
Stampfli, A. R. & Seebeck, F. P. (2020). The catalytic mechanism of sulfoxide synthases. Current Opinion in
Chemical Biology, 59(1), 111-118. https://doi.org/10.1016/j.cbpa.2020.06.007
Suárez,
H. M. y Brito, D. C. (2020). Eficiencia de encapsulacion
y capacidad de carga de antocianinas de Vaccinium
floribundim kunt en nanoparticulas de zeina. Infoanalítica, 8(1), 83-97. https://doi.org/10.26807/ia.v8i1.98
Ulfa, A. S., Emelda, E., Munir, M. A.,
& Sulistyani, N. (2023). Pengaruh
metode ekstraksi maserasi dan sokletasi terhadap standardisasi parameter spesifik dan non spesifik ekstrak etanol biji pepaya (Carica papaya
L.). Jurnal Insan
Farmasi Indonesia, 6(1), 1-12. https://doi.org/10.36387/jifi.v6i1.1387
Vilchis-Gómez,
D. S., Calderón-Santoyo, M., Barros-Castillo, J. C., Zamora-Gasga,
V. M., & Ragazzo-Sánchez, J. A. (2024). Ultrasound assisted extraction of polyphenols
from Randia monantha: Optimization, characterization and antifungal activity. Industrial Crops and
Products, 209, 117932. https://doi.org/10.1016/j.indcrop.2023.117932
Wang, Y., Ghosh, S., & Nickerson, M. T. (2022).
Microencapsulation of flaxseed oil by lentil protein isolate -k- carrageenan
and -i- carrageenan based wall materials through spray and freeze drying. Molecules, 27, 3195. https://doi.org/10.3390/molecules27103195
Warsame,
A. O., Michael, N., O’Sullivan, D. M., & Tosi, P.
(2020). Identification and quantification of major faba bean seed
proteins. Journal of Agricultural and Food Chemistry, 68(32), 8535-8544.
https://doi.org/10.1021/acs.jafc.0c02927
Wu, Z., Wu, Y., Zakhvatayeva, A., Wang, X., Liu, Z.,
Yang, M., Zheng, Q., & Wu, C. Y. (2022). Influence of moisture content on
die filling of pharmaceutical powders. Journal of Drug Delivery Science and
Technology, 78, 103985. https://doi.org/10.1016/j.jddst.2022.103985
Yan, C., Kim, S. R., Ruiz, D. R., & Farmer, J. R.
(2022). Microencapsulation for food applications: A review. ACS
Applied Bio Materials, 5(12), 5497-5512. https://doi.org/10.1021/acsabm.2c00673
Zhu, J. & Huang, Q. (2019). Nanoencapsulation of
functional food ingredients. In T. Mingquian (Ed.),
Advances in Food and Nutrition Research (pp. 129-165). Elsevier. https://doi.org/10.1016/bs.afnr.2019.03.005
Żmudziński, D., Goik, U., & Ptaszek, P. (2021). Functional and rheological
properties of Vicia faba
L. protein isolates. Biomolecules, 11(2), 178. https://doi.org/10.3390/biom11020178