https://doi.org/10.29059/cienciauat.v20i1.1972
Efecto en la cicatrización de
heridas inducido por proteínas de Mangifera
indica var. manila en fibroblastos humanos
Wound
healing effect induced by Mangifera indica var. manila proteins in human
fibroblast
Cicatrización inducida por proteínas de mango
Gloria Barrera-Morales1,2,
Alma Vázquez-Luna1, Leticia Nicolás-Toledo2, Yessica Eduviges Zamudio-Cuevas3*
*Correspondencia:
yesszamudio@gmail.com/Fecha de recepción: 20 de diciembre de 2024/Fecha de
aceptación: 27 de mayo de 2025/Fecha de publicación: 6 de junio de 2025.
1Universidad
Veracruzana, Instituto de Ciencias Básicas, Xalapa, Veracruz, México, C. P.
91190. 2Universidad Autónoma de Tlaxcala, Centro Tlaxcala Biología
de la Conducta, Tlaxcala, Tlaxcala, México, C. P. 90070. 3Instituto
Nacional de Rehabilitación "Luis Guillermo lbarra
lbarra", Laboratorio de Líquido Sinovial,
Calzada México-Xochimilco núm. 289, col. Arenal de Guadalupe, Tlalpan, Ciudad
de México, México, C. P. 14389.
RESUMEN
La medicina ayurveda
ha reportado el uso de Mangifera indica
L. (mango) para la cicatrización de heridas ocasionadas por picaduras y
mordeduras de ciertos animales. El objetivo del presente estudio fue evaluar el
efecto cicatrizante de las proteínas de mango in vitro en un modelo de
herida-cicatriz en fibroblastos humanos. Las
proteínas totales de la pulpa de mango fueron aisladas y cuantificadas
usando el método de Bradford. Posteriormente, las muestras fueron liofilizadas
y cuantificadas por el método BCA. La electroforesis SDS-PAGE fue usada para la
separación e identificación de las fracciones proteicas. Se realizaron ensayos
de citotoxicidad a 24 h de las proteínas (0.25 mg/mL,
2.5 mg/mL y 25 mg/mL) en
los fibroblastos humanos. El ensayo herida-cicatriz fue llevado a cabo a través
de un raspado en el cultivo de fibroblastos, midiendo la longitud de la herida
mediante microscopía, después de los tratamientos con las diferentes
concentraciones de proteínas a 24 h y 48 h. Se calculó el porcentaje de cierre de
herida. Las proteínas de mango aisladas presentaron un peso molecular entre 10 kDa y
95 kDa y similar al control (P < 0.05) no indujeron citotoxicidad o cambios
morfológicos en los fibroblastos a las concentraciones utilizadas. El tratamiento utilizando 0.25 mg/mL de proteínas de mango sugiere un incremento en la
migración de los fibroblastos que podría favorecer el cierre de la herida.
PALABRAS CLAVE: cicatrización
de heridas, fibroblastos humanos, proteínas
de mango, migración celular, ensayo herida-cicatriz.
ABSTRACT
Ayurvedic medicine
has reported the use of Mangifera indica
L (mango) to heal wounds caused by
stings and bites from certain animals. The aim of this study was to evaluate the healing effects of mango proteins
in vitro in a wound scar model in human fibroblasts. The total proteins
from mango pulp were isolated and quantified
using the Bradford method and subsequently the samples were lyophilized
and quantified by BCA. SDS-PAGE electrophoresis was used for the separation and
identification of the protein fractions. Assays to determine protein
cytotoxicity were performed by quantifying fibroblast viability at different
protein concentrations (0.25 mg/mL, 2.5 mg/mL, and 25 mg/mL). The scratch wound
assay was carried out through scraping the fibroblast culture, with wound
length being measured via microscopy after treatment with the different protein
concentrations at 24 h, and 48 h and the percentage of wound closure being calculated.
The isolated mango proteins had a molecular weight between 10 kDa and 95 kDa
and similar to the control (P < 0.05) they did
not induce cytotoxicity or morphological changes in fibroblasts at the concentrations used. The treatment
using a 0.25 mg/mL protein suggests an increase in fibroblast migration that
could favor wound closure.
KEYWORDS: wound healing, human fibroblasts, mango proteins, cell
migration, essay wound scar.

INTRODUCCIÓN
La cicatrización es un
proceso biológico cuya finalidad es reparar el tejido dañado hasta la formación
de una cicatriz. Es un proceso complejo, el cual está controlado por moléculas
y factores de crecimiento. Para llevarlo a
cabo se requieren diversas células, como
queratinocitos, fibroblastos y células inflamatorias, además de
mediadores inmunológicos como factores de
crecimiento, y mensajeros químicos, como las interleucinas, quimiocinas
y proteínas de la matriz celular (ECM, por sus siglas en inglés: extracellular matrix)
(Fernández-Guarino y col., 2023), las cuales se organizan de tal manera que
puedan establecer reacciones e interrelaciones celulares y su proliferación
está mediada por citocinas liberadas al medio extracelular. Dicho proceso se
activa una vez que se produce una herida (Lin y col., 2023).
En condiciones
normales, la cicatrización se realiza sin complicaciones; sin embargo, en
algunas patologías crónicas degenerativas, como la diabetes y obesidad, las
heridas tardan más en cicatrizar, originando problemas de infecciones por
microorganismos (Raziyeva y col., 2021). El uso
indiscriminado de tratamientos a base de cortisona, en pacientes con algún tipo de artritis, asma e inmunosuprimidos
y la utilización de cremas antibacterianas
durante períodos prolongados de tiempo, afectan la estructura y funcionalidad
de la piel, ya que estas contienen neomicina,
polimixina B y bacitracina; compuestos que ocasionan prurito, ardor, irritación, enrojecimiento y erupciones (Punjataewkupt
y col., 2019).
La
diabetes es una de las patologías con mayor incidencia de complicaciones en los
procesos de cicatrización y se estima que a la fecha existen 451 millones de
personas a nivel mundial que padecen esta enfermedad. Los daños colaterales
que presentan los pacientes diabéticos son
principalmente úlceras de presión y úlceras del pie diabético (Ousey y col., 2018).
Mangifera indica L.
(mango) pertenece a la familia Anacardiaceae y es uno
de los frutos con mayor demanda comercial a nivel mundial. Se cultiva en
regiones tropicales y subtropicales incluyendo a México (Marquínez y col.,
2023). El mango es una fuente importante de fibra, además de tener un alto
valor nutricional por su contenido en vitaminas, minerales, polifenoles,
carotenos, ácido ascórbico, fitoquímicos,
carbohidratos y proteínas (Quintana y col., 2021; Lenucci
y col., 2022; Rajasekaran
y Soundarapanduan, 2023).
En la medicina
ayurveda (medicina tradicional india), el mango y sus componentes han sido
valorados por sus propiedades terapeúticas, como su
capacidad antiinflamatoria y cicatrizante (Shah y
col., 2010). Se han utilizado para tratar
diversos tipos de heridas, incluidas
las mordeduras de serpientes y otros animales (Pithayanukul
y col., 2009). Sin embargo, la mayoría de
los estudios se han centrado en evaluar los efectos de los compuestos
fitoquímicos, principalmente taninos, flavonoides
y triterpenos (Kumar y col., 2021; Rajasekaran
y Soundarapandian, 2023).
En
un modelo de ratones machos blancos Swiss donde se estudió el efecto del
extracto de hoja de mango en la cicatrización de heridas, se demostró mejoría
en el proceso de cicatrización (Suhatri y col.,
2022). Además, se estableció un efecto favorable del extracto de hojas de mango
sobre la formación de colágeno y el aumento de la epitelización de heridas en
ratas Sprague Dawley. Estas
propiedades curativas se atribuyeron principalmente a los taninos presentes en
el mango (Nuevo y Bernardino, 2013).
Para reducir el uso de
animales en experimentos médicos, se han desarrollado varios modelos humanos in
vitro que permiten investigar la movilidad celular durante la cicatrización
de heridas. Se ha descrito la movilidad de queratinocitos, melanocitos,
fibroblastos y células endoteliales, ya que son las células residentes
encargadas de restaurar las principales características estructurales de la piel (Hofmann y col., 2023). El interés en los
fibroblastos como modelo de migración
celular, se debe a que estos pueden proporcionar un método para evaluar
la cicatrización de heridas (Grupta y col., 2022).
En los últimos años,
el papel de las proteínas de mango ha llamado la atención, no sólo desde el punto de vista alergénico, sino
también porque tienen un posible efecto sobre la viabilidad celular
(Herbert-Doctor y col., 2017). Hasta ahora, no queda claro el papel de las
proteínas del mango en los mecanismos de migración y proliferación necesarios
para la curación de heridas.
El
objetivo de este estudio fue evaluar el efecto cicatrizante
de las proteínas de mango en un modelo de herida-cicatriz en fibroblastos humanos.
MATERIALES Y MÉTODOS
Materia prima
Los frutos de mango (Mangifera indica var.
manila) fueron recolectados en estado de madurez
fisiológica en la población de Jalcomulco, Veracruz, México, durante los
meses de junio y julio de 2020. La fruta fue separada de la cáscara para
obtener el extracto proteico a partir de la pulpa.
Obtención de los
extractos proteicos
Se obtuvieron los
extractos proteicos conforme a las
especificaciones de Zhou y col. (2016) con las siguientes
modificaciones. La pulpa de mango fue fragmentada y congelada en nitrógeno líquido y disgregada mecánicamente hasta
su completa pulverización. Se pesaron 2.5 g del mango pulverizado y se adicionaron
25 mL de Tris-HCL 0.5M (pH 7.2), agentes desnaturalizantes como el dodecil
sulfato de sodio (SDS, por sus siglas en inglés: sodium
sulfate dodecyl) al 1 % y agentes reductores como el b-mercaptoetanol al 0.5 % para la lisis de la matriz alimentaria y la obtención de las proteínas por
agitación, y posterior centrifugación
a 18 560 xg (Sorvall Super
T21, USA) durante 30 min.
Las proteínas fueron
obtenidas del sobrenadante usando
metanol-cloroformo, mezclándose hasta su completa disolución.
Posteriormente, fueron centrifugadas a 2 016 xg por 6
min. Después, las proteínas fueron mezcladas con acetona fría 1:2 para inducir
su precipitación y centrifugadas a 2 016 xg por 6 min,
decántandose y volviéndose a precipitar hasta que los
residuos de acetona se eliminaron. Las proteínas fueron resuspendidas
en 1 mL de amortiguador de fosfatos (PBS, por sus
siglas en inglés: phosphate-buffered saline) y
almacenadas a -20°C. Se cuantificaron, empleando el método de Bradford. La electroforesis
en gel de poliacrilamida (PAGE, por sus siglas en inglés: Polyacrylamide Gel Electrophoresis)
y SDS, fue realizada para su identificación, utilizando 10 mg/mL de proteínas
disueltas en amortiguador Laemmli, el cual contiene
SDS y b-mercaptoetanol, que se unen a las
proteínas y rompen los enlaces no covalentes que
mantiene su estructura tridimensional, con lo cual se logra una mayor
separación de las proteínas de acuerdo a su peso
molecular. Adicionalmente, se realizó una comparación de proteínas
disueltas en amortiguador Laemmli sin b-mercaptoetanol para comparar la separación de las
proteínas. Con la finalidad de conservar sus
propiedades, los extractos proteicos fueron liofilizados (Labconco, 4.5 L. USA) mediante un proceso de secado por
congelación durante 24 h y cuantificados por el método del ácido bicinconínico (BCA, por sus siglas en inglés: Bicinchoninic Acid). Los
tratamientos para su aplicación en el modelo in vitro se diseñaron de acuerdo a
dosis reportadas previamente de 25 mg/mL, y a partir de esa concentración se realizaron
diluciones seriadas de 2.5 mg/mL y 0.25 mg/mL (Conejero
y col., 2007). Las proteínas se disolvieron en medio de cultivo Eagle
modificado por Dulbecco (DMEM, por sus siglas en inglés: Dulbecco`s
modified eagle medium).
Preparación
de los tratamientos celulares
Se prepararon cuatro
soluciones de trabajo (stock), disolviendo por separado 50 mg de proteínas
liofilizadas en 5 mL de medio de cultivo DMEM, con un
mezclador vortex (Fiznevortex
FinePCR, Daigger, Korea). Para incorporar las proteínas al medio de cultivo e
incrementar su solubilidad, se utilizaron cuatro técnicas: centrifugación,
filtración, mezcla con dimetilsulfóxido (DMSO, por sus siglas en inglés: dimethyl sulfoxide) y concentración a través de columnas de ultrafiltración VivaspinTM
3000MWCO. En la primera técnica, la solución homogenizada se centrifugó a 1.9 xg por 4 min a 4 °C. En la segunda, la solución se filtró
utilizando una membrana (Merck-Millipore) de
0.45 mm. A la tercera solución se le adicionó
0.1 % de DMSO (Sigma-Aldrich) mezclado por
agitación, y posteriormente se filtró en una membrana de 0.45 mm. Por último, la cuarta solución homogenizada se incubó
en baño de agua (Termobaño AR-371D, México) a 37 ºC por 30 min, posteriormente se centrifugó a 5.8 xg por 6 min a 4 °C, obteniéndose el sobrenadante, el cual
se filtró en una membrana y después se depositó en una columna de ultrafiltración VivaspinTM
3000MWCO, centrifugándose a 13 257 xg durante
20 min a 4 °C. De las cuatro soluciones se
recuperó el sobrenadante para la cuantificación de proteínas por BCA.
Cultivo celular
Se
obtuvieron fibroblastos de piel humana, provenientes de tres
pacientes del banco de criopreservación (-195.8 °C)
del Instituto Nacional de Rehabilitación Luis Guillermo Ibarra Ibarra (INR-LGII) de la Ciudad de México, México. Estas
células fueron obtenidas de remanentes de cirugías de abdominoplastia de
pacientes que firmaron un consentimiento informado para su inclusión antes de
participar en el estudio, el cual, fue conducido de conformidad con la
Declaración de Helsinki, y el protocolo fue aprobado por el Comité de Ética
CONBIOETICA-09-CEI-031-201711207 (Identificación del proyecto 78/15) del
INR-LGII.
Los fibroblastos
fueron descongelados en primer pase (primera etapa en donde crecen los
fibroblastos en medio de cultivo) y expandidos con DMEM conteniendo 10 % de
suero fetal bovino (FBS, por sus siglas en inglés: fetal bovine serum) y 1 % antibiótico-antimicótico
(penicilina-estreptomicina PE, Gibco). El medio de
cultivo fue reemplazado con medio fresco cada tercer día hasta que las células
alcanzaron una confluencia de 80 % a 90 % en el frasco de cultivo.
Ensayo de viabilidad
celular
En
una placa de 24 pozos, se colocaron 35 000 células por pozo con medio DMEM
con 10 % FBS y 1 % PE. Las células se cultivaron
durante 24 h y posteriormente se retiró el medio de cultivo, agregándole
medio DMEM al 2 % de FBS conteniendo las diferentes dosis de
proteínas de mango (25 mg/mL, 2.5 mg/mL y 0.25 mg/mL). Las células
fueron estimuladas durante 24 h para determinar los efectos tóxicos inducidos
por las proteínas de mango, a través de la identificación de cambios
morfológicos en las células mediante microscopía de campo claro y la técnica de
Flick y Gifford (1984), que
incorpora el colorante cristal violeta para cuantificar las células vivas. Se
utilizó un grupo de células control (células sin proteínas). A las células se
les retiró el medio de cultivo y los tratamientos mediante lavados con PBS y se
fijaron usando glutaraldehído al 2.5 % (Hycel); la
tinción se realizó con cristal violeta al 0.1 % (Sigma-Aldrich). Se
documentaron los cambios morfológicos a través de fotografías, con un
microscopio EVOS FL (modelo L1113-178C-173, Thermo Scientific, W. A., United States). La absorbancia se cuantificó a 595 nm en un lector
de microplacas Biorad Mark (10176) Japan. Las absorbancias se normalizaron al % de viabilidad celular de las células control, de
las cuales 100 % se consideraron viables (Krebs y col., 2018).
Ensayo herida-cicatriz
Se realizaron ensayos
herida-cicatriz utilizando placas de cultivo de 6 pozos conteniendo 150 000
fibroblastos por pozo, los cuales fueron
cultivados, y al alcanzar 80 % de confluencia, estos fueron pretratados
con 10 mg/mL de mitomicina
C (Sigma-Aldrich) por 4 h para descartar la influencia de la proliferación celular en el cierre de la herida. Se llevaron a
cabo estudios adicionales sin el uso de mitomicina
C.
Se realizó un raspado
por la mitad de la superficie del pozo utilizando una punta estéril de 1 000 mL. Las células despegadas por el daño mecánico fueron
retiradas y se colocaron las distintas concentraciones experimentales de
proteínas de mango disueltas en DMEM al 2 % de FBS, 1 % PE. Las células tratadas
se compararon contra un control (células con herida, tratadas con medio de cultivo sin proteínas de mango). A las 24 h se
llevó a cabo la fijación de las células y su tinción con la técnica de Cristal
Violeta en todas las muestras, antes de fotografiarlas en campo claro con un microscopio EVOS FL (modelo L1113-178C-173, Thermo
Scientific, W. A. United States). Se realizaron ensayos adicionales de
cicatrización para evaluar el cierre de la herida a 24 y 48 horas mediante
registro fotográfico en células vivas, sin fijación ni tinción. Las imágenes se obtuvieron en campo claro con el mismo
equipo y se integraron en una figura comparativa, optimizada digitalmente para
mejorar la nitidez y facilitar la evaluación morfológica. La distancia de la
migración celular entre los bordes del área dañada mecánicamente de la monocapa
se calculó utilizando el software EVOS® FL and FL color Cell Imaging Systems v.1.4 Rev 26059 (Grada y col., 2017).
La adquisición de
datos consistió en dividir la herida en tres segmentos: superior, medio e
inferior. Se realizaron al menos tres mediciones de la distancia entre los
bordes de las tres áreas y se calculó la media. Para determinar el porcentaje
(%) de contracción de la herida se aplicó la
siguiente fórmula a las 24 h y 48 h (Sushanth
y col., 2016).

Análisis estadístico
Los resultados de la
viabilidad celular y de la contracción de la herida fueron expresados como la
media aritmética de tres repeticiones provenientes de tres experimentos
independientes ± el error estándar (ES). La significancia estadística de la viabilidad se determinó realizando un
análisis de varianza (ANOVA) de una vía con un intervalo de confianza del 95 %,
seguido de un análisis post-hoc de Tukey, con nivel de a < 0.05. En la variable contracción de la herida, los datos fueron expresados como la media ± ES. Se evaluó la diferencia
de las micras de la lesión entre los tratamientos a lo largo de 0 h, 24 h y 48
h mediante la prueba de ANOVA de 2 vías de medidas repetidas. En caso de
detectar significancia en los efectos principales, se reprogramó el análisis
utilizando un ANOVA de una vía de medidas repetidas para el adecuado cálculo de
los estadísticos. Las comparaciones múltiples se realizaron mediante la prueba
de Bonferron. El programa estadístico utilizado fue Graph Pad Prisma versión 8.2.1.
RESULTADOS
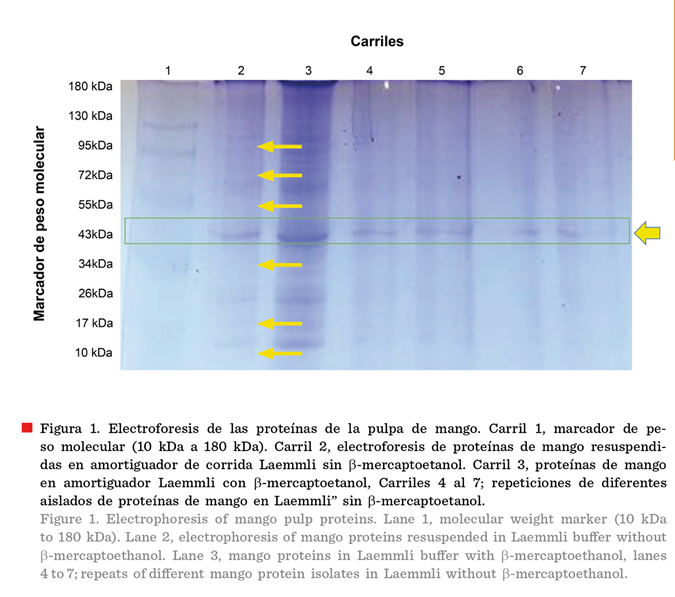
Caracterización
del extracto proteico de mango
La muestra de pulpa de
Mangifera indica analizada por
electroforesis, tenía una concentración de
proteínas de 10 mg/mL, y mostró 7 bandas de
proteínas, las cuales correspondieron a pesos moleculares de 10 kDa, 17 kDa, 30 kDa, 40 kDa, 55 kDa, 72 kDa y 95 kDa, con base en el
marcador de peso molecular (Figura 1: carril
1). La banda de proteínas de 40 kDa mostró
mayor intensidad en todos los carriles. Se observó una mayor cantidad de
fracciones proteicas cuando la muestra se disolvió en el amortiguador Laemmli conteniendo b-mercaptoetanol (carril 3), que sin b-mercaptoetanol, ya que
existe menor cantidad de fracciones proteicas, no obstante, la banda
correspondiente a 40 kDa se identificó (Figura 1: carriles 2, 4, 5, 6 y 7).
Efecto del extracto de
proteínas de mango en la viabilidad celular
Los ensayos de
viabilidad no mostraron cambios morfológicos en los fibroblastos por efecto de
los diferentes tratamientos con respecto al control, todos presentaban una
morfología típica fusiforme y un índice alto de mitosis, comportamiento
indicativo de no haber sufrido un efecto citotóxico al ser expuestos a las
proteínas de mango (Patil y col., 2020).
Se observó un mayor
porcentaje de viabilidad con las técnicas de centrifugación y filtración (Tabla
1), probablemente porque estos procedimientos retienen las proteínas de bajo
peso molecular, como las lectinas, la cuales son mitogénicas
permitiendo una mayor proliferación, y por
lo tanto un porcentaje mayor de viabilidad (Fujii y col., 2024). Los fibroblastos de piel que estimularon con proteínas
que se obtuvieron por centrifugación, mostraron
un incremento en la viabilidad que varió de 15.40 % a 25.10 % por efecto
de las diferentes concentraciones proteicas,
comparado con el control. En el caso de la estimulación
de fibroblastos con proteínas de
mango obtenidas a través de la filtración, el incremento varió de 19.70 % a 35.45 %, comparado con el grupo
de células control.
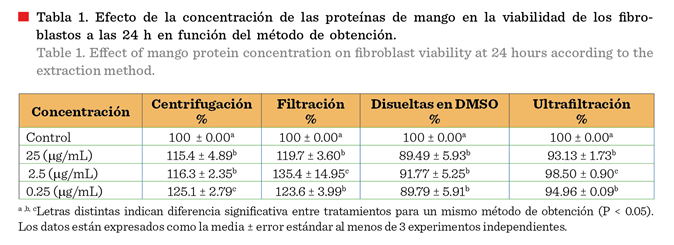
En contraste, las
técnicas de obtención de proteínas utilizando DMSO y ultrafiltración indujeron
un leve decremento en el porcentaje de viabilidad celular, probablemente
asociado al DMSO y a la temperatura de incubación en el baño de agua, las
cuales pueden desnaturalizar y agregar las proteínas de bajo peso molecular
(Pal y col., 2012), en tanto que la ultrafiltración podría impedir el paso de
algunas proteínas de interés (Greening y Simpson,
2010). Sin embargo, el porcentaje de
viabilidad fue superior al 50 % en ambos casos, lo que se considera aceptable
(Wei y col., 2020). En los cultivos con las proteínas disueltas en DMSO, el
decremento varió de 8.23 % a 10.51 %. En las
proteínas que se obtuvieron por
ultrafiltración, el decremento varió
de 1.5 % a 6.87 % (Tabla 1). Basados en estos resultados, se utilizó el
tratamiento de proteínas de mango por centrifugación para los ensayos de
migración.
Efecto de las
proteínas de mango sobre la migración celular de fibroblastos
En la Figura 2 se
muestran los tratamientos en los que las células recibieron tratamiento previo
con mitomicina C, que es un agente antineoplásico y antiproliferativo que reduce la formación de colágeno por
los fibroblastos e impide la duplicación celular (Chen y col., 2006). El cultivo control presentó a las 24 h una tasa de cierre de herida de 25.78 %. En
las muestras expuestas a proteínas de mango, el tratamiento de 2.5 mg/mL mostró el mayor
porcentaje de cierre de herida (21.62 %), en comparación con los otros
dos tratamientos: 25 mg/mL (12.00 %) y 0.25 mg/mL (13.65 %); pero ninguno de los tratamientos redujo
significativamente el cierre de herida en comparación con el control.

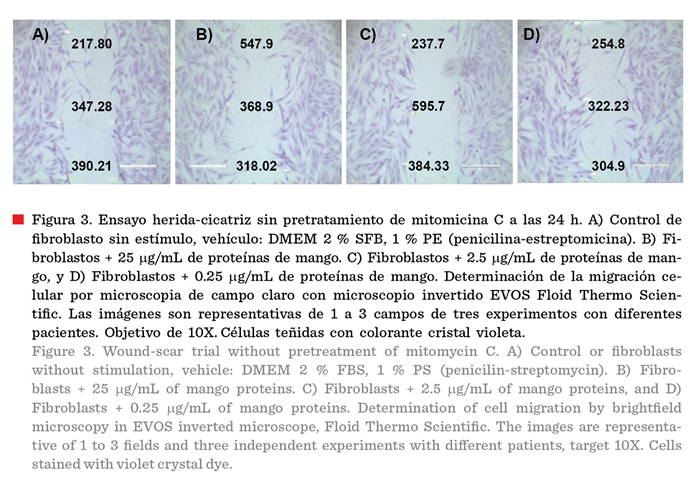
En la Figura 3 se
muestran los fibroblastos que se sometieron a una prueba de raspado de la
herida sin pretratamiento con mitomicina C. El
tratamiento control mostró a las 24 h, un cierre de la herida del 22.15 %. En
las células expuestas a proteínas de mango el cierre de herida varió de 6.29 %
a 13.76 %.
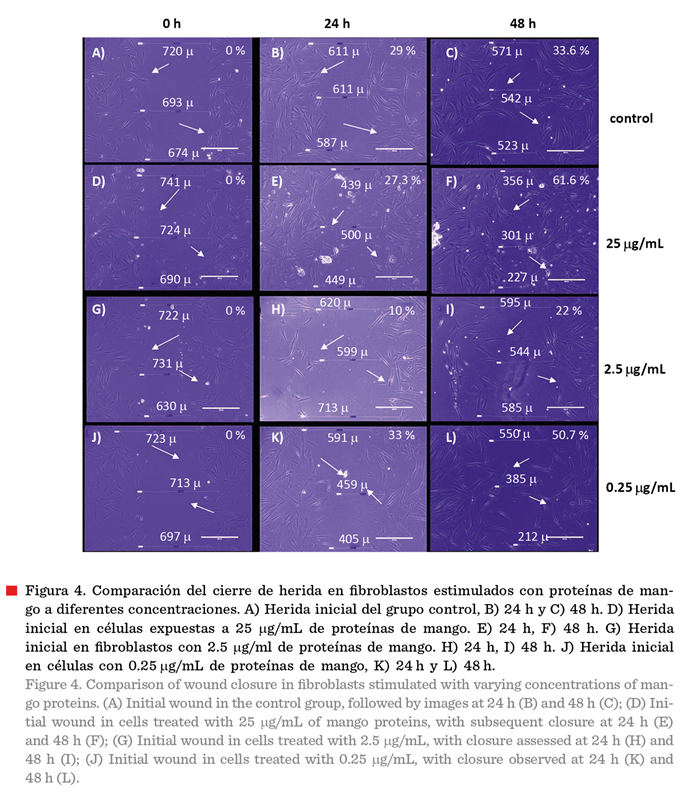
La
Figura 4 muestra el cierre de herida de manera inmediata a la
realización de la herida (0 h) a las 24 h y 48 h, de los fibroblastos pretratados
con mitomicina C. Las muestras control presentaron 29 % de
cierre de herida a las 24 h (Figura 4B) y de
33.6 % a las 48 h (Figura 4C). Las células expuestas a una concentración de 0.25 mg/mL
mostraron la mayor tasa de cierre de herida (33 %) a las 24 h (Figuras 4J) y alcanzaron un 50.7 % a las 48 h
(Figura 4L). La muestra con 2.5 mg/mL mostró
la mayor tasa de cierre (61.6 %) a las 48 horas (Figura 4F).
Análisis de la
longitud de la herida en fibroblastos expuestos a proteínas de mango
El % de cierre a las
24 horas (Figura 5) fue significativamente mayor en la muestra con 0.25 mg/ml (38.06 %) indicando un mayor efecto
respecto al control (27.11 %) y los otros dos tratamientos. Este porcentaje de
cierre correspondió a una longitud de herida menor para la muestra tratada (535.0 ± 51.9 mm) con relación al
control (526.33 ± 7.9 mm). Dicho comportamiento concordó con la tendencia hacia
una mayor migración celular presente en los cultivos que fueron estimulados con la concentración de 0.25 mg/mL durante 24 h. La longitud de la herida fue más
corta a las 48 h en todos las muestras, sin evidencia de una diferencia
significativa por efecto de los tratamientos.

DISCUSIÓN
Caracterización
del extracto proteico de mango
El
patrón electroforético de las proteínas que se identificaron en el presente
trabajo coincide con estudios previos de pulpa de mango. Herbert-Doctor y col. (2017) reportaron bandas de 250 kDa,
149 kDa, 75 kDa, 54 kDa, 24 kDa, 18 kDa y 15 kDa. Así mismo,
documentaron la presencia de bandas alrededor de 15 kDa,
30 kDa y 50 kDa. La banda
de proteína alrededor de 30 kDa se ha atribuido a la
actividad de las lectinas. Otros autores registraron bandas con peso molecular
de 14 kDa, 16 kDa, 20 kDa, 25 kDa, 27 kDa, 30 kDa, 37 kDa, 40 kDa, 43 kDa, 50 kDa, 60 kDa y 70 kDa (Zhou y col., 2016). En donde la banda de 14 kDa pertenece a la familia de las profilinas (Wu y
col., 2024). Algunas proteínas como Man i1 (40 kDa) y
Man i2 (30 kDa) han sido identificadas como los
principales alérgenos (Tsai y col., 2021), aunque la
Man i1 de 40 kDa corresponde a la familia de
gliceraldehido 3 fosfato deshidrogenasa (GAPDH), la cual está presente tanto en
el reino animal como vegetal, por esto, es
clasificada como una proteína multifuncional (Kopeckova
y col., 2020).
Efecto del extracto de
proteínas de mango en la viabilidad celular
Los resultados
obtenidos indican que las proteínas aisladas de la pulpa de mango no fueron
citotóxicas en ninguna de las dosis evaluadas, no afectaron la viabilidad de
los fibroblastos, e incluso, en dosis altas, se identificó una tendencia a una
mayor proliferación. Estos hallazgos difieren de lo reportado por
Herbert-Doctor y col. (2017), quienes determinaron que el extracto de proteínas de mango
presentó, además de un efecto proliferativo un efecto citotóxico, aunque
evaluaron la proliferación utilizando
concentraciones más bajas que las de
este trabajo (0.771 mg/mL y 0.076 mg/mL). También reportaron que, altas concentraciones (3 804 mg/mL) y tiempos de exposición cortos mostraron un efecto citotóxico, a través de la activación de apoptosis y para
tiempos de estimulación prolongados necrosis.
Efecto
de las proteínas de mango sobre la migración celular de fibroblastos
Las proteínas se han
estudiado tradicionalmente en términos de función nutricional o como alergenos
(Zhou y col., 2016; Rajasekaran y Soundarapadian,
2023; Wu y col., 2024), pero estudiarlas por
su efecto cicatrizante es reciente. Varias partes del árbol de mango han
sido usadas para curar o tratar diversas condiciones, incluyendo las heridas (Suhatri y col., 2022),
debido a que esta planta tiene propiedades
antiinflamatorias, antioxidantes y antibacterianas, entre otras (Rajasekaran y Soundarapandian.,
2023). Dichas propiedades pueden ser atribuidas al contenido de compuestos
fitoquímicos, tales como polifenoles, terpernos, taninos, esteroles y carotenos (Quintana y col., 2021; Kumar y
col., 2021; Suhatri y col., 2022).
En
otro estudio, Pithayanukul y col. (2009) evaluaron
el extracto etanólico de la semilla de mango, las
cuales mostraron un efecto inhibitorio en la
actividad caseinolítica y fibrinogenolítica
del veneno de serpiente en necrosis tisular in vitro. Ellos también
reportaron que el extracto de mango podría inhibir la actividad de
metaloproteasas.
En cuanto a la
migración celular, los resultados del estudio mostraron que las proteínas de la
pulpa tienden a movilizar los fibroblastos en el cierre de la herida, con la
concentración de 0.25 mg/mL mostrando el mejor
resultado a las 48 h y favoreciendo la migración
moderadamente (Espinosa-Espinosa y col., 2022). Los resultados con la dosis más pequeña, sugieren que a
esta concentración las proteínas son más solubles y fueron difundidas con mayor
facilidad a las células, aunque faltan
realizar estudios que corroboren este mecanismo.
Uno de los mecanismos
para llevar a cabo la movilización de los fibroblastos en la herida, podría ser
a través de la formación de los filamentos de actina, los cuales son necesarios
para la reestructuración del citoesqueleto y la formación de filopodios y lamelopodios que permiten a la célula moverse de un lugar a
otro, un paso fundamental en la cicatrización de las heridas. Algunas proteínas
tipo profilinas, encontradas en alimentos como el maíz, han reportado utilizar
este mecanismo de migración (Gibbon y col., 1997). En este estudio, la proteína
de 40 kDa, presente en el extracto proteico,
probablemente tiene actividad GAPDH (Gliceraldehído-3-fosfato deshidrogenasa),
lo que le permitiría interactuar con proteínas de la matriz extracelular (ECM,
por sus siglas en inglés: extracellular matrix proteins) favoreciendo la
adhesión de la fibronectina con la región
transmembrana de integrina a través de receptores a y b. A través de
este proceso, la cascada de señalización intracelular es activada causando un
cambio en los filamentos de actina y miosina, por lo tanto, es necesario un
reordenamiento del citoesqueleto de los fibroblastos para llevar a cabo la
proliferación y migración (Tristan y col., 2011; Kopeckova y col., 2020),
no obstante, una limitación del estudio fue la caracterización estructural de las
fracciones proteicas.
Anteriormente GAPDH
era considerada una proteína cuya función principal era la glicólisis. Sin
embargo, se ha demostrado que participa en muchos procesos celulares, como la
reparación del DNA, la exportación del RNA de transferencia, la fusión de
membranas y transporte; también participa en la dinámica del citoesqueleto, así
como en la muerte celular. Su actividad va a depender del estado de
oligomerización y modificaciones post-traduccionales.
GAPDH se localiza a nivel celular, ya sea en el citoplasma, vesículas,
mitocondria, núcleo y membrana celular (Tristan y
col., 2011). Cuando se localiza en la membrana sirve como receptor de los
componentes de la ECM como la fibronectina, lamininas, fibrinógeno y
plasminógeno (Kopeckova y col., 2020). Esto permite
que se adhiera a las células interactuando
con lisozimas, proteínas del citoesqueleto (actina y miosina),
fibronectina, vitronectina y plasminógeno (Wang y col., 2021). Cuando
el GAPDH se localiza en el citoplasma, participa en la formación de
microtúbulos debido a que interactúa con la tubulina y actina, promoviendo la
polimerización de la actina (Tristan y col., 2011).
Durante las etapas del proceso de cicatrización de heridas, los tejidos están
en constante remodelación finalizando con el cierre de la herida (Tristan y col., 2011;
Huerta y col., 2023) a través de la re-epitelización (Huerta y col., 2023).
Otra vía que pudiera
estarse modulando a través de las proteínas del mango, es la activación de
proteínas reguladoras de la familia Rho GTPasas, RhoA, Rac1 y Cdc42. Estas proteínas dirigen y regulan
diversos procesos celulares como la citocinesis, la adhesión y la motilidad.
Las GTPasas actúan como interruptores moleculares y
activan la remodelación del citoesqueleto. Dicho proceso se lleva a cabo
mediante la polimerización de actina y la formación de lamelipodios (Fu y col.,
2022). La formación de estas estructuras requiere de factores que promuevan la
nucleación, tales como, WAVE, WASP, WASH,
WHAM y JMY, que activan el complejo Arp2/3, el cual es el responsable de
la polimerización de actina, de la nucleación (Zheng y col., 2023) y de guiar
la polaridad de la célula para el cierre de la herida (Fu y col., 2022).
Suraneni y col.
(2012) demostraron la importancia del complejo Arp2/3 en una línea celular de
fibroblastos que tenía inhibido el gen Arpc3
(subunidad 3 del complejo Arp2/3). Cuando lo compararon con fibroblastos
normales que expresaban Arpc3 en un ensayo de cicatrización de herida,
observaron que, en fibroblastos, sin la inhibición del gen, la herida se cerró
a las 30 h. Por otro lado, en fibroblastos, con inhibición del gen, el cierre
de herida se retrasó; las células no lograron extender los lamelipodios, pero
generaron pequeños bordes como propulsiones en las membranas. Resulta
interesante valorar el impacto de las proteínas de mango en estas vías. A la
fecha, lo que se conoce es el potencial cicatrizante de un extracto acuoso de
hojas de mango en un modelo in vivo con ratones blancos machos (Mus musculus), en el cual se demostró que la contracción de
la herida fue mayor en los animales tratados con este extracto (Suhatri y col., 2022). En otro estudio del extracto crudo
de hojas de mango, los autores reportaron que los componentes fitoquímicos como
los taninos promueven el cierre de herida en un modelo de ratas de la cepa Rattus norvegious
(Nuevo y Bernardino, 2013). De la misma manera, se documentó que la combinación
de miel y un extracto de pulpa de mango pulverizado influyeron en el cierre de
la herida en un modelo in vivo utilizando ratones de Swiss. Este estudio
demostró que el 100 % de cierre de la herida ocurrió después de 10 d (Sushanth y col., 2016).
En el caso de las
proteínas de la pulpa de mango evaluadas en este estudio, mostraron un efecto
moderado sobre la migración de fibroblastos
en el cierre de herida. Por lo tanto, se sugiere realizar más estudios
para verificar si las proteínas de mango ejercen un efecto citoprotector frente
a mecanismos de daño en la piel. También, es conveniente caracterizar las
diferentes proteínas involucradas usando técnicas como gel bidimensional y
espectrofotometría de masas, con la finalidad
de identificar su estructura, así como, realizar el análisis informático
de las mismas. De esta manera será posible en un futuro su síntesis con fines
farmacológicos (Delahunty y Yates, 2005; López-Macay
y col., 2024).
CONCLUSIONES
Las proteínas de mango
no mostraron un efecto citotóxico en los cultivos celulares, a las
concentraciones empleadas, independientemente del método de preparación. Las
técnicas de obtención mediante centrifugación y filtración indujeron un
porcentaje mayor de viabilidad con respecto al control, asociado probablemente
con una mayor retención de proteínas de bajo
peso molecular, como las lectinas, las cuales son mitógenicas,
permitiendo una mayor proliferación. Las técnicas de mezclado con DMSO y la de
ultrafiltración se asociaron con la disminución de la viabilidad celular. Las
proteínas de mango favorecieron moderadamente la migración celular y se evidenció una disminución en la longitud
de la herida, principalmente a las 24 h, por lo que sería recomendable realizar
más estudios para establecer la concentración óptima para inducir la máxima
eficiencia de cicatrización sin mostrar efecto citotóxico.
Agradecimientos
Los autores agradecen
a Roberto Sánchez Sánchez por el soporte técnico para
el análisis celular de este estudio y la donación de los fibroblastos humanos.
Asimismo, a Liliana Ivonne Betancourt Trevedhan y
Ricardo Tovar Miranda por su apoyo para la extracción proteica.
DECLARACIÓN DE
INTERESES
Los
autores declararon no tener conflicto de interés alguno.
Referencias
Chen, T., Kunnavatana, S. S., & Koch, R. J. (2006). Effects of
mitomycin-C on normal dermal fibroblasts. The Laryngoscope, 116(4), 514-517.
Conejero,
L., Higaki, Y., Baeza, M. L., Fernández, M.,
Varela-Nieto, I., & Zubeldia, J. M. (2007). Pollen-induced
airway inflammation, hyper-responsiveness and apoptosis in a murine model of allergy.
Clinical & Experimental Allergy, 37(3), 331-338. https://doi.org/10.1111/j.1365-2222.2007.02660.x
Delahunty, C. & Yates III, J. R. (2005). Protein identification using 2d-lc-ms/ms. Methods, 35(3), 248-255. https://doi.org/10.1016/j.ymeth.2004.08.016
Espinosa-Espinosa,
L., Garduño-Siciliano, L., Rodriguez-Canales, M., Hernandez-Portilla, L. B., Canales-Martinez,
M. M., & Rodriguez-Monroy, M. A. (2022). The wound healing effect of mango peel extract on incision wounds in a
murine model. Molecules, 27(1),
259.
Fernández-Guarino,
M., Hernández-Bule, M. L., & Bacci, S. (2023). Cellular and molecular processes in wound healing. Biomedicines,
11(9), 2526.
Flick, D. A. & Gifford, G. E. (1984).
Comparison of in vitro cell cytotoxic assays for tumor necrosis factor. Journal
of Immunological Methods, 68(1-2), 167-175.
Fu, J., Liu, B., Zhang, H., Fu, F., Yang, X., Fan, L., & Zhang, S.
(2022). The role of cell division controls protein
42 in tumor and non-tumor diseases: a systematic
review. Journal of Cancer, 13(3), 800-814. https://doi.org/10.7150/jca.65415
Fujii, Y., Kamata, K., Gerdol, M., Hasan, I., Rajia, S., Kawsar, S. M.,
Padma, S., Chatterjee, B. P., Oh-kawa, M., Ishiwata, R., Yoshimot, S., Yamada,
M., Matsuzaki, N., Yamada, M., Yamamoto, K., Niimi, Y., Miyanishi, N., Konno,
M., ..., & Fujita, H. (2024). Multifunctional Cell Regulation Activities of
the Mussel Lectin SeviL: Induction of
Macrophage Polarization toward the M1 Functional Phenotype. Marine
Drugs, 22(6), 269.
Gibbon, C. B., Ren, H., & Staiger, J. C. (1997). Characterization of
maize (Zea mays) pollen profilin function in vitro and in live cells. Biochemical Journal, 327(3),
909-915.
Grada,
A., Otero-Vinas, M., Prieto-Castrillo, F., Obagi, Z.,
& Falanga, V. (2017). Research
techniques made simple: analysis of collective cell migration using the wound
healing assay. Journal of Investigative Dermatology, 137(2),
e11-e16. https://doi.org/10.1016/J.JID.2016.11.020
Greening, D. W. & Simpson, R. J. (2010). A centrifugal ultrafiltration strategy for isolating the low-molecular
weight (≤ 25 K) component of human plasma proteome. Journal of Proteomics,
73(3), 637-648. https://doi.org/10.1016/j.jprot.2009.09.013.
Gupta,
S., Patel, L., Mitra, K., & Bit, A. (2022). Fibroblast
Derived Skin Wound Healing Modeling on Chip
under the Influence of Micro-Capillary Shear Stress. Micromachines 2022, 13(305), 1-22.
Herbert-Doctor,
L. A., Coutiño-Rodríguez, E. M. R., Palmeros-Sánchez, B., & Sampieri, R. C.
L. (2017). Necrotic and Apoptotic Activity of the
Protein Extract from Mesocarp in Human
Lymphocytes in Culture. ECORFAN-Bolivia Journal, 4(6), 28-47.
Hofmann, E., Fink, J., Pignet, A. L., Schwarz, A., Schellnegger, M.,
Nischwitz, S. P., & Kotzbeck, P. (2023). Human In Vitro Skin Models
for Wound Healing and Wound Healing Disorders. Biomedicines, 11(4),
1056. https://doi.org/10.3390/biomedicines11041056
Huerta,
M., Franco-Serrano, L., Amela, I., Perez-Pons, J. A., Piñol, J., Mozo-Villarías,
A., & Cedano, J. (2023). Role of moonlighting proteins in
disease: analyzing the contribution of canonical and moon-lighting functions in disease progression. Cells,
12(2), 235.
Kopeckova, M., Pavkova, I., & Stulik, J. (2020). Diverse localization
and protein binding abilities of glyceraldehyde-3-phosphate dehydrogenase in
pathogenic bacteria: the key to its multifunctiona-lity. Frontiers in
Cellular and Infection Microbiology, 10(89), 1-7. https://doi.org/10.3389/fcimb.2020.00089
Krebs, A., Nyffeler, J., Rahnenführer, J., & Leist, M. (2018). Normalization of
data for viability and
relative cell function
curves. Alternatives to Animal Experimentation:
ALTEX, 35, 268-271. https://doi.org/10.14573/1803231
Kumar,
M., Saurabh, V., Tomar, M., Hasan, M., Changan, S., Sasi, M., & Mekhemar, M.
(2021). Mango (Mangifera indica L.) leaves: Nutritional composition, phytochemical profile, and health-promoting bioactivities. Antioxidants,
10(2), 299.
Lenucci, M. S., Tornese, R., Mita, G., &
Durante, M. (2022). Bioactive compounds and antioxidant
activities in different fractions of mango fruits (Mangifera indica L.,
cultivar Tommy Atkins and Keitt). Antioxidants, 11(3), 484: 1-21. https://doi.org/10.3390/antiox11030484
Lin, P., Zhang, G., & Li, H. (2023). The Role of Extracellular Matrix
in Wound Healing. Dermatologic Surgery, 49(5S), S41-S48.
López-Macay, A., Montes-Sánchez, D., Narváez-Morales, J.,
Salas-Paniagua, M., Barrios-Aguilar, S., Zamudio-Cuevas, Y., Fernández-Torres,
J. y Martínez, K. (2024). Explorando algunas técnicas proteómicas: Western blot, Dot blot y electroforesis bidimensional
complementada con espectrometría de masas. Investigación en Discapacidad,
10(3), 187-202.
Marquínez,
E. Y. L., Ortega, J. G., Morán, J. M., Campana, W. N. y Figueroa, T. F. (2023).
Situación actual y perspectivas del cultivo de mango (Mangifera
indica l.) en el Sur de Manabi, Ecuador. Revista
UNESUM-Ciencias, 7(1), 156-172.
Nuevo, J.
J. M. & Bernardino, E. R. K. (2013). The effect of
Mangifera indica (Mango) leaf crude extract
in the wound healing properties of Rattus norvegicus (Sprague Dawley). Fatima
University Research Journal, 5(1), 1-1.
Ousey, K., Chadwick, P., Jawień, A., Tariq, G., Nair, H. K. R.,
Lázaro-Martínez, J. L., & Moore, Z. (2018). Identifying and treating foot ulcers in patients with diabetes:
saving feet, legs and lives. Journal of Wound Care, 27(Sup5), S1-S52. https://doi.org/10.12968/jowc.2018.27.Sup5.S1
Patil, R., Kale, A. D., Mane, D. R., & Patil, D. (2020). Isolation,
culture and characterization of primary cell lines of human buccal mucosal
fibroblasts: A combination of explant enzamytic technique. Journal of Oral
and Maxillofacial Pathology, 24(1), 68-75. https://doi.org/10.4103/jomfp.JOMFP_282_19
Pal, R., Mamidi, M. K., Das, A. K., & Bhonde,
R. (2012). Diverse effects of dimethyl sulfoxide
(DMSO) on the differentiation potential of human embryonic stem cells. Archives of Toxicology, 86,
651-661
Pithayanukul, P., Leanpolchareanchai, J., & Saparpakorn, P. (2009). Molecular docking studies and anti−snake
venom metalloproteinase activity of Thai mango seed kernel extract. Molecules, 14(9), 3198-3213. https://doi.org/10.3390/molecules14093198
Punjataewakupt, A., Napavichayanun, S., & Aramwit,
P. (2019). The downside of antimicrobial agents for wound healing. European Journal of
Clinical Microbiology & Infectious Diseases, 38,
39-54.
Quintana,
S. E., Salas, S., & García-Zapateiro, L. A.
(2021). Bioactive compounds of mango (Mangifera indica): A review
of extraction technologies and chemical constituents. Journal of the Science
of Food and Agriculture, 101(15), 6186-6192. https://doi.org/10.1002/jsfa.1145
Rajasekaran, A. & Soundarapandian,
S. (2023). Nutritional and medicinal values of Mangifera
indica L. fruit. Trends
in Horticulture, 6(2), 1-12. https://doi.org/10.24294/th.v6i2.2949
Raziyeva, K., Kim, Y., Zharkinbekov, Z., Kassymbek, K., Jimi, S., &
Saparov, A. (2021). Immunology of acute and chronic wound healing. Biomolecules,
11(5), 1-25. https://doi.org/10.3390/biom11050700
Shah, K. A., Patel, M. B.,
Patel, R. J., & Parmar, P. K. (2010). Mangifera indica (mango). Pharmacognosy
Reviews, 4(7), 42-48. https://doi.org/10.4103/0973-7847.65325
Suhatri, S., Fidiyani,
D., Azzahra, N., & Suardi,
M. (2022). Effectiveness of Mango Leaf Extract (Mangifera
indica L) on Healing of Second Level Cut Wound in Male White Mice (Mus
musculus). Journal Kesehatan Terapan, 9(2), 7-12. https://doi.org/10.54816/jk.v9i2.520
Suraneni, P., Rubinstein, B., Unruh, J. R., Durnin, M., Hanein, D., &
Li, R. (2012). The Arp2/3 complex is required for lamellipodia extension and
directional fibroblast cell migration. Journal of Cell Biology, 197(2),
239-251. https://doi.org/10.1083/jcb.201112113
Sushanth, K. A., Lakshmi, K. C., & Reddy, D. S. (2016). Evaluation of
wound healing activity with a new formulation of dry Mangifera indica and honey
using swiss albino mice. Asian Journal of Pharmaceutical and Clinical
Research, 139-142.
Tristan, C., Shahani, N., Sedlak, T.
W., & Sawa, A. (2011). The diverse functions of GAPDH: views from different subcellular compartments. Cellular
Signalling, 23(2), 317-323.
Tsai, W. C., Yin, H. Y., Chen, S. N., Chang, H. C., & Wen, H. W.
(2021). Development of monoclonal antibody-based sandwich ELISA for detecting
major mango allergen Man i1 in processed foods. Journal of Food Safety,
41(2), e12884.
Wang, J., Li, Y., Pan, L., Li, J., Yu, Y., Liu, B., & Xiong, Q. (2021).
Glyceraldehyde-3-phosphate dehydrogenase (GAPDH) moonlights as an adhesin in
Mycoplasma hyorhinis adhesion to epithelial cells as well as a plasminogen receptor mediating extracellular matrix
degradation. Veterinary Research, 52(1), 1-14. https://doi.org/10.1186/s13567-021-00952-8
Wei, F.,
Zhao, L., & Jing, Y. (2020). Mechanisms underlying dimethyl
sulfoxide-induced cellular migration in human
normal hepatic cells. Environmental Toxicology and
Pharmacology, 80, 103489.
Wu, C. C., Lin, C. C., Yin, H. Y., Tsai, W. C., Yang, P. F., Liu, H. J.,
& Wen, H. W. (2024). Rapid detection of mango allergen in processed foods
using an immunomagnetic nanoparticle-based electrochemical immunosensor. Microchemical
Journal, 110070: 1-16.
Zheng, S., Qin, F., Yin, J., Li, D., Huang, Y., Hu, L., & Hu, W.
(2023). Role and mechanism of actin-related protein 2/3 complex signaling in
cancer invasion and metastasis: A review. Medicine, 102(14), 1-8.
Zhou, C., Ludmila, T., Sun, N., Wang, C., Pu, Q., Huang, K., & Che, H.
(2016). BALB/c mice can be used to evaluate allergenicity of different food protein extracts. Food
and Agricultural Immunology,
27(5), 589-603.