https://doi.org/10.29059/cienciauat.v20i1.1979
Mortalidad de ninfas de Bactericera
cockerelli por ingredientes activos químicos potencializados con
nanopartículas de grafito
Mortality of Bactericera Cockerelli
nymphs by active chemical ingredients enhanced with graphite nanoparticles
Control de Bactericera con
nanogafito-insecticidas
Alberto Roque-Enriquez,
Rocío de Jesús Díaz-Aguilar, Yisa María Ochoa-Fuentes, Ernesto Cerna-Chávez*
*Correspondencia:
jabaly1@yahoo.com/Fecha de recepción: 10 de enero de 2025/Fecha de aceptación:
8 de abril de 2025/Fecha de publicación: 10 de abril de 2025.
Universidad Autónoma Agraria Antonio
Narro, Departamento de Parasitología, Calzada Narro núm. 1923, Buenavista,
Saltillo, Coahuila, México. C.P. 25315.
RESUMEN
El insecto Bactericera cockerelli es
una de las plagas más importantes en México en cultivos de solanáceas. Su
control y manejo regularmente es mediante
ingredientes activos químicos. Actualmente, en la agricultura, se busca
mejorar la eficiencia de los insecticidas logrando un bajo impacto ambiental,
pero con alta efectividad. El objetivo de la presente investigación fue evaluar
la mortalidad de ninfas de B. cockerelli, mediante bioensayos in
vitro, con ingredientes activos químicos mezclados con nanopartículas de
grafito. Los bioensayos se realizaron bajo condiciones de laboratorio, donde se
evaluó el efecto de los insecticidas
imidacloprid, lambda cyalotrina y dimetoato, solos y combinados con
nanografito, contra ninfas del insecto B. cockerelli. Las CL50 de las
combinaciones imidacloprid-nanografito, lambda cyalotrina-nanografito y
dimetoato-nanografito fueron de 1.96 mg/L, 13.85 mg/L y 57.31 mg/L,
respectivamente, alcanzando mortalidades por encima del 90 % en todos los
insecticidas. Las CL50 de los ingredientes activos solos fueron de 103.07 mg/L, 285.52 mg/L y 492.35 mg/L, para los
mismos insecticidas. Las nanopartículas de
grafito potenciaron 52.34, 20.60 y
8.59 veces, el efecto letal respecto a los productos solos. La combinación de
insecticidas con nanopartículas de grafito,
mostró una alta efectividad en las
mortalidades contra las ninfas de B. cockerelli, en comparación con los productos solos, por lo que
representan una alternativa de control prometedora al reducir las dosis de
aplicación.
PALABRAS CLAVE: potenciación,
nanoformulados, paratrioza, pesticidas, sinergia.
ABSTRACT
Bactericera
cockerelli is one of the most important pests in Mexico in solanaceous crops. Their control and
management are typically achieved through chemical active ingredients.
Currently, in agriculture, efforts are being made to improve the efficiency of insecticides achieving low
environmental impact and high effectiveness.
The objective of this research was to evaluate the mortality of B.
cockerelli nymphs using in vitro bioassays with chemical active
ingredients mixed with graphite nanoparticles. The bioassays were conducted
under laboratory conditions, where the effect of three insecticides:
imidacloprid, lambda cyalothrin, and dimethoate, alone and in combination with
nanographite, against B. cockerelli nymphs was evaluated. The LC50 of
the imidacloprid-nanographite, lambda cyalothrin-nanographite, and dimethoate-nanographite combinations were 1.96
mg/L, 13.85 mg/L, and 57.31 mg/L, respectively,
achieving mortality rates above 90 % for all insecticides. The LC50 of
the active ingredients alone were 103.07 mg/L, 285.52 mg/L, and 492.35 mg/L for
the same insecticides. The graphite nanoparticles enhanced the lethal
effect 52.34, 20.60, and 8.59 times more than the products alone. The
combination of insecticides with graphite nanoparticles showed high
effectiveness in mortality against B. cockerelli nymphs, compared to the
products alone, and represents a promising
control alternative by reducing application rates.
KEYWORDS: potentiation,
nanoformulations, paratrioza,
pesticides, synergy.

INTRODUCCIÓN
El insecto B. cockerelli (Sulc)
(Hemíptera: Triozidae), conocido comúnmente como paratrioza, pulgón saltador o
salerillo, es una plaga que a lo largo de los años sigue generando daños importantes en los cultivos de solanáceas en
el mundo (Butler y Trumble, 2012; Villegas-Rodríguez y col., 2014; Tucuch-Haas
y col., 2020). La enfermedad del “amarillamiento del psílido” se relaciona
históricamente al insecto B. cockerelli, y es causada al inyectar una
toxina al floema de la planta a través de su saliva, como parte de su forma de
alimentación, desde el estadio de ninfa hasta la etapa de adulto, lo que genera
la infección; provocando aborto floral,
clorosis, retraso de crecimiento, y en algunos casos muerte de la
planta. Es vinculado como vector de la bacteria Candidatus Liberibacter solanacearum
que daña severamente cultivos de solanáceas
(Liu y Trumble, 2006; Munyaneza, 2013;
Olaniyan y col., 2020; Rivera-Martínez y col., 2020).
En México, este psílido se asocia a
grandes pérdidas económicas en producción de solanáceas como papa (Solanum tuberosum L.), tomate (Solanum
lycopersicum L.) y chile (Capsicum spp), siendo la última especie la
preferida del insecto (Ramírez-Dávila y col., 2012; EPPO, 2014; Trujillo-García
y col., 2018), por lo que sus plantas presentan un mayor daño y disminución de
su producción (Lozano-Gutiérrez y col.,
2018). Aun así, el cultivo de chile es
uno de los productos agrícolas de mayor importancia en México, ocupando
entre el segundo y cuarto lugar de producción a nivel mundial (SADER, 2024). A
nivel nacional se producen alrededor de 3 millones 237 000 T, siendo los
principales estados productores Sinaloa con
751 000 T, Chihuahua con 701 000 T y Zacatecas con 480 694 T,
representando un 59.7 % del volumen nacional, de acuerdo al
Servicio de Información Agroalimentaria y
Pesquero (SIAP, 2024).
Los métodos de control para el insecto
carecen de eficiencia, al no considerar las agrupaciones y propagación dentro
de la parcela que permita focalizarlas; los
productos más utilizados por los productores son los insecticidas
químicos, aunque los agricultores detectan que su efectividad no es
satisfactoria, por varios factores, como eficiencia de aplicación, entre otros (Vega-Gutiérrez y col., 2008; Ramírez-Dávila
y col., 2012). Por otro lado, la toxicidad y
presencia en el medio ambiente de los ingredientes activos químicos ha
generado preocupación, ya que aproximadamente, más del 90 % de los insecticidas
formulados que
se comercializan no desempeñan sus efectos
por diferentes circunstancias, como la degradación, volatilización y
lixiviación. Esto conlleva a que los
insecticidas se apliquen en concentraciones más altas para asegurar su
efecto por un periodo idóneo y contrarrestar
las pérdidas (Mogul y col., 1996; Xiang y col., 2014).
El grafito es un material
tridimensional de carbono construido por un gran número de placas superpuestas
de cristales de grafeno débilmente unidas. El
grafeno se obtiene a partir del grafito, es un material bidimensional de
carbono que consiste en una sola capa de átomos de carbono organizados en una
estructura de periodo hexagonal (Rodríguez y Kharissova, 2008; Behbudi, 2020).
Las nanopartículas derivadas del carbono, en general, han demostrado que tienen
propiedades insecticidas. Se ha documentado que externamente afectan la
integridad de la cutícula y la pigmentación. Internamente alteran la expresión genética, el metabolismo de proteínas,
lípidos y carbohidratos, e incrementan las
especies reactivas de oxígeno y
modifican la actividad bioquímica, además de que presentan también como
característica el poder ser portadoras de ingredientes activos (Liu y col.,
2009; Wang y col., 2019b).
El uso de nanopartículas, en
combinación con ingredientes activos, se realiza con la finalidad de que se superen las limitaciones que presentan
los insecticidas convencionales, al garantizar la solubilidad del agua,
dispersión más uniforme y velocidad de disolución. Entre las ventajas de las nanoformulaciones destacan el bajo impacto ambiental y que permiten realizar aplicaciones más seguras (Venugopal
y Sainadh, 2016; Kumar y Kalita, 2017).
Las nanopartículas de grafito cuentan
con propiedades únicas, las cuales destacan naturalmente de las imperfecciones de sus estructuras cristalinas y
no han presentado problemas de toxicidad en
cientos de años (Dziewięcka y col., 2021). Pueden usarse como aditivo de
insecticidas para mejorar su eficiencia en la agricultura (Li y col., 2022).
Las nanopartículas de carbono han demostrado
alta tasa de afectación en diferentes
insectos, por ejemplo, Bemisia
tabaci, Spodoptera frugiperda y Plutella xylostella, registrando
desde 30 % a 70 % de mortalidad sobre estos
insectos (Wang y col., 2021; Chen y col., 2022; Lui y col., 2022). A
menor tamaño de la partícula mayor será su toxicidad y son más eficientes al
introducirse a los insectos (Wang y col., 2019a).
El objetivo de
esta investigación fue evaluar la tasa de mortalidad de ninfas de Bactericera
cockerelli mediante bioensayos in vitro con ingredientes activos
químicos mezclados con nanopartículas de grafito.
MATERIALES Y MÉTODOS
Obtención de las
ninfas
Las ninfas de B. cockerelli se
recolectaron en la zona productora de chile del estado de San Luis Potosí, México. Se tomaron hojas con ninfas
del estrato medio de las plantas de chile serrano (Capsicum annuum),
en etapa de fructificación, y se transportaron en una hielera para evitar la
exposición a temperaturas extremas. El trabajo se llevó a cabo en el
Laboratorio de Toxicología de la Universidad Autónoma
Agraria Antonio Narro (UAAAN) en Saltillo, Coahuila, México.
Bioensayo
Se realizó en
condiciones de laboratorio (temperatura de 24 °C ± 2 °C, humedad relativa de 60
% y fotoperiodo de 14:10 h/luz: oscuridad) mediante la técnica del método de
prueba de susceptibilidad del IRAC 002, versión 3 (IRAC, 2024). Las hojas con
30 a 50 ninfas del tercero al quinto estadio de B. cockerelli se
sumergieron durante 5 s en las diferentes concentraciones de los ingredientes
activos químicos, solos o mezclados con nanopartículas de grafito. Para la
determinación de las concentraciones se realizó una ventana biológica, que fue
desde 1 mg/L a 10 000 mg/L. Los insecticidas evaluados fueron Muralla Max®
(imidacloprid al 19.60 %), Karate Zeon® (lambda
cyalotrina 5.51 %) y Deltapir® (dimetoato 38.50 %) a concentraciones de 10
mg/L, 100 mg/L, 500 mg/L, 1 000 mg/L,
2 000 mg/L, 3 000 mg/L solos o adicionados
con nanopartículas de grafito (80 nm a 200 nm) al 1 %, 3 %, 5 % y 10 %,
respectivamente (proporcionadas por la empresa CULTA S. A. DE C. V. ®). Cada
tratamiento contó con tres repeticiones, un
testigo absoluto y un testigo con nanopartículas de grafito, a los
porcentajes antes mencionados. A todos los
tratamientos se les adicionó tween 20
como adherente. Las hojas tratadas se dejaron secar sobre papel filtro durante
3 s (WhatmanTM, modelo: 17199048, China), y posteriormente se
colocaron con papel húmedo en cajas Petri.
Evaluación de la
mortalidad
La mortalidad se
evaluó a las 24 h con la ayuda
de un microscopio estereoscopio binocular 32X (Carl Zeiss Microlmaging GmbH
37081, Gottingen, Alemania). Para considerar ninfas muertas, los criterios de
mortalidad fueron aquellas ninfas con cambio de coloración café marrón o
consistencia lechosa, deshidratadas y que no respondieron al estímulo de un
pincel.
El bioensayo se realizó con un diseño
de máxima verosimilitud (finnex) (medida de la tendencia de la evolución de dos
variables). A los resultados se les aplicó la
corrección de mortalidad mediante la fórmula de Henderson y Tilton
(1955) (basada en la comparación de la mortalidad inducida por el tratamiento, respecto
al testigo).
Análisis
estadístico
Las mortalidades
obtenidas se analizaron usando
análisis de varianza (ANOVA) y comparación de medias mediante la prueba Tukey
(P ³ 0.05), utilizando el programa estadístico (Statistical Analysis System) SAS, versión 9.1. La desviación estándar
se definió mediante la raíz cuadra de la varianza.
Los datos obtenidos fueron sometidos a
un análisis dosis-respuesta Probit para determinar la CL50 mediante
el programa SAS versión 9.1, lo que permitió calcular el grado de sinergismo.
La relación de sinergia (RS) se calculó dividiendo la CL50 del
ingrediente activo químico entre la CL50 de la combinación del
insecticida con nanopartículas de grafeno.
RESULTADOS Y DISCUSIÓN
El tratamiento de
ninfas de B. cockerelli con nanopartículas de grafito a concentraciones
de 5 % y 10
%, sin insecticidas, registraron mortalidades de 27.0 % y 41.2 %,
respectivamente (Tabla 1). Estos resultados indicaron que, las nanopartículas tuvieron efecto letal en los
organismos, pero solo alcanzaron a inducir menos del 50 % de mortalidad.
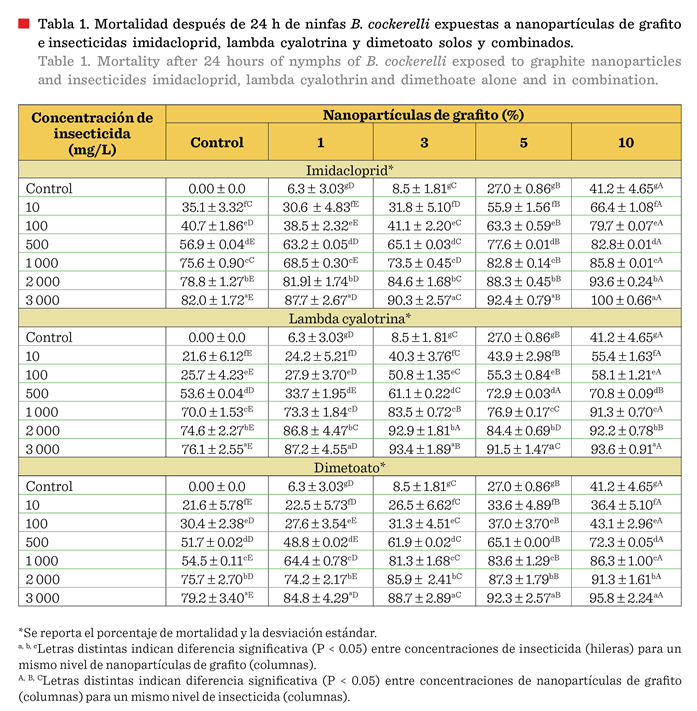
El tratamiento con 1 % de concentración de nanopartículas de grafito evaluado en este estudio,
presentó un comportamiento de mortalidad (6.3
%) similar al óxido de grafeno (GO,
por sus siglas en inglés: graphane oxide), con una baja tasa de
mortalidad (3.33 %) sobre el barrenador
asiático del maíz, cuando fue tratado con
el compuesto solo (25 mg/mL), el cual se incrementó al combinarlo con
imidacloprid, reportando mortalidades del
26.37 % al 72.6 %, demostrando su sinergia, bajo condiciones de laboratorio (Wang y col., 2019a).
La combinación de las nanopartículas de
grafito con los tres insecticidas estudiados, mostró un incremento significativo en su eficiencia
letal (Tabla 1). Los tratamientos de 500 mg/L, en todos los ingredientes
activos, presentaron mortalidades por encima
del 50 % (a excepción de lambda cyalotrina y dimetoato, ambos con una concentración al 1 % de nanopartículas
de grafito); y todos los tratamientos de 2 000 mg/L y 3 000 mg/L indujeron
mortalidades por encima del 70 %, incluido
el control, y al 90 % en todas las
concentraciones del 10 % de grafito.
También se registró un 90 % de mortalidad en las concentraciones del 3 %
y 5 % de grafito a 3000 mg/L (a excepción de dimetoato al 3 % de grafito).
El ingrediente activo clorpirifos
registró mortalidades en condiciones de
laboratorio del 23.67 % al 42.33 % contra el ácaro Tetranychus
truncatus, mientras que, combinado con óxido
de grafeno aumentó la mortalidad de 41.67 % a 86.33 % (Wang y col.,
2019b). En el caso del gusano cogollero de la
cápsula de algodón, alimentado con GO, se redujo la esperanza de vida en hembras y machos (Li y col., 2022). El
uso de grafeno (en su forma no oxidada)
combinado con lambda cyalotrina en una relación 3/1 (grafeno-insecticida) indujo una mortalidad del 62.91 %
contra el tercer estadio del gusano de la cápsula de algodón, superior a la de
ambos compuestos en forma individual. Su acción se asoció con el efecto causado
sobre las células espinosas de la epicutícula
del gusano, incrementando la permeabilidad y, por ende, su toxicidad (Chen
y col., 2022). Wang y col. (2021), observaron bajo
condiciones controladas, la eficacia de moléculas de biocarbón
desarrolladas en el laboratorio,
cargadas con conidios Cordyceps fumosorosea, mediante su
inmersión en suspensiones con concentraciones
de 10 ppm, 20 ppm, 50 ppm y 100 ppm
de conidios, contra Bemicia tabaci,
registrando mortalidades acumuladas a
los 7 d por encima del 90 % para ninfas del segundo, tercer estadio y
pupas con valores de CL50 de las nanopartículas de 6.80 ppm, 7.45
ppm y 8.64 ppm, respectivamente. Estos
estudios muestran que, las partículas derivadas de carbono son
candidatas prometedoras en el ámbito
biológico, para utilizarse en la agricultura como aditivo de pesticidas,
por su versatilidad y gran potencial al
mejorar su efectividad (Li y col., 2022).
Dosis letal CL50
La CL50
registrada solo para imidacloprid fue de 103.07 mg/L, la cual mostró la mayor
tasa de mortalidad de los tres insecticidas, aplicados sin las nanopartículas de
grafito. De la misma manera, al combinarse
con 5 % y 10 % de
nanopartículas de grafito, este activo químico, presentó las concentraciones CL50
más bajas (8.75 mg/L y 1.96 mg/L, respectivamente); con una relación de sinergia (RS)
de 11.77
veces y 52.34 veces, respectivamente, indicando la capacidad del grafito
en nanopartículas para potenciar la
efectividad del imidacloprid como insecticida (Tabla 2). Las CL50 registrada para lambda cyalotrina, aplicada sola
a ninfas de B. cockerelli fue de 285.52 mg/L. Su eficacia se incrementó
notablemente a partir de su combinación con 3 % de nanopartículas de grafito
(48.10 mg/L) y alcanzó su máxima efectividad al combinarse con 10 % (13.85
mg/L), con una RS de 20.60 veces (Tabla
3). El dimetoato-grafito presentó la menor tasa de letalidad contra las
ninfas de B. cockerelli con una
dosis CL50 de 492.35 mg/L cuando se aplicó sólo el
insecticida, y alcanzando únicamente una
dosis de CL50 de 57.31 mg/L al combinarse con 10 % de nanopartículas de grafito, representando una RS
de 8.59 veces (Tabla 4).
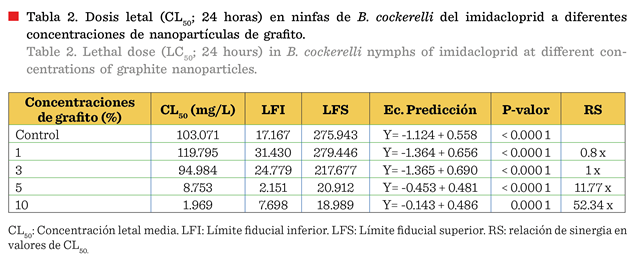
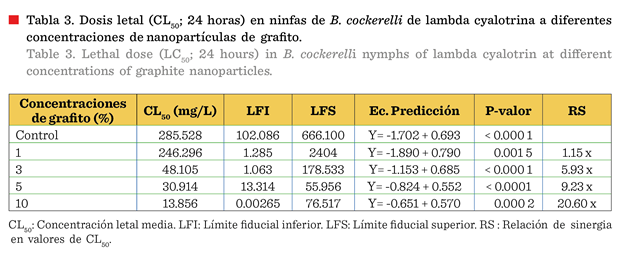
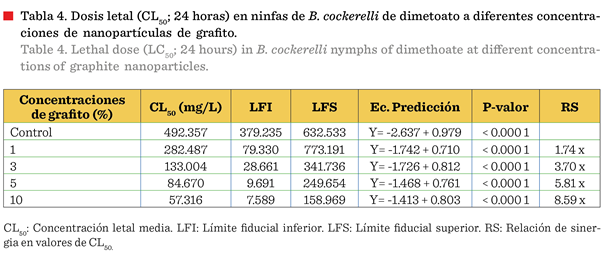
La eficacia de las nanopartículas de
carbono para reducir la dosis CL50 de diferentes insecticidas
coincide con otros registros de la literatura. Wang y col. (2019a), reportaron
que la actividad sinérgica del óxido de grafeno, en combinación con el
insecticida imidacloprid, contra el insecto barrenador asiático del maíz, redujo
la CL50 a 2.31 mg/L, exhibiendo una
toxicidad de contacto de 1.83 veces. El óxido de grafeno sinérgicamente con el
insecticida beta-ciflutrina, aplicado al ácaro Tetranychus urticae,
documentó una CL50 de 2.06 mg/L y una RS de 1.50 veces (Wang y col.,
2019b). Batool y col. (2020), registraron que, al utilizar puntos cuánticos de
grafeno como nanotransportadores, cargados con cisteína proteasa como
insecticida contra Tribolium castaneum y Rhyzopertha dominica, redujeron el valor de CL50 a 0.759 mg/L y
0.771 mg/L, respectivamente. Wang y col. (2019b), evaluaron la
mortalidad del ácaro Tetranychus
truncatus, con el ingrediente
clorpirifos en combinación con el óxido de grafeno, reportando una CL50
de ingrediente solo de 3.21 mg/L y del nanocompuesto de 2.07 mg/L, indicando
que la CL50 bajó con la adición de óxido de grafeno, presentando una
RS del nanocompuesto para el valor de CL50, 1.55 veces en la
actividad insecticida en relación con el producto solo. Liu y col. (2022),
documentaron la nanoformulación de óxido de grafeno cargado con abamectina
contra el insecto dorso de diamante (Plutella xylostella), registraron el valor de CL50 de 1.503
mg/L para la abamectina sola y una CL50 de 0.996 mg/L para
abamectina cargada en óxido de grafeno.
Los resultados de
este trabajo muestran que
las nanopartículas derivadas del carbono presentan un prometedor potencial en
el control de diferentes insectos, incluyendo el B. cockerelli, al
reducir las dosis de los productos químicos.
CONCLUSIONES
Los tres insecticidas mostraron ser
eficientes contra ninfas de B. cockerelli en el siguiente orden:
imidacloprid, lambda cyalotrina y dimetoato. La combinación de los tres
compuestos químicos con nanopartículas de grafito se incrementó notablemente a
partir de los tratamientos de 500 mg/L de insecticida al 3 % y 5 % de nanopartículas
de grafito. La mejor combinación fue el
insecticida imidacloprid-nanopartículas de grafito al 10 % con una dosis letal de 1.96 mg/L y una relación de
sinergia de 52.34 %. Las nanopartículas de grafito mostraron ser una
alternativa a considerar para incrementar el control de B. cockerelli mediante
el uso de insecticidas.
Agradecimiento
Al Consejo
Nacional de Humanidades, Ciencia y Tecnología, por la beca otorgada durante la
realización de la estancia posdoctoral en el departamento de parasitología
agrícola, dentro del laboratorio de toxicología, perteneciente a la Universidad
Autónoma Agraria Antonio Narro.
DECLARACIÓN DE INTERESES
Los autores
declararon no tener conflicto de interés alguno.
Referencias
Batool, M., Hussain, D.,
Akrem, A., Najam-ul-Haq, M., Saeed, S., Zaka, S. M., Nawaz, M. S., Buck, F.,
& Saeed, Q. (2020). Graphene quantum dots as cysteine protease nanocarriers
against stored grain insect pests. Scientific Reports, 10(1), 3444. https://doi.org/10.1038/s41598-020-60432-5.
Behbudi, G. (2020). Mini review of graphene oxide for medical
detection and applications. Advances in Applied NanoBio-Technologies,
1(3), 63-66.
Butler, C.
D. & Trumble, J. T. (2012). Identification and impact of natural enemies of
Bactericera cockerelli (Hemiptera: Triozidae) in Southern California. Journal
of Economic Entomology, 105(5), 1509-1519. https://doi.org/10.1603/EC12051.
Chen, Z.,
Zhao, J., Liu, Z., Bai, X., Li, W., Guan, Z., Zhou, M., & Zhu, H. (2022).
Graphene-Delivered Insecticides against Cotton Bollworm. Nanomaterials, 12(16),
2731. https://doi.org/10.3390/nano1216273.
Dziewięcka,
M., Pawlyta, M., Majchrzycki, Ł., Balin, K., Barteczko, S., Czerkawska, M.,
& Augustyniak, M. (2021). The structure–properties–cytotoxicity interplay:
A crucial pathway to determining graphene oxide biocompatibility. International
Journal of Molecular Sciences, 22, 5401. https://doi.org/10.3390/ijms22105401.
EPPO, Organización Europea
y Mediterránea de Protección de las Plantas (2014). Bactericera cockerelli
PARZCO. [En línea]. Disponible en: http://www.eppo.int. Fecha de consulta: 10
de diciembre de 2024.
Henderson,
C. F. & Tilton, E. W. (1955). Tests with acaricides against the brown wheat
mite. Journal
of Economic Entomology,
48(2), 157-161.
IRAC, Insecticide
Resistance Action Committee (2024). Modes de action. [En línea]. Disponible en:
https://irac-online.org/methods/psylla-spp-all-stages/. Fecha de consulta: 8 de
enero de 2025.
Kumar, D. & Kalita, P.
(2017). Reducing postharvest losses during storage of grain crops to strengthen food security in developing countries. Foods,
6(1), 8. https://doi.org/10.3390/foods6010008.
Li, C.,
Hu, C., Zhi, J., Yue, W., & Li, H. (2022). Effects of nano-graphene oxide
on the growth and reproductive dynamics of Spodoptera frugiperda based on an age-stage, two-sex life table. Insects,
13(10), 929. https://doi.org/10.3390/insects13100929.
Liu, J.,
Luo, Y., Jiang, X., Sun, G., Song, S., Yang, M., & Shen, J. (2022).
Enhanced and sustained pesticidal activity of a graphene-based pesticide
delivery system against the diamondback moth Plutella xylostella. Pest
Management Science, 78(12), 5358-5365. https://doi.org/10.1002/ps.7158.
Liu, D.
& Trumble, J. T. (2006). Ovipositional
preferences, damage thresholds, and detection
of the tomato–potato psyllid Bactericera cockerelli (Homoptera:
Psyllidae) on selected tomato accessions. Bulletin of
Entomological Research, 96(2), 197-204. https://doi.org/10.1079/BER2005416.
Liu, X.,
Vinson, D., Abt, D., Hurt, R. H., & Rand, D. M. (2009). Differential
toxicity of carbon nanomaterials in Drosophila: larval dietary uptake is
benign, but adult exposure causes locomotor impairment and mortality. Environmental Science
& Technology,
43(16), 6357-6363.
Lozano-Gutiérrez, J.,
Chávez-Brizuela, A., Lara-Herrera, A., España-Luna, M. P., Balleza-Cadengo, J.
D. J. y Hernández-Muñoz, C. A. (2018). Poblaciones de Bactericera cockerelli Sulc. 1909 (HEMIPTERA: PSILLIDAE) en 50
cultivares de chile (Capsicum annum
L.) en Morelos, Zacatecas, México, 5, 354-357. https://doi.org/10.48779/ba80-a717.
Mogul, M.
G., Akin, H., Hasirci, N., Trantolo, D. J.,Gresser, J. D., & Wise, D. L.
(1996). Controlled release of biologically active agents for purposes of
agricultural crop management. Resources, Conservation and Recycling,
16(1-4), 289-320. https://doi.org/10.1016/0921-3449(95)00063-1.
Munyaneza,
J. E. (2013). Bactericera
cockerelli.
[En línea]. Disponible en:
https://www.ars.usda.gov/research/publications/publication/?seqNo115=289067.
Fecha de consulta: 8 de diciembre de 2024.
Olaniyan, O.,
Rodríguez-Gasol, N., Cayla, N., Michaud, E.,
& Wratten, S. D. (2020). Bactericera cockerelli
(Sulc), a potential threat to China's potato industry. Journal of
Integrative Agriculture, 19(2), 338-349. https://doi.org/10.1016/S2095-3119(19)62754-1.
Ramírez-Dávila, J. F.,
Porcayo-Camargo, E. y Sánchez-Pale, J. R. (2012). Análisis de la distribución espacial de Bactericera Cockerelli Sulc
(HEMIPTERA: TRIOZIDAE) en Solanum Tuberosum L. En Donato
Guerra México, 12(1), 12-24. https://hdl.handle.net/10893/4083.
Rivera-Martínez, R.,
Ramírez-Dávila, J. F., Martínez-Quiroz, M. y González-Huerta, A. (2020).
Modelización espacial de ninfas de Bactericera cockerelli Sulc. en
tomate de cáscara (Physalis ixocarpa Brot.) por medio de técnicas
geoestadísticas. Biotecnia, 22(1), 142-152. https://doi.org/10.18633/biotecnia.v22i1.1162.
Rodríguez, G. C. y
Kharissova, O. V. (2008). Pro-piedades y aplicaciones del grafeno. Ingenierías,
11(38), 17-23.
SADER, Secretaría de
Agricultura y Desarrollo Rural (2024). México, entre los principales
productores de chile verde en el mundo: agricultura. [En línea]. Disponible en:
https://www.gob.mx/agricultura. Fecha de consulta: 19 de noviembre de 2024.
SIAP, Servicio de
Información Agroalimentaria y Pesquero (2024). Principales estados productores
de chile verde en México: agricultura. [En línea]. Disponible en:
siap.gob.mx/cierreagricola/. Fecha de consulta: 18 de noviembre de 2024.
Trujillo-García, J.,
Lozano-Gutiérrez, J., España-Luna, M. P., Lara-Herrera, A. y Balleza-Cadengo, J. J. (2018). Parasitismo de Bactericera
cockerelli (Sulc) (Hemiptera:
Psyllidae) en dos cultivares de chile guajillo en invernadero. Entomología
Mexicana, 5, 160-163. https://doi.org/10.48779/xm0m-w095.
Tucuch-Haas, J. I.,
Silva-Aguayo, G., & Rodríguez-Maciel, J. C. (2020). Oviposition of Bactericera
co-ckerelli (Sulc) (Hemiptera: Triozidae) on Capsicum chinense
(Jacq) treated with spiromesifen or spirotetramat.
Revista Fitotecnia Mexicana, 43(3), 317-323. https://doi.org/10.35196/rfm.2020.3.317.
Vega-Gutiérrez, M. T.,
Rodríguez-Maciel, J. C., Díaz-Gómez, O., Bujanos-Muñiz, R., Mota-Sánchez, D.,
Martínez-Carrillo, J. L. y Garzón-Tiznado, J. A. (2008). Susceptibilidad a
insecticidas en dos poblaciones mexicanas del salerillo, Bactericera
cockerelli (Sulc) (Hemiptera: Triozidae). Agrociencia, 42(4),
463-471. https://www.scielo.org.mx/pdf/agro/v42n4/v42n4a9.pdf.
Venugopal, N. V. S. &
Sainadh, N. V. S. (2016). Novel polymeric nanoformulation of Mancozeb–An eco-friendly nanomaterial. International Journal of
Nanoscience, 15(04), 1650016. https://doi.org/10.1142/S0219581X16500162.
Villegas-Rodríguez, F.,
Marín-Sánchez, J., Delgado-Sánchez, P., Torres-Castillo, J. A., & Alvarado-Gómez, O. G. (2014). Management of Bactericera cockerelli (Sulc) (Hemiptera: Triozidae)
in green-houses with
entomopathogenic fungi (Hypocreales). Southwestern Entomologist,
39(3), 613-624. https://doi.org/10.3958/059.039.0320.
Wang, X.,
Xu, J., Sun, T., & Ali, S. (2021). Synthesis of Cordyceps
fumosorosea-biochar nanoparticles and their effects on growth and survival of Bemisia
tabaci (Gennadius). Frontiers in Microiology, 12, 630220. https://doi.org/10.3389/fmicb.2021.630220.
Wang, X.,
Xie, H., Wang, Z., & He, K. (2019b). Graphene oxide as a pesticide delivery
vector for enhancing acaricidal activity against spider mites. Colloids
and Surfaces B: Biointerfaces, 173, 632-638. https://doi.org/10.1016/j.colsurfb.2018.10.010.
Wang, X., Xie, H., Wang, Z., He, K., & Jing, D. (2019a). Graphene oxide
as a multifunctional synergist of insecticides against lepidopteran insect. Environmental Science: Nano, 6(1), 75-84. https://doi.org/10.1039/C8EN00902C
Xiang, Y.,
Wang, M., Sun, X., Cai, D., & Wu, Z. (2014). Controlling pesticide loss through nanonetworks. ACS
Sustentable Chemistry & Engineering, 2(4), 918-924.