https://doi.org/10.29059/cienciauat.v20i1.1989
Microencapsulación de jugo de
granada y extracto de jamaica: caracterización fisicoquímica, antioxidante y antimicrobiana
Microencapsulation of pomegranate juice and
hibiscus extract: physicochemical, antioxidant, and antimicrobial
characterization
Microencapsulación: granada y jamaica
Brenda
Esmeralda Jiménez-Villeda*, Edna Zaranné
Martínez-Ramírez, Marithza Guadalupe Ramírez-Gerardo, Erik Gómez-Hernández
*Correspondencia:
bjimenez@itsoeh.edu.mx/Fecha de recepción: 28 de enero de 2025/Fecha de
aceptación: 8 de mayo de 2025/Fecha de publicación: 30 de mayo de 2025.
TecNM/Instituto Tecnológico Superior
del Occidente del Estado de Hidalgo, Departamento de Ingeniería en Industrias
Alimentarias, carretera Mixquiahuala-Tula km 2.5, Paseo del Agrarismo núm.
2000, Mixquiahuala de Juárez, Hidalgo, México, C. P. 42700.
Resumen
La microencapsulación
mejora la estabilidad y disponibilidad de compuestos bioactivos, como polifenoles de fuentes vegetales, para satisfacer
la demanda de alimentos funcionales. Este estudio buscó obtener y
caracterizar microencapsulados de jugo de granada y extracto de jamaica,
evaluando sus propiedades fisicoquímicas,
antioxidantes y antimicrobianas. Los microencapsulados se produjeron mediante secado por aspersión a 100 °C, con
una velocidad de alimentación de 4 mL/min, en proporciones de jugo de granada y extracto de jamaica: 100:0 (C1),
70:30 (M1), 50:50 (M2), 30:70 (M3) y 0:100 (C2). Se analizaron humedad,
actividad de agua, solubilidad, color, morfología, capacidad antioxidante y actividad antimicrobiana al inicio y tras
6 meses de almacenamiento. Los microencapsulados mostraron baja humedad (< 5
%, excepto C1) y actividad de agua (<
0.3), asegurando estabilidad fisicoquímica al limitar reacciones de
degradación y crecimiento microbiano. La
solubilidad superó el 93 % en todos los tratamientos. Las formulaciones con mayor contenido de extracto
de jamaica (M3 y C2) presentaron mayor
luminosidad y tonos rojizos. La microscopía electrónica de barrido reveló
partículas esféricas con concavidades, sin grietas, típicas del secado por aspersión. Los tratamientos M3 y
C2 también exhibieron la mayor capacidad
antioxidante, destacando C2 con 4 717.10 mg de Trolox/100 g para ABTS y 4
729.43 mg de equivalente de ácido ascórbico/100 g para DPPH, con inhibiciones del radical del 95.68 % y 80.83
%, respectivamente. Además, M3 y C2, mostraron una inhibición significativa (P < 0.05), contra Escherichia
coli. Tras 6 meses, las propiedades se
preservaron parcialmente, especialmente en formulaciones ricas en
extracto de jamaica. La microencapsulación
de jugo de granada y extracto de jamaica demostró ser una estrategia
efectiva para obtener productos con alta solubilidad, actividad antioxidante y antimicrobiana, ideales para
aplicaciones en alimentos funcionales.
PALABRAS CLAVE: microencapsulación,
jugo de granada, extracto de jamaica, capacidad antioxidante, actividad
antimicrobiana.
ABSTRACT
Microencapsulation enhances the stability
and bioavailability of
bioactive compounds, such
as polyphenols from plant
sources, to meet the demand for functional
foods. This study aimed to
produce and characterize microencapsulated
pomegranate juice and hibiscus extract, evaluating their physicochemical, antioxidant, and
antimicrobial properties. Microencapsulates were obtained by spray drying at
100 °C with a feed rate of 4 mL/min, using pomegranate
juice and hibiscus extract ratios of 100:0 (C1), 70:30 (M1), 50:50 (M2), 30:70
(M3), and 0:100 (C2). Humidity, water activity, solubility, color, morphology,
antioxidant capacity, and antimicrobial activity were assessed initially and
after 6 months of storage. The microencapsulates exhibited low humidity (< 5
%, except C1) and water activity (< 0.3),
ensuring physicochemical stability by limiting degradation reactions and
microbial growth. Solubility exceeded 93 %
across all treatments. Formulations with higher hibiscus extract content (M3 and C2) showed greater luminosity
and reddish hues. Scanning electron microscopy revealed spherical particles
with concavities, without cracks, typical of spray drying. Also, the M3 and C2 treatments displayed the highest
antioxidant capacity, with C2 recording 4
717.10 mg Trolox/100 g for ABTS and 4 729.43 mg ascorbic acid
equivalent/100 g for DPPH, with radical inhibitions of 95.68 % and 80.83 %, respectively. Besides, the M3 and C2 treatments
showed significant inhibition (P <
0.5) against Escherichia coli. After 6 months, properties were partially
preserved, especially in rich in hibiscus extract
formulations. Microencapsulation of pomegranate juice and hibiscus
extract proved effective in producing products with high solubility,
antioxidant activity, and antimicrobial properties, making them suitable for
functional food applications.
KEYWORDS: microencapsulation, pomegranate juice, hibiscus extract, antioxidant capacity, antimicrobial activity.
![]()
INTRODUCCIÓN
La producción de
fruto de granada (Punica granatum L.) en México es amplia por su
adaptabilidad a las condiciones climáticas y edáficas; su consumo es mayormente
en fresco o bien, es la materia prima para fabricar licores y jugos a nivel
artesanal (Betanzos-Cabrera y col., 2015). No obstante, su aprovechamiento se
limita a la época de producción (del mes de julio hasta principios del mes de
octubre) que es de aproximadamente tres meses por año. El jugo del fruto ha
sido estudiado en diversas aplicaciones biológicas debido a la presencia de
compuestos bioactivos, como los elagitaninos, punicalagina, punicalina, ácido
punícico y ácido elágico, los cuales tienen efectos beneficiosos para la salud
humana y han sido evaluados en ensayos in vitro e in vivo para
contrarrestar ciertas enfermedades,
como el cáncer, la obesidad, la diabetes,
algunos virus como la influenza, infecciones bacterianas e inflamación
(Haidari y col., 2009; Khajebishak y col.,
2019; Mortada y col., 2020).
La jamaica (Hibiscus sabdariffa
L.), es una especie ampliamente cultivada en regiones tropicales a nivel
mundial (Archaina y col., 2019). Su versatilidad y propiedades funcionales han
favorecido su incorporación en diversos productos de la industria alimentaria,
incluyendo bebidas, mermeladas, jaleas,
licores y harinas para repostería
(Borrás-Linares y col., 2015;
Archaina y col., 2019;). Diversos estudios han demostrado que H.
sabdariffa posee efectos benéficos para la salud, atribuidos principalmente
a su alta actividad antioxidante. Dicha propiedad está relacionada con la
presencia de compuestos bioactivos, como ácidos fenólicos y antocianinas, los
cuales desempeñan un papel clave en la neutralización de especies reactivas de oxígeno (Borrás-Linares y col.,
2015; Maciel y col., 2018; Vargas-León y
col., 2018; Archaina y col., 2019).
La granada (P.
granatum) y la jamaica (H. sabdariffa) presentan actividad
antioxidante y antimicrobiana contra patógenos de importancia médica y
alimentaria, como Enterococcus faecalis, Escherichia
coli, Salmonella typhi, Shigella flexneri y Staphylococcus
aureus, entre otros (Betanzos-Cabrera y col., 2015; Borrás-Linares y col.,
2015). Sin embargo, los compuestos bioactivos de los extractos de granada
y jamaica tienen una alta susceptibilidad a la degradación, debido a factores
como la temperatura, la luz y el oxígeno, lo que limita su estabilidad y
funcionalidad en aplicaciones industriales (Jafari y col., 2017; Archaina y
col., 2019).
La microencapsulación representa una
estrategia efectiva para mejorar la
estabilidad y funcionalidad de compuestos bioactivos sensibles a
factores ambientales. En el caso del jugo de granada y el extracto de jamaica,
el proceso de secado por aspersión ha demostrado ser efectivo para proteger sus
compuestos fenólicos y antioxidantes frente a la degradación por temperatura,
luz y oxígeno (Ribeiro y col., 2020). Además, facilita su incorporación en productos alimentarios, mejorando
su biodisponibilidad y prolongando su vida útil. Diversos estudios han
explorado el uso de matrices encapsulantes
como maltodextrinas (MD) y gomas naturales para optimizar la retención
de estos compuestos, obteniendo microcápsulas con propiedades fisicoquímicas
adecuadas para su aplicación industrial
(Archaina y col., 2019; Álvarez-Cervantes y col., 2021). Durante el
proceso de secado por aspersión, se mezclan
los componentes del núcleo (los compuestos bioactivos) y los componentes
de la pared (polisacáridos y proteínas) para crear una emulsión que luego se
atomiza en una cámara de secado (Dhakal y He, 2020). Ello permite procesar
materiales líquidos, como los jugos, que son sensibles al calor, sin afectar
significativamente su calidad, además de ser una técnica de microencapsulación
económica (Ye y col., 2018).
Archaina y col. (2019),
microencapsularon un extracto de jamaica mediante secado por aspersión,
reportando que las matrices de MD y goma arábiga (GA) fueron una buena opción
para producir polvos de jamaica con excelentes
propiedades físicas: bajo contenido de humedad (< 1.7 g H2O/100
g de muestra de peso seco) y actividad de agua (< 0.26); alta temperatura de transición vítrea (42 °C a 48 °C) y
alta solubilidad (> 99 %). Los polvos mostraron
baja cohesividad y buena fluidez. Además de retener eficazmente las
antocianinas, polifenoles y la capacidad antioxidante.
El objetivo del presente trabajo fue
obtener un microencapsulado a partir del jugo de granada madura (P. granatum) adicionado con extracto de jamaica (H.
sabdarifa) mediante secado por
aspersión, con el fin de evaluar sus propiedades fisicoquímicas,
antioxidantes y su actividad antimicrobiana
frente a Escherichia coli, Listeria monocytogenes y
Salmonella typhimurium.
MATERIALES Y MÉTODOS
Materia prima
Se recolectaron
granadas maduras (Punica granatum L.) en el Valle de Mezquital, Hidalgo,
México, entre los meses de julio y septiembre de 2024. Los cálices secos de
jamaica (Hibiscus sabdariffa L.) se obtuvieron de un mercado en Tula de
Allende, Hidalgo, México.
Reactivos químicos
Se emplearon GA E-414 (Diquitra®,
Estado de México, México) y MD 20 DE (Cazel®, Oaxaca, México) como materiales de pared.
Los reactivos fenol Folin-Ciocalteu, 2, 2-difenil-1-picrilhidrazilo (DPPH•),
ácido 6-hidroxi-2,5,7,8-tetrametilcromano-2-carboxílico (Trolox) y persulfato
de potasio (K2S2O8) se adquirieron de Sigma-Aldrich (St.
Louis, MO, EE. UU.). El citrato de sodio se obtuvo de Golden Bell Reactivos
(Cuidad de México, México). El Agar para métodos estándar y caldo de soya
tripticaseína fueron de la marca DB Bioxon®.
Obtención del jugo
de granada
Las granadas se lavaron cuidadosamente
frotando la superficie con una solución de agua potable y jabón en el
laboratorio, posteriormente se cortaron por
la mitad para extraer el jugo, utilizando un exprimidor mecánico para
cítricos. El jugo obtenido se filtró con un
colador fino para remover partículas sólidas; se sometió a un proceso de
pasteurización (85 °C por 15 min) y se almacenó en condiciones de refrigeración
a 4 °C/24 h, asegurando su protección contra la exposición a la luz en envases
ámbar.
Extracto acuoso de
jamaica
Se elaboró un
extracto a partir de cálices secos
de jamaica (15 % p/v), mezclando 15 g de
cálices con 100 mL de agua destilada y manteniendo la solución a 100 °C
durante 10 min. El extracto se filtró al vacío 2 veces utilizando papel Whatman
N° 2, siguiendo el procedimiento descrito por Archaina y col. (2019) y se
almacenó en condiciones de refrigeración a 4 °C/24 h, protegido de la luz en
envases ámbar.
Preparación de las
formulaciones
Se combinaron el jugo
de granada y el extracto de jamaica (JG:EJ) utilizando proporciones específicas de 100:0
(C1), 70:30 (M1), 50:50 (M2), 30:70 (M3) y 0:100 (C2), expresadas en términos de porcentaje en volumen.
Las soluciones fueron combinadas con
una proporción 85:15 de MD y GA,
respectivamente, y ajustadas a un
contenido de sólidos totales del 30 % (p/v). Las soluciones se sometieron a
agitación magnética durante 10 min para dispersar los hidrocoloides y se
homogenizaron a 6 000 rpm durante 5 min con homogenizador
Ultra Turrax T-25 SI (IKA Works, Wilmington, NC, EE. UU.).
Secado por
aspersión
La microencapsulación se llevó a cabo
mediante un secador por aspersión de laboratorio modelo Buchi
B-191 (Labortechnik AG, Flawil, Suiza). Se utilizó
temperatura de entrada de 100 °C y temperatura de salida de 62 ± 2 °C. El flujo de líquido (velocidad de
alimentación) se mantuvo constante a 4 mL/min, utilizando una boquilla
de 0.5 mm de diámetro y la presión del aire se ajustó a 3.0 bar. Los polvos
obtenidos se almacenaron herméticamente en
bolsas de plástico a -18 °C hasta su análisis.
Caracterización de
encapsulados de jugo de granada y extracto de jamaica
Contenido
de humedad
La determinación
del contenido de humedad en las microcápsulas se realizó siguiendo el método
44-15.02 (AACC, 2000). Se pesaron 2 g de muestra y se distribuyeron en charolas
de aluminio, posteriormente se sometieron a un proceso de secado en una estufa
(Biobase, BOV-D125, China) a una temperatura de 105 °C/24 h. El contenido de
humedad se estimó mediante la diferencia del peso antes y después del secado de
la muestra, de acuerdo con la ecuación 1:
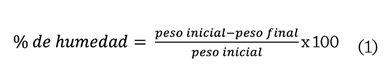
Actividad
de agua (aw)
Se empleó un equipo Aqua Lab (LITE, Washington, EE. UU.) que opera bajo el principio
de equilibrio de presión de vapor. Las muestras se colocaron en contenedores
propios del equipo, y la medición se realizó a temperatura ambiente (± 25 °C).
Solubilidad
Se vertieron 100 mL de agua destilada
en un recipiente de vidrio. Posteriormente, se pesó cuidadosamente 1 g del
polvo y se añadió al recipiente a temperatura
ambiente (± 25 °C). La solución resultante se agitó inmediatamente
utilizando un homogeneizador Ultra Turrax T-25 SI (IKA Works, Wilmington, NC,
EE. UU.) a 15 000 rpm durante 3 min. Luego,
se centrifugó (Sigma, modelo 3–30 k, Alemania), a 3 000 rpm durante 5 min a temperatura ambiente (± 25 °C).
El sobrenadante se vertió cuidadosamente en placas limpias y previamente
pesadas, las cuales se secaron en una estufa
a 105 °C/5 h hasta alcanzar un peso constante. El peso de la materia
seca fue utilizado como base para calcular la solubilidad del polvo.
Color
Se empleó la escala
de color CIE L* C* H* utilizando un analizador de color portátil (Kaalee, WR10QC, China).
Las muestras se prepararon homogéneamente y se colocaron en una superficie
uniforme para la medición. El dispositivo registró los valores L*
(luminosidad), a* (verde-rojo) y b* (azul-amarillo). Posteriormente, se
calcularon los valores de C* (croma) y H* (tono o matiz) de acuerdo con las
ecuaciones 2 y 3:
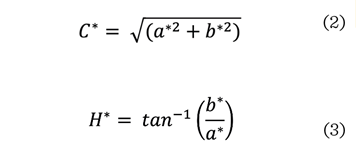
Morfología
de las microcápsulas
La morfología de las microcápsulas se
observó con un microscopio electrónico de
barrido (SEM, por sus siglas en inglés: Scanning Electron Microscope)
(model JEOL JSM-6300, Akishima, Tokyo, Japan). Las muestras secas se colocaron en un portaobjetos recubierto con
cinta electroconductora de carbono de doble cara, y posteriormente se
recubrieron con una capa de oro de 0.5 nm a 1 nm de espesor durante 3 min. Las
observaciones se realizaron bajo condiciones de 15 A y 20 kV.
Capacidad
antioxidante
Acondicionamiento
de la muestra
Para cuantificar la capacidad
antioxidante de las microcápsulas mediante
las técnicas ABTS y DPPH, se llevó a cabo la destrucción completa de su
estructura. Se pesaron 200 mg de microcápsulas en un tubo Eppendorf, a los cuales se añadieron 2.0 mL de agua. La mezcla fue
agitada vigorosamente durante 5 min, y
posteriormente centrifugada a 7 000 ×g (MiniSpin plus, Eppendorf,
Alemania) durante 10 min. El sobrenadante obtenido se filtró a través de un
filtro de membrana con un tamaño de poro de 0.45 mm, y el filtrado resultante
se utilizó para las pruebas de ABTS y DPPH.
ABTS
La capacidad de captación del radical
ABTS fue evaluada de acuerdo con lo descrito por Martinez-Ramirez y col. (2024)
con algunas modificaciones. El radical se generó mediante la reacción del ácido 2,2’-azino-bis (3-etilbenzotiazolina-6-sulfónico)
(ABTS) a una concentración de 7 mM con K2S2O8
(2.45 mM), incubándose a temperatura ambiente en ausencia de luz durante 16 h.
Posteriormente, se mezclaron 1 050 mL de la solución del radical con 50 mL de
la solución del microencapsulado (cápsulas disueltas en una solución de citrato
de sodio al 2 %). Después, la mezcla se agitó en vórtex durante 2 min con un
vortex Velp Scientifica XZ3 (Monza y Brianza, Italia) y se centrifugó a 10 000
rpm durante 3 min con una centrífuga
Eppendorf 5804R (Hamburgo, Alemania),
permitiendo que la mezcla reaccionara durante 30 min en oscuridad. La
absorbancia se midió a 732 nm; los resultados se expresaron en miligramos de
equivalentes de Trolox (mg ETrolox/100 g de muestra de peso seco). La
inhibición del radical ABTS se calculó de acuerdo a la ecuación 4.
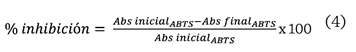
Donde:
Abs inicial_ABTS =
Absorbancia del radical ABTS antes de la reacción con la muestra.
Abs
final_ ABTS = Absorbancia del radical ABTS después de la reacción con
la muestra.
DPPH
La capacidad de reducción del radical
estable DPPH de los microencapsulados fue determinada utilizando 1 050 mL del
radical estable 2,2-difenil-1-picrilhidrazina (DPPH), que reaccionó con 50 mL
del microencapsulado durante 30 min en la oscuridad, siguiendo los métodos de
Martinez-Ramirez y col. (2024). La absorbancia fue medida a 515 nm, y los resultados
se expresaron en miligramos de equivalentes de ácido ascórbico (mg EA.A/100 g de peso seco). La inhibición del radical DPPH se
calculó de acuerdo a la ecuación 5.
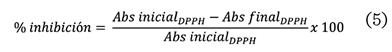
Donde:
Abs inicial_DPPH =
Absorbancia del radical DPPH antes de la reacción con la muestra.
Abs final_DPPH
= Absorbancia del radical DPPH después de la
reacción con la muestra.
Estabilidad
fisicoquímica de los microencapsulados a temperatura ambiente
Las muestras de los
diferentes tratamientos se
almacenaron a temperatura ambiente (aproximadamente 25 °C) y humedad relativa
constante, evitando la exposición a la luz directa, durante un periodo de hasta
6 meses, para determinar cambios en la
capacidad antioxidante de los polvos.
Actividad
antimicrobiana de los polvos
La actividad antimicrobiana de los
tratamientos microencapsulados de jugo de granada y extracto de jamaica se evaluó mediante el método de difusión en
pozos, basado en Borrás-Linares y col. (2015) con modificaciones. Se utilizaron
100 mL de suspensiones de Escherichia coli, Salmonella typhimurium
y Listeria monocytogenes, cultivadas en caldo de soya tripticaseína a 37
°C/24 h. Tras el cultivo, las células fueron lavadas y resuspendidas en
solución salina estéril (NaCl, 0.9 %) hasta alcanzar
una densidad óptica a 660 nm (OD660) de 0.5, equivalente a 6 log UFC/mL.
Cada suspensión se inoculó en agar por vertido y, tras la solidificación, se
perforaron pozos de 6 mm de diámetro. En cada pozo se depositaron 50 mL de las
cápsulas disueltas en una solución de citrato de sodio al 2 %. Luego de la
absorción del líquido, las placas se incubaron a 37 °C/24 h, y finalmente, se
midieron los diámetros de las zonas de
inhibición en milímetros.
Análisis
estadístico
Todos los análisis
se llevaron a cabo por triplicado. El procesamiento estadístico de los datos se
realizó con el software Statistica, versión 7.0, StatSoft (2009). Se aplicó un análisis de varianza de una
vía (ANOVA) seguido de la prueba de comparación múltiple de Tukey (P <
0.05).
RESULTADOS
Obtención de
microencapsulados de jugo de granada y extracto de jamaica
El proceso de
microencapsulación mediante secado
por aspersión demostró ser una opción de proceso efectiva, que permitió obtener
cinco muestras en forma de polvos finos, fáciles de manipular, con consistencia
suave y granular y sin signos de apelmazamiento, lo cual puede atribuirse a la
temperatura de entrada (100 °C) utilizada en el secador y que, además está estrechamente relacionada con el rendimiento del
proceso, ya que influye directamente en la transferencia de calor y masa
(Díaz-López y col., 2023).
Caracterización de
las microcápsulas
Humedad
Los niveles de
humedad iniciales fueron inferiores a 5 % excepto para la muestra (C1) (Tabla
1), valor considerado aceptable (Rodríguez y col., 2017)
por influir favorablemente en la estabilidad de los compuestos microencapsulados
(Álvarez-Cervantes y col., 2021).
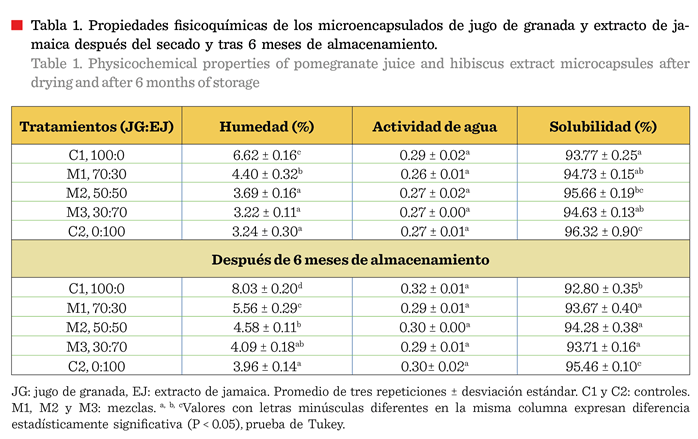
El contenido de humedad de todas las
muestras aumentó después de 6 meses, lo que indica
una reabsorción de agua desde el ambiente,
fenómeno esperado en productos secos almacenados sin un control adecuado
de la humedad relativa. Los tratamientos C1 y M1, ambos con contenido
predominante de jugo de granada, alcanzaron valores de 8.03 % y 5.56 %,
respectivamente, valores por encima de lo recomendado y que se asocia con
pérdida de la estabilidad estructural y funcional
de los microencapsulados. La mayor capacidad de absorción de agua del
jugo de granada puro podría deberse a su alto contenido de compuestos
hidrofílicos.
Las muestras que contenían extracto de
jamaica, como M2, M3 y C2, mantuvieron un contenido
de humedad por debajo de 5 % al término de los 6 meses, lo que indica
que la incorporación de jamaica podría tener un efecto positivo en la reducción
de la absorción de humedad. Este
comportamiento es consistente con estudios previos que sugieren que los
compuestos polifenólicos y la fibra,
presentes en la jamaica, podrían contribuir a una mayor estabilidad en
condiciones de almacenamiento (Tonon y col., 2010).
Actividad
del agua
El valor de actividad de agua (aw)
representa la fracción de agua libre, disponible en el sistema. Los valores de
aw en todos los tratamientos fueron inferiores a 0.3 (Tabla 1),
valor que se considera adecuado para mantener la estabilidad del polvo y
prolongar su vida útil (Reyes y col., 2018). Este nivel de aw indica
una limitada cantidad de agua libre disponible para participar en reacciones
bioquímicas, fisicoquímicas y el desarrollo
microbiano, entre otras, y que deterioran la calidad del producto, reduciendo
el riesgo de degradación fisicoquímica, el desarrollo microbiano, pardeamiento enzimático, reacciones hidrolíticas, oxidación lipídica y
enzimáticas durante el almacenamiento (Marques y col., 2007; Archaina y col.,
2019). Los valores obtenidos son similares a los reportados por Hernández-López
y col. (2018), quienes usaron también una
temperatura de entrada de 100 °C, para microencapsular Lactobacillus
pentosus, utilizando como pared una matriz de pulque y almidón. A esta
condición de secado se genera una transferencia de calor en las partículas que
incrementa la fuerza motriz de la evaporación y que favorece una mayor
eliminación de agua, resultando en polvos con un menor contenido de humedad
(Daza y col., 2016).
Después de 6 meses
de almacenamiento, los 5 tratamientos registraron un aumento en la aw, asociado
con el mayor contenido de humedad (Tabla 1), sin que se alcanzara,
aparentemente un cambio del estado vítreo que
se manifiesta con la presencia de aglomeración de las partículas o la degradación estructural de la matriz
encapsulante (Jafari y col., 2017). Archaina y col. (2019) reportaron valores de aw similares (0.33) en
microencapsulados de jamaica obtenidos mediante secado por aspersión que
mantuvieron su estructura en almacenamiento.
Solubilidad
La solubilidad de todos los
tratamientos de microencapsulados se presentó
por encima del 93 % (Tabla 1), lo cual se puede atribuir a que el uso de
MD con un valor alto de equivalente de dextrosa (DE) mejora la reconstitución
de los polvos (Archaina y col., 2019). El valor fue mayor (P < 0.05) para el
control de extracto de jamaica (C2), que para el de jugo de granada (C1).
Después de 6 meses de almacenamiento
la solubilidad descendió ligeramente en todas las muestras, aunque la mayoría
conservaron su solubilidad por encima del 93 %. Los tratamientos con extracto
de jamaica preservaron mejor la solubilidad, esto debido probablemente a la
mayor presencia de compuestos fenólicos, que pueden interactuar con los agentes
encapsulantes y darle estabilidad del polvo (Nguyen y col., 2022).
La solubilidad es un factor esencial
para evaluar el comportamiento de un producto
en fase acuosa y constituye un criterio fundamental para determinar la calidad de reconstitución de los polvos
(Choudhury y col., 2021). Para los consumidores, la capacidad de los
productos en polvo, de disolverse de manera rápida y completa, representa uno
de los principales indicadores de calidad. Diversos factores pueden influir en
esta propiedad, entre ellos, la composición inicial de la materia prima
destinada al secado por aspersión, los agentes portadores, las tasas de flujo
de aire comprimido y las bajas velocidades de alimentación (Jafari y col.,
2017).
Color
Las proporciones de jugo de granada
(M1) y extracto de jamaica (M3), tuvieron los mismos valores en L*
(luminosidad), lo cual, posiblemente afectó
los valores de H* (tono o matiz) (Tabla
2). Este fenómeno se puede explicar mediante
la interacción de factores como la concentración de compuestos naturales
en las materias primas y los efectos
térmicos durante el proceso de secado. El
tratamiento C1 (100:0, granada: jamaica) presentó un H* de 20.31, indicando un tono
rojo menos intenso que el tratamiento C2 (0:100
granada: jamaica) con valor de 4.89, que sugiere un tono rojo más puro. En las
soluciones de jugo de granada y extracto de jamaica se observó una tendencia
clara: a mayor proporción de extracto de jamaica, el matiz (H*) se desplazó
hacia tonos más rojos. Esta variación puede atribuirse a la mayor concentración
de antocianinas y otros compuestos fenólicos como en el extracto de
jamaica, que influyen en la percepción del
color. Estudios recientes han demostrado que la estabilidad y el tono
del color en productos de granada están también directamente relacionados con la concentración de estos
compuestos. Además, la interacción de las antocianinas con otros componentes puede afectar el matiz percibido en
productos derivados de este fruto (Türkyılmaz y col., 2023).
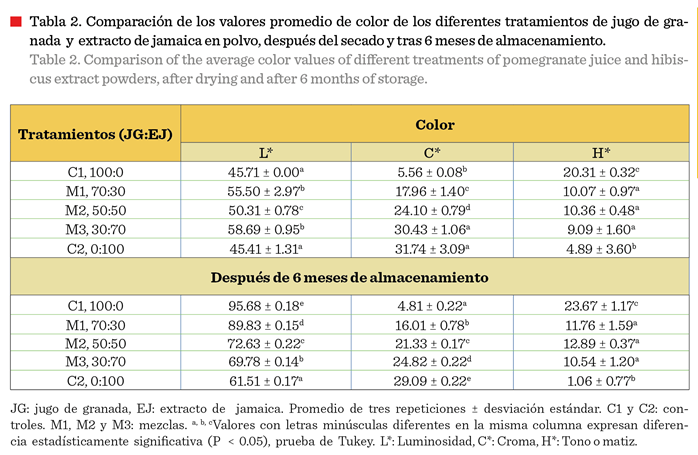
El valor del parámetro C* fue
significativamente superior (P < 0.05) en los tratamientos M3 y C2 en
comparación con C1 (Tabla 2). Este incremento se relaciona con el aumento en la
proporción de extracto de jamaica en la solución, lo cual indica una
intensificación del tono rojizo de los polvos. Dicho comportamiento es
consistente con estudios previos que sugieren que el extracto de jamaica, rico
en antocianinas, produce colores rojos intensos (Archaina y col., 2019).
Los dos
tratamientos control (C1 y C2) presentaron un valor similar de L* (» 45) que fue
superior en los tratamientos con combinaciones de ambos productos (50 a
58) (Tabla 2) sugiriendo un efecto aditivo entre ambos.
Los parámetros de H* registraron una
tendencia decreciente conforme aumentó la proporción de extracto de jamaica (P
< 0.05). El tratamiento C1 presentó el valor más alto de H*, lo cual indica
una tonalidad más cercana al rojo-anaranjado. En contraste, el tratamiento C2
registró el valor más bajo, reflejando un tono rojo más puro (Tabla 2). También
el parámetro C* mostró una tendencia a disminuir (P < 0.05) su valor durante
el almacenamiento en todas las muestras que contenían jugo de granada, lo que
sugiere la degradación parcial de antocianinas y otros pigmentos. Este fenómeno
es consistente con lo reportado por Tonon y col. (2010), quienes indicaron que
la estabilidad del color en polvos microencapsulados depende del tipo de
material encapsulante y de las condiciones de almacenamiento.
Los valores de L* aumentaron en todos
los tratamientos después de 6 meses, indicando coloración más clara, un
fenómeno asociado a la oxidación de pigmentos debido a reacciones de degradación térmica y oxidativa (Jafari
y col., 2017). El tratamiento C1 mostró el mayor incremento en L* (95.68 ±
0.18), al igual que M1 (89.83 ± 0.15) lo que
sugiere una pérdida significativa del color característico de la
granada. En contraste, la muestra con mayor proporción de extracto de jamaica
(M3) presentó la menor pérdida, lo que podría atribuirse a la mayor estabilidad
de sus antocianinas jamaica, en comparación
con las de la granada, como se ha documentado en estudios sobre la estabilidad
de antocianinas en diferentes matrices alimentarias (Türkyılmaz y col., 2023).
El color del microencapsulado es un
factor visual importante, que influye en la aceptación del consumidor (Jiménez-González y Guerrero-Beltrán, 2021), aunque
también debe considerarse la percepción del color después de
reconstituir el microencapsulado en un producto final, y su impacto en la
apariencia y aceptación sensorial global. Sin embargo, adicional a esta
percepción sensorial, los cambios de color
asociados con el almacenamiento de las muestras sugieren la oxidación de
los pigmentos y podría ser un indicador de la
pérdida de otras propiedades funcionales deseables de sus compuestos
bioactivos (Türkyılmaz y col., 2023).
Morfología
de las microcápsulas
Las micrografías
obtenidas mediante SEM, reflejaron que los
polvos de los diferentes tratamientos de jugo de granada y extracto de
jamaica están compuestos de micropartículas
de diámetro variable (Figura 1) que muestran morfologías típicas de
polvos secados por aspersión, como esferas
arrugadas caracterizadas por numerosas y grandes concavidades formadas
durante la rápida evaporación de las gotas
de líquido (Tatasciore y col., 2024). Los parámetros del secador por
aspersión, como la temperatura, la velocidad de alimentación y la composición
de la solución encapsulante, influyen significativamente en la forma de los
polvos (Rezende y col., 2018).
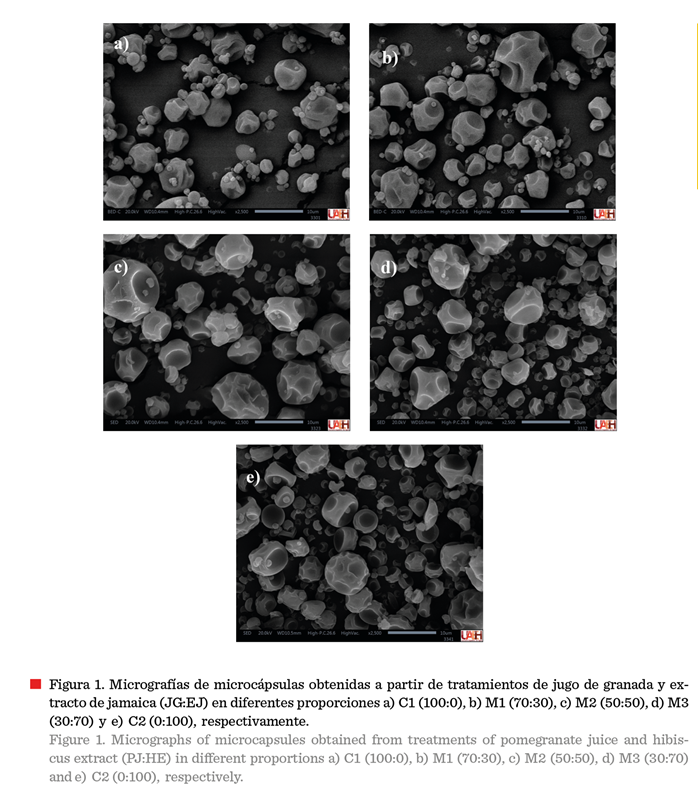
Las micropartículas obtenidas en este
estudio presentaron superficies externas intactas, sin grietas ni
complicaciones visibles, lo que indica una excelente capacidad de la MD y GA
para formar películas protectoras. Además, se observaron microcápsulas con
tamaños que varían entre 4 mm y 15 mm. Tonon y col. (2008) también obtuvieron microcápsulas de tamaños pequeños, concluyendo
que las partículas de menor tamaño se generan
al utilizar temperaturas más bajas en el aire de entrada (< 124 °C),
ya que esto favorece una mayor contracción. Un comportamiento similar fue
observado por Jafari y col. (2017), quienes
microencapsularon jugo de granada utilizando MD como material
encapsulante.
Capacidad antioxidante
La prueba de captación del radical
ABTS, mostró que el tratamiento control C1 alcanzó
una concentración de 2 563.47 mg de ETrolox/100 g de muestra de peso
seco, con un porcentaje de inhibición del 60.45 %. Esta técnica evalúa la
transferencia de electrones (hidrógenos), permitiendo la detección de
antioxidantes presentes en la muestra. En el
caso del radical DPPH, el mismo control presentó una concentración de 534.31 mg EA.A/100
g de muestra de peso seco y una inhibición
del 19.92 %. Estos resultados sugieren que el jugo de granada, por sí solo (C1), posee una capacidad antioxidante
significativa.
El tratamiento
control C2 alcanzó una concentración de 4 717.10 mg de ETrolox/100 g de muestra
de peso seco, con un porcentaje de inhibición del 95.68 %; y de 4 729.43 mg EA.A/100 g de muestra de peso seco, con inhibición del 80.83 %, ambos valores significativamente mayores
(P < 0.05) respecto a los alcanzados por el jugo de granada (Tabla 3). Al
incrementar la proporción de extracto de
jamaica en las tres mezclas, se observó un aumento en la actividad antioxidante e inhibitoria para ABTS y DPPH, con un rendimiento superior al del
tratamiento C1.
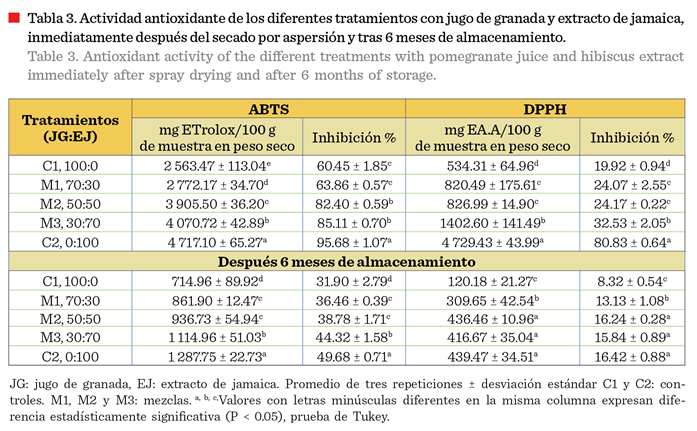
El efecto antioxidante observado puede
atribuirse a los metabolitos secundarios presentes en la granada y la jamaica.
En particular, estudios previos han reportado que P. granatum contiene
compuestos bioactivos como elagitaninos,
punicalagina, punicalina, ácido punícico y ácido elágico, los cuales,
debido a su notable capacidad antioxidante, han demostrado beneficios para la salud humana en ensayos in vitro
e in vivo (Haidari y col.,
2009; Khajebishak y col., 2019; Mortada y col., 2020). Por otro lado, investigaciones
sobre la jamaica han demostrado sus efectos beneficiosos para la salud,
principalmente atribuidos a su alta actividad antioxidante, gracias a la
presencia de compuestos bioactivos como ácidos fenólicos y antocianinas. Estos
compuestos juegan un papel fundamental en la neutralización de especies
reactivas de oxígeno, proporcionando un
efecto protector frente al daño celular (Borrás-Linares y col., 2015; Maciel y col., 2018; Vargas-León y col., 2018; Archaina
y col., 2019).
Los tratamientos
conteniendo jugo de granada y extracto de jamaica microencapsulados mostraron
capacidad antioxidante, que permanecen
durante el proceso de secado por aspersión, especialmente cuando se aumenta la
proporción de extracto de jamaica, lo que permite considerar a estos
ingredientes naturales como fuentes funcionales de compuestos bioactivos para
aplicaciones en la industria alimentaria y de suplementos (Archaina y col.,
2019).
Estabilidad los microencapsulados
después de 6 meses a temperatura ambiente
El almacenamiento por 6 meses a
temperatura ambiente (± 25 ºC), de los
polvos microencapsulados, indujo una reducción significativa en la
concentración de antioxidantes y en la capacidad de inhibición de los radicales ABTS y DPPH en todas las formulaciones (Tabla
3). El tratamiento control C1 mostró actividad antioxidante de 31.90 % y 8.32
%, respectivamente, valores menores a los presentados por el tratamiento C2 con
valores de 49.68 % y 16.42 %. Ambos tratamientos mantuvieron una actividad antioxidante relativa, con
inhibiciones del 36.46 % al 44.32 % para
ABTS y del 13.13 % al 16.24 % para DPPH.
La disminución de la actividad
antioxidante podría estar relacionada con la degradación de compuestos
bioactivos, como polifenoles, taninos y alcaloides, debido a factores como la
exposición al oxígeno, la humedad y la luz, como lo sugieren estudios previos
(Ochoa-Reyes y col., 2022). Sin embargo, que los tratamientos mantuvieran
actividad antioxidante tras seis meses, sugiere que estos microencapsulados
podrían ser una opción viable para aplicaciones en la industria alimentaria,
donde se requiere una funcionalidad prolongada
en productos procesados (Ozkan y col., 2019).
Capacidad
antimicrobiana
El tratamiento C1, compuesto de solo
jugo de granada, no presentó actividad antimicrobiana contra E. coli, L.
monocytogenes y Salmonella Typhimurium (Figura 2), ya que en el
análisis microbiológico no indujo la formación de halo de inhibición y tampoco
lo hicieron los tratamientos M1 y M2, que lo contenían hasta en un 50 %. En contraste, el tratamiento C2 (solo
extracto de jamaica) mostró una inhibición significativa del crecimiento bacteriano, con particular
eficacia para E. coli, con halo de inhibición de 11.43 ± 0.81 mm. El tratamiento
M3 conteniendo (70 % de extracto de jamaica fue el único que mostró una inhibición
significativa del crecimiento bacteriano.

Estos resultados
indicaron que solo el extracto de jamaica tuvo efecto inhibidor del crecimiento de
microorganismos a las condiciones
estudiadas, probablemente debido a su alta concentración de antocianinas y
polifenoles, compuestos bioactivos conocidos por su capacidad de alterar
la membrana celular de las bacterias y
suprimir su crecimiento, lo que demuestra su efectividad como agente antimicrobiano
(Portillo-Torres y col., 2019; Izquierdo-Vega y col., 2020). Rangel-Vargas y
col. (2017) encontraron que extractos acuosos de jamaica fueron efectivos en la
reducción de poblaciones de L. monocytogenes, S. Typhimurium y E.
coli en alimentos. La mayor eficacia observada en C2, y su pérdida a partir
de su adición en proporción 50:50, sugiere una relación dosis-dependiente entre
la concentración de extracto de
jamaica y la actividad antimicrobiana.
Los tratamientos C2 y M3 perdieron
parcialmente su capacidad antimicrobiana contra los patógenos evaluados después
de 6 meses de almacenamiento. Este fenómeno
puede atribuirse a la degradación de
antocianinas y polifenoles, compuestos bioactivos presentes en el
extracto de jamaica responsables de la actividad antimicrobiana
(Portillo-Torres y col., 2019).
La temperatura de almacenamiento
influye en la estabilidad de las antocianinas. A mayor temperatura, se
incrementa la tasa de degradación de estos compuestos. Un estudio indicó que
las antocianinas presentes en extractos de gulupa (Passiflora edulis,
Sims) mostraron la mayor tasa de degradación a temperatura ambiente (21 °C),
seguida por refrigeración (5 °C) y
congelación (-14 °C), donde fueron más estables (Meneses-Marentes y
col., 2019).
CONCLUSIONES
El proceso de secado por aspersión
confirió adecuadas propiedades fisicoquímicas de los microencapsulados de jugo
de granada y extracto de jamaica, y permitió preservar su capacidad
antioxidante. Los tratamientos C2 (extracto
de jamaica) y M3 (30:70, jugo de granada
y extracto de jamaica) fueron las muestras más prometedoras al presentar
y preservar mejor sus propiedades fisicoquímicas y antioxidantes, tonalidades
más rojizas y también fueron las únicas con capacidad antimicrobiana contra los
tres patógenos evaluados. Los resultados
obtenidos sugirieron que el uso de extracto de jamaica puede incrementar
las propiedades del jugo de granada, fruta con buena aceptación en el mercado.
La formulación 30:70 (jugo de granada: extracto de jamaica) podría ser una
alternativa ideal para el desarrollo de productos funcionales, aprovechando las
propiedades de ambos ingredientes.
Agradecimientos
Al Tecnológico
Nacional de México por el financiamiento del proyecto con clave 20677.24-PD denominado Evaluación de
las propiedades antioxidantes y antimicrobianas de microencapsulados de jugo de
granada adicionado con jamaica, en la convocatoria de Proyectos de
Investigación Científica, Desarrollo Tecnológico
e Innovación 2024, de los Institutos Tecnológicos Descentralizados.
Además, a la Universidad Autónoma del Estado de Hidalgo por todas las
facilidades de infraestructura usadas en el desarrollo experimental del
proyecto.
Declaración de
conflicto de intereses
Los autores declararon no tener
conflictos de intereses de ningún tipo.
Referencias
AACC, (2000). Approved Methods of the
American Association of Cereal Chemists, (11 th Ed.), Vol II, American
Association of Cereal Chemists,St. Paul. [En
línea]. Disponible en: https://www.cerealsgrains.org/resources/Methods/Pages/default.aspx.
Fecha de consulta: 6 de enero de 2025.
Álvarez-Cervantes, P., Cancino-Díaz,
J. C., Fabela-Illescas, H. E., Cariño-Cortés, R., López-Villegas, E. O.,
Ariza‑Ortega, J. A., Belefant-Miller, H., &
Betanzos-Cabrera, G. (2021). Spray-drying
micro-encapsulation of pomegranate juice increases its antioxidant activity
after in vitro digestion. International Journal of Food Science and
Technology, 56(10), 5089-5096. https://doi.org/10.1111/ijfs.15093
Archaina,
D., Vasile, F., Guzmán, J. J., Alamilla, L., &
Carolina, B. (2019). Physical and
functional properties of roselle (Hibiscus sabdariffa L.) extract spray dried
with maltodextrin-gum arabic mixtures. May, 1-9. https://doi.org/10.1111/jfpp.14065
Betanzos-Cabrera, G., Montes-Rubio, P. Y.,
Fabela-Illescas, H. E., Belefant-Miller, H., Cancino-Diaz, J. C., Montes-Rubio, P. Y., &
Fabela-Illescas, H. E. (2015). Antibacterial
activity of fresh pomegranate juice against clinical strains of Staphylococcus
epidermidis. Food & Nutrition Research, 59(1), 27620. https://doi.org/10.3402/fnr.v59.27620
Borrás-Linares, I., Fernández-Arroyo, S., Arráez-Roman, D., Palmeros-Suárez, P. A., Del-Val-Díaz, R.,
Andrade-Gonzáles, I., Fernández-Gutiérrez, A., Gómez-Leyva, J. F., &
Segura-Carretero, A. (2015). Characterization of phenolic compounds,
anthocyanidin, antioxidant
and antimicrobial activity of 25 varieties of Mexican Roselle
(Hibiscus sabdariffa). Industrial
Crops and Products, 69,
385-394. https://doi.org/10.1016/j.indcrop.2015.02.053https://doi.org/10.32870/rmip.vi.552
Choudhury, N., Meghwal, M., &
Das, K. (2021). Microencapsulation:
An overview on concepts, me-thods, properties and applications in foods. Food Frontiers, 2(4), 426–442. https://doi.org/10.1002/fft2.94
Daza, L. D., Fujita, A., Fávaro-Trindade, C. S., Rodrigues-Ract,
J. N., Granato, D., & Genovese, M. I. (2016). Effect of spray drying conditions on the physical
properties of Cagaita (Eugenia dysenterica DC.) fruit extracts. Food and
Bioproducts Processing, 97, 20-29. https://doi.org/10.1016/j.fbp.2015.10.001
Dhakal, S. P. & He, J. (2020).
Microencapsulation of vitamins in food applications to prevent losses in
processing and storage: A review. Food Research International,
137, 109326. https://doi.org/10.1016/j.foodres.2020.109326
Díaz-López, A. C., Villa-Cruz, V. y Vela-Gutiérrez, G.
(2023). Viabilidad de bacterias ácido lácticas microencapsuladas mediante secado por aspersión con almidón
de malanga en dos suplementos alimenticios. CienciaUAT,
18(2), 145-154. https://doi.org/10.29059/cienciauat.v18i2.1804
Haidari,
M., Ali, M., Ward Casscells, S., & Madjid, M. (2009). Pomegranate (Punica granatum) purified polyphenol extract inhibits influenza virus
and has a synergistic effect
with oseltamivir. Phytomedicine,
16(12), 1127–1136. https://doi.org/10.1016/j.phymed.2009.06.002
Hernández-López, Z., Rangel-Vargas, E., Castro-Rosas, J.,
Gómez-Aldapa, C. A., Cadena-Ramírez, A., Acevedo-Sandoval, O. A.,
Gordillo-Martínez, A. J., & Falfán-Cortés, R. N.
(2018). Optimization of a spray-drying process
for the production
of maximally viable microencapsulated Lactobacillus pentosus
using a mixture of starch-pulque as wall material.
Lwt, 95, 216–222. https://doi.org/10.1016/j.lwt.2018.04.075
Izquierdo-Vega, J. A., Arteaga-Badillo, D. A.,
Sánchez-Gutiérrez, M., Morales-González, J. A., Vargas-Mendoza, N.,
Gómez-Aldapa, C. A., Castro-Rosas, J., Delgado-Olivares, L., Madrigal-Bujaidar, E., & Madrigal-Santillán, E. (2020). Organic acids from
Roselle (Hibiscus sabdariffa L.)-A brief review of its
pharmacological effects. Biomedicines, 8(5), 1-16. https://doi.org/10.3390/BIOMEDICINES8050100
Jafari, S. M., Ghalegi-Ghalenoei, M.,
& Dehnad, D. (2017). Influence of spray drying on water solubility index,
apparent density, and anthocyanin content of pomegranate juice powder. Powder Technology, 311,
59-65. https://doi.org/10.1016/j.powtec.2017.01.070
Jiménez-González, O. & Guerrero-Beltrán, J. Á. (2021). Extraction, microencapsulation, color properties, and experimental design of natural pigments obtained by spray
drying. In Food Engineering Reviews,13(4), 769-811. https://doi.org/10.1007/s12393-021-09288-7
Khajebishak, Y., Payahoo, L., Alivand, M., Hamishehkar, H., Mobasseri, M., Ebrahimzadeh, V., Alipour, M., & Alipour, B.
(2019). Effect of pomegranate seed oil
supplementation on the GLUT-4 gene expression and glycemic control in obese
people with type 2 diabetes: A randomized controlled clinical trial. Journal of Cellular
Physiology,
234(11), 19621–19628. https://doi.org/10.1002/jcp.28561
Maciel, L. G., do-Carmo, M. A. V., Azevedo, L., Daguer, H., Molognoni, L.,
de-Almeida, M. M., Granato, D., & Rosso, N. D.
(2018). Hibiscus sabdariffa
anthocyanins-rich extract:
Chemical stability, in vitro antioxidant
and antiproliferative activities.
Food and Chemical Toxicology,
113, 187-197. https://doi.org/10.1016/j.fct.2018.01.053
Marques,
L. G., Ferreira, M. C., & Freire, J. T. (2007). Freeze-drying of acerola (Malpighia glabra L.). Chemical
Engineering and Processing: Process Intensification, 46(5), 451–457. https://doi.org/10.1016/j.cep.2006.04.011
Martinez-Ramirez, E. Z., Gonzalez-Cruz, L.,
Bernardino-Nicanor, A., Silva-Martínez, G. A., Falfan-Cortes, R. N., Gonzalez-Montiel, S., & Gomez-Aldapa,
C. A. (2024). Hibiscus Acid
Inhibitory Capacity of Angiotensin Converting Enzyme: an In Vitro and In Silico
Study. Plant Foods for
Human Nutrition,
79(1), 234-241. https://doi.org/10.1007/s11130-024-01142-5
Meneses-Marentes, N. A., Herrera-Ramírez, E. J., &
Tarazona-Díaz, M. P. (2019). Characterization and
stability of an extract rich in anthocyanins from passion purple fruit peel. Revista Colombiana de Quimica, 48(2), 27–32. https://doi.org/10.15446/rev.colomb.quim.v48n2.76682
Mortada,
W. I., Awadalla, A., Khater,
S. M., Barakat, N. M., Husseiny,
S. M., & Shokeir, A. A. (2020). Preventive effect of pomegranate
juice against chemically induced bladder cancer: An experimental study. Heliyon, 6(10), e05192. https://doi.org/10.1016/j.heliyon.2020.e05192
Nguyen, Q. D., Dang, T. T.,
Nguyen, T. V. L., Ngu-yen, T. T. D., & Nguyen, N.
N. (2022). Microencapsulation
of roselle (Hibiscus sabdariffa L.) anthocyanins: Effects of different carriers
on selected physicochemical properties and antioxidant activities of
spray-dried and freeze-dried powder. International
Journal of Food Properties, 25(1), 359-374. https://doi.org/10.1080/10942912.2022.2044846
Ochoa-Reyes, E., Guevara-Aguilar, A. y Tirado-Gallegos, J. M. (2022). Adición de extracto de cáscara de
granada en un alimento tradicional mexicano y evaluación de la estabilidad al
procesado. Universitas Agri, 1 (1): 18
Ozkan, G., Franco, P., De-Marco, I., Xiao, J.,
& Capanoglu, E. (2019). A
review of microencapsulation methods for food antioxidants: Principles,
advantages, drawbacks and applications. Food Chemistry, 272: 494–506. https://doi.org/10.1016/j.foodchem.2018.07.205
Portillo-Torres,
L. A., Bernardino-Nicanor, A., Gómez-Aldapa, C. A., González-Montiel, S.,
Rangel-Vargas, E., Villagómez-Ibarra, J. R., González-Cruz, L., Cortés-López,
H., & Castro-Rosas, J. (2019). Hibiscus acid and chromatographic fractions from Hibiscus sabdariffa calyces: Antimicrobial activity against multidrug-resistant pathogenic
bacteria. Antibiotics, 8(4), 1-18. https://doi.org/10.3390/antibiotics8040218
Rangel-Vargas, E., Gómez-Aldapa, C. A., Falfan-Cortes, R.
N., Rodŕiguez-Maŕin, M. L., Godinez-Oviedo,
A., Acevedo-Sandoval, O. A., & Castro-Rosas, J. (2017). Attachment
of 13 types of foodborne bacteria to Jalapeño and Serrano peppers
and antibacterial effect of roselle calyx
extracts, sodium hypochlorite, colloidal silver, and acetic acid against these
foodborne bacteria on peppers. Journal of Food
Protection, 80(3), 406-413. https://doi.org/10.4315/0362-028X.JFP-16-269
Reyes, V., Chotiko, A., Chouljenko,
A., & Sathivel, S. (2018). Viability of Lactobacillus acidophilus NRRL
B-4495 encapsulated with high maize starch, maltodextrin, and gum arabic. Lwt,
96, 642-647. https://doi.org/10.1016/j.lwt.2018.06.017
Rezende,
Y. R. R. S., Nogueira, J. P., & Narain, N. (2018). Microencapsulation
of extracts of bioactive compounds obtained from acerola (Mal-pighia emarginata DC) pulp and residue by spray and freeze
drying: Chemical, morphological
and chemometric characterization.
Food Chemistry, 254, 281-291. https://doi.org/10.1016/j.foodchem.2018.02.026
Ribeiro, A. M., Shahgol, M.,
Estevinho, B. N., & Rocha, F. (2020). Microencapsulation of Vitamin A by
spray-drying, using binary and ternary blends of gum arabic, starch and
maltodextrin. Food Hydrocolloids, 108, 106029. https://doi.org/10.1016/j.foodhyd.2020.106029
Rodríguez, O., Cardoso, F., González, J., Íñiguez, C. y
Núñez, M. (2017). Temperaturas de secado para la microencapsulación de
saborizantes frutales mediante secado por aspersión. Ciencia y Tecnología de
Alimentos, 27(3), 1-6.
Tatasciore, S., Santarelli, V., Neri, L.,
Di-Mattia, C. D., Di-Michele, A., Mastrocola,
D., & Pittia, P. (2024). Microencapsulation of hop bioactive compounds by spray
drying: Role of inlet temperature and wall material. Current Research in
Food Science, 8. 100769 https://doi.org/10.1016/j.crfs.2024.100769
Tonon, R. V., Brabet, C., & Hubinger, M. D. (2008). Influence of process conditions on the
physico-chemical properties of açai (Euterpe oleraceae Mart.) powder produced
by spray drying. Journal of Food Engineering, 88(3), 411–418. https://doi.org/10.1016/j.jfoodeng.2008.02.029
Tonon, R. V, Brabet, C., &
Hubinger, M. D. (2010). Anthocyanin stability and antioxidant activity of
spray-dried açai (Euterpe oleracea Mart.) juice produced with different carrier
agents. Food Research International, 43(3), 907–914. https://doi.org/10.1016/j.foodres.2009.12.013
Türkyılmaz, M., Hamzaoğlu, F.,
Çiftci, R. B. A., & Özkan, M. (2023). Increase in colour stability of pomegranate juice against 5-hydroxymethylfurfural (HMF) through copigmentation with phenolic acids. Journal of the
Science of Food and Agriculture, 103(15), 7836–7848. https://doi.org/10.1002/jsfa.12866
Vargas-León, E. A., Díaz-Batalla, L., González-Cruz, L.,
Bernardino-Nicanor, A., Castro-Rosas, J., Reynoso-Camacho, R., &
Gómez-Aldapa, C. A. (2018). Effects of acid
hydrolysis on the free radical scavenging capacity and inhibitory activity of
the angiotensin converting enzyme of phenolic compounds of two varieties of
Jamaica (Hibiscus sabdariffa). Industrial Crops and Products, 116,
201-208. https://doi.org/10.1016/j.indcrop.2018.02.044
Ye, Q., Georges, N., & Selomulya,
C. (2018). Microencapsulation of active ingredients in functional foods: From
research stage to commercial food products. Trends in Food Science and
Technology, 78, 167-179. https://doi.org/10.1016/j.tifs.2018.05.025