https://doi.org/10.29059/cienciauat.v20i1.2007
Optimización del proceso de
hidrólisis del colágeno bovino y evaluación de sus propiedades tecnofuncionales
y antioxidantes
Optimization of the bovine
collagen hydrolysis process and evaluation of its techno-functional and
antioxidant properties
Optimización de la
hidrólisis de colágeno
Raúl Reyes-Bautista1*,
Erik Gustavo Tovar-Pérez2, Gustavo Hernández-Mendoza1,
Luis Alberto Reyes-Nava3, Jorge Enrique Pliego-Sandoval3
*Correspondencia:
raul.rb@purisima.tecnm.mx/Fecha de recepción: 4 de marzo de 2025/Fecha de
aceptación: 9 de septiembre de 2025/Fecha de publicación: 15 de septiembre de
2025
1Tecnológico
Nacional de México/ITS de Purísima del Rincón, Laboratorio de Bioprocesos,
División de Ingeniería Bioquímica, boulevard del Valle núm. 2301, Guardarrayas,
Purísima del Rincón, Guanajuato, México, C. P. 36425. 2Universidad
Autónoma de Querétaro, campus Amealco, Facultad de Ingeniería, Amealco de
Bonfil, Querétaro, México, C. P. 76850. 3Universidad de Guadalajara,
Centro Universitario del Sur, Departamento de Ciencias de la Naturaleza, Ciudad
Guzmán, Jalisco, México, C. P. 49000.
Resumen
El
colágeno es una proteína abundante en los organismos vertebrados. Forma parte
de tejidos conectivos como la piel, las articulaciones, los ligamentos y los
huesos. Se puede hidrolizar enzimáticamente con la finalidad de mejorar sus propiedades tecnofuncionales (solubilidad, emulsificación,
espumantes, entre otras). Durante la generación de colágeno hidrolizado se
exponen secuencias peptídicas que presenten propiedades bioactivas, como
antioxidantes, antihipertensivas y
antidiabéticas. El objetivo de este trabajo fue optimizar el grado de
hidrólisis del colágeno bovino mediante proteasas comerciales y la evaluación de las propiedades
tecnofuncionales y antioxidantes, de los productos resultantes. La optimización
del grado de hidrólisis se realizó
usando la metodología de superficie de respuesta, mediante un diseño central
compuesto. El análisis proximal de la materia prima mostró un alto contenido de
proteína (88 %). El proceso de optimización indicó un grado de hidrólisis
extensivo (76.38 %, P ≤0.05) para la enzima PAL®, con una relación E/S de 1.43
UN/g en un tiempo de 23.75 h. Las propiedades tecnofuncionales se asociaron de manera
positiva (P ≤ 0.05) con el grado de hidrólisis: 95.02 % con la solubilidad (pH 9), 48 % y 34 % con la capacidad y
la estabilidad de emulsificación, respectivamente. El espumado disminuyó en
función del incremento del grado de hidrólisis con la enzima HT proteolitic®,
alcanzando una reducción del 47 % de la estabilidad y 26 % en la capacidad. La
capacidad antioxidante del colágeno hidrolizado (24 h) incrementó de manera
significativa (P ≤ 0.05), mostrando un valor de 62.38 % (DPPH) y 0.39 UA700 nm (poder reductor) con la enzima PAL® y de
80.55 % (ABTS) para la enzima HT proteolitic®. La optimización de la hidrólisis
enzimática del colágeno mejoró sus propiedades tecnofuncionales (solubilidad y
emulsificación) y antioxidantes.
PALABRAS CLAVE: colágeno hidrolizado,
grado de hidrólisis, propiedades tecnofuncionales, optimización, actividad
antioxidante.
ABSTRACT
Collagen is a protein abundant in vertebrate
organisms. It is part of connective tissues such as skin, joints, ligaments,
and bones. To enhance its techno-functional characteristics, namely solubility,
viscosity, emulsification, and foaming capacity, it can undergo chemical and
enzymatic hydrolysis. This process unveils specific peptide sequences with demonstrable bioactive functions,
including antioxidant, antihypertensive, and antidiabetic effects. The present
paper had a twofold purpose. Firstly, it aimed
at optimizing the enzymatic hydrolysis of bovine collagen using commercial proteases. Secondly, it intended to
assess the resulting products in terms of
their techno-functional and antioxidant properties. Hydrolysis optimization was
conducted using response surface
methodology (RSM) with a Central Composite Design. Proximate analysis of the raw material indicated a high protein content
(88 %). The optimization process indicated an extensive hydrolysis level (76.38
%, P ≤ 0.05) for the PAL® enzyme, with an E/S ratio of 1.43 UN/g within a 23.75 h period. The techno-functional properties were
positively correlated (P ≤ 0.05) with the hydrolysis degree: 95.02% with solubility (pH 9), and 48% and 34%
with capacity and emulsification stability respectively. Conversely, foaming
capacity of emulsification declined with increased hydrolysis when the HT
proteolytic® enzyme was applied, resulting in a 47 % reduction in foam
stability and a 26 % decrease in foam volume. The antioxidant capacity of
hydrolyzed collagen (24 h) increased
significantly (P ≤ 0.05), showing a 62.38 % value (DPPH) and 0.39 UA700
nm (reduction power) employing the PAL® enzyme and an 80.55 % value (ABTS)
employing the HT proteolytic® enzyme. Overall, the optimization of enzymatic
collagen hydrolysis enhanced both the techno-functional (solubility and
emulsification) and antioxidant properties of the final hydrolysates.
KEYWORDS: hydrolyzed
collagen, degree of hydrolysis, techno-functional properties, process optimization, antioxidant activity.

INTRODUCCIÓN
El colágeno es una de
las proteínas más ubicuas y abundantes. Está presente en los tejidos conectivos laxo y denso, piel, tendones, huesos,
cartílago, córneas, dentina y vasos sanguíneos. Su nombre proviene del griego “kólla”
(pegamento) y “gen” (producción), aludiendo a su función estructural en
los tejidos (Silvipriya y col., 2015).
Entre las diversas
fuentes de colágeno comercial se encuentran los animales terrestres, las aves
de corral y las especies marinas (Zhang y col., 2016a; Tawalbeh y col., 2025).
La piel y los huesos de origen porcino y bovino se utilizan ampliamente para obtener
colágeno con esos fines (Deng y col., 2023). Actualmente, diferentes industrias
utilizan diversos residuos de producción, como las pieles de pescado y pollo,
para su obtención, así como del procesamiento de grenetinas, basadas en
procesos de economía circular, con enfoques integrados y holísticos para la
utilización de los residuos alimentarios (Zhang y col., 2022).
El mercado del
colágeno ha mejorado constantemente y el índice de productos que lo contienen
ha aumentado debido a sus excepcionales propiedades tecnofuncionales y
bioactivas que tienen aplicaciones en las industrias alimentaria y farmacéutica (Barzideh y col., 2014). Sus
propiedades se pueden clasificar en dos categorías: las relacionadas con su
comportamiento gelificante, como la capacidad de retención de agua, la
formación de gel, el espesamiento y la texturización; y las asociadas con el
comportamiento superficial, como la formación
de películas, la función coloide protectora, la adhesión y cohesión, la
estabilización, la formación de espuma y la emulsión (Ahmad y col., 2024).
Debido a su
funcionalidad y creciente demanda, se han realizado diversos estudios para
mejorar la calidad y las aplicaciones mediante su transformación en
hidrolizados o péptidos bioactivos (León-López y col., 2019 Aguirre-Cruz y
col., 2020). Se ha demostrado que los péptidos contenidos en el colágeno
hidrolizado pueden favorecer la salud humana, exhibiendo actividades con
efectos antihipertensivos, antiinflamatorios, antioxidantes, anticancerígenos,
antiobesogénicos, antimicrobianos y antidiabéticos (Anzani y col., 2020).
El colágeno
hidrolizado se puede obtener mediante el uso de enzimas comerciales. En ese
proceso se rompen los enlaces peptídicos de la proteína, formándose moléculas
más pequeñas, tales como, péptidos y aminoácidos libres (Ulug y col., 2021).
Los péptidos
antioxidantes son moléculas naturales utilizadas en la industria alimentaria,
farmacéutica y cosmética, por su capacidad para prevenir o retrasar la
oxidación, lo que los convierte en un ingrediente popular en diversos productos (Aguirre-Cruz y col.,
2020). Se ha evidenciado la actividad antioxidante
de los hidrolizados/péptidos de colágeno obtenidos de piel de bovino, cerdo,
pescado, pollo, así como de subproductos (huesos, pellejos, cartílagos) de las mismas fuentes. Dicha actividad puede evaluarse in
vitro mediante métodos de generación de radicales libres (DPPH y
ABTS) y reacciones redox (poder reductor) (Hong y col., 2019; León-López y
col., 2019).
El colágeno
hidrolizado tiene un alto potencial en la
industria alimentaria, ya que puede contribuir a propiedades
tecnofuncionales como la formación de espuma, la solubilidad y la emulsión.
Estas propiedades pueden verse afectadas por distintos parámetros de
hidrólisis, como el tipo de enzimas utilizadas, el tiempo de hidrólisis, la relación enzima-sustrato, la temperatura, la relación disolvente/material
(tejido conteniendo colágeno) y el pH (Tawalbeh y col., 2023).
La optimización de la
hidrólisis del colágeno ha sido estudiada mediante la metodología de superficie
de respuesta (MSR) (Hema y col., 2017; Yu y col., 2018; Blanco y col., 2019;
Nguyen y col., 2021). Esta herramienta estadística y matemática se utiliza ampliamente en el diseño de experimentos por su facilidad para optimizar las condiciones en que una
o varias variables pueden mejorar un proceso
(Myers y col., 2016; Montgomery, 2020).
El objetivo del
presente trabajo fue evaluar la optimización del grado de hidrólisis del
colágeno bovino mediante dos proteasas comerciales y determinar las propiedades
tecnofuncionales y antioxidantes de los productos resultantes.
Materiales y métodos
Materia prima
Se
trabajó con barredura (colágeno parcialmente desnaturalizado,
obtenido de pieles bovinas) provenientes de la industria productora de
grenetina, proporcionada por la empresa Nova
Orgánica S. A. de C. V., y generadas por la empresa Progel S. A. de C.
V. Las muestras fueron deshidratadas a 60 °C durante 3 h en un horno de secado (Thermo Scientific Heratherm,
Waltham, EUA) y posteriormente se molieron en molino de cuchillas (IKA® A-10
Basic, Staufen, Alemania). La harina obtenida se hizo pasar por un tamiz
de 250 mm y fue almacenada en refrigeración
a 4 °C durante 6 meses, y procesada para su análisis, en un periodo no
mayor a 6 meses hasta su uso.
Análisis químico
proximal
El análisis químico
proximal de la harina de barredura se realizó de acuerdo con los métodos de la
Asociación de Químicos Analíticos Oficiales (AOAC, por sus siglas en inglés:
Association of Official Analytical Chemists) (AOAC, 2000). Determinación de humedad
por método de secado en horno (método No. 14004); cenizas por incineración
(método No. 14006); extracto etéreo (grasas) por el método de Soxhlet (No.
7.056); determinación de proteínas por el método Kjeldahl (No. 2.049)
utilizando un factor de conversión de 5.55 (Sosulski y Imafidon, 1990).
Hidrólisis del
colágeno
Las muestras de harina
de colágeno se hidrolizaron comparando la acción de dos proteasas comerciales
PAL® y HT proteolitic® (Enmex, Grupo Kerry) ambas de grado alimenticio. La
enzima PAL®, se produce mediante fermentación controlada usando Bacillus
licheniformis. Tiene actividad reportada > 2 600 UN/g (Unidad de
Northrop; se define como la cantidad de enzima que hidroliza el 40 % del
sustrato de caseína en las condiciones del
ensayo) (Lambré y col., 2023) y sus condiciones óptimas de operación se
obtienen a 60 °C y pH 8.5. La enzima HT proteolitic® se obtiene por
fermentación controlada de Bacillus subtilis. Su actividad > 180
UN/g, y sus condiciones óptimas de operación son 50 °C y pH 7.2.
El proceso de
hidrólisis, para cada enzima, se llevó a cabo utilizando un diseño factorial
mixto, con dos factores: tiempo (0 h, 4 h, 8
h, 12 h, 16 h, 20 h y 24 h) y relación enzima-sustrato [E/S] (0.4 UN/g,
0.8 UN/g y 1.2 UN/g). El proceso de hidrólisis se realizó por triplicado en
matraces Erlenmeyer, con una relación [E/S]: búfer 1:10 (m/v) y agitación
constante (120 rpm). El pH se ajustó con búfer de fosfatos 0.1 M y, junto con
la temperatura, se mantuvieron en el nivel óptimo para cada enzima evaluada. La
reacción enzimática fue detenida añadiendo fluoruro de fenilmetilsulfonilo
(PMSF 2 mg/mL) en una relación 1:10 (v/v). Las muestras fueron congeladas a -20
°C hasta su análisis. La eficacia del proceso hidrolítico se evaluó
determinando la cantidad de enlaces peptídicos escindidos mediante la medición
del grado de hidrólisis.
Grado de hidrólisis
(GH)
Se determinó evaluando
la cantidad de grupos amino libres, por el método de ácido
trinitrobenzensulfónico (TNBS) (Adler-Nissen, 1979), con algunas
modificaciones. Se añadieron alícuotas de 125 mL de las muestras hidrolizadas a
tubos de ensayo que contenían 1 mL de búfer de fosfatos 0.5 M, pH 8.2.
Posteriormente, se agregó 1 mL de solución de TNBS (1 mg/mL en agua destilada);
la mezcla se incubó a 50 ºC durante 1 h en oscuridad utilizando un termo baño
(Felisa®, Zapopan, México). La reacción se detuvo añadiendo 2 mL de HCl 0.1 N.
Las muestras se enfriaron a temperatura ambiente durante 30 min y se midió la absorbancia a 340 nm utilizando un lector de
microplacas (Thermo scientific Multiskan SKY, Waltham, EUA). El GH se
calculó mediante la ecuación (1):
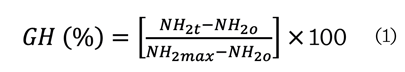
Donde:
NH2t =
concentración de grupos amino libres después de la hidrólisis.
NH2o =
concentración de grupos amino libres del colágeno sin hidrolizar.
NH2max =
concentración de grupos amino libres después
de hidrólisis total del colágeno (que se realizó por hidrólisis con HCl
6 N a 120 ºC durante 24 h).
La
concentración de grupos amino libres se expresó en meq
L-Leucina/g proteína, los cuales fueron
determinados mediante la elaboración de
una curva patrón de L-Leucina (0 mM- 2.5 mM).
Optimización del GH
Las condiciones
utilizadas como base para el estudio de optimización fueron a las 24 h con una
relación E/S de 1.2 UN/g, debido a que obtuvieron el mayor GH. Para evaluar los
efectos de los parámetros de procesamiento, incluido el tiempo y la relación enzima-sustrato, se utilizó la MSR, empleando un diseño central
compuesto (DCC) de 2 factores y 5 niveles (Tabla 1).
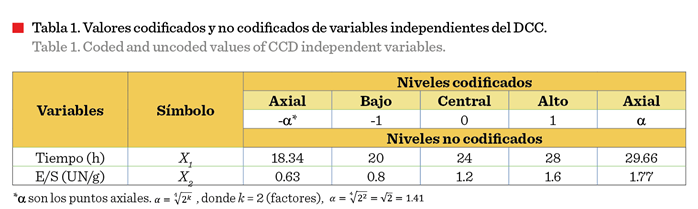
La variable
dependiente (Y) fue el grado de hidrólisis.
El DCC incluyó 24 experimentos, que consistieron en 9 puntos factoriales, 6 puntos
axiales y 9 puntos centrales (Zhang y col., 2016b). Los datos experimentales de
los ensayos se ajustaron a un polinomio empírico de segundo orden, de acuerdo
con la ecuación (2):
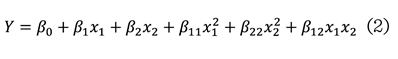
Donde:
b0
= Coeficiente constante de intersección.
b1 y b2
= Coeficientes de primer orden.
b1 1 y b22
= Coeficientes de segundo orden.
b12
= Coeficiente de la
interacción.
La ecuación del modelo
propuesto predice la respuesta en función de los diferentes niveles de las
variables independientes (X1: tiempo y X2:
relación E/S). La significancia de cada coeficiente en el modelo resultante se
determinó utilizando la prueba F y el valor P alcanzado. La adecuación del
modelo polinomial se expresó mediante el coeficiente de determinación múltiple
(![]() ) y se empleó el
análisis de varianza (ANOVA, por sus siglas en inglés: Analysis of Variance)
para determinar la significancia del modelo. Además, la ecuación polinomial
ajustada se presentó como un gráfico de superficie para visualizar la relación
entre la respuesta y los niveles experimentales de cada factor, los cuales se
mostraron mediante el diagrama de Pareto de efectos estandarizados. El análisis
estadístico se realizó utilizando el
software Minitab 18 (State College, PA 16801, USA).
) y se empleó el
análisis de varianza (ANOVA, por sus siglas en inglés: Analysis of Variance)
para determinar la significancia del modelo. Además, la ecuación polinomial
ajustada se presentó como un gráfico de superficie para visualizar la relación
entre la respuesta y los niveles experimentales de cada factor, los cuales se
mostraron mediante el diagrama de Pareto de efectos estandarizados. El análisis
estadístico se realizó utilizando el
software Minitab 18 (State College, PA 16801, USA).
Determinación de
proteína soluble
Se
cuantificaron las fracciones proteínicas mediante el método de Bradford (1976),
con algunas modificaciones. Brevemente, el reactivo de Bradford
se obtuvo al: 0.01 % (m/v) Azul Brillante de Coomassie G-250, 4.7 % (m/v)
etanol y 8.5 % (m/v) de ácido fosfórico. Se mezclaron 100 mL de la disolución
de proteína con 5 mL del reactivo de Bradford. La absorbancia se midió a 595 nm
después de 2 min en un lector de microplacas (Thermo scientific Multiskan SKY,
Waltham, EUA). Se elaboró una curva patrón de albúmina sérica bovina (BSA, por
sus siglas en inglés: bovine serum albumin) 0.1 mg/mL a 1 mg/mL, para
cuantificar la concentración de proteína en las muestras de colágeno
hidrolizado.
Propiedades
tecnofuncionales
Las
propiedades de solubilidad, espumado y emulsificación, se evaluaron de acuerdo
con los métodos reportados por Hu y col. (2023) con algunas
modificaciones.
Solubilidad
La solubilidad de las
fracciones proteínicas (sin hidrolizar) y de los hidrolizados de colágeno se
determinaron preparando dispersiones al 1 % m/v en búfer de fosfatos 0.05 M
(ajustando el pH de 3 a 9 con HCl o NaOH 0.1 M). Las dispersiones se mantuvieron
en agitación en una placa (IKA® C-MAG,
Staufen, Alemania) durante 30 min y se centrifugaron a 10 000 xg por 30
min a temperatura ambiente. Los sobrenadantes se filtraron a través de filtros
de 0.45 mm (Millipore, Mississauga, Canadá) y se determinó la proteína
solubilizada por el método de Bradford. El porcentaje de solubilidad se calculó
mediante ecuación (3).
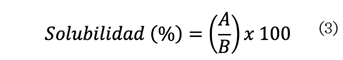
Donde:
A
= cantidad de proteína en el sobrenadante.
B
= cantidad de proteína en la dispersión inicial.
Espumado
La capacidad de
espumado (CEs) y la estabilidad de espumado (EEs) se determinaron preparando
dispersiones al 1 % m/v en búfer de fosfatos 0.05 M. Las dispersiones de
proteína e hidrolizados se homogenizaron por separado a 13 500 rpm durante 1
min, utilizando un homogeneizador (Ultra Turrax IKA T25, IKA-Labortechnick, Staufen, Alemania). La CEs y
EEs de espumado se calcularon mediante las ecuaciones (4 y 5):
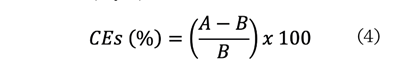
Donde:
A = volumen de la
espuma inmediatamente después de homogenizar.
B = volumen inicial de
la fase líquida.
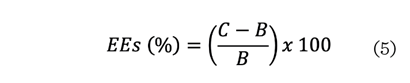
Donde:
C = volumen de la
espuma después de 30 min.
B = volumen inicial de
la fase líquida.
Emulsificación
Se evaluó la capacidad
de emulsificación (CEm) y la estabilidad de emulsificación (EEm), de la
fracción proteínica e hidrolizados. Para la formación de la emulsión, se
mezclaron 5 mL de la dispersión de la muestra (1 % m/v en búfer de fosfatos
0.05 M) con 5 mL de aceite de maíz y se homogenizaron a 20 000 rpm durante 1 min, utilizando un homogeneizador Ultra
Turrax (IKA T25, IKA-Labortechnick, Staufen, Alemania). Una vez formada
la emulsión, ésta se sometió a
centrifugación a 3 000 xg durante 5 min. La CEm se determinó mediante la
ecuación (6):
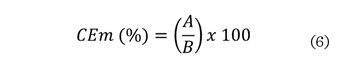
Donde:
A = altura de la capa
emulsificada después de centrifugar.
B
= altura del contenido antes de la emulsión.
La EEm se midió en
presencia de calor, manteniendo la emulsión formada en baño maría usando un termo baño (Felisa®, Zapopan, México) a
80 °C durante 30 min. Pasado este tiempo se enfrió a chorro de agua (25
°C). Posteriormente la emulsión se centrifugó a 3 000 xg por 5 min. Para la
evaluación de la estabilidad se midió la altura de la emulsión antes del
tratamiento térmico y la altura remanente de la emulsión después de la centrifugación.
Para la medición de la altura, se utilizó un vernier digital (Marca INSIZE
IP67, Suzhou, China). Para el cálculo de la EEm se utilizó la ecuación (7).
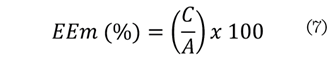
Donde:
C
= altura de la capa remanente de la emulsión.
A
= altura de la capa emulsificada después de centrifugar.
Propiedades
biofuncionales: actividad antioxidante
Capacidad de
atrapamiento del radical DPPH (CAR-DPPH)
Se determinó como lo
describen Liang y col. (2014) con algunas modificaciones. Brevemente, se
añadieron 2 mL de muestra de proteína/hidrolizado de colágeno a 2 mL de
solución etanólica de DPPH 0.2 mM. La
mezcla de reacción se agitó y se mantuvo 30 min a temperatura ambiente
en oscuridad. La absorbancia se midió a 517 nm utilizando un lector de
microplacas (Thermo scientific multiskan sky, Waltham,
EUA.). Se utilizó etanol en lugar de la muestra como control. La CAR-DPPH se calculó
utilizando la ecuación (8):
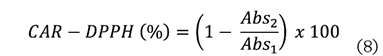
Donde:
Abs2 =
absorbancia de la muestra.
Abs1 =
absorbancia del control.
Capacidad de
atrapamiento del radical ABTS (CAR-ABTS)
Se determinó como lo
describen Xie y col. (2021) con algunas modificaciones. El radical catiónico
ABTS se generó mezclando una solución madre de ABTS (7 mM) con persulfato de
sodio (2.45 mM); la mezcla se dejó reposar en oscuridad durante 12 h a temperatura
ambiente. Luego, la solución de radicales
ABTS se diluyó en solución de búfer
de fosfatos salino 0.01 M, pH 7.4 (PBS, por sus siglas en inglés: phosphate
buffered saline) hasta una absorbancia de
0.70 ± 0.02 nm a 730 nm antes de su uso. El experimento se realizó
mezclando 2 mL de la proteína/hidrolizado de colágeno con 2 mL de la solución
diluida de ABTS. La absorbancia se leyó a
730 nm (entre 1 min a 6 min después de la mezcla inicial) utilizando un
lector de microplacas (Thermo scientific multiskan sky, Waltham, EUA.). Se usó
PBS en lugar de la muestra como control. La
CAR-ABTS se calculó utilizando la ecuación (9).
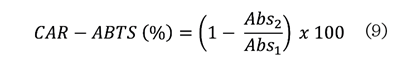
Donde:
Abs2 =
absorbancia de la muestra.
Abs1 =
absorbancia del control.
Poder reductor
Se midió según el
método descrito por Xie y col. (2021) con algunas modificaciones. Se mezclaron 2.5 mL de la muestra de proteína/hidrolizado
de colágeno con 2.5 mL de búfer de fosfatos (0.2 M, pH 7.4) y 2.5 mL de
ferricianuro de potasio (1 % m/v). Esta mezcla se incubó a 50 °C durante 20
min, y se añadieron 2.5 mL de ácido tricloroacético (10 % m/v) a la mezcla de
reacción, seguida de una centrifugación a 4 000 rpm durante 10 min.
Posteriormente, se mezclaron 2.5 mL del sobrenadante con 0.5 mL de agua desionizada y 0.5 mL de cloruro férrico
(FeCl3) (0.1 % m/v). La reacción
se continuó durante 15 min a temperatura
ambiente, posteriormente se midió la absorbancia a 700 nm (UA700 nm),
utilizando un lector de microplacas (Thermo scientific multiskan sky,
Waltham, EUA). Una absorbancia más alta indicaba una mayor capacidad reductora
(Fe3+ ® Fe2+).
Análisis estadístico
Los resultados se
presentaron como la media de tres muestras independientes y su desviación
estándar. Se aplicó el ANOVA de una vía para evaluar los efectos de los
tratamientos. Se realizó la prueba de normalidad de Kolmogorov-Smirnov para
cumplir con los supuestos del ANOVA que son normalidad, además de verificar la
varianza constante (igualdad de la varianza de los tratamientos) e
independencia entre las muestras (Montgomery, 2020). Para evaluar las
diferencias entre los valores medios, se realizó la prueba Post-hoc de
Tukey con un nivel de significancia de P £ 0.05. El análisis estadístico de los
datos se realizó con el software Minitab 18
(State College, PA 16801, USA).
RESULTADOS Y DISCUSIÓN
Análisis químico
proximal
La composición
proximal de la materia prima utilizada se muestra en la Tabla 2. El contenido
en proteína cruda fue de 88.01 % y su composición general fue parecida a la de
polvo y fibras de colágeno obtenidas de pieles de bovino (Wolf y col., 2009). Estos tres productos fueron diferentes a la
gelatina de bovino, con un contenido
de 52.22 % de proteína (Wulandari y col., 2016).
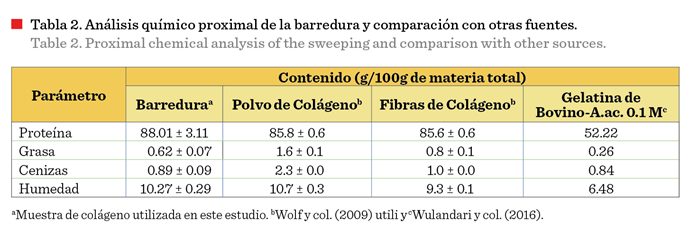
Las barreduras son
consideradas, dentro de la industria de producción de grenetinas, como la
materia prima que no cumple con las especificaciones para ser comercializada,
sin embargo, están conformadas por colágeno parcialmente desnaturalizado con
alto contenido proteínico (Tabla 2). Este subproducto, por lo tanto, se puede
hidrolizar de forma exhaustiva para obtener un producto que puede ser
comercializado como colágeno hidrolizado.
Grado de hidrólisis
(GH)
El tiempo de
hidrólisis y la relación E/S presentaron una correlación positiva, sobre el GH
(Figura 1). Para la enzima PAL®, hasta las 20 h de hidrólisis, no se
encontraron diferencias significativas (P
> 0.05). Los valores de 64.53 % y 70.38 % en el GH, para las
relaciones E/S de 0.8 UN/g y 1.2 UN/g, fueron cercanos (Figura 1A). Un
comportamiento similar presentó la enzima HT proteolitic® (P £ 0.05) a lo largo
de las distintas cinéticas (0.4 E/S, 0.8 E/S y 1.2 E/S). Sin embargo, no se
presentaron diferencias significativas (P > 0.05) a partir de las 24 h en
los sistemas con una relación E/S de 0.8 UN/g y 1.2 UN/g, obteniéndose valores de GH de 60.31 % y 67.72 %, respectivamente.
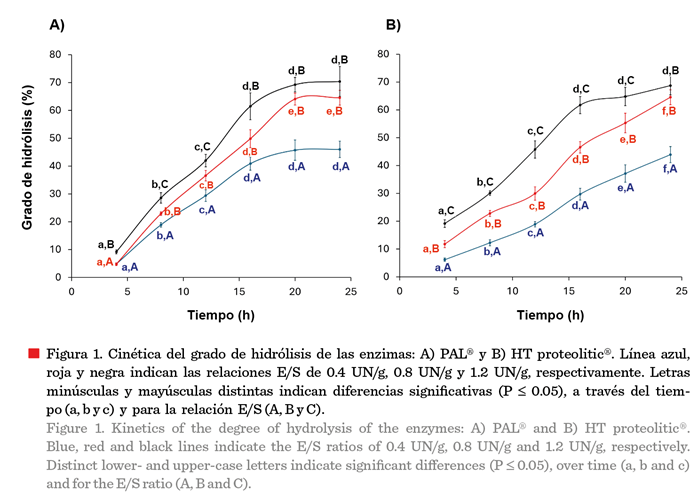
En el presente estudio
se encontró un GH extensivo de 70 % (PAL®,
E/S 1.2 UN/g, 24 h) y 68 % (HT
proteolitic®, E/S 1.2 UN/g, 24 h) (Figura 1). Las endoproteasas (enzimas
que pueden actuar sobre enlaces peptídicos dentro de la molécula de proteína) se utilizan normalmente para producir
hidrolizados de proteínas, a veces en combinación con exoproteasas (enzimas
que pueden escindir enlaces peptídicos en un extremo C o N terminales), además se ha reportado que las
preparaciones enzimáticas comerciales pueden contener principalmente una
proteasa o una mezcla de proteasas (Philipps-Wiemann, 2018; Vogelsang-O’dwyer y
col., 2022).
Zhang
y col. (2013) realizaron la hidrólisis enzimática
de colágeno bovino por 4 h con alcalasa® obteniendo un GH de 18.1 %. Por otro
lado, Nuñez y col. (2020) hicieron el mismo proceso, con gelatina de piel
bovina durante 24 h, utilizando la enzima subtilisina, una endoproteinasa de Bacillus licheniformis, generando
un GH de 26.28 %. Algunos autores, hidrolizando el colágeno de piel de pescado
con diversas enzimas, reportaron diferentes grados de hidrólisis en un tiempo
de 3 h de digestión: protamex® 12.29
%, alcalasa® 17.40 %, tripsina 15.02 % y
neutrasa® 13.81 % (Zhang y col., 2016b; Sun y col., 2022). Los valores
de GH inferiores a los mostrados en el
presente trabajo, pueden deberse a distintos factores, entre los cuales
se encuentran, el tipo de proteasa utilizada, la relación E/S, el tiempo de
hidrólisis, el tipo de escisión enzimática
(endo o exopeptidasa), así
como la temperatura y el pH de operación (Bhuimbar y col., 2024).
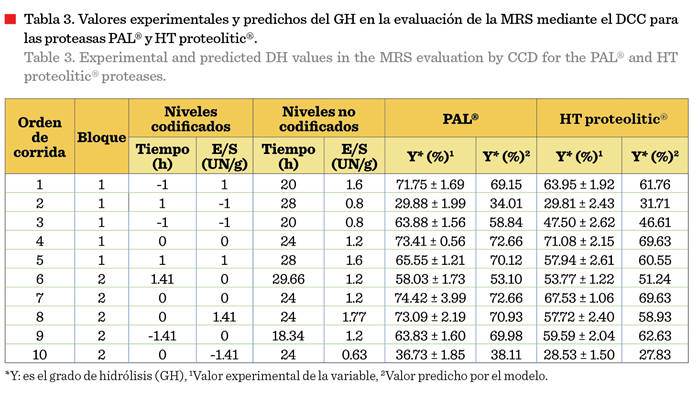
Optimización del GH
Los valores
experimentales y los predichos del GH, por el
modelo ajustado de segundo orden, se muestran en la Tabla 3, en la
evaluación de la MSR, mediante el DCC, para
las proteasas PAL® y HT proteolitic®.
El valor experimental más alto de GH para la enzima PAL® se obtuvo con
el orden de corrida 7 (74.42 %); en tanto que, para HT proteolitic® fue con la
corrida 4 (71.08 %).
Las
Figuras 2 y 3 muestran los gráficos de superficie de
respuesta (A), el diagrama de Pareto (B) y el modelo matemático con el valor
del coeficiente de determinación (C), para la actividad hidrolítica de las
enzimas PAL® y HT proteolitic®, respectivamente. Las curvas de superficie de respuesta (Figuras 2A y 3A),
obtenidas mediante la aplicación del DCC, mostraron
la presencia de un valor máximo (Myers y col., 2016; Montgomery, 2020),
para el GH.
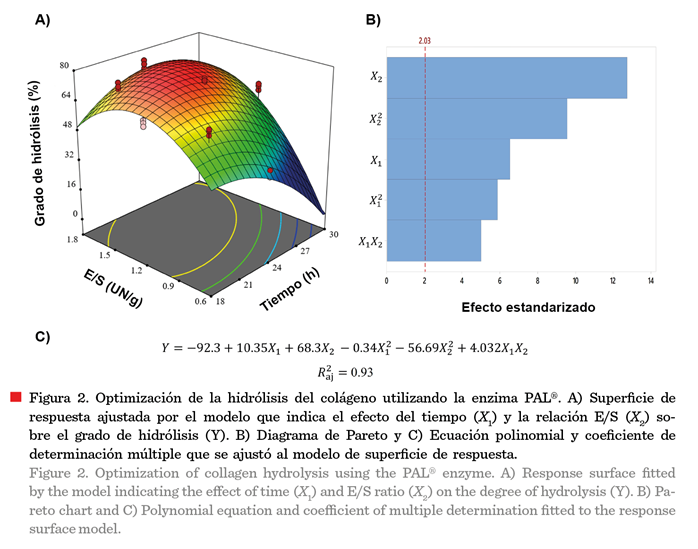
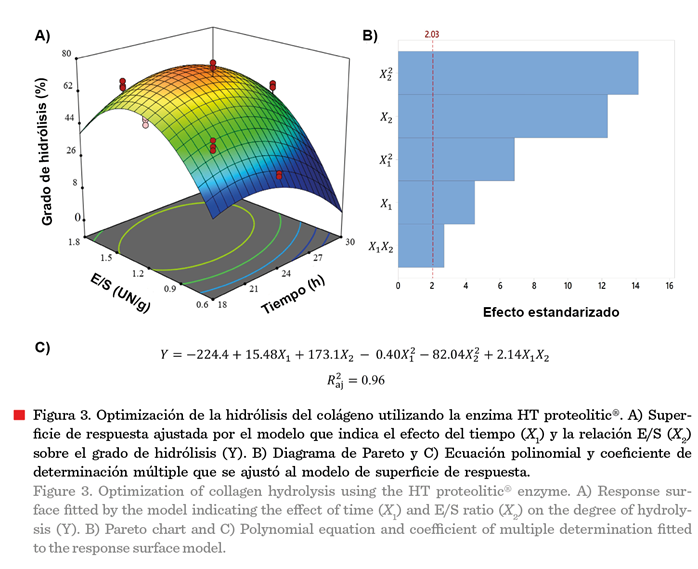
Las Figuras 2A y 3B
muestran los diagramas de Pareto para los
efectos estandarizados. Todos los términos de los coeficientes del
modelo de segundo orden fueron significativos (P £ 0.05), para los factores
Tiempo (X1) y la relación E/S (X2). En la
enzima PAL®, el efecto lineal, correspondiente a la relación E/S (X2),
fue el de mayor peso dentro de la variabilidad que explica el modelo cuadrático
(Figura 2B); encontrándose, así mismo, un
coeficiente de determinación ajustado para el modelo presentado de 0.93 (Figura
2C).
En la enzima HT
proteolitic®, el efecto cuadrático de la relación E/S (![]() ) fue el término,
dentro del modelo, que mayor peso tuvo sobre la respuesta (Figura 3B). Además,
la variabilidad de los datos, explicada por el modelo matemático, arrojó un valor de 0.96 (Figura 3C).
) fue el término,
dentro del modelo, que mayor peso tuvo sobre la respuesta (Figura 3B). Además,
la variabilidad de los datos, explicada por el modelo matemático, arrojó un valor de 0.96 (Figura 3C).
La MSR mostró que los
valores máximos de optimización del GH
extensivo, para las enzimas PAL® y HT proteolitic® (Figuras 2A y 3A), fueron 76.38
% (23.75 h y 1.43 E/S) y 72.15 % (23.18 h y
1.35 E/S), respectivamente. Estas condiciones se utilizaron para determinar las
propiedades tecnofuncionales y biofuncionales.
En la literatura no se
encontró información sobre el proceso de optimización de la hidrólisis de
colágeno bovino utilizando la MSR, pero existen reportes de estudios que
emplearon sustratos de colágeno de piel de pescado, pepino de mar y atún de
aleta amarilla, entre otras. Yu y Chen
(2014) documentaron la optimización del GH de colágeno del pepino de mar
(Acaudina molpadioides) mediante la MSR, utilizando una hidrólisis con
papaína durante 30 min, y hallaron un GH de 17 %. Por otro lado, durante la
hidrólisis para la producción de péptidos de colágeno, a partir de la piel de
pescado (Epinephelus malabaricus), usando las enzimas proteolíticas
pepsina (5.47 h), papaína (4.25 h) y las proteasas del páncreas de bovino (4.25
h), encontraron un GH de 10 %, 20 % y 28 %, respectivamente (Hema y col.,
2017). Por último, Nguyen y col. (2021) optimizaron la hidrólisis de colágeno
de la piel de atún aleta amarilla (Thunnus albacares) con la enzima
alcalasa® en un tiempo de 5.2 h con un GH de 24.54 %.
Propiedades
tecnofuncionales
La hidrólisis
enzimática, aplicada a las fibras de
colágeno, ha sido ampliamente utilizada con la finalidad de evidenciar
algunas propiedades tecnofuncionales
(solubilidad, espumado y emulsificación).
Solubilidad
La solubilidad es una
de las propiedades más importantes de las
proteínas, ya que define sus aplicaciones en la industria alimentaria,
farmacéutica y médica, entre otras. Influye en otras propiedades, como la
formación de espuma y la emulsión, debido a la rápida migración y adsorción de
los péptidos en la superficie de la interfase (Tawalbeh y col., 2025).
En la Figura 4 se
observa el efecto del pH sobre el colágeno nativo (0 h) y el colágeno obtenido
por hidrólisis enzimática (24 h), a diferente pH (3 a 9). Ambas enzimas, PAL® y
HT proteolitic®, indujeron un incremento significativo (P £ 0.05) en la solubilidad
del rango de pH estudiado. La hidrólisis con
PAL® no incrementó significativamente
(P £ 0.05) a partir de pH 5, en tanto que con HT proteolitic® no
incrementó a partir de pH 7. En un ambiente alcalino, con un pH entre 7 a 11,
el colágeno adquiere una mayor carga negativa, mejorando las fuerzas de
repulsión entre las cadenas, aumentando la solubilidad (Song y col., 2021b). El
máximo valor de GH alcanzado fue de 95.02 ±
2.3 % (pH 9) y 93.47 ± 3.1 % (pH 7)
para PAL® y HT proteolitic®, respectivamente.
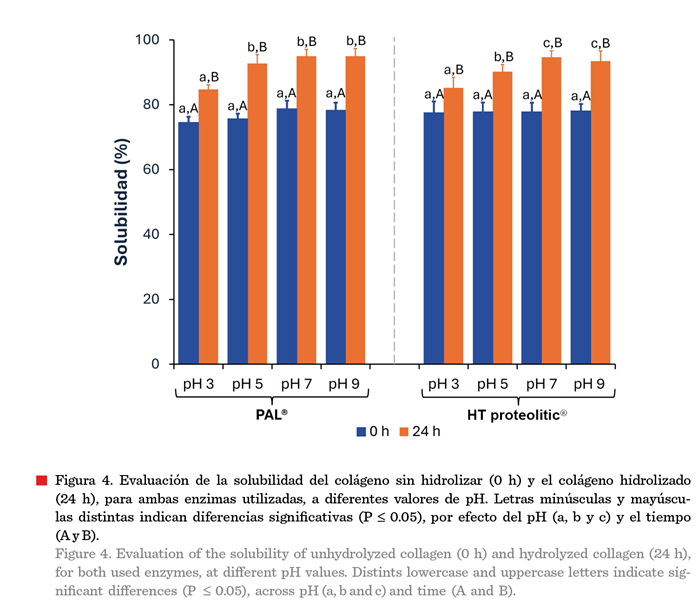
El comportamiento
encontrado en el presente estudio es similar al reportado por algunos autores.
Chi y col. (2016) documentaron valores de solubilidad superiores al 95 % para
hidrolizados de colágeno de diferentes pieles de pescado. En su estudio reportaron que el proceso de hidrólisis,
usando tripsina en un medio débilmente
básico, podría mejorar considerablemente
la solubilidad de las muestras en todos los valores de pH. Anzani y col.
(2020) evaluaron la solubilidad de los hidrolizados de colágeno de pieles
bovinas y porcinas obtenidos mediante la
enzima Alcalsa® y encontraron que el efecto de la hidrólisis enzimática
mejoraba la solubilidad » 100 %. Los productos de
hidrólisis enzimática, con un GH elevado,
presentaron péptidos con pesos moleculares bajos. González-Serrano y col. (2022) documentaron el peso molecular
relativo de hidrolizados de piel de colágeno del pescado carpa, obtenidos con
Alcalasa®, en donde las fracciones con pesos entre 3 kDa a 10 kDa y < 1 kDa,
reportaron solubilidades de 87.3 % y 89.1 %, respectivamente, lo que indica que
la solubilidad aumentó al disminuir el tamaño, probablemente debido al hecho de
que las moléculas pequeñas fueron más polares y solubles.
El efecto de la
hidrólisis enzimática, en la solubilidad de
una proteína específica, puede cambiar
por efecto de varios factores, que incluyen el tipo de proteasa, el
tiempo de reacción, el grado de hidrólisis, la relación enzima-sustrato y
las condiciones ambientales (Vogelsang-O’dwyer y col., 2022). Los
valores obtenidos en el presente estudio indicaron que el hidrolizado de colágeno mostraba una mayor solubilidad,
asociada a un alto grado de hidrólisis (Figuras 2 y 3). Este aumento en
la solubilidad podría deberse a la reducción del peso molecular por la acción
de las enzimas, induciendo el aumento en el número de unidades polipeptídicas
más pequeñas, y probablemente más
hidrofílicas y solvatadas. Los péptidos más pequeños pueden ser más
polares y formar enlaces de hidrógeno
con el agua, lo que incrementa su solubilidad en soluciones acuosas (Chi y col., 2016). Por lo tanto, se puede especular
que, una hidrólisis extensiva del colágeno,
utilizando proteasas en su pH óptimo, podría ser una estrategia eficaz
para mejorar la solubilidad del colágeno.
Espumado
La formación de espuma
se produce cuando, en una mezcla líquida, la presencia de proteínas provoca una
disminución de la tensión superficial entre la interfaz del agua y el aire. La
capacidad y la estabilidad de espumado de las fracciones de péptidos son dos de
los parámetros medibles para evaluar la formación y estabilidad de espumas en
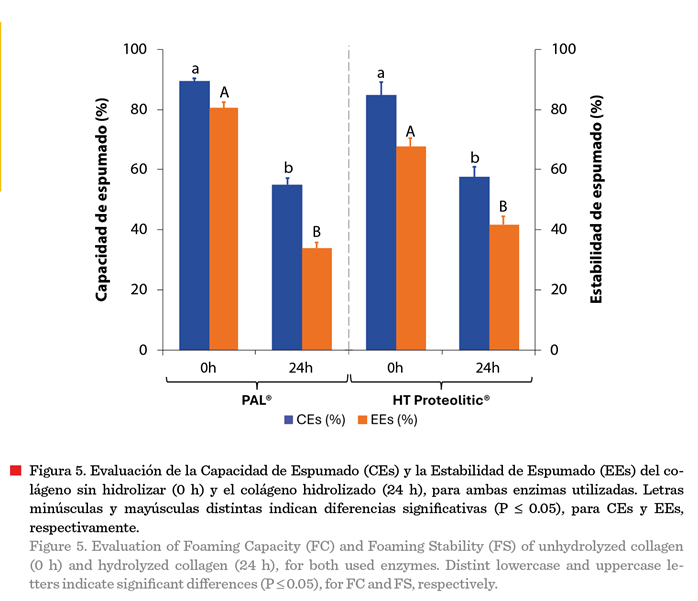
sistemas proteínicos y peptídicos (Vogelsang-O’dwyer y col., 2022). La Figura 5
muestra la capacidad de espumado (CEs), para los sistemas realizados con PAL® y
HT proteolitic®. El efecto de la hidrólisis (24 h) causó una reducción
significativa (P £ 0.05) del 34 % y 27 %, respectivamente, comparado con el
colágeno sin hidrolizar (0 h). Respecto a la estabilidad de espumado (EEs) se
encontró un comportamiento similar a la CEs, presentando una reducción
significativa (P £ 0.05) del 47 % (PAL®) y 26 % (HT proteolitic®). La CEs
muestra la expansión de la espuma inmediatamente después del batido, mientras
que la EEs muestra la expansión de la espuma después de batir durante un periodo
de tiempo. La disminución de ambas propiedades, encontrada en este estudio,
ocurrió debido a que la hidrólisis extensiva del colágeno genera fracciones peptídicas, y las moléculas de
proteínas con alto peso molecular pueden
interactuar mejor en la interfase generando películas más resistentes, lo que conduce
a una mayor estabilidad de la espuma. Las
propiedades espumantes de la proteína pueden verse afectadas por la
fuente, las propiedades intrínsecas, la
composición y la conformación de las
proteínas (Tawalbeh y col., 2025) y en este estudio, la hidrólisis
enzimática parece haber modificado las propiedades intrínsecas.
Diversas
investigaciones han evaluado la CEs y la EEs, encontrando reducciones mínimas
en ambos parámetros analizados, debido a los menores tiempos de hidrólisis, lo
cual genera espumas más estables, por lo que, las cadenas polipeptídicas
liberadas mediante el proceso de digestión enzimática parecen haber reducido su capacidad de formar interacciones proteína-proteína,
disminuyendo la incapacidad de formar películas fuertes, debido a la falta de
estabilización de la interfase líquido-aire en el sistema disperso de la espuma (Chi y col., 2016; Vidal y col., 2020; Zamorano-Apodaca y col.,
2020).
Emulsificación
Las
propiedades emulsionantes son importantes en los sistemas alimentarios por
que contribuyen directamente a la textura y las propiedades sensoriales de los
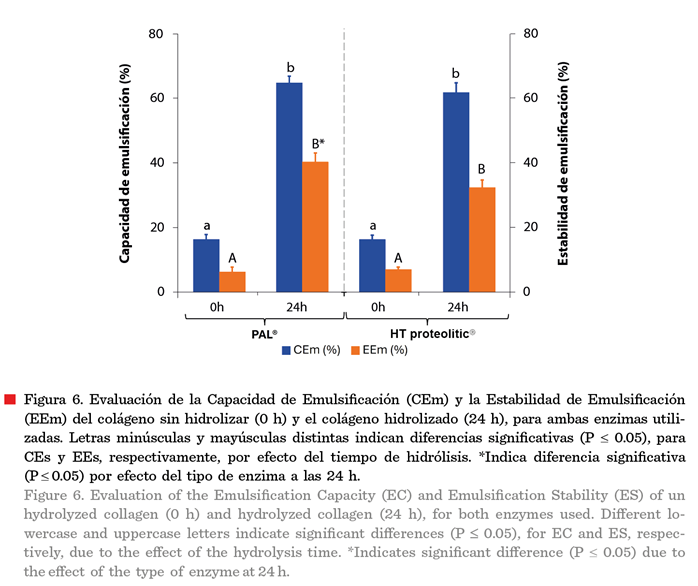
alimentos (Xie y col., 2021). En la Figura 6
se presenta el efecto de la hidrólisis de ambas enzimas sobre la
capacidad de emulsificación (CEm) y la estabilidad de la emulsión (EEm). Ambos
parámetros incrementaron de manera significativa (P ≤ 0.05), por efecto del
hidrolizado de 24 h, respecto al control, colágeno sin hidrolizar (0 h). La CEm
aumentó 48 % (PAL®) y 46 % (HT proteolitic®), con respecto al colágeno sin
hidrolizar. Es necesario mencionar que, la comparación a las 24 h de hidrólisis
no presentó diferencias significativas (P
> 0.05) por el tipo de enzima utilizada. Para la EEm se encontró un comportamiento similar, la estabilidad
para PAL® aumentó 34 %, mientras que para HT proteolitic® incrementó en 26 %. Además, se hallaron diferencias significativas
(P ≤ 0.05) para el hidrolizado de 24 h por
efecto del tipo de enzima.
El comportamiento
encontrado en el presente estudio fue diferente al reportado por algunos autores. Hu y col. (2023) documentaron los efectos
de la CEm (53 %) y la EEm (68 %) en colágeno extraído por pepsina, usando pH 7.
Anzani y col. (2020) hidrolizaron colágeno de piel porcina, utilizando
Alcalsa®, y reportaron una reducción en la CEm y EEm. Asociaron sus resultados
a que los hidrolizados reducen el peso molecular de la fracción proteínica, y
los polipéptidos más grandes, que contienen cargas y grupos hidrofílicos e
hidrofóbicos, están mejor adaptados para
estabilizar las películas de proteína en emulsiones de aceite en agua (Chi
y col., 2014). Sin embargo, según Schmidt y col. (2020), el hidrolizado de
colágeno de piel de pollo, con bajo peso
molecular, presentó valores más altos de EEm y CEm en comparación con el no hidrolizado. Los autores sugieren
que, en su estudio, las cadenas polipeptídicas de menor tamaño pudieron
presentar mayor flexibilidad molecular,
permitiéndoles difundirse fácilmente a la interfaz aceite-agua.
Propiedades
biofuncionales: actividad antioxidante
Capacidad de
atrapamiento del radical DPPH (CAR-DPPH)
El radical DPPH es uno
de los radicales libres más estables. Puede usarse para probar la capacidad de
los compuestos para actuar como atrapadores (captadores) de radicales libres o donantes de hidrógeno (Munteanu y Apetrei,
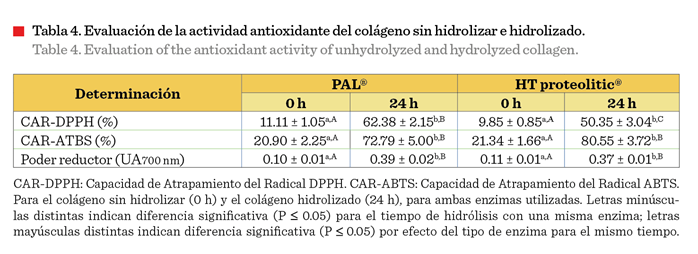
2021). En la Tabla 4 se muestra el efecto de la hidrólisis sobre el porcentaje
de atrapamiento del radical DPPH. Se puede apreciar que el colágeno
hidrolizado, obtenido mediante ambas enzimas, incrementó de forma significativa
(P 0.05).
Además, el valor de la CAR-DPPH a las 24 h para la enzima PAL® fue
estadísticamente mayor, comparado con el de la enzima HT proteolitic®. El
comportamiento descrito en el presente estudio mostró una correspondencia entre
el GH y la capacidad eliminadora de radicales DPPH, lo que sugiere una probable
dependencia con el tamaño molecular de los
hidrolizados de colágeno. Diversas investigaciones, realizadas con
hidrolizados de colágeno de piel de bovino,
piel de pescado y tejido óseo bovino, presentaron el mismo
comportamiento, con incrementos desde 15 % hasta 85 % en la CAR-DPPH. Esta
variación depende del tiempo de hidrólisis,
el tipo de proteasa, así como de la relación E/S utilizada. Los autores
mencionaron que el poder antioxidante de los péptidos y/o aminoácidos es superior al de las proteínas nativas,
debido a la facilidad de donar electrones o átomos de hidrógeno (Liang y col.,
2014; Chi y col., 2016; Song y col., 2021a; Xie y col., 2021; Vidal y col.,
2022).
Capacidad de
atrapamiento del radical ABTS (CAR-ABTS)
El ensayo de CAR-ABTS
es un método para determinar la capacidad antioxidante, en el que el radical se
oxida para formar un complejo radical catiónico ABTS•+. Este método también
evalúa la capacidad de los antioxidantes de donar un electrón o un átomo de hidrógeno para estabilizar los radicales. Se puede
aplicar en un amplio rango de pH y es soluble
en medios acuosos y orgánicos (Munteanu
y Apetrei, 2021). En este trabajo se observó que, en los hidrolizados de
colágeno aumentó la CAR-ABTS de forma
significativa (P ≤ 0.05), sin embargo, los
hidrolizados de 24 h no presentaron diferencias significativas por el
efecto del sistema enzimático utilizado.
El
comportamiento encontrado en este estudio es semejante al reportado por Song y col.
(2021a), quienes hidrolizando colágeno de hueso bovino observaron un aumento en
la CAR-ABTS. Los autores mencionaron que, el fenómeno podría resultar de la
acción combinada de los aminoácidos terminales o dipéptidos y tripéptidos. Además, el peso molecular más bajo puede
desempeñar un papel importante, debido a que la estructura secundaria de estas
moléculas expone relativamente los grupos R de los aminoácidos. Por otra parte,
durante la evaluación de hidrolizados de colágeno de hueso, glicosilados antes
y después
de llevarse a cabo la reacción de Maillard, presentaron productos de
glicosilación que podrían desempeñar el papel de donadores de hidrógeno, al
mostrar una mayor actividad CAR-ABTS. Los compuestos generados durante el
proceso podrían desempeñar un papel antioxidante, al inducir la extinción de
radicales mediante el mecanismo de transferencia de átomos de hidrógeno o de su
reducción directa por transferencia de electrones (Qi y col., 2024).
Poder reductor
El poder reductor es
un método que mide la reducción de iones férricos (Fe3+) al complejo
ferroso intensamente azul (Fe2+) por medio de antioxidantes en
ambientes ácidos (Munteanu y Apetrei, 2021). En el presente estudio, se
encontró un aumento significativo (P £ 0.05), del poder reductor de ambas
enzimas utilizadas, de » 3.9 veces para PAL® y » 3.36 veces para HT proteolitic®, lo que indica que los
péptidos generados por la hidrólisis enzimática representan una excelente
fuente donadora de electrones. Xie y col. (2021), en su estudio sobre colágeno
hidrolizado, evaluaron el mismo método, encontrando valores de absorbancia
(UA700 nm) entre 0.149 y 0.323, similares a los del presente estudio. La
composición de los residuos de aminoácidos en los péptidos es uno de los
factores importantes que afectan a la actividad antioxidante de las cadenas
polipeptídicas. Se ha demostrado que los aminoácidos glicina (Gly) y prolina
(Pro), ambos abundantes en el colágeno, desempeñan un papel importante en la
capacidad de eliminación de radicales libres en ciertos péptidos (Wang y col.,
2013). Además, los residuos aromáticos e hidrofóbicos hallados en los
hidrolizados de colágeno, mostraron una alta eficiencia en atrapar
radicales libres debido a su facilidad para donar átomos de hidrógeno (Xie y
col., 2021).
Conclusiones
La optimización del
proceso de hidrólisis del colágeno bovino con las endoproteasas comerciales PAL® y HT proteolitic® presentaron un grado
de hidrólisis extensivo (76.38 % y 72.15 %, respectivamente). Los
modelos polinómicos de segundo orden generados explicaron entre 93 % y 96 % la
variabilidad de los datos experimentales. Los hidrolizados de colágeno
mejoraron significativamente en su solubilidad, así como en la capacidad y
estabilidad de emulsificación, sin embargo, disminuyeron en la capacidad y
estabilidad de espumado. La asociación directa entre el colágeno hidrolizado y
las actividades antioxidantes de los péptidos generados por la hidrólisis
enzimática, indica que el colágeno hidrolizado, obtenido bajo las condiciones
de optimización, presentó propiedades tecnofuncionales y antioxidantes
mejoradas, lo que sugiere una potencial aplicación como ingrediente
funcional en sistemas alimentarios, que debe ser comprobada mediante estudios
específicos.
Agradecimientos
Los autores agradecen
al Instituto de Innovación Ciencia y Emprendimiento para la Competitividad del estado de Guanajuato, por el
financiamiento otorgado al proyecto con clave IDEAGTO/CONV/099/2023.
Declaración
de conflicto de intereses
Los autores declararon
no tener conflictos de intereses de ningún tipo.
Referencias
Adler-Nissen, J. (1979).
Determination of the degree of hydrolysis of food protein hydrolysates by
trinitrobenzenesulfonic acid. Journal of
Agricultural and Food Chemistry, 27(6), 1256-1262. https://doi.org/10.1021/jf60226a042
Aguirre-Cruz, G., León-López, A., Cruz-Gómez, V.,
Jiménez-Alvarado, R., & Aguirre-Álvarez, G. (2020). Collagen Hydrolysates
for Skin Protection: Oral Administration and Topical Formulation. Antioxidants,
9(2), 181. https://doi.org/10.3390/antiox9020181
Ahmad, M. I., Li, Y., Pan, J., Liu, F., Dai, H., Fu, Y.,
Huang, T., Farooq, S., & Zhang, H. (2024). Collagen and gelatin: Structure, properties, and
applications in food industry. International Journal of Biological
Macromolecules, 254, 128037. https://doi.org/10.1016/j.ijbiomac.2023.128037
Anzani, C., Álvarez, C., & Mullen, A. M. (2020). Assessing the effect of Maillard reaction with dextran on the techno-functional properties of collagen-based peptides
obtained from bovine hides. LWT, 118, 108800. https://doi.org/10.1016/j.lwt.2019.108800
AOAC, Association of Official
Analytical Chemists (2000). Official Methods of Analysis (Seventeenth edition).
AOAC International.
Barzideh, Z., Abd-Latif, A., Gan, C. Y., Abedin, Md. Z.,
& Alias, A. K. (2014). ACE Inhibitory and Antioxidant Activities of
Collagen Hydrolysates from the Ribbon Jellyfish (Chrysaora sp.). Food Technology and Biotechnology, 52(4), 495-504. https://doi.org/10.17113/ftb.52.04.14.3641
Bhuimbar, M. V., Jalkute, C. B.,
Bhagwat, P. K., & Dandge, P. B. (2024). Purification, characterization and application of collagenolytic protease from Bacillus subtilis strain MPK. Journal of Bioscience and
Bioengineering, 138(1), 21-28. https://doi.org/10.1016/j.jbiosc.2024.03.003
Blanco,
M., Vázquez, J. A., Pérez-Martín, R. I., & G. Sotelo, C. (2019). Collagen Extraction Optimization from the Skin of the Small-Spotted
Catshark (S. canicula) by Response Surface
Methodology. Marine Drugs, 17(1), 40. https://doi.org/10.3390/md17010040
Bradford, M. M. (1976). A rapid and sensitive method for
the quantitation of microgram quantities of protein utilizing the principle of
protein-dye binding. Analytical Biochemistry, 72(1-2), 248-254. https://doi.org/10.1016/0003-2697(76)90527-3
Chi, C., Hu, F., Li, Z., Wang, B., & Luo, H. (2016).
Influence of Different Hydrolysis Processes by Trypsin on the Physicochemical,
Antioxidant, and Functional Properties of
Collagen Hydrolysates from Sphyrna lewini, Dasyatis akjei, and Raja
porosa. Journal of Aquatic Food Product Technology, 25(5),
616-632. https://doi.org/10.1080/10498850.2014.898004
Chi, C. F., Cao, Z. H., Wang, B., Hu, F. Y., Li, Z. R.,
& Zhang, B. (2014). Antioxidant and Functional Properties of Collagen
Hydrolysates from Spanish Mackerel Skin as
Influenced by Average Molecular Weight. Molecules, 19(8),
11211–11230. https://doi.org/10.3390/molecules190811211
Deng, G., Huang, K., Jiang, X., Wang, K., Song, Z., Su,
Y., Li, C., Zhang, S., Wang, S., & Huang, Y. (2023). Developments for
collagen hydrolysates as a multifunctional anti-oxidant in biomedical domains. Collagen
and Leather, 5(1), 26. https://doi.org/10.1186/s42825-023-00131-9
González-Serrano, D. J., Hadidi, M., Varcheh, M.,
Jelyani, A. Z., Moreno, A., & Lorenzo, J. M. (2022). Bioactive Peptide
Fractions from Collagen Hydrolysate of Common Carp Fish Byproduct: Antioxidant
and Functional Properties. Antioxidants, 11(3), 509. https://doi.org/10.3390/antiox11030509
Hema, G. S., Joshy, C. G., Shyni, K., Chatterjee, N. S.,
Ninan, G., & Mathew, S. (2017). Optimization of process parameters for the
production of collagen peptides from fish skin (Epinephelus malabaricus) using
response surface methodology and its characterization. Journal of Food
Science and Technology, 54(2), 488-496. https://doi.org/10.1007/s13197-0172490-2
Hong, G. P., Min, S. G., & Jo, Y. J. (2019).
Anti-Oxidative and Anti-Aging Activities of Porcine By-Product Collagen
Hydrolysates Produced by Commercial Proteases: Effect of Hydrolysis and
Ultrafiltration. Molecules, 24(6), 1104. https://doi.org/10.3390/molecules24061104
Hu,
G., Li, X., Su, R., Corazzin, M., Liu, X., Dou, L., Sun, L., Zhao, L., Su, L.,
Tian, J., & Jin, Y. (2023). Effects of ultrasound on the structural
and functional properties of sheep bone collagen. Ultrasonics Sonochemistry,
95, 106366. https://doi.org/10.1016/j.ultsonch.2023.106366
Lambré, C., Barat-Baviera, J. M., Bolognesi, C.,
Cocconcelli, P. S., Crebelli, R., Gott, D. M., Grob, K., Lampi, E., Mengelers,
M., Mortensen, A., Rivière, G., Steffensen, I., Tlustos, C., Van Loveren, H.,
Vernis, L., Zorn, H., Herman, L., Aguilera,
J., Andryszkiewicz, M., Fernandez-Fraguas, C., Liu, Y., & Chesson,
A. (2023). Safety evaluation of the food enzyme bacillolysin from the
non-genetically modified Bacillus amyloliquefaciens strain HPN 131. EFSA
Journal, 21(11), 1-12. https://doi.org/10.2903/j.efsa.2023.8390
León-López,
A., Fuentes-Jiménez, L., Hernández-Fuentes, A. D., Campos-Montiel, R. G., &
Aguirre-Álvarez, G. (2019). Hydrolysed Collagen from Sheep-skins as
a Source of Functional Peptides with Antioxidant Activity. International
Journal of Molecular Sciences, 20(16), 3931. https://doi.org/10.3390/ijms20163931
Liang, Q., Wang, L., He, Y., Wang, Z., Xu, J., & Ma,
H. (2014). Hydrolysis kinetics and antioxidant activity of collagen under simulated gastrointestinal digestion. Journal
of Functional Foods, 11, 493-499. https://doi.org/10.1016/j.jff.2014.08.004
Montgomery, D. C. (2020). Design and Analysis of
Experiments (10th edition). Wiley.
Munteanu, I. G. & Apetrei, C. (2021). Analytical
Methods Used in Determining Antioxidant Activity: A Review. International
Journal of Molecular Sciences, 22(7), 3380. https://doi.org/10.3390/ijms22073380
Myers, R. H., Montgomery, D. C., & Anderson-Cook, C.
M. (2016). Response Surface Methodology: Process and Product Optimization Using
Designed Experiments (Fourth edition). Wiley series in
probability and statistics.
Nguyen,
B. C., Kha, T. C., Nguyen, K. H. N., & Nguyen, H. M. X. (2021). Optimization of enzymatic hydrolysis of
collagen from yellowfin tuna skin (Thunnus albacares) by response
surface methodology and properties of
hydrolyzed collagen. Journal of Food Processing and
Preservation, 45(4). https://doi.org/10.1111/jfpp.15319
Nuñez,
S. M., Cárdenas, C., Pinto, M., Valencia, P., Cataldo, P., Guzmán, F., &
Almonacid, S. (2020). Bovine skin gelatin hydrolysates as
potential substitutes for polyphosphates: The role of degree of hydrolysis and
pH on water-holding capacity. Journal of Food Science, 85(7), 1988-1996.
https://doi.org/10.1111/1750-3841.15299
Philipps-Wiemann, P. (2018). Proteases—general aspects.
In Nunes, C.S. and Kumar, V. (Ed.), Enzymes in Human and Animal Nutrition
(pp. 257-266). Elsevier. https://doi.org/10.1016/B978-0-12-8054192.00012-5
Qi, L., Zhang, H., Guo, Y., Liu, H., & Zhang, C.
(2024). Preparation, characterization and antioxidant activity analysis of three Maillard glycosylated bonecollagen
hydrolysates from chicken, porcine and bovine. Food Science and Human
Wellness, 13(4), 2002–2013. https://doi.org/10.26599/FSHW.2022.9250166
Schmidt,
M. M., Fontoura, A. M. da, Vidal, A. R., Dornelles, R.
C. P., Kubota, E. H., Mello, R. de O., Cansian, R. L., Demiate, I. M., &
Oliveira, C. S. (2020). Characterization of hydrolysates of
collagen from mechanically separated chicken meat residue. Food Science and
Technology, 40(suppl 1), 355-362. https://doi.org/10.1590/fst.14819
Silvipriya, K., Kumar, K., Bhat, A., Kumar, B., John, A.,
& Lakshmanan, P. (2015). Collagen: Animal Sources and Biomedical
Application. Journal of Applied Pharmaceutical Science, 123-127. https://doi.org/10.7324/JAPS.2015.50322
Song, Y., Fu, Y., Huang, S., Liao, L., Wu, Q., Wang, Y.,
Ge, F., & Fang, B. (2021a). Identification and anti-oxidant activity of
bovine bone collagen-derived novel peptides prepared by recombinant collagenase
from Bacillus cereus. Food Chemistry, 349, 129143. https://doi.org/10.1016/j.foodchem.2021.129143
Song, Z., Liu, H., Chen, L., Chen, L., Zhou, C., Hong, P., & Deng, C. (2021b). Characterization and
comparison of collagen extracted from the skin of the Nile tilapia by
fermentation and chemical pretreatment. Food Chemistry, 340, 128139. https://doi.org/10.1016/j.foodchem.2020.128139
Sosulski, F. W. & Imafidon, G.
I. (1990). Amino acid composition and nitrogen-to-protein
conversion factors for animal and plant foods. Journal of Agricultural and
Food Chemistry, 38(6), 1351-1356. https://doi.org/10.1021/jf00096a011
Sun, S., Gao, Y., Chen, J., & Liu, R. (2022).
Identification and release kinetics of peptides from tilapia skin collagen
during alcalase hydrolysis. Food Chemistry, 378, 132089. https://doi.org/10.1016/j.foodchem.2022.132089
Tawalbeh,
D., Ahmad, W. A. N. W., & Sarbon, N. M. (2023). Effect
of ultrasound pretreatment on the functional and bioactive properties of
legumes protein hydrolysates and peptides: A
comprehensive review. Food Reviews
International, 39(8), 5423-5445. https://doi.org/10.1080/87559129.2022.2069258
Tawalbeh, D., Kha’sim, M. I., Mhd Sarbon, N., &
Sarbon, N. M. (2025). Techno-Functional and Bio-activity Properties of Collagen
Hydrolysate and Peptide: A Review. Food Reviews International, 1-29. https://doi.org/10.1080/87559129.2025.2450052
Ulug, S. K., Jahandideh, F., & Wu, J. (2021). Novel
technologies for the production of bioactive peptides. Trends in Food
Science & Technology, 108, 27-39. https://doi.org/10.1016/j.tifs.2020.12.002
Vidal,
A. R., Cansian, R. L., Mello, R. de O., Demiate, I. M., Kempka, A. P.,
Dornelles, R. C. P., Rodriguez, J. M. L., & Campagnol, P. C. B. (2022). Production of Collagens and Protein Hydrolysates with Antimicrobial and
Antioxidant Activity from Sheep Slaughter By-Products. Antioxidants,
11(6), 1173. https://doi.org/10.3390/antiox11061173
Vidal,
A. R., Duarte, L. P., Schmidt, M. M., Cansian, R. L., Fernandes, I. A.,
de-Oliveira-Mello, R., Demiate, I. M., & Dornelles, R. C. P. (2020). Extraction and characterization of collagen from sheep slaughter
by-products. Waste Management, 102, 838-846. https://doi.org/10.1016/j.wasman.2019.12.004
Vogelsang-O’dwyer, M., Sahin, A. W., Arendt, E. K., &
Zannini, E. (2022). Enzymatic Hydrolysis of Pulse Proteins as a Tool to Improve
Techno-Functional Properties. Foods,
11(9), 1307. https://doi.org/10.3390/foods11091307
Wang, B., Wang, Y. M., Chi, C. F., Luo, H. Y., Deng, S.
G., & Ma, J. Y. (2013). Isolation and Characterization of Collagen and
Antioxidant Collagen Peptides from Scales of
Croceine Croaker (Pseudosciaena crocea). Marine Drugs, 11(11),
4641-4661. https://doi.org/10.3390/md11114641
Wolf,
K. L., Sobral, P. J. A., & Telis, V. R. N. (2009). Physicochemical
characterization of collagen fibers and collagen powder for self-composite film
production. Food Hydrocolloids, 23(7), 1886-1894. https://doi.org/10.1016/j.foodhyd.2009.01.013
Wulandari,
D., Triatmojo, S., Erwanto, Y., & Pranoto,
Y. (2016). Physicochemical
Properties and Amino Acid and Functional Group Profiles
of Gelatin Extracted from Bovine Split Hide Cured by Acid. Pakistan Journal
of Nutrition, 15(7), 655–661. https://doi.org/10.3923/pjn.2016.655.661
Xie, Z., Wang, X., Yu, S., He, M., Yu, S., Xiao, H.,
& Song, Y. (2021). Antioxidant and functional properties of cowhide
collagen peptides. Journal of Food Science, 86(5), 1802-1818. https://doi.org/10.1111/1750-3841.15666
Yu, F., Zong, C., Jin, S., Zheng, J., Chen, N., Huang,
J., Chen, Y., Huang, F., Yang, Z., Tang, Y., & Ding, G. (2018).
Optimization of Extraction Conditions and Characterization
of Pepsin-Solubilised Collagen from Skin
of Giant Croaker (Nibea japonica). Marine Drugs, 16(1), 29. https://doi.org/10.3390/md16010029
Yu, P., & Chen, H. (2014). Optimization of Conditions
for Enzymatic Production of Collagen Hydrolysates from a Low-Value Acaudina
molpadioides and Their Activities. Journal of Food
Biochemistry, 38(2), 227-235. https://doi.org/10.1111/jfbc.12041
Zamorano-Apodaca,
J. C., García-Sifuentes, C. O., Carvajal-Millán, E., Vallejo-Galland, B.,
Scheuren-Acevedo, S. M., & Lugo-Sánchez, M. E. (2020). Biological and functional properties of
peptide fractions obtained from collagen hydrolysate derived from mixed by-products of different fish species. Food
Chemistry, 331, 127350. https://doi.org/10.1016/j.foochem.2020.127350
Zhang, Q., Dhir, A., & Kaur, P. (2022). Circular
economy and the food sector: A systematic literature review. Sustainable
Production and Consumption, 32, 655-668. https://doi.org/10.1016/j.spc.2022.05.010
Zhang, Q., Wang, Q., Lv, S., Lu, J., Jiang, S., Regenstein, J. M., & Lin, L. (2016a). Comparison of
collagen and gelatin extracted from the skins of Nile tilapia
(Oreochromis niloticus) and channel catfish (Ictalurus punctatus). Food
Bioscience, 13, 41-48. https://doi.org/10.1016/j.fbio.2015.12.005
Zhang, Y., Ma, L., & Otte, J. (2016b). Optimization
of Hydrolysis Conditions for Production of Angiotensin-Converting Enzyme
Inhibitory Peptides from Basa Fish Skin Using
Response Surface Methodology. Journal of Aquatic Food Product Technology,
25(5), 684-693. https://doi.org/10.1080/10498850.2014.919049
Zhang, Y., Olsen, K., Grossi, A., & Otte, J. (2013).
Effect of pretreatment on enzymatic hydrolysis of bovine collagen and formation
of ACE-inhibitory peptides. Food Chemistry, 141(3),
2343-2354. https://doi.org/10.1016/j.foodchem.2013.05.058