https://doi.org/10.29059/cienciauat.v20i1.2012
Incremento
de temperatura: desafío emergente para la producción de
frijol y el control de sus virus y plagas en México
Temperature increase: an
emerging challenge for common bean production and the control of its viruses
and pests in Mexico
Altas temperaturas
afectan producción de frijol
José Luis Anaya-López1*,
Elizabeth Chiquito-Almanza1, Jorge Alberto Acosta-Gallegos1,
Oscar Hugo Tosquy-Valle2
*Correspondencia:
anaya.jose@inifap.gob.mx/Fecha de recepción: 10 de marzo de 2025/Fecha de aceptación:
4 de septiembre de 2025/Fecha de publicación: 11 de septiembre de 2025
1Instituto
Nacional de Investigaciones Forestales, Agrícolas y Pecuarias, Campo
Experimental Bajío, km 6.5, carretera Celaya-San Miguel de Allende, Celaya,
Guanajuato, México, C. P. 38110. 2Instituto Nacional de
Investigaciones Forestales, Agrícolas y Pecuarias, municipio de Medellín,
Veracruz, México, C. P. 94270.
Resumen
El frijol (Phaseolus vulgaris L.), cultivo clave para la seguridad
alimentaria en México, requiere de condiciones térmicas específicas para su
desarrollo reproductivo. En el ciclo otoño-invierno 2024, en ensayos
experimentales realizados en el Campo Experimental Bajío del Instituto Nacional
de Investigaciones Forestales, Agrícolas y Pecuarias (INIFAP) se registraron
pérdidas totales y parciales en siembras de frijol de diversas variedades,
coincidentes con las temperaturas récord registradas en mayo. Además, se
documentó la presencia de "raíz negra" en el cultivo, lo que sugiere
la necesidad de estudios específicos para establecer si se están presentando
cambios en la dinámica de plagas y enfermedades, relacionados con el estrés
térmico. El objetivo de este trabajo fue analizar evidencia científica sobre el
impacto del incremento térmico en la fisiología reproductiva de frijol y su
relación con la dinámica de enfermedades virales y plagas, como marco teórico
para interpretar estos fenómenos emergentes y desarrollar estrategias de
mitigación. Las temperaturas elevadas afectan la fisiología reproductiva del
frijol y alteran las interacciones planta-patógeno, creando nuevos desafíos
fitosanitarios. Ante proyecciones climáticas de condiciones más extremas, se requiere
determinar la asociación entre el incremento térmico y las observaciones de
campo, desarrollar variedades tolerantes al calor portadoras del gen bc-3
para resistencia a virus, monitorear virus y plagas emergentes, adaptar
tecnologías de manejo integrado basadas en un diagnóstico preciso, e
identificar áreas alternativas de producción. Las pérdidas registradas en 2024
en los ensayos experimentales constituyen una alerta sobre el impacto de las
altas temperaturas en la seguridad alimentaria de México.
PALABRAS CLAVE: Phaseolus
vulgaris, estrés térmico, virus emergentes, Empoasca spp, seguridad
alimentaria.
ABSTRACT
Common bean (Phaseolus vulgaris L.) is a key
crop for food security in Mexico, which requires
specific thermal conditions for its reproductive development. During the fall-winter 2024 cycle, experimental
trials conducted at the Bajío Experimental Station of the National Institute of Forestry, Agriculture and Livestock
Research (INIFAP) recorded total and partial losses in common bean
plantings of diverse varieties, coinciding with record high temperatures
recorded in May. Additionally, the presence of "top necrosis" has
been documented in the crop, suggesting the need for specific studies to establish
whether changes in pest and disease dynamics related to thermal stress are
occurring. The objective of this work was to analyze scientific evidence on the
impact of thermal increase on common bean reproductive physiology and its
relationship with viral diseases and pest dynamics, as a theoretical framework
to interpret these emerging phenomena and develop mitigation strategies.
Elevated temperatures affect common bean reproductive physiology and alter
plant-pathogen interactions, creating new phytosanitary challenges. Given
climate projections of more extreme conditions, it is necessary to determine
the association between thermal increase and field observations, develop
heat-tolerant varieties carrying the bc-3
gene for virus resistance, monitor emerging viruses and pests, adapt
integrated management technologies based on precise diagnosis, and identify
alternative production areas. The losses recorded in 2024 in the experimental trials constitute an alert about the
impact of high temperatures on food security in Mexico.
KEYWORDS: Phaseolus
vulgaris, heat stress, emerging viruses, Empoasca
spp, food security.
![]()
INTRODUCCIÓN
El
frijol (Phaseolus vulgaris
L.) es de gran importancia cultural y económica en México, donde es un cultivo
relevante por superficie sembrada y cuyo grano constituye la
principal fuente de proteína vegetal para la
población (Jacinto-Hernández y col., 2019). De acuerdo con los datos
de los Fideicomisos Instituidos en Relación
con la Agricultura (FIRA, 2023), los frijoles negros, que agrupa a numerosas variedades de dos tipos principales, Negro brillante y Negro opaco, son los de mayor producción
y consumo, seguidas por las
de tipo Pinto.
La producción de
frijol se ve afectada por temperaturas elevadas durante la floración, ya que
impactan negativamente en el rendimiento y la calidad del grano (Rainey y
Griffiths, 2005; Suárez y col., 2020). Estudios de modelación predijeron que la
región productora de frijol en México era un área
crítica, donde los efectos del cambio climático serían intensos y se
manifestarían a corto plazo (Medina-García y col., 2016; Beebe
y col., 2017). Estas predicciones se confirmaron en mayo de 2024 que, de
acuerdo con el Reporte del Clima en México del Servicio Meteorológico Nacional
y la Comisión Nacional del Agua (SMN-CONAGUA, 2024), fue el mes más caluroso en
la historia de México. Los cambios extremos de temperatura influyen en las
epidemias virales al afectar la fisiología de la planta y su interacción
ecológica, incrementando la frecuencia y patogenicidad de los virus que las
infectan (Trebicki, 2020). Las condiciones climáticas que se presentaron recientemente, particularmente
el estrés térmico, podrían repetirse de manera recurrente en los próximos años
y alterar la dinámica de plagas y enfermedades del frijol, lo que requiere de
estudios dirigidos a documentar el fenómeno.
El objetivo de este
trabajo fue analizar la evidencia sobre los efectos de las temperaturas altas
en la fisiología reproductiva del frijol y su influencia en la dinámica de
plagas y enfermedades virales, así como sus implicaciones para el mejoramiento
genético, el manejo integrado y la seguridad alimentaria de México.
Producción
de frijol en México: contexto y vulnerabilidad climática
La producción de
frijol en México varía según el estado y los tipos preferidos por los
consumidores. Zacatecas es el principal productor, seguido por Sinaloa, juntos
aportan aproximadamente 50 % de la producción nacional. Nayarit, Chihuahua,
Chiapas, Durango, Guanajuato y Veracruz
completan el grupo más importante, con
un aporte conjunto de 36.2 %. En Zacatecas predomina el cultivo de los
frijoles Negro brillante (49.0 %) y Pinto
(33.4 %), además de los tipos Flor de mayo y Flor de junio (ambos de
color rosita). En Sinaloa se cultiva casi
exclusivamente frijol Azufrado (97.3 %), mientras que en Nayarit se
produce frijol Pinto (34.2 %), Negro (21.8 %) y Azufrado (21.6 %). Chiapas
produce mayormente frijol Negro opaco de grano pequeño (74.6 %), y Veracruz
solo cultiva este tipo de frijol. En Chihuahua y Durango predomina el frijol Pinto con 99.0 % y 62.8 %, respectivamente,
en tanto que Guanajuato se especializa en los
tipos Flor de junio (32.4 %) y Flor de
mayo(30.7
%) (FIRA, 2023).
Casi
70 % de la producción nacional se obtiene en el ciclo
primavera-verano (PV), mayormente en la región centro-norte (Chihuahua, Coahuila,
Durango, Zacatecas, Aguascalientes, San
Luis Potosí, Jalisco, Guanajuato y Querétaro), donde se genera aproximadamente
50 % de la producción total nacional
en condiciones de temporal de secano. El 30 % restante se cultiva en el
ciclo otoño-invierno (OI). En este último
ciclo, Sinaloa aporta 50 % de la producción, principalmente en
condiciones de riego, mientras que Nayarit contribuye con el 22 %, dos tercios
de los cuales se cultivan en temporal bajo
humedad residual (FIRA, 2023).
El frijol requiere
entre 300 mm y 400 mm de agua durante su ciclo fenológico, característica que
ha favorecido su producción en condiciones de temporal en la zona centro-norte
del país donde se obtienen rendimientos entre 500 kg/ha y 800 kg/ha. El riego impacta positivamente su productividad con rendimientos entre 1 600 kg/ha y 1 800 kg/ha (FIRA, 2023).
La producción de
frijol en México depende en gran medida de las lluvias, lo que la vuelve
vulnerable a condiciones de precipitación errática y deficiente. En los últimos
5 años, la escasez de lluvias y su irregular distribución fue un factor
determinante para que la producción nacional disminuyera 5 %, tendencia que se
agravó en 2022, cuando la producción del ciclo PV se redujo 32.5 % respecto al
año anterior (FIRA, 2023). Esta problemática se ha abordado desde una
perspectiva de mejoramiento genético durante décadas, y aunque se dispone de
variedades tolerantes a estrés hídrico, la mayoría son de tipo Pinto
(Anaya-López y col., 2021). No obstante, la vulnerabilidad del frijol a las
altas temperaturas recién está cobrando relevancia. En distintas partes del
mundo, incluido México, se realizan investigaciones para identificar fuentes de
tolerancia (Suárez y col., 2020; Anaya-López
y col., 2022; Appiah-Kubi y col., 2022).
El mejoramiento
genético de frijol en México enfrenta desafíos particulares. La diversidad de
tipos de frijol demandados por los consumidores y la variedad de condiciones
agroclimáticas en las que se producen (Rodríguez-Licea y col., 2010;
Espinosa-García y col., 2021) representan un reto importante. Las fuentes de
tolerancia a factores bióticos, y particularmente
abióticos, en esta especie, son limitadas; y su cruzamiento produce segregantes con una
amplia variación de formas, tamaños y colores sin demanda comercial (Beebe y col., 2009).
El trabajo del
Instituto Nacional de Investigaciones
Forestales, Agrícolas y Pecuarias (INIFAP) es fundamental en el
desarrollo de variedades mejoradas para las distintas regiones productoras del país (Anaya-López y col., 2021).
De las 100 variedades registradas en el
Catálogo Nacional de Variedades Vegetales, 80 fueron desarrolladas por
el INIFAP. Entre estas destacan 'Negro Jamapa', 'Mayocoba',
'Azufrado Higuera', 'Flor de Junio Marcela' y 'Pinto Saltillo', consideradas
referentes nacionales por su demanda por los consumidores (Rodríguez-Licea y
col., 2010; Espinosa-García y col., 2021).
Para
incrementar la precisión de selección y acelerar el desarrollo de nuevas
variedades, en el INIFAP se han
incorporado marcadores moleculares ligados a genes de interés específico.
Destacan los que confieren resistencia a roya y antracnosis (ambas,
enfermedades de origen fúngico), a diferentes virus, así como al oscurecimiento
lento de la testa, un carácter de calidad importante en frijol (Anaya-López y
col., 2021). En relación con la resistencia a virus, desde 2012, el Campo
Experimental Bajío (Guanajuato), en colaboración con las sedes de Cotaxtla
(Veracruz) y Santiago Ixcuintla (Nayarit), adoptaron como política que las
nuevas variedades de frijol desarrolladas por el Programa de Mejoramiento de frijol, incorporaran marcadores ligados al gen I
(Anaya-López y col., 2021). Las 5 variedades liberadas por dichos centros en el periodo 2018-2025 portan este
gen (Jiménez-Hernández y col., 2018; Anaya-López y col., 2021; Anaya-López y col., 2025b; Tosquy-Valle
y col., 2025). Sin embargo, la incorporación del gen I depende de
la disponibilidad de fuentes parentales que
permitan una introgresión eficiente en términos de tiempo de desarrollo, y de
priorizar la resistencia viral sobre otros caracteres en función de la
incidencia de virus en la región a las que
está destinada la variedad, así como de la disponibilidad de recursos económicos
por restricciones presupuestarias futuras
(Acosta-Gallegos y col., 2021).
El
gen I, naturalmente presente en diversos genotipos, confiere
resistencia al virus del mosaico común del
frijol (BCMV, por sus siglas en inglés: bean common mosaic virus) y reduce la
diseminación del virus de la necrosis y del mosaico común del frijol (BCMNV, bean common mosaic
necrosis virus). El Programa de Mejoramiento de frijol, mediante estrategias
de mejoramiento genético, también incorpora
en sus variedades desarrolladas
el gen bc-3, de resistencia a BCMV y
BCMNV (Drijfhout y col., 1978), y el gen bgm-1,
que reduce el mosaico y el amarillamiento sistémico producidos por el virus del mosaico amarillo dorado del frijol
(BGYMV, por sus siglas en inglés: bean golden yellow
mosaic virus) (Morales y Niessen,
1988).
La primera variedad de
frijol en México desarrollada mediante selección asistida por marcadores
moleculares, a la que se le incorporó el gen I, fue 'Dalia' de tipo Flor
de Junio (Acosta-Gallegos y col., 2014). Otras
variedades más recientes, que también contienen este gen, son: 'Salinas' de tipo Pinto (Jiménez-Hernández
y col., 2018), 'San Blas' (Acosta-Gallegos y col.,
2020), 'Rubí' (Ibarra-Pérez y col., 2022) y 'Rincón Grande' (Tosquy-Valle y col., 2025) de tipo Negro opaco, y 'San Luis 22' de tipo Negro brillante (Anaya-López
y col., 2025b). De estas, 'San Blas' porta además el gen bc-3, y 'Rubí'
el gen bgm-1, lo que les confiere resistencia a los virus prevalentes en
sus regiones objetivo. Las principales características y genes de resistencia
de las variedades de frijol desarrolladas
hasta el 2021 por el INIFAP fueron reportadas en el artículo de Anaya-López y
col. (2021).
La incorporación del
gen I en las variedades de frijol, como estrategia para reducir las
pérdidas ocasionadas por BCMV y BCMNV y limitar
su diseminación, tiene implicaciones importantes en el contexto del
calentamiento global que serán discutidas más adelante.
Temperaturas extremas:
una amenaza emergente
Estudios
de modelación realizados por el Centro Internacional de Agricultura Tropical
(CIAT, 2015) indican que el estrés térmico será la
restricción abiótica con mayor probabilidad de
limitar la productividad de frijol a escala global, incluido México. Estimaciones actuales de la Organización
Meteorológica Mundial (WMO, por sus siglas en inglés: World
Metereological Organization
(2024) prevén que entre 2024 y 2028, la
temperatura media global será 1.1 °C a 1.9 °C superior al periodo de
referencia de 1850-1900, con 86 % de
probabilidad de que se alcance un nuevo máximo histórico por encima del
registro de 2023, que es el año más cálido
documentado. Las plantas, al ser organismos sésiles (inmóviles), son
particularmente vulnerables al estrés térmico cuando se exponen a temperaturas
superiores a su óptimo por periodos
prolongados. Este estrés afecta los
procesos fisiológicos, el crecimiento y el desarrollo, causando alteraciones en
la floración, desincronización reproductiva y pérdida de estructuras
reproductivas (Vargas y col., 2021).
El frijol tiene una
temperatura base mínima de 8.3 °C, con un máximo óptimo de 25 °C (Barrios-Gómez
y López-Castañeda, 2009). Esta leguminosa se
desarrolla de manera óptima entre 10
°C y 21 °C. Temperaturas superiores a 30
°C/20 °C (día/noche) durante la floración causan la esterilidad del
polen y el aborto de botones, flores,
embriones y vainas, por lo que afectan el rendimiento y la calidad del
grano hasta en un 60 % (Rainey y Griffiths, 2005; Suárez y col., 2020). La
disminución de la producción, calidad y rendimiento se manifiesta a través del incremento en el porcentaje de semillas
arrugadas, y reducción en el tamaño y número de semillas, número de vainas,
peso promedio de las semillas y del número de semillas por vaina (Rainey y
Griffiths, 2005). La exposición de flores de frijol recién abiertas a 35 °C
durante 2 d reduce alrededor de 50 % la
viabilidad del polen (Weaver y col., 1985), mientras que la exposición
por 5 d a 32 °C y 27 °C (día/noche) previo a la antesis impide la producción de
vainas con semillas maduras (Gross y Kigel, 1994).
El clima de El Bajío
permite sembrar frijol bajo condiciones de riego en el ciclo OI. En Guanajuato,
las fechas recomendadas para su siembra en este ciclo son del 1 de febrero al
10 de marzo (Acosta-Gallegos y col., 2013). En 2024,
la mayor parte del territorio nacional enfrentó
temperaturas sin precedentes, con récord histórico de un promedio de 27
ºC en mayo (SMN-CONAGUA, 2024).
El efecto de estas
temperaturas récord en la fisiología reproductiva y el rendimiento de frijol se
confirmó en el Campo Experimental Bajío (CEBAJ) del INIFAP en Celaya,
Guanajuato, donde Prado-García y col. (2025) evaluaron 100 genotipos, incluidas
variedades mejoradas, nativas y líneas experimentales de distintos tipos de
frijol. El estudio se desarrolló en 2024, durante los dos ciclos de cultivo:
OI, y PV, lo que permitió evaluar la respuesta de los genotipos bajo tres
condiciones de crecimiento contrastante. En el ciclo OI (febrero–mayo),
correspondiente a la época seca, las condiciones
de riego completo posibilitaron analizar el estrés por altas temperaturas, en tanto
que la presencia de altas temperaturas y sequía terminal durante esa época
permitió evaluar el estrés combinado. Por otra parte, la época de lluvias, en el ciclo PV (julio-octubre) proporcionó
condiciones óptimas (control). La etapa reproductiva del cultivo, durante la época seca, ocurrió entre abril y mayo, y de
acuerdo con la Red de Estaciones Agroclimáticas del estado de Guanajuato
de la Fundación Guanajuato Produce (FGP, 2025), mayo fue el mes más cálido del
año. En el CEBAJ, las temperaturas promedio diurnas y nocturnas durante ese
mes, fueron de 30.7 °C y 22 °C, con máximas
de 37.4 °C y 33.1
°C, respectivamente. Estas condiciones extremas de calor indujeron
pérdidas de rendimiento, que se manifestaron en el aborto de embriones y la
reducción del número de vainas y de granos por vaina, además del deterioro de
la calidad de la semilla (Figuras 1a-1d). Aunque algunos materiales genéticos lograron producir bajo esas condiciones, los
estragos fueron significativos: de 100 genotipos, 42 no produjeron
semilla. De estos últimos, 9 no desarrollaron flores. En el resto se observó
aborto de flores y vainas pequeñas que contenían 1 o 2 semillas de baja calidad
y tamaño.

El rendimiento
promedio de los 58 genotipos que produjeron semilla, en ambos tratamientos, fue
de 889 kg/ha en riego (estrés por altas temperaturas) y 317 kg/ha en sequía
terminal (estrés combinado) (Prado García y col., 2025). Estos rendimientos
fueron significativamente inferiores al rendimiento promedio nacional de 1 700
kg/ha para condiciones de riego y 650 kg/ha para temporal (FIRA, 2023).
En contraste, en el
ciclo de temporal PV de 2024, la etapa reproductiva ocurrió entre septiembre y
octubre. En septiembre, el mes más cálido, las temperaturas promedio diurnas y
nocturnas fueron 23.3 °C y 17.8 °C, con máximas
de 30.0 °C y 23.9 °C, respectivamente (FGP, 2025), lo que sugiere que este
ciclo es el más adecuado para evadir las pérdidas causadas por
temperaturas altas. Sin embargo, es
importante considerar que, las predicciones realizadas por Medina-García y col.
(2016), basadas en modelos climáticos, indican un incremento de 1.1 °C a 2.6 °C
en la temperatura promedio entre mayo y octubre en las principales regiones
productoras de frijol de temporal en México hacia los años 2030, 2050 y 2070.
Los autores consideran que dicho incremento, junto con la disminución de la
precipitación, reducirá la superficie con potencial alto para este cultivo.
Los resultados
obtenidos por Prado-García y col. (2025), indican que el incremento de la
temperatura en el año 2024 indujo la inhibición total en la producción de
granos de diferentes variedades, así como fuertes reducciones en el rendimiento
de las variedades que mostraron distintos niveles de resistencia al calor y la
sequía. Estos resultados coincidieron con
observaciones de campo realizadas por técnicos de la FGP y de la Secretaría del
Campo de Guanajuato (SECAM) en el ciclo OI 2024 en parcelas de riego. Los
técnicos detectaron pérdidas totales en lotes de frijol a los que daban
seguimiento, en los municipios de
Salvatierra, Irámuco, Jaral del Progreso y
Valle de Santiago, Guanajuato (Héctor
Valencia Morales, líder de proyectos de FGP, Celaya, Guanajuato, comunicación
personal, 2 de septiembre, 2025; Luis Manuel Rojas Tovar, Agente Técnico de SECAM, Celaya, Guanajuato, comunicación personal, 3 de
septiembre, 2025). La coincidencia existente entre la evidencia científica (Prado-García y col., 2025), los datos climáticos que reportaron
altas temperaturas durante abril y mayo y las observaciones de campo, mostraron
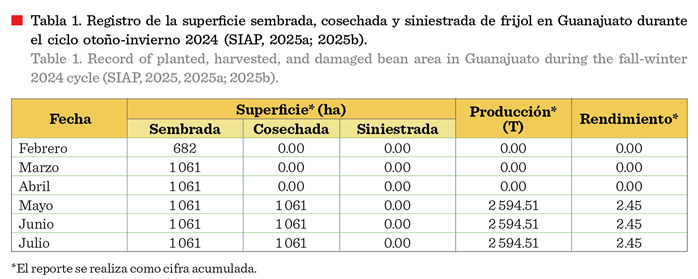
discrepancia con los reportes oficiales (Tabla 1), lo que señala la necesidad
de fortalecer los sistemas de documentación de siniestros agrícolas.
Las estaciones
climáticas ubicadas en los municipios de Acámbaro, Celaya, Jaral del Progreso,
Salvatierra y Valle de Santiago, reportaron que los
datos presentados corresponden a las temperaturas máximas diurnas y nocturnas.
Las diurnas, estuvieron entre 35.2 °C y 37.4
°C, y las nocturnas entre 30.7 °C y 33.7 °C. Acámbaro fue, en promedio,
2.3 °C más fresco (FGP, 2025). Dichas condiciones
térmicas exceden los umbrales críticos para la
formación de vainas y llenado de grano (Rainey y Griffiths, 2005; Suárez
y col., 2020), y coincidieron temporalmente
con la etapa reproductiva de las
siembras de frijol establecidas en esas localidades. El hecho de que fueran siembras de riego indica que la causa
de pérdidas se asoció a las altas temperaturas de la región en el periodo.
Los reportes mensuales
de avance de siembras y cosechas de frijol en Guanajuato, para el ciclo OI
2024, proporcionados por el Servicio de
Información Agroalimentaria y Pesquera
(SIAP, 2025a; 2025b) muestran que se establecieron 682 ha de frijol en
febrero con un acumulado de 1 061 ha en
marzo, lo que indica que se sembraron
379 ha en este último mes (Tabla 1).
En cuanto a la producción alcanzada, el reporte oficial de cierre al 31 de
julio documenta una producción de 2 594.51 T, sin que haya registro de hectáreas siniestradas.
Considerando que las
fechas de siembra recomendadas para frijol en la región son del 1 de febrero al
10 de marzo, y que este cultivo tiene un ciclo productivo de 110 d (Acosta-Gallegos y col., 2013), las siembras tempranas del 1 de
febrero (682 ha) debían cosecharse el 21 de mayo. Al cierre de ese mes se
registró una producción de 2 594.51 T (Tabla 1). Mientras que las siembras tardías, del 1 al 10 de marzo (379 ha), que
representaron el 35.7 % de la superficie sembrada, debieron completarse el 19 de junio. Sin embargo, el reporte oficial de cierre al 30 de junio documenta
una producción acumulada de 2 594.51 T, lo que implica la ausencia de
producción en el periodo de siembras tardías. La omisión del reporte de
producción en el mes de junio y de superficie siniestrada sugieren que las
superficies no cosechadas pueden ser omitidas de su clasificación como siniestro
cuando las causas específicas no son identificadas sistemáticamente en campo.
Esto podría considerarse como una limitación metodológica importante del sistema oficial de registro de pérdidas agrícolas, especialmente para las condiciones climáticas que se están
presentando globalmente y que afectan la
producción de frijol.
El fenómeno emergente
de calor de 2024 alertó sobre la vulnerabilidad del frijol a las temperaturas
extremas y motiva a que, además de registrar en las bases de datos oficiales
las pérdidas de los cultivos, se documenten a profundidad las causas que las
originan para establecer una línea base que permita tomar medidas preventivas o
correctivas evitando que el problema se generalice. Es importante motivar la
participación de expertos para plantear hipótesis, diseñar estudios específicos
y generar información precisa.
Mejoramiento genético
Para reducir el
impacto del cambio climático en el cultivo del frijol en México, es necesario
implementar estrategias como prácticas agronómicas,
desarrollar variedades tolerantes a temperaturas altas y a baja
disponibilidad hídrica, producir en zonas y temporadas con regímenes térmicos e
hídricos más favorables o introducir cultivos alternativos tolerantes, que tengan aceptación comercial por parte del consumidor
al que va dirigido. De estos últimos destacan el caupí (Vigna unguiculata L.), del que se han identificado variedades
que mantienen la viabilidad del polen hasta
41 °C (Weaver y col., 1985) y el frijol Tépari
(Phaseolus acutifolius
A. Gray) que es tolerante al estrés hídrico y térmico; y compatible con P.
vulgaris (Barrera y col., 2024).
En
relación con el mejoramiento genético, destacan dos opciones
principales: identificar germoplasma de frijol (P. vulgaris)
tolerante, o realizar cruzas interespecíficas con especies tolerantes como P. acutifolius.
Tene y col. (2023) evaluaron 196 genotipos del
género Phaseolus, e identificaron 5 de P. vulgaris, 2 de P.
lunatus,
1 de P. coccineus y 1 de P. acutifolius resistentes, tanto a condiciones de estrés
moderado en campo (máximas de 29.9 °C) como a
estrés extremo en invernadero (máximas de 43.9 °C). Por su parte, Rose y col. (2023)
identificaron una línea de tipo Andino (HTA4), derivada de la cruza entre P.
vulgaris y P. acutifolius,
tolerante a 31 °C/24 °C (día/noche), cuyo mecanismo de tolerancia se asoció a
la germinación exitosa del estigma, y al mantenimiento de la viabilidad del
polen. Si bien, estos resultados son prometedores, en ninguno de los dos
estudios se indicaron los rendimientos ni la calidad del grano, por lo que deben
tomarse con precaución. Además, la tolerancia a factores abióticos, como el
estrés térmico y la sequía, involucra
mecanismos genéticos complejos controlados por múltiples genes, lo que
puede complicar el mejoramiento (Lone y col., 2021). Esto
contrasta con la resistencia al estrés biótico, que típicamente presenta
una herencia monogénica y, en algunos casos, hay marcadores moleculares ligados
o asociados al gen de interés que facilitan su selección (Assefa
y col., 2019).
Los
avances en tolerancia a temperaturas altas en México son incipientes, siendo los
genotipos tolerantes identificados en el ciclo OI 2024 en el CEBAJ (Prado-García y col., 2025) el progreso más
significativo. Hasta ahora, el Programa de Mejoramiento de Frijol del
INIFAP ha priorizado la tolerancia a sequía como factor determinante del
rendimiento (Anaya-López y col., 2021). Sin
embargo, en el contexto del cambio climático se debe considerar también
la tolerancia al calor. Esta característica es crucial en ambientes donde ambos
estreses ocurren simultáneamente, como documentaron Appiah-Kubi
y col. (2022), quienes evaluaron 40 variedades de frijol tolerantes a sequía en
el ciclo PV, y confirmaron que solo aquellas que toleraban temperaturas altas completaron su desarrollo reproductivo, independientemente del manejo de
fósforo y riego. Ello indica que, si el incremento de temperatura en las
regiones productoras de frijol en México
sobrepasa los umbrales de tolerancia durante el ciclo PV, las
consecuencias serán críticas independientemente de la disponibilidad de agua.
Efectos del cambio
climático en la dinámica de plagas y enfermedades virales
Las alteraciones
climáticas afectan la prevalencia,
distribución e intensidad de plagas y enfermedades vegetales mediante
múltiples mecanismos, donde la temperatura y la precipitación pluvial son
factores críticos (Sharma y col., 2020; Alfizar y Nasution, 2024). El cambio climático puede incrementar la
vulnerabilidad de las plantas a plagas y
patógenos actualmente limitados por condiciones climáticas
desfavorables, y propiciar la emergencia de patógenos preexistentes como
agentes causales de enfermedades (Reddy, 2018; Sharma y col., 2020).
Investigaciones de campo sobre la incidencia estacional de insectos plaga en
girasol mostraron correlación positiva significativa entre la temperatura y las
poblaciones de mosquita blanca (Bemisia tabaci Genn.) y
chicharrita (Empoasca spp)
(Basit y col., 2016). De manera similar, en
frijol mungo (Vigna radiata L.), las poblaciones
de B. tabaci y áfidos también tuvieron
una correlación positiva con la temperatura, y negativa con la humedad y las
precipitaciones (Gehlot y Prajapat,
2021).
La manera en que el
incremento de temperatura afectará la dinámica de los insectos plaga puede
variar en función del clima de cada región. Se prevé que especies confinadas a
regiones tropicales y subtropicales se extenderán a zonas templadas, mientras
que algunas especies vulnerables a temperaturas altas podrían disminuir en las
regiones templadas (Deutsch y col., 2018). Esto se
debe a que las regiones templadas no tienen la temperatura óptima para su
desarrollo, por lo que los insectos crecerán más rápido con el aumento de
temperatura; mientras que en los trópicos, al estar
cerca de su óptimo, las poblaciones crecerán más lentamente cuando la
temperatura se eleve demasiado.
No obstante, anticipar
los efectos del calentamiento global en los insectos es complejo. El estudio realizado por Lehmann y col. (2020)
concluye que, la amenaza que representan como plagas puede no aumentar de
manera uniforme debido a las necesidades específicas de nicho, tolerancias
fisiológicas y efectos variables de la temperatura en su fenología y ciclo de
vida, por lo que la mitigación de sus efectos requiere comprender mejor las
respuestas de especies individuales y los mecanismos ecológicos subyacentes.
Esta evidencia también sugiere la necesidad de un monitoreo constante.
Entre los principales
insectos plaga del frijol destacan la mosquita blanca (B. tabaci) y las chicharritas del género Empoasca. De esta última, en un mismo campo pueden
coexistir varias especies, como se documentó en Cuba con E. kraemeri Ross y Moore, E. fabae
Harris y E. papayae Oman
(Sánchez-Castro y col., 2016). Aunque no se ha demostrado que el género Empoasca transmita virus al frijol, E. kraemeri causa toxemia severa al inyectar toxinas
salivales (Backus y col., 2005). Por otra parte, E. papayae
tiene la capacidad de transmitir fitoplasmas y el
virus de la meleira (PeMV)
a la papaya, lo que destaca la importancia de su correcta identificación
taxonómica, para estudiar su epidemiología y desarrollar estrategias de
control.
Aunque no hay
publicaciones que muestren un incremento en la incidencia de la chicharrita (Empoasca spp) en el
cultivo de frijol en México, diferentes investigadores que laboran en los
campos de investigación del INIFAP consideran que este insecto podría emerger como plaga relevante en varios estados. En 2023,
en Durango, se presentó una infestación sin
precedentes que requirió aplicaciones múltiples de insecticida (José C.
Jiménez-Galindo, investigador del INIFAP, Cuauhtémoc, Chihuahua, comunicación personal, 8 de agosto, 2024).
El problema se ha observado también en
parcelas experimentales y comerciales en Guanajuato (Figura 2a-2d) y
Querétaro (Jorge A. Acosta-Gallegos, investigador del
INIFAP, Celaya, Guanajuato, comunicación personal, 20 de noviembre, 2024),
mientras que en Nayarit su incidencia es recurrente (Nadia C. García-Álvarez,
investigador del INIFAP, Santiago Ixcuintla,
Nayarit, comunicación personal, 8 de enero, 2025). Estas observaciones
recientes de infestaciones inusuales de Empoasca
spp podrían estar relacionadas con los cambios en los
patrones climáticos, ya que la temperatura es un factor dominante en la
regulación de las poblaciones de insectos, lo que requiere de una investigación
rigurosa para establecer la relación entre los factores del cambio climático,
como la sequía y las temperaturas altas, con la dinámica de las poblaciones
insectiles y los virus, toda vez que la mayoría de los virus de plantas son
transmitidos por insectos vectores en sistemas biológicos complejos que
incluyen múltiples plantas hospederas, virus, vectores y sus endosimbiontes
bacterianos. La incidencia temprana y prolongada de clima cálido puede alterar
estas interacciones, incrementando el riesgo de nuevas enfermedades virales y
brotes en la agricultura y los ecosistemas
naturales (Sharma y col., 2020).

El frijol es una de
las leguminosas más susceptibles a las enfermedades virales, con pérdidas de
rendimiento de hasta 100 %, dependiendo de la
época de cultivo, densidad de vectores y especie viral (Morales y Castaño,
2008). En diversas especies vegetales, el incremento en la temperatura
ambiental puede potenciar la propagación viral sistémica y de célula a célula
(Amari y col., 2021). Además, bajo condiciones de estrés, que reflejan
escenarios extremos previstos por el cambio climático, las semillas infectadas
pueden ser más viables que las no infectadas, lo que incrementa la prevalencia y persistencia viral en la población
hospedante (Gutiérrez-Sánchez y col., 2023).
La temperatura modula
las epidemias virales a nivel de micro y macroclima,
afectando tanto los procesos en la planta
(acumulación y movimiento viral), como las interacciones ecológicas
(dinámica y comportamiento de vectores, características del hospedero y
supervivencia de reservorios virales) (Sharma y col., 2020; Tsai
y col., 2022). Estas alteraciones pueden afectar la virulencia y patogenicidad
de los virus de plantas, lo que incrementa la frecuencia y escala de los brotes
de las enfermedades que producen (Trebicki, 2020).
La complejidad de las
interacciones insecto-virus se evidencia en los distintos mecanismos de
transmisión. B. tabaci transmite al frijol los
virus BGMV, BGYMV, el virus del moteado suave del caupí (CPMMV, por sus siglas en
inglés: cowpea mild mottle virus) y otros
begomovirus (Ferreira y col., 2024); mientras
que diversas especies de áfidos transmiten al BCMV
y al BCMNV (Morales y Castaño, 2008). Adicionalmente, es frecuente
detectar el fenómeno de coinfección, que
implica la presencia de varias especies virales en una misma planta.
Esto puede resultar en interacciones de neutralismo, sinergismo, antagonismo y
sinergismo/antagonismo entre virus, con implicaciones significativas para el
desarrollo de enfermedades, la expresión de síntomas y la epidemiología viral
(Moreno y López-Moya, 2020; Singhal y col., 2021).
En México, se han
detectado infecciones simples y mixtas de BCMV y BCMNV en siembras de frijol en
los estados de Guanajuato, Jalisco y Nayarit. En el último se ha identificado
además la coinfección con CPMMV, BGYMV y el virus latente del frijol (BLV). De
estas especies, BCMV, BCMNV y BGYMV destacan por su incidencia y la severidad
de los daños que ocasionan (Chiquito-Almanza y col., 2018; Martínez-Marrero y
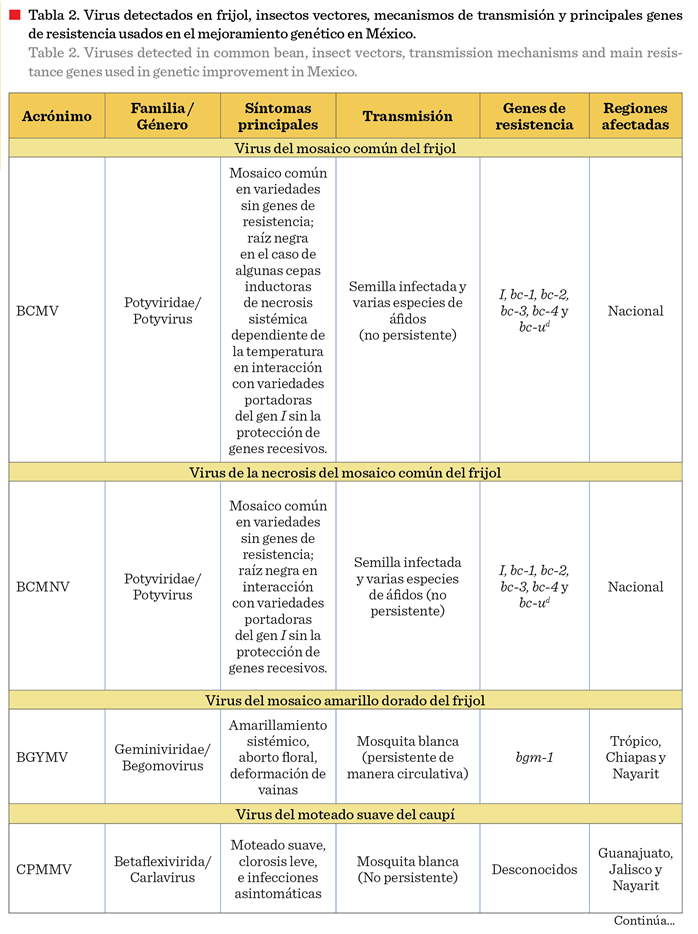
col., 2020; Chiquito-Almanza 2021). Los principales virus que infectan al
frijol, identificados en México, sus mecanismos de transmisión, síntomas que producen y los genes usados en
programas nacionales para el mejoramiento de variedades de frijol resistentes
se resumen en la Tabla 2.

Aplicar medidas de
control adecuadas requiere conocer aspectos biológicos, epidemiológicos,
patológicos y ecológicos, tanto de los virus como de sus vectores. BCMV y BCMNV
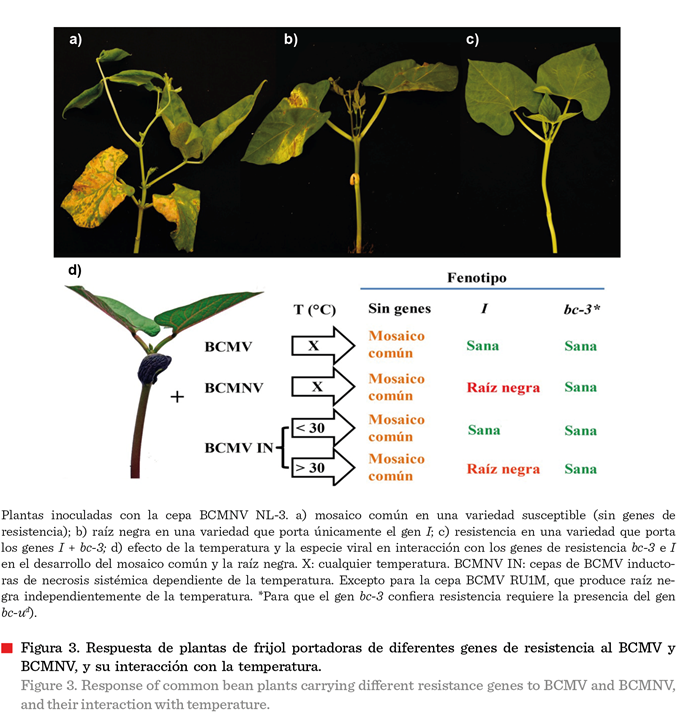
causan mosaico común (Figura 3a) cuando
infectan variedades sin genes de resistencia, mientras que el BCMNV
produce raíz negra (también conocida como necrosis apical) en variedades
portadoras del gen I sin la protección de genes recesivos (Figura 3b),
al igual que algunas cepas de BCMV por efecto
del incremento de temperatura (Figura 3d), como se detalla en la siguiente sección (Drijfhout y col., 1978; Collmer
y col., 2000). Los dos virus se han detectado en la mayoría de las regiones
productoras de frijol en México (Flores-Esteves y col., 2003; Chiquito-Almanza y col., 2021), y pueden transmitirse al embrión de variedades
susceptibles con tasas de hasta 80 %, por lo que la semilla infectada es su
principal medio de diseminación. La transmisión secundaria es realizada por
diversas especies de áfidos de manera no persistente dentro y fuera del
cultivo, lo que favorece la perpetuación del agente etiológico y el inicio de
nuevos ciclos de la enfermedad (Morales y Castaño, 2008). El BCMV puede
ocasionar una reducción en el rendimiento de entre 53 % y 83 % (Sastry, 2013).
El BGYMV se encuentra
principalmente en áreas tropicales como Chiapas y Nayarit (Garrido-Ramírez y
col., 2000; Chiquito-Almanza y col., 2021). Los genotipos susceptibles
infectados en las primeras etapas de desarrollo presentan amarillamiento
sistémico intenso y pueden tener pérdidas totales, debido al aborto de flores y la deformación de las vainas (Morales y Niessen,
1988). En el trópico de México se han reportado pérdidas de rendimiento
atribuidas a este virus en variedades
susceptibles como ‘Negro Jamapa’ (87.6 %), ‘Negro Tacaná’ (18 %) y
‘Negro Huasteco-81’ (40.5 %) (López-Salinas y col., 1993). La transmisión del
BGYMV se realiza de manera persistente por B. tabaci
con un periodo de latencia de 4 h a 48 h (Morales y Anderson, 2001). La
incidencia de la enfermedad y la magnitud de las pérdidas varían dependiendo de
las poblaciones del vector, la susceptibilidad de la variedad, las prácticas
culturales, y las condiciones ambientales, principalmente la precipitación
pluvial, que afectan a las poblaciones de B.
tabaci (Morales y Anderson, 2001).
Adicionalmente, es común que este virus cause deformación y enanismo de la planta, así como aborto de flores en genotipos de
frijol de la raza Mesoamericana, particularmente
en condiciones de temperatura alta (Morales y Niessen,
1988).
Los diferentes
mecanismos de transmisión y la biología de los virus y vectores determinan las
prácticas de manejo. Por ejemplo, para BGYMV, que no se transmite por semilla y requiere un periodo de incubación en el insecto
antes de poder transmitirse, las estrategias se basan en reducir las
poblaciones del vector mediante insecticidas, barreras vegetales y la siembra
en épocas con menor incidencia de mosquita blanca. En contraste, para BCMV y
BCMNV, la estrategia de control más adecuada y económica es la resistencia
genética, ya que su principal medio de diseminación es la semilla infectada y
el control del vector tiene poca eficacia, pues este puede transmitir los virus
segundos después de alimentarse de una planta infectada (Morales y Castaño,
2008).
Influencia de
temperaturas altas en la ruptura de resistencia a BCMV y BCMNV
La presencia del gen I
como estrategia de mejoramiento genético de las variedades de frijol
desarrolladas por el INIFAP, destinadas a diferentes regiones (Anaya-López y
col., 2021), es de gran importancia para la producción de frijol en el país. Sin embargo, la efectividad de
esta resistencia puede verse comprometida por factores ambientales,
particularmente la temperatura, lo que
representa un riesgo potencial para la seguridad alimentaria nacional.
En variedades que
portan únicamente el gen I, sin la protección de genes recesivos, se
pro-duce la raíz negra a cualquier temperatura por la interacción con el BCMNV (Figura 3b) y con algunas cepas de
BCMV como la recombinante RU1M (Drijfhout y col.,
1978; Collmer y col., 2000; Feng y col., 2014). La
combinación del gen I con el gen recesivo bc-3 confiere
resistencia al BCMNV (Figura 3c), y a la mayoría de las cepas de BCMV descritas
(Drijfhout y col., 1978; Soler-Garzón y col., 2021a;
2021b). El gen I induce una respuesta
hipersensible contra el BCMNV independientemente de la temperatura (Figura 3d), que resulta en necrosis
sistémica y que frecuentemente causa la muerte de la planta, aunque evita la
diseminación del virus por medio de la semilla infectada (Drijfhout
y col., 1978). Este gen confiere alta resistencia o incluso inmunidad completa a la mayoría de las cepas del BCMV por
debajo de 30 °C (Figura 3d). Sin embargo, por encima
de esta temperatura, algunas cepas del
BCMV como NL2 y NL6, denominadas “cepas inductoras de necrosis dependiente de la temperatura”,
inducen síntomas de necrosis sistémica
(Figura 3d) (Drijfhout y col., 1978; Collmer y col., 2000).
En 2024, en
coincidencia con el calor extremo, se observaron síntomas de necrosis apical en
plantas de frijol en los campos experimentales del CEBAJ (Figuras 4a y 4b).
Aunque no se confirmó el agente viral responsable, es necesario realizar
estudios de identificación, ya que esos
síntomas pueden ser causados por diferentes virus, incluyendo BCMNV,
ciertas cepas de BCMV u otros virus emergentes
como el virus del mosaico severo del frijol (PvSMV).
Esta investigación es especialmente importante
si las condiciones climáticas extremas persisten.

Los mecanismos
moleculares subyacentes a la necrosis inducida por temperatura aún no están
claros. Se ha propuesto que la expresión del
gen I está regulada negativamente por la temperatura. Como
resultado, la cantidad de proteína I que se produce es baja para
conferir resistencia confiable a temperaturas altas. También es posible que, la
respuesta inmune inducida por este gen (y su proteína expresada) se vea
atenuada por la temperatura alta (Collmer y col.,
2000).
El gen I es
útil en regiones con baja incidencia de BCMNV, ya que, al morir la planta (por
efecto de la respuesta hipersensible), se reduce la diseminación del virus a
través de la semilla. Sin embargo, no es adecuado en zonas con temperaturas
elevadas o incidencia alta de especies o cepas inductoras de necrosis, como
ocurre en Nayarit. Para esas condiciones, se requieren genes recesivos que
puedan actuar de forma específica contra cepas virales de interés. Hasta ahora
se han identificado 5 genes recesivos que podrían ser utilizados: bc-1,
bc-2, bc-3, bc-4 y bc-ud
(Drijfhout y col., 1978; Soler-Garzón y col., 2021a;
2021b).
El gen bc-3 es
el más estudiado, este se encuentra en el cromosoma 6 del frijol y codifica el
factor de inicio de la traducción eucariótica
4E (eIF4E). La combinación de bc-3 y bc-ud
puede proteger al frijol de la infección por todas
las cepas de BCMV (Drijfhout y col., 1978), excepto a
BCMV-1755a (Feng y col., 2015), y es hasta ahora la mejor opción de
resistencia a cepas inductoras de necrosis.
Es importante estudiar
el origen de la presencia de raíz negra observada en los lotes experimentales
del CEBAJ (Figuras 4a y 4b), para establecer si el fenómeno está relacionado
con el aumento de temperatura, en combinación con una mayor incidencia de BCMNV
o de cepas de BCMV inductoras de necrosis. Un resultado positivo a esta
hipótesis indicaría la necesidad de incorporar el gen bc-3 en las nuevas variedades. Aunque, también es probable
que esté relacionado con el brote de una nueva especie viral.
El
virus del mosaico severo del frijol (PvSMV), descubierto
por primera vez en el CEBAJ (Chiquito-Almanza y col., 2020) es un comovirus que provoca síntomas similares a raíz negra
(Figura 4c), por lo que es crucial confirmar la presencia y distribución de dichas especies virales. Los comovirus típicamente son transmitidos por crisomélidos (Coleoptera: Chrysomelidae) y por
medios mecánicos, aunque algunos, como el virus latente 1 de Arabidopsis (ArLV1), pueden transmitirse a la
semilla (Verhoeven y col., 2023). Esta diversidad en los
mecanismos de transmisión resalta la importancia de investigar las vías de
transmisión del PvSMV para comprender mejor su
epidemiología.
Perspectivas para el
manejo integrado bajo el cambio climático
En el escenario actual
del cambio climático se requiere implementar estrategias de manejo integrado que consideren tanto los factores bióticos
como abióticos que afectan la producción de frijol. El enfoque debe incluir medidas preventivas, sistemas de monitoreo y
prácticas adaptativas que permitan mitigar los efectos conjuntos del incremento
de temperatura y la variabilidad de las precipitaciones, ya que su efecto
combinado es mayor que cuando se presentan individualmente (Appiah-Kubi
y col., 2022).
En relación con las
plagas, la Convención Internacional de Protección Fitosanitaria (IPPC, 2021)
recomienda prácticas de manejo que incluyen la producción y uso de semillas y
materiales libres de patógenos,
establecimiento de sistemas de alerta temprana, herramientas de diagnóstico precisas, tratamientos efectivos
para las semillas, variedades resistentes, adopción de prácticas
culturales que fomenten la sanidad vegetal,
manejo integrado de plagas, aplicación rigurosa de medidas de higiene y empleo de productos biológicos para la protección
de cultivos.
Mitigar el impacto de
la sequía y las altas temperaturas requiere
la implementación de medidas a corto y largo plazo. Las medidas a corto
plazo se basan en prácticas agronómicas adaptativas relacionadas con el manejo
del suelo, el uso de sistemas de riego eficientes y prácticas culturales como
la labranza de conservación, el manejo de residuos de cultivo, los cultivos de
cobertura, el uso de biocarbón y el acolchado, así
como la selección de las variedades más
apropiadas (Lamaoui y col., 2018; Wang y Ren,
2025). Entre las medidas de largo plazo se encuentran la construcción de
reservorios, el mejoramiento de sistemas de alerta temprana y el desarrollo de
variedades resistentes (Wang y Ren, 2025). Estas prácticas deben implementarse
de manera integrada, considerando las condiciones de cada región productora y
las proyecciones climáticas locales, pues su efectividad puede ser específica
para cada región, y algunas pueden tener consecuencias no deseadas en la
calidad ambiental.
La investigación del
frijol en México requiere un enfoque
interdisciplinario. Entre las prioridades se incluyen: la identificación
de nuevas áreas aptas para su producción, el desarrollo de variedades
tolerantes a temperaturas altas mediante selección bajo condiciones de estrés
controladas (evaluando características como viabilidad del polen y carga de
vainas), la introgresión de los genes I y bc-3, el monitoreo del clima y de las poblaciones de insectos
y virus, así como el desarrollo de tecnologías de manejo integrado basadas en
modelos predictivos (Skendžić y col., 2021; Jeger y col., 2023; Subedi y
col., 2023; Alfizar y Nasution,
2024). Estas estrategias requieren concordancia con la región productora,
considerando la interacción entre estrés térmico y problemas fitosanitarios,
por lo que probablemente se requerirá de variedades específicas de nicho
(del-Canto y col., 2025).
La identificación
precisa de vectores y especies virales, junto con la predicción del efecto de
temperaturas altas sobre enfermedades y plagas de frijol, son esenciales para
adoptar medidas efectivas. La inclusión de herramientas moleculares en el
diagnóstico es estratégica; por ejemplo, la secuenciación masiva para la
identificación de virus (Anaya-López y col., 2025a), y en el caso de las
chicharritas, el código de barras de ADN, que complementa la identificación
morfológica tradicional y permite la caracterización precisa de especies en cualquier etapa de su ciclo de vida (Emam y col., 2020). Estas herramientas y el
conocimiento generado sentarán bases para desarrollar variedades resistentes,
sistemas de alerta temprana y métodos de manejo integrado que eviten pérdidas
severas de producción y contribuyan a la sostenibilidad alimenticia.
Actualmente, en México
se carece de un sistema centralizado de registro y monitoreo de pérdidas en
frijol atribuibles al cambio climático, lo que dificulta cuantificar el impacto económico y social, así como evaluar la efectividad
de las estrategias implementadas. Un sistema que integre datos climáticos,
fitosanitarios y económicos de las distintas regiones productoras, con la
participación coordinada de instituciones de investigación, organizaciones de
productores y dependencias gubernamentales,
orientará políticas públicas, investigación y transferencia de
tecnología que garanticen la seguridad
alimentaria de este cultivo básico en México.
CONCLUSIONES
El incremento de la
temperatura ambiental, efecto asociado al cambio climático, representa una
amenaza emergente para la producción de frijol en México. Las pérdidas
confirmadas experimentalmente por el INIFAP, durante el ciclo otoño-invierno
2024, alertan sobre la vulnerabilidad del cultivo a temperaturas extremas. La
evidencia científica indica que las altas temperaturas pueden afectar tanto la
fisiología reproductiva del cultivo como alterar la dinámica de plagas y
enfermedades virales, lo que podría ser
consistente con las observaciones de campo que necesitan ser
confirmadas. Ante esta situación se requieren estrategias integrales que
incluyen: el desarrollo de variedades
tolerantes a temperaturas altas portadoras de los genes I y bc-3
de resistencia a BCMV y BCMNV, el monitoreo sistemático de virus y plagas
emergentes, la adaptación de tecnologías de manejo integrado, y la
identificación de áreas alternativas de producción. Estas medidas son
fundamentales para preservar la seguridad alimentaria de México, donde el
frijol constituye un pilar de la dieta nacional.
Declaración de conflicto de intereses
Los autores declararon
no tener conflictos de intereses de ningún tipo.
Referencias
Acosta-Gallegos, J. A.,
Anaya-López, J. L., Uresti-Gil, J., Chiquito-Almanza, E., Guerrero-Aguilar, B.
Z. y Jiménez-Hernández, Y. (2021). Mejoramiento genético del frijol en la
región de El Bajío de México. En A. V. Ayala-Garay Garay, J. A. Acosta-Gallegos y L. Reyes-Muro (Eds.). El cultivo del frijol
presente y futuro para México (pp. 83-97). Instituto Nacional de
Investigaciones Forestales, Agrícolas y Pecuarias. Centro de Investigación
Regional Centro. Campo Experimental Bajío. https://vun.inifap.gob.mx/VUN_MEDIA/BibliotecaWeb/_media/_librotecnico/12319_5085_El_cultivo_del_frijol_presente_y_futuro_para_M%C3%A9xico.pdf.
Fecha de consulta: 5 de septiembre de 2025.
Acosta-Gallegos, J. A.,
Jiménez-Hernández, Y., García-Álvarez, N. C., Rojas-Tovar, M., Chiquito-Almanza, E. y Anaya-López, J. L. (2020). ‘San Blas’:
variedad de frijol Negro Opaco resistente a BCMV y BCMNV para Nayarit y El
Bajío de Guanajuato. Revista Mexicana de Ciencias Agrícolas, 11(7),
1701-1707. https://doi.org/10.29312/remexca.v11i7.1963
Acosta-Gallegos, J. A., Montero-Tavera, V., Jiménez-Hernández, Y.,
Anaya-López, J. L. y Gonzalez-Chavira, M. M. (2014).
‘Dalia’, nueva variedad de frijol de grano tipo Flor de Junio para la región
centro de México. Revista Mexicana de Ciencias Agrícolas, 5(2), 331-336.
https://doi.org/10.29312/remexca.v5i2.971
Acosta-Gallegos, J. A.,
Sánchez-García, M. B., Ocampo-Hernández. J. y Jiménez-Hernández, Y. (2013). Guía para
la producción de frijol. En A. Mandujano-Bueno, R. Paredes-Melesio, M. P.
Alamilla-Gómez, y J. F. Buenrostro-Rodríguez (Eds.), Guía para la producción
de Maíz, Frijol, Trigo y Sorgo en Guanajuato (pp. 82-112). Instituto
Nacional de Investigaciones, Forestales, Agrícolas y Pecuarias.
Alfizar & Nasution,
S. S. (2024). The explosion
of pests and diseases due to
climate change. IOP
Conference Series: Earth and
Environmental Science,1297(1), 012072. https://doi.org/10.1088/1755-1315/1297/1/012072
Amari, K., Huang, C., & Heinlein, M. (2021).
Potential impact of global warming on virus propagation in infected plants and
agricultural productivity. Frontiers in Plant Science, 12, 649768. https://doi.org/10.3389/fpls.2021.649768
Anaya-López,
J. L., Chiquito-Almanza, E., Acosta-Gallegos, J. A., Tosquy-Valle, O. H., Montero-Tavera, V., &
González-Pérez, E. (2025a). Diagnosis and characterization of plant
viruses in Mexico using HTS: an approach to guide virus management and marker
assisted selection. Discover Plants, 2(1), 246. https://doi.org/10.1007/s44372-025-00332-y
Anaya-López,
J. L., Guerrero-Aguilar, B. Z., Jiménez-Hernández, Y., Chiquito-Almanza, E.,
Prado-García, A. A. y Acosta-Gallegos, J. A. (2025b).
‘San Luis 22’: variedad de frijol negro brillante de temporal para el
centro-norte de México. Revista Mexicana de Ciencias Agrícolas, 16(2),
e3411. https://doi.org/10.29312/remexca.v16i2.3411.
Anaya-López,
J. L., Ibarra-Pérez, F. J., Rodríguez-Cota, F. G., Ortega-Murrieta, P. F.,
Chiquito-Almanza, E. y Acosta-Gallegos, J. A. (2021).
Leguminosas de grano en México: variedades mejoradas de frijol y garbanzo
desarrolladas por el INIFAP. Revista Mexicana de Ciencias Agrícolas,
12(25), 63-75. https://doi.org/10.29312/remexca.v12i25.2827
Anaya-López,
J. L., Rojas-Tovar, L. M., Cisneros-López, H. C., & Acosta-Gallegos, J. A. (2022). Seed
yield and harvest index of Pinto and Flor de Mayo dry beans germplasm under
stress by high temperature. Revista Fitotecnia Mexicana, 45(1),
33-41.
Appiah-Kubi, D., Asibuo,
J. Y., Butare, L., Yeboah,
S., Appiah-Kubi, Z., Kena,
A. W., Tuffour, H. O., & Akromah,
R. (2022). Heat stress tolerance:
A prerequisite for the selection of
drought-and low phos-phorus-tolerant common beans for equatorial
tropical regions such as
Ghana. Plants, 11(18), 2352. https://doi.org/10.3390/plants11182352
Assefa,
T., Assibi-Mahama, A., Brown, A. V., Cannon, E. K.
S., Rubyogo, J. C., Rao, I. M., Blair, M. W., &
Cannon, S. B. (2019). A review of
breeding objectives, genomic resources, and marker-assisted methods in common
bean (Phaseolus vulgaris L.). Molecular Breeding, 39(2), 20. https://doi.org/10.1007/s11032-018-0920-0
Backus, E. A., Serrano, M. S., &
Ranger, C. M. (2005). Mechanisms of hopperburn: an overview of
insect taxonomy, behavior, and physiology. Annual Review of Entomology, 50(1),
125-151. https://doi.org/10.1146/annurev.ento.49.061802.123310
Barrera,
S., Berny-Mier y Teran, J. C., Aparicio, J., Díaz,
J., Leon, R., Beebe, S.,
Urrea, C. C., & Gepts, P. (2024). Identification of drought and heat tolerant tepary beans in a
multienvironment trial study. Crop Science, 64(6), 3399-3416. https://doi.org/10.1002/csc2.21354
Barrios-Gómez,
E. J. y López-Castañeda, C. (2009). Temperatura base y tasa de extensión foliar
en frijol. Agrociencia, 43(1), 29-35.
Basit, M., Saeed,
S., Saleem, M. A., & Zulfiqar,
R. (2016). Population dynamics of sunflower insect
pests and their natural enemies. Sarhad Journal of Agriculture, 32(4),
417-423. | http://dx.doi.org/10.17582/journal.sja/2016/32.4.417.423
Beebe, S., Ramírez-Villegas, J., Álvarez, P.,
Ricaurte, J., Mora, A., Guerrero, A. F., Rosas, J. C., Rodríguez-Baide, J. M., & van-den-Berg,
M. (2017). Modelación del frijol en Latinoamérica: Estado del arte y base de
datos para parametrización, EUR. Publications Office of the European
Union, Luxembourg. http://dx.doi.org/10.2760/325955, JRC110112.
Beebe, S. E., Rao, I. M., Blair, M. W., & Butare, L.
(2009). Breeding for abiotic stress tolerance in common bean: Present and
future challenges. SABRAO Journal of
Breeding and Genetics, 41,
1-10.
Chiquito-Almanza,
E., Caballero-Pérez, J., Acosta-Gallegos, J. A.,
Montero-Tavera, V., Mariscal-Amaro, L. A., & Anaya-López, J. L. (2021). Diversity and distribution of viruses infecting wild and domesticated Phaseolus
spp. in the Mesoamerican Center of domestication. Viruses, 13(6), 1153. https://doi:10.3390/v13061153
Chiquito-Almanza,
E., Caballero-Pérez, J., Guevara-Olvera, L., Acosta-García, G., Pérez-Pérez, M.
C. I., Acosta-Gallegos, J. A., & Anaya-López, J.
L. (2018). First report of cowpea mild mottle virus
infecting cultivated and wild Phaseolus
in the Central-Western region of Mexico. Plant Disease, 102(5), 1047-1047. https://doi.org/10.1094/PDIS-07-17-0990-PDN
Chiquito-Almanza,
E., Zamora-Aboytes, J. M., Medina, H. R., Acosta-Gallegos,
J. A., & Anaya-López, J. L. (2020). Complete genome
sequence of a novel comovirus infecting common bean. Archives of Virology, 165(6),
1505-1509. https://doi: 10.1007/s00705-020-04610-w
CIAT,
Centro Internacional de Agricultura Tropical (2015). Developing
Beans That Can Beat the Heat; Tech. Report;
International Center for Tropical Agriculture:
Cali, Colombia. [En línea]. Disponible en:
http://ciatlibrary.ciat.cgiar.org/articulos_ciat/biblioteca/DEVELOPING_BEANS_THAT_CAN_BEAT_THE_HEAT_lowres%20(2).pdf.
Fecha de consulta: 20 de mayo de 2024.
Collmer, C. W., Marston, M. F., Taylor, J. C., &
Jahn, M. (2000). The I gene of bean: A dosage-dependent allele conferring
extreme resistance, hypersensitive resistance, or spreading vascular necrosis
in response to the potyvirus Bean common mosaic virus. Molecular
Plant Microbe Interactions, 13(11), 1266-1270. https://doi.org/10.1094/MPMI.2000.13.11.1266
Del-Canto,
A., De-Diego, N., Sanz-Sáez, Á., Štefelová, N.,
Pérez-López, U., Mena-Petite, A., & La-cuesta, M.
(2025). Organic management and local genotypes for elevating yield and seed quality to confront climate
change challenges. European Journal of Agronomy, 168, 127613. https://doi.org/10.1016/j.eja.2025.127613
Deutsch, C. A., Tewksbur, J. J., Tigchelaar, M.,
Battisti, D. S., Merrill, S. C., Huey, R. B., & Naylor, R. L. (2018).
Increase in crop losses to insect pests in a warming climate, Science,
361, 916-919. https://doi.org/10.1126/science.aat3466
Drijfhout, E., Silbernagel, M. J., & Burke, D. W.
(1978). Differentiation of strains of bean common mosaic virus. Netherlands
Journal of Plant Pathology, 84, 13-26. https://doi.org/10.1007/BF01978099
Emam, A. K., Ibrahim, H. E., Helmi, A., & Sharaf, A.
(2020). Identification of
some Egyptian leafhopper species (Hemiptera: Cicadellidae) using DNA barcoding. Biologia, 75, 1337-1346. https://doi.org/10.2478/s11756-019-00384-y
Espinosa-García,
J. A., Acosta-Gallegos, J. A., Vélez-Izquierdo, A. y Jolalpa-Barrera, J. L. (2021). Mercado potencial de semilla
de variedades mejoradas de frijol para riego y temporal. En A. V. Ayala-Garay,
J. A. Acosta-Gallegos y L. Reyes-Muro (Eds.). El
cultivo del frijol presente y futuro para México (pp. 145-161). Instituto
Nacional de Investigaciones Forestales, Agrícolas y Pecuarias. Centro de
Investigación Regional Centro. Campo Experimental Bajío. https://vun.inifap.gob.mx/VUN_MEDIA/Biblio-tecaWeb/_media/_librotecnico/12319_5085_El_cultivo_del_frijol_presente_y_futuro_para_M%C3%A9xico.pdf
Feng, X., Myers, J. R., & Karasev, A. V. (2015). Bean
common mosaic virus isolate exhibits a novel pathogenicity profile in common
bean, overcoming the bc-3 resistance allele coding for the mutated eIF4E
translation initiation factor. Phytopathology, 105(11), 1487-1495.
https://doi: 10.1094/PHYTO-04-15-0108-R
Feng, X., Poplawsky, A. R., & Karasev, A. V. (2014).
A recombinant of Bean common mosaic virus induces temperature-insensitive
necrosis in an I gene-bearing line of common bean. Phytopathology,
104(11), 1251-1257. https://doi.org/10.1094/PHYTO-02-14-0048-R
Ferreira, A. L., Ghanim, M., Xu, Y., & Pinheiro, P.
V. (2024). Interactions between common bean viruses and their whitefly vector. Viruses,
16(10), 1567. https://doi.org/10.3390/v16101567
FGP,
Fundación Guanajuato Produce (2025). Red de estaciones Agroclimáticas del
estado de Guanajuato. [En línea]. Disponible en:
https://www.estaciones.fundacionguanajuato.mx/home.php. Fecha de consulta: 2 de
julio de 2025.
FIRA,
Fideicomisos Instituidos en Relación con la Agricultura (2023). Panorama
agroalimentario frijol 2023. Dirección de Investigación y Evaluación Económica
y Sectorial. [En línea]. Disponible en:
https://www.fira.gob.mx/InvYEvalEcon/EvaluacionIF. Fecha de consulta: 5 de
febrero de 2024.
Flores-Esteves,
N., Acosta-Gallegos, J. A., & Silva-Rosales, L.
(2003). Bean common mosaic virus and bean common mosaic necrosis virus in Mexico. Plant Disease, 87(1), 21-25. https://doi.org/10.1094/PDIS.2003.87.1.21
Garrido-Ramírez,
E. R., Sudarshana, M. R., & Gilbertson,
R. L. (2000). Bean golden yellow mosaic virus from Chiapas, Mexico: Characterization, pseudorecombination with other bean-infecting geminiviruses
and germ plasm screening. Phytopathology, 90(11), 1224-1232. https://doi.org/10.1094/PHYTO.2000.90.11.1224
Gehlot, L. & Prajapat, A. K. (2021). Seasonal incidence of insect pests
on mungbean (Vigna radiata)
in correlation with meteorological data. Agricultural
Science Digest-A Research Journal, 41(spl), 199-202. https://doi.org/10.18805/ag.D-5222
Gross, Y. & Kigel, J. (1994). Differential
sensitivity to high temperature of stages in the reproductive development of
common bean (Phaseolus vulgaris L.). Field Crops Research, 36(3),
201-212. https://doi.org/10.1016/0378-4290(94)90112-0
Gutiérrez-Sánchez,
Á., Cobos, A., López-Herranz, M., Canto, T., & Pagán, I. (2023). Environmental conditions modulate plant virus vertical transmission and survival of infected seeds.
Phytopathology, 113 (9), 1773-1787. https://doi.org/10.1094/PHYTO-11-22-0448-V
Ibarra-Perez,
F. J., Tosquy-Valle, O. H., Rodríguez-Rodríguez, J.
R., Villar-Sánchez, B., López-Salinas, E. y Anaya-López, J. L. (2022). Rubí:
nueva variedad mejorada de frijol negro para las áreas tropicales de Veracruz y
Chiapas. Revista Mexicana de Ciencias Agrícolas, 13(3), 577-585. https://doi.org/10.29312/remexca.v13i3.2227
IPPC,
International Plant Protection
Convention (2021). Scientific
review of the impact of
climate change on plant pests
– A global challenge to prevent and mitigate plant pest risks
in agriculture, forestry and ecosystems. Rome. FAO on behalf of the IPPC Secretariat. https://doi.org/10.4060/cb4769en
Jacinto-Hernández,
C., Coria-Peña, M., Contreras-Santos, G., Martínez-López, L., Zapata-Martelo,
E. y Ayala-Carrillo, M. R. (2019). Azúcares totales y proteína en frijol nativo
de la región Triqui Alta, Oaxaca. Revista Mexicana de Ciencias Agrícolas,
10(7), 1667-1674. https://doi.org/10.29312/remexca.v10i7.2114
Jeger, M., Hamelin, F., & Cunniffe, N. (2023).
Emerging themes and approaches in plant virus epidemiology. Phytopathology, 113(9), 1630-1646. https://doi.org/10.1094/PHYTO-10-22-0378-V
Jiménez-Hernández,
Y., Montero-Tavera, V., Anaya-López, J. L., Jiménez-Galindo, J. C.,
Herrera-Hernández, G., Guerrero-Aguilar, B. Z. y Acosta-Gallegos,
J. A. (2018). Salinas: nueva variedad de frijol pinto para áreas de temporal de
Guanajuato. Revista Mexicana de Ciencias Agrícolas, 9(6), 1295-1301. https://doi.org/10.29312/remexca.v9i6.1589
Lamaoui, M., Jemo, M.,
Datla, R., & Bekkaoui,
F. (2018). Heat and drought stresses in crops and
approaches for their mitigation. Frontiers in Chemistry, 6, 26. https://doi.org/10.3389/fchem.2018.00026
Lehmann, P., Ammunét, T., Barton, M., Battisti, A.,
Eigenbrode, S. D., Jepsen, J. U., Kalinkat, G., Neuvonen, S., Niemelä, P.,
Terblanche, J. S., Økland, B., & Björkman, C. (2020). Complex responses of
global insect pests to climate warming.
Frontiers in Ecology
and the Environment,
18(3), 141-150. https://doi.org/10.1002/fee.2160
Lone, A. A., Khan, M. N., Gul, A., Dar, Z. A., Iqbal, A. M., Lone, B. A., Ahangar, A., Ur-Rasool, F.,
Habib-Khan, M., Ali, G., Nisar, F., & Fayaz, A. (2021). Common beans and
abiotic stress challenges. Current Journal of Applied Science and
Technology, 40(14), 41-53. http://www.sdiarticle4.com/review-history/69745
López-Salinas,
E., Becerra-Leonor, E. N., Acosta-Gallegos, J. A. y
Villar-Sanchez, B. (1993). Variedades de frijol
tolerantes al virus del mosaico dorado para el trópico de México. Agricultura
Técnica en México, 19(2), 99-109.
Martínez-Marrero,
N., Avalos-Calleros, J. A., Chiquito-Almanza, E., Acosta-Gallegos,
J. A., Ambriz-Granados, S., Anaya-López, J. L., & Argüello-Astorga, G. R.
(2020). A new begomovirus isolated
from a potyvirus-infected bean plant causes asymptomatic infections in bean and N. benthamiana. Archives
of Virology, 165(7),
1659-1665. https://doi.org/10.1007/s00705-020-04646-y
Medina-García,
G., Ruiz-Corral, J. A., Rodríguez-Moreno, V. M., Soria-Ruiz, J., Díaz-Padilla,
G. y Zarazúa-Villaseñor, P. (2016). Efecto del cambio climático en el potencial
productivo del frijol en México. Revista
Mexicana de Ciencias Agrícolas, 7(SPE13), 2465-2474. https://doi.org/10.29312/remexca.v0i13.461
Morales,
F. J. & Anderson, P. K. (2001). The emergence and
dissemination of whitefly-transmitted geminiviruses in Latin America. Archives of Virology, 146(3),
415-441. https://doi.org/10.1007/s007050170153
Morales,
F. J. y Castaño, J. M. (2008). Enfermedades virales del frijol común en América
Latina. Publicación No. 364. Centro Internacional de Agricultura tropical
(CIAT), Cali, Colombia. [En línea]. Disponible en: http://ciat-library.ciat.cgiar.org/Articulos_Ciat/Digital/SB327.E56_C.3_Enfermedades_Virales_del_Fr%C3%ADjol_Com%C3%BAn_en_Am%C3%A9rica_Latina.pdf
Fecha de consulta: 5 de septiembre de 2025.
Morales,
F. J. & Niessen, I. 1988. Comparative responses of selected Phaseolus
vulgaris germplasm inoculated artificially and naturally with bean golden mosaic
virus. Plant Disease, 72(12), 1020-1023.
Moreno, A. B. & López-Moya, J. J. (2020). When viruses play team sports: Mixed infections in plants. Phytopathology, 110(1), 29-48. https://doi.org/10.1094/PHYTO-07-19-0250-FI
Prado-García,
A. A., Acosta-Gallegos, J. A., Montero-Tavera, V.,
Yáñez-López, R., Ramírez-Pimentel, J. G., & Aguirre-Mancilla, C. L. (2025).
Identification of common bean genotypes tolerant to the
combined stress of terminal drought and high temperature conditions. Agronomy,
15(7), 1624; https://doi.org/10.3390/agronomy15071624
Rainey K. M. & Griffiths P. D. (2005). Differential
response of common bean genotypes to high temperature. Journal of the
American Society for Horticultural Science, 130(1), 18-23. https://doi.org/10.21273/JASHS.130.1.18
Reddy, P. P. (2018). Emerging crop pest problems:
redefining management strategies. [En línea]. Disponible en:
https://www.scientificpubonline.com/bookdetail/emerging-crop-pest-problems-redefining-management-strategies/9789386652249/0.
Fecha de consulta: 5 de febrero de 2024.
Rodríguez-Licea,
G., García-Salazar, J. A., Rebollar-Rebollar, S. y Cruz-Contreras, A. C.
(2010). Preferencias del consumidor de frijol (Phaseolus
vulgaris L.) en México: factores y
características que influyen en la decisión de compra diferenciada por tipo y
variedad. Paradigma Económico, 2(1), 121-145.
Rose,
T., Lowe, C., Miret, J. A., Walpole,
H., Halsey, K., Venter, E., Urban, M. O., Buendía, H. F., Kurup,
S., O’Sullivan, D. M., Beebe,
S., & Heuer, S. (2023). High temperature tolerance in a novel, high-quality phaseolus vulgaris
breeding line is due to maintenance of pollen viability and successful
germination on the stigma. Plants, 12(13),
2491. https://doi.org/10.3390/plants12132491
Sánchez-Castro,
A., Miranda-Cabrera, I., Quiñones-Pantoja, M. L., Piñol, B. E. y Fernández-Argudín, B. M. (2016). Saltahojas
(Typhlocybinae) y su relación con los síntomas
de enfermedades en un campo de frijol (Phaseolus
vulgaris L.). Revista de Protección Vegetal,
31(3), 153-158.
Sastry, K. S. (2013). Mechanism
of seed transmission.
In K. S. Sastry (Ed.), Seed-borne
plant virus diseases
(pp. 327). Springer Science & Business Media.
Sharma,
M., Sharma, A., & Gupta, S. K. (2020). Climate change and plant diseases. Agricultural Research Journal, 57(1), 1-6.
https://doi.org/10.5958/2395-146X.2020.00021.6
SIAP,
Servicio de Información Agroalimentaria y Pesquera (2025a). Anuario Estadístico
de la Producción Agrícola. [En línea]. Disponible en:
https://nube.agricultura.gob.mx/cierre_agricola/. Fecha de consulta: 2 de julio
de 2025.
SIAP,
Servicio de Información Agroalimentaria y Pesquera (2025b). Anuario Estadístico
de la Producción Agrícola. [En línea]. Disponible en:
https://nube.agricultura.gob.mx/avance_agricola/. Fecha de consulta: 2 de julio
de 2025.
Singhal, P., Nabi, S.
U., Yadav, M. K., & Dubey,
A. (2021). Mixed infection of plant viruses:
Diagnostics, interactions and impact on host. Journal of Plant Diseases and
Protection, 128(2), 353-368. https://doi.org/10.1007/s41348-020-00384-0
Skendžić, S., Zovko, M., Živković, I. P., Lešić, V.,
& Lemić, D. (2021). The impact of climate
change on agricultural insect pests. Insects, 12(5),
440. https://doi.org/10.3390/insects12050440
SMN-CONAGUA,
Servicio Meteorológico Nacional / Comisión
Nacional del Agua (2024). Reporte del Clima en México. Mayo 2024. [En
línea]. Disponible en: https://smn.conagua.gob.mx/tools/DATA/Climatolog%C3%ADa/Diagn%C3%B3stico%20Atmosf%C3%A9rico/Reporte%20del%20Clima%20en%20M%C3%A9xico/RC-Mayo24.pdf.
Fecha de consulta: 3 de febrero de 2024.
Soler-Garzón,
A., McClean, P. E., & Miklas,
P. N. (2021a). Genome-wide association mapping of bc-1
and bc-u reveals candidate genes and new adjustments to the
host-pathogen interaction for resistance to bean common mosaic necrosis virus
in common bean. Frontiers in Plant Science, 12, 699569. https://doi.org/10.3389/fpls.2021.699569
Soler-Garzón, A., McClean, P. E., & Miklas, P. N.
(2021b). Coding mutations in vacuolar protein-sorting 4 AAA+ ATPase endosomal
sorting complexes required for transport protein homologs underlie bc-2 and
new bc-4 gene conferring resistance to bean common mosaic virus in
common bean. Frontiers in Plant Science, 12,
769247. https://doi.org/10.3389/fpls.2021.769247
Suárez,
J. C., Polanía, J. A., Contreras, A. T., Rodríguez, L., Machado, L., Ordoñez,
C., Beebe, S., & Rao, I. M. (2020). Adaptation of common bean lines to high temperature conditions: genotypic
differences in phenological and agronomic performance. Euphytica, 216(2), 28. https://doi.org/10.1007/s10681-020-2565-4
Subedi, B., Poudel,
A., & Aryal, S. (2023). The
impact of climate change on insect pest biology and ecology: Implications for
pest management strategies, crop production, and food security. Journal of
Agriculture and Food Research, 14; 100733. https://doi.org/10.1016/j.jafr.2023.100733
Tene, T. M., Sari, H., Canci, H., Maaruf, A., Eker, T.,
& Toker, C. (2023). Traits related to heat
stress in Phaseolus species.
Agriculture, 13(5), Article
953. https://doi.org/10.3390/agriculture13050953
Tosquy-Valle, O. H., Ibarra-Pérez, F. J.,
Acosta-Gallegos, J. A., Esqueda-Esquivel, V. A. y
Anaya-López, J. L. (2025). Rincón Grande: variedad de frijol negro para
Veracruz y Chiapas. Revista Mexicana de Ciencias Agrícolas, 16(3),
e3646. https://doi.org/10.29312/remexca.v16i3.3646
Trebicki, P. (2020). Climate
change and plant virus epidemiology. Virus
Research, 286, 198059. https://doi.org/10.1016/j.virusres.2020.198059
Tsai, W. A., Brosnan, C. A., Mitter, N., & Dietzgen,
R. G. (2022). Perspectives on plant virus diseases in a climate change scenario
of elevated temperatures. Stress Biology, 2(1), 37. https://doi.org/10.1007/s44154-022-00058-x
Vargas, Y., Mayor-Duran, V. M., Buendia, H. F.,
Ruiz-Guzman, H., & Raatz, B. (2021). Physiological and genetic
characterization of heat stress effects in a common bean RIL population. PLoS
One, 16(4), Article e0249859. https://doi:10.1371/journal.pone.0249859
Verhoeven, A., Kloth, K. J., Kupczok, A., Oymans, G. H.,
Damen, J., Rijnsburger, K., Jiang, Z., Deelen, C., Sasidharan, R., van-Zanten,
M., & van-der-Vlugt, R. A. A. (2023). Arabidopsis latent virus 1, a
comovirus widely spread in Arabidopsis thaliana collections. New Phytologist, 237, 1146-1153. https://doi.org/10.1111/nph.18466
Wang, L. & Ren, W. (2025). Drought in agriculture and
climate-smart mitigation strategies. Cell Reports Sustainability, 2(6),
1-9. https://doi.org/10.1016/j.crsus.2025.100386
Weaver, M. L., Timm, H., Silbernagel, M. J., & Burke,
D. W. (1985). Pollen staining and high-tem-perature tolerance of bean. Journal of
the American Society for Horticultural Science, 110(6),
797-799. https://doi.org/10.21273/JASHS.110.6.797
WMO, World Meteorological
Organization (2024). Global Annual to Decadal Climate Update Target years: 2024
and 2024-2028. [En línea]. Disponible en:
https://library.wmo.int/records/item/68910wmo-global-annual-to-decadal-climate-update.
Fecha de consulta: 3 de febrero de 2024.