Influencia del origen del inóculo sobre la
producción de biohidrógeno
Influence of the inoculum source on the
biohydrogen production
Pedro Vera-Toledo1*,
Iván Moreno-Andrade2, Carlos M. García-Lara1
*Autor para correspondencia: caachis1@hotmail.com/ Fecha de recepción:17 de
diciembre de 2014/ Fecha de aceptación: 8 de octubre de 2015
1Universidad de Ciencias y Artes de Chiapas. Facultad
de Ingeniería, Escuela de Ingeniería Ambiental, libramiento Norte-Poniente
núm. 1150, col. Caleras Maciel, Tuxtla Gutérrez, Chiapas, México, C.P. 29000. 2Universidad
Nacional Autónoma de México. Laboratorio de Investigación en Procesos Avanzados
de Tratamiento de Aguas del Instituto de Ingeniería, Blvd. Juriquilla núm.
3001, Juriquilla, Querétaro, México, C.P. 76230.
RESUMEN
El biohidrógeno se considera el más prometedor de los biocombustibles por
generar solo agua como residuo de su combustión. En este trabajo se compararon
dos inóculos para la producción de biohidrógeno; el primero proveniente de la
planta de tratamiento de una industria cervecera (Inóculo A) y el segundo
de una planta de tratamiento de aguas residuales domésticas (Inóculo B).
En ambos casos, para la selección de microorganismos productores de
biohidrógeno se empleó un pretratamiento, consistente en choque térmico por 24
h a 104 °C de temperatura, seguido de una trituración hasta alcanzar la
consistencia de polvo. La producción de biohidrógeno acumulado se ajustó
al modelo de Gompertz, demostrando que a pesar de que se operó con un sustrato
consistente de solución de glucosa al 5 %, enriquecido con medio mineral,
agitación 15.71 rad/s y temperatura de 35 ºC, el tiempo de latencia y la
productividad fueron distintos. Los reactores del Inóculo A generaron un
acumulado de 128.27 mL de biohidrógeno, 12 veces mayor que los del Inóculo
B (9.11 mL), con productividades de 85.52 mL y 6.07 mL de H2/Lreactor/d
respectivamente, lo que se atribuye a las cantidades de microorganismos
presentes en los inóculos comparados. La concentración del biohidrógeno
varió desde 0 % hasta 72.42 % para el Inóculo A y de 0 % a unos 29.49 %
para el Inóculo B. El Inóculo A mostró alto potencial para la producción
de biohidrógeno.
PALABRAS CLAVE: biohidrógeno; inóculo; pretratamiento.
ABSTRACT
Biohydrogen
is considered the most promising biofuel as it generates only water as waste
combustion. In this work, two inocula for biohydrogen production were compared,
one from the treatment plant of a brewery (Inoculum A), and the other from a
treatment plant of domestic residual waters (Inoculum B). In both cases, for
selecting biohydrogen producing microorganisms, a pretreatment consisting of
heat shock for 24 h at 104 ° C temperature, followed by crushing
to reach the consistency of poder was used. The accumulated biohydrogen
production was adjusted to the Gompertz model, showing that despite operating
with a substrate which consisted of a 5 % glucose solution, enriched with
mineral medium, stirring 15.71 rad/s at 35 °C, the latency period and
productivity differed. The Inoculum A reactors generated a cumulative
biohydrogen of 128.27 mL, 12 times higher than tho se inoculated with Inoculum
B (9.11 mL), with productivities of 85.52 mL and 6.07 mL of H2/Lreactor/d
respectively. This is attributed to the quantities of microorganisms present in
the inocula compared. Biohydrogen concentration varied from 0 % to 72.42 % for
the Inoculum A, and from 0 % to about 29.49 % for Inoculum B. The inoculum A
strain showed high potential for biohydrogen production.
KEYWORDS: biohydrogen; inocula; pretreatments.
INTRODUCCIÓN
Los combustibles fósiles siguen siendo una importante fuente de energía a
escala global, a pesar de que su disponibilidad se encuentra limitada y de los
efectos adversos causados al medio ambiente por su explotación y uso excesivo.
Actualmente se busca desarrollar fuentes alternativas de energía para resolver
estas problemáticas. Una posibilidad alentadora para suplir a los
combustibles convencionales son los biocombustibles: biodiésel, bioetanol,
biogás y biohidrógeno. Estas fuentes de energía, deben cumplir con tres
requisitos: respeto al medio ambiente tanto en su generación como en su uso, no
afectar la seguridad alimentaria y que sean económicamente factibles (Hill y
col., 2006).
De los cuatro biocombustibles, el biohidrógeno es el único que en su
combustión genera como residuos únicamente agua, los restantes aportan ciertas
cantidades de gases de efecto invernadero, por ello no cumplen con el primer
requisito, y en algunos casos, dependiendo el sustrato utilizado, tampoco
cumplirían el segundo. De acuerdo con Han y Shin (2004), para garantizar los
requisitos ideales de un biocombustible, en la generación biológica de
hidrógeno, se deben utilizar como sustrato materiales residuales de bajo costo.
Entre estos sustratos se pueden mencionar: la fracción orgánica
de residuos sólidos, el agua residual u otros residuos orgánicos, como por
ejemplo de las agroindustrias e industrias alimenticias como: láctea, almazara,
panadera, levadura de cerveza (Karapinar y Kargi, 2006), jugos, néctares, conservas
de frutas y verduras, azúcar, entre otros.
En la generación de biohidrógeno, existe una serie de variables que
intervienen en el proceso, que aún no se sabe de manera clara cómo afectan en
la velocidad y la cantidad de producción, pero que en algunos casos la pueden
inhibir totalmente (Valdez-Vazquez y Poggi-Varaldo, 2009). Estos parámetros se
deben seguir con especial atención a fin de poner en práctica las técnicas de
colección y recuperación del biohidrógeno de los procesos aplicados. Las
variables que inciden en la generación de biohidrógeno son: la ruta
metabólica que se decida utilizar: fermentación obscura, foto fermentación
o ambas (Levin y col., 2004), los rangos de las
variables termodinámicas: temperatura (Wang y Wan, 2008) y presión
(Abreu y col., 2012) a la que es sometido el sistema, el tipo de reactor o
equipo utilizado: continuo, semi-continuo, lotes, agitado o no, el tiempo de
retención hidráulica, las características y tipo de sustrato: contenido de
humedad, sólidos totales, fijos y volátiles, contenido de nutrientes,
proteínas, lípidos, carbohidratos, la demanda química de oxígeno, la capacidad
de amortiguamiento del sistema, que guarda una relación estrecha con la
naturaleza del sustrato, el tamaño medio de la partícula, entre otros
(Antonopoulou y col., 2008), el pH al que se decida mantener el proceso
(Yogananda y col., 2015) y el uso de inóculo (Ren y col., 2008).
El uso de inóculo en la producción de biohidrógeno es un factor que a su
vez representa otra serie de variables, tales como: procedencia u origen,
características físicas, químicas y biológicas (comunidades microbianas), el
uso de sales minerales o nutrientes y el pretratamiento que reciba
(Chinellato y col., 2013; Gadhe y col., 2013).
El pretratamiento es de importancia en los resultados esperados, ya que
reduce los tiempos de aclimatación de las bacterias seleccionadas y
aumenta la producción de biohidrógeno por la eliminación de las arqueas (Ren y
col., 2008).
Se ha utilizado una gama de diversos inóculos incluyendo: estiércol de
diversos animales, como vacas (Fan y col., 2006), pandas (Xing y col.,
2010) y búfalos (Nagaiah y col., 2012); o tierra (Logan, 2004), composta
(Yokoyama y col., 2007), rumen de bovinos y lodos de plantas de tratamiento de
agua residual (PTAR) (Chenlin y Fang, 2007). Entre ellos, destaca el último por
su uso generalizado. En lo que se refiere a los pretratamientos se
identifican por lo menos cuatro que se usan solos o combinados: choque
térmico, adición de químicos, sonicación y aireación. En el choque térmico, se
calienta el inóculo a temperaturas que rondan en los 100 ºC (Valdez-Vazquez y
Poggi-Varaldo, 2009), por rangos de tiempos que van desde los 15 min hasta las
24 h.
La adición de químicos ha demostrado no ser una buena opción debido a
su costo y a los posibles residuos que pueden permanecer en el medio o
sólidos gastados cuando se utiliza biomasa (Oh y col., 2003). Por lo anterior,
sustancias químicas como 2-bromoetanosulfonato de sodio (BES), fluoroacetato,
cloroformo y ácidos inorgánicos no pueden ser utilizadas a gran escala (Oh y
col., 2003), además que se reporta la existencia de metano con la utilización
de BES (Zahedi y col., 2011).
La sonicación persigue, como los otros pretratamientos, suprimir el
crecimiento de los microorganismos metanogénicos y enriquecer los productores
de biohidrógeno. Sin embargo, uno de los principales problemas son los costos
de capital y de operación de las unidades de ultrasonido. El costo puede
subir o bajar al madurar la tecnología. Del mismo modo, los datos de
rendimiento a largo plazo, de los sistemas de ultrasonidos de gran escala, son
todavía limitados, lo que desalienta a los ingenieros de diseño a recomendarlos
(Elbeshbishy y col., 2011a).
En el caso de la aireación, se ha reportado que al aplicar un
tratamiento de aireación constante durante 30 d, puede inhibir la
actividad metanogénica (Wei y col., 2011). Sin embargo, su
principal desventaja es el tiempo de preparación del inóculo.
El pretratamiento térmico permite recortar el tiempo de preparación,
costos de proceso, operaciones tecnológicas y además garantiza no generar
organismos metanogénicos. En este caso, una de las metodologías reportadas es
realizar un choque térmico a 104 ºC por 24 h, de acuerdo con Buitrón y Carvajal
(2010).
El objetivo de este trabajo fue establecer si el pretratamiento térmico
permite obtener inóculos productores de biohidrógeno a partir de plantas de
tratamiento de aguas residuales.
MATERIALES Y MÉTODOS
Origen de los lodos utilizados como inóculo y su pretratamiento
Se utilizaron dos inóculos de diferentes orígenes, a los que se
realizó análisis de humedad, sólidos totales, fijos y volátiles de acuerdo con
los Métodos estándar (APHA, 2005). El primer inóculo fue obtenido de una
planta de tratamiento de aguas residuales (PTAR) de una industria cervecera
(Inóculo A). El segundo inóculo (Inóculo B) fue obtenido de una PTAR doméstica.
Ambos inóculos fueron pretratados térmicamente en una estufa (Termo Scientific,
Waltham, MA USA), durante 24 h, a 104 ± 2 ºC (Buitron y Carbajal, 2010).
Posteriormente, se trituraron hasta alcanzar la consistencia de talco.
Experimento
Se emplearon como reactores botellas serológicas con capacidad de 160 mL,
con un volumen útil de 100 mL y un espacio de cabeza de 60 mL, con una repetición
para cada inóculo. Como sustrato, se empleó una solución de glucosa al 5
% enriquecida, con medio mineral, adaptado de Mizuno y col. (2000) (cada
litro de solución: 0.4 mg MnCl2•4H2O, 20 mg MgCl2•6H2O,
20 mg FeSO4•7H2O, 2 mg CoCl2•6H2O,
2 mg Na2MoO4•2H2O, 2 mg H3BO4, 2 mg
NiCl2•6H2O and 2 mg ZnCl2) y 0.3 g de
inóculo pretratado. Una vez que se adicionó la solución
de glucosa enriquecida e inóculo, se desplazó el aire del espacio de
cabeza con nitrógeno, para evitar contaminación por oxígeno, se sellaron y
colocaron en una incubadora orbital marca Wisd, Laboratory Instruments Orbital
Motion WIS-30 (witeg Labortechnik GmbH, Wertheim Deutschland),
en ausencia de luz a 35 °C y agitación de 15.71 rad/s, de acuerdo con
Yen-Hui y col. (2011). Diariamente, se midió la presión interna de cada una de
las botellas con una sonda marca Sper Scientific Wide Range Pressure Meter,
Pressure Transducer Model P 5100-2 bar (Scottsdale, AZ 85260, USA). Se tomaron
muestras de los gases generados, sin tratamiento alguno, con una jeringa
comercial equipada con una válvula de tres vías (muestra con volumen de 10 mL
de gas cada 3 d), analizando los gases producidos con la ayuda de un
cromatógrafo de gases marca SRI modelo 8610 C (Menlo Park, California, USA),
equipado con un detector de conductividad térmica y dos columnas capilares de
metal acero 2 - m embalado con Porapak TDS- 01 (60/80 mesh). La
temperatura operativa en el horno de columna y el detector fueron de 150 ºC. Se
utilizó nitrógeno como gas portador a una velocidad de flujo de 70 mL/min.
El experimento se realizó por 15 d, finalizando cuando la presión de
los reactores reportó valores de cero. La producción de biogás en los reactores
se midió cada 24 h y se comprobó la presión utilizando la sonda Sper
Scientific Wide Range Pressure Meter (Scottsdale, AZ 85260, USA). Estos
parámetros establecidos a temperatura constante se emplearon para
desarrollar la ecuación de estado más sencilla y manejable: la ecuación general
de los gases ideales, debido a los rangos relativamente bajos de presión
obtenidos y a que la energía interna de las moléculas del sistema depende
de la temperatura, que se mantuvo constante (35
ºC), para calcular los volúmenes (mL) de los gases correspondientes a
los días muestreados.
El análisis de los resultados se realizó en dos vertientes, la primera para
determinar qué inóculo reportó la mayor producción de biohidrógeno y
en una segunda instancia se utilizó un ajuste al modelo de Gompertz
(Martínez y col., 2010), que predice el comportamiento de la generación de
biohidrógeno, determinando el tiempo de latencia, máxima producción de
biohidrógeno y la máxima velocidad de producción de biohidrógeno.
RESULTADOS Y DISCUSIÓN
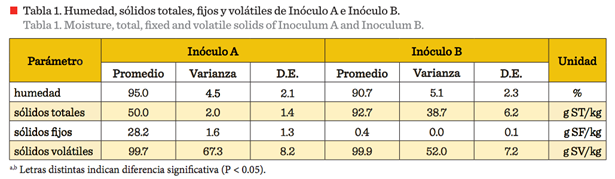
Las determinaciones de humedad, sólidos totales, fijos y volátiles, antes
del pretratamiento para ambos inóculos se muestran en la Tabla 1, donde tanto
los sólidos totales, como los fijos, presentan diferencias significativas (P
< 0.05), lo que se atribuye a que el Inóculo B se generó en casas habitación
con una carga sólida relativamente alta, compuesta de materiales inertes, tales
como fibras sintéticas y/o naturales, plásticos, arenas y huesos, entre otros.
Mientras que los lodos de la industria cervecera no presentan estos materiales,
ya que se generan en un proceso industrial que implica los cuidados necesarios
para el envasado de bebidas grado alimenticio. Es importante considerar que la
concentración de sólidos, particularmente los sólidos fijos, representa una
estimación de la cantidad de materia orgánica, incluyendo la biomasa (McCarty y
Parkin, 2001), y determina la densidad de los sólidos residuales (Zhu y Béland,
2006). Los microorganismos presentes en los lodos incluyen a las especies que
se especializan en la generación del biohidrógeno y que serán de utilidad
después de aplicar el pretratamiento (Elbeshbishy y col., 2011b).
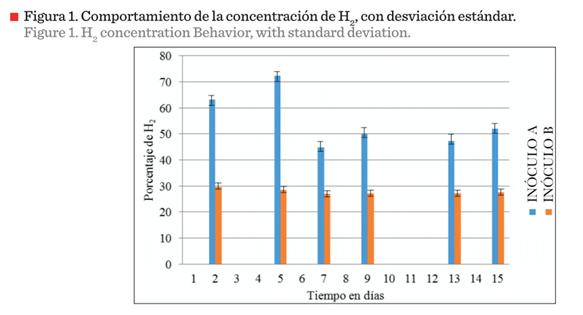
El análisis cromatográfico de los gases producidos mostró que el H2 y
el CO2 estaban presentes al utilizar ambos inóculos. En este
trabajo solo se analiza el H2. La concentración del H2 se
estableció mediante una curva de calibración, transformando el área bajo la
curva en porcentaje (Figura 1).
A partir de la concentración porcentual y la presión medida, se obtuvo el
volumen por componente. Con estos valores se calcularon, en volúmenes, el promedio
diario de biohidrógeno y su acumulado, incluyendo la productividad; esta última
en volumen de biohidrógeno en mL/L de reactor por día (mL H2/Lreactor/d)
alcanzado por cada experimento, así como la varianza y desviación estándar
(Tabla 2).
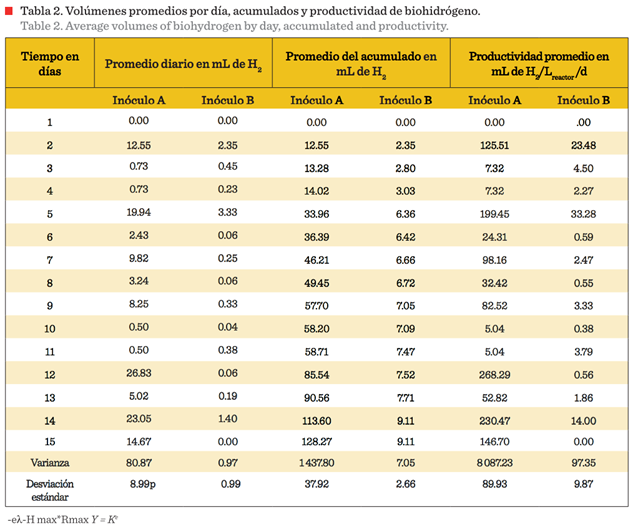
Se observaron máximos de producción en los días 2, 5, 12 y 14 de los
reactores inoculados con el Inóculo A (Tabla 2). El primer máximo coincide
con Faloye y col. (2014), quienes reportan que el crecimiento y la fermentación
progresó hasta alcanzar un máximo después de 2 d, y la concentración de
biohidrógeno aumentó gradualmente hasta 56.43 %, cercano a lo encontrado en
este estudio, sbre todo en el Inóculo A con 63.21 % (Figura 1); sin
embargo, en general, el rango abarcó desde 47.30 % hasta 72.43 %, no así en el
Inóculo B, en donde se registraron concentraciones porcentuales de biohidrógeno
bajas en comparación al Inóculo A, entre los 27.15 % (día 7), hasta 29.49 %
(día 2). Los días 2
y 5 coincidieron para ambos experimentos, no así los subsecuentes, que de acuerdo
a las eficiencias de conversión reportada para Clostridium intermedius varían
hasta en un 38 % al usar glucosa como sustrato (Vipin y Hemant, 2008).
La productividad promedio presentó una media diaria de 85.52 mL de H2/Lreactor/d
para el Inóculo A y de 6.07 mL de H2/Lreactor/d para el
Inóculo B; sin embargo, debido a las fluctuaciones diarias de
productividad se presentaron valores altos de varianza y desviación estándar,
particularmente para el Inóculo A (Tabla 2).
Con los datos del promedio del acumulado de producción se analizó el ajuste
al modelo matemático con la ecuación de Gompertz, debido a que ofrece detalles
que los modelos matemáticos más simples, como la recta o ecuaciones de segundo
grado no pueden. El modelo matemático de Gompertz modela el crecimiento
bacteriano; relacionado con la generación de biohidrógeno que se presenta a
continuación:
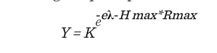
Las constantes expresadas en el modelo son:
λ = periodo de latencia,
Hmax = valor acumulado máximo, Rmax = la pendiente de la curva.
Los resultados de los ajustes sobre el promedio del acumulado de la
producción del biohidrógeno arrojaron que para el Inóculo A el ajuste fue de
0.967, en contra parte, el ajuste para el caso del Inóculo B fue de 0.929
(Figura 2). De acuerdo al modelo, las estimaciones de la generación de
biohidrógeno para el Inóculo A, son: máxima pro-ducción de biohidrógeno (Hmax)
de 1 687 mL, a los 160 d; pendiente (Rmax) de 8.54 y periodo de latencia de los
microorganismos de 35 d. Para el Inóculo B la máxima producción de biohidrógeno
(Hmax) se registró en 8.94 mL, a 20 d, pendiente (Rmax) de 10.97 y periodo de
latencia de los microorganismos a 3 d.
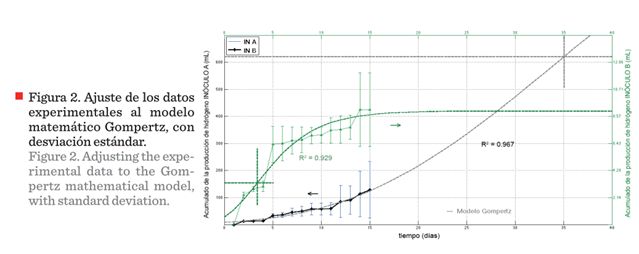
En la práctica, la producción de biohidrógeno disminuyó sensiblemente a los
15 d. Los resultados experimentales no mostraron una meseta clara. El
modelo predice tiempos de máxima producción a 20 d para el Inóculo B, poco
atractiva (8.94 mL de biohidrógeno) y de 160 d para el Inóculo A, con
1 687 mL de biohidrógeno, lo que significa una mayor rentabilidad. Sin embargo,
es poco factible para ser llevado a un proceso a escala real, porque
tiempos tan largos de operación representan reactores con grandes volúmenes, lo
que aumenta costos de construcción, pero sobretodo de operación. Ante esto, es
necesario el desarrollo de un modelo ajustado que tome en cuenta valores de
experimentos que no llegan a una fase asintótica de producción de hidrógeno.
Este proceso fermentativo es complejo, gobernado por diversas variables,
aun cuando se utilice el sustrato más sencillo: glucosa, que primero es
convertida en piruvato, que puede ser convertido a acetil - CoA y formiato, que
a su vez puede ser fácilmente convertido en hidrógeno y dióxido de carbono. La
acetil – CoA, finalmente se convierte en algunos metabolitos solubles, tales
como acetato, butirato y etanol, entre otros (Chenlin y Fang, 2007). En suma,
la solventogenesis implica la remodelación global del metabolismo para
redirigir recursos (carbono y la reducción de potencia), a partir de la
producción de biomasa en la producción disolvente (Alsaker yPapoutsakis, 2005);
ello se refleja en diferentes composiciones y volúmenes de biogás.
Adicionalmente, otra de las dificultades es conseguir una cantidad de biomasa o
la densidad de microorganismos que generen la misma producción de hidrógeno
(Zhu y Béland, 2006), sin que el proceso se inhiba. Werner y col. (2011),
demostraron que intentar controlar o mantener las poblaciones de fermentación
es más difícil, ya que, de acuerdo con Wittebolle y col. (2009), la uniformidad
de las comunidades iniciales favorece la funcionalidad bajo estrés selectivo, y
cuando las comunidades son desiguales, o hay dominación extrema por una o unas
pocas especies, su funcionamiento es menos resistente a la tensión ambiental,
lo que es perfectamente entendible, ya que las comunidades microbianas
provienen de un pretratamiento con choque térmico.
Las especies microbianas que han sido reportadas con la capacidad de
generar biohidrógeno son: Pseudomonas (Guo y col., 2008), Clostridium
saccharobut ylicum y Clostridium pasteurianum (Chang y
col., 2006), Ruminococcu ssp., Selenomonas ruminantium,
Clostridium cellobioparum, Citrobacter freundii, Acetobacterium woodii,
Trichomonas brockii y Syntrophomonas wolfei (Vi-pin y
Hemant, 2008), Clostridium butyricum y Citrobacter
freundii (Beckers y col., 2010), cultivos puros de Clostridium
butyricum CWBI1009, Clostridium pasteurianum DSM525, Clostridium
beijerinckii DSM1820 y Clostridium felsineum DSM749
(Masset y col., 2012). De acuerdo con Karapinar y Kargi (2006), las
investigaciones de diversidad microbiológica de lodos mesofílicos en la
producción de biohidrógeno, indican la presencia de especies de Clostridia en
un 64.6 %.
Específicamente, en estudios utilizando lodos que provenían de una
PTAR como inóculos, Ren y col. (2008) reportan en 8 de 15 pruebas de los 4
pretratamientos: ácido, básico, aireación y choque térmico, la presencia
de Clostridium longisporum, Clostridium vincentii y Clostridium
tyrobutyricum; únicamente en aireación no se encontró presencia de Clostridium.
Lo mismo reportan Cisneros-Pérez y col. (2015), Clostridium y Enterobacterias eran
dominantes, con una fuerte presencia del género Lactobacillus, sin
embargo, otro aspecto importante, es la densidad de microorganismos en el
inóculo, que mucho depende de las características y de la fuente de origen
del mismo (Zhao y col., 2012).
CONCLUSIONES
El empleo de un sustrato a partir de una solución al 5 % de glucosa, con
las mismas condiciones de proceso y pretratamiento permitió establecer que el
origen del inóculo tiene una marcada diferencia en la producción de
biohidrógeno. En el presente estudio, el inóculo proveniente de una PTAR de la
industria cervecera produjo un volumen 12 veces mayor de hidrógeno que el
inóculo proveniente de una PTAR doméstico. Es importante considerar la cantidad
de microorganismos presentes en el inóculo inicial y la concentración de
sólidos fijos inciales para incrementar la producción de biohidrógeno contenido
en el biogás.
AGRADECIMIENTOS
Agradecemos el apoyo financiero del proyecto CONACYT 24008.
REFERENCIAS
Abreu, A. A., Karakashev, D., Angelidaki, I., Sousa,
D. Z., and Alves, M. M. (2012). Biohydrogen production from arabinose and glucose
using extreme thermophilic anaerobic mixed cultures. Biotechnology for
Biofuels. 5(6): 1-12.
Alsaker, K. V. and Papoutsakis, E. T. (2005).
Transcriptional program of early sporulation and stationary-phase events in
Clostridium acetobutylicum. Journal of Bacteriology. 187(20):
7103–7118.
APHA, American Public Health Association (2005). Standard
Methods for the Examination of Water and Wastewater (Twenty edition),
APHA. Baltimore: Port city press. 216–220 Pp.
Antonopoulou, G., Hariklia, N. G., Ioannis, V. S. K.,
Angelopoulos, G. L., and Lyberatos, G. (2008). Biofuels generation from sweet
sorghum: Fermentative hydrogen production and anaerobic digestion of the
remaining biomass. Bioresource Technology. 99(1): 110–119.
Beckers, L., Hiligsmann, S., Hamilton, C., Masset, J.,
and Thonart, P. (2010). Fermentative hydrogen production by Clostridium
butyricum CWBI1009 and Citrobacter freundii CWBI952
in pure and mixed cultures. Biotechnologie, Agronomie, Société et
Environnemen. 14(2): 541-548.
Buitrón, G. and Carvajal C. (2010). Biohydrogen
production from Tequila vinasses in an anaerobic sequencing batch reactor:
Effect of initial substrate concentration, tem-perature and hydraulic retention
time. Bioresource Technology. 23(101): 9071–9077.
Chang, J. J., Chen, W. E., Shih, S. Y., Yu, S. J.,
Lay, J. J., Wen, F. S., and Huang, C. C. (2006). Molecular detection of the
clostridia in an anaerobic biohydrogen fermentation system by hydrogenase
mRNA-targeted reverse transcription PCR. Applied Microbial and Cell
Physiology. 70(5): 598–604.
Chinellato, G., Cavinato, C., Bolzonella, D., Heaven,
S., and Banks, C. J. (2013). Biohydrogen production from food waste in batch
and semi-continuous conditions: Evaluation of a two-phase approach with
digestate recirculation for pH control. International Journal of Hydrogen
Energy. 38(11): 4351-4360.
Chenlin, L. and Fang H. H. P. (2007). Fermentative
hydrogen production from wastewater and solid wastes by mixed cultures. Critical
Reviews in Environmental Science and Technology. 37(1): 1–39.
Cisneros-Pérez, C., Carrillo-Reyes, J., Celis, L. B.,
Alatriste-Mondragón, F., Etchebehere, C., and Razo-Flores, E. (2015). Inoculum
pretreatment promotes differences in hydrogen production performance in EGSB
reactors. International Journal of Hydrogen Energy. 40(19):
6329–6339.
Elbeshbishy, E., Hafez, H., and Nakhla, G. (2011a).
Viability of ultrasonication of food waste for hydrogen production. International
Journal of Hydrogen Energy. 37(3) : 2960–2964.
Elbeshbishy, E., Hafez, H., Ranjan-Dhar, B., and
Nakhla, G. (2011b). Single and combined effect of various
pretreatment methods for biohydrogen production from food
waste. International Journal of Hydrogen Energy. 36(17):
11379–11387.
Faloye, F. D., Gueguim-Kana, E. B., and Schmidt,
S. (2014). Optimization of biohydrogen inoculum development via a hybrid
pH and microwave treatment technique-Semi pilot scale production
assessment. International Journal of Hydrogen Energy. 39(11):
5607-5616.
Fan, Y. T., Zhang, Y. H., Zhang, S. F., Hou, H. W.,
and Ren, B. Z.
(2006).
Efficient Conversion of wheat straw wastes into biohydrogen gas by cow
dung compost, Bioresource Technology. 97(3): 500-505.
Gadhe, A., Sonawane, S. S., and Varma, M. N. (2013).
Optimization of conditions for hydrogen production from complex dairy
wastewater by anaerobic sludge using desirability function approach. International
Journal of Hydrogen Energy. 38(16): 6607–6617.
Guo, L., Li, X. M., Bo, X., Yang, Q., Zeng, G. M.,
Liao, D. X., and Liu, J. J. (2008). Impacts of sterilization, microwave
and ultrasonication pretreatment on hydrogen producing using waste
sludge. Bioresource Technology. 99(9): 3651-3658.
Han, S. K. and Shin, H. S. (2004). Biohydrogen
production by anaerobic fermentation of food waste. International
Journal of Hydrogen Energy. 29(6): 569–577.
Hill, J., Nelson, E., Tilman, D., Polasky, S., and
Tiffany, D. (2006). Environmental, economic, and energetic costs
and benefits of biodiesel and ethanol biofuels. Proceedings of the National Academy of Sciences of the United States of America. 103(30): 11206-11210.
Karapinar, I. and Karg, F. (2006). Biohydrogen
production from waste materials. Enzyme and microbial technology.
38(5): 569-582.
Levin, D. B., Pittb, L., and Loveb, M. (2004).
Biohydrogen production: prospects and limitations to practical
application. International Journal of Hydrogen Energy. 2(29):
173–185.
Logan, B. E. (2004). Peer reviewed: extracting
hydrogen and electricity from renewable resources. Environmental Science and Technology. 38(9): 160A-167A.
Martínez, C. A., Rodríguez, A. P., Jiménez, A. y
Manrique, C.
(2010). Descripción matemática de la función Gompertz aplicada al
crecimiento de animales. Reflexión,
Revista Médica Veterinaria Zootecnista. 57: 76-80.
Masset, J., Calusinska, M., Hamilton, C., Hiligsmann,
S., Joris, B., Wilmotte, A., and Thonart, P. (2012). Fermentative hydrogen
production from glucose and starch using pure strains and artificial
co-cultures of Clostridium spp. Biotechnology for Biofuels. 5(1): 20-35.
McCarty, P. L. and Parkin, G. F. (2001). Química
para ingeniería ambiental (Cuarta edición). Colombia: McGraw-Hill. 713 Pp.
Mizuno, O., Dinsdale, R., Hawkes, F. R., Hawkes, D.
L., and Noike, T. (2000). Enhacement of hydrogen production from glucose by
nitrogen gas sparging. Bioresource Technology. 73(1): 59-65.
Nagaiah, D., Srinivasa-Rao, P., Prakasham, R. S., Uma,
A., Radhika, K., Yoganand, B., and Umakanth, A. V. (2012). High Biomass Sorghum
as a Potential Raw Material for Biohydrogen Production: A Preliminary
Evaluation. Current Trends in Biotechnology and Pharmacy.
6(2):183-189.
Ren, N. Q., Guo, W. Q., Wang, X. J., Xiang, W. S.,
Liu, B. F., Wang, X. Z., …, and Chen, Z. B. (2008). Effects of different
pretreatment methods on fermentation types and dominant bacteria for hydrogen
production. International Journal of Hydrogen Energy. 16(33):
4318–4324.
Oh, S. E., Van, G. S., and Logan, B. E. (2003). The
relative effectiveness of pH control and heat treatment for enhancing
biohydrogen gas production. Environmental Science and Technology.
37(22): 5168-5190.
Valdez-Vazquez, I. and Poggi-Varaldo, H. M. (2009).
Hydrogen production by fermentative consortia. Renewable and
Sustainable Energy Reviews. 13(5): 1000-1013.
Vipin, C. K. and Hemant, J. P. (2008). Microbial
diversity and genomics in aid of bioenergy. Journal of Industrial
Microbiology and Biotechnology. 5(35): 403-419.
Wang, J. and Wan, W. (2008). Effect of temperature on
fermentative hydrogen production by mixed cultures. International
Journal of Hydrogen Energy. 33(20): 5392–5397.
Wei, H., Zhanqing, W., Hong, C., Xin, Y., and Yong, F.
L. (2011). Simultaneous Biohydrogen and Bioethanol Production from Anaerobic
Fermentation with Immobilized Sludge. Journal of Biomedicine and
Biotechnology. 2011: 1-5.
Werner, J. J., Knights, D., Garcia, M. L., Scalfone,
N. B., Smith, S., Yarasheski, K., …, and Angenent, L. T. (2011). Bacterial
community structures are unique and resilient in full-scale
bioenergy systems. Proceedings of the National Academy of
Sciences. 108(10): 4158– 4163.
Wittebolle, L., Marzorati, M., Clement, L., Balloi,
A., Daffonchio, D., Heylen, K., …, and Boon, N. (2009). Initial community
evenness favours functionality under selective stress. Nature.
458(7238): 623–626.
Xing, Y., Fan, Y. T., and Hou, H. W. (2010).
Production of Cellulose-Hydrogen from Corn Stalk based on Acid-enzyme Two-Stage
Pretreatment by Mixed Culture. The 6th International Symposium on Multiphase
Heat Mass Trasfer and Energy Conversion. American Institute of Physics.
1207(1): 1045-1048.
Yen-Hui, L., Mu-Ling, J., and Hsin-Jung, H. (2011).
Effects of temperature and initial pH on biohydrogen production from
food-processing wastewater using anaerobic mixed cultures. Biodegradation.
22(3): 551-563.
Yogananda, M., Yan, Z., Chenghong, G., Keke, X., and
Wun, J. N. (2015). The effect of pH on solubilization of organic matter and
microbial community structures in sludge fermentation. Bioresource
Technology. 10(190): 289–298.
Yokoyama, H., Waki, M., Ogino, A., Ohmori, H., and
Tanaka, Y. (2007). Hydrogen Fermentation properties of undiluted
cow dung. Journal of Biosciencie and Bioengineering. 104(1): 82-85.
Zahedi, S., Sales, D., Solera, R. y Romero, L. I.
(2011). Enriquecimiento de inóculo anaerobios en eubacterias productoras de
hidrógeno. Residuos. (123): 42-47.
Zhao, M. X., Yan, Q., Ruan, W. Q., Miao, H. F., Ren,
H. Y., and Xu, Y. (2012). A
Comparative Study of Sequential Hydrogen-methane and Independent Methane
Production from Kitchen Wastes. Energy Sources, Part A: Recovery,
Utilization, and Environmental Effects. 34(11): 1046-1054.
Zhu, H. and Béland, M. (2006). Evaluation of
alternative methods of preparing hydrogen producing seeds from digested
wastewater sludge. International Journal of Hydrogen Energy. 14(31): 1980–1988.