Desarrollo de una técnica
para la detección in vitro de la
presencia de antibióticos en muestras de hígado de res, cerdo y pollo
Development of an
in vitro antibiotics detection
technique in samples of beef liver, pork and chicken
Rebeca Monroy-Torres 1, 2*,
Benigno Linares-Segovia 1,
Xochitl Sofía Ramírez-Gómez 1
Autor para
correspondencia: rmonroy79@gmail.com/ Fecha de recepción: 12 de julio de 2014 /
Fecha de aceptación: 22 de mayo de 2015.
1Universidad de
Guanajuato. División de Ciencias de la Salud. Departamento de Medicina y
Nutrición. Laboratorio de Nutrición Ambiental y Seguridad Alimentaria. Torre de
Laboratorio del Departamento de Medicina y Nutrición de la División de Ciencias
de la Salud, 4° Piso, Blvd. Puente del Milenio 1001; Fraccionamiento del Predio
de San Carlos, León, Guanajuato, México, C.P. 37670. 2Observatorio
Universitario de Seguridad Alimentaria y Nutricional del Estado de Guanajuato,
Blvd. Paseo del Gigante No. 145, col. Pedregal del Gigante, León, Guanajuato,
México, C.P. 37296.
RESUMEN
El descubrimiento
de los antibióticos ha permitido salvar la vida de millones de personas, sin
embargo, su efectividad ha ido disminuyendo a la par que los microorganismos
van desarrollando resistencia debido a su exposición constante durante su aplicación
en el crecimiento de animales de abasto, por lo que se hace necesario contar
con técnicas de detección oportuna de su presencia en alimentos. Se realizó un
estudio preliminar, de corte transversal, en muestras de hígado de res, cerdo y
pollo para establecer la viabilidad de determinar la presencia de antibióticos
mediante la inhibición del crecimiento de una cepa de Escherichia coli ATCC25922,
utilizando el método de Kirby-Bauer. Se inocularon 15 cajas Petri conteniendo
agar Mueller Hinton (cinco para cada muestra de hígado: res, cerdo y pollo),
con la cepa E. Coli sensible a
antibióticos. En cada caja de agar se colocaron porciones de hígado de 5 mm de
diámetro, con 1 cm de distancia entre muestras. Las cajas se incubaron a 35 OC por 24 h y se
evaluó la formación de halos de inhibición. Se encontró que sólo una de las 15
muestras de hígado analizadas, correspondiente a hígado de res, presentó un
halo de inhibición mayor a 30 mm. Los resultados obtenidos indican la
viabilidad de usar esta técnica para la detección de la presencia de
antibióticos en productos cárnicos.
PALABRAS CLAVE: Antibióticos, Escherichia coli, hígado, efecto
inhibitorio.
ABSTRACT
With the discovery of antibiotics, millions of lives
have been saved, however, its effectiveness has been declining has been
declining at the same microorganisms are developing resistance because of their
constant exposure during application on the growth of animals for slaugther, so it is necessary to have techniques for the
early detection of their presence in food. A cross-sectional and preliminar study was conducted to stablish the feasibility
to determine the presence of antibiotics in samples of liver of beef, pork and
chicken by inhibiting the growing of the Escherichia coli ATCC25922 strain following the Kirby-Bauer
methodology. Fiftheen Petri plates (five for each
liver sample: beef, pork and poultry) containing the Mueller Hinton agar were
inoculated with the E. coli ATCC25922 strain
antibiotic sensitive. In each agar plate a portion of liver of 5 mm of diameter
were placed 1 cm away from each inoculum. The plates were incubated at 35 OC for 24 h and the presence of inhibition halos were
evaluated. It was found that only one of the fiftheen
liver samples analyzed, corresponding to a beef liver, showed a inhibition halo higher than 30 mm. The results obtained
indicated the feasibility of using this technique to detect the presence of
antibiotics in meat products.
KEYWORDS: Antibiotics, Escherichia coli, liver, inhibitory effect.
INTRODUCCIÓN
Desde su
introducción comercial, en la década de 1940, los antibióticos se han vuelto
esenciales en la medicina moderna para tratar enfermedades infecciosas con
prontitud y eficacia, disminuyendo los índices de morbimortalidad, salvando
millones de vidas. Sin embargo, su uso indiscriminado y sin control adecuado,
ha propiciado que algunas cepas bacterianas causantes de infección en el ser
humano y los animales desarrollen resistencia a los antibióticos, poniendo en
riesgo la salud de las personas (McManus, 1999; Witte, 1999). Se estima que
anualmente, en los Estados Unidos, por lo menos 2 millones de personas se infectan con bacterias
resistentes a los antibióticos, y que mueren más de 23 000 personas como
resultado directo de esas infecciones, lo que significa una alta tasa de
mortalidad (Medina y col., 2008; Centers for Disease, Control and Prevention,
2013). Las infecciones resistentes a los antibióticos pueden ocurrir en
cualquier lugar con una alta prevalencia para población general. Sin embargo,
las muertes relacionadas con la resistencia a los antibióticos ocurren
principalmente en hospitales, clínicas y casas hogar para adultos mayores
(Gorbach, 2001; D’Costa, 2011; Balkhair, 2014).
La producción
animal constituye la segunda causa en el uso intensivo de antibióticos y con
ello la promoción de su resistencia, después de los hospitales (Martínez,
2010). Los antibióticos se emplean como agentes antimicrobianos y promotores de
crecimiento, especialmente en cerdos y aves de corral. Se utilizan para el
tratamiento de infecciones de forma individual o colectiva, como tratamientos
profilácticos y metafilácticos para prevenir la propagación de infecciones de
animales enfermos a sanos en una misma unidad de producción, ya que la
producción industrial de ganado mantiene a un gran número de animales en
espacios comparativamente pequeños y los brotes de infecciones pueden
propagarse con facilidad (JECFA, 2000). También se emplean para promover el
crecimiento en dosis más bajas que para tratar enfermedades. Se considera que esta
exposición prolongada a bajas dosis de antibióticos genera mayor resistencia
que su uso en el tratamiento o la prevención de infecciones (McManus, 1999;
Gorbach, 2001). Se estima que existen dos factores principales que generan la
resistencia a los antibióticos: los genes transferibles de resistencia y la
presión selectiva sobre su uso. Entre los antibióticos más comúnmente
utilizados y agregados en el alimento de los animales, destacan: las
penicilinas, tetraciclinas, cefalosporinas, fluoroquinolonas, avoparcina y
virginiamicina (JECFA, 2000).
Existen estudios
que demuestran que el empleo de oxitetraciclina en la alimentación de pollos
favorece el desarrollo de microorganismos resistentes a tetraciclina. También
se demostró la transferencia de cepas de Escherichia coli resistente a la
tetraciclina de los pollos al personal de la granja. Otras cepas aisladas que
han desarrollado resistencia a antibióticos incluyen a Shigella y
Campylobacter sp. (Witte, 1999; Martínez, 2010). Se ha
reportado que un 20 % de las muestras de carne obtenida de supermercados estaba
contaminada con salmonella, y 84 % de estos aislamientos fueron resistentes al
menos a un antimicrobiano (Witte, 1999). En general, la incidencia de cepas
resistentes a fluoroquinolonas se ha incrementado con la introducción del uso
terapéutico de estos antibióticos en la alimentación animal (Witte, 1999). Si
bien, la resistencia de los microorganismos patógenos a los antibióticos va en
aumento por el uso en la alimentación de los animales de abasto, también se ve
influenciada por las malas prácticas clínicas en su uso por parte del ser
humano, principalmente por la falta de apego al tratamiento, debido al abandono
de la terapia al manifestarse efectos adversos, el costo del medicamento, o el
olvido al usarlos, entre otras, que llevan a la creación de cepas resistentes y
la transmisión de genes de resistencia (JECFA, 2000).
El estudio de la
sensibilidad bacteriana en humanos a los antibióticos es una de las funciones
más importantes de los laboratorios de microbiología clínica. El propósito es
dirigir la terapéutica una vez que el germen es conocido para su correcto
tratamiento, vigilar la aparición de nuevos mecanismos de resistencia y
detectar la diseminación epidémica de una cepa, tanto a nivel hospitalario como
comunitario (Cantón y col., 2000). Estos métodos pueden clasificarse en métodos
cuantitativos y cualitativos. Los métodos cuantitativos son aquellos
procedimientos que permiten determinar la concentración inhibitoria mínima y la
concentración bactericida mínima. Los métodos cualitativos, permiten establecer
si un microorganismo patógeno presenta resistencia a diferentes antibióticos,
usualmente sin buscar establecer dosis inhibitorias mínimas; el más
frecuentemente usado es el método de Kirby-Bauer, también denominado
antibiograma, y que consiste en la difusión en placa de una cepa aislada de un
paciente colocando discos que contienen diferentes antibióticos en la
superficie, y observando si se presentan halos de inhibición. Esta técnica ha
sido aprobada por el National Committee for Clinical Laboratory Standards
(NCCLS) y se desarrolló como un estándar para datos clínicos y de laboratorio
(Cantón y col., 2000; Ferraro, 2000).
En México existen
dos normas oficiales para la detección de antibióticos, la NOM-004-ZOO-1994 y
la NOM-032-ZOO-1996. La norma oficial mexicana NOM-004-ZOO-1994, establece las
bases para la detección y el control de residuos tóxicos, incluyendo los
antibióticos, en tejidos alimenticios primarios de origen animal y es aplicable
a la carne, grasa, hígado y riñón de bovinos, equinos, porcinos y ovinos,
provenientes de establecimientos de sacrificio ubicados en el país o de una
planta aprobada por la Secretaría de Agricultura y Recursos Hidráulicos, cuando
éstos sean de importación. Los métodos de detección descritos en esta norma son
cromatográficos. Por otra parte, la norma NOM-032-ZOO-1996, para la
determinación de antibióticos en hígado, músculo y riñón de bovinos, ovinos,
equinos, porcinos, aves, caprinos y cérvidos por la prueba de torunda y el
bioensayo, se basa en el principio del antibiograma y describe un método para
hacer estimaciones cuantitativas de resistencia a antibióticos. Esta prueba se
encuentra en desuso por ser costosa, debido a la cantidad de material requerido
en los bioensayos y el tiempo necesario para la detección. Actualmente se
mantiene como referencia la NOM-004-ZOO-1994, que también señala la posibilidad
de usar la prueba de torunda y el bioensayo para detección de antibióticos.
El hígado es el
órgano encargado del metabolismo de la mayoría de las sustancias tóxicas, en
este órgano se concentran altos niveles de antibióticos y de sus residuos. En
México, es frecuente el consumo de hígado por parte de la población, por ser
económico y accesible. Además de que en México se tienen hábitos alimenticios
que permiten aprovechar todos los tejidos de los animales, incluyendo la masa
muscular, las vísceras, la sangre y parte del téjido óseo (Medina, 2008). El
objetivo del presente trabajo fue desarrollar una técnica que permita detectar
la presencia de antibióticos in vitro, en muestras de
hígado de res, cerdo y pollo, mediante la modificación del método convencional
de sensibilidad por difusión en placa Kirby-Bauer, al reemplazar el uso de
sensidiscos por muestras de tejido de hígado y evaluando la presencia de un
halo inhibitorio en el crecimiento de la cepa Escherichia coli ATCC25922,
caracterizada por su sensibilidad a antibióticos.
MATERIALES Y MÉTODOS
Obtención
de la muestra
Se obtuvieron 5
muestras de hígado de res, 5 muestras de hígado de cerdo y 5 muestras de hígado
de pollo provenientes de diferentes carnicerías ubicadas en la ciudad de León,
Guanajuato, México, seleccionadas al azar por simple disponibilidad y acceso a
ellas. Las muestras adquiridas se introdujeron en hieleras cerradas, las cuales
contenían bolsas con gel refrigerante, que fueron previamente congeladas, lo
que permitió mantener las muestras a menos de 4 0C durante el
transporte al laboratorio de Microbiología de la Facultad de Medicina de la Universidad
de Guanajuato, en León, Guanajuato, México, en un periodo no mayor de 3 h, en
horario matutino. Las muestras se refrigeraron hasta su análisis en un plazo no
mayor a 24 h.
Presencia de antibióticos en muestras de hígado
Se utilizó una
modificación del método de sensibilidad por difusión en placa Kirby-Bauer.
Siguiendo los procedimientos del National Committee for Clinical Laboratory
Standards (NCCLS), y el procedimiento descrito por Ferraro (2000), se preparó
un inóculo con la cepa control de Escherichia coli ATCC25922, caracterizada
por su alta susceptibilidad antimicrobiana, tomando una asada de 5 μg, la cuál
se suspendió en 5 mL de solución salina estéril, ajustando visualmente a una
turbidez de 0.5 de Mc Farlan; se procedió a inocular la cepa con hisopo estéril
en una caja Petri, conteniendo medio de Mueller Hinton, preparado con pH de 7.2
a 7.4 (determinado a temperatura ambiente, con tiras indicadoras de pH rango
0-14 MERCK® 109535). Utilizando un sacabocado, se tomaron 5 mm
de diámetro de los diferentes hígados de res, pollo y cerdo, y se colocaron en
cajas con agar Mueller Hinton de 150 mm de diámetro; se incubaron a 35 OC por 24 h para
su posterior medición de los halos de inhibición.
Análisis estadístico
Los resultados se
analizaron mediante medidas de tendencia central y porcentaje.
RESULTADOS Y DISCUSIÓN
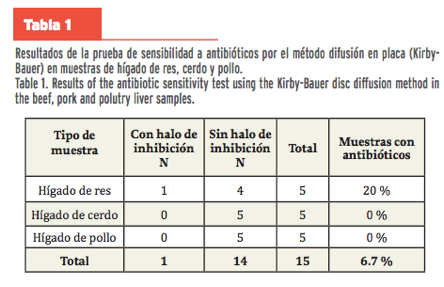
La cepa de Escherichia coli ATCC25922 creció
en todas las cajas Petri inoculadas, excepto en una muestra de hígado de res,
en la que se presentó un halo de inhibición mayor a 30.mm (Tabla1), que puede
ser un marcador de una probable presencia de algún tipo de antibiótico en la
muestra. Esto representa el 20 % de prevalencia de antibióticos en las muestras
de hígado de res y el 6.7 % para el total de muestras analizadas. Adicional a
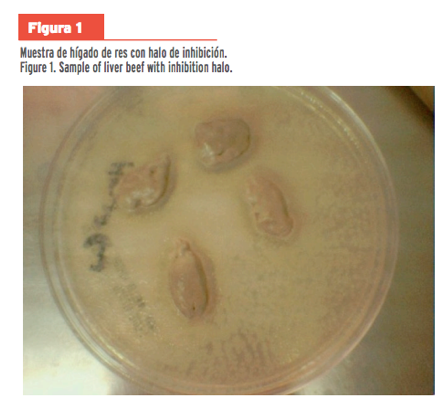
esta prueba confirmatoria, se observó la presencia de espacios vacíos,
separados de los halos, sin crecimiento, como se muestra en la Figura 1. El
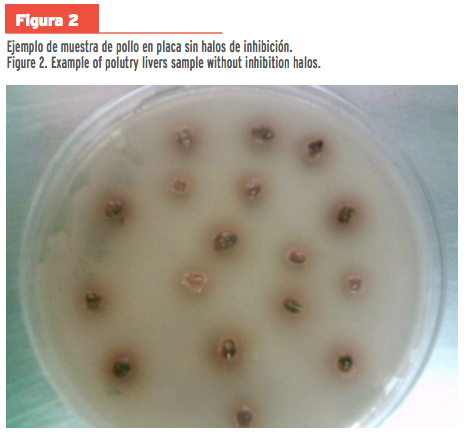
resto de las muestras no presentaron halos de inhibición (Figura 1; Figura 2).
En México, como
en cualquier otro país, el empleo indiscriminado de antibióticos para apoyar el
crecimiento de los animales de abasto y con ello la rentabilidad productiva,
conlleva riesgos para la salud, al favorecer el crecimiento de organismos
resistentes a antibióticos. El principal mecanismo de transferencia de la
resistencia a los antibióticos es por uso no terapéutico, que representa una
compleja vía de transmisión, ya que los consumidores estarán expuestos a
bacterias resistentes a través del consumo de productos de origen animal
(Bonnie, 2011; Chang y col., 2015). Estas sustancias pueden concentrarse
principalmente en órganos como son el hígado y el riñón. En este estudio
piloto, sólo se observó la presencia de un halo de inhibición en una de las 15
muestras analizadas, lo cual podría ser señal de poca presencia de
antibióticos. Aunque también podría ser resultado de una limitación en la
metodología desarrollada, ya que las muestras de hígado se colocaron en crudo,
enjuagadas en solución salina, de forma directa en el medio nutritivo, y no se
estableció si existía la presencia de otros microorganismos resistentes a
antibióticos, sin embargo, las características visuales de las colonias que
crecieron en los medios no sugieren la presencia de otro tipo de
microrganismos, diferentes a la cepa de estudio Escherichia coli ATCC25922. El
halo de inhibición encontrado en una muestra de hígado de res podría estar
siendo causado por la presencia de antibióticos u otros residuos con efecto
bactericida (Gorbach, 2001; López-Meza y col., 2015).
La concentración
de un antibiótico, expresada en una zona de inhibición mediante el método de
cultivo en placa, no puede ser calculada con precisión, por lo que requiere ser
confirmada y cuantificada con un posterior análisis químico (Medina y col.,
2008); por lo que será necesario mejorar y adaptar este método de análisis
propuesto, de manera que se pueda observar inhibición bacteriana aún en
muestras contaminadas. Esto pudiera requerir algún método de esterilización de
los productos por técnicas que no utilicen autoclave, para evitar la
destrucción del antibiótico.
La presencia de
antibióticos, en productos de origen animal, incrementa el riesgo de
desarrollar microorganismos resistentes a antibióticos, particularmente en
México, porque no existen suficientes estudios dirigidos hacia la detección de
antibióticos en alimentos. Sin embargo, la determinación de la sensibilidad a
antimicrobianos no implica sólo realizar un conjunto de técnicas y medir los
resultados. Es necesario saber interpretar los mismos y darles el significado
que realmente tienen (Cantón y col., 2000).
Los resultados
preliminares obtenidos en el presente estudio señalan la importancia de
formular estrategias para evaluar sistemáticamente la presencia de antibióticos
en alimentos, como uno de los factores determinantes de prevención en el
desarrollo de cepas microbianas con resistencia a antibióticos, así como para
mantener y actualizar la regulación para el uso de estas sustancias en animales
(CAC/RCP, 2005). Por ello, es relevante contar con herramientas que permitan
establecer la presencia de antibióticos en alimentos, lo cual en el presente
estudio se realiza a través de un modelo in vitro, del cual ya se
cuenta con estudios piloto.
CONCLUSIONES
La técnica
desarrollada en el presente estudio demostró ser adecuada para detectar la
presencia de antibiótico en muestras de hígado, mediante la inhibición in vitro del crecimiento
de la cepa de Escherichia
coli ATCC25922, sensible a antibióticos. Es necesario
mejorar la técnica desarrollada para establecer su nivel de sensibilidad y
descartar la presencia de falsos positivos debido a la contaminación de las
muestras por cepas resistentes a antibióticos.
AGRADECIMIENTOS
Al Dr. Alejandro
Macias, Jefe del Laboratorio de Microbiología Clínica, por sus aportaciones y
críticas, así como por permitir realizar el estudio en el Laboratorio de
Microbiología de la Facultad de Medicina de la Universidad de Guanajuato.
REFERENCIAS
Balkhair, A.,
Al-Farsi, Y. M., Al-Muharrmi, Z., Al-Rashdi, R., Al-Jabri, M., Neilson, F.,
Al-Adawi, S. S., El-Beeli, M., and Al-Adawi, S. (2014). Epidemiology
of Multi-Drug Resistant Organisms in a Teaching Hospital in Oman: A One-Year
Hospital-Based Study. The Scientific World Journal.
14: 1-6.
Bonnie, M. and Stuart, B. (2011). Food animals and antimicrobials:
impacts on human health. Clinical Microbiology Reviews. 4: 718–733.
Cantón, R., García, J.
E., Gómez,’L., Martínez., L., Rodríguez, C., Vila, J. y García, J. A. (2000).
Procedimientos en microbiología clínica. Métodos básicos para el estudio de
la sensibilidad a los antimicrobianos en recomendaciones de la Sociedad
Española de Enfermedades Infecciosas y Microbiología Clínica. En J. J.
Picazo (Ed.). [En línea]. Disponible en: http://www.seimc.org. Fecha de
consulta: 20 de junio de 2014.
CAC/RCP, Código de
Prácticas para Reducir al Mínimo y Contener la Resistencia a los
Antimicrobianos (2005). Código de prácticas para reducir mínimo y contener la
resistencia a los antimicrobianos. [En línea]. Disponible en:
http://www.codexalimentarius.net/download/standards/10213/CXP_061e.pdf. Fecha
de consulta: 15 de marzo de 2014.
Centers for Disease, Control and Prevention.
(2013). Antibiotic
Resistance Trends. [En línea]. Disponible en:
http://www.cdc.gov/drugresistance/threat-report-2013/pdf/ar-threats-2013-508.pdf.
Fecha de consulta: 30 de septiembre de 2014.
Chang, Q., Wang, W., Regev-Yochay,
G., Lipsitch, M., and Hanage,
W. (2015). Antibiotics in agriculture and the
risk to human health: how worried should we be? Evolutionary Applications.
8: 240–247.
D’Costa, V. M., King, C.
E., Kalan, L., Morar, M., Sung, W. W., Schwarz, C.,
Froese, D., Zazula, G., Calmels,
F., Debruyne, R., Golding, G. B., Poinar,
H. N., and Wright, G. D. (2011). Antibiotic resistance is ancient. Nature. 477: 457-461.
Ferraro, M. J. (2000).
National Committee for Clinical Laboratory Standards.
Methods for dilution antimicrobial susceptibility tests for bacteria that grow
aerobically: approved standard. National Committee for
Clinical Laboratory Standards, Wayne, PA, 36.
Gorbach, S. (2001). Antimicrobial use
in animal feed- Time to stop. New England. Journal
of Medicine. 345: 1202-1203.
JECFA Joint FAO/WHO Expert Committee on Food Additives (2000).
Evaluation of certain veterinary drug residues in food, WHO.
Technical Report Series. 893(1): 21-54.
López-Meza, J.
E., Ochoa-Zarzosa, A., Barboza-Corona, J.
E., and Bideshi, D. (2015). Antimicrobial Peptides:
Current and Potential Applications in Biomedical Therapies. BioMed Research International. [En línea]. Disponible en:
http://dx.doi.org/10.1155/2015/367243. Fecha de consulta: 29 de abril de 2015.
Martínez, A., Cruz,
M., Veranes, O., Carballo, M. E., Salgado, I. Olivares, S., Lázaro, L., y
Rodríguez, D. (2010). Resistencia a antibióticos y a metales pesados en
bacterias aisladas del río Almendares. Revista CENIC de Ciencias Biológicas.
41: 1-10.
McManus, P. S. (1999).
Uso de antibióticos en el control de enfermedades de las plantas. Enfermedades
Infeccionas y Microbiológicas. 19: 199-218.
Medina, M. S.,
Gonzalez, D. G., y Ramírez, A. (2008). Detección de residuos antimicrobianos en
tejidos comestibles y tetraciclina en hueso de cerdo. Revista de Salud
Animal. 30(2): 110-115.
NOM-004-ZOO-1994
(1994). Norma Oficial Mexicana. Secretaría de Agricultura y Recursos
Hidráulicos, Control de residuos tóxicos en carne, grasa, hígado y riñón de
bovinos, equinos, porcinos y ovinos. [En línea]. Disponible en:
http://www2.sag.gob.cl/Pecuaria/establecimientos_habilitados_exportar/normativa/mexico/NOM-004-ZOO-1994_control_residuos_carne_otros.pdf.
Fecha de consulta: 20 de julio de 2014.
NOM-032-ZOO-1996
(1996). Norma Oficial Mexicana. Determinación de antibióticos en hígado,
músculo y riñón de bovinos, ovinos, equinos, porcinos, aves, caprinos y
cérvidos por la prueba de torunda y por bioensayo. [En línea]. Disponible en:
http://legismex.mty.itesm.mx/normas/zoo/zoo032.pdf. Fecha de consulta: 21 de
noviembre de 2014.
Witte, W. (1999). Uso de antibióticos
en la producción animal y desarrollo de la resistencia en las infecciones
humanas. Enfermedades Infecciosas y Microbiológicas. 19:
83-86.