Evaluación
de levaduras nativas productoras de etanol presentes en el bagazo de caña de
azúcar
Evaluation of producing ethanol native
yeasts present in sugar cane bagasse
Adrián
González-Leos, José Alfredo Del Angel-Del Angel, José Luis González-Castillo,
Nadia Rodríguez-Durán,
Guadalupe Bustos-Vázquez*
*Autor para correspondencia: gbustos@uat.edu.mx/ Fecha
de recepción:13 de enero de 2016/ Fecha de aceptación: 17 de octubre de 2016
Universidad Autónoma de Tamaulipas, Unidad Académica
Multidisciplinaria Mante, Blvd. Enrique Cárdenas González núm. 1201, col.
Jardín, Ciudad Mante, Tamaulipas, México, C.P. 89840.
RESUMEN
La
hidrólisis química o enzimática del bagazo de caña de azúcar permite la obtención
de azúcares fermentables, utilizados en la producción biotecnológica de etanol,
mediante el empleo de levaduras comerciales o autóctonas obtenidas de
diferentes materiales lignocelulósicos. El objetivo de este trabajo fue valorar
la capacidad de producción de etanol de cepas de levaduras nativas, aisladas en
medio YPD e hidrolizado de bagazo de caña de azúcar, concentrado hasta un 75 %.
Utilizando como variables de estudio el tipo de cepa y el tiempo de proceso, se
realizó un análisis multifactorial (ANOVA) para su evaluación. Los resultados
obtenidos con la cepa seleccionada UAT-3, fueron para YP/S de 0.441 7 g/g y QP de 0.076 7 g/L·h a las 120 h. Las condiciones
de proceso utilizadas en el presente estudio permitieron aislar y seleccionar
cepas nativas de Sacharomyces cereviseae, con características
adecuadas para ser utilizadas en procesos biotecnológicos industriales de
producción de etanol, utilizando como sustrato residuos o subproductos
derivados de la industria azucarera como el bagazo de caña de azúcar.
PALABRAS CLAVE: levaduras nativas, etanol, bagazo de caña de azúcar, hidrolizado hemicelulósico.
ABSTRACT
The chemical or enzymatic hydrolysis of
sugarcane bagasse, allows the obtaining of fermentable sugars used in the
biotechnological production of ethanol by using commercial or native yeasts
obtained from different lignocellulosic materials. The purpose of this study
was to assess the production capacity of ethanol from a native yeast strain
isolated in YPD and hydrolyzed sugar cane bagasse concentrated up to 75 %.
Using as study variables the type of strain and processing time, a multivariate
analysis (ANOVA) was performed for its evaluation. The results achieved with
the selected strain UAT-3, were 0.441 7 g/g for YP/S and 0.076 7 g/L·h to 120 h for QP. The process conditions used in
the present study allowed to
isolate and select native strains of Sacharomyces cereviseae, with characteristics
suitable to be used in industrial biotechnological proceses
of ethanol production, using as substrate residues or by-products derived from
the sugar industry such as bagasse of sugar.
Keywords: native yeasts, ethanol,
sugar cane bagasse, hemicelulosic
hydrolyzate.
INTRODUCCIÓN
El desarrollo económico demanda un elevado
consumo de los diferentes recursos energéticos, por lo que se
pronostica un aumento en su costo y su probable escasez en el
mediano plazo. Un problema adicional es que los
combustibles fósiles han sido asociados con los
problemas de
contaminación actuales (Carreón-Rodríguez y col.,
2009; Saha y col., 2014). Ante esto, se hace necesario
encontrar soluciones a la demanda de combustible
con reducido impacto ambiental, por ejemplo, energía mareomotriz,
hidroeléctrica, geotérmica, solar, eólica y biocombustibles, como el bioetanol
obtenido a partir de materiales celulósicos (Suleiman,
2010; Saha y col., 2014).
Existe gran interés en aprovechar los materiales lignocelulósicos que se descartan en los procesos agrícolas
y forestales, para transformarlos, a través de hidrólisis química o enzimática,
en azúcares fermentables que puedan ser convertidos por diversos
microorganismos en metabolitos de interés comercial (Field y col., 2015). La
hidrólisis química o enzimática del material lignocelulósico
proveniente de residuos de cosecha, como bagazos, sobrantes forestales, pajas o
cascarillas, permite su conversión en etanol, que se utiliza como combustible,
pero también puede aprovecharse en la obtención de diversos productos
químicos (Aguilar-Rivera, 2007; 2011; 2013). El bagazo de caña de azúcar (Saccharum
officinarum) es un material lignocelulósico ampliamente utilizado para la producción de
etanol en
diferentes países, como Cuba, Brasil y Estados Unidos, entre otros,
sin afectar la producción de alimentos (Fernández y col., 2009).
El etanol fue empleado inicialmente solo para la producción
de bebidas alcohólicas, vinagres y conservas, pero
actualmente es aplicado a la industria de fármacos, perfumes y cosméticos; en
la fabricación de colorantes, materiales explosivos, seda artificial y materiales
plásticos (Brooks, 2008). Sin embargo, debido a que el etanol es una fuente
neta de energía, fácilmente almacenable, con alto contenido de oxígeno (35 %) y
combustión limpia, se le considera de gran aplicación potencial
como combustible (Agüero-Rodríguez y col., 2015), siendo
utilizado como alternativa para la oxigenación y aumento de octanaje
de la gasolina o como aditivo de la misma y como insumo para la
producción de biodiésel (Carreón-Rodríguez
y col., 2009).
La producción de etanol empleando diferentes levaduras y
utilizando bagazo de caña de azúcar como sustrato, se considera una excelente
opción industrial por la amplia disponibilidad de esta materia prima. Las
levaduras más ampliamente utilizadas desde hace siglos, pertenecen al género Saccharomyces
sp., por
su capacidad de convertir rápidamente los azúcares a etanol, además de
presentar una amplia aceptación en los procesos industriales (Ingram y Buttke, 1985). Se han
realizado investigaciones para obtener microorganismos capaces de producir etanol
eficientemente, a partir de diferentes hexosas y pentosas provenientes de la
hidrólisis química o enzimática de los materiales lignocelulósicos (Huerta-Beristain
y col., 2008; Chandel y col., 2011).
En el proceso de producción artesanal de etanol, a partir
de caña de azúcar, participan microorganismos nativos de la caña, entre los que
destacan levaduras de Saccharomyces
sp.,
Torula sp. y Pichia
sp. Sin
embargo, en el proceso industrial de obtención de etanol, particularmente para
fines carburantes, no es deseable tener la permanencia de linajes diferentes a Saccharomyces sp., debido a los requerimientos de alto rendimiento
necesarios para alcanzar la rentabilidad económica (Pataro
y col., 2000; Schwan y col., 2001). En estos procesos
se utilizan inóculos de cepas puras de Saccharomyces
cerevisiae, para sustituir las levaduras
nativas de la caña y tener un mejor control
de la fermentación (Carreón-Rodríguez y col., 2009). Es por
ello, que regularmente se aíslan levaduras de diversas fuentes naturales, para
evaluar su capacidad fermentativa, tolerancia al alcohol y la presión osmótica,
habilidad para usar la maltosa o el almidón como sustrato (Yeon-Ju
y col., 2011). Los bagazos de caña de azúcar, melazas, mostos para pulques,
mezcales, tequilas y otras destilerías pueden ser empleadas como fuentes para
la búsqueda, selección y evaluación de cepas de interés en la producción
biotecnológica de etanol (Lappe-Oliveras y col.,
2008). La actividad killer, que es la capacidad de
liberar toxinas que matan a otros microorganismos presente
en el medio, es una característica deseable para algunos autores, ya que da una
ventaja durante la producción de etanol (Magliani y
col., 1997; Marquina y col., 2002; Nally y col., 2005).
Ceccato-Antonini
y col. (2004) y Ortiz-Zamora y col. (2009), evaluaron la resistencia de
diferentes levaduras a altas concentraciones de sustratos y productos.
Actualmente se estudian algunas bacterias, como Zymomonas
mobilis sp,
debido a que son capaces de transformar la glucosa en etanol, con rendimientos
del 5 % al 10 %, los cuales son más altos que los rendimientos obtenidos por la
mayoría de las levaduras (García, 1998; Mielenz,
2001), aunque presentan algunas desventajas, como su baja tolerancia al alcohol
y su tamaño pequeño, lo cual hace difícil su separación, al momento de
recuperar el etanol (Ingram y Buttke,
1985). También existe la posibilidad de buscar nuevos microorganismos
productores de etanol en ambientes extremos (Oliart-Ros
y col., 2016).
El objetivo del presente estudio fue determinar la
capacidad de producción de etanol de diferentes cepas de levadura nativas
aisladas en medio YPD e hidrolizado de bagazo de caña concentrado hasta un 75
%.
MATERIALES Y MÉTODOS
Materia
prima
El
bagazo de caña de azúcar fue proporcionado por el Ingenio Aarón Sáenz Garza de
Ciudad Mante, Tamaulipas, México, el cual fue sometido a un proceso
de secado, molienda y tamizado; posteriormente, fue almacenado en recipientes
cerrados para evitar fluctuaciones de humedad.
Análisis
del bagazo
Una alícuota de bagazo de caña fue sometida a secado en
estufa (FELISA Mod. FE-291, Jalisco, México) a 105
°C, para determinar la humedad, y en mufla (Thermo Lyne 600, Modelo F6018, EUA) durante 2 ciclos de 3 h cada uno, a
550 °C para calcular el % de cenizas. La muestra seca se sometió
a una hidrólisis ácida cuantitativa en dos etapas de tratamiento ácido para
calcular su composición química. La primera etapa se realizó con ácido
sulfúrico al 72 % a 30 °C por 1 h; la segunda etapa
consistió en diluir el medio hasta alcanzar 3 % de
concentración de ácido sulfúrico y se calentó a 121 °C
por 1 h. El residuo
sólido después de la hidrólisis fue considerado como lignina de
Klason. Se analizaron el jarabe obtenido en la hidrólisis
y el concentrado. Se realizó un análisis cromatográfico
(Cromatógrafo marca Waters Mod.
2695, Milford, EUA), para cuantificar azúcares simples, filtrando las muestras
con una membrana de 0.45 μm y
usando un flujo de 0.5 mL/min-1, columna
ion-exclusión 50 μm a 7 μm, 7.8 mm x 300 mm, 37
°C, detector de IR (índice
de refracción) a 40 °C, fase móvil H2SO4
al 0.01 N para conocer la concentración de azúcares
(glucosa, xilosa, arabinosa y ácido acético). Posteriormente, se hizo un análisis espectrofotométrico
para medir la concentración de inhibidores como
el furfural y 5-hidroximetilfurfural, usando un
espectrofotómetro UV-Vis (Perkin Elmer Mod. Lambda 35 Shelton, EUA),
midiendo la absorbancia en longitud es de onda de 230 nm y 260 nm para su
cuantificación.
Obtención
de hidrolizados
El bagazo de caña fue tratado con ácido sulfúrico al 2 % a
122 °C, y un tiempo de reacción de 60 min, en una relación 1:8, siguiendo el
procedimiento descrito por Aguilar y col. (2002). El hidrolizado hemicelulósico obtenido fue separado del material fibroso
por filtración y concentrado al vacío a 50 °C, con un rotoevaporador
(Rotary evaporator Mod.
H5-2001NS, Nae-dong, Korea
del Sur), para aumentar la concentración de azúcares fermentables,
principalmente la glucosa. El hidrolizado se redujo hasta un 75 % de su volumen
inicial, ajustando el pH inicial de 0.76 hasta 5.3 con la adición de CaCO3.
Selección
y mantenimiento de células
Se aislaron 15 cepas de levadura nativas, productoras de etanol, presentes
en bagazo de caña de azúcar y se realizaron fermentaciones, como principal
prueba fisiológica utilizada en la identificación de levaduras productoras de
etanol, de acuerdo a Orberá (2004). Las
cepas seleccionadas (UAT
3, UAT 5, UAT 6, UAT 7, UAT 8, UAT 9, UAT 10, UAT 11, UAT 20, UAT 23 y UAT 24), por su
capacidad productora de etanol, fueron mantenidas en glicerol (crioprotector) a una temperatura de - 18 °C.
Las cepas se reactivaron utilizando la técnica de estrías
en tubo inclinado, en medio nutritivo sintético YPD (glucosa 20 g/L, peptona 20
g/L y extracto de levadura 10 g/L, agar 20 g/L). Después de las 48 h de
incubación se etiquetaron y conservaron en refrigeración (4 °C ± 1).
La productividad de las cepas se evaluó usando un medio de
cultivo YPD que contenía 20 g/L de glucosa, 20 g/L de
peptona y 10 g/L de extracto de levadura,
en matraces de 250 mL estériles, con un
volumen total de 120 mL de medio, incubados a 29 °C ±
1, a una velocidad de agitación de 100 revoluciones por minuto (rpm) por 48 h.
Se tomaron muestras cada 12 h, determinando en cada una: 1) Biomasa producida,
determinada por peso seco celular; 2) Recuento directo de células totales
utilizando una cámara de Neubauer en microscopio
óptico (Modelo Revelation III, marca LW Scientific, Lawrenceville,
Georgia, EUA); 3) Consumo de sustrato, por determinación de grados Brix; 4) Consumo de sustrato (glucosa) y formación de
productos (etanol y ácido acético), por
Cromatografía Líquida de Alta eficacia (CLAE), usando una
Columna de Intercambio iónico ION-300 (Fase móvil con H2SO4
al 0.01M; flujo de 0.4 mL/min-1; IR
y detección UV).
Evaluación
de la cepa nativa seleccionada en medios con hidrolizado
La cepa de levadura seleccionada como la mejor productora
de etanol (UAT-3), se evaluó en medios formulados con concentrado del hidrolizado de
bagazo de caña de azúcar, conteniendo 65.42 g/L de xilosa,
20.40 g/L de glucosa y 7.83 g/L de arabinosa. El contenido
de compuestos inhibidores en el medio fue de 3.47 g/L de ácido acético, 1.71
g/L de furfural y 1.24 g/L de 5-hidroximetilfurfural.
Se comparó la producción de esta levadura en un medio de cultivo YPD que
contenía 20 g/L de glucosa, 20 g/L de peptona y 10 g/L de extracto de levadura.
Se realizó una cinética de producción durante 216 h. Se tomó muestra cada 24 h
y se realizaron análisis de consumo de sustrato, formación de productos y
biomasa producida; determinando la productividad volumétrica (QP) (g/L·h),
rendimiento en producto (YP/S)
(g/g), y rendimiento en biomasa (YX/S)
(g/g).
Análisis
estadístico
Los resultados fueron analizados utilizando los programas
de Microsoft Excel 2007 y Statgraphics, versión 5.1.
Para conocer el efecto de la composición del medio en los rendimientos de YP/S, QP, YX/S y del tiempo de la cinética de fermentación
para cada una de las cepas, se realizó un ANOVA multifactorial con un nivel de
confiabilidad del 95 %, evaluando los parámetros de rendimiento durante la
fermentación.
RESULTADOS Y DISCUSIÓN
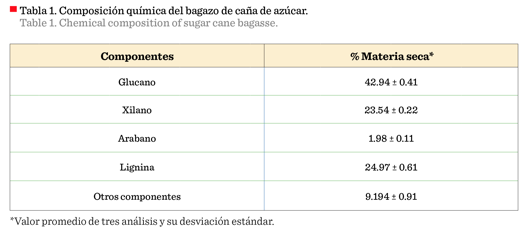
La caracterización química permitió establecer que el
bagazo de caña de azúcar contenía 8.94 ± 0.07 % de humedad y 3.03 ± 0.1 % de
cenizas. Pandey y
col. (2000), mencionaron que el bajo contenido
de cenizas del bagazo de caña le permite ser un mejor sustrato durante la
fermentación comparado con otros residuos lignocelulósicos
como la paja de arroz o trigo.
La composición estructural del bagazo, obtenida mediante
una hidrólisis ácida cuantitativa, para establecer el contenido de glucano, xilano, arabano y lignina, se muestra en la Tabla 1. Los valores
obtenidos son cercanos a los valores teóricos reportados en la literatura por
diferentes autores para caña de azúcar (Pandey y
col., 2000; Ferrer y col., 2002; Boussarsar y col.,
2009; Zumalacárregui-De-Cárdenas y col., 2015).
La hidrólisis ácida permite degradar el bagazo, obteniendo
glucosa, que puede ser utilizada en procesos de fermentación etanólica con alto rendimiento (Guarnizo-Franco y col., 2009). En hidrolizados
lignocelulósicos, la concentración de
azúcares depende de las condiciones de hidrólisis utilizadas (Larsson
y col., 1999; Palmqvist y
Hahn-Hägerdal 2000a). En este sentido, Chan-dler y col. (2012), mencionaron que se pueden obtener altas
concentraciones de azúcares si se realiza hidrólisis en dos etapas, aplicando
inicialmente temperaturas entre 100 °C y 140 °C, seguido de un
calentamiento entre 160 °C a 180 °C. Sin embargo, si en la
primera etapa se utilizan
rangos de 140 °C a 160 °C cambia el comportamiento,
disminuyendo la cantidad de azúcares producidos.
En el presente estudio, se obtuvo un alto contenido de carbohidratos con las
condiciones de hidrólisis química utilizadas, lo que puede ser aprovechado para
transformar el bagazo de caña de azúcar en un medio fermentable, que puede ser convertido
por fermentación microbiana en productos con alto valor agregado, como el
etanol (Chandler y col., 2012).
La concentración del hidrolizado utilizada en este trabajo
permitió incrementar el contenido de los azúcares fermentables: xilosa, glucosa
y arabinosa (Tabla 2). Sin embargo, se concentraron también el ácido acético, el furfural y el hidroximetilfurfural,
compuestos derivados del furano y que
pueden actuar como inhibidores en el proceso de fermentación, afectando el
crecimiento de las levaduras y el rendimiento en la producción de etanol
(Oliva, 2003). En la Tabla 2 se observa que el ácido
acético alcanzó valores de 10.21 g/L,
concentración muy superior a los 3 g/L que ha sido
reportada como suficiente para afectar el proceso de fermentación (Felipe y
col., 1995). Zyl y col. (1991), utilizaron Pichia stipitis para producir etanol
a partir de hidrolizado hemicelulósico de
bagazo de caña, y descubrieron que el grado de inhibición
causado por el ácido acético no sólo dependía de su concentración, sino también
de la concentración de oxígeno y pH del medio.
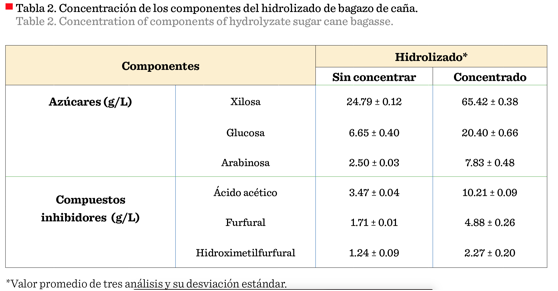
El furfural e hidroximetilfurfural (HMF) alcanzaron concentraciones
de 4.88 g/L y 2.27 g/L respectivamente. Estos compuestos fenólicos de bajo peso
molecular son tóxicos y afectan el crecimiento celular (Purwadi
y col., 2004). Se ha reportado que concentraciones de 0.25 g/L a 0.5 g/L de furfural no afectaron el crecimiento de S.
stipitis; aunque
concentraciones más altas (1.5 g/L a 2 g/L) afectaron el crecimiento de la
levadura y disminuyeron el rendimiento de etanol y la productividad
(Nigam, 2001). Palmqvist y
Hahn-Hägerdal (2000b), demostraron que el efecto inhibitorio de hidroximetilfurfural
es similar al de furfural, causando de igual forma un
retraso tardío en el crecimiento celular, sin embargo se considera menos tóxico
al HMF.
Por otra parte, es posible reducir el efecto que pudiera
causar la presencia de compuestos inhibidores en el hidrolizado, aplicando un
método de detoxificación que permita reducir su
concentración a niveles más bajos de los requeridos para afectar el
metabolismo de los microorganismos fermentadores de interés (Yong-Jin y col., 2011; Field y col., 2015).
Selección
de la cepa nativa mayor productora de etanol
La capacidad productora de etanol de las levaduras varía
entre géneros, especies e incluso entre cepas dentro de una misma especie. S.
cerevisae es la levadura más
utilizada para la obtención de etanol, sin embargo, se ha reportado que las
diferentes cepas varían en su rendimiento de etanol, dependiendo de las
condiciones de proceso (Tuite y Oliver, 1991;
Carballo, 2000). Entre los criterios de selección de las cepas destacan, su
capacidad fermentativa, medida como producción de etanol, la tolerancia a la
acidez, el consumo de azúcares y la buena productividad volumétrica de etanol.
La capacidad fermentativa se ve influenciada por diferentes factores, como la
temperatura, la concentración de azúcares, el pH, y algunas otras variables que
influyen en el crecimiento de los microorganismos (Caridi,
2003).
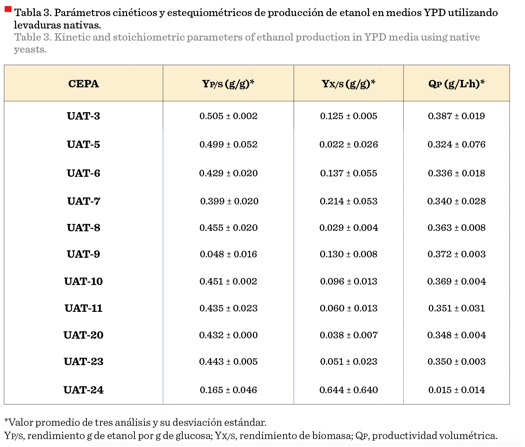
En este estudio, las cepas de levadura nativas, aisladas
previamente, fueron evaluadas en su capacidad productiva
de etanol usando medio comercial YPD (Figura 1),
determinando el rendimiento en producto (YP/S), el
rendimiento de biomasa (YX/S) y la
productividad volumétrica (QP)
(Tabla 3). Las principales cepas productoras
identificadas fueron UAT-3, UAT-5, UAT-9 y UAT-10 con 9.28 g/L,
8.4 g/L, 8.31 g/L y 8.37 g/L de etanol
respectivamente (Figura 1). La cepa nativa UAT-3 fue
seleccionada como la mejor productora de etanol, por presentar el valor más
alto de rendimiento (YP/S) con
0.504 6 g/g, muy cercano al rendimiento teórico (0.51 g/g); y la mayor
productividad volumétrica (QP) de
0.386 g/L·h (Tabla 3). Los resultados de esta cepa
fueron mayores a los obtenidos en fermentaciones en fedbatch
de hidrolizados enzimáticos no deslignificados de
bagazos realizados por Albuquerque-Wanderley y col.
(2013), lo que indica que es una cepa con buena capacidad de producción de
etanol. Gómez-Ruiz y col. (2007), aislaron cepas de levaduras S.
cerevisiae de
la región productora de mezcal, presentando
resultados de YP/S de
0.068 0 g/g, biomasa (cel/mL)
de 1.37E + 08 y una QP de
0.136 5 g/L·h, valores inferiores a los presentados
por la cepa UAT-3 de este estudio.
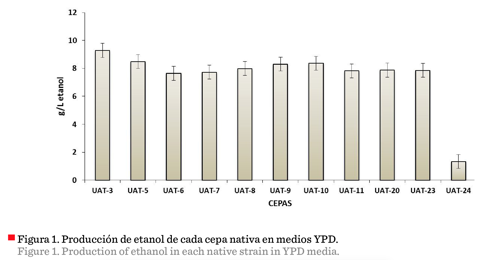
La cepa UAT-24 presentó la menor productividad de
etanol (1.34 g/L) (Figura 1) y los menores valores de rendimiento y
productividad volumétrica (Tabla 3), pero presentó la
mayor producción de biomasa (Tabla 3). Estos resultados indicaron
que esta levadura destinó el consumo de azúcares al
crecimiento celular, teniendo baja eficiencia
fermentativa.
Existen otras fuentes disponibles para el aislado de cepas productoras
de etanol que no fueron exploradas en el presente estudio. Oviedo-Zuma-qué y
col. (2009), utilizaron excedentes de plátano para darle un valor agregado a
los residuos poscosecha, logrando una evaluación de
cepas nativas con potencial en la producción de etanol. Joshi
y col. (2005) y Mohanty y col. (2006), alcanzaron
altas concentraciones usando células de S. cerevisiae en
pulpa de piña, durazno y marañón, adicionando sales minerales. Por otra parte,
se puede mejorar la productividad de las levaduras mediante su inmovilización,
proceso que permite un mayor aprovechamiento del sustrato.
Matiz y col. (2002), ensayaron con diferentes cepas nativas inmovilizadas a
partir de Z. mobilis sp. utilizando el medio de fermentación sintético
modificado en condiciones de microaerofilia,
obteniendo mejores resultados que al utilizar células libres.
Cinética
de fermentación utilizando la cepa seleccionada en hidrolizado de bagazo de
caña de azúcar En la Figura 2 se observa la
cinética de crecimiento celular de la cepa nativa seleccionada UAT-3, tanto en
el medio de cultivo YPD caldo (control), como en hidrolizado de caña de azúcar
concentrado, enriquecido con 10 g/L de extracto de levadura y 20 g/L de
Peptona, para determinar la producción de etanol y su capacidad de adaptación
al medio con diversos inhibidores presentes en el hidrolizado, realizando una
cinética de fermentación de 216 h y tomando muestra cada 24 h. El medio control
presentó una concentración inicial de 20 g/L de glucosa. En tanto que la
concentración inicial en el hidrolizado de bagazo de caña de azúcar fue de
65.42 g/L de xilosa, 20.40 g/L de glucosa y 7.83 g/L de arabinosa; y de
compuestos inhibidores de 3.47 g/L de ácido acético, 1.71 g/L de furfural y 1.24 g/L de 5-hidroximetilfurfural.
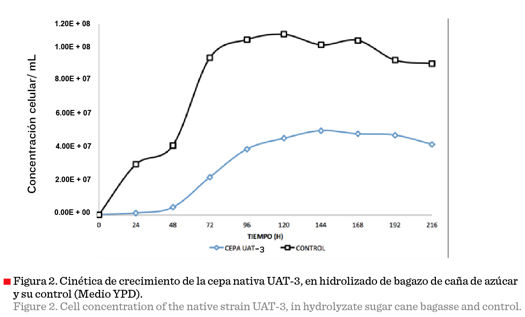
El crecimiento celular de la cepa
nativa UAT-3 en el medio control fue mayor y alcanzó una concentración celular
superior a 1.10E + 08 a las 96 horas (Figura 2), en tanto que su crecimiento
mostró una fuerte inhibición en el hidrolizado de bagazo de caña de azúcar
durante las primeras 48 horas, provocado por una lenta adaptación al medio, lo
que causó que se presentase una fase exponencial prolongada, obteniéndose una
concentración celular máxima de 4.50E + 07 a las 144 horas, debido a la
presencia de sustancias
inhibidoras liberadas tras el tratamiento ácido
que se realizó en el bagazo de caña de azúcar. Aunque el crecimiento celular de
la cepa UAT-3 fue afectado negativamente, Ortiz-Zamora y col. (2009),
obtuvieron valores muy por de bajo de los obtenidos en este ensayo, en un
tiempo de fermentación de 144 h, con cepas de levadura aisladas de fuentes
naturales (melaza de caña de azúcar, jugo de uva, miel de caña, jugo de caña y
piña), que fueron inhibidas por la concentración de azúcares en el medio. La
inhibición de sustrato se hace muy significativa en rangos de 5 % a 25 % p/v de azúcar, con una
inhibición completa del crecimiento de 25 % a 40 % p/v de glucosa,
dependiendo de la cepa (Jones y col.,
1981; Attfield y Ketsas, 2000; Malacrino y col., 2005).
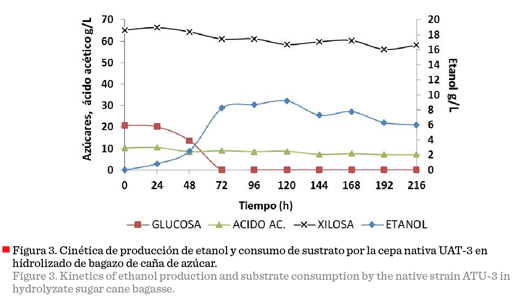
En
la Figura 3 se muestra la cinética de producción de etanol y
consumo de azúcares de la cepa nativa UAT-3, en medio obtenido a partir del
hidrolizado de caña. El incremento en la producción de etanol estuvo
directamente asociado con la disminución en el contenido de glucosa,
alcanzándose el valor máximo de producción etanólica
y el agotamiento del carbohidrato a las 72 horas. Aunque existen cepas de
levaduras capaces de producir etanol hemicelulósico,
al metabolizar la xilosa, además de glucosa (Antunes
y col., 2014), la cepa seleccionada, no fue capaz de hidrolizar la D-xilosa
presente en el medio, ni la L-arabinosa (datos no mostrados), ambos denominados
azúcares residuales. Algunos investigadores han demostrado que los suplementos
de urea pueden aumentar la producción de etanol, ya que la
urea en sí es un componente esencial en el crecimiento de la levadura (Lopes y Sola-Penna, 2001; Choi y col., 2009).
En
la Tabla 4 se muestran los parámetros cinéticos de etanol
obtenidos por la cepa nativa UAT-3, utilizando el
hidrolizado de bagazo de caña de azúcar. A los 120 días se alcanzó el valor más
alto de rendimiento de etanol (YP/S), que fue de 0.442 g de etanol/g de
glucosa, que representa el 86 % del máximo rendimiento teórico
(0.511 g/g); así como el máximo valor de productividad (Qp), siendo de a 0.077
(g/L·h). Los valores de productividad obtenidos por
la cepa UAT-3 fueron superiores a los publicados por Fernández y col. (2009),
quienes reportaron una productividad de 0.12 g/g y rendimiento de 0.19 g/L·h, utilizando una cepa de S. cerevisiae
nativa en hidrolizados ácidos de bagazo con una concentración inicial de 12.1
g/L de glucosa, 2.0 g/L de ácido acético, 0.8 g/L de furfural
y 2.0 g/L de hidroximetil- furfural.
Al utilizar dos cepas industriales en el mismo medio, la productividad máxima
alcanzada fue de 0.06 g/g, 0.43 g/g, y el rendimiento máximo de 0.06 g/L·h, 0.46 g/L·h respectivamente.
También existen estudios en los que se han aislado cepas de levaduras con
capacidad de fermentación en ambientes severos, estableciendo
las características de crecimiento en varios monosacáridos y
evaluando su capacidad para fermentar etanol a
partir de glucosa, manosa, galactosa, fructosa y
xilosa (Kodama y col., 2013). En
este estudio se observó que la inhibición del rendimiento de etanol fue mayor a
la productividad volumétrica, debido probablemente a que los inhibidores
presentes en el hidrolizado impidieron una producción rápida de etanol durante
las primeras horas, pero luego ocurrió un proceso de adaptación de la cepa
UAT-3, lo que permitió incrementar el
rendimiento de etanol.

CONCLUSIONES
Las
condiciones utilizadas en el presente estudio, para la hidrólisis química del
bagazo de caña de azúcar,
permitieron obtener un mosto fermentable, compuesto principalmente por azúcares hemicelulósicos, en el que pudieron crecer las cepas de
levaduras seleccionadas y producir etanol. El proceso de acondicionamiento para
las cepas de levaduras aisladas, permitió su adaptación y crecimiento en el
mosto obtenido por hidrólisis química, alcanzando la máxima productividad de etanol a los 120 días, siendo del 86 %
del máximo rendimiento teórico. Es conveniente mantener la búsqueda de nuevas cepas
productoras de etanol, con mayor capacidad de fermentación, preferentemente
capaces de consumir y transformar en etanol arabinosa y xilosa.
AGRADECIMIENTOS
Los autores agradecen al Fondo Mixto CONACyT
Gobierno
del Estado de Tamaulipas, Convenio 00192588 de la
Convocatoria M0021-2012-40, y a la Dirección de Superación Académica, del Programa
para el Desarrollo Profesional Docente de la Convocatoria 2015 para el
fortalecimiento a Cuerpos Académicos por el apoyo
financiero otorgado en el proyecto con clave UAT-CA-115.
REFERENCIAS
Agüero-Rodríguez, J. C., Tepetla-Montes, J. y
Torres-Beristaín, B. (2015). Producción de biocombustibles a partir de la caña
en Veracruz, México: perspectivas y riesgos socio-ambientales. CienciaUAT. 9(2): 74-84.
Aguilar, R., Ramírez, J., Garrote, G., and
Vázquez, M. (2002). Kinetic study of the acid hydrolysis of sugar cane bagasse. Journal
of Food Engineering. 55(4): 309–318.
Aguilar-Rivera, N. (2007). Bioetanol de la
caña de azúcar. Avances en Investigación Agropecuaria. Revista
AIA. 11(3):
25-39.
Aguilar-Rivera, N. (2011). Efecto del
almacenamiento de bagazo de caña en las propiedades físicas de celulosa grado
papel. Ingeniería investigación y tecnología. 12(2): 189-197.
Aguilar-Rivera, N. (2013). Análisis de la
productividad de etanol de caña de azúcar en ingenios azucareros de México.
Universidad Autónoma del Estado de México, Toluca, México. Ciencia Ergo Sum. 20(1): 17-28.
Albuquerque-Wanderley, M., C., Martín, C., Moraes-Rocha,
J. G., and Ribeiro-Gouveia, E. (2013). Increase in ethanol production from
sugarcane bagasse based on combined pretreatments and fed-batch enzymatic hy drolysis. Bioresource
Technology. 128: 448–453.
Antunes, F. A. F., Chandel, A. K., Milessi,
T. S. S., Santos, J. C., Rosa C. A., and da-Silva, S. S. (2014). Bioethanol production from
sugarcane bagasse by a novel Brazilian pentose fermenting yeast Scheffersomycesshehatae UFMG-HM 52.2: Evaluation of fermentation medium. International Journal of Chemical Engineering. (1): 1-8.
Attfield, P. V. and Ketsas, S. (2000). Hyper-osmotic stress
response by strains of baker’s yeasts in high sugar concentration medium.
Letters in Applied Microbiology. 31(4): 323–327.
Boussarsar, H., Rogé,
B., and Mathlouthi, M. (2009). Optimization
of sugarcane bagasse conversion by hydrothermal treatment for the recovery of
xylose. Bioresource Technology. 100(24): 6537-6542.
Brooks, A. A. (2008).
Ethanol production potential of local yeast strains isolated from ripe banana
peels.
African journal of Biotechnology. 7(20): 3749-3752.
Carballo, F. (2000). Microbiología industrial: Microorganismos de
interés industrial. España:
Editorial Acribia. 31 Pp.
Caridi, A. (2003). Effect of protectants on the fermentation
performance of wine yeasts subjected to osmotic
stress. Food
Technology Biotechnology. 41(2): 145-148.
Carreón-Rodríguez, O. E., Ramos-López, A. S.,
Centeno-Leija, S., Leal-Reyes, L. J., Martínez-Jiménez, A., and
Fernández-Sandival, M. T. (2009). Etanol
carburante. Biotecnología. 13(3): 79-102.
Ceccato-Antonini, S. R., Davis-Tosta, Ch.,
and da-Silva, A. C. (2004). Determination
of yeast killer activity in fermenting sugarcane juice using selected
ethanol-making strains. Brazilian Archives of Biology and
Technology. 47(1):
13-23.
Chandel, A. K., Chandrasekhar, G.,
Radhika, K., Ravinder, R., and Ravindra,
P. (2011). Bioconversion of pentose sugars into ethanol: A review and future
directions. Biotechnology and Molecular Biology Review. 6(1): 8-20.
Chandler, C., Villalobos, N., González, E.,
Arenas, E., Mármol, Z., Ríos, J. y Aiello-Mazzarri, A. (2012). Hidrólisis ácida
diluida en dos etapas de bagazo de caña de azúcar para la producción de
azúcares fermentables. Multiciencias.
12(3): 245-253.
Choi, G. W, Kang, H. W.,
and Moon, S. K. (2009). Repeated-batch fermentation using flocculent hybrid,
S.
cerevisiae for the efficient production of bioethanol. Applied Microbiology and
Biotechnology. 84(2): 261–269.
Felipe, M. G. A., Veira, M. V., Vitolo, M.,
Mancilha, I. M., Roberto, I. C., and Silva, S. S. (1995). Effect of acetic acid
on xylose fermentation to xylitol by Candida guilliermondii.
Journal of Basic
Microbiology.
35(3):
171–177.
Fernández, T., Martín, C. y Taherzadeh, M. (2009). Evaluación
de cepas industriales de Saccharomyces cerevisiae para la obtención de
etanol a partir de fuentes que no afectan la producción de alimentos. ATAC. 1: 5-10.
Ferrer, J. R, Páez, G., Arenas-De-Moreno, L.,
Chandler, C., Mármol, Z. y Sandoval, L. (2002). Cinética de la hidrólisis ácida
de bagacillo de caña de azúcar. Revista de la Facultad de Agronomía.
19(1): 23-33.
Field, S. J., Ryden, P., Wilson, D., James, S. A., Roberts, I. N.,
Richardson, …, and Clarke, T. A. (2015). Identification of furfural resistant strains of Saccharomyces cerevisiae and Saccharomyces paradoxus from a collection of environmental
and industrial isolates. Biotechnology
for Biofuels. 8(1): 1-8.
García, M., Quintero, R. y Lopez, A. (1998). Biotecnología
Alimentaria. México: Editorial LIMUSA S.A. 619 Pp.
Gómez-Ruiz, S. E.,
De-los-Ríos-Deras, G. C., Soto-Cruz, N. O., López-Miranda, J. y Rutiaga-Quiñones,
O. M. (2007). Capacidad fermentativa de cepas de Saccharomyces cerevisiae nativas de la región productora de
mezcal de Durango, en XIII Congreso Nacional de Biotecnología y
Bioingeniería VII, Simposio Internacional de Producción de Alcoholes y Levaduras. Durango. [En línea]. Disponible en:
http://www.smbb.com.mx/congresos%20smbbacpulco09/TRABAJOS/AREA_X/CX-18.pdf.
Fecha de consulta: 24 de noviembre de 2015.
Guarnizo-Franco, A., Martínez-Yépes, P. N.,
and Valencia- Sánchez, H. A. (2009). Pretratamientos de la celulosa y biomasa
para la sacarificación. Scientia et Technica. 2(42):
284-289.
Huerta-Beristain, G., Utrilla, J.,
Hernández-Chavez, G., Bolívar, F., Gosset, G., and Martínez, J. (2008). Specific ethanol production rate in ethanologenic Escherichia coli strain KO11
is limited by pyruvate decarboxylase. Journal of Molecular
Microbiology and Biotechnology. 15(1): 55-64.
Ingram, L. O. and Buttke, T. M. (1985). Effects of alcohols on
microorganisms. Advances in microbial physiology.
25: 253-300.
Jones, S. R. P., Pammen, T. N., and Greenfield, P. F. (1981). Alcohol fermentation by yeasts. The effect
of environmental and other variables. Process Biochememistry. 16(3): 42–49.
Joshi, V. K., Shah,
P. K., and Kumar, K. (2005). Evaluation of peach cultivars for wine preparation.
Journal of Food Science and Technology. 42(1): 83-89.
Kodama, S.,
Nakanishi, H., Arachchige, T., Piyamali,
T. T., Isono, N., and Hisamatsu,
M. (2013).
A wild and tolerant yeast suitable for ethanol
fermentation from lignocelluloses. Journal of Bioscience
and Bioengineering. 115(5): 557-561.
Lappe-Oliveras, P., Moreno-Terrazas, R.,
Arrizón-Gaviño, J., Herrera-Suárez, T., García-Mendoza, A., and
Gschaedler-Mathis, A. (2008). Yeasts
associated with the production of Mexican alcoholic nondistilled
and distilled Agave beverages. FEMS yeast research. 8(7): 1037–1052.
Larsson, S., Palmqvist, E., Hahn-Hägerdal, B.,
Tengborg, Ch., Stenberg, K., Zacchi,
G., and Nilvebrant, N. O. (1999). The generation
of fermentation inhibitors during dilute acid hydrolysis of softwood. Enzyme and Microbiology
Technology. 24(3): 151–159.
Lopes, D. H. J. and
Sola-Penna, M. (2001). Urea increases tolerance of yeast inorganic pyrophosphatase activity to ethanol: the other side of urea
interaction with proteins. Archives of Biochemistry
and Biophysics. 394 (1): 61–66.
Magliani, W., Conti, S., Gerloni, M., Bertolotti, D., and Polonelli, L. (1997). Yeast killer systems. Clinical
Microbiology Reviews. 10(3): 369-400.
Malacrino, P., Tosi, E., Caramia, G., Prisco,
R., and Zapparoli, G. (2005). The
vinification of partially dried grapes: A comparative
fermentation study of Saccharomyces cerevisiae strains under high sugar stress. Letters
in Applied Microbiology. 40(6): 466–472.
Marquina, D., Santos, A., and Peinado, J. (2002). Biology of killer
yeasts. International Microbiology. 5(2): 65-71.
Matiz, A., Torres, C. y Poutou, R. A. (2002).
Producción de etanol con células inmovilizadas de Zymomonas mobilis spp.
Revista MVZ Córdoba. 7(2):
216-223.
Mielenz, J. R. (2001). Ethanol production from
biomass: technology and commercialization status. Current
Opinion in Microbiology.
4(3):
324–329.
Mohanty, S., Ray, P., Swain,
M. R., and Ray, R. C. (2006). Fermentation of cashew (Anacardium occidentale L.)
“apple” into wine. Journal of
Food Processing and Preservation.
30(3): 314-322.
Nally, M. C., Maturano, Y. P., Vázquez F. y Toro M. E. (2005). Comportamiento de una cepa salvaje de Saccharomyces cerevisiae killer y su isogénica sensible
respecto de diferentes fuentes de nitrógeno en cultivos mixtos. Revista
Argentina de Microbiología. 37(1): 73-77.
Nigam, J. N. (2001). Ethanol production
from wheat straw hemicellulose hydrolysate by Pichia stipitis. Journal of
Biotechnology. 87(1):
17– 27.
Oliart-Ros, R. M., Sánchez-Otero, M. G. y
Manresa- Presas, Á. (2016). Utilización de microorganismos de ambientes
extremos y sus productos en el desarrollo biotecnológico. CienciaUAT. 11(1): 79-90.
Oliva, J. M. (2003). Efecto de los productos
de degradación originados en la explosión por vapor de biomasa de chopo sobre Kluyveromyces
Marxianus. [En línea]. Disponible en:
http://www.ucm.es/BUCM/tesis/bio/ucmt26833.pdf. Fecha de consulta: 27 de
noviembre de 2015.
Orberá, T. (2004). Métodos moleculares de
identificación de levaduras de interés biotecnológico. Revista
Iberoamericana de Micología. 21: 15-19.
Ortiz-Zamora, O., Cortés-García, R.,
Ramírez-Lepe, M., Gómez-Rodríguez, J., and Aguilar-Uscanga, M. G. (2009).
Isolation and selection of ethanol resistant and osmotolerant yeasts from
Regional Agricultural Sources in Mexico. Journal of
Food Process Engineering. 32
(5): 775-786.
Oviedo-Zumaqué, L., Lara-Mantilla, C. y
Mizger-Pantoja, M. (2009). Levaduras autóctonas con capacidad fermentativa en
la producción de etanol a partir de pulpa de excedentes de plátano Musa (AAB Simmonds) en el
departamento de Córdoba, Colombia. Revista Colombiana de Biotecnología. 11(1): 40-47.
Palmqvist, E. and Hahn-Hägerdal, B. (2000a). Fermentation of lignocellulosic
hydrolysates I: Inhibition and detoxification. Bioresource
Technology. 74(1): 25–33.
Palmqvist, E. and Hahn-Hägerdal, B. (2000b). Fermentation of lignocellulosic
hydrolysates II: Inhibitors and mechanisms of inhibition. Bioresource
Technology. 74(1): 17-24
Pandey, A., Soccol, C. R., Nigam, C., and Soccol,
V. T. (2000). Biotechnological potential of agroindustrial
residues I: Sugar cane bagasse. Bioresource
Technology. 74(1): 69-80.
Pataro, C., Guerra, J. B., Petrillo-Peixoto,
M. L., Mendonça-Hagler, L. C., Linardi, V. R., and Rosa, C. A. (2000).
Comunidades de levadura y polimorfismo genético de la especie Saccharomyces
cerevisiae asociada a una
fermentación artesanal en Brasil. Journal Applied Microbiology. 89(1): 24-31.
Purwadi, R., Niklasson,
C., and Taherzadeh, M. J. (2004). Kinetic study of
detoxification of dilute-acid hydrolyzates by Ca(OH)2. Journal of Biotechnology. 114(1): 187–198.
Saha, P., Baishnab, A. C., Alam, F., Khan,
M. R., and Islam, A. (2014). Production of bio-fuel (bio-ethanol) from biomass (pteris) by fermentation process with yeast. Procedia Engineering. 90: 504–509.
Schwan, R. F., Mendonça, A. T., Da-Silva, J. J., Rodrigues, V., and
Wheals, A. E. (2001).
Microbiology and physiology of Cachaça (Aguardente)
fermentations. Antonie van Leeuwenhoek. 79(1): 89–96.
Suleiman, L. N. (2010). Renewable energy as a
solution to Nigerian energy crisis. VUAS. 13-19.
Tuite, M. F. and Oliver, S.
G. (1991). Saccharomyces. Biotechnology Handbooks, chapter 8, Culture Systems. New
York: Plenum Press. 282 Pp.
Yeon-Ju, L., Yu-Ri, Ch., So-Young, L., Jong-Tae, P., Jae-Hoon, S., Kwan-Hwa, P., and Jung-Wan, K. (2011). Screening
wild yeast strains for alcohol fermentation from various fruits. Mycobiology. 39(1): 33-39.
Yong-Jin, K.,
An-Zhou, M., Qian, L., Feng, W., Guo-Qiang, Z., and
Chun-Zhao, L. (2011).
Effect of lignocellulosic inhibitory compounds on growth and
ethanol fermentation. Bioresource
Technology. 102(17): 8099-8104.
Zumalacárregui-De-Cárdenas, L. M.,
Pérez-Ones, O., Rodríguez-Ramos, P. A., Zumalacárregui-De-Cárdenas, B. M., and
Lombardi, G. (2015). Potencialidades del bagazo para la obtención de etanol
frente a la generación de electricidad. Ingeniería, Investigación y
Tecnología. 16(3): 407–418.
Zyl, C. V., Prior, B. A., and
Du-Preez, J. C. (1991). Acetic acid
inhibition of D-xylose fermentation by Pichia
stipitis. Enzyme Microbiology Technology. 13(1): 82–86.