Identificación de espermatozoides humanos en
muestras contaminadas con levaduras
Identification
of human spermatozoids in samples
contaminated
with yeast
Beatriz Reina-Bouvet *, Adriana
Beatriz-Pavesi, Cecilia Vicenta-Paparella, Adriana María-Ombrella
*Autora para correspondencia: beatrizbouvet@arnet.com.ar/
Fecha de recepción:13 de julio de 2016/ Fecha de aceptación: 3 de enero de 2017
Universidad Nacional Rosario, Facultad de Ciencias
Bioquímicas y Farmaceúticas Suipacha 531- 2000. Rosario Santa Fe. Argentina.
RESUMEN
La violencia sexual es un problema mundial, y representa un delito grave que frecuentemente es difícil imputar, ante la ausencia de testigos. La valoración de las muestras de semen enviadas al laboratorio, para la detección de espermatozoides, es de gran importancia para encontrar al agresor; sin embargo, la evidencia no es sencilla, por la presencia de otros organismos y la labilidad espermática. El objetivo del presente estudio fue identificar espermatozoides humanos en muestras contaminadas con levaduras. Se aplicaron diferentes técnicas y recursos microscópicos. Se seleccionaron 46 muestras de semen fresco. Se dividieron en dos grupos: G1 normo u oligozoospérmicas (n = 28) y G2 azoospérmicas (n = 18). Cada muestra se diluyó 1:1 con solución fisiológica y se agregaron 0.05 mL de suspensión de levaduras Candida albicans. Como control, se procesaron testigos puros de espermatozoides (CE) y levaduras (CL). Las muestras se analizaron con microscopio óptico (MO), contraste de fase (CF), de luz polarizada (LP) y microscopio fluorescente (MF) con diferentes técnicas de tinción. El tinte Papanicolaou mostró mayor eficiencia que el tinte hematoxilina verde brillante (P < 0.05) para identificar espermatozoides con microscopio óptico. La detección de elementos refringentes mostró mayor correlación con la presencia de espermatozoides (CF: r = 0.966; P < 0.001), que la presencia de elementos birrefringentes (LP: r = 0.737; P < 0.001) y elementos fluorescentes (MF: r = 0.487; P < 0.05). La microscopía confocal con tinción de blanco de calcofluor-azul de Evans y naranja de acridina permitió la identificación de contaminación por levaduras. El empleo de técnicas microscópicas auxiliadas con técnicas de tinción permite confirmar la presencia de espermatozoides enteros o fragmentados en muestras de semen contaminadas con levaduras.
PALABRAS CLAVE:
espermatozoide,
levaduras, semen, medicina legal, técnicas microscópicas.
ABSTRACT
Sexual violence is a global problem, and represents a serious felony which is often difficult to impute due to the absence of witnesses. The evaluation of semen samples sent to the laboratory, for the detection of spermatozoa is of great importance to find the aggressor. However the evidence is not simple due to the presence of other organisms and sperm lability. The objective of the present study was to identify human spermatozoa in samples contaminated with yeast. Different techniques and microscopic resources were applied and 46 samples of fresh semen were selected. They were divided into two groups: G1 normo or oligozoosperms (n = 28) and G2 azoosperms (n = 18). Each sample was diluted 1:1 with physiological solution and 0.05 mL of yeast suspension Candida albicans was added. As controls, pure sperm (CE) and pure yeast (CL) were processed. The samples were analyzed with optical microscopy (MO), phase contrast (CF), polarized light (LP) and fluorescent microscope (MF) with different staining techniques. Papanicolaou dye showed greater efficiency than bright hematoxylin-green dye (P < 0.01) to identify spermatozoa with an optical microscope. The presence of refringent elements showed a higher correlation with the presence of spermatozoa (LP: r = 0.966; P < 0.001), that the presence of birrefringent elements (LP: r = 0.737; P < 0.001) and fluorescent elements (MF: r = 0.487, P < 0.05). Confocal microscopy with Evans blue calcofluor white stain and acridine orange allowed the identification of yeast contamination. The use of microscopic techniques aided by staining techniques confirms the presence of whole or fragmented spermatozoa in semen
samples contaminated with yeasts.
KEYWORDS: spermatozoa, yeast, semen, forensic medicine, microscopic techniques.
INTRODUCCIÓN
La violencia sexual consiste en la realización de todo acto sexual sin consentimiento ni deseo por parte de la víctima e implica utilización de fuerza física o intimidación (OMS, 2013). Tiene un impacto profundo en la salud física y mental de las víctimas y se encuentra asociada tanto a lesiones físicas como a un aumento del riesgo de padecer una serie de problemas de salud sexual y reproductiva, con consecuencias inmediatas y a largo plazo (Arroyo-Sánchez, 2016).
Este delito constituye un problema global, tanto en términos geográficos, como en el hecho de que no distingue entre edad y sexo (Cortés-Arboleda y col., 2011). En América Latina es uno de los problemas más graves de salud pública por su asociación con enfermedades venéreas, embarazos no deseados y problemas psicológicos (Fernández-Moreno, 2015). Anualmente se reportan 87 589 violaciones en América Latina y el Caribe, lo que representa aproximadamente 240 denuncias diarias con una tasa regional de 16.4 por cada 100 000 habitantes, según datos reportados en 2011 a la Oficina de las Naciones Unidas contra la Droga y el Delito (UNODC, por sus siglas en inglés: United Nations Office on Drugs and Crime), por la mayoría de los países, con excepción de Nicaragua (2010), Guatemala y Perú (2009), Argentina (2008), Ecuador (2006) y Suriname (2004) (Fleitas, 2014). Al respecto, el Observatorio de Criminalidad del Ministerio Público del Perú (Ministerio Público Fiscalía de la Nación, 2014) reportó que se recibieron 17 763 denuncias por el delito contra la libertad sexual en todo el país, correspondiendo a la ciudad de Lima una tasa de 37.96 por cada 100 000 habitantes. Además se señala que el 75 % de las víctimas fueron menores de edad y que el 34 % fueron ultrajadas sexualmente (Aguilar-Cabrera, 2013; Sánchez, 2015).
En Estados Unidos se publicaron estudios que demuestran índices significativamente más altos de agresión sexual en el ejército, en comparación con reportes civiles, exacerbando la gravedad de este problema (Stander y Thomsen, 2016). Por otro lado, en México, Andrade-Rubio (2016), reportó una asociación, ya sea como causa o consecuencia, entre la violación sexual y la migración de las mujeres dedicadas al trabajo agrario en Tamaulipas
Los movimientos feministas no solo han contribuido a visibilizar la discriminación y violencia contra las mujeres, sino a impulsar un proceso de reivindicación que procura la equidad de género y la construcción de políticas públicas coherentes con sus necesidades reales. En este marco, las víctimas conscientes de sus derechos, asumen los hechos de violencia sexual no como una valoración social a esconder, sino que realizan las denuncias pertinentes para procurar la detención del culpable (Afanador-Contreras y Caballero-Badilla, 2012). A menudo, las víctimas que deciden reportar un delito sexual buscan ayuda a través de la policía, desde donde son remitidas a un centro de salud para realizar una valoración médica, o incluso las víctimas acuden de manera directa a los servicios de salud (Arroyo-Sánchez, 2016). Estos delitos se caracterizan por la ausencia de testigos, y el laboratorio adquiere importancia en la valoración, siendo el semen el indicio más importante en este tipo de hechos (Espín-Falcón y col., 2008). El estudio del fluido seminal en química forense está relacionado con el derecho penal e involucra delitos de índole sexual, frecuentes en medicina legal (Támara, 2013).
En medicina legal es esencial rastrear la evidencia y tomar muestras del material biológico para documentar el presunto contacto sexual o físico, así como corroborar la historia de la víctima y el presunto agresor, para recabar información que resulte útil en la resolución del proceso legal. Dentro de la evidencia que se debe tomar tempranamente está la ropa íntima de la víctima, muestras de la cavidad oral en casos donde se haya referido sexo oral como parte de la agresión, muestras de las manos y uñas, así como muestras de piel (Arroyo-Sánchez, 2016).
La valoración médico legal proporciona evidencia de la agresión tendiente a facilitar la identificación, enjuiciamiento, condena y castigo de los ofensores. A pesar de lo importante que es obtener esta evidencia, debe alcanzarse un balance entre la adquisición de las muestras y la atención de las demás necesidades de la víctima, en tanto que una conducta insensible o forzosa, al realizar el examen forense, podría convertirse en “una segunda violación” (Dickens, 2015).
En los delitos sexuales, la valoración médico forense se realiza bajo un protocolo estandarizado. La toma de las muestras, con el consentimiento informado de la víctima, debe tener en cuenta las características y circunstancias en que ocurrieron los hechos y el tiempo transcurrido. En todo momento se debe garantizar la cadena de custodia y quedar documentada. Aún cuando el indicio más categórico es el semen, el no hallazgo del mismo no implica la ausencia de acceso carnal, solo la falta de eyaculación del autor; de la misma manera, la presencia del indicio, o sea del semen, no indica presencia del delito, sino solo la realización del acto, cobrando importancia la intervención y el análisis del laboratorio forense (Vega-Vega y col., 2014).
El semen está compuesto mayoritariamente por la secreción de las glándulas sexuales anexas y un pequeño porcentaje: 2 % a 3 % por espermatozoides (López-García y col., 2012).
El 46 % al 80 % del fluido seminal es aportado por las vesículas seminales, 13 % a 33 % es secretado por la glándula prostática, aproximadamente 5 % proviene de los testículos y el epidídimo, y 2 % a 5 % de la secreción de las glándulas uretrales y bulbouretrales. En cuanto a la composición química del semen, contiene mayoritariamente ácido cítrico, aminoácidos libres, fructosa, fibrinógeno, enzimas, fosfatidilcolina, carnitina, prostaglandinas, potasio y cinc (Carma, 2010).
El elemento fundamental en la identificación del fluido seminal es el hallazgo del espermatozoide, compuesto por cabeza, segmento intercalar o intermedio y cola o flagelo. La cabeza presenta forma ovalada vista de frente y piriforme de perfil; mide de 4 μm a 5 μm de longitud y 2.5 μm a 3.5 μm de ancho. Contiene el núcleo haploide con cromatina compacta altamente resistente a la digestión, el acrosoma en la parte anterior y un par de centríolos detrás del núcleo (distal y proximal). El acrosoma es una estructura tipo capuchón, contiene enzimas hidrolíticas como hialuronidasa, acrosina, fosfatasa ácida y neuraminidasa, que facilitan la penetración del espermatozoide a la zona pelúcida del ovocito (WHO, 2010). El segmento intercalar es una región cilíndrica estrecha, de 5 μm de longitud, que une la cabeza con la cola o flagelo, y contiene la carga mitocondrial que provee la energía necesaria (ATP) para la movilidad del espermatozoide (WHO, 2010). La cola o flagelo es una estructura importante para la movilidad del espermatozoide. Tiene una longitud de 40 μm a 50 μm, desenrollada y uniforme. En la parte central del flagelo y en toda su extensión se encuentra el axonema o filamento axial, que es un sistema microtubular formado por un par central rodeado de nueve pares de microtúbulos periféricos y permite el desplazamiento con movimiento ondular de la gameta masculina (WHO, 2010).
Entre los componentes químicos del plasma seminal, el cinc secretado por la glándula prostática, se encuentra en concentración 100 veces superior al suero sanguíneo, reuniendo las características suficientes para ser utilizado como marcador forense de presencia de semen (Pavesi y col., 2010). La fosfatasa ácida prostática (FAP), es sintetizada por la glándula prostática y secretada en el semen durante la eyaculación. La actividad de FAP está incrementada en el fluido seminal y es detectable aun en muestras sometidas a condiciones desfavorables, como la exposición a temperaturas elevadas; su determinación es un recurso aplicable a la búsqueda de semen, adquiriendo importancia como marcador forense en casos de muestras azoospérmicas (no contienen espermatozoides) u oligozoospérmicas (concentración espermática menor a 15 millones por mL de semen) (Pavesi y col., 2008). Otro marcador de presencia de fluido seminal es la determinación de la enzima lactato des-hidrogenasa (LDH), cuya actividad en plasma seminal es superior al valor en suero y además, la isoenzima LDH C4 es específica del epitelio seminal (Pavesi y col., 2011). La detección de componentes del fluido seminal es importante, sin embargo, el diagnóstico de certeza de la presencia de semen es el hallazgo de al menos un espermatozoide.
Aunque el hecho de no observar un espermatozoide en las muestras examinadas no excluye la presencia de semen, dado que por la fragilidad del espermatozoide a nivel del segmento intercalar pueden aparecer sólo cabezas espermáticas, que debido a su morfología ovoide y longitud de 4 μm a 5 μm, pueden confundirse con levaduras en las observaciones microscópicas en fresco, e incluso con coloración de Gram-Nicolle, ya que los espermatozoides se colorean como Gram negativos y las levaduras son Gram variables.
Ante la elevada frecuencia de muestras forenses clasificadas como presuntivas, es un desafío buscar métodos confiables que permitan corroborar la presencia de cabezas de espermatozoides, logrando un punto de inflexión en la química forense, dado que el hallazgo certero de cabezas de espermatozoides permite confirmar la presencia de semen y además en las cabezas espermáticas se encuentra el ácido desoxirribonucleico (ADN), permitiendo la identificación del agresor. Por otra parte, el no hallazgo de espermatozoides en el material proveniente de una violación puede deberse a que el causante del delito es azoospérmico o puede haber utilizado preservativo, y es otra de las situaciones en las que un ensayo de laboratorio puede dar resultado negativo (Támara, 2013; Turvey, 2014).
El objetivo de este estudio fue reconocer espermatozoides humanos en muestras contaminadas con levaduras.
MATERIALES
Y MÉTODOS
Se trabajó con muestras seminales provenientes de pacientes del Laboratorio Mixto de Reproducción de las Facultades de Ciencias Bioquímicas y Farmacéuticas y de Ciencias Médicas de la Universidad Nacional de Rosario, radicado en el Hospital Provincial del Centenario de la ciudad de Rosario en la provincia de Santa Fe de la República Argentina. El proyecto fue revisado y aprobado por evaluadores designados por la Secretaría de Ciencia y Tecnología y el Comité de Ética de dicha Secretaría. Todos los pacientes entregaron su consentimiento informado, para que el remanente de la muestra de semen, luego de procesar e informar las determinaciones indicadas por el médico solicitante, se utilicen con este propósito. Se seleccionaron 46 muestras de semen fresco, que se dividieron en dos grupos: G1 (n = 28) integrado por muestras de semen normo u oligozoospérmicas con concentración espermática entre 10 millones por mL y 30 millones por mL de semen; y G2 (n = 18) muestras seminales azoospérmicas: sin espermatozoides y sólo contenían fluido seminal. Se tomó 1 mL de cada una de las muestras y se diluyó en proporción 1:1 con solución fisiológica. A cada tubo se le adicionaron 0.05 mL de suspensión de levaduras Candida albicans, conteniendo 20 millones de células/mL, contadas utilizando una cámara de Neubauer (bright-line HBG, Germany) provenientes de un cultivo en medio Sabouraud-glucosa. Como control de la observación microscópica de las células a identificar (espermatozoides y levaduras), se procesaron testigos puros, consistentes en: una muestra con espermatozoides en concentración de 20 millones de espermatozoides/mL en solución fisiológica (CE) y una muestra con levaduras en concentración de 20 millones de células/mL en el mismo medio (CL) (Guarner y Brandt, 2011; Villarroel-Rodríguez y Santa-Cruz-Rodríguez, 2011). Todas las mues-tras analizadas se procesaron por duplicado y como resultados se tomaron los promedios de los porcentajes de espermatozoides y de levaduras hallados en los duplicados. Se aplicaron diferentes tinciones y recursos microscópicos con el fin de identificar con certeza espermatozoides y levaduras.
Identificación de espermatozoides
aplicando microscopio óptico
Se analizó la eficiencia de las tinciones hematoxilina verde brillante y Papanicolaou para identificar la presencia de espermatozoides, a través de sus características morfológicas, en muestras normo u oligozoospérmicas (G1); además, se analizaron las muestras azoospérmicas (G2) y los controles de espermatozoides y levaduras, para evaluar resultados falsos positivos y falsos negativos (WHO,2010; Brito y col., 2011). Se trabajó con 0.5 mL de las muestras, las cuales, se centrifugaron durante 10 min a 250 xg. Se descartó el sobrenadante y con el sedimento se realizaron dos extendidos en portaobjetos que se fijaron con etanol-éter (1:1); y se aplicaron las respectivas tinciones, utilizando colorantes nuevos, para evitar el arrastre de material proveniente de coloraciones previas. Los extendidos teñidos se evaluaron con microscopio óptico (Leitz Laborlux 11, Germany) y objetivo de inmersión (1000x). Se consideró:
Resultado positivo: hallazgo de al menos un espermatozoide completo.
Resultado presuntivo: solo se observan cabezas.
Resultado negativo: no se observan células espermáticas.
Se compararon los resultados obtenidos con ambas tinciones aplicando la prueba Chi cuadrado (χ2).
Identificación
de espermatozoides y levaduras aplicando microscopio con contraste de fases,
luz polarizada y de
fluorescencia
Se trabajó con las muestras de los
grupos G1 y G2 provenientes de diluciones de semen a
las que se agregó suspensión de
levaduras. Como control de
la observación microscópica se procesaron
testigos puros de espermatozoides (CE) y de levaduras (CL).
Se tomaron 0.5 mL de cada muestra y se centrifugaron 10 min a 250 xg.
Se descartó el sobrenadante y se colocó una gota del sedimento entre porta y cubre objeto, se aplicaron distintos recursos
microscópicos.
Mediante microscopía con contraste de fases (CF) utilizando
microscopio (Zeiss 37081, Germany)
se determinó el porcentaje de elementos refringentes (espermatozoides) y
opacos (levaduras).
Con microscopio óptico (Leitz Laborlux 11, Germany) y colocando
polarizadores en los oculares y en el objetivo, para generar luz polarizada
(LP), se identificaron espermatozoides y/o cabezas espermáticas. La técnica se
fundamenta en las características birrefringentes que presenta el
espermatozoide como consecuencia de las propiedades anisotrópicas
de su textura protoplásmica interna. El análisis de birrefringencia de los
espermatozoides mediante la aplicación de microscopía con LP es una herramienta
adicional que permite evaluar la organización de los organelos
situados en la cabeza y el flagelo espermático. El núcleo espermático maduro
presenta birrefringencia intrínseca asociada con sus filamentos proteicos
ordenados y orientados longitudinalmente. La organización microtubular
del axonema y de las mitocondrias en la pieza
intermedia también presentan birrefringencia
(Gianaroli y col., 2010).
En el
análisis con microscopio de fluorescencia (MF) (Nikon Eclipse 50 i, Japón) se
utilizó el fluorocromo naranja de acridina, el cual,
por sus características metacromáticas, al
intercalarse como monómero entre las dos cadenas del ADN nuclear de las cabezas
de los espermatozoides, presenta un máximo de excitación a 502 nm y de emisión a 525 nm, que se
observa de color verde si el ADN se encuentra nativo y anaranjado si se
encuentra desnaturalizado. En dichas condiciones, las levaduras no producen
interferencia. Por otra parte, este mismo fluorocromo
puede asociarse con el ácido ribonucleico (ARN) fúngico, y bajo condiciones de
excitación de 460 nm y de emisión a 550 nm emite una fluorescencia roja, la cual fue analizada pero
no reportada, para confirmar que las muestras no presentaban interferencia cromáticas durante su análisis.
En
este análisis se trabajó solo con 23 de las 28 muestras disponibles por
cuestiones técnicas. Se midió el grado de asociación de las tres variables CF,
LP y MF con el número de espermatozoides a través del coeficiente de correlación
de rangos Spearman.
Identificación de
levaduras aplicando microscopía confocal con blanco
de calcofluor-azul
de Evans y
naranja de acridina
El
microscopio confocal (MFC) emplea una técnica óptica
de imagen para incrementar el contraste o reconstruir imágenes tridimensionales
utilizando un colimador para eliminar la luz desenfocada o destellos de la
lente, en especímenes que son más gruesos que el plano focal (Saldaña y col.,
2010). La apertura localizada delante del fotomultiplicador evita el pasaje de
fluorescencia de las regiones de la muestra que no están en foco, la luz que
proviene de regiones localizadas por encima o por debajo del plano focal no
converge en el orificio y no es detectada por el fotomultiplicador (Saldaña y
col., 2010).
La
aplicación de MCF, al eliminar la luz procedente de los planos fuera de foco,
permite observar imágenes con alta resolución, nitidez y contraste. Se pueden
utilizar varios fluorocromos y obtener señales sin
solapamiento, generando múltiples imágenes de cada uno de los fluorocromos superpuestas en una imagen única
(Sánchez-Armendáriz y col., 2013). Se aplicó MCF para identifi-car
levaduras que son frecuentes contaminantes de las muestras forenses donde se
investiga presencia de semen. Se utilizó una solución en proporción 1:1 de dos fluorocromos: a) blanco de calcofluor
1.0 g/L y azul de Evans 0.5 g/L, que emite fluorescencia azul en presencia de
levaduras (ARN). El blanco de calcofluor tiñe de
color azul las paredes celulares que contienen quitina, celulosa y otros
polisacáridos con uniones β-1,4
(Vázquez y col., 2016). Cuando se emplea la luz UV, las paredes fúngicas emiten
fluorescencia de color entre verde brillante y azul, mientras que otros
materiales fluorescen de color rojizo-amarronado; b)
naranja de acridina 0.01 % en buffer fosfato salino (PBS, por sus siglas en
inglés phosphate buffered saline) que emite fluorescencia verde en presencia de
cabezas espermáticas (ADN). Esta técnica microscópica utiliza iluminación
puntual, en un plano óptico conjugado frente del detector, por lo que elimina
la información ubicada fuera del plano focal, registrando solamente la luz que
está dentro de este plano (Alberts y col., 2006).
Además es sensible, específica, brinda imágenes tridimensionales con elevada
resolución y es utilizada con creciente frecuencia para estudios micológicos
(Forbes y col., 2009; Sánchez-Armendáriz y
col., 2013).
Se
analizaron por separado 0.5 mL de muestras
correspondientes a los grupos G1 y G2 así como CE
y CL. Se centrifugaron durante 10 min a 250 xg. Luego
de descartar el sobrenadante se agregó al sedimento de cada muestra 0.05 mL de la solución compuesta por los 2 fluorocromos
(a:b) y se analizó con el microscopio confocal Nikon Eclipse TE-2000-E (Japón). El análisis
estadístico de los promedios de los porcentajes de células azules, indicadoras
de presencia de levaduras, entre los grupos; se realizó aplicando la prueba t
- Student.
RESULTADOS
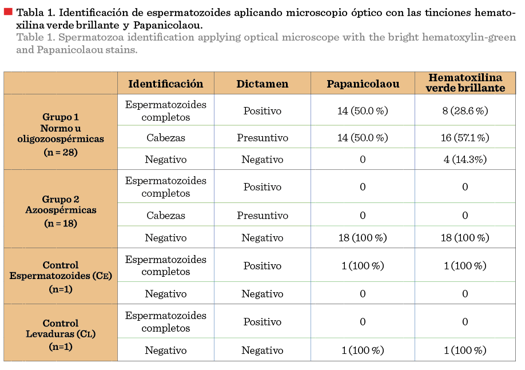
La
tinción de hematoxilina verde brillante permitió identificar sólo 8 muestras
positivas (28.6 %) del total de 28 analizadas del Grupo 1 (normo u oligozoospérmicas), y dio 4 resultados negativos (Tabla 1).
La tinción Papanicolaou permitió identificar como positivas al 50 % de las
muestras, y como presuntivas al otro 50 %, sin arrojar muestras negativas. En
el grupo G2 se obtuvieron resultados negativos aplicando ambas
tinciones en las 18 (100 %) muestras analizadas. El análisis de las muestras
control confirmó que ambas tinciones daban positivo en presencia de
espermatozoides y negativo en presencia de levaduras. Estos resultados
indicaron que las dos tinciones pueden utilizarse para la búsqueda de
espermatozoides en muestras biológicas contaminadas por levaduras, pero la
tinción de Papanicolaou ofrece
mayor sensibilidad (P < 0.05).
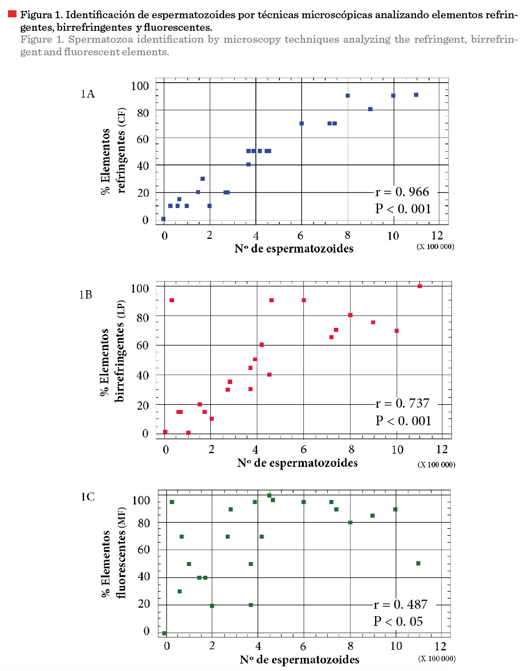
En
cuanto al análisis de las muestras seminales, con distintos recursos
microscópicos, para reconocer espermatozoides en mues-tras contaminadas con
levaduras, se analizó la correlación de las variables con el porcentaje de
elementos refringentes (CF) (Figura 1A), el porcentaje de elementos
birrefringentes (LP) (Figura 1B) y el porcentaje de elementos fluorescentes
(MF) (Figura 1C) con el número de espermatozoides observados en las muestras.
Aplicando el coeficiente de correlación de rangos Spearman,
se encontró que, si bien las tres variables correlacionan con el número de
espermatozoides en forma directa y significativa, el mayor coeficiente se
observó con la variable porcentaje de elementos refringentes obtenido por CF (r
= 0.966), indicando una fuerte asociación con el número de espermatozoides (P
< 0.001) (Figura 1A). Estos resultados demostraron que mediante la
aplicación de CF es posible identificar espermatozoides en presencia de
levaduras, brindando información importante en el esclarecimiento de casos
periciales donde se investiga la presencia de semen humano. Se encontró también
un nivel más bajo de asociación (aunque significativo) para el análisis de LP
(r = 0.737; P < 0.001) (Figura 1B) y MF (r = 0.487; P < 0.05) (Figura
1C) por lo que no son técnicas adecuadas
cuando se busca alto nivel de discriminación en el laboratorio, especialmente
al tratarse del esclarecimiento de delitos
graves.
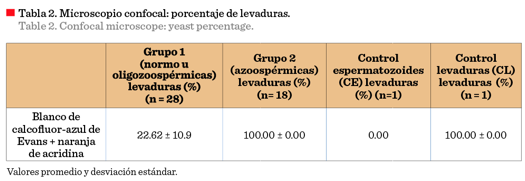
En las
muestras seminales y controles analizados con MCF, y la tinción blanco de calcofluor-azul de Evans y naranja de acridina para
identificar levaduras en presencia de espermatozoides, se observó en G2
solo células azules (100 %) indicadoras de presencia de levaduras, como en la
muestra CL. Mientras que G1 presentó menor porcentaje de células
azules (22.62 %), porque además de levaduras las muestras contenían
espermatozoides. En la muestra CE no se observaron células azules. Se aplicó la
prueba t Student para evaluar la diferencia
entre los promedios de los porcentajes de células azules indicadoras de
levaduras entre los grupos G1 y G2 y se halló diferencia
estadísticamente significativa (P < 0.001) (Tabla 2). Estos resultados
indicaron que la metodología aplicada contribuye al reconocimiento de levaduras
que son frecuentes contaminantes del material que se recoge en las pericias forenses;
siendo un recurso microscópico confiable en la resolución de casos periciales
que involucran abuso sexual, donde muchas veces, por las condiciones adversas a
las que son sometidas las muestras, es difícil determinar si son levaduras
o cabezas espermáticas.
DISCUSIÓN
La
Criminalística es una ciencia de carácter empírico e interdisciplinario, donde
se integran métodos y técnicas para verificar, examinar y analizar vestigios,
indicios y evidencias de toda índole y origen, dejados por cualquier individuo,
sea éste presunto o culpable de la comisión de un delito (Ccaza-Zapana, 2013). El semen está constituido por las
secreciones provenientes de los testículos, el epidídimo, la glándula
prostática, las vesículas seminales, las glándulas de Cowper
y de Litreé.
El
estudio de manchas de semen tiene gran importancia en criminalística, ya que
constituye una prueba precisa y está asociada a crímenes de índole sexual. El
reconocimiento es sencillo en manchas seminales de reciente data, pero se
complica al transcurrir el tiempo (Támara, 2013). Si bien, el hallazgo de un
espermatozoide es diagnóstico genérico de semen en química forense (Tratado de
Criminalística, 2007), es importante recordar que pueden no hallarse
espermatozoides en casos de violaciones realizadas por sujetos azoospérmicos e incluso oligozoospérmicos,
y en estas situaciones el estudio de marcadores bioquímicos del fluido seminal
contribuye a esclarecer el delito (Pavesi y col.,
2008; 2010; 2011).
La
mayoría de las investigaciones se focalizaron en la búsqueda de los
espermatozoides (Quispe-Mayta y col., 2010), seguidos
por los marcadores de las glándulas anexas como FAP y cinc, que adquieren
relevancia en casos de delitos sexuales realizados por sujetos azoospérmicos (Pavesi y col., 2008;
2010). Además, Támara (2013), estudió la aplicación de diferentes métodos y
recursos analíticos, según las disponibilidades de cada laboratorio para el
reconocimiento e identificación de
manchas de semen
(Támara, 2013).
En el
presente estudio, la tinción de hematoxilina verde brillante permitió la
detección positiva de semen en el 85.7 % de las 28 muestras del G1, pero solo
permitió detectar espermatozoides completos en el 28.6 % de las muestras
(dictamen positivo). La tinción de Papanicolaou fue más eficiente, determinando
semen en el 100 % de las muestras analizadas y cabezas espermáticas (espermatozoides
incompletos: dictamen presuntivo) en el 50 % de las muestras. Estos porcentajes
son mayores a los reportados por Quispe-Mayta y col.
(2010), quienes lograron la detección positiva de semen en 60 % de los casos
evaluados, aplicando la combinación de tres métodos para pesquisar fluido
seminal en muestras forenses, en 37 % de los casos detectaron presencia de
fosfatasa ácida, en 35 % encontraron antígeno prostático específico, y
espermatozoides en 25 %, aplicando tinción Fast
Nuclear Red (Quispe-Mayta y col., 2010).
El
hallazgo de un espermatozoide es un estándar de oro en la ciencia forense, pero
este caso no es de alta frecuencia, debido a la labilidad del espermatozoide
frente a cambios osmóticos y a la deshidratación, que trae como consecuencia la
observación de sólo cabezas de los mismos (Khaldi y
col., 2004). El espermatozoide es una célula con características morfológicas
especiales, y aplicando diferentes coloraciones se observa intensamente teñido
el núcleo y en forma tenue el acrosoma (WHO, 2010).
Estas peculiaridades pueden no ser óptimas en circunstancias donde el material
estuvo expuesto a condiciones desfavorables y en presencia de contaminantes
como las levaduras. En dichas condiciones se observan solo cabezas espermáticas
y debido a sus características morfológicas pueden confundirse con levaduras en
las observaciones microscópicas en fresco e incluso aplicando
coloración de Gram-Nicolle.
En
este trabajo se aplicaron técnicas microscópicas especiales como CF, LP y MF
para identificar espermatozoides en muestras contaminadas con levaduras. Los
resultados mostraron buena correlación con LP (P < 0.001) y son coincidentes
con las conclusiones de Collodel y col. (2013),
quienes evaluaron los espermatozoides con microscopio óptico, empleando tinción
Papanicolaou, LP y microscopía electrónica de transmisión, encontrando buena
correlación con LP (P < 0.01). Por otra parte, si bien Collodel
y col. (2013), aplicaron los recursos microscópicos mencionados, no trabajaron
con CF, que es una de las metodologías empleadas en el presente estudio, en la
cual, se obtuvo el mayor coeficiente de correlación (r = 0.966; P < 0.001) (Figura 1A).
Otras
de las tecnologías aplicadas fueron la MCF y las tinciones blanco de calcofluor-azul de Evans y naranja de acridina, mediante
las cuales, se logró identificar las levaduras presentes en las muestras (P =
000). En cuanto a la confiabilidad que demuestra la aplicación de blanco de calcofluor-azul de Evans en el reconocimiento de levaduras,
los resultados del presente trabajo son comparables a los de Sánchez-Armendáriz
y col. (2013), autores que evaluaron la aplicación de esta tinción en el diagnóstico
de onicomicosis y encontraron 65 % de pruebas
positivas para levaduras aplicando blanco de calcofluor-azul
de Evans. Además, Vázquez y col. (2016), utilizaron blanco de calcofluor para estimar la biomasa fúngica en muestras de
suelo y obtuvieron resultados sensibles a los cambios climatológicos y
comparables con los obtenidos por otros autores que habían aplicado
metodologías más sofisticadas en la identificación de hongos (Vázquez y col.,
2016). Otra técnica utilizada es la de hidróxido de potasio negro de clorazol que dio el 47 % de resultados positivos ob-tenidos (Collodel y col.,
2013; Sánchez-Armendáriz y col., 2013).
Disponer
de una técnica que permita reconocer levaduras, que son contaminantes
frecuentes en las muestras periciales relacionadas con delitos sexuales
sometidas a condiciones ambientales desfavorables, es un aporte importante a la
hora de tener que definir si se está en presencia de cabezas espermáticas o son
levaduras que contaminan la muestra (Pavesi y col.,
2015). Y la confirmación de la presencia de semen en materiales sometidos a
condiciones desfavorables, a través de la utilización de distintas tinciones y
recursos microscópicos, brinda un alto grado de cer-teza,
aunque solo se observen cabezas espermáticas,
lo que facilita
el trabajo parcial.
CONCLUSIONES
El
diagnóstico genérico del semen se ha detenido en su evolución, debido a la
falta de aplicación de técnicas adecuadas y modernas que aporten mayor
credibilidad al hallazgo. La aplicación de diferentes tinciones y recursos
microscópicos superadores de la microscopia óptica, como el contraste de fases,
luz polarizada y microscopia fluorescente con naranja de acridina como fluorocromo, contribuyen al esclarecimiento de muchos casos
periciales. La microscopia confocal combinando blanco
de calcofluor y azul de Evans permitió detectar la
presencia de levaduras que son frecuentes contaminantes de las muestras
forenses. Los recursos presentados en este estudio contribuyen al diagnóstico
de casos periciales de violación caracterizados como positivos y presuntivos.
REFERENCIAS
Afanador-Contreras, M. I. y Caballero-Badilla, M. C. (2012).
La violencia sexual contra las mujeres. Un enfoque desde la criminología, la victimología y el derecho. Refexión
Política. 14(27): 122-133.
Aguilar-Cabrera, D. A. (2013). Una realidad insostenible en
el Perú, en Apuntes sobre la violación sexual contra menores de edad.
[En línea]. Disponible en:
http://larepublica.pe/05-10-2013/acusados-de-violacion-impunes-ante-la-ley.
Fecha de consulta: 28 de noviembre
de 2016.
Alberts, B., Bray, D., Hopkin, K., Johnson,
A., Lewis, J., Raff, M., and Walter, P. (2006). Introducción
a la Biología Celular. Buenos Aires:
Panamericana. 10 Pp.
Andrade-Rubio, K. L. (2016). Víctimas de trata: mujeres migrantes,
trabajo agrario y acoso sexual en Tamaulipas. CienciaUAT. 11(1): 28-36.
Arroyo-Sánchez, G. (2016). Valoración Médico Legal de la
víctima de delito sexual. Medicina Legal de Costa Rica. 33(1): 126-132.
Brito, L. F., Greene, L. M., Kelleman, A., Knobbe, M., and
Turner, R. (2011). Effect of method
and clinician on stallion sperm morphology evaluation. Theriogenology.
76(4): 745-750.
Carma, I.
(2010). Métodos de Reconocimiento, Identificación e Individualización de
manchas de semen. [En línea]. Disponible en:
http://www.criminalistica.net/.../index.php?...metodos-de-reconocimiento-identificacion-e-i.
Fecha de consulta: 31 de marzo
de 2017.
Ccaza-Zapana, J. E. (2013). La nueva criminalística, en Sociedad
Mexicana de Criminología capítulo Nuevo León, A.C. [En línea]. Disponible
en: http//:www.somecrimnl.es.tl.
Fecha de consulta: 2 de julio de 2016.
Collodel, G., Iacoponi, F., Mazzi, L., Terzuoli, G., Pascarelli, N. A.,
and Moretti, E. (2013). Light, polarizing,
and transmission electron microscopy: three methods for the
evaluation of sperm quality. Systems biology in reproductive medicine.
59(1): 27-33.
Cortés-Arboleda, M. R., Cantón-Duarte, J. y Cantón-Cortés,
D. (2011). Naturaleza de los abusos sexuales a menores y consecuencias en la
salud mental de las víctimas. Gaeta Sanitaria. 25(2):
157–165.
Dickens, B. (2015). Ethical issues after sexual assault. B. International Journal of Gynecology and Obstetrics. 128:
187-188.
Espín-Falcón, J. C., Valladares-González, A. M.,
Abad-Araujo, J. C., Presno-Labrador, C. P. y Gener-Arencibia, N. (2008). La violencia un problema de
salud. Revista Cubana de Medicina
General Integral. 24(4):
1-6.
Fernández-Moreno, S. Y. (2015). Postura de la Red
Latinoamericana de Género y Salud Colectiva de ALAMES frente a la cobertura
universal de salud. Ciudad de La Habana.
Revista Cubana Salud
Pública. 41(2): 349-350.
Fleitas, D.
M. (2014). Delito y violencia en América Latina y el Caribe: Perfil de los
países de la región. Ciudad Autónoma de Buenos Aires: Edición de la
Asociación para el Análisis de Políticas
Públicas. 25 Pp.
Forbes, B. A., Scottn, E. G., and Weissfeld, A. S. (2009). Bailey y Scott Diagnóstico
Microbiológico. Buenos Aires: Panamericana. 705 Pp.
Gianaroli, L., Magli, M. C., Ferraretti, A. P., Crippa, A., Lappi, M., Capitani,
S., and Baccetti, B. (2010). Birrefringence
characteristics in sperm
head sallow for the selection of reacted spermatozoa for intracytoplasmic sperm injection. Fertility and Sterility. 93(3): 807-813.
Guarner, J.
and Brandt, M. E. (2011). Histopathologic
diagnosis of fungal infections
in the 21st century. Clinical microbiology reviews. 24(2): 247-280.
Khaldi, N.,
Miras, A., Botti, K., Benali,
L., and Gromb, S. (2004). Evaluation
of three rapid detection methods for the forensic
identification of seminal fluid in rape cases. Journal of
Forensic
Science. 49(4): 1-5.
López-García, M. J., Urbano-Felice,
A. y Cárdenas-Povedano, M. (2012). Manual de laboratorio para análisis del
semen, en Omnia Science.
[En línea]. Disponible en: http://www. omniascience.com/scholar/index.php/scholar/article/download/4/6. Fecha de
consulta: 17 de octubre de 2013.
Ministerio Público Fiscalía de la Nación – Lima, Perú
(2014). Víctimas de feminicidios registrados en Perú-julio 2014. Estadísticas
sobre Feminicidio según las características de las víctimas y el presunto
victimario-julio 2014. [En línea]. Disponible en: http://www.portal.mpfn.gob.pe/boletin_informativo/infoestadfeminicidio.
Fecha de consulta: 30 de marzo de 2017.
OMS, Organización Mundial de la Salud (2013). Informe de la
OMS destaca que la violencia contra la mujer es “un problema de salud global de
proporciones epidémicas. Nuevas guías de práctica clínica y de políticas
lanzadas para orientar la respuesta del sector salud, en Comunicado de
prensa 20 de junio de 2013 Ginebra. [En línea]. Disponible en: http://www.who.int/mediacentre/news/releases/2013/violence_against_women_20130620/en/. Fecha de consulta: 30 de
marzo de 2017.
Pavesi, A., Ombrella, A., Cadierno, A., Kuverling, L., Mansilla, R., Paparella,
C. y Bouvet, B. (2015). Aplicación del microscopio confocal para la identificación de espermatozoides o
cabezas espermáticas en presencia de levaduras con fines forenses. Revista
de la Asociación Bioquímica Argentina. 71(1): 80.
Pavesi, A., Paparella, C., Bouvet, B., and Pituelli, N. (2008). Prostatic acid phosfatase activity in basal seminal plasma and post exposition to hight temperature. Biocell.
32(3): 29.
Pavesi, A., Paparella, C., and Bouvet, B.
(2011). Lactate deshidrogenase: activity
in human seminal plasma. Biocell. 35(2): 179.
Pavesi, A, Servidio, A., Paparella, C., Girolami, H. y Bouvet, B. (2010).
Valoración de cinc en manchas seminales y su aplicación en
la práctica forense. CienciaUAT. 4(3): 69-73.
Quispe-Mayta, S., Tarifa-Espinoza,
S., Solíz-Pacheco, R., and Sierra-Gareca,
A. (2010). Investigación forense del fluido seminal en víctimas de violencia
sexual, por el Laboratorio de Biología
Forense. BIOFARBO. 18(2): 91-99.
Saldaña, C., Morales-Tlalpan, V., and Castaño, V. N. (2010).
Confocal microscopy: from fundamental optics to innovative applications. In A.
Méndez-Vilas and J. Díaz (Eds.), Microscopy: science, technology, applications and education.
[En línea]. Disponible en:
http://www.formatex.info/microscopy4/1350-1355.pdf. Fecha
de consulta: 3 de noviembre
de 2016.
Sánchez, R. (2015). Abuso sexual en menores de edad,
problema de salud
pública. Unifé.
Av. Psicol. 23(1): 62.
Sánchez-Armendáriz, K., Fernández–Martínez, R. F.,
Moreno-Morales, M. E., Villegas-Acosta, L., Meneses-González, F. y
Arenas–Guzmán, R. (2013). Sensibilidad y especificidad del examen directo
micológico con blanco de calcofluor para el
diagnóstico de onicomicosis. Medicina Cutánea
Ibero-Latino-Americana. 41(6):
261-266.
Stander, V.
A. y Thomsen, C. J. (2016). El acoso sexual y asalto
en el ejército de Estados Unidos: Un examen de las tendencias de política y de
investigación. Medicina Militar. 181: 20-27.
Támara, K. L. (2013). Reconocimiento e identificación de
manchas de semen en diferentes soportes de interés forense. [En línea].
Disponible en: http://guzlop-editoras.com/web_des /bio01/bioforense/pld0638.pdf. Fecha de consulta: 12 de
agosto de 2013.
Tratado de Criminalística de la Policía Federal Argentina
(2007). La química Analítica en la Investigación del Delito. [En línea].
Disponible en: http://doggy.blogcindario.com/2007/09/00008investigacion-de-espermios.html. Fecha de consulta:
2 de abril de 2017.
Turvey, B.
F. (2014). Forensic victimilogy
examining violent crime. Victims in investigative and Legal Context. Reino Unido:
Elseiver.
546 Pp.
Vázquez, M. B., Amodeo, M. R. y Bianchinotti, M. V. (2016).
Estimación de la biomasa fúngica en un suelo del sudoeste de la
provincia de Buenos Aires (Argentina) con una tinción directa con Blanco de Calcofluor. Revista Argentina de Microbiología. 48(3): 252-258.
Vega-Vega, C., Navarro-Escayola, E. y Edo-Gil, J. C. (2014).
Protocolo de actuación médico forense en los delitos contra la libertad sexual.
Revista Española de Medicina Legal. 40(3):
120-128.
Villarroel-Rodríguez, P. y Santa Cruz-Rodríguez, A. (2011).
Identificación de especies de levaduras del género Candida
aislados de exudados vaginales de pacientes en el Hospital Materno Germán Urquídi. Gaceta Médica Boliviana. 34(2): 84-86.
WHO, World Health
Organization (2010). WHO laboratory
manual for the examination of human semen and sperm
servical-mucus interaction.
[En línea]. Disponible en:
www.cnrha.msssi.gob.es/bioetica/pdf/semen_humano.pdf. Fecha de consulta: 30 de
marzo de 2017.