Bebida fermentada
elaborada con bacterias ácido lácticas aisladas del pozol
tradicional chiapaneco
Fermented drink elaborated with lactic acid bacteria
isolated from chiapaneco traditional pozol
Arturo
Velázquez-López 2,
David Covatzin-Jirón 1,
María
Dolores Toledo-Meza 1, Gilber Vela-Gutiérrez 1*
*Correspondencia: gilber.vela@unicach.mx/ Fecha de recepción: 21 de octubre de 2016/ Fecha de aceptación: 22 de septiembre
de 2017.
1Universidad de Ciencias y Artes de Chiapas, Facultad de Ciencias de la Nutrición y Alimentos, Laboratorio
de Investigación y Desarrollo
de Productos Funcionales,
Ciudad Universitaria, Libramiento
Norte Poniente núm. 1150,
col. Lajas Maciel, Tuxtla
Gutiérrez, Chiapas, México, C.P. 29000. 2Unidad de Investigación y Desarrollo en Alimentos del Instituto Tecnológico de
Veracruz.
RESUMEN
El lactosuero es uno de
los principales residuos
de la industria quesera, toda vez que contiene
nutrientes de alta calidad (lactosa 4.5 %, proteínas solubles 0.7 % y compuestos bioactivos), lo
que lo hace una buena fuente para la fermentación por medio de bacterias ácido
lácticas (BAL). En
Chiapas, existen bebidas fermentadas típicas, una de ellas es el pozol, la cual contiene gran
cantidad de microorganismos benéficos. El objetivo de esta investigación
fue establecer la capacidad de fermentación de bacterias ácido lácticas,
provenientes del pozol
chiapaneco fermentado, para elaborar una bebida a base de lactosuero,
adicionada con mermelada
de sabor a piña-coco, y evaluar su potencial probiótico
y su aceptación organaléptica. Se aislaron e
identificaron BAL provenientes de pozol, y se
seleccionaron las de mayor capacidad fermentativa y potencial probiótico.
La evaluación organoléptica se realizó con 20 jueces no
entrenados, con edades de
entre 14 y 20 años. Las pruebas bioquímicas y el
potencial probiótico demostraron que el pozol fermentado contenía bacterias
benéficas para el consumo humano, por lo que se
consideró una bebida probiótica. La bebida fermentada obtenida con cepa de pozol presentó el mayor nivel de agrado (P < 0.05) y 2 x 107 UFC/mL. Los resultados de
este estudio abren la posibilidad de la utilización del lactosuero para la elaboración de bebidas
fermentadas ricas en probióticos y con buena aceptación organoléptica.
PALABRAS
CLAVE: suero lácteo, probióticos,
fermentación, bebida.
ABSTRACT
One of the main residues in Chiapas comes from the cheese industry,
whey, which contains high quality nutrients (lactose 4.5 %, soluble proteins 0.7 % and bioactive
peptides). By containing optimum amounts of sugars, it is a good source for fermentation by means of lactic
acid bacteria (LAB). In Chiapas, there
are typical fermented beverages, one of which is
pozol, which contains many beneficial microorganisms.
Therefore, the following research was carried out, which consisted of isolating, identifying and evaluating the fermentation capacity of lactic acid bacteria, as well as the probiotic potential, from the fermented chiapaneco pozol, to make
a whey-based beverage added with jam of pineapple-coconut flavor. Firstly, BAL were isolated, and identified through basic biochemical
tests. Those with the greatest
fermentative capacity and probiotic potential were then selected. The level of enjoyment
was evaluated by a group of 20 untrained
judges (14 and 20 years).
The biochemical tests and probiotic potential showed that the fermented
pozol contains bacteria beneficial to human consumption: therefore, it was considered probiotic drink. The fermented
beverage with the pozol strain showed the highest
level of liking (P < 0.05) and 2 x 107 CFU/mL. The results
of this
study open up the possibility for the use of whey in the preparation of fermented beverages with probiotics and good organoleptic acceptance.
Keywords: whey, probiotics, fermentation, beverage.
INTRODUCCIÓN
En México, las
bebidas fermentadas han sido de gran importancia en la vida diaria y ceremonial de numerosos grupos
indígenas, desde la época
prehispánica hasta la actual. Los lacandones utilizan el pozol no solo en los
rituales, sino también mezclado con miel para bajar la fiebre y controlar la diarrea (Vela-Gutiérrez y col., 2012). El pozol
es una bebida de maíz que se consume en el sureste de México y en algunos
países de Centroamérica. Se puede consumir recién elaborado o fermentado. Tradicionalmente se consume
solo (pozol blanco), aunque también es común agregarle
cacao o coco (Jiménez
y col., 2010).
El pozol, al ser una bebida fermentada no alcohólica, contiene
gran cantidad de microrganismos benéficos, como algunas bacterias lácticas, las
cuales se desarrollan durante la fermentación. Estas son las responsables de la acidificación de la masa, por la producción de una
mezcla de ácidos; y además, imparten un sabor fresco y agradable al producto.
También contienen bacterias como Achromobacter pozolis
o Agrobacterium
azotophilum, que fijan
el nitrógeno atmosférico
y que podrían ser las responsables del alto contenido de nitrógeno del
pozol (Flores, 2008).
Las bacterias
ácido lácticas (BAL) están presentes en la alimentación del hombre desde hace
mucho tiempo y es posible encontrarlas en diferentes productos. Desde años
atrás, los microorganismos probióticos se han
reconocido como microorganismos benéficos, evitando el desarrollo de microorganismos patógenos
(Martin-del-Campo y col., 2008). Entre los efectos del consumo de probióticos,
sobre la salud humana, se encuentran la
disminución de la intensidad y duración de diarreas virales, asociadas a antibióticos o por hospitalización;
además, ayudan a la síntesis y absorción de nutrimentos (vitaminas), inhiben la actividad de enzimas implicadas en la generación de
carcinógenos, participan activamente en la movilidad intestinal; esto último se
atribuye a la producción de ácido láctico, que estimula los movimientos peristálticos
del intestino, contribuyendo así a la excreción adecuada, evitando con ello el
estreñimiento, ya que se
retienen menos tiempo las heces y se contribuye a evitar la formación de sustancias cancerígenas en el intestino
grueso (Parra, 2010).
Del total de
leche producida en el estado de Chiapas (423.6 millones de L), casi el 39 % se utiliza en la elaboración de quesos (aproximadamente 165.2 millones de
L), desechándose
alrededor de 147.03 millones de L de lactosuero con
alto valor nutricional a los
ríos, consecuentemente,
causando graves problemas
ambientales
(Vela-Gutiérrez y col., 2012); considerando que el lactosuero
contiene aproximadamente 1 % de proteínas, anualmente se desperdician alrededor
de 1.47 millones de kg de proteína de buena calidad en el
estado. El principal componente del suero de
leche es la lactosa, un azúcar fácilmente asimilable por las BAL. Algunas de
las ventajas nutricionales
del consumo de suero lácteo, son su alto contenido
de aminoácidos ramificados y potenciadores del sistema inmune, que escapan intactos al proceso de digestión, por lo tanto, son capaces de retener sus
valores específicos hasta
ser absorbidos por la pared intestinal larga (Vela-Gutiérrez y col., 2012). Las
propiedades funcionales del lactosuero son brindadas
por dos principales proteínas, α-lactoalbúmina y β-lactoglobulina. La α-lactoalbúmina
está formada por una sola cadena polipeptídica de 123
aminoácidos, con peso molecular de unos 14 200 Da y
tamaño de partículas entre 1 μm a 2 μm (Callejas y col., 2012); de ellas, destaca su solubilidad, si no se calientan; sus
propiedades emulsionantes, espumantes y su capacidad gelificante.
El objetivo de
la presente investigación fue determinar la capacidad fermentativa de bacterias ácido lácticas, provenientes de pozol fermentado
chiapaneco, así como el potencial probiótico, para su uso en la elaboración de una bebida fermentada a base de lactosuero,
adicionada con mermelada de sabor a piña-coco; además de evaluar el nivel de
agrado de esta
bebida.
MATERIALES
Y MÉTODOS
Aislamiento, selección
y purificación de BAL
Muestras
Con el fin de aislar cepas con potencial probiótico, se tomaron muestras de pozol fermentado provenientes de dos zonas del estado de Chiapas, donde aún existen poblaciones indígenas que pertenecen a la cultura zoque (Tuxtla Gutiérrez y Venustiano Carranza). Las cepas se adquirieron en los mercados locales de las ciudades de Tuxtla Gutiérrez (A, C, E y G) y Venustiano Carranza (B, D, F y H), las cuales, se transportaron en bolsas de plástico estériles y refrigeradas, al Laboratorio de Investigación y Desarrollo de Productos Funcionales (LIDPF), de la Facultad de Ciencias de la Nutrición y Alimentos de la Universidad de Ciencias y Artes de Chiapas; las muestras se procesaron, tal y como se describe a continuación. Además, se utilizó un cultivo iniciador Streptoccocus termhopylus (ST), donado por la empresa PRADEL®, y Lactobacillus casei (YK), aislado de un producto comercial.
Aislamiento
y selección de BAL
Las muestras de
pozol se bolearon manualmente
en condiciones asépticas. Cada bola, formó una unidad experimental, 8 en total; se envolvieron en hojas de
plátano (previamente desinfectadas), y se colocaron dentro de bolsas de
plástico; una unidad de cada tipo se incubó para su fermentación en condiciones
diferentes (A y B: pozol blanco, se almacenaron a temperatura ambiente; C y D: pozol blanco, a temperatura de refrigeración; E y F: pozol con
cacao a temperatura ambiente; G y H: pozol con cacao, a temperatura de refigeración), durante
5 d, para su posible
fermentación. La fermentación
a 4 °C se utilizó como control negativo. Se tomaron 10 g del interior de cada unidad experimental
y se mezclaron con 90 mL de agua destilada desionizada estéril (dilución 1:10), y se hicieron diluciones seriadas (1:100, 1:1 000,
1:10 000 y 1:100 000); se extrajo 1 mL de cada dilución y se inoculó por vaciado en placa [15 mL a 20 mL de
Agar Man, Rogosa y Sharpe (MRS) DIFCO®],
de acuerdo con la NOM-092-SSA1-1994. Las placas inoculadas se incubaron a
37 ºC durante 24 h; el ensayo se realizó por triplicado y los resultados se
expresaron como Log UFC/g. De cada placa de cultivo que contenían entre 30 UFC a 300 UFC, se
seleccionaron las que
morfológicamente correspondían a BAL, y se subcultivaron
mediante estría cruzada en placas con agar MRS, incubándose después a 37 ºC por 48 h. Se realizaron cuatro
subcultivos bajo las mismas condiciones, para purificar y seleccionar
las cepas. De cada cultivo, se tomaron muestras a las que se les realizó prueba
de tinción de Gram, prueba de catalasa y oxidasa para
confirmar que correspondían a BAL.
Evaluación de las
propiedades probióticas in vitro
(potencial probiótico)
Tolerancia
a cambios de pH
Se prepararon
placas con agar MRS, ajustando el pH del medio de cultivo a 4.0, 5.0, 6.0 y 7.0; se cuantificó la supervivencia y resistencia al cambio de pH de las
bacterias posterior a su incubación a 37 °C durante 24 h, se compararon con
microorganismos viables del inóculo; el porcentaje de
resistencia se calculó de
acuerdo a la ecuación publicada de Khagwai
y col. (2014):
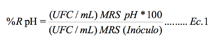
Las cepas que
resistieron como mínimo el 50 % al cambio de pH (A, B, E y F), fueron a las que se les realizó el
resto de las pruebas, y que se describen en seguida, sin embargo, se utilizaron las demás cepas como
control negativo (C, D, G y H) a las pruebas realizadas. Las cepas conocidas (ST y YK) (Tabla
1) no se utilizaron en
estas pruebas, debido a que ya fueron identificadas
previamente (Gutiérrez y col., 2007; Arenas y
col., 2012).
Tolerancia
a sales biliares
Las cepas se
inocularon en agar MRS, adicionado con sales biliares (DIBICO®, México) en concentraciones de 0.05 %, 0.1 %, 0.15 % y 0.3 % (p/v); el pH del medio se ajustó a 7.0. Los cultivos se incubaron a 37 °C durante 24
h, al cabo de este tiempo, se efectuó el conteo de células viables mediante
UFC/mL, considerando de esa
forma la sobrevivencia microbiana y su resistencia a sales biliares (Rubio y col., 2008; Soliman y
col., 2015).
Tolerancia
a cambios de temperatura
Las cepas
aisladas se inocularon en
cajas petri con agar MRS, a un pH 6, y se incubaron a diferentes temperaturas (28 °C, 37 °C y 43 °C) durante 24 h; pasado este tiempo, se efectuó el conteo
de células viables mediante UFC/mL, considerando de esa forma la sobrevivencia
microbiana y su resistencia para crecer a distintas
temperaturas (Rubio y col., 2008; Cueto y col.,
2012).
Tolerancia
a altas concentraciones de NaCl
Las cepas
aisladas se inocularon en tres medios distintos de cultivo líquidos (MRS, malta y nutritivo), con un pH de
6, adicionándoles diferentes concentraciones de NaCl
(2 %, 4 %, 7 % y 10 %), y se incubaron a 37 °C durante 24 h; transcurrido el
tiempo, se determinó la viabilidad y el crecimiento microbiano a altas
concentraciones de NaCl, midiendo la densidad óptica
(DO) del caldo de cultivo de 0 a 24 h
a 600 nm.
Prueba
de antagonismo
Se inoculó Salmonella sp. mediante estría superficial
en agar Müeller-Hinton; se colocaron tres discos de 2
cm de diámetro impregnados con el cultivo líquido de las bacterias aisladas; se
preincubaron a 15 ºC
durante 30 min; luego a 37 °C por 48 h. La acción antagónica se evidenció por
la presencia de halos de inhibición y crecimiento alrededor de los discos (Pérez
y col., 2015).
Cinética microbiana en
leche y lactosuero
Previo al
desarrollo de la cinética microbiana, el suero lácteo fue pasteurizado.
Después, se inocularon individualmente las cepas aisladas que presentaron
potencial probiótico adecuado (A y F), así como las
cepas controles [Lactobacillus
casei Shirota (YK) y Streptoccocus
termhopylus (ST) - Lactobacillus bulgaris (LB] en matraces que contenían 450 mL de
leche pasteurizada
(PRADEL®) o suero lácteo; el inóculo se transfirió
con un asa calibrada estéril (de 3 a 4 asadas por matraz, aproximadamente 1 % de inóculo). Para el cálculo de los parámetros cinéticos se linealizó la fase
exponencial, seguido del
cálculo de la
ecuación de la
recta.
El análisis se
realizó cada 2 h, midiendo los parámetros
que se describen
a continuación:
Determinación
de peso seco
Se tomaron 5 mL de cada muestra y se colocaron en tubos de ensayos
previamente pesados y calibrados; se
centrifugaron a 4 000 rpm
durante 10 min y se eliminó el sobrenadante. Posteriormente, se secó en una
estufa (TER-LAB, TE-H450, Nogales, Jalisco) a 105 °C durante 3 h hasta obtener el peso constante. Se registró el peso de cada tubo utilizando una balanza
analítica (TE601, Sartorius®, EUA) y se cuantificó
la biomasa en g/mL.
Determinación
de pH
Se determinó cada
2 h durante la fermentación de acuerdo al método
publicado por Pérez y col.
(2015), utilizando un
potenciómetro (pH 209, HANNA®
instruments, Rumania).
Determinación de
acidez titulable
Se determinó cada
2 h; se tomaron 10 mL de leche o suero lácteo y se colocaron en matraces Erlenmeyer de 125 mL; se les adicionó 1 mL de solución
fenolftaleína (9 gotas aproximadamente) y se homogeneizó. Se tituló con NaOH 0.1 N. La acidez (ºD), se
obtuvo a través de la
cantidad de hidróxido de sodio gastado (mL) para
neutralizar la leche o suero lácteo (1 mL de hidróxido de sodio equivale a 10
° D).
Elaboración de la
bebida fermentada
Una vez aisladas
y seleccionadas las cepas que resistieron las pruebas
anteriores (A y F), se
prosiguió a desarrollar la bebida fermentada.
Primero, se inocularon tres matraces con 150 mL,
conteniendo suero de leche previamente pasteurizada, con las bacterias Streptococcus thermophylus-Lactobacillus bulgaris (cultivo iniciador). Se incubaron a 35 ± 1 °C durante las
primeras 24 h. Entonces,
se inoculó en cada matraz las cepas aisladas de pozol blanco (A), pozol con cacao (F) y otro con la cepa Lactobacillus casei (YK) (control). Todos los tratamientos se incubaron bajo las mismas condiciones del cultivo iniciador. Previo a la fermentación,
se seleccionaron las cepas con mayor velocidad de producción de ácido láctico y
al tiempo de duplicación. Al término del proceso se determinaron, el pH y el porcentaje de ácido láctico, bajo
los métodos descritos
anteriormente, así como la biomasa (UFC/mL) en la
bebida, empleando la técnica
de dilución y vaciado en placa, mediante el procedimiento establecido en la
NOM-092-SSA1-1994, que indica como mínimo una concentración
de bacteria probiótica de 1X106 UFC/mL o g. El
crecimiento de cada cepa
se corroboró por su morfología común, además de observarlas por
medio de microscopía. A la
bebida fermentada, se le adicionó mermelada de
piña con coco (63 °Brix); la mezcla se efectuó en una relación de 70:30
(bebida fermentada:
mermelada).
Análisis fisicoquímico
El análisis fisicoquímico (proteína cruda, sólidos totales, lactosa, densidad, pH, acidez y cantidad de grasa) del lactosuero, así como de la bebida elaborada se efectuó de acuerdo a la NOM-155-SCFI-2012. La cantidad de grasa se determinó de acuerdo a lo publicado por Durán (1999), tal y como se describe en la ecuación 2.
%SST= (0.25 L) + 1.22 G9 + 0.55 ... ... ... Ec. 2
Donde, %SST= % de
sólidos totales; L: densidad obtenida con el lactodensímetro; G: porcentaje de
grasa
Análisis
microbiológicos
A la bebida obtenida
se le determinó coliformes totales de acuerdo a la NOM-092-SSA1-1994, mohos y levaduras mediante la
NOM-111-SSA1-1994, bacterias coliformes
fecales conforme a la técnica del número más probable de acuerdo a la NOM-112-SSA1-1994; y la
presencia de Staphylococcus aureus con
el método marcado
en la NOM-115-SSA1-1994.
Análisis sensorial
A cada una de
las tres bebidas formuladas (A, F y YK), se les determinó el nivel de agrado o preferencia, evaluándose sensorialmente con un grupo de 20 jueces no entrenados.
Los atributos analizados fueron el sabor, aroma y textura. Para esto, se mostraron tres
niveles de agrado: “Me agrada, no me agrada ni me desagrada, me desagrada”. La
prueba se desarrolló de acuerdo a la metodología publicada por Vela-Gutiérrez y
col. (2012).
RESULTADOS
Y DISCUSIÓN
Aislamiento, selección
y purificación de BAL
Aislamiento
y selección
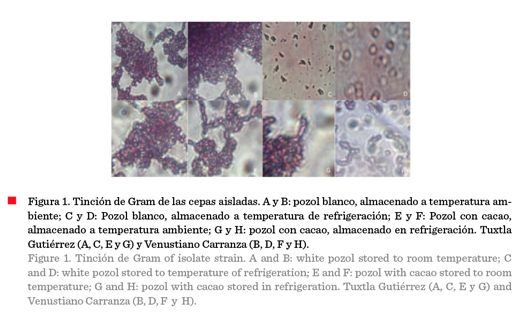
De las ocho muestras analizadas, solo dos de las cepas aisladas del pozol blanco (A y B) y pozol con cacao (E y F), presentaron características típicas de BAL [macromorfología, tinción Gram (+), catalasa y oxidasa negativa]. Los resultados de las pruebas de tinción de Gram se muestran en la Figura 1, de las cuales, las cepas A, B, E, F resultaron Gram +, presentando también catalasa + y oxidasa +, mientras que las cepas aisladas de la masa fermentadas a 4 ºC presentaron características no deseadas. Resultados similares fueron reportados por Olagnero y col. (2011), en un estudio de capacidad probiótica de cepas del género Lactobacillus, extraídas del tracto intestinal de animales de granja, en el que se seleccionaron e identificaron cuatro cepas de Lactobacillus con potencial para ser utilizadas como aditivos probióticos en la alimentación animal. En las placas con agar MRS, las cepas BAL formaron colonias cuyo tamaño fue alrededor de 1 mm a 2 mm, de color blanco cremoso, forma redonda, puntiforme, bordes enteros, consistencia húmeda; características propias de este grupo de bacterias de acuerdo a lo reportado por Sánchez y col. (2016).
Pruebas de probióticos in vitro (potencial probiótico)
La Organización
de las Naciones Unidas para la Agricultura y la Alimentación (FAO) y la Organización
Mundial de la Salud (OMS), establecieron criterios de selección para microorganismos
en el “Informe del grupo de trabajo sobre la redacción de directrices
para la evaluación de los probióticos
en los alimentos” (FAO, 2015). Uno de los criterios de selección in vitro es la resistencia de la acidez estomacal y las sales biliares del
intestino delgado (Santillan-Urquiza y col., 2014),
por lo que los primeros ensayos realizados en este
estudio se fincaron en el desarrollo de estas pruebas, para
seleccionar las cepas con potencial probiótico;
seguidamente, se eligieron las cepas tolerantes de estas condiciones y se
ensayaron las pruebas de antagonismo contra Salmonella
spp.
Tolerancia a
cambios de pH
Las cepas
aisladas de muestras de
pozol blanco y pozol con cacao (A, B, E y F), almacenadas a temperatura
ambiente, resistieron los cambios de pH durante 24 h, mostrando mayor
crecimiento a valores cercanos a 4.0, que el resto de las bacterias aisladas,
con un crecimiento del 55 %, comparadas con las que se mantuvieron en
refrigeración, que alcanzaron un 15 % máximo al mismo pH, evidenciándose de esa
manera su supervivencia en condiciones ácidas; características similares fueron
obtenidas por Lara y Burgos (2012), quienes indicaron que aquellas bacterias
con potencial probiótico deben de sobrevivir y
resistir a cambios de pH
(neutro a ácido); generalmente los probióticos que
resisten pH muy ácido
(<4) pertenecen a la familia de Lactobacillus (Cueto
y col., 2010).
Tolerancia
de sales biliares
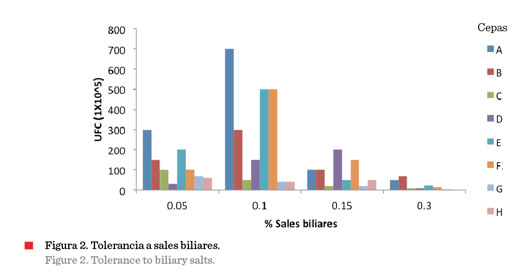
En la Figura 2,
se puede observar que las
cepas seleccionadas son
capaces de tolerar las sales biliares en un intervalo
de 0.05 % a 0.3 % (p/v). De acuerdo con Ruiz y col. (2016)
aquellas bacterias que
sobreviven a ciertas concentraciones de sales biliares tienen actividad metabólica que permitirá la
colonización del intestino, ya que entran en
contacto directo con sales
biliares en el
intestino delgado.
Tolerancia
a
cambios de temperatura
La mayoría de las
cepas seleccionadas (A, B, C, D, F, G y H) crecieron adecuadamente a las temperaturas de 28 ºC y
37 ºC; a 43 °C, el
crecimiento fue bajo. La temperatura de 37 °C fue la que mejor favoreció el crecimiento de las bacterias. Sin embargo, las
cepas provenientes de
pozol blanco mostraron un mejor desarrollo y crecimiento a 43
°C; la adaptación y crecimiento de las bacterias a estos intervalos de temperatura, indica la posibilidad de
aplicación industrial (Tripathi y Giri, 2014). Resultados similares fueron obtenidos por Lara y Burgos (2012), donde
prevalecen los Lactobacillus.
Son considerados probióticos las bacterias que
resisten cambios drásticos de temperatura debido a que durante su transcurso dentro del tracto gastrointestinal
existen cambios de temperatura, lo cual permite que las bacterias se propaguen en el intestino
delgado (duodeno principalmente). Las bacterias probióticas deben resistir los cambios de temperatura, debido a que, en el
transcurso de la vía digestiva, se presentan estas condiciones, por lo que la
temperatura de incubación tiene que ser cercana a la
del cuerpo humano
(González-Montiel y col.,
2010).
Tolerancia
a altas concentraciones de NaCl
Se observó bajo
nivel de tolerancia a la sal (NaCl). Los medios de
cultivo adicionados con 2
% y 4 % (p/v) de sal, presentaron mayor crecimiento bacteriano, de las cepas (A, B, C, D, F, G y H),
alcanzándose un máximo de 5.6 x 10^4 UFC/mL, mientras
que en concentraciones de
7 % y 10 % el crecimiento fue limitado (1 x 10^3 UFC/mL) para las cepas provenientes de pozol blanco (A y B).
Esta propiedad es
necesaria en aquellas cepas con potencial probiótico,
debido a que el jugo gástrico contiene esta sal (2 % a 4 %), la cual es la
primer barrera fisiológica del tracto digestivo, que también corresponde a
valores bajos de pH, junto con la acción de enzimas proteolíticas
(Sánchez y
col., 2015).
Prueba
de antagonismo
Las cepas A, B, E
y F, que resistieron la prueba anterior, provenientes de pozol blanco y cacao (fermentados a
temperatura ambiente), mostraron halos de inhibición aproximadamente de 1 mm a 2 mm frente al patógeno, lo que indica la producción de sustancias
inhibitorias (principalmente ácido láctico), comparadas con las muestras control (4 ºC), que no exhibieron halos de inhibición. Otras bacterias aisladas de diferentes medios como la leche (Sánchez y Tromps,
2014) y quesos (Martindel-Campo y col., 2008) han presentado halos de
inhibición similares; los autores reportaron que la familia de Lactobacillus mostró 1.33 mm, mientras que Streptococcus
1.78 mm. La
presencia de halos de inhibición en cultivos con bacterias aisladas de muestras
de pozol fermentado, en condiciones ambientales, permite considerarlas como
cepas probióticas productoras de bacteriocinas; diferentes especies de
bacterias probióticas han sido empleadas por mucho tiempo en alimentos
fermentados, tal es el caso de Lactobacillus sp., y que además son consideradas como microorganismos generalmente reconocidos como seguros (GRAS, por sus siglas en inglés: Generally Recognocide As Safety).
La producción de bacteriocinas se ve afectada por el medio en que se desarrollen. Al respecto, Puniya y col. (2016), encontraron que: “la producción óptima de bacteriocinas es detectada en medios que tienen una
concentración limitada de azúcares, fuentes de nitrógenos, vitaminas y fosfatos de potasio,
o bajo
condiciones reguladas de
pH”.
La tolerancia a cambios de temperatura y pH
son uno de los factores
más importantes que afectan la viabilidad y
sobrevivencia de las células
probióticas (Lesbros y
col., 2016). La respuesta
obtenida de las cepas seleccionadas por la simulación del tránsito gástrico se observa en las Figuras 2 y 3,
donde los resultados del porcentaje de supervivencia muestran que las sales
biliares tienen mayor efecto que el pH ácido sobre la inhibición del crecimiento
de las cepas, aunque presentan alta tolerancia a una
concentración de 0.1 % de sales biliares (cepas de pozol blanco y cacao).
Resultados similares
fueron reportados por Sánchez y col. (2016), en un estudio donde desarrollaron
la caracterización probiótica de una cepa nativa de
quesos artesanales típicos de Perú, presentando resistencia a 0.1 % de sales
biliares y sin crecimiento a 0.25 %. Conforme el pH disminuye, la viabilidad de
los microorganismos se reduce, un efecto similar que se presenta con el cambio de concentración de sales,
al aumentar el porcentaje
de NaCl disminuye el crecimiento (Rubio y col.,
2008). González-Montiel y col. (2010), reportaron que la adaptación de las
células al ácido provoca cambios en la composición de lípidos de la membrana,
mostrando un incremento de ácidos grasos saturados.
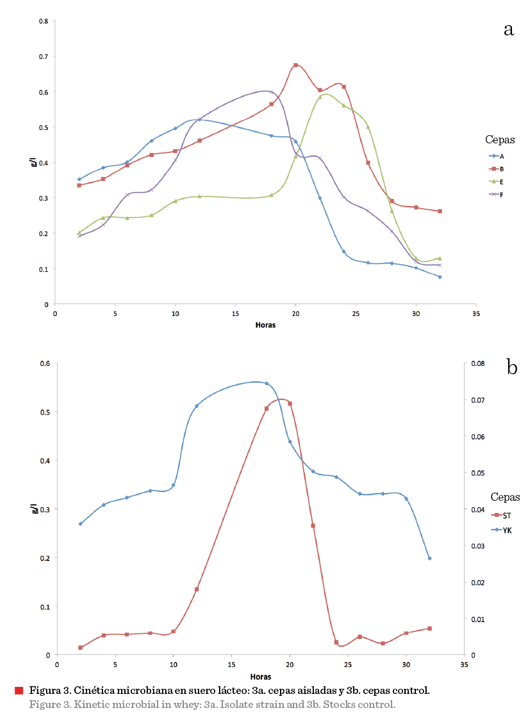
Cinética microbiana en
leche y suero lácteo
Los resultados de
la cinética microbiana en lactosuero mostraron en la
Figura 3a, que 4 de las cepas aisladas presentaron potencial probiótico de acuerdo con las pruebas in vitro. Se puede observar que la cepa A alcanzó mayor concentración de biomasa
(0.041 g/L), seguido de la cepa B con 0.038 g/L. La fase de crecimiento
exponencial en leche ocurrió en un tiempo de 8 h a 12 h (datos no mostrados), mientras en suero lácteo fue de 10 h a 20 h (datos no mostrados). Al
compararse las cinéticas microbianas de los microorganismos control Streptococcus thermophylus (ST) y Lactobacillus casei (YK) se observó una marcada diferencia
en la fase estacionaria, puesto que estas últimas lo presentaron de 20 h a 25 h
(Figura 3b), y la fase de muerte después de las 25 h. La cantidad de ácido láctico producido durante el crecimiento de las BAL es concomitante al pH determinado,
ya que los ácidos orgánicos
resultantes se acumulan y producen, consecuentemente ocurre un gradual
descenso del pH. La mezcla de cepas control, Streptococcus thermophylus - Lactobacillus bulgaris, presentaron una producción óptima al
transcurrir un lapso de 30 h, alcanzando 0.77 % de ácido láctico. En cuanto a
las cepas aisladas, la que mostró mayor producción de
ácido láctico fue la cepa
A (proveniente de pozol blanco de la ciudad de Tuxtla Gutiérrez) y la cepa F
(pozol con cacao de la ciudad de Venustiano Carranza), con una producción de
0.28 % y 0.32 %, respectivamente; de acuerdo con estos datos, ambas cepas son
las más aptas para la elaboración de la bebida. La producción de ácido láctico
favorece el desarrollo de la textura en los productos lácteos, debido a que, la
disminución de pH provoca la desestabilización de las micelas de caseína,
principalmente solubilizarían el fosfato de calcio, al igual que confiere el sabor
ácido y fresco de los productos lácteos fermentados (Parra, 2010). Durante el
desarrollo de la cinética se observó la disminución de pH. Este cambio se
encuentra directamente relacionado con la conversión de lactosa en ácido
láctico. Diversos estudios (Astashkina y col., 2014; Newaj y col., 2014; Tripathi y Giri, 2014), indicaron que bajos niveles de pH inhiben la
proliferación de las bacterias patógenas, debido a que no son resistentes a los
cambios de pH; considerando lo anterior, las cepas (A y F), causarían este
efecto, al disminuir más rápidamente los valores de pH en la bebida. El pH
sugerido para una bebida fermentada es 4, una bebida a base de suero lácteo
presenta alto contenido de calcio, el ácido láctico interacciona con el calcio presente en la red de paracaseínato, disolviéndolo como lactato de calcio,
provocando una mejor absorción de calcio en el intestino delgado (Hemaiswarya y
col., 2013).
La mayoría de las
cepas estudiadas presentaron una fase estacionaria de poco tiempo, excepto las
cepas control; este comportamiento puede deberse a la producción de ácidos orgánicos por parte de los
cultivos iniciadores
utilizados, así como al efecto de las cepas
iniciadoras al producir bactericinas para su propia adaptación al medio. Los valores más bajos de pH son concordantes con la mayor cantidad de BAL. Según Khagwai y col. (2014), indicaron que el pH, unido a las altas concentraciones de ácido láctico y ácidos
grasos volátiles, producidos por estos microorganismos, disminuyen el pH de los productos fermentados, tal y como
ocurrió en este estudio. Con los resultados obtenidos en las cinéticas
microbianas, se pudieron comparar los parámetros cinéticos: velocidad de crecimiento
y tiempo de duplicación entre las cepas, encontrándose que las cepas (A, B, E y F), provenientes de
la masa de pozol fermentado
a temperatura ambiente
(blanco A y B y pozol con cacao: E y F) crecieron y fermentaron favorablemente
el suero lácteo. El lactosuero y la leche en promedio contienen alrededor de 4.7 g de lactosa (Parra,
2008). Cueto y col.
(2012), reportaron mejor crecimiento de bacterias lácticas al combinar carbohidratos
como fuente de carbono en el medio de cultivo, comparado con aquellas fermentaciones donde solo se utiliza lactosa. El
uso de un medio de cultivo pobre en monosacáridos confiere un metabolismo
altamente adaptable para
la utilización de oligos o polisacáridos, lo que da ventaja competitiva a
cierto tipo de bacterias, afectando fuertemente los productos de la fermentación, sobre todo en la
producción de ácidos grasos de
cadena corta (Rubio
y col., 2008).
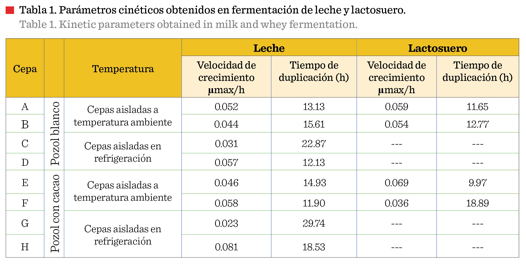
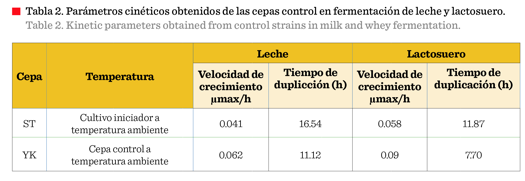
Los resultados
mostrados permitieron determinar umax/h y tiempo de
duplicación (Tabla 1); puede observarse que el mejor comportamiento se obtuvo
con las cepas aisladas del pozol blanco y pozol con cacao, ambas almacenadas a
temperatura ambiente (A y
F); estos resultados permitieron ensayar la cinética microbiana utilizando leche y suero lácteo como sustrato. Se realizó la cinética
microbiana de las cepas conocidas (Tabla 2), observándose un comportamiento similar
a las cepas aisladas a temperatura ambiente
(A y F).
Determinaciones
realizadas a la bebida fermentada
Análisis
fisicoquímicos
Los resultados
evidenciaron que la bebida elaborada con la cepa control (YK) presentó un valor de acidez del 0.060, al igual que la bebida elaborada con la cepa F, un contenido
de proteínas superior al del lactosuero, probablemente
debido a la presencia de microorganismos, ya que estos aportan suficiente
cantidad de proteínas, además de la conferida por la mermelada de piña y coco
(Tabla 3). El pH de la bebida elaborada con las cepas A y F fue de 4 a 5, lo
que limita el crecimiento de bacterias patógenas; esta reducción es consecuente
de un incremento del ácido láctico, proveniente de la degradación de la lactosa
por las BAL. Se observó que en 24 h la lactosa se había consumido casi en su
totalidad, coincidente con el momento de mayor crecimiento bacteriano (10^6
UFC/mL), y con la mayor concentración de mezcla de ácidos,
predominando el ácido láctico en la bebida (Parra, 2010). En base a los parámetros obtenidos (umax/h) en la fermentación del suero lácteo, que se muestran en la Tabla 1,
aquellas cepas que presentaron mejor
fermentación (umax/h) fueron las utilizadas para realizar las bebidas probióticas. La cantidad de proteína
que presenta la leche es superior que la del lactosuero, el contenido de grasa en lasbebidas fermentadas con las cepas A y F (Tabla 3) es mayor que, el presente en leche bronca (3.0 % a 3.3%), esto debido a que
las bebidas fueron elaborados con mermelada de piña, la cual aumentó los sólidos
totales, permitiendo obtener una bebida reducida en grasas, favoreciendo a la salud del
consumidor.
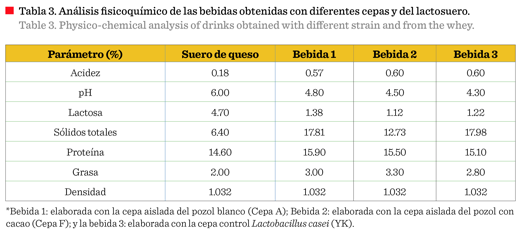
El suero lácteo y las bebidas fermentadas presentaron una densidad de 1.032 g/L, sin diferencia significativa entre el contenido de caseína, reduciendo su cantidad en el suero lácteo; la cantidad de lactosa fue de 4.70 %. Estos resultados son similares a los de Vela-Gutiérrez y col. (2012), quienes determinaron que el lactosuero contenía 5 % de lactosa y una densidad de 1.03. Las bebidas desarrolladas con las cepas A y F presentaron una acidez de 0.60 % (60 °D) y un pH menor a 5. Diversos estudios han reportado el beneficio del ácido láctico presente en las bebidas lácteas (Ortiz-Valderas, 2006); dentro de los efectos positivos se encuentra que, promueve la absorción de minerales a nivel de las células epiteliales y mejora el movimiento peristáltico. El uso de cultivos iniciadores (Streptococcus thermophylus y Lactobacillus bulgaris) permitió acondicionar el pH inicial de la bebida. Hernández y Romagosa (2014), documentaron que el empleo de este tipo de microorganismos permite aumentar la vida de anaquel de los productos inocu-
lados. Es
importante resaltar que en todas las bebidas desarrolladas se aumentó la
cantidad de proteínas totales (de 14.60 g/L a 15.90 g/L), esto debido a la presencia de células bacterianas; sin embargo, casi en
su totalidad provienen del lactosuero;
desde el punto de vista
digestivo, las proteínas del suero permanecen solubles al pH ácido, en base al pH del jugo gástrico
(pH 4); la solubilidad de las proteínas conlleva una ventaja para su absorción durante su recorrido en el tracto digestivo (Rubio y
col., 2008). El control del crecimiento de las cepas aisladas se observó a través de la cinética microbiana de la cepa control, así como
de la cepa
iniciadora.
Análisis
microbiológico
La cantidad de Lactobacillus casei presentes en las tres bebidas (2 x 107 UFC/mL) fue
superior a lo establecido
por la NOM-181-SCFI-2010 (1
X 10^6 UFC/mL), para ser considerada como una bebida probiótica.
Además, la bebida es apta
para el consumo humano, debido a que no se encontraron bacterias patógenas (Sthaphyloccocus
y coliformes totales),
aunque se observaron mohos
y levaduras (< 10 UFC). Los
resultados de este estudio mostraron una inhibición fuerte contra coliformes fecales (0 UFC/mL). León y col. (2011), registraron que los microorganismos probióticos tienen la capacidad de inhibir el crecimiento de bacterias patógenas, debido a la síntesis de bacteriocinas o a la misma producción de ácido láctico. En las
tres bebidas desarrolladas se obtuvieron una cantidad menor a 10 UFC/mL respecto a hongos y levaduras, por lo que la cantidad de estos microorganismos presentes en las bebidas se encuentra dentro de lo permitido por la NOM-111-SSA1-1994.
Análisis sensorial
El 60 % de los
panelistas prefirieron la bebida 2 (“Me agrada”), elaborada con la cepa F de
pozol con cacao fermentada a 28 ºC, seguido de la
bebida 3 (35 %), que se elaboró con la cepa control (Lactobacillus casei). La bebida 2 tuvo mejores resultados
de aceptabilidad, superiores a la bebida 3 (cepa YK). Los resultados de nivel de agrado de acuerdo a la prueba hedónica efectuada a las
tres bebidas, respecto al nivel “Me agrada” fueron los siguientes: las bebidas 2 y 3 fueron superiores y estadísticamente diferentes
(P < 0.05)
a la bebida 1
(cepa A), pero no existió diferencia estadística entre ellas. En cuanto al
nivel “Me desagrada” la bebida 1, obtuvo el mayor número, seguido de la bebida
3. La bebida 2 a ningún
juez le desagradó. Las tres muestras presentaron diferencia estadísticas (P < 0.05) para este atributo.
Considerando los tres niveles evaluados, la bebida 2 presentó el mayor nivel de agrado para los jueces;
la bebida elaborada con la cepa control (Lactobacillus casei) mostró diferencia significativa (P
< 0.05) con el resto; ésta diferencia fue corroborada mediante un análisis de ji-cuadrado.
Vela-Gutiérrez y col. (2012),
desarrollaron bebidas fermentadas, utilizando las mismas cepas control que las usadas en este estudio, y reportaron
que no existe preferencia
por alguna de las bebidas
elaboradas, debido a que el cultivo iniciador les confiere un sabor y olor similar a todas, ya que los
microorganismos utilizados son homofermentativos.
CONCLUSIONES
El pozol, bebida no alcohólica tradicional de Chiapas, perteneciente a la cultura zoque chiapaneca, contiene una gran cantidad de
bacterias, algunas de ellas con potencial probiótico, y cuyo consumo es
beneficioso para la salud humana. Del total de bacterias aisladas del pozol
fermentado blanco y con
cacao, en este estudio, dos cumplieron con dichas características; las bebidas fermentadas elaboradas con estas dos cepas cumplen con lo establecido por la normativa federal
vigente para ser
considerada como una bebida probiótica (pH y ácido
láctico); estas bacterias
analizadas pueden servir
para uso industrial, debido a la sobrevivencia a condiciones casi extremas. La presencia de bacterias probióticas,
aisladas de las muestras
de pozol, ácido láctico, proteínas y péptidos bioactivos provenientes del lactosuero, a los que se le
atribuye funciones especiales y un efecto positivo en el organismo, hacen que
sea considerada como una
“bebida funcional”.
REFERENCIAS
Arenas, C., Zapata, R., Gutiérres,
C. (2012). Evaluación de la fermentación láctica de leche con adición de Quinua
(Chenopodium quinoa). Vitae. 19(1): S276- S278.
Astashkina, A., Khudyakova,
L., and Kolbysheva, Y. V. (2014). Microbiological
quality control of probiotics
products. Procedia Chemistry. 10: 74-79.
Callejas, H. J., Prieto, G. F., Reyes, C. V.,
Marmolejo, S. Y. y Méndez, M. M. A. (2012). Caracterización fisicoquímica de un
lactosuero: potencialidad de recuperación de fósforo.
Acta Universitaria. 22(1): 11-18.
Cueto, M., Yudtanduly,
M. y Valenzuela, J. (2010). Evaluación in
vitro del potencial probiótico de
bacterias ácido
lácticas aisladas de suero costeño. Actualidades
biológicas. 32(93):
129-138.
Cueto, M., Yudtanduly,
M. y Valenzuela, J. (2012). Evaluación in vitro del potencial probiótico de bacterias ácido lácticas aisladas de suero
costeño. Actualidades biológicas. 32(93): 129-138.
Durán, P. (1999). Analiticos en alimentaria. Argentina: Centre Telemàtic Editorial. 35-37 Pp.
FAO, Food and Group Administration (2015). Probióticos en los alimentos. [En línea]. Disponible en:
http://www.fao.org/3/a-a0512s.pdf. Fecha de consulta: 5 de noviembre de 2016.
Flores, E. (2008). Pozol: Una bebida
tradicional de México. [En línea]. Disponible en: http://www.cienciorama.unam.mx/a/pdf/177_cienciorama.pdf.
Fecha de consulta: 12 de octubre de 2017.
González-Montiel, L., Delgado-Bravo, C. H.,
Pimentel-González, D. J. y Campos-Montiel, R. J. (2010). Viabilidad de cepas probioticas en leche fermentada almacenada en
refrigeración. Universidad de Guanajuato, XII Congreso Nacional de Ciencia y Tecnologia de alimentos, México. [En línea]. Disponible en:
http://webcache.googleusercontent.com/search?q=cache:2xQrF9zwHWwJ:respyn2.uanl.mx/especiales/2010/ee092010/documentos/lacteos/LA8.pdf+&cd=2&hl=es&ct=clnk&gl=mx.Fecha
de consulta: 28 de julio de 2016.
Gutiérrez, L. A., Gómez, A. J., Arias, L. y Tangarife, B. (2007). Evaluación de la viabilidad de una
cepa probiótica nativa de Lactobacillus casei en queso crema. Revista Lasallista
de Investigación. 4(2): 37-42.
Hemaiswarya, S., Raja, R., Ravikumar, R., and Carvalho, I. (2013). Mechanism
of Action of Probiotic. Brazilian Archives of Biology and Technology. 56(1): 113-119.
Hernández, A. y Romagosa,
S. (2014). Desarrollo de una leche fermentada probiótica
con jugo de Aloe vera. Tecnología química. 35(1): 81-97.
Khagwai,
N., Sharma, P., and Chand,
D. (2014). Screening and evaluation of Lacobacillus spp. for the development
of potential probiotics. African Journal of Microbiology Research. 8(15): 1573-1579.
Jiménez, R., Gonzalez,
N., Magaña, A. y Corona, A. (2010).
Evaluación microbiologica y sensorial de
fermentados de pozol blanco, con cacao (Theobroma cacao) y coco (Cocos nucifera). Revista Venezolana de Ciencia y Tecnología de Alimentos. 1(1): 070-080.
Lara, C. y Burgos, A.
(2012). Potencial probiótico de cepas nativas para su
uso como aditivos en la alimentación avícola. Revista Colombiana
de Biotecnología. 14(1):
31-40.
Lesbros, D.,
Theulaz, I., and Blum, A.
(2016). Helicobacter pylori and Probiotics. The journal of nutrition. 8(2): 812S-818S.
León, J., Aponte, J., Rojas, R., Cuadra, L.,
Ayala N., Tomás, G. y Guerrero, M.
(2011). Estudio de Actinomicetos marinos aislados de la costa central de Perú y
su actividad antibacteriana frente a Staphylococcus aureus meticilina resistentes y Enterococcus
faecalis vancomcina
resistentes. Revista Peruana de Medicina Experimental y
Salud Pública. 28(2): 237-246.
Martin-del-Campo, M., Goméz,
H. y Alaniz, R. (2008). Bacterias ácido lácticas con
capacidad antagonica y actividad bacterio-cinogénica
aisladas de quesos frescos. e-Gnosis. 6(5): 1-17.
Newaj, A., Harbi,
A., and Austin, B. (2014). Review: Developments in the use of probiotics for disease control in aquaculture. Aquaculture. 431: 1-11.
NOM-092-SSA1-1994 (1994). Productos y servicios.
Método para la cuenta de bacterias aerobias en placa. México. [En línea].
Disponible en: http://www.salud.gob.mx/unidades/cdi/nom/092ssa14.html. Fecha de
consulta: 15 de abril de 2016.
NOM-111-SSA1-1994
(1994). Bienes y servicios. Método para la cuenta de mohos y levaduras en
alimentos. México. [En línea]. Disponible en:
http://www.salud.gob.mx/unidades/cdi/nom/111ssa14.html. Fecha de consulta: 23
de abril de 2016.
NOM-112-SSA1-1994 (1994). Bienes y servicios.
Determinación de bacterias coliformes. Técnica del
número más probable. México. [En línea]. Disponible en:
http://www.salud.gob.mx/unidades/cdi/nom/112ssa14.html. Fecha de consulta: 23
agosto de 2016.
NOM-115-SSA1-1994 (1994). Bienes y servicios.
Método para la determinación de Staphylococcus aureus en alimentos. México. [En línea]. Disponible en:
http://www.salud.gob.mx/unidades/cdi/nom/115ssa14.html. Fecha de consulta: 18
de julio de 2016.
NOM-155-SCFI-2012 (2012).
Leche-Denominaciones, especificaciones fisicoquímicas, información comercial y
métodos de prueba. México. [En línea]. Disponible en:
http://www.dof.gob.mx/normasOficiales/4692/seeco/seeco.htm. Fecha de consulta:
28 de julio de 2016.
NOM-181-SCFI-2010 (2010).
Yogurt-Denominación, especificaciones fisicoquímicas y microbiológicas, información
comercial y métodos de prueba. México. [En línea]. Disponible en:
http://dof.gob.mx/nota_detalle.php?codigo=5167303&fecha=16/11/2010. Fecha
de consulta: 15 de junio de 2016.
Olagnero,
G., Abad, A., Bendersky, S., Genevois,
C., Granzella, L. y Montonati, M. (2011). Alimentos funcionales: fibra, prebióticos, probióticos y
simbióticos. DIAETA. 25(121): 20-33.
Ortiz-Valderas, M.
(2006). Identificación bioquímica de bacterias
acido lácticas aisladas a partir de productos lácteos en el estado de
Hidalgo. Universidad Autónoma del Estado de Hidalgo. Química en
Alimento. 13(43):
6-60.
Parra, R. (2008). Lactosuero:
importancia en la industria de alimentos. Revista de la
Facultad Nacional de Agronomía. 62(1): 4967- 4982.
Parra, A. (2010). Bacterias ácido lácticas:
Papel funcional en los alimentos. Facultad de
Ciencias Agropecuarias. 8(1): 94-105.
Pérez, J., Rocha, E., Uzcategui,
D., Aranguren, Y. y Machado, E.
(2015). Aislamiento, selección y
caracterización de Lactobacillus
genus aisladas del líquido ruminal
vacuno en la zona sur del lago, Venezuela. Revista colombiana
de ciencia animal. 7(2): 165- 170.
Puniya, M., Ravinder
M., Panwar H., Kumae, N.,
and Kumar, P. (2016). Screening
of Lactic Acid Bacteria of Different Origin for Probiotic Potential.
Food Process Technol. 7(1): 1-9.
Rubio, M. A., Hernández, E. M., Aguirre, R. A.
y Poutou, P. R. (2008). Identificación preliminar in
vitro de propiedades probióticas en cepas de S. cerevisiae. Revista MVZ Córdoba. 13(1): 1157-1169.
Ruiz, K., Ortega, P., Hoyos, J. y Andrés, G.
(2016). Selección de bacterias ácido lácticas con potencial probiótico
de interés en el sector piscícola. Agronoía Colombiana. 94 (1Supl): S1009-S1012.
Sánchez, B., Delgado, S., Blanco, A., Lourenco, A., Gueimonde, M., and Margolles, A. (2016). Probiotics,
gut microbiota, and their influence on host health and disease. Molecular Nutriolofy
Food Research. 61(1): 1-15.
Sánchez, L., Omura,
M., Adam, L., Pérez, T., Llanes, M. y Ferreira
C., (2015). Cepas de Lactobacillus spp. con
capacidades probióticas aisladas del tracto
intestinal de terneros neonatos. Revista de Salud Animal. 37(2): 94-104.
Sánchez, L. y Tromps,
J. (2014). Caracterización in vitro de bacterias ácido lácticas con potencial probiótico.
Revista de Salud Animal. 36(2): 124-129.
Santillan-Urquiza, E., Mendez-Rojas, M. A. y Vélez-Ruiz J. F. (2014). Productos
lácteos funcionales, fortificados y sus beneficios en la salud humana. Temas selectos de Ingenieria de Alimentos. 8(1): 5-14.
Soliman, A., Sharoba,
A., Bahlol, H., and Radi,
O. (2015). Evaluation of Lactobacillus acidophilus, Lactobacillus case
and Lactobacillus plantarum
for probiotics characterstics. Middle East Journal Applied. 5(1): 94-101.
Tripathi, M. and Giri, S. (2014). Probiotic functional foods: Survival of probiotics during processing and storage. Journal of functional food. 9: 225-241.
Vela-Gutiérrez, G., Castro-Mundo, M.,
Caballero-Roque, A. y Ballinas-Díaz, E. J. (2012).
Bebida probiótica de lactosuero
adicionada con pulpa de mango y almendras sensorialmente aceptable en adultos
mayores. ReCiTeIA. 11(2): 10-20.