Propiedades
y posibles aplicaciones de las proteínas de salvado de trigo
Properties and application possibilities
of wheat bran proteins
Guadalupe Chaquilla-Quilca1, 2, René Renato
Balandrán-Quintana2*, Ana María Mendoza-Wilson2,
Jorge Nemesio Mercado-Ruiz2
*Correspondencia:
rbalandran@ciad.mx/ Fecha de recepción: 4 de enero de 2017/ Fecha de
aceptación: 25 de septiembre de 2017
1Universidad Nacional Micaela Bastidas de Apurímac,
Facultad de Ingeniería, Abancay, Apurímac, Perú,
2Centro de Investigación en Alimentación y Desarrollo,
A.C., Coordinación de Tecnología de Alimentos de Origen Vegetal, Carretera a La
Victoria km 0.6, Hermosillo, Sonora, México, C.P. 83304.
RESUMEN
El salvado de trigo se destina principalmente al consumo animal, por lo que algunos de sus componentes son subutilizados, representando oportunidades de valor agregado. Constituye las capas externas del grano y contiene hasta 18 % en peso de proteínas con mejor calidad que las de la harina. Estas proteínas no son aprovechadas debido a que la mayoría están protegidas por una matriz de polisacáridos, indigerible para el sistema gastrointestinal humano, por lo que es necesaria su extracción. Tradicionalmente, las proteínas de salvado han sido recuperadas mediante extracción alcalina y se han propuesto como ingredientes para la elaboración de productos alimenticios. Sin embargo, su uso es casi inexistente, debido a que los procesos de extracción son agresivos y no redituables. El objetivo del presente trabajo fue describir las propiedades de las proteínas del salvado de trigo, así como sus usos potenciales. Entre sus propiedades destacan la digestibilidad, el perfil de aminoácidos y la capacidad de absorción de grasa. La fracción soluble en agua de estas proteínas, por su fácil extracción, podría tener valor agregado al utilizarse en tecnologías emergentes: como fuente de péptidos bioactivos, en la producción de nanopartículas con aplicaciones industriales o como matrices para procesos de biomineralización artificial.
PALABRAS CLAVE: proteínas
de cereales, subproductos agroindustriales, tecnologías emergentes.
ABSTRACT
Wheat bran is mainly intended for animal consumption and some of its components are
underutilized, representing value-added opportunities.
It forms the outer layers of the grain and contains up to 18 % by weight of proteins of better quality than those of flour.
These proteins are not exploited because most are protected by a matrix of
polysaccharides, which is
indigestible by the human gastrointestinal system, so their extraction is necessary. Traditionally, wheat bran proteins have been recovered by
alkaline extraction and have been proposed as ingredients for the manufacture of foodstuffs. However, their use is almost non-existent because the extraction
processes are aggressive and not profitable. The aim of the present review is
to present the properties of wheat bran proteins, as well as, their potential uses. Among their
properties, the digestibility, lipid absorption capacity and aminoacid
pattern are highlighted. The water soluble fraction
of these proteins, because of their easy extraction, could have
an added value from the perspetive of emerging technologies, for example, as a source of bioactive
peptides, in the production of nanoparticles with
industrial applications or as matrices for
artificial
biomineralization processes.
Keywords: cereal proteins, agroindustrial byproducts, emerging
technologies.
INTRODUCCIÓN
Los cereales son la fuente de energía y nutrientes más importante en la alimentación humana y animal (Serna-Saldivar, 2010; Koehler y Wieser, 2013), distinguiéndose entre ellos el trigo, del cual se obtiene harina como producto principal; salvado y germen como subproductos (Dexter y Sarkar, 2004). La harina se utiliza para la elaboración de una gran variedad de alimentos, destacando los productos de la panificación. Por otro lado, el salvado se destina en su mayor parte a la alimentación animal (Heuzé y col., 2013) y tradicionalmente ha recibido menor atención en lo que respecta a sus propiedades nutrimentales, fitoquímicas y funcionales, por lo que su utilización para consumo humano se ha basado en aplicaciones específicas, apreciándose principalmente por su alto conte-nido de fibra insoluble (Prückler y col., 2014).
En la actualidad,
se encuentran documentadas una serie de propiedades del salvado que son
benéficas para la salud humana, gracias a sus componentes, entre los que se
incluyen la fibra
dietaria, proteínas, minerales, vitaminas del complejo B, vitamina E, compuestos fenólicos, luteína, antocianinas, tocotrienoles y ácido fítico (Nogata y Nagamine, 2009;
Shewry, 2009; Fardet,
2010; Brewer y col., 2014; de-Mora, 2015; Onipe y col., 2015; Kawaguchi y col.,
2017). Estos compuestos
nutricionales y bioactivos son importantes en la prevención de enfermedades
degenerativas (Javed y col., 2012; Rosa-Sibakov y col., 2015), por lo que el
consumo del salvado ha tendido a incrementarse en los últimos 10 años (Javed y
col., 2012; Prückler y col., 2014).
De entre los componentes del salvado de trigo, sus proteínas han sido las menos estudia-das, a pesar de tener mayor calidad que las de la harina de este cereal, debido a un mejor balance de aminoácidos (Stevenson y col., 2012). Esto es de destacarse, ante la demanda permanente por diversas fuentes de proteína barata, no solo por su importancia en la nutri-
ción sino también por su potencial uso como ingredientes funcionales en la industria de los
alimentos (Idris
y col., 2003). Sin embargo, la extracción eficiente
de las proteínas del salvado se encuentra restringida por factores anatómicos
propios del grano, por lo que el proceso global podría ser
económicamente inviable en términos de las aplicaciones tradicionales.
El objetivo del presente trabajo fue dar a conocer las propiedades y usos potenciales de las proteínas del salvado de trigo.
Composición y usos del salvado de trigo
El trigo (Triticum aestivum L.) ha sido cultivado desde inicios de
la civilización (Javed y col., 2012) y actualmente es el tercer cereal con
mayor producción a nivel mundial, con un volumen anual de alrededor de 729
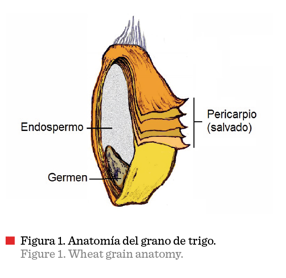
millones de T (FAOSTAT, 2016). El grano de trigo se compone de varios tejidos,
los cuales se esquematizan en la Figura 1. El germen o embrión, es el órgano
reproductivo y de almacenamiento y representa entre 2 % y 3 % del peso del
grano. El endospermo, principal fuente de energía durante la germinación, es la
parte anatómica más abundante (81 % a 84 % del peso del grano). El pericapio
(salvado) está constituido por un conjunto de capas que protegen al grano y comprende entre 14 % y 16 %
del peso de este
último (Corke, 2004).
El endospermo es extraído mediante molienda para la obtención de harina y
semolina, que son utilizadas en las industrias de
panificación, galletería y pastas, mientras que el germen y el pericarpio se
recuperan como subproductos (Nandini y Salimath, 2001; Dexter y Sarkar, 2004;
Stevenson y col., 2012). Solamente un 10 % del salvado producido se
destina a la alimentación humana, principalmente como fuente de fibra en pan, galletas,
cereales y otros (Hossain y col., 2013; Prückler y col., 2014); el resto se
dirige a la alimentación
animal (Javed y col., 2012; Heuzé y col., 2013; Reisinger y col.,
2014). De acuerdo con los datos de producción mundial
de trigo y el porcentaje de este cereal que se destina a la molienda para
consumo humano (CANIMOLT, 2014; FAOSTAT, 2016), se estima que la
cantidad de salvado obtenida anualmente es de alrededor de 74 millones de T, lo
cual es interesante desde la óptica del
valor agregado.
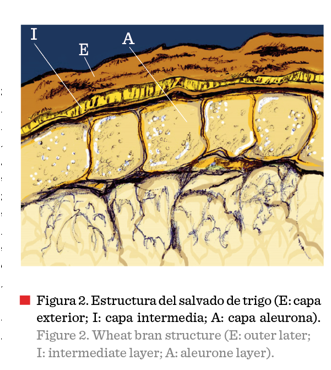
El término
salvado es coloquial, pues anatómicamente se conoce como pericarpio (Balandrán-Quintana y col., 2015) y consiste de tres
secciones identificadas como pericarpio exterior, pericarpio interior y capa
aleurona, respectivamente (Figura 2). El pericarpio exterior rodea a la semilla y está
morfológicamente compuesto
por tres capas de células muertas (epidermis, hipodermis y capa interna). El
pericarpio interior se constituye de células tubulares y células cruzadas, así
como por la testa o cubierta de la semilla, la cual contiene los pigmentos que
dan el color característico al grano. La capa aleurona es una monocapa de
células vegetativas que rodea y cubre enteramente al germen y al endospermo. La
aleurona pertenece al endospermo, pero se considera la capa más interna del
salvado, debido a que permanece adherida a este después de la
molienda (Corke, 2004).
La composición
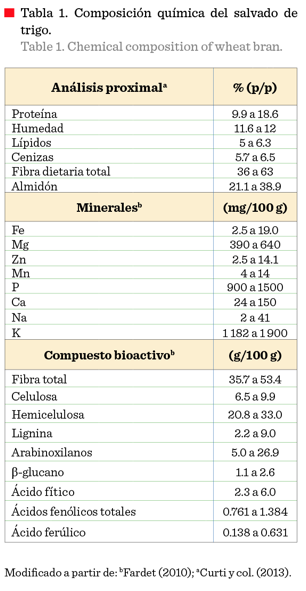
química del salvado de trigo es compleja. En la Tabla 1 se presentan los
componentes más representativos, entre los que destacan la fibra dietaria total, principalmente fibra insoluble lignificada (Rosenfelder y col., 2013), las proteínas y, en menor proporción, lípidos y cenizas. Así mismo, se observa un nivel relativamente alto de ácido fítico, que constituye la reserva de fósforo del grano y el cual es considerado un factor anti nutricional, ya que puede interferir con la absorción de minerales como Fe, Mg, Zn y Ca (Stevenson y col., 2012; Prückler y col., 2014; Reisinger y col., 2014). Entre los compuestos fenólicos, el ácido ferúlico es importante y se encuentra esterificando algunos residuos de arabinosa de los arabinoxilanos, los cuales son polisacáridos que representan mayormente a la fibra dietaria en el salvado de trigo (Morales-Ortega y col., 2013).
Entre los usos no
convencionales propuestos para el salvado de trigo está su potencial co-mo
sustrato para la producción de hongos comestibles
(Locci y col., 2008) y como fuente de azúcares fermentables para procesos biotecnológicos,
por ejemplo la producción de bioetanol (Favaro y
col., 2013). También se ha estudiado su capacidad para la remoción de metales pesados (Kanwal y col.,
2013) y su factibilidad como componente en el diseño de empaques biodegradables
(Fama y col., 2010). Sobre
usos alternativos de las proteínas de salvado
de trigo se
ha investigado muy
poco.
Proteínas de salvado
de trigo
Dependiendo del cultivar, el salvado de trigo contiene entre 9.9 % y 18.6 % en peso de proteínas (Shewry y col., 2009; Apprich y col., 2014; Reisinger y col., 2014), las cuales se distribuyen en tres grandes capas (Figura 2). El contenido de proteínas del pericarpio exterior es de 0.4 mg/g, la capa intermedia contiene 3.6 mg/g y la capa aleurona 156 mg/g, lo cual representa el 0.25 %, 2.25 % y 97.5 % del total de las proteínas encontradas en el salvado, respectivamente. Es decir, la aleurona contiene la gran mayoría de las proteínas del salvado (Jerkovic y col., 2010), las cuales representan además un 20 % del total de las proteínas del grano del trigo, de ahí la importancia de su estudio.
En el grano en desarrollo, las proteínas de salvado desempeñan funciones metabólicas; mientras que en el grano maduro, constituyen una reserva de nitrógeno y también están involucradas en la defensa contra estreses bióticos y abióticos. Debido a su composición en aminoácidos, estas proteínas son de mayor valor biológico que las del endospermo, y su digestibilidad es cercana a la de la caseína; esta última considerada como proteína de referencia (Woerman y Satterlee, 1974). De acuerdo con los datos de producción anual mundial de trigo y el porcentaje destinado a la molienda, se calcula que aproximadamente 12 millones de T de proteínas de buena calidad podrían estar siendo subutilizadas (CANIMOLT, 2014; FAOSTAT, 2016).
De acuerdo con su
solubilidad, las proteínas de los cereales se han clasificado tradicional-mente como albúminas, globulinas, prolaminas y glutelinas (Koehler y Wieser, 2013).
Las albúminas son solubles en agua; las globulinas en soluciones diluidas de NaCl; las gliadinas (prolaminas de salvado de trigo) en
alcohol al 70 % y las glutelinas en soluciones ácidas y básicas diluidas
(Goesaert y col., 2005; Šramková y col., 2009;
Koehler y Wieser, 2013). Dicha solubilidad hace posible extraer las proteínas
secuencialmente. Jones y Gersdorff (1923), extrajeron las proteínas de salvado de trigo en esta forma por vez primera, encontrando un 16.6 % de albúminas, 13.6 % de globulinas y 31 % de prolaminas. En otro estudio, se
reportó 23.5 % de albúminas, 15.5 % de globulinas, 18.5 % de prolaminas y 25.5 % de glutelinas (Idris y col., 2003). Las diferencias entre autores pueden deberse al método
de preparación del salvado, previo
a la extracción.
Las proteínas de
los cereales también se pueden clasificar como de reserva y como biológicamente
activas (enzimas) (Fabian y Ju, 2011). Las proteínas de salvado de trigo, esencialmente albúminas y globulinas,
despliegan ambas funciones (Jerkovic y col., 2010;
Meziani y col., 2012;
Koehler y Wieser, 2013), aunque probablemente también
desempeñan algún papel estructural (Rhodes y Stone, 2002). Las proteínas de las capas externa e intermedia
son básicamente enzimas
que actúan contra el estrés oxidativo y contra patógenos que sobreviven a la
deshidratación, enzimas hidrolíticas necesarias para la germinación, así como inhibidores de otras enzimas (Jerkovic y
col., 2010; Koehler y
Wieser, 2013). Las proteínas de la capa
aleurona están constituidas en un 58 %
por globulinas,
aproximadamente, cuya función
principal es la de reserva para su uso du-
rante la germinación; el restante 42 % tiene actividad enzimática (Jerkovic y col., 2010; Meziani y col., 2012).
En las capas
externas del salvado de trigo se han identificado las enzimas oxalato oxidasa
y de transferencia de lípidos, así como lipoxigenasa; en la fracción interna están reportadas la oxalato oxidasa, inhibidor de xilanasa I, quitinasa, endoquitinasa, α-amilasa y taumatina, mientras que las proteínas de la capa aleurona están constituidas por globulinas, proteínas de almacenamiento de la superfamilia cupina y la globulina 7S de trigo (Jerkovic y col., 2010). Por otro lado, en el extracto acuoso de la capa exterior se ha observado la presencia de proteínas de defensa, como la polifenol oxidasa, peroxidasa y oxalato oxidasa (Jerkovic y col., 2010). En otro estudio se identificaron 142 proteínas en la aleurona de trigo, de las cuales, el 57 % son proteínas de reserva, 16.2 % están involucradas en el metabolismo de carbohidratos y 17.6 % en la defensa contra el estrés (Meziani y col., 2012).
Las proteínas de
salvado de trigo son de alta calidad nutricional, ya
que presentan una composición
balanceada y rica en aminoácidos esenciales como lisina (Lys), triptófano (Trp) y metionina (Met), los
cuales son deficientes o
limitantes en la harina de trigo (Shewry y col., 2009). Las proteínas de
salvado tienen un
contenido de Lys que es casi el doble del encontrado
en la harina (Cornell, 2003; Shewry y col., 2009) y representa el 4.5 % del total de los aminoácidos del
salvado (Corke, 2004); además, contienen arginina
(Arg), alanina (Ala), ácido
aspártico (Asp), glicina (Gly) y, en menor proporción, ácido glutámico (Glu),
prolina (Pro) y fenilalanina (Phe), así como aminoácidos azufrados, como la
cisteína (Cys) (Apprich y
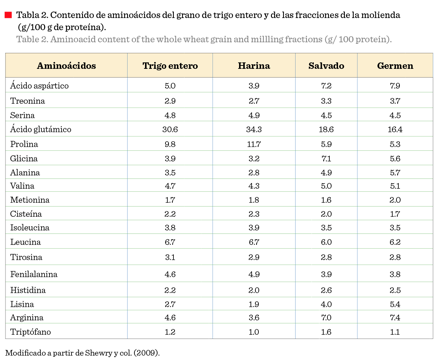
col., 2014; De-Brier y col., 2015). En la Tabla 2 se muestra la composición de
aminoácidos del grano de trigo y de las principales
fracciones de la molienda,
destacándose el contenido de 5 aminoácidos esenciales (histidina, lisina, treonina, valina y triptófano),
el cual es mayor en el salvado que en la harina (Shewry y col., 2009).
La razón de
eficiencia proteica (PER, por sus siglas en inglés: Protein Efficiency Ratio) es otro factor que contribuye al valor biológico y
nutricional de las proteínas extraídas del salvado de trigo. La PER de un
concentrado de proteínas de salvado de trigo es de
2.07 (Woerman y Satterlee, 1974), ligeramente menor al de la caseína (2.50), pero mucho mayor
que el de trigo entero (1.07) o la harina (0.59), mientras que la
digestibilidad es de 89.9 %, en comparación
con un 92.8 %
para la caseína.
Extracción de las proteínas de salvado de trigo
La obtención de
concentrados o aislados proteicos del salvado de trigo representa un gran desafío. Estas proteínas son difíciles
de extraer, pues la mayor
parte de ellas son globu-linas que se encuentran en las células de la capa
aleurona, cuya pared celular compuesta por polisacáridos dificulta su accesibilidad (Shewry y col., 2009; Meziani y col.,
2012). Además, muchas de las proteínas de la capa aleurona tienden a asociarse
a carbohidratos como los arabinoxilanos (Rhodes y Stone, 2002), y a formar
complejos con el ácido fítico (Martínez y col., 2002). En lo que respecta a las
proteínas solubles en agua, es decir las albúminas, a pesar de que esta
fracción se extracta facilmente a temperatura
ambiente, las sales
minerales presentes en los tejidos son coextraídas, requiriendo de varias
etapas de purificación, así como precipitación repetitiva, ultra centrifugación
y/o diálisis (Chaquilla-Quilca y col., 2016). Aún con estas limitantes, se han obtenido diferentes concentrados y
aislados proteicos a partir del salvado de
trigo, principalmente
mediante extracción húmeda alcalina, en cuyo proceso influyen factores como el pH,
tiempo, temperatura y tamaño de partícula. El tema de la extracción de
proteínas de salvado de trigo ha sido revisado en mayor detalle por
Balandrán-Quintana y col. (2015) y Balandrán-Quintana (2018). En el presente
trabajo solo se describen brevemente los aspectos más relevantes.
Los primeros
intentos por extraer y aprovechar las proteínas de salvado de trigo datan de
las décadas de 1960 y 1970. Fellers y col. (1966), reportaron la extracción mediante lavado con álcali a pH 10.5, encontrando una influencia del tamaño de partícula sobre el rendimiento de extracción: a menor tamaño de partícula mayor rendimiento. Saunders y col. (1975), también utilizaron la extracción húmeda alcalina y obtuvieron un concentrado con 65 % de proteína, con rendimientos en el intervalo 15 % a 25 %. En otro estudio se optimizó el proceso de extracción mediante el uso de las enzimas celulasa, hemicelulasa y pectinasa, posterior al tratamiento alcalino a pH 8.5, lográndose rendimientos de hasta 38.5 % (Waszczynskyj y col., 1981). Por otro lado, Roberts y col. (1985), observaron condiciones óptimas de extracción a temperatura ambiente, pH 6.5, 16 h y un tamaño fino de partícula; también emplearon la enzima celulasa para degradar la fibra e incrementar el rendimiento, el cual no se vio favorecido.
La mayoría de
los concentrados de proteína de salvado de trigo
obtenidos mediante extracción
alcalina han sido utilizados en el enriquecimiento de
productos de panificación y galletería (Haque y col., 2002; Prückler y col.,
2014). La extracción
alcalina constituye un factor restrictivo, debido a que se puede dañar la calidad nutricional y alterar las
propiedades funcionales de las proteínas, por lo cual es deseable el uso de
métodos menos agresivos. Se ha encontrado que la fermentación o el uso de cócteles de carbohidrasas no afecta la solubilidad
de las proteínas de salvado de trigo, sin embargo, mediante la activación de proteasas endógenas o bien, mediante el uso de proteasas exógenas, dicha solubilidad se puede aumentar hasta en un 10 %; aunque este procedimiento no tiene gran efecto sobre las
proteínas de la aleurona
(Arte y col., 2015; 2016).
También se ha recurrido al uso de métodos físicos, entre los cuales la
explosión de vapor ha resultado ser el más
prometedor, ya que se ha
reportado una solubilidad de proteínas casi cinco
veces superior a la obtenida en los controles (Zhao y col.,
2015).
Propiedades
funcionales de las proteínas de salvado de trigo
El uso de
proteínas vegetales como ingredientes en sistemas
alimenticios se basa en sus propiedades funcionales, i.e., solubilidad en agua, capacidad de emulsificación, capacidad de
formar espuma, capacidad de absorción de agua y aceite y gelificación (Fabian y
Ju, 2011; Bolontrade y col., 2016). La solubilidad es uno de los atributos más
importantes de las proteínas,
ya que influye directamente en el resto de
las propiedades funcionales.
Muy poco se ha
investigado sobre las propiedades funcionales de las proteínas del salvado de
trigo. Se ha determinado que la digestibilidad, el perfil de aminoácidos y la
capacidad de absorción de grasa de las proteínas contenidas en una mezcla de
salvado de trigo grueso y fino, germen y harina (lo que en el argot molinero se
conoce como “millrun”), las hace factibles de utilización como enriquecedores de harina, para la elaboración
de pan (Saunders y col.,
1976). Sin embargo, el método de obtención es complejo y laborioso, además de
que no se utilizó solo salvado. En un estudio realizado con salvado de trigo se
extrajeron las proteínas totales mediante extracción alcalina y precipitación ácida
con calor, seguido de
diálisis y liofilizado, y se determinaron algunas de sus propiedades funcionales
(Idris y col., 2003). Las solubilidades mínima y máxima de nitrógeno se obtuvieron a pH de 5.5 y 11.5, respectivamente. La capacidad de emulsificación y estabilidad de la
emulsión, así como la
capacidad de formar espuma
y estabilidad de la misma, se vieron muy afectadas por el pH y la concentración
de sales. Dichas capacidades fueron mayores a pH alcalino
y bajas concentraciones de sal. La concentración mínima para la gelificación de proteínas de
salvado de trigo disueltas en NaCl 1.0 M fue de 16 %.
De dichos estudios, se observa que, para la extracción y aprovechamiento de las propiedades funcionales de las proteínas totales de salvado, es necesaria la extracción mediante métodos complejos y pH alcalino, por lo que prevalece el problema de la agresividad química, además de que se pone en duda la rentabilidad del proceso.
Posibilidades de
innovación para las proteínas de
salvado de trigo
La constante
necesidad por innovaciones tecnológicas podría ser una plataforma para dar
valor agregado a las proteínas de salvado de trigo. Se ha reportado el
potencial que tienen los hidrolizados de proteínas de
salvado de trigo como
inhibidores de oscurecimiento enzimático, logrando reducciones de hasta 40 % en la actividad de polifenol
oxidasa de manzana (Campas-Ríos y col., 2012) y de 24 % en la de tirosinasa de
champiñón (Ortíz-Estrada y col., 2012).
Otro enfoque, es
la formación de nanopartículas proteicas para el transporte y entrega de compuestos bioactivos y fármacos, tal y como se ha reportado
para otros sistemas proteicos. Se han fabricado nanopartículas a partir de proteínas, como la gelatina, proteínas de soya y
albúminas (Lohcharoenkal y col., 2014). La ventaja de
las albúminas es que son biocompatibles y biodegradables (Elzoghby y col., 2012; Yedomon y col., 2013; Lohcharoenkal y col., 2014). Además, tienen un alto potencial
para su uso como soporte en la liberación controlada de fármacos (in vitro e in vivo) (Patil, 2003; Wongsasulak y col.,
2010).
Las albúminas más
utilizadas para la fabricación de nanopartículas son las de suero humano y de
bovinos. También se han realizado estudios con proteínas de soya y de semillas
de girasol (Nesterenko y col., 2013), así como con α-lactoalbúmina del suero de leche, para la obtención de nanoestructuras,
como nanotubos y nanodiscos
(Graveland-Bikker y col.,
2004; Balandrán-Quintana y col., 2013). Tales nanopartículas pueden tener una
diversidad de aplicaciones en las industrias de alimentos y farmacéutica.
Respecto al salvado de trigo, hay reportes sobre la formación de nanotubos y nanopartículas esféricas a partir de extractos acuosos ricos en albúminas
(Chaquilla-Quilca y col., 2016; Luna-Valdez y col., 2017), sin embargo, aún
hace falta estudiar sus
posibles aplicaciones.
El desarrollo de
matrices para biomineralización artificial es otra perspectiva innovadora. La biomineralización in vivo consiste en la formación de cristales
minerales mediante la deposición de iones precursores sobre una matriz
orgánica, constituida por proteínas y polisacáridos, dando lugar a estructuras
macroscópicas con propiedades mecánicas únicas, por ejemplo, la cáscara de
huevo, los dientes, los huesos, los caparazones de los artrópodos, las conchas
de los moluscos y los corales (Veis y Dorvee, 2013; Addadi y col., 2016).
La
biomineralización artificial se estudia induciendo la mineralización sobre
geles de proteína y/o polisacáridos de alta pureza (Asenath-Smith y col., 2012;
Rauner y col., 2014). Es un tema de vanguardia, ya que se podrían producir
estructuras con capacidad para la regeneración de tejido óseo, implantes
dentales o una variedad de materiales con diferentes aplicaciones industriales
(Chabanon y col., 2016). Los extractos acuosos del
salvado de trigo, que
tienen cantidades altas de proteína, carbohidratos y iones fosfato, podrían
servir como matrices para inducir la biomineralización de diferentes polimorfos
de fosfato de calcio. Esta es una línea de investigación reciente sobre la que
se está trabajando y de la que ya se hicieron los primeros reportes
preliminares (Luna-Valdez y col., 2016); se considera que
tiene un gran
potencial.
En perspectiva,
aunque se podría ver económicamente inviable la extracción tradicional alcalina
de las proteínas de salvado de trigo, debido a la matriz de polisacáridos que
las protege (factores anatómicos del grano), bajo un esquema de aprovechamiento
integral del salvado de trigo, podría aprovecharse la fracción de proteínas
solubles en agua, debido a su facilidad de extracción. Entre las alternativas
innovadoras para el uso de estas proteínas está la producción de péptidos
bioactivos, la prevención del oscurecimiento enzimático y la posibilidad de su
uso en nanotecnología para la fabricación de nanopartículas o bien como matrices para procesos de
biomineralización
artificial (Balandrán-Quintana y
col., 2015).
CONCLUSIONES
Las tecnologías
emergentes en la industria alimentaria, como la nanotecnología y la
biomineralización artificial, representan alternativas viables para el
aprovechamiento de las más de 12 millones de toneladas de proteínas de salvado
que se considera se desperdician actualmente a nivel mundial. Sin embargo, es
necesario optimizar los procesos de extracción para incrementar su rentabilidad
y preservar o mejorar sus
propiedades funcionales.
AGRADECIMIENTOS
Al Consejo
Nacional de Ciencia y Tecnología (CONACYT, México), por el financiamiento del proyecto CB-2011/169839. Guadalupe
Chaquilla Quilca agradece al CONACYT por la beca otorgada para realizar
estudios de doctorado y a la Universidad Nacional Micaela Bastidas de Apurímac,
por todo el
apoyo brindado.
REFERENCIAS
Addadi, L.,
A. Gal, D., Faivre, Scheffel, A., and Weiner, S. (2016). Control of biogenic
nanocrystal formation in biomineralization. Israel Journal of Chemistry. 56(4): 227-241.
Apprich,
S., Tirpanalan, O., Hell, J., Reisinger, M., Böhmdorfer, S., Siebenhandl-Ehn,
S., …, and Kneifel, W. (2014). Wheat bran-based biorefinery 2: Valorization of
products. LWT-
Food Science and Technology.
56(2): 222-231.
Arte, E.,
Rizzello, C. G., Verni, M., Nordlund, E., Katina, K., and Coda, R. (2015).
Impact of enzymatic and microbial bioprocessing on protein modification and
nutritional properties of wheat bran. Journal of Agricultural and Food
Chemistry.
63(39): 8685-8693.
Arte, E.
Katina, K., Holopainen-Mantila, U., and Nordlund, E. (2016). Effect of
hydrolyzing enzymes on wheat bran cell wall integrity and protein solubility. Cereal Chemistry. 93(2): 162-171.
Asenath-Smith,
E., Li, H., Keene, E. C., Wei-Seh, Z., and Estroff, L. A. (2012). Crystal
growth of calcium carbonate in hydrogels as a model of biomineralization. Advanced Functional Materials. 22(14): 2891-2914.
Balandrán-Quintana,
R., Valdéz-Covarrubias, M. A., Mendoza-Wilson, A. M., and Sotelo-Mundo, R.
(2013). α-Lactalbumin
hydrolysate spontaneously produces diskshaped nanoparticles. International Dairy Journal. 32(2): 133-135.
Balandrán-Quintana,
R. R., Mercado-Ruiz, J. N., and Mendoza-Wilson, A. M. (2015). Wheat bran
proteins: A review of their uses and potential. Food Reviews International. 31(3): 279-293.
Balandrán-Quintana,
R. R. (2018). Recovery of proteins from cereal processing by-products. In C. M.
Galanakis (Ed.), Sustainable
recovery and reutilization of cereal processing by-products. (En prensa). San Diego, CA: Elsevier.
Bolontrade,
A. J., Scilingo, A. A., and Anón, M. C. (2016). Amaranth proteins foaming
properties: Film rheology and foam stability – Part 2. Colloids and Surfaces B:
Biointerfaces. 141:
643-650.
Brewer, L.
R., Kubola, J., Siriamornpun, S., Herald, T. J., and Shi, Y. S. (2014). Wheat
bran particle size influence on phytochemical extractability and antioxidant
properties. Food
Chemistry. 152:
483-490.
Campas-Ríos,
M., Mercado-Ruiz, J., Valdéz-Covarrubias, M. A., Islas-Rubio, A. R.,
Mendoza-Wilson, A. M., and Balandrán-Quintana, R. (2012). Hydrolysates from
wheat bran albumin as color-adding agents and inhibitors of apple polyphenol
oxidase. Journal
of Food Biochemistry.
36(4): 470-478.
CANIMOLT-Reporte
estadístico (2014). Cámara Nacional de la Industria Molinera del Trigo, en Panorama global del trigo. [En línea]. Disponible en:
https://drive.google.com/file/d/0B7aliWpRu8y3ck1nRmZNNHJUcWc/view. Fecha de consulta: 15 de noviembre de
2016.
Chabanon,
E., Mangin, D., and Charcosset, C. (2016). Membranes and crystallization
processes: State of the art and prospects. Journal of Membrane Science. 509: 57-67.
Chaquilla-Quilca,
G., Balandrán-Quintana, R. R., Azamar-Barrios, J. A., Ramos-Clamont Montfort,
G., Mendoza-Wilson, A. M., Mercado-Ruiz, J. N., …, and Luna-Valdez, J. G.
(2016). Synthesis of tubular nanostructures from wheat bran albumins during
proteolysis with V8 protease in the presence
of calcium ions. Food Chemistry. 200: 16-23.
Corke, H.
(2004). Grain, morphology of internal structure. In C. Wrigley, H Corke, and Y.
C. Walker (Eds.), Encyclopedia of Grain Science (pp. 30-38). New York, USA: Editorial
Elsevier Ltd.
Cornell, H.
(2003). The chemistry and biochemistry of wheat. In S. P. Cauvain (Ed.), Bread Making Improving Quality (pp. 31-70). Cambridge, UK: Woodhead
Publishing.
Curti, E.,
Carini, E., Bonacini, G., Tribuzio, G., and Vittadini, E. (2013). Effect of the
addition of bran fractions on bread properties. Journal of Cereal Science. 57(3): 325-332.
De-Brier,
N., Gomand, S. V., Celus, I., Courtin, C. M., Brijs, K., and Delcour, J. A.
(2015). Extractability and chromatographic characterization of wheat (Triticum aestivum L.) bran protein. Journal of Food Science. 80(5): 967-974.
De-Mora, B.
R. R. C. (2015). Positive effects of wheat bran for digestive health;
Scientific evidence. Nutrición
hospitalaria. 32:
41-45.
Dexter, J.
E. and Sarkar, A. K. (2004). Dry Milling. In C. Wrigley, H. Corke, and Y. C.
Walker (Eds.), Encyclopedia
of Grain Science
(pp. 363-375). New York, USA: Editorial Elsevier Ltd.
Elzoghby,
A. O., Samy, W. M., and Elgindy, N. A. (2012). Albumin-based nanoparticles as
potential controlled release drug delivery systems. Journal of Controlled Release. 157(2): 168-182.
Fama, L.,
Bittante, A. M. B. Q., Sobral, P. J. A, Goyanes, S., and Gerschenson, L. N.
(2010). Garlic powder and wheat bran as fillers: Their effect on the
physicochemical properties of edible biocomposites. Materials Science and
Engineering: C. 30(6):
853-859.
Fabian, C.
and Ju, Y. S. (2011). A review on rice bran protein: Its properties and
extraction methods. Critical
reviews on Food Science and Nutrition. 51(9): 816-827.
FAOSTAT,
Food and Agriculture Organization of the United Nations (2016). Food and
Agriculture Organization of the United Nations. Statistics Division. [En
línea]. Disponible en: http://faostat3.fao.org/browse/Q/QC/E. Fecha de
consulta: 15 de noviembre de 2016.
Fardet, A.
(2010). New hypotheses for the health-protective mechanisms of whole-grain
cereals: What is beyond fibre?. Nutrition Research Reviews. 23(1): 65-134.
Favaro, L.,
Basaglia, M., van Zyl, W. H., and Casella, S. (2013). Using an efficient
fermenting yeast enhances ethanol production from unfiltered wheat bran
hydrolysates. Applied
Energy. 102:
170–178.
Fellers, D.
A., Sinkey, V., Shephered, A. D., and Pence, J. W. (1966). Solubilization and
recovery of protein from wheat millfeeds. Cereal Chemistry. 43(1): 1-13.
Goesaert,
H., Brijs, K., Veraverbeke, W. S., Courtin, C. M., Gebruers, K., and Delcour,
J. A. (2005). Wheat flour constituents: how they impact bread quality, and how
to impact their functionality. Trends in Food Science & Technology. 16(1): 12-30.
Graveland-Bikker,
J., Ipsen, R., Otte, J., and de Kruif, G. (2004). Influence of calcium on the
self-assembly of partially hydrolyzed α-Lactalbumin. Langmuir. 20(16): 6841-6846.
Haque, A.,
Shams-Ud-Din, and Haque, A, (2002). The effect of aqueous extracted wheat bran
on the baking quality of biscuit. International Journal of Food
Science and Technology. 37(4):
453-462.
Heuzé, V., Tran, G., Baumont, R., Lebas, F.,
Lessire, M., Noblet, J., and Renaudeau, D. (2013). Animal feeds resources
information system. Wheat bran. A programme by INRA, CIRAD, AFZ and FAO, in Feedipedia.org. [En línea]. Disponible en:
http://www.feedipedia.org/node/726. Fecha de consulta: 5 de febrero de 2014.
Hossain,
K., Ulven, C., Glover, K., Ghavami, F., Simsek, S., Alamri, M. S., …, and
Mergoum, M. (2013). Interdependence of cultivar and environment on fiber
composition in wheat bran. Australian
Journal of Crop Science. 7(4):
525-531.
Idris, W.
H., Babiker, E. E., and El-Tinay, A. H. (2003). Fractionation, solubility and
functional properties of wheat bran proteins as influenced by pH and/or salt
concentration. Molecular
Nutrition & Food Research.
47(6): 425-429.
Javed, M.,
Zahoor, S., Shafaat, S., Mehmooda, I., Ambreen, G., Rashee, H., ..., and
Ikram-ul-Haq (2012). Wheat bran as a brown gold: Nutritious value and its
biotechnological applications. African Journal of Microbiology Research. 6(4): 724-733.
Jerkovic,
A., Kriegel, A., Bradner, J., Atwell, B., Roberts, T., and Willows, R. (2010).
Strategic distribution of protective proteins within bran layers of wheat
protects the nutrient-rich endosperm. Plant Physiology. 152(3): 1459-1470.
Jones, B.
and Gersdorff, C. (1923). Proteins of wheat bran. I. Isolation and elementary
analyses of a globulin, albumin; and prolamin. Journal of Biological Chemistry. 58(1): 117-131.
Kanwal, F.,
Rehman, R., Anwar, J., and Saeed, M. (2013). Removal of lead (II) from water by
adsorption on novel composites of polyaniline with maize bran, wheat bran and
rice bran. Asian
Journal of Chemistry. 25(5):
2399-2404.
Kawaguchi,
T., Ueno, T., Nogata, Y., Hayakawa, M., Koga, H., and Torimura, T. (2017).
Wheat-bran autolytic peptides containing a branched-chain amino acid attenuate
non-alcoholic steatohepatitis via the suppression of oxidative stress and the
upregulation of AMPK/ACC in high-fat diet-fed mice. International Journal of
Molecular Medicine. 39(2):
407-414.
Koehler, P.
and Wieser, H. (2013). Handbook on sourdough biotechnology. In M. Gobbetti and M. Gänzle (Eds.), Chapter 2: Chemistry of Cereal Grains (Sixth edition) (pp. 11-45). New York, USA: Springer
Science+Business Media.
Locci, E.,
Laconi, S., Pompei, R., Scano, P., Lai, A., and Marincola, F. C. (2008). Wheat
bran biodegradation by Pleurotus
ostreatus: A
solid-state carbon-13 NMR study. Bioresources Technology. 99(10): 4279-4284.
Lohcharoenkal,
W., Wang, L., Chen, Y. C., and Rojanasakul, Y. (2014). Protein nanoparticles as
drug delivery carriers for cancer therapy. BioMed Research International. 4: 1-12.
Luna-Valdez
J. G., Balandrán-Quintana, R., Azamar-Barrios, J., Mercado-Ruiz, J.,
Clamont-Montfort, G., Mendoza-Wilson, A., and Chaquilla-Quilca, G. (2016).
“Wheat bran albumins as organic matrices for artificial bio-mineralization
processes”. Annual meeting of the American Asociation of Cereal Chemists
International. Savannah, GA, U.S.A. [En línea]. Disponible en:
http://www.aaccnet.org/meetings/Documents/2016Abstracts/aacc2016abs200.htm.
Fecha de consulta: 15 de noviembre de 2016.
Luna-Valdez,
J. G., Balandrán-Quintana, R. R., Azamar-Barrios, J. A., Clamont-Montfort, G.,
Mendoza-Wilson, A. M., Mercado-Ruiz, J. N., ..., and Chaquilla-Quilca, G.
(2017). Structural and physicochemical characterization of nanoparticles
synthesized from an aqueous extract of wheat bran by a cold-set
gelation/desolvation approach. Food Hydrocolloids. 62: 165-173.
Martínez,
B., Gómez, M. V., and Rincón, F. (2002). Ácido fítico: Aspectos nutricionales e
implicaciones analíticas. Archivos
Lationamericanos de Nutrición.
52(3): 219-231.
Meziani,
S., Nadaud, I., Gaillard-Martinie, B., Chambon, C., Benali, M., and Branlard,
G. (2012). Proteomic analysis of the mature kernel aleurone layer in common and
durum wheat. Journal
of Cereal Science.
55(3): 323-330.
Morales-Ortega,
A., Carvajal-Millán, E., López-Franco, Y., Rascón-Chu, A., Lizardi-Mendoza, J.,
Torres-Chávez, P., and Campa-Mada, A. (2013). Characterization of water
extractable arabinoxylans from spring wheat flour: Rheological properties and
microstructure. Molecules. 18(7): 8417-8428.
Nandini, C.
D. and Salimath, P. V. (2001). Carbohydrate composition of wheat, wheat bran,
sorghum and Bajra with Good Chapati/Roti (indian flat bread) making quality. Food Chemistry. 73(2): 197-203.
Nesterenko,
A., Alric, I., Silvestre, F., and Durrieu, V. (2013). Vegetable proteins in
microencapsulation: A review of recent interventions and their effectiveness. Industrial Crops and Products. 42: 469-479.
Nogata, Y.
and Nagamine, T. (2009). Production of free amino acids and γ-aminobutyric acid by autolysis
reactions from wheat bran. Journal
of Agricultural and Food Chemistry. 57(4): 1331-1336.
Onipe, O.
O., Jideani, A. I., and D. Beswa. (2015). Composition and functionality of
wheat bran and its application in some cereal food products. International Journal of Food
Science and Technology. 50(12):
2509-2518.
Ortíz-Estrada,
A. M., Mercado-Ruiz, J. N., García-Robles, J. M., Islas-Rubio, A. R.,
Mendoza-Wilson, A. M., and Balandrán-Quintana, R. R. (2012). Wheat bran
globulins: Competitive inhibitors of mushroom tyrosinase. Food Science and Biotechnology. 21(3): 633-635.
Patil, G.
V. (2003). Biopolymer albumin for diagnosis and in drug delivery. Drug Development Research. 85(3): 219-247.
Prückler,
M., Siebenhandl-Ehn, S., Apprich, S., Höltinger, S., Haas, C., Schmid, E., and
Kneifel, W. (2014). Wheat bran-based biorefinery 1: Composition of wheat bran
and strategies of functionalization. Food Science and Technology. 56(2): 211-221.
Rauner, N.,
Meuris, M., Dech, S., Godde, J., and Tiller, J. C. (2014). Urease-induced
calcification of segmented polymer hydrogels - A step towards artificial
biomineralization. Acta
Biomaterialia. 10(9):
3942-3951.
Reisinger,
M., Tirpanalan, Ö., Huber, F., Kneifel, W., and Novalin, S. (2014).
Investigations on a wheat bran biorefinery involving organosolv fractionation
and enzymatic treatment. Bioresource
Technology. 170:
53-61.
Rhodes, D.
I. and Stone, B. A. (2002). Proteins in walls of wheat aleurone cells. Journal of Cereal Science. 36(1): 83-101.
Roberts, P.
J., Simmonds, D. H., Wooton, M., and Wrigley, W. (1985). Extraction of protein
and solids from wheat bran. Journal of the Science of Food and
Agriculture.
36(1): 5-10.
Rosa-Sibakov,
N., Poutanen, K., and Micard, V. (2015). How does wheat grain, bran and
aleurone structure impact their nutritional
and technological properties?. Trends in
Food
Science and Technology.
41(2): 118-134.
Rosenfelder,
P., Eklund, M., and Mosenthin, R. (2013). Nutritive value of wheat and wheat
by-products in pig nutrition: A review. Animal Feed Science and
Technology. 185(3):
107-125.
Saunders,
R. M., Connors, M. A., Edwards, R. H., and Kohler, G. O. (1975). Preparation of
protein concentrates from wheat shorts and wheat millrun by a wet alkaline
process. Cereal
Chemistry.
52(93): 553-567.
Serna-Saldivar,
S. O. (2010). Cereal
Grains. Properties, Processing and Nutritional Attributes. Boca Raton, FL: CRC Press Taylor and
Francis Group. 1 Pp.
Shewry, P.
R. (2009). The health grain program opens new opportunities for improving wheat
for nutrition and health. Nutrition
Bulletin. 34(2):
225-231.
Shewry, P.
R., D’Ovidio, R., Lafiandra, D., Jenkins, J. A., Mills, E. N. C., and Bekés, F. (2009). Wheat grain proteins. In K. Khan and P.
R. Shewry (Eds.), Wheat Chemistry and Technology. (Second edition) (pp. 223-249). St.
Paul, Minnesota, USA: Association of Cereal Chemists, Inc.
Šramková,
Z., Gregová, E., and Šturdík, E. (2009). Chemical composition and nutritional
quality of wheat grain. Acta Chimica Slovaca. 2(1): 115-138.
Stevenson,
L., Phillips, F., O’sullivan, K., and Walton, J. (2012). Wheat bran: its
composition and benefits to health, a european perspective. International Journal of Food
Sciences and Nutrition.
63(8): 1001-1013.
Veis, A.
and Dorvee, J. R. (2013). Biomineralization mechanisms: a new paradigm for
crystal nucleation in organic matrices. Calcified tissue international. 93(4): 307-315.
Waszczynskyj,
N., Rao, C., and Da-Silva, R. (1981). Extraction of proteins from wheat bran:
application of carbohydrases. Cereal Chemistry. 58: 264-266.
Woerman, J.
and Satterlee, L. (1974). Extraction and nutritive quality of wheat protein
concentrate. Food
Technolo-
gy. 28: 50–52.
Wongsasulak,
S., Patapeejumruswong, M., Weiss, J., Supaphol,
P., and Yoovidhya, T. (2010). Electrospinning of food-grade nanofibers
from cellulose acetate and egg albumen blends. Journal of Food Engineering. 98(3): 370-376.
Yedomon,
B., Fessi, H., and Charcosset, C. (2013). Preparation of bovine serum albumin
(BSA) nanoparticles by desolvation using a membrane contactor: A new tool for
large scale production. European
Journal of Pharmaceutics and Biopharmaceutics Part A. 85(3): 398-405.
Zhao, M.,
Liu, L., Zhong, K., Tong, L., Zhou, X., and Zhou, S. (2015). Effect of steam
explosion treatment on the solubility of wheat bran components. Journal Chinese Institute Food
Sci. Tech. 15(8):
170-177.