Propiedades
antioxidantes e inmunoestimulantes de polifenoles en peces carnívoros de
cultivo
Antioxidant and immunostimulant properties of polyphenols in
carnivorous farmed fish
Cynthia Esmeralda Lizárraga-Velázquez1,
Crisantema Hernández1*, Gustavo Adolfo González-Aguilar2,
José Basilio-Heredia3
*Correspondencia: chernandez@ciad.mx/ Fecha de
recepción: 8 de febrero de 2017/ Fecha de aceptación: 17 de mayo de 2017
1Centro de Investigación en Alimentación y Desarrollo (CIAD), A.C.,
Laboratorio de Nutrición y Alimentación de Peces y Crustáceos, Av.
Sábalo-Cerritos S/N, Estero del Yugo, Mazatlán, Sinaloa, México, C.P. 82000. 2Centro
de Investigación en Alimentación y Desarrollo (CIAD), A.C., Laboratorio de
Antioxidantes y Alimentos Funcionales. 3Centro de Investigación en
Alimentación y Desarrollo (CIAD), A.C., Laboratorio de alimentos funcionales y
nutracéuticos.
RESUMEN
El cultivo
intensivo de peces es una estrategia económicamente importante para producir
alimento. Sin embargo, las prácticas de cultivo intensivo generan estrés
oxidativo e inmunosupresión, lo que ocasiona pérdidas de la calidad del espécimen y aumento en la mortalidad. Para contrarrestar estos efectos, se ha
optado por la administración de vegetales como fuente de polifenoles con propiedades antioxidantes e inmunoestimulantes en peces carnívoros de
cultivo. El objetivo de este trabajo fue describir
los efectos de los
polifenoles de origen vegetal como antioxidantes e inmunoestimulantes en peces
carnívoros, y promover su uso como ingredientes funcionales en la acuicultura.
Los vegetales como fuente de polifenoles tienen la capacidad de mejorar los
sistemas de defensa inmune y antioxidante de las especies analizadas, con un
tejido de mejor calidad nutricional y un mayor contenido endógeno de
antioxidantes. No obstante, las propiedades biológicas de los polifenoles
dependen del tipo y concentración en el vegetal, de la dosis y el tiempo de administración, así como de la matriz
alimentaria, la cual
determina la bioaccesibilidad y biodisponibilidad de los polifenoles en el
organismo. Es escasa la información generada sobre el efecto de
los polifenoles en la calidad post
mortem, por
lo que se
deben realizar más
estudios.
PALABRAS CLAVE: acuicultura,
estrés oxidativo, respuesta inmune innata, enzimas antioxidantes, alimento funcional.
ABSTRACT
Fish production
by intensive aquaculture, is an economically important strategy to produce food. However, intensive
fish farming generates oxidative stress and suppress the immune system, causing
loss of product quality and increasing fish mortality rates. To diminish these
effects, plants as a source of polyphenols with antioxidants and
immunostimulant properties were administered to carnivorous farmed fish. The aim of this study was to describe
the effects of
plant polyphenols as antioxidants and immunostimulants on carnivorous fish, and to promote their use as functional
ingredients in aquaculture. Plants as a source of polyphenols showed the
ability to improve the immune and antioxidant defense systems of the analyzed species, resulting in a tissue of better nutritional quality and a higher endogenous
antioxidant content.
However, the biological properties of
polyphenols are dependent on the type of plant and
their concentration within it, the dose and the time of administration,
as well as the food matrix, which determines their bioaccessibility and bioavailability in the organism. There is little information
on the effec of polyphenols in post mortem quality; therefore,
further studies should
be conducted.
Keywords: aquaculture, oxidative stress, innate immune system, antioxidant enzymes,
functional food.
INTRODUCCIÓN
La
intensificación de la acuicultura y la globalización de la comercialización de los pescados y
mariscos han producido un desarrollo muy importante en la industria de la
acuicultura. Sin embargo, el cultivo de peces a altas densidades, incrementa la
probabilidad de exponer a los organismos a condiciones de estrés elevado. Estas
condiciones pueden provocar la supresión del sistema inmune y por tanto,
favorecer la incidencia de enfermedades infecciosas, que dan lugar a una
elevación en la tasa de mortalidad y a pérdidas económicas considerables
(Alexander y col., 2010). En décadas recientes, la prevención de las
enfermedades y su
control, ha llevado a un sustancial aumento en el uso de aditivos químicos y medicina veterinaria, que pueden
acumularse en el tejido, pero con la desventaja de
promover, en el caso de los antibióticos, la resistencia de las bacterias
(Magrone y col., 2016). De la misma forma, el uso de aditivos químicos puede
provocar daños en la salud y al medio ambiente (Harikrishnan y col., 2012). Por otro lado, la especies carnívoras requieren de altos niveles de lípidos en su dieta,
lo que puede incrementar la adiposidad en diferentes tejidos y la
susceptibilidad a la peroxidación lipídica, proceso implicado en el desarrollo
del estrés oxidativo y en la
pérdida de la calidad post mortem, debido principalmente a la
oxidación de ácidos grasos poliinsaturados (PUFA, por sus siglas en inglés:
polyunsaturated fatty acids) de la serie omega 3 y a la formación de compuestos
volátiles relacionados con la
rancidez (Villasante y
col., 2015).
En la búsqueda
de promover el bienestar y preservar la calidad del
animal, sin comprometer al
medio ambiente y la salud de los consumidores, la investigación científica se
ha enfocado en la evaluación de inmunoestimulantes y antioxidantes provenientes
de fuentes naturales (Bulfon y col., 2013). En este sentido, los polifenoles presentes en frutas,
verduras, legumbres,
cereales y bebidas, como el té verde y el vino tinto,
exhiben propiedades inmnunoestimulantes y antioxidantes (Bulfon y col., 2013; Reverter y col., 2014; Vaseeharan y Thaya, 2014; Afzal y col., 2015; Shahidi
y Ambigaipalan, 2015);
estas últimas relacionadas directamente con propiedades antiestrés (Chakraborty
y Hancz, 2011). Los polifenoles son compuestos que se derivan del metabolismo secundario de las plantas a
través de la vía fenil-propanoide.
La característica general de los polifenoles, es
que tienen anillos aromáticos con grados de hidroxilación variable y la mayoría se encuentran en forma
conjugada con uno o más restos de azúcares unidos a grupos hidroxilo o directamente al anillo
aromático, incluso pueden encontrarse asociados a otros compuestos (Kumar y Pandey, 2013). La diversidad estructural deriva en una amplia gama de polifenoles
(Figura 1) (Bravo, 1998).
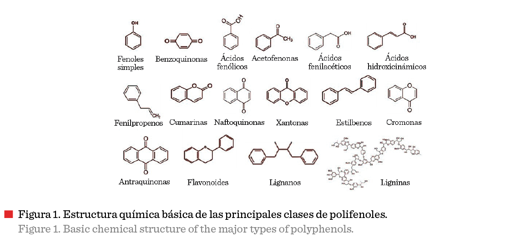
La utilización
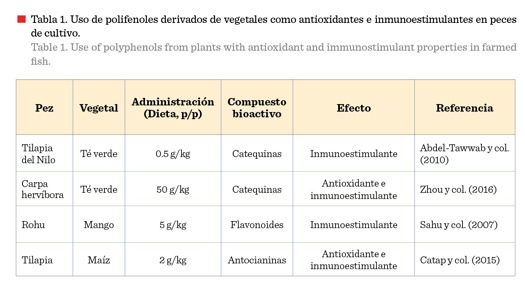
de vegetales, como fuentes de polifenoles en la dieta, puede reducir el estrés y mejorar el sistema inmune innato tanto de peces omnívoros,
herbívoros (Tabla 1) y carnívoros; en estos últimos, se ha empleado el té verde [Camellia
sinensis (L.) Kuntze],
la granada (Punica
granatum L.) y la
cebolla (Allium cepa L.), entre otros
(Harikrishnan y col., 2011; Nootash y col.,
2013).
El objetivo del
presente trabajo fue describir los principales efectos antioxidantes e
inmunoestimulantes de polifenoles presentes en diferentes vegetales, sobre la
respuesta inmune y el
estrés oxidativo en peces carnívoros, así como promover el uso de polifenoles de fuentes vegetales y sus subproductos,
como ingredientes, para el desarrollo de alimentos
funcionales en
la acuicultura.
Estrés oxidativo y
peroxidación lipídica
El estrés
oxidativo es descrito como un desequilibrio entre la generación de prooxidantes como
son los radicales libres, las especies reactivas de oxígeno (ROS, por sus siglas en inglés:
Reactive Oxygen Species) y especies reactivas de nitrógeno (RNS, por sus siglas en inglés: Reactive Nytrogen Species) y la generación de
antioxidantes en favor de los prooxidantes, a nivel
celular, de tejido y órganos (Ayala y col., 2014; Lushchak, 2014). Altos niveles
de prooxidantes causan daño directo a los lípidos mediante el proceso conocido como peroxidación lipídica, en el cual los agentes prooxidantes atacan a los lípidos que
contienen dobles enlaces carbono-carbono
(ácidosgrasos
insaturados), y generan radicales peróxidos e hidroperóxidos con capacidad de
reaccionar y causar daño oxidativo a las proteínas y al ácido desoxirribonucleico (ADN)
(Barrera, 2012). Los PUFA de la serie omega 3 como los ácidos eicosapentaenoico (EPA, 20:5 ω-3) y docosahexaenoico (DHA, 22:6 ω-3), conforman la
estructura de los fosfolípidos de la bicapalipídica de la membrana celular. La peroxidación de los PUFA de la membrana favorece la pérdida de su integridad y en consecuencia, la inactivación de
proteínas unidas a la membrana y la alteración de las
vías de señalización
intracelular (Ayala y col., 2014). En respuesta a la
peroxidación lipídica en la membrana, la célula estimula su mantenimiento y supervivencia através de los sistemas de defensa antioxidantes de naturaleza enzimática y no enzimática. El sistema
de defensa
enzimático incluye a la superóxido
dismutasa (SOD), glutatión
peroxidasa (GPx), catalasa (CAT), glutatión reductasa (GR), glutatión-S-transferasa (GST), glutarredoxin
y tiorredoxina reductasa.
La línea de defensa no enzimática incluye al glutatión (GSH), las vitaminas
E, C, el β-caroteno y el selenio (Shalaby y Shanab,
2013).
En los sistemas
de cultivo existen diversos factores que pueden generar estrés oxidativo, sin embargo, entre los más importantes se encuentra el
factor nutricional. Esto debido a que la dieta de peces carnívoros requiere de
altos niveles de lípidos
o PUFA altamente susceptibles a la oxidación
(Villasante y col., 2015).
Estudios en salmón del Atlántico (Salmo salar Linnaeus, 1758) han reportado que dietas con alto contenido
de lípidos conducen a la deposición de grasa,
al desencadenamiento del estrés
oxidativo y a la pérdida de la calidad nutricional del filete (Hamre y col.,
2004; Todorcevic y col., 2009). Por lo tanto, para contrarrestar los efectos causados por el
estrés oxidativo, se ha recurrido al uso de antioxidantes
como aditivos alimentarios.
Sistema inmune
innato
El sistema inmune
protege a los organismos contra enfermedades, mediante la identificación y
eliminación del patógeno, y se divide en sistema inmune innato y sistema inmune
adquirido. En peces, el sistema inmune adquirido es poco eficiente por ser
organismos poiquilotérmicos (de sangre fría), por lo que dependen fuertemente del sistema inmune innato, el cual se divide
comúnmente en tres mecanismos
de defensa: físicos, celulares y humorales. Los parámetros físicos comprenden la barrera epitelial, mucosa en
piel, branquias y el tracto digestivo (Magnadóttir,
2010). Los principales componentes celulares son los granulocitos (neutrófilos), con actividad
fagocítica. Cuando los
fagocitos son estimulados se presentará la actividad
denominada explosión respiratoria (liberación de ROS), la
producción de citocinas y
de moléculas de comunicación
celular (Zou y Secombes, 2016). Los parámetros humorales incluyen, la actividad
de lisozima y la actividad hemolítica del complemento. Ésta última se ha reconocido
como un mecanismo clave de la resistencia bacteriana en teleósteos, como la trucha arcoíris (Oncorhynchus mykiss Walbaum, 1792), salmón del Atlántico y bagre (Ictalurus punctatus Rafinesque, 1818), entre otros (Sunyer y col., 2013; Buonocorea
y col., 2014).
En sistemas de
cultivo intensivo, la alta densidad, malas prácticas en el manejo, alteraciones en las condiciones óptimas
ambientales (temperatura,
oxígeno, salinidad, pH, nitritos y carga orgánica) y factores nutricionales
(deficiencia o exceso de nutrientes) generan un entorno fisiológico estresante
que conduce a la reducción del crecimiento, supresión del sistema inmune y a la
susceptibilidad para contraer
enfermedades infecciosas que pueden generar altas tasas de mortalidad
(Martínez-Álvarez y col.,
2005; Lushchak, 2011; Reverter y col., 2014; Philip y
col., 2015), que en consecuencia
ocasionan pérdidas económicas considerables, que
conllevan al uso de agentes quimioterapéuticos, que causan el desarrollo de bacterias resistentes y
la contaminación del ambiente (Nootash y col., 2013; Done y col., 2015). Por esa razón, se ha optado por el uso
de inmunoestimulantes que mejoran el estado de salud
y confieran resistencia contra patógenos, a través del fortalecimiento del
sistema inmune innato (Vaseeharan y
Thaya, 2014).
Propiedades
biológicas de los polifenoles en peces
carnívoros
Fuentes
de origen vegetal como antioxidantes
Se ha reportado
que la inclusión dietaria de hojas de té verde (0.1 g/kg) disminuye el nivel de
peroxidación lipídica e incrementa la actividad de la enzima SOD en suero de
trucha arcoíris (Nootash y col., 2013). También se ha documentado que la inclusión de extracto de té verde (50 g/kg) a la dieta para black
rockfish (Sebastes
schlegelii Hilgen, 1880)
disminuye el nivel de colesterol en plasma (Hwang y col., 2013). En ambos estudios,
el efecto benéfico del té verde es atribuido a las catequinas, las cuales
pueden inducir la actividad de enzimas antioxidantes y neutralizar las ROS (Wang y col., 2013). Estudios en humanos han demostrado que el
té verde incrementa el potencial antioxidante en suero y disminuye los valores de lipoproteínas de baja densidad (LDL) y
colesterol en plasma, así como la concentración de productos de la
peroxidación lipídica (Onakpoya y col., 2014;
Domanski y col., 2015). Los resultados de los estudios en trucha arcoíris y black rockfish,
indicaron que las catequinas son antioxidantes efectivos para combatir la
peroxidación lipídica y
reducir los niveles de colesterol
en plasma
in vivo.
La inclusión
dietaria de polvo de cebolla (10 g/kg) disminuye los niveles de colesterol y triglicéridos en el suero
de esturión beluga (Huso huso Linnaeus, 1758) (Akrami y col., 2015). La cebolla es una fuente rica en quercetina
(Aditya y col., 2017), la cual se ha demostrado que previene la oxidación de LDL
en plasma, e impide la biosíntesis de colesterol mediante la inhibición de la
actividad de síntesis de ácidos grasos (Moon y col., 2012). Por lo que, la
disminución de colesterol en esturión beluga, se atribuye a la influencia de la quercetina sobre la biosíntesis de
colesterol.
Contrariamente, se ha reportado que la inclusión de cebolla a la dieta para
fletán japonés (Paralichtys olivaceus Temminck Schleges, 1846) no afecta los niveles de colesterol y triglicéridos (Cho y Lee, 2012). La diferencia de resultados en el esturión beluga y fletán japonés puede relacionarse con la
fisiología de cada especie, ya que la acción de los polifenoles dependerá directamente de la biodisponibilidad de estos compuestos y por
tanto de factores intrínsecos, como el pH gástrico,
la actividad de enzimas digestivas y la microflora bacteriana, dado que pueden
inducir la hidrólisis y/o transformación de los polifenoles a moléculas biológicamente activas y biodisponibles (Velderrain-Rodríguez y
col., 2014).
La dorada (Sparus aurata Linneasus, 1758) alimentada
con una dieta enriquecida con el subproducto de la refinación de aceite de oliva (10 g/kg y 50 g/kg), mostró un ligero retraso en el
proceso de oxidación lipídica de su filete almacenado a 4 °C (Sicuro y col.,
2010). El aceite de oliva
contiene polifenoles como el
hidroxitirosol,
tirosol, oleuropeína, ácidos hidroxicinámicos y ácido cafeíco, los cuales poseen la capacidad de reducir
los niveles de peroxidación lipídica, y mejorar el sistema de defensa
antioxidante (Rafehi y col., 2012; Servili y col., 2013). Es
por ello que el conjunto de polifenoles del aceite de oliva inhibe el proceso de peroxidación
lipídica y contribuye en la preservación de la calidad
del filete de la
dorada.
En trucha
arcoíris, se evaluó el efecto de la inclusión dietaria del extracto de maíz
morado (50 g/kg), sobre la actividad antioxidante (expresión de los genes GPx1 y SOD1) en los eritrocitos, la concentración de biomarcadores del daño oxidativo (ADN, lípidos y
proteínas) en el plasma y el perfil de PUFA omega 3 y 6
en el cuerpo
(Villasante y col., 2015). Los autores registraron un aumento en la expresión del gen GPx1, que codifica para la
GPx, una tendencia a disminuir los niveles de
peroxidación lipídica y un
incremento en la proporción de PUFA omega 3 y 6. El maíz morado es una fuente importante de antocianinas, como la cianidina-3-glucósido y
pelargonidina-3-glucósido (Ramos-Escudero y col., 2012). Aboonabi y Singh
(2015), reportaron que las antocianinas inducen la expresión de enzimas relacionadas con el glutatión (GR, GPx y GST), por la vía de activación del factor nuclear derivado de eritroide 2 (Nrf2). Debido a
lo anterior, se sugiere que las antocianinas mejoran la protección antioxidante
en plasma y eritrocitos de trucha arcoíris, a través de la modulación de la actividad de la enzima
GPx y probablemente, a través de la quelación de hierro (Fe3+) o donación de
protones a especies
reactivas, las cuales están implicadas directamente en el
proceso de peroxidación
lipídica in vivo.
Fuentes
de origen vegetal como inmunoestimulantes
Los vegetales
contienen diversos tipos de polifenoles con actividad
inmunoestimulatoria, por lo que se estudia el uso de diferentes
fuentes para controlar enfermedades y
fortalecer el sistema inmune
innato. Nootash y col. (2013), reportaron que la administración dietaria de
extracto de té verde (0.1 g/kg) disminuyó los niveles de transcritos
codificantes para distintas citocinas (interleucina-1β e
interleucina-8,
en bazo e hígado, respectivamente) e
incrementó los niveles de
proteína total y la actividad bactericida en trucha arcoíris. Por su parte, Harikrishnan y col. (2011), registraron que la
administración dietaria de extracto de té verde (0.1 g/kg y 1 g/kg) aumentó la
producción de RNS, la actividad de lisozima y la
actividad hemolítica del complemento sérico en mero diente largo (Epinephelus bruneus Bloch, 1793), infectado con Vibrio carchariae. Hwang y col. (2013), indicaron que la
administración dietaria de extracto de té verde (10 g/kg), incrementó la
actividad de lisozima y el porcentaje de supervivencia
de black rockfish,
cultivado en condiciones de estrés inducido. Esto se
debe a que los
flavonoides, una vez que son absorbidos, pueden influenciar la síntesis de
proteínas (Carlo y col., 1999). El alto contenido de proteína en suero y la
alta actividad bactericida se asocia con la síntesis
de proteínas activas, lo
que resulta en una fuerte respuesta innata. En particular, las catequinas pueden regular reacciones inmunológicas
por modu-
lación de
citocinas proinflamatorias, o por influenciar la actividad de células del sistema inmune (Patel y Vajdy,
2015). De acuerdo con lo anterior, es evidente que
las catequinas pueden
mejorar el sistema inmune innato a través de la modulación de la respuesta humoral y
celular.
Akrami y col.
(2015), reportaron que la inclusión de cebolla en
polvo (10 g/kg), en la dieta para juveniles de esturión beluga, elevó la actividad de lisozima y la
actividad de explosión respiratoria. En la cebolla se han identificado
glucósidos de flavonoides como la quercetina y fructooligosacáridos, a los
cuales se les atribuye el efecto modulatorio (Kumar y col., 2015; Oliveira y
col., 2015). No obstante, se desconoce el mecanismo de acción por el cual estos
compuestos mejoran el sistema inmune innato. Por lo que, se requiere de
estudios adicionales con los compuestos bioactivos purificados y probados por
separado, en la misma especie, para poder esclarecer
qué tipo de compuesto es
el responsable de la modulación de la respuesta inmune
innata.
La administración
por vía intraperitoneal de extracto de granada (0.1
g/kg de peso corporal) en fletán japonés, infectado naturalmente con el
virus de linfocistis, incrementó la tasa de supervivencia, la actividad de lisozima, la actividad fagocítica, la explosión
respiratoria y la actividad del complemento sérico
(Harikrishnan y col., 2010). Otro estudio, en la misma especie, infectada con el parásito Philasterides dicentrarchi, reportó que las dietas enriquecidas
con extracto de granada (10 g/kg) mejoraron el sistema inmune innato celular, mediante el aumento de leucocitos, que
incluyen los linfocitos,
monocitos y neutrófilos (Harikrishnan y col., 2012). La granada es rica en polifenoles, tales como, ácido elágico, elagitaninos (punicalaginas), galotaninos y antocianinas (Galego y col., 2013). Ross
y col. (2001), indicaron
que la administración oral de granada estimuló la respuesta inmune innata humoral y celular de conejos. Sin
embargo, aunque se desconocen los compuestos que desencadenan la respuesta inmune
innata, estos podrían estar relacionados directamente con el conjunto de polifenoles que
conforman el extracto de granada. Por lo tanto, se requiere de más
investigación para una mejor comprensión del efecto inmunoestimulante de los
compuestos polifenólicos que se
encuentran en la
granada.
Magrone y col.
(2016), analizaron la influencia de la dieta suplementada con extracto de uva
(1 g/kg y 2 g/kg), sobre la modulación de citocinas en el bazo e intestino de
la lubina (Dicentrarchus
labrax L.) y
observaron una disminución en la concentración de las
interleucinas intestinales
(IL-1β) e IL-6; y un aumento en la producción de interferón-𝛾
(IFN-𝛾) en el bazo. Así mismo, los autores identificaron proantocianidinas y
catequinas como los polifenoles principales del extracto de uva, los cuales poseen propiedades
antiinflamatorias e
inmunomodulatorias (Zhou y Raffoul, 2012; Chu y col., 2016). Por lo que, el
efecto inmunoestimulante observado en los diferentes órganos analizados de la
lubina, lo atribuyeron a los polifenoles
del extracto de
uva.
Aunque los
alimentos para acuicultura proveen los nutrientes
necesarios para el desarrollo
de los organismos, la inclusión de los polifenoles como compuestos bioactivos,
le confieren una funcionalidad
dirigida a la salud animal, con un tejido de mejor
calidad nutricional y un mayor
contenido endógeno de antioxidantes, combatiendo el
estrés oxidativo y mejorando el sistema inmune innato.
Polifenoles como la epigalocatequina y la quercetina, tienen la capacidad tanto de combatir
el estrés oxidativo como
de modular la respuesta inmune innata en especies como la trucha arcoíris y la dorada (Shin y col., 2010; Thawonsuwan
y col., 2010).
Debido al impacto
positivo de las propiedades biológicas de los polifenoles, se ha incrementado el número de investigaciones
enfocadas en la extracción
e identificación de estos compuestos a partir de subproductos vegetales tales
como la cáscara de mango (Blancas-Benítez y col., 2015), plátano (Aboul-Enein y
col., 2016), manzana
(Giomaro y col., 2014), uva (Makris y Kefalas, 2013), semilla de aguacate (Kosinska
y col., 2012) y café (Murthy y Naidu, 2012). El té verde es el vegetal mayormente utilizado en los
estudios con peces
carnívoros (Hwang y col., 2013; Nootash y col., 2013; Hasanpour y col.,
2017).
CONCLUSIONES
Los vegetales,
como fuente de polifenoles, tienen la capacidad de mejorar los sistemas de
defensa inmune y antioxidante de especies de peces carnívoros, siendo el té verde el vegetal mayormente utilizado, por su alto
contenido polifenólico.
Sin embargo, es necesaria la evaluación de polifenoles purificados, extraídos
de fuentes vegetales, con el propósito de demostrar cuáles son los componentes
responsables de la modulación de la respuesta inmune y antioxidante en las diferentes especies
estudiadas, y de este modo, potenciar su aprovechamiento como ingredientes en
el desarrollo de alimentos funcionales para acuicultura. Se requiere establecer
las dosis óptimas que generen el efecto deseado por
especie, analizando como
influyen los componentes de la matriz del alimento sobre las variables de
respuesta de interés. Por otro lado, es escasa la información generada sobre el efecto de los polifenoles
en la calidad post mortem, factor fundamental en términos comerciales, ya que el
estrés oxidativo puede afectar el contenido de ácidos grasos poliinsaturados de
la serie omega 3 y dar lugar a la formación de compuestos volátiles que afectan
algunas características sensoriales y en consecuencia, su comercialización. Se requiere analizar
parámetros relacionados
con la calidad post mortem ocasionados por estrés oxidativo,
aprovechando los
conocimientos generados en el desarrollo de productos funcionales para humanos a partir de subproductos de vegetales, los cuales
presentan alto contenido de polifenoles. Este conocimiento puede aprovecharse en la elaboración de alimentos
funcionales para peces, dentro del marco de la
acuicultura sostenible.
REFERENCIAS
Aboonabi, A. and Singh, I.
(2015). Chemopreventiverole of anthocyanins in aterosclerosis via activation of
Nrf2-ARE as an indicator and modulator of redox. Biomedicine and
Pharmacotherapy. 72: 30-36.
Abdel-Tawwab, M., Ahmad, M.
H., Seden, M. E. A., and Sakr, S. F. M. (2010). Use of green tea, Camellia sinensis L., in practical diet for
growth and protection of nile tilapia, Oreochromis niloticus
(L.),
against Aeromonas hydrophila Infection. Journal of the World Aquaculture Society. 41(S2): 203-213.
Aboul-Enein, A. M., Salama,
Z. A., Gaafar, A. A., Aly, H. F., A-bou-Elella, F., and Ahmed, H. A. (2016).
Identification of phenolic compounds from banana peel (Musa paradaisica L.) as antioxidant and
antimicrobial agents. Journal of Chemical and Pharmaceutical Research. 8(4): 46-55.
Aditya, S., Ahammed, M.,
Jang, S. H., and Ohh, S. J. (2017).
Effects of dietary onion (Allium cepa) extract supplementation on performance, apparent total tract
retention of nutrients, blood profile and meat quality of broiler chicks. Asian-Australasian
Journal of Animal Sciences. 30(2): 229-235.
Afzal, M., Safer, A. M., and
Menon, M. (2015). Green tea polyphenols and their potencial role in health and
disease. Inflammopharmacology. 23(4): 151-161.
Akrami,
R., Gharaei, A., Mansour, M. R., and Galeshi, A. (2015). Effects of dietary
onion (Allium cepa) powder
on growth, innate immune response and hemato-biochemical parameters of beluga (Huso
huso Linnaeus, 1754) juvenile. Fish
Shellfish Immunology. 45(2): 828-834.
Alexander,
C. P., Kirubakaran, C. J. W. and Michael, R. D. (2010). Water soluble fraction of Tinospora
cordifolia leaves enhanced the non-specific immune mechanisms and disease
resistance in Oreochromis mossambicus. Fish & shellfish
immunology. 29(5): 765-772.
Ayala, A., Muñoz, M. F., and
Argüelles, S. (2014). Lipid peroxidation: production, metabolism, and signaling
mechanisms of malondialdehyde and 4-Hydroxy-2-nonenal. Hindawi Publishing
Corporation. 2014: 1-32.
Barrera, G. (2012).
Oxidative stress and lipid peroxidation products in cancer progression and
therapy. ISRN Oncology. 1-21.
Blancas-Benítez, F. J.,
Mercado-Mercado, G., Quirós-Sauceda, A. E., Montalvo-González, E.,
González-Aguilar, G. A., and Sáyago-Ayerdi, S. G. (2015). Bioaccessibility of
polyphenols associated with dietary fiber and in vitrokinetics release of
polyphenols in Mexican Ataulfo mango(Mangifera indica L.) by-products. Food & Function. 6(3): 859-868.
Bravo, L. (1998).
Polyphenols: Chemistry, dietary sources, Metabolism, and Nutrititional
Significance. Nutrition Reviews. 56(11): 317-333.
Bulfon, C., Donatella, V.,
and Galeotti, M. (2013). Current research on the use of plant-derived products
in farmed fish. Aquaculture Research. 46(3): 1-39.
Buonocorea, F., Randellia,
E., Trisolinoa, P., Facchianob, A., de-Pascalec, D., and Scapigliati, G.
(2014). Molecular characterization, gene structure and antibacterial activity
of a g-type lysozyme from the European sea bass (Dicentrarchus labrax L.). Molecular Immunology. 62(1): 10-18.
Carlo, G. D., Mascolo, N.,
Izzo, A. A., and Capasso, F. (1999). Flavonoids: old and new aspects of a class
of natural therapeutic drugs. Life Sciences. 65(4): 337-353.
Catap, E. S., Jimenez, M. R.
R., and Tumbali, P. B. (2015). Immunostimulatory
and anti-oxidative properties of corn silk from zea mays L. in Nile tilapia, Oreochromis
niloticus. International Journal of Fisheries and Aquaculture. 7(3): 30-36.
Chakraborty, S. B. and
Hancz, C. (2011). Application of phytochemicals as immunostimulant,
antipathogenic and antistress agents in finfish culture. Reviews in
Aquaculture. 3(3): 103-119.
Cho, H. C. and Lee, S. M.
(2012). Onion powder in the diet of the Olive flounder (Paralichthys
olivaceus): Effects on the growth, body composition and lysozyme activity. Journal of the World
Aquaculture Society. 43(1): 30-38.
Chu, H., Tang, Q., Huang,
H., Hao, W., and We, X. (2016). Grape-seed proanthocyanidins inhibit the
lipopolysaccharide-inducedinflammatory mediator
expression in RAW264.7 macrophages bysuppressing MAPK and NF-κb signal pathways. Environmental
Toxicology and Pharmacology. 41: 159-166.
Domanski, M. J., Fuster, V.,
Diaz-Mitoma, F., Grundy, S., Lloyd-Jones, D., Mamdani, M., …, and Udell, J. A.
(2015). Next steps in primary prevention of coronary heart disease: rationale
for and design of the ECAD trial. Journal of the
American College of Cardiology. 66(16): 1828-1836.
Done, H. Y., Venkatesan, A.
K., and Halden, R. U. (2015). Does the recent growth of aquaculture create
antibiotic resistance threats different from those associated with land animal
production in agriculture?. The AAPS journal. 17(3): 513-524.
Galego, L. R., Jockusch, S.,
and Da-Silva, J. P. (2013). Polyphenol and volatile profiles of pomegranate (Punica granatum L.) fruit extracts and
liquors. International Journal of Food Science and Technology. 48(4): 693-700.
Giomaro, G., Karioti, A.,
Bilia, A. R., Bucchini, A., Giamperi, L., Ricci, D., and Fraternale, D. (2014).
Polyphenols profile and antioxidant activity of skin and pulp of a rare apple
from Marche región (Italy). Chemistry Central Journal. 8(1): 45.
Hamre, K., Christiansen, R.,
Waagbø, R., Maage, A., Torstensen, B. E., Lygren, B., …, and Albrektsen, S.
(2004). Antioxidant vitamins, minerals and lipid levels in diets for Atlantic
salmon (Salmo salar L.): effects on growth performance and fillet quality. Aquaculture
Nutrition. 7(10): 113-123.
Harikrishnan, R.,
Balasundaram, C., and Heo, M. S. (2011). Influence of diet enriched with green
tea on innate humoral and celular immune response of kelp grouper (Epinephelus bruneus) to Vibrio carchariae
infection. Fish Shellfish immunology. 30(3): 972-979.
Harikrishnan, R., Heo, J.,
Balasundaram, C., Kim, M. C., Kim, S. J., Han, Y. K., and Heo, M. S. (2010). Effect of Punica
granatum
solvent extracts on immune system and disease resistance in Paralichthys
olivaceus against lymphocystis disease virus (LDV). Fish Shellfish
Immunology. 29(4): 668-673.
Harikrishnan, R., Kim, J.
S., Kim, M. C., Balasundaram, C., and Heo, M. S. (2012). Pomegranate enriched
diet enhances the hematology, innate immune response, and disease resistance in
olive flounder against Philasterides dicentrarchi. Veterinary Parasitology. 187(1): 147-156.
Hasanpour, S., Salati, A.
P., Falahatkar, B., and Azarm, H. M. (2017). Effects of dietary green tea (Camelia sinensis L.) supplementation on growth
performance, lipid metabolism, and
antioxidant status in a sturgeon hybrid of
Sterlet (Huso huso ♂ × Acipenser
ruthenus ♀) fed
oxidized fish oil. Fish Physiology and Biochemistry. 43(4):
1315-1323.
Hwang, J. H., Lee, S. W.,
Rha, S. J., Yoon, H. S., Park, E. S., Han, K. H., and Kim, S. J. (2013).
Dietary green tea extract improves growth performance, body composition, and stress
recovery in the juvenile black rockfish, Sebastes schlegeli.
Aquaculture International. 21(3): 525-538.
Kosinska, A., Karamac, M.,
Estrella, I., Hernández, T., Bartolomé, B., and Dykes, G. A. (2012). Phenolic
compounds profiles and antioxidant capacity of Persea americana Mill. Peels and sedes of two
varieties. Journal of Agricultural and Food Chemistry. 60(18): 4613-4619.
Kumar, S. and Pandey, A. K.
(2013). Chemistry and biological activities of flavonoids: An overview. The Scientific World
Journal.
1-16.
Kumar, V. P., Prashanth, K.
V., and Venkatesh, Y. P. (2015). Structural analyses and immunomodulatory
properties of fructo-oligosaccharides from onion (Allium cepa). Carbohydrate
Polymers. 117: 115-22.
Lushchak, V. I. (2011).
Environmentally induced oxidative stress in aquatic animals. Aquatic Toxicology. 101(1): 13-30.
Lushchak, V. I. (2014). Free
radicals, reactive oxygen species, oxidative stress and its classification. Chemico-Biological
Interactions. 224: 164-175.
Magnadóttir, B. (2010).
Immunological control of fish diseases. Marine Biotechnology. 12(4): 361-379.
Magrone, T., Fontana, S.,
Laforgia, F., Dragone, T., Jirillo, E., and Passantino, L. (2016).
Administration of polyphenol-enriched feed to farmed sea bass (Dicentrarchaus Labrax
L.)
modulates intestinal and spleen immune responses. Oxidative Medicine
and Cellular Longevity. 2: 1-11.
Makris, D. P. and Kefalas,
P. (2013). Characterization of polyphenolic phytochemicals in red grape pomace.
International Journal of Waste Resources. 3(2): 126.
Martínez-Álvarez, R. M.,
Morales A. E., and Sanz, A. (2005). Antioxidant defense in fish: biotic and
abiotic factors. Reviews in Fish Biology and Fisheries. 15(1-2): 75-88.
Moon, J., Lee, S., Do, H.
J., Cho, Y., Chung, J. H., and Shin, M. J. (2012). Quercetin up-regulates LDL
receptor expression in HepG2 cells. Phytotherapy
Research. 26(11): 1688-1694.
Murthy, P. S. and Naidu, M.
M. (2012). Recovery of phenolic antioxidants and functional compounds from
coffee industry by-products. Food and Bioprocess Technology. 5(3): 897-903.
Nootash, S., Sheikhzadeh,
N., Baradaran, B., Oushani, A. K., Moghadam, M. R. M., Nofouzi, K., and
Shabanzadeh, S. (2013). Green tea (Camelia sinensis) administration induces
expression of immune relevant genes and biochemical parameters in rainbow trout
(Oncorhynchus mykiss). Fish Shellfish immunology. 35(6): 1916-1923.
Oliveira, T. T., Campos, K.
M., Cerqueira-Lima, A. T., Cana-Brasil-Carneiro, T., da-Silva-Velozo, E., …,
and Figueiredo, C. A. (2015). Potential therapeutic effect of Allium cepa L. and quercetin in a murine
model of Blomia tropicalis induced asthma. DARU Journal of Pharmaceutical Sciences. 23(1): 1-12.
Onakpoya, I., Spencer, E.,
Heneghan, C., and Thompson, M. (2014). The effect of green tea on blood
pressure and lipid profile: a systematic review and meta-analysis of randomized
clinical trials. Nutrition, Metabolism and Cardiovascular Diseases. 24(8): 823-836.
Patel, S. and Vajdy, M.
(2015). Induction of cellular and molecular immunomodulatory pathways by
vitamin A and Flavonoids. Expert Opinion on Biological Therapy. 15(10): 1411-1428.
Philip, A. M. and Vijayan,
M. M. (2015). Stress-immune-growth interactions: cortisol modulates suppressors
of cytokine signaling and JAK/STAT pathway in rainbow trout liver. PLoS One. 10(6): 1-18.
Rafehi, H., Ververis, K.,
and Karagiannis, T. C. (2012). Mechanisms of action of phenolic compounds in
olive. Journal of Dietary Supplements. 9(2): 96-109.
Ramos-Escudero, F., Muñoz,
A. M., Alvarado-Ortiz, C., Alvarado, A., and Yañez J. A. (2012). Purple Corn (Zea mays L.) Phenolic compounds
profile and its assessment as an agent against oxidative stress in isolated
mouse organs. Journal of medicinal Food. 15(2): 206-215.
Reverter, M., Bontemps, N.,
Lecchini, D., Banaigs, B., and Sasal, P. (2014). Use of plant extracts in fish
aquaculture as an alternative to chemotherapy: Current status and future
perspectives. Aquaculture. 433: 50-61.
Ross, G. R.,
Selvasubramanian, S., and Jayasundar, S. (2001). Immunomodulatory activity of
Punica granatum in rabbits-a preliminary study. Journal of
Ethnopharmacology. 78(1): 85-87.
Sahu, S., Das, B. K.,
Pradhan, J., Mohapatra, B. C., Mishra, B. K., and Sarangi, N. (2007). Effect of
Mangifera indica kernel as a feed additive on immunity and resistance to Aeromonas
hydrophila in Labeo rohita in fingerlings. Fish Shellfish
Immunology. 23(1): 109-118.
Servili, M., Sordini, B.,
Esposto, S., Urbani, S., Veneziani, G., Di-Maio, I., ..., and Taticchi, A.
(2013). Biological activities of phenolic compounds of extra virgin olive oil. Antioxidants. 3(1): 1-23.
Shahidi, F. and
Ambigaipalan, P. (2015). Phenolics and polyphenolics in foods, beverages and
spices: Antioxidant activity and health effects- A review. Journal of Functional
Foods.
18: 820-897.
Shalaby, E. A. and Shanab,
S. M. M. (2013). Antioxidant compounds, assays of determination and mode of
action. African Journal of Pharmacy and Pharmacology. 7(10): 528-539.
Shin, H. S., Yoo, J. H.,
Min, T. S., Lee, K. Y., and Choi, C. Y. (2010). The effects of quercetin on
physiological characteristics and oxidative stress resistance in olive
flounder, Paralichtys olivaceus. Asian Australasian Journal of Animal
Sciences. 23(5): 588-597.
Sicuro, B., Dapra, F., Gail,
F., Palmegiano, G. B., Schiavone, R., Zilli, L., and Vilella, S. (2010). Olive
oil by-product as a natural antioxidant in Gilthead sea bream (Sparus aurata) nutrition. Aquaculture
International. 18(4): 511-522.
Sunyer, J. O. (2013).
Fishing for mammalian paradigms in the teleost immune system. Nature Immunology. 14(4): 320-326.
Thawonsuwan, J., Kiron, V.,
Satoh, S., Panigrahi, A., and Verlhac, V. (2010). Epigallocatechin-3-gallate
(EGCG) affects the antioxidant and immune defense of the rainbow trout, Oncorhynchus mykiss.
Fish Physiology Biochemistry. 36(3): 687-697.
Todorcevic, M., Kjær, M. A.,
Djakovic, N., Vegusdal, A., Torstensen, B. E., and Ruyter, B. (2009). N-3 HUFAs
affect fat deposition, susceptibility to oxidative stress, and apoptosis in Atlantic salmon visceral adipose
tissue. Comparative Biochemistry and Physiology Part B. 152(2): 135-143.
Vaseeharan, B. and Thaya, R.
(2014). Medicinal plant derivates as immunostimulants: an alternative to
chemotherapeutics and antibiotics in aquaculture. Aquaculture
International. 22(3): 1079-1091.
Velderrain-Rodríguez, G. R.,
Palafox-Carlos, H., Wall-Medrano, A., Ayala-Zavala, J. F., Chen, C. Y. O.,
Robles-Sánchez, M., …, and González-Aguilar, G. A. (2014). Phenolic compounds:
their journey after intake. Journal of Functional Foods. 5(2): 189-197.
Villasante, A., Patro, B.,
Chew, B., Becerra, M., Wacyk, J., Overturf, K., ..., and Hardy, R. W. (2015).
Dietary intake of purple corn extract reduces fat body content and improves
antioxidant capacity and n-3 polyunsaturated fatty acid profile in plasma of
rainbow trout, Oncorhynchus mykiss. Journal of the World Aquaculture Society. 46(4): 381-394.
Wang, A. M., Tidrick, C. L.,
Haque, M., and Stuehr, D. J. (2013). Green tea polyphenols decrease enzyme
activity of nitric oxide synthase. The FASEB Journal. 27(1): 790.14.
Zou, J. and Secombes, C. J.
(2016). The function of fish cytokines. Biology. 5(2): 23.
Zhou, J., Lin, Y., Ji, H.,
and Yu, H. (2016). The effect of green tea waste on growth and health of grass
carp (Ctenopharyngodon idellus). Turkish Journal of
Fisheries Aquatic Sciences. 16(3): 679-689.
Zhou, K. and Raffoul J. J.
(2012). Potential anticancer properties of grape antioxidants. Journal Oncology. 5: 1-8.